染料木素氨基酸酯衍生物的制备方法及其抗肿瘤应用与流程
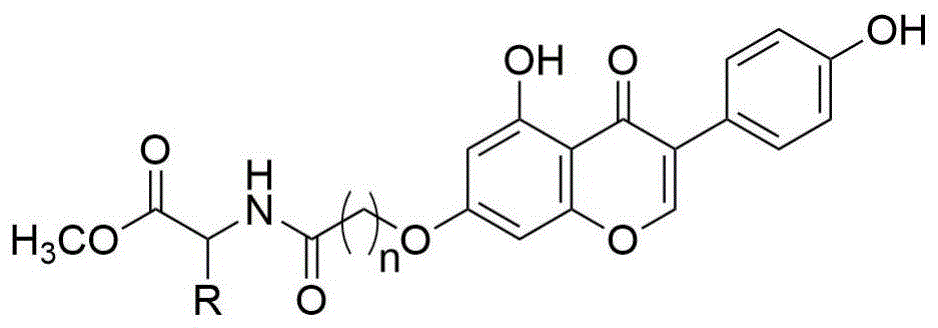
本发明涉及化合物的新用途,具体是染料木素氨基酸酯衍生物的制备方法及其作为抗肿瘤药物的应用。
背景技术:
癌症是世界上第二大死亡原因。化疗药物的毒性和副作用通常导致大多数癌症患者终止治疗。因此迫切需要寻求更安全和更有效的化疗药物。众所周知,许多抗肿瘤药物都是从天然植物中分离而得。黄酮类是一类广泛存在于自然界中的天然产物,具有广泛的生物活性,比如消炎、抗氧化、抗肿瘤等。染料木素(金雀异黄酮)是黄酮类的一种,经过大量的学者研究发现,其具有抗肿瘤、抗氧化、抗骨质疏松和雌激素样等作用。然而,由于其水溶性较差,肠道吸收少,生物利用度低,在体内容易代谢失活。为了提高其药理活性,对其进行结构修饰与改造,对于获得高效低毒的新型候选药物具有重要意义。
蛋白质是人类生命活动的承担着,而氨基酸作为蛋白质的基本组成成分,参与体内各种生理活动。氨基酸其本身具有结构多样性、官能基团丰富、低毒性等优点。此外,氨基酸是各种肠内寡肽转运蛋白的底物,可以改善药物的口服利用度。例如,缬氨酸是寡肽转运蛋白(pept1)的底物,因此缬氨酸能与pept1结合而进入小肠内。近年来,已有文献报道,将药物与氨基酸结合成为氨基酸前药,能够提高药物的口服利用度以及抗肿瘤活性。比如,缬更昔洛韦(更昔洛韦的l-缬氨酸酯前药),其口服利用度比更昔洛韦提高了约10倍;以氨基酸酯修饰5-氟尿嘧啶提高了其抗乳腺癌活性。
因此,本发明将氨基酸引入到染料木素结构中,得到一系列染料木素氨基酸酯衍生物。初步的药效学实验表明,衍生物对结肠癌细胞hct116显示出良好的抗增殖活性,并阻滞癌细胞分裂周期于g1期。
技术实现要素:
本发明目的在于提供化学结构式i所示化合物的制备方法及其在制备抗人结肠癌hct-116药物中的应用:
式i中r选自:选自具有如下a-s结构基团的任一种;n选自:3或5。
一种制备上述化学结构式i染料木素氨基酸酯衍生物的方法,它基本上包括如下步骤:
步骤1、将染料木素溶于n,n-二甲基甲酰胺(dmf)中,再加入koh,染料木素与koh物质的量之比为1:1,60℃反应1h。1h后加入4-溴丁酸乙酯或6-溴己酸乙酯以及ki,染料木素与溴化物以及ki的物质的量之比为:1:2:0.1,反应4~6h。将反应液倒入少量蒸馏水中,抽滤,所得到的滤饼用四氢呋喃溶解后,加入硅胶,通过柱层析进行纯化,获得中间产物1或者2:
步骤2、将化合物1或者2加入约8ml水中,再加入1mol/lkoh溶液,化合物1或者2与koh溶液的物质的量之比为:1:4,加入1~2ml甲醇助溶,60℃反应1~2h,调节反应液ph为2-3,得到中间产物3或者4;
步骤3、在冰浴条件下将化合物3或者4加入到由1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edcl)、1-羟基苯并三唑(hobt)组成的反应体系中,化合物3或者4与edcl和hobt物质的量之比为:1:3:3,常温搅拌4h,加入如a-s结构所示的氨基酸甲酯盐酸盐、缚酸剂n,n’-二异丙基乙胺(dipea)、4-二甲氨基吡咯(dmap),化合物3或者4与氨基酸甲酯盐酸盐和dipea以及dmap物质的量之比为:1:3:3:2,室温反应12h。得到如权利1所述的结构式i所示染料木素氨基酸酯衍生物。
其中:r为具有a-s结构基团的一种;n为3或者5。
本发明目的在于提供式i所示的染料木素氨基酸酯衍生物选自:(4-((5-羟基-3-(4-羟基苯基)-4-氧代-4h-色烯-7-基)氧基)丁酰基)色氨酸甲酯在抗人结肠癌hct-116细胞增值的活性。
本发明与现有技术相比具有如下优点:
本发明首次制备染料木素氨基酸酯衍生物,并发现(4-((5-羟基-3-(4-羟基苯基)-4-氧代-4h-色烯-7-基)氧基)丁酰基)色氨酸甲酯对于人结肠癌细胞(hct-116)具有良好的抗增殖活性,并阻滞癌细胞分裂周期于g1期。
附图说明
图1是本发明所制备化合物的母体结构,其中r选自具有如下a-s结构基团的任一种;n选自:3或5。
图2是hct-116细胞经过化合物5j处理48h后,hct-116细胞周期分布发生明显变化。
图3是周期结果统计柱状图。
具体实施方式
以下实施例旨在说明本发明而不是对本发明的进一步限定。
实施例1
4-((5-羟基-3-(4-羟基苯基)-4-氧代-4h-色烯-7-基)氧基)丁酸乙酯(化合物1)
将染料木素(2.0g,7.4mmol)与koh(0.415g,7.4mmol)溶于dmf中,60℃反应1h。再加入4-溴丁酸乙酯(2.11ml,14.8mmol)及ki(122.8mg,0.74mmol),反应4~6h。将反应液倒入少量蒸馏水中,抽滤取滤饼,硅胶柱层析纯化,得到乳白色粉末。产率:81%。1hnmr(400mhz,dmso)δ12.95(s,1h),9.60(s,1h),8.41(s,1h),7.40(d,j=8.5hz,2h),6.83(d,j=8.6hz,2h),6.66(d,j=2.1hz,1h),6.40(d,j=2.1hz,1h),4.12(t,j=6.4hz,2h),3.84(d,j=5.9hz,2h),3.63(t,2h),2.33(t,j=7.3hz,2h),2.02–1.92(s,3h).
实施例2
4-((5-羟基-3-(4-羟基苯基)-4-氧代-4h-色烯-7-基)氧基)丁酸(化合物3)
将实例1中得到的化合物1(800.0mg,2.25mmol)加入约8ml水中然后加入1mol/l的koh溶液(4ml),加入1~2ml甲醇助溶,60℃反应1~2h,调节反应液ph为2-3,得到乳白色粉末。产率:54%。1hnmr(400mhz,dmso)δ16.47(s,1h),12.95(s,1h),9.60(s,1h),8.41(s,1h),7.40(d,j=8.5hz,2h),6.83(d,j=8.6hz,2h),6.66(d,j=2.1hz,1h),6.40(d,j=2.1hz,1h),4.12(t,j=6.4hz,2h),3.63(t,2h),2.33(t,j=7.3hz,2h).
实施例3
(4-((5-羟基-3-(4-羟基苯基)-4-氧代-4h-色烯-7-基)氧基)丁酰基)甘氨酸甲酯(化合物5a)
在冰浴条件下将实例2得到的化合物3(356.0mg,1mmol)加入到由1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edcl)(575.0mg,3mmol)、1-羟基苯并三唑(hobt)(405.0mg,3mmol)组成的反应体系中,搅拌4h,加入甘氨酸甲酯盐酸盐(377.0mg,3mmol)、缚酸剂n,n’-二异丙基乙胺(dipea)(523.0μl,3mmol)、4-二甲氨基吡咯(dmap)(244.0mg,2mmol),室温反应。用硅胶柱层析分离纯化(乙酸乙酯/石油醚=3:1;v/v),得到淡黄色固体。产率:49%。1hnmr(400mhz,dmso)δ12.95(s,1h),9.60(s,1h),8.41(s,1h),8.36(t,j=6.1hz,1h),7.40(d,j=8.5hz,2h),6.83(d,j=8.6hz,2h),6.66(d,j=2.1hz,1h),6.40(d,j=2.1hz,1h),4.12(t,j=6.4hz,2h),3.84(d,j=5.9hz,2h),3.63(s,3h),2.33(t,j=7.3hz,2h),2.02–1.92(m,2h).13cnmr(101mhz,dmso)δ180.86,172.56,170.95,164.96,162.23,157.97,157.95,154.84,130.62,122.97,121.53,115.55,105.86,98.85,93.27,68.23,52.12,41.04,31.56,24.90.
实施例4
(4-((5-羟基-3-(4-羟基苯基)-4-氧代-4h-色烯-7-基)氧基)丁酰基)亮氨酸甲酯(化合物5o)
在冰浴条件下将实例2得到的化合物3(356.0mg,1mmol)加入到由1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edcl)(575.0mg,3mmol)、1-羟基苯并三唑(hobt)(405.0mg,3mmol)组成的反应体系中,搅拌4h,加入亮氨酸甲酯盐酸盐(545.0mg,3mmol)、缚酸剂n,n’-二异丙基乙胺(dipea)(523.0μl,3mmol)、4-二甲氨基吡咯(dmap)(244.0mg,2mmol),室温反应。用硅胶柱层析分离纯化(乙酸乙酯/石油醚=3:1;v/v),得到淡黄色固体。产率:64%。1hnmr(400mhz,dmso)δ12.94(d,j=7.5hz,1h),9.60(s,1h),8.41(s,1h),8.28(d,j=7.6hz,1h),7.40(d,j=8.5hz,2h),6.83(d,j=8.6hz,2h),6.65(d,j=2.2hz,1h),6.40(d,j=2.1hz,1h),4.29(ddd,j=9.7,7.7,5.3hz,1h),4.09(h,j=10.2hz,2h),3.61(d,j=5.7hz,3h),2.41–2.26(m,2h),1.97(dd,j=13.4,6.7hz,2h),1.58–1.48(m,2h),1.24(s,1h),0.87(d,j=6.4hz,3h),0.83(d,j=6.4hz,3h).13cnmr(101mhz,dmso)δ180.86,173.64,172.21,165.00,162.22,157.96,154.84,130.62,122.97,121.52,115.55,105.86,98.85,93.25,68.22,52.24,50.68,31.56,24.92,24.72,23.18,21.67.
实施例5
(4-((5-羟基-3-(4-羟基苯基)-4-氧代-4h-色烯-7-基)氧基)丁酰基)苯丙氨酸甲酯(化合物5k)
在冰浴条件下将实例2得到的化合物3(356.0mg,1mmol)加入到由1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edcl)(575.0mg,3mmol)、1-羟基苯并三唑(hobt)(405.0mg,3mmol)组成的反应体系中,搅拌4h,加入苯丙氨酸甲酯盐酸盐(647.0mg,3mmol)、缚酸剂n,n’-二异丙基乙胺(dipea)(523.0μl,3mmol)、4-二甲氨基吡咯(dmap)(244.0mg,2mmol),室温反应。用硅胶柱层析分离纯化(乙酸乙酯/石油醚=2:1;v/v),得到淡黄色固体。产率:59%。1hnmr(400mhz,dmso)δ12.96(s,1h),9.61(s,1h),8.44–8.36(m,2h),7.40(d,j=8.6hz,2h),7.28–7.19(m,5h),6.83(d,j=8.6hz,2h),6.60(d,j=2.2hz,1h),6.37(d,j=2.2hz,1h),4.50(td,j=9.4,5.5hz,1h),3.99(t,j=6.4hz,2h),3.66–3.57(m,3h),3.04(dd,j=13.7,5.4hz,1h),2.88(dd,j=13.7,9.6hz,1h),2.33–2.18(m,2h),1.94–1.82(m,2h).13cnmr(101mhz,dmso)δ180.86,172.64,172.07,164.92,162.21,157.95,154.85,137.76,130.63,129.49,128.66,126.96,122.97,121.53,115.55,105.85,98.83,93.25,68.13,53.95,52.30,37.15,31.55,24.83.
实施例6
(4-((5-羟基-3-(4-羟基苯基)-4-氧代-4h-色烯-7-基)氧基)丁酰基)色氨酸甲酯(化合物5j)
在冰浴条件下将实例2得到的化合物3(356.0mg,1mmol)加入到由1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edcl)(575.0mg,3mmol)、1-羟基苯并三唑(hobt)(405.0mg,3mmol)组成的反应体系中,搅拌4h,加入色氨酸甲酯盐酸盐(764.0mg,3mmol)、缚酸剂n,n’-二异丙基乙胺(dipea)(523.0μl,3mmol)、4-二甲氨基吡咯(dmap)(244.0mg,2mmol),室温反应。用硅胶柱层析分离纯化(乙酸乙酯/石油醚=4:1;v/v),得到淡黄色固体。产率:72%。1hnmr(500mhz,dmso)δ12.96(s,1h),10.85(s,1h),9.61(s,1h),8.39(s,1h),8.36(d,j=7.5hz,1h),7.51(d,j=7.9hz,1h),7.40(d,j=8.5hz,2h),7.35(d,j=8.1hz,1h),7.17(d,j=1.9hz,1h),7.07(t,j=7.4hz,1h),6.99(t,j=7.4hz,1h),6.85(d,j=8.6hz,2h),6.59(d,j=2.0hz,1h),6.38(d,j=2.1hz,1h),4.56(dd,j=13.8,7.9hz,1h),4.03(t,j=6.4hz,2h),3.60(s,3h),3.12(ddd,j=23.1,14.6,7.1hz,2h),2.30(tq,j=14.8,7.3hz,2h),1.96–1.88(m,2h).13cnmr(126mhz,dmso)δ180.86,173.01,172.12,164.94,162.22,157.96,154.79,136.58,130.62,127.56,124.10,122.98,121.43,118.87,118.47,115.57,111.91,110.04,105.87,98.85,93.22,68.23,67.49,53.62,52.24,31.61,27.57,25.60,24.86.
实施例7
(4-((5-羟基-3-(4-羟基苯基)-4-氧代-4h-色烯-7-基)氧基)丁酰基)酪氨酸甲酯(化合物5l)
在冰浴条件下将实例2得到的化合物3(356.0mg,1mmol)加入到由1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edcl)(575.0mg,3mmol)、1-羟基苯并三唑(hobt)(405.0mg,3mmol)组成的反应体系中,搅拌4h,加入酪氨酸甲酯盐酸盐(695.0mg,3mmol)、缚酸剂n,n’-二异丙基乙胺(dipea)(523.0μl,3mmol)、4-二甲氨基吡咯(dmap)(244.0mg,2mmol),室温反应。用硅胶柱层析分离纯化(乙酸乙酯/石油醚=2:1;v/v),得到淡黄色固体。产率:63%。1hnmr(400mhz,dmso)δ12.96(s,1h),9.60(s,1h),9.20(s,1h),8.41(s,1h),8.33(d,j=7.7hz,1h),7.40(d,j=8.6hz,2h),7.00(d,j=8.4hz,2h),6.83(d,j=8.6hz,2h),6.66(s,1h),6.64–6.61(m,2h),6.39(d,j=2.1hz,1h),4.40(dd,j=14.1,8.5hz,1h),4.04(t,j=6.0hz,2h),3.59(s,3h),2.88(d,j=5.5hz,1h),2.79(d,j=9.2hz,1h),2.26(dd,j=11.6,7.2hz,2h),1.92–1.87(m,2h).13cnmr(101mhz,dmso)δ180.86,172.78,172.09,164.94,162.22,157.96,156.44,154.80,130.62,127.69,122.97,121.55,115.55,105.86,98.84,93.22,68.20,60.22,54.38,52.21,36.48,31.59,24.88.
实施例8
6-((5-羟基-3-(4-羟基苯基)-4-氧代-4h-色烯-7-基)氧基)己酸乙酯(化合物2)
将染料木素(2.0g,7.4mmol)与koh(0.415g,7.4mmol)溶于dmf中,60℃反应1h。再加入6-溴己酸乙酯(2.62ml,14.8mmol)及ki(122.8mg,0.74mmol),反应4~6h。将反应液倒入少量蒸馏水中,抽滤取滤饼,硅胶柱层析纯化,得到淡黄色固体。产率:79%。1hnmr(500mhz,dmso)δ12.94(s,1h),9.59(s,1h),8.38(s,1h),7.40(d,j=8.5hz,2h),6.84(d,j=8.6hz,2h),6.62(d,j=2.0hz,1h),6.38(d,j=2.0hz,1h),4.27(p,j=7.2hz,2h),4.08(t,j=6.4hz,2h),2.15(t,j=7.3hz,2h),1.77–1.69(m,2h),1.57(dt,j=14.8,7.3hz,2h),1.44–1.37(m,2h),1.27(t,j=7.3hz,3h).
实施例9
6-((5-羟基-3-(4-羟基苯基)-4-氧代-4h-色烯-7-基)氧基)己酸(化合物4)
将实例8中得到的化合物2(927.0mg,2.25mmol)加入约8ml水中,然后加入1mol/l的koh溶液(4ml),加入1~2ml甲醇助溶,60℃反应1~2h,调节反应液ph为2-3,得到黄色粉末。产率:46%。谱图信息1hnmr(500mhz,dmso)δ16.12(s,1h),12.94(s,1h),9.59(s,1h),8.38(s,1h),7.40(d,j=8.5hz,2h),6.84(d,j=8.6hz,2h),6.62(d,j=2.0hz,1h),6.38(d,j=2.0hz,1h),4.08(t,j=6.4hz,2h),2.15(t,j=7.3hz,2h),1.77–1.69(m,2h),1.57(dt,j=14.8,7.3hz,2h),1.44–1.37(m,2h).
实施例10
(6-((5-羟基-3-(4-羟基苯基)-4-氧代-4h-色烯-7-基)氧基)己酰基)丙氨酸甲酯(化合物6b)
在冰浴条件下将例9得到的化合物4(384.0mg,1mmol)加入到由1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edcl)(575.0mg,3mmol)、1-羟基苯并三唑(hobt)(405.0mg,3mmol)组成的反应体系中,搅拌4h,加入丙氨酸甲酯盐酸盐(419.0mg,3mmol)、缚酸剂n,n’-二异丙基乙胺(dipea)(523.0μl,3mmol)、4-二甲氨基吡咯(dmap)(244.0mg,2mmol),室温反应。用硅胶色谱柱分离纯化(乙酸乙酯/石油醚=1:1;v/v),得到淡黄色固体。产率:51%。1hnmr(500mhz,dmso)δ12.94(s,1h),9.59(s,1h),8.38(s,1h),8.23(d,j=7.0hz,1h),7.40(d,j=8.5hz,2h),6.84(d,j=8.6hz,2h),6.62(d,j=2.0hz,1h),6.38(d,j=2.0hz,1h),4.27(p,j=7.2hz,1h),4.08(t,j=6.4hz,2h),3.62(s,3h),2.15(t,j=7.3hz,2h),1.77–1.69(m,2h),1.57(dt,j=14.8,7.3hz,2h),1.44–1.37(m,2h),1.27(d,j=7.3hz,3h).13cnmr(126mhz,dmso)δ180.84,173.74,172.51,165.10,162.23,157.96,154.77,130.61,122.95,121.54,115.55,105.80,98.79,93.23,68.88,52.21,47.92,35.25,30.88,28.62,25.43,25.31,17.43.
实施例11
(6-((5-羟基-3-(4-羟基苯基)-4-氧代-4h-色烯-7-基)氧基)己酰基)缬氨酸甲酯(化合物6m)
在冰浴条件下将例9得到的化合物4(384.0mg,1mmol)加入到由1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edcl)(575.0mg,3mmol)、1-羟基苯并三唑(hobt)(405.0mg,3mmol)组成的反应体系中,搅拌4h,加入缬氨酸甲酯盐酸盐(503.0mg,3mmol)、缚酸剂n,n’-二异丙基乙胺(dipea)(523.0μl,3mmol)、4-二甲氨基吡咯(dmap)(244.0mg,2mmol),室温反应。用硅胶色谱柱分离纯化(乙酸乙酯/石油醚=2:1;v/v),得到黄色固体。产率:72%。1hnmr(500mhz,dmso)δ12.94(s,1h),9.60(s,1h),8.39(s,1h),8.09(d,j=8.2hz,1h),7.41–7.36(m,2h),6.86–6.80(m,2h),6.62(d,j=2.2hz,1h),6.38(d,j=2.2hz,1h),4.19(dd,j=8.1,6.5hz,1h),4.08(t,j=6.4hz,2h),3.63(s,3h),2.27–2.15(m,2h),2.06–1.98(m,1h),1.77–1.69(m,2h),1.61–1.53(m,2h),1.45–1.36(m,2h),0.90–0.88(m,3h),0.87(d,j=6.8hz,3h).13cnmr(126mhz,dmso)δ180.84,173.00,172.73,165.10,162.22,157.95,154.78,130.61,122.96,121.54,115.55,105.81,98.79,93.23,68.88,57.79,52.02,35.21,30.28,28.60,25.47,19.46,18.77.
实施例12
(6-((5-羟基-3-(4-羟基苯基)-4-氧代-4h-色烯-7-基)氧基)己酰基)苯丙氨酸甲酯(化合物6k)
在冰浴条件下将例9得到的化合物4(384.0mg,1mmol)加入到由1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edcl)(575.0mg,3mmol)、1-羟基苯并三唑(hobt)(405.0mg,3mmol)组成的反应体系中,搅拌4h,加入苯丙氨酸甲酯盐酸盐(647.0mg,3mmol)、缚酸剂n,n’-二异丙基乙胺(dipea)(523.0μl,3mmol)、4-二甲氨基吡咯(dmap)(244.0mg,2mmol),室温反应。用硅胶色谱柱分离纯化(乙酸乙酯/石油醚=3:1;v/v),得到黄色固体。产率:52%。1hnmr(500mhz,dmso)δ12.96(s,1h),9.61(s,1h),8.39(s,1h),8.28(d,j=7.9hz,1h),7.40(d,j=8.6hz,2h),7.28(d,j=3.8hz,1h),7.27(d,j=4.0hz,1h),7.26(s,1h),7.24–7.16(m,4h),6.84(d,j=8.6hz,2h),6.62(d,j=2.1hz,1h),6.38(d,j=2.1hz,1h),4.53–4.46(m,1h),4.03(t,j=6.4hz,2h),3.61(s,3h),3.04(dd,j=13.8,5.3hz,1h),2.93–2.85(m,1h),2.10(t,j=7.2hz,2h),1.72–1.63(m,2h),1.52–1.44(m,2h),1.33–1.23(m,2h).13cnmr(126mhz,dmso)δ180.85,172.70,172.64,165.10,162.24,157.97,154.78,137.81,130.62,129.66,129.50,128.64,126.92,122.97,121.55,115.56,105.81,98.79,93.23,68.85,53.84,52.25,37.17,35.31,28.57,25.29.
实施例13
(6-((5-羟基-3-(4-羟基苯基)-4-氧代-4h-色烯-7-基)氧基)己酰基)色氨酸(化合物6j)
在冰浴条件下将例9得到的化合物4(384.0mg,1mmol)加入到由1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edcl)(575.0mg,3mmol)、1-羟基苯并三唑(hobt)(405.0mg,3mmol)组成的反应体系中,搅拌4h,加入色氨酸甲酯盐酸盐(764.0mg,3mmol)、缚酸剂n,n’-二异丙基乙胺(dipea)(523.0μl,3mmol)、4-二甲氨基吡咯(dmap)(244.0mg,2mmol),室温反应。用硅胶色谱柱分离纯化(乙酸乙酯/石油醚=3:1;v/v),得到黄色固体。产率:58%。1hnmr(500mhz,dmso)δ12.96(s,1h),10.86(s,1h),9.60(s,1h),8.38(s,1h),8.24(d,j=7.6hz,1h),7.50(t,j=7.8hz,1h),7.40(d,j=8.5hz,2h),7.34(d,j=8.1hz,1h),7.16(d,j=1.5hz,1h),7.07(t,j=7.5hz,1h),6.99(t,j=7.4hz,1h),6.84(d,j=8.5hz,2h),6.61(s,1h),6.39(s,1h),4.55(dd,j=13.8,8.0hz,1h),4.02(t,j=6.3hz,2h),3.59(d,j=7.4hz,3h),3.16(dd,j=14.5,5.5hz,1h),3.04(dd,j=14.5,8.7hz,1h),2.17–2.10(m,2h),1.73–1.63(m,2h),1.58–1.48(m,2h),1.33(dd,j=14.1,7.1hz,2h).13cnmr(126mhz,dmso)δ180.85,173.05,172.68,165.09,162.23,157.96,154.77,136.57,130.62,127.57,124.09,122.96,121.56,121.41,118.85,118.48,115.56,111.88,110.07,105.81,98.80,93.24,68.84,53.47,52.21,35.33,28.59,27.58,25.34,25.28.
实施例14
体外抗人结肠癌增值活性测试。
细胞株选用hct-116(人结肠癌细胞),购买于中国科学院上海生命科学院。
方法:mtt法。取对数期生长的hct-116细胞,稀释成8×104个/ml,种于96孔板(100μl/孔)。设5-氟尿嘧啶为对照组,dmso组、空白组及6个不同浓度的待测化合物组,每孔100μl,平行3个复孔。置37℃、5%co2培养箱培育48h。避光条件下每孔加入20μlmtt(3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑翁溴化物,5mg/ml)溶液,再放入培养箱内放置4h;4h后弃去培养液,每孔加入150μldmso溶解震荡,用mk-2全自动酶标仪测490nmod值,计算半数抑制浓度ic50。
4-((5-羟基-3-(4-羟基苯基)-4-氧代-4h-色烯-7-基)氧基)丁酰基)色氨酸甲酯、染料木素、5-氟尿嘧啶ic50计算结果。
表1ic50计算结果
由上面能看出,4-((5-羟基-3-(4-羟基苯基)-4-氧代-4h-色烯-7-基)氧基)丁酰基)色氨酸甲酯(化合物5j)抗癌活性大于阳性对照5-氟尿嘧啶且远远大于染料木素母体。
实施例15
流式细胞术测定化合物对人结肠癌(hct-116)分裂周期的影响。
1.方法:流式细胞术。取对数期细胞种于6孔板,每孔约五十万个细胞,以5-氟尿嘧啶和染料木素为阳性对照组,设置3个待测化合物浓度,每个浓度2个副孔,置37℃、5%co2培养箱培育48h。48h后,吸出含药培养基,冷pbs洗涤细胞表面,胰酶消化每孔细胞。离心3次后,每个样品加入1ml70%的4℃乙醇,放入4℃环境12h。
2.细胞染色:12h后,进行第四次离心,小心吸出上清液后,加入1mlpbs重悬细胞而后进行第五次离心,小心吸出上清液,每个样品加入0.5ml染色剂溶液(缓冲液+pi染色液+rnasea)重悬细胞。放置于37℃环境下避光孵育30分钟后进行流式检测。
4-((5-羟基-3-(4-羟基苯基)-4-氧代-4h-色烯-7-基)氧基)丁酰基)色氨酸甲酯、染料木素、5-氟尿嘧啶对细胞分裂周期的影响。
表2化合物处理后细胞周期分布统计表
实验结果表明化合物4-((5-羟基-3-(4-羟基苯基)-4-氧代-4h-色烯-7-基)氧基)丁酰基)色氨酸甲酯通过阻滞hct-116细胞于g1期来抑制细胞增殖。
活性测试表明,染料木素氨基酸酯衍生物具有良好抗人结肠癌hct-116增殖活性,并阻滞癌细胞分裂周期于g1期。
- 还没有人留言评论。精彩留言会获得点赞!