高产虾青素的雨生红球藻JNU35及其培养方法与应用与流程
本发明属于微藻生物技术领域,特别涉及高产虾青素的雨生红球藻jnu35及其培养方法与应用。
背景技术:
虾青素(astaxanthin)是一种红色的天然类胡萝卜素,具有清除氧自由基的强大能力。目前公认的天然虾青素的来源主要有三种方式,从甲壳类动物提取、利用酵母菌生产以及微藻生产,而雨生红球藻(haematococcuspluvialis)是目前已知的天然虾青素含量最高的生物,虾青素含量通常在1.5~3.6%,最高可以达到干重的5%,被认为是天然虾青素的浓缩品。因此,天然的藻源虾青素有广阔的市场前景,利用雨生红球藻高效地生产虾青素一直是国际上藻类学研究领域和生产企业关注的热点。
雨生红球藻常用的培养方法主要是一步法和两步法。然而,在培养方式上,两步法更能充分地诱导虾青素的积累。因此,国内外利用雨生红球藻生产天然虾青素主要的方法是两步法培养,即先在第一阶段优化培养条件从而获得较高的藻细胞密度,然后在第二阶段进行诱导胁迫(如高光、高盐和营养盐缺乏等)使其大量积累虾青素。虽然,虾青素的合成不依赖于光,但强光刺激是诱导虾青素积累的重要手段,如何在现有的条件下提高两步法生产过程中虾青素积累阶段的诱导程度,是提高雨生红球藻虾青素产量的关键。
目前,工业上利用雨生红球藻生产虾青素的最大问题主要是藻种特性,由于不同雨生红球藻株系表型与遗传差异的影响,大多数研究结果表明,光合自养培养时,雨生红球藻难以达到较高的生物量,且存在虾青素产量低、易污染、生长慢、诱导条件复杂等问题。在培养过程中需要筛选优良藻株并改进培养方法。因此,筛选获得性状优良的雨生红球藻藻株是实现商业化生产的关键;同时,雨生红球藻的虾青素积累能力也决定了其商业化生产的可行性。
技术实现要素:
本发明的首要目的在于克服现有技术的缺点与不足,提供一株高产虾青素的雨生红球藻jnu35,该藻株的生物量可高达13.89g/l,虾青素含量最高可达到4.35%。
本发明的另一目的在于提供所述的雨生红球藻jnu35的培养方法,通过所述的培养方法,所述的雨生红球藻jnu35的生长较快,生物量累积可观。
本发明的又一目的在于提供所述的雨生红球藻jnu35的虾青素诱导方法,根据藻株jun35的特性,对诱导培养方法进行了创新,有效平衡了藻株繁殖生长和虾青素积累,极大地提高了雨生红球藻生物量和虾青素含量,该方法具有较高的可操作性和实际运用价值。
本发明的又一目的在于提供所述的雨生红球藻的应用。
本发明的目的通过下述技术方案实现:
一株高产虾青素的雨生红球藻,命名为雨生红球藻haematococcuspluvialisjnu35,于2018年9月7日保藏于位于中国北京的中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏编号为cgmccno.16438。
本发明从海拔3948米的四川贡嘎山垭家埂溪流边小沙塘分离筛选出一株雨生红球藻,在bg-11培养基或bbm培养基(氮源为18mm/lnano3)上培养时,游动的藻细胞呈球状或梨形,细胞直径在10~15μm,细胞具两根等长的顶生鞭毛,细胞质膜外有较厚的胶质包被并有胶质连丝。氮营养充足时,细胞为绿色,随着培养时间的延长,细胞中无或有少量虾青素积累;培养时间的进一步延长游动细胞鞭毛脱落,呈绿色不动细胞或有少量虾青素积累,当不动的营养细胞转入新鲜的培养基后,细胞会产生游动孢子,并呈现不同的分裂状态,包括2、4、8、16、32分裂甚至64分裂或更多分裂细胞;绿色不动的营养细胞转入无氮培养基并给予高光,细胞中不断积累虾青素,随着虾青素的大量积累,整个细胞将呈红色。
根据形态学鉴定、18srdna多序列比对和系统发育分析,确定该藻株为绿藻门(chlorophyta)、绿藻纲(chlorophyceae)、衣藻目(chlamydomonadales)、红球藻科(haematococcaceae)、红球藻属(haematococcus)的雨生红球藻(haematococcuspluvialis)。
一种所述的雨生红球藻jnu35的培养方法:将所述的雨生红球藻jnu35接种于bbm培养基或bg-11培养基,在含有氮源的情况下,于光照强度为100~200μmol·m-2·s-1,培养温度为20~30℃的条件下通入含1~2%co2的空气进行搅拌培养。
所述的培养温度优选为25~30℃。
所述的氮源优选为nano3、nh4hco3和co(nh2)2中的至少一种;进一步优选为nh4hco3和co(nh2)2的至少一种;所述的氮源在培养基中的初始氮浓度为3~18mmol/l;进一步优选为9~18mmol/l;更优选为18mmol/l。
所述的光照强度优选为单侧光照强度。
所述的雨生红球藻jnu35接种的初始浓度优选为od750=0.50~0.90;进一步优选为od750=0.5±0.01。
所述的雨生红球藻jnu35优选接种于bbm培养基。
所述的bg-11培养基优选为改良的bg-11培养基,其配方(不含氮源)为:mgso4·7h2o75mg、cacl2·2h2o36mg、na2co320mg、k2hpo440mg、fecl3·2h2o3.15mg、na2edta·2h2o4.36mg和citricacid6.0mg和a5mix1ml,加水到1l;其中a5mix的配方为h3bo32.86g、mncl2·4h2o1.81g、znso4·7h2o222mg、cuso4·5h2o79mg、namoo4·2h2o0.39g、co(no3)2·6h2o49.4mg和98%浓h2so41ml,加水至1l。
所述的bbm培养基的配方(不含氮源)为:mgso4·7h2o75mg、nacl25mg、k2hpo4175mg、kh2po425mg、cacl2·2h2o25mg、h3bo31.43mg、znso4.7h2o8.82mg、mncl2.4h2o1.44mg、moo30.71mg、cuso4.5h2o1.57mg、co(no3)20.49mg、edtana250mg、koh31mg、feso4.7h2o4.98mg和98%浓h2so43μl,加水到1l。
所述的雨生红球藻jnu35的虾青素诱导方法,包括如下步骤:
(1)将所述的雨生红球藻jnu35在含氮培养基中于第一玻璃柱状光生物反应器中,在光照强度为100~200μmol·m-2·s-1,培养温度为20~30℃的条件下通入空气进行搅拌培养,获得生长旺盛的细胞;
(2)将步骤(1)培养后的雨生红球藻jnu35转入无氮培养基中在第二玻璃柱状光生物反应器中,于300~400μmol·m-2·s-1,培养温度为20~30℃的条件下通入空气进行搅拌培养;
其中,第二玻璃柱状光生物反应器的管径小于第一玻璃柱状光生物反应器的管径。
所述的第二玻璃柱状光生物反应器的管径优选为第一玻璃柱状光生物反应器管径的2/5~3/5;进一步优选为第一玻璃柱状光生物反应器管径的1/2。
步骤(1)中所述的第一玻璃柱状光生物反应器的管径为6cm;进一步优选其规格为
步骤(1)中所述的含氮培养基优选为含nh4hco3的bbm培养基、含co(nh2)2的bbm培养基、含nano3的bbm培养基、含co(nh2)2的bg-11培养基、含nano3的bg-11培养基或含nh4hco3的bg-11培养基中的至少一种;更优选为含nh4hco3的bbm培养基。
步骤(1)中所述的光照强度优选为单侧光照强度。
步骤(1)中所述的培养的时间优先为15~20天;进一步优选为15~18天。
步骤(2)中所述的第二玻璃柱状光生物反应器的管径优选为3cm;进一步优选其规格为
步骤(2)中所述的无氮培养基优选为不加任何氮源的bbm培养基或bg-11培养基中的至少一种;更优选为bg-11培养基。
步骤(1)、步骤(2)中的空气优选为含1~2%co2的空气。
步骤(1)、步骤(2)中所述的培养温度优选为25~30℃;进一步优选为(25±1)℃。
所述的高产虾青素的雨生红球藻在制备虾青素中的应用。
本发明相对于现有技术具有如下的优点及效果:
1.本发明在高海拔高紫外辐射的特殊生境筛选分离获得了一株性状优良的高产虾青素的雨生红球藻haematococcuspluvialisjnu35,该藻株的生物量可高达13.89g/l,虾青素含量最高可达到4.35%,较现有的虾青素生产藻株具有显著优势。
2.本发明根据新分离藻株jun35的特性,提供了一种适合于所述藻株生长的培养方法,可以快速积累雨生红球藻生物量。
3.本发明还提供了新分离藻株jun35的虾青素诱导方法,从培养基类型和氮源种类两个方面入手,优化了传统雨生红球藻两步法策略,创新地考虑了营养胁迫和光胁迫,设计了两步法中第一步于较大管径反应器中培养,随后提高第二步诱导程度,将藻细胞转于无氮培养基且管径较小的反应器中诱导虾青素积累,具有较高的可操作性;该诱导方法极大地提高了雨生红球藻生物量和虾青素含量,有效平衡了生物量和虾青素含量的同步快速积累,最终实现生物量可达到13.89g/l,虾青素含量最高可达到4.35%,可显著降低虾青素生成的成本,在实际生产中具有重要的应用价值,具有良好的工业化生产前景。
附图说明
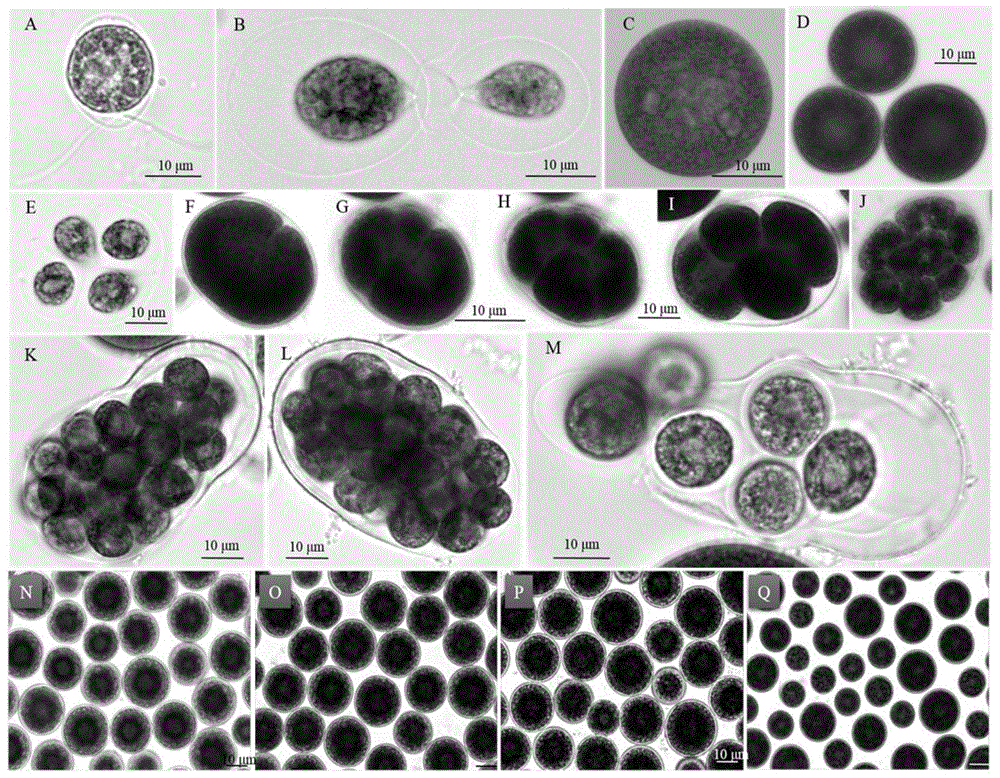
图1是雨生红球藻jnu35在光学显微镜下的形态照片图。
图2是雨生红球藻jnu35的18srdna分子系统发育树图;其中★表示本发明的雨生红球藻jnu35。
图3是实施例2中不同初始氮浓度对jnu35生物量积累的影响结果分析图。
图4是实施例2中不同初始氮浓度对jnu35虾青素积累的影响结果分析图。
图5是实施例3中不同光强下雨生红球藻jnu35生物量积累的影响结果分析图。
图6是实施例4中不同培养条件下雨生红球藻jnu35生物量积累时相变化结果分析图。
图7是实施例4中不同培养条件下雨生红球藻jnu35虾青素含量结果分析图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
以下实施例中涉及的培养基:
1.无氮改良的bg-11培养基
依次加入mgso4·7h2o75mg、cacl2·2h2o36mg、na2co320mg、k2hpo440mg、fecl3·2h2o3.15mg、na2edta·2h2o4.36mg和citricacid6.0mg和a5mix1ml加水到1l,灭菌。其中a5mix的配制是加入h3bo32.86g、mncl2·4h2o1.81g、znso4·7h2o222mg、cuso4·5h2o79mg、namoo4·2h2o0.39g、co(no3)2·6h2o49.4mg和98%浓h2so41ml,随后加水至1l,灭菌。
2.无氮bbm培养基
依次加入mgso4·7h2o75mg、nacl25mg、k2hpo4175mg、kh2po425mg、cacl2·2h2o25mg、h3bo31.43mg、znso4.7h2o8.82mg、mncl2.4h2o1.44mg、moo30.71mg、cuso4.5h2o1.57mg、co(no3)20.49mg、edtana250mg、koh31mg、feso4.7h2o4.98mg和98%的浓h2so43μl,加水到1l,灭菌。
实施例1jnu35的分离与鉴定
一、藻样品采集、分离与纯化
本实施例中的改良bg-11培养基为在上述的无氮改良的bg-11培养基中加入氮浓度为18mmol/l的nano3制得。
将海拔3948米的四川贡嘎山垭家埂溪流边小沙塘的水样样品带回实验室,取1ml水样,加入到含有50ml改良bg-11培养基的100ml三角瓶中,设置5个平行,于25℃连续光照培养5天,之后每天无菌操作下取1ml培养样品转于1.5ml无菌ep管中,观察是否有藻细胞生长,发现目标藻类后,取含目标藻类的5μl藻液,涂于改良bg-11培养基固体平板(固体培养基加入琼脂20g/l)上,于25℃连续光照培养。待藻细胞生长后取单一藻落继续划线于改良bg-11培养基固体平板,重复几次,得到单一无菌藻落;挑取单一藻落转入小体积的改良bg-11培养基中,待藻繁殖生长至一定浓度后,吸取1ml藻液转入含抗生素(氨苄青霉素和氯霉素,浓度为20~100μg/l)的50ml改良bg-11培养基中,接着吸取5μl上述藻液涂布于含有抗生素的改良bg-11固体平板上,待藻落长出后,再挑取单一藻落划线于另一固体平板上得到无菌藻落,即得到纯化无菌藻株。之后将筛选得到的无菌藻株jnu35,通过划线保存于改良bg-11培养基琼脂斜面,进行保藏。
二、藻细胞鉴定
1.显微特征观察
取改良bg-11培养基琼脂斜面保存的藻株jnu35,接种于含有50ml改良bg-11培养基的100ml三角瓶中,于25℃连续光照培养培养3天,每天定时取样制片,使用光学显微镜观察藻细胞形态特征、细胞分裂过程和细胞形态随时相变化的过程。
藻株jnu35在改良bg-11和bbm培养基中生长良好。该藻形态特征如图1所示,游动的藻细胞呈球状或梨形,细胞直径在10~15μm,细胞具两根等长的顶生鞭毛,细胞质膜外有较厚的胶质包被并有胶质连丝。氮营养充足时,细胞为绿色,随着培养时间的延长,氮营养的不断消耗,细胞中无或有少量虾青素积累(图1-a,b);培养时间的进一步延长游动细胞鞭毛脱落,呈绿色不动细胞或有少量虾青素积累(图1-c,d),当不动的营养细胞转入新鲜的培养基后,藻细胞产生游动孢子如图1e;一般细胞呈现不同的分裂状态,包括2、4、8、16、32分裂甚至64分裂或更多分裂细胞,分裂过程如图1f-1l;图1m为分裂后成熟细胞不断释放出母细胞壁;绿色不动的营养细胞转入无氮培养基并给予高光,细胞中不断积累虾青素,最初细胞中间呈现红色并不断向细胞边缘扩散,由于虾青素的大量积累,最后大约培养10~20天后整个细胞为墨绿色、褐色、红褐色和红色(图1n-1q)。根据以上形态特征,将jnu35鉴定为雨生红球藻(h.pluvialis)。
2.藻种分子鉴定
(1)dna提取
取三角瓶无菌培养的7天的藻液约200ml,3000rpm离心收集藻泥,利用takara植物dna提取试剂盒(minibestplantgenomicdnaextractionkit)提取jnu35全基因组dna,利用qubitfluorometer测定dna浓度和纯度。
(2)18srdna扩增、测序与序列分析
以步骤(1)提取的jnu35藻细胞全基因组dna作为模板,以18srdna引物(s1f:5’-aacctggttgatcctgccagt-3’;s1r:5’-tgatccttctgcaggttcacctac-3’)扩增其片段,pcr反应体系为(50μl):10×buffer5μl、2.5μmdntp4μl、mgcl23μl、s1f2μl(10μm)、s1r2μl(10μm)、dmso2.5μl、taq酶0.5μl、模板dna(浓度100~200ng/μl)2μl和ddh2o29μl。pcr反应程序为95℃预变性3min;95℃30s、52℃45s、72℃2min,共循环35次;72℃10min;最后4℃。将扩增获得的产物用1%琼脂糖凝胶电泳检测,选取具有单一清晰条带的送上海生工生物有限公司测序。
将测序获得的序列去除头和尾测序不准确的部分,将测序序列在ncbi中进行blast比对,利用mega7.0软件中muscle程序进行多序列比对,并利用kimura2-parameter和gammadistributionwithinvariantsites(g+i)替代模型构建最大释然法(maximumlikelihood)系统树,以自展值(bootstrap)检验树的准确性和支持率,频率设置为1000次。
扩增测序获得jnu35的18srdna的核苷酸序列如下所示(seqidno.3),将该序列在ncbi中进行blast比对,下载36条近缘物种18srrna序列,一共37条序列进行多序列比对和系统发育分析。
ggaaataagcatgcatgtctaagtataaactgcttatacggtgaaactgcgaatggctcattaaatcagttatagtttatttgatggtactttactcggataaccgtagtaattctagagctaatacgtgcgtatatcccgacttctggaagggacgtatttattagataaaaggccagccgggcttgcccgacctatggcgaatcatgataacttcacgaatcgcacggccttgcgccggcgatgtttcattcaaatttctgccctatcaactttcgatggtaggatagaggcctaccatggtggtaacgggtgacggaggattagggttcgattccggagagggagcctgagaaacggctaccacatccaaggaaggcagcaggcgcgcaaattacccaatcccgacacggggaggtagtgacaataaataacaataccgggcatcaatgtctggtaattggaatgagaacaatttaaatcccttaacgagtatccattggagggcaagtctggtgccagcagccgcggtaattccagctccaatagcgtatatttaagttgttgcagttaaaaagctcgtagttggatttcgggtgggttccagcggtctgcctctggtatgtactgctgtggcctacctttctgccggggacgtgttcctgggcttcattgtccgggactcgaattcggcgaggatactttgagtaaaacagcgtgttcaaagcaagcctacgctctgaatgcattagcatggaatatcacgataggactctggcctatcttgttggtctgtaggaccggagtaatgattaagagggacagtcgggggcattcgtatttcattgtcagaggtgaaattcttggatttatgaaagacgaacttctgcgaaagcatttgccaaggatgttttcattaatcaagaacgaaagttgggggctcgaagacgattagataccgtcgtagtctcaaccataaacgatgccgactagggattggcaggtgttttattgatgaccctgccagcaccttatgagaaatcaaagtttttgggttccggggggagtatggtcgcaaggctgaaacttaaaggaattgacggaagggcaccaccaggcgtggagcctgcggcttaatttgactcaacacgggaaaacttaccaggtccagacacgggaaggattgacagattgagagctctttcttgattctgtgggtggtggtgcatggccgttcttagttggtgggttgccttgtcaggttgattccggtaacgaacgagacctcagcctgctaaatagtcaagcgtaccttggtacgcgcctgacttcttagagggactattgacgtttagtcagtggaagtgtgaggcaataacaggtctgtgatgcccttagatgttctgggccgcacgcgcgctacactgatgcattcagcgagcctatccttggccgagaggtccgggtaatctttgaaactgcatcgtgatggggatagattattgcaattattagtcttcaacgaggaatgcctagtaagcgcgatcatcgcttgca
通过构建ml系统发育树(如图2),确证藻株jnu35为绿藻门(chlorophyta)、绿藻纲(chlorophyceae)、衣藻目(chlamydomonadales)、红球藻科(haematococcaceae)红球藻属(haematococcus)的雨生红球藻(h.pluvialis)。
该藻株已于2018年9月7日保藏于位于中国北京的中国微生物菌种保藏管理委员会普通微生物中心(cgmcc,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101),分类命名为雨生红球藻haematococcuspluvialisjnu35,保藏号为cgmccno.16438。
受藻株遗传差异的影响,雨生红球藻培养过程中存在易污染、生长慢、诱导条件复杂等问题,因此,筛选获得性状优良的雨生红球藻藻株一直是国际上研究和关注的热点。
通常,藻细胞在氮缺乏条件下增加油脂和次生代谢产物的含量,但会显著抑制藻细胞生物量产率,令人意外的是,发明人发现本发明的h.pluvialisjnu35易培养且不易污染,生物量和虾青素积累能力较强;特别是在更换为无氮培养基后(营养饥饿条件下),藻株还能保持相对快速的生物量积累,同时积累大量的虾青素。这一过程可能是该藻在高海拔高辐射环境中长期适应进化的特征,值得进行深入的开发和利用研究。
实施例2不同初始氮浓度对jnu35的影响
1.藻种的制备
首先将三角锥形瓶中保藏的无菌的jnu35藻种,通过逐级扩种,扩增至光径为10cm的玻璃柱状光生物反应器中。将培养至对数生长期的藻种沉降、无菌水洗涤后,收集藻细胞作为二级藻种,随后进行后续的培养。
2.不同初始氮浓度下生物量的变化
以od750=0.50~0.90的初始接种浓度,在
藻细胞培养过程中每天测定藻细胞生物量的变化,每天取10ml藻液,用预先烘干并冷却至恒重(m1)的混合纤维滤膜(孔径为0.45μm)抽滤,之后置于105℃的烘箱中烘干至恒重(m2)。用单位体积藻液的干重(dryweight,dw)表示生物量,单位是(g/l),计算公式如下:dw(g/l)=(m2-m1)×100。
不同初始氮浓度对jnu35生长的影响如图3所示。从第6天开始,3mmol/l氮浓度下藻细胞生长相对缓慢,9mmol/l和18mmol/l氮浓度下藻细胞生长速度无显著差异。培养到15天,3种氮浓度下生物量分别为4.66g/l,5.71g/l和5.74g/l。随后,将藻细胞转入无氮bbm培养基中,培养到第25天,生物量达到最高,生物量逐渐平稳,到第30天生物量分别为6.00g/l,8.20g/l和9.90g/l。
3.不同初始氮浓度培养下虾青素含量的时相变化
每3天收集100ml藻液,3000rpm离心5min,收集藻泥,冷冻干燥后保存于4℃。取冻干的藻粉10mg加入预先放有磁性转子的10ml的螺口玻璃离心管中,加入5ml二甲基亚砜,在70℃下恒温磁力搅拌水浴加热15min后,在3000r/min的转速下离心5min。收集上清液装于25ml的棕色容量瓶中。重复3~5次,直至藻渣变为白色,提取过程一律避光操作。合并所有上清液在容量瓶中并用二甲基亚砜定容,震荡摇匀后避光保存。利用紫外分光光度计在波长530nm下检测并计算样品中虾青素的含量。计算公式:虾青素含量(%dw)=(c×0.25)×100%/m(其中c表示紫外分光光度计检测的样品中虾青素的浓度(mg/l),c=(a530-0.0107)/0.1556,m表示藻粉的质量)。
不同初始氮浓度对jnu35虾青素积累的影响如图4所示,与生物量积累相反,3mmol/l和9mmol/l氮浓度下虾青素在第6天开始迅速积累,培养至第15天虾青素含量分别为1.41%和1.13%。高氮浓度18mmol/l下,培养到15天虾青素含量仅为0.36%,随着第二阶段转到无氮的培养中,虾青素才开始迅速积累,且积累速率高于第二阶段3mmol/l和9mmol/l氮浓度下的虾青素积累速率,最终在培养30天,虾青素含量分别为2.35%、2.00%和1.35%。结果表明,氮限制和无氮胁迫能显著的促进虾青素的积累,但是同时也会影响藻细胞的生长。因此,需要优化两步法条件,实现雨生红球藻高生物量和高虾青素积累平衡。
实施例3不同光强对jnu35的影响
在
如图5所示为jnu35在培养15天时生物量达到5.1g/l,然后转入无氮培养中,并分别给予单侧光强300μmol·m-2·s-1和双侧光强300μmol·m-2·s-1的持续光照,培养到30天两种光强下生物量分别为9.8g/l和12.2g/l。
同样取培养最后一天的藻细胞,离心冻干后测定虾青素含量,虾青素测定方法同实施例2。单侧光强300μmol·m-2·s-1和双侧光强300μmol·m-2·s-1下虾青素含量分别为1.45%和2.1%。结果表明增加一倍的光强,能明显促进生物量和虾青素的积累,相对于单侧高光强,双侧高光强能净增加2.4g/l生物量和0.65%虾青素含量,但就能源消耗来讲,这一结果仍然不理想。
实施例4jnu35的培养条件优化
1.培养基与氮源种类的选择
培养藻种的制备同实施例2。
分别设置改良的bg-11培养基和改良的bbm培养基,第一个阶段分别以nano3、nh4hco3和co(nh2)2为氮源(初始氮浓度均为18mmol/l)培养jnu35,以od750=0.50±0.01的初始浓度接种于
结果如图6所示,jnu35在三种氮源和两种培养基下均生长良好,培养18天6个处理条件差异不大,最高达到4.6g/l,之后转于无氮且
2.虾青素含量分析
虾青素测定方法同实施例2。
6种培养条件下培养到第40天,虾青素含量如图7,与生物量积累相反,bg-11培养基下虾青素含量均高于bbm培养基,最高虾青素含量在bg-11培养基氮源为co(nh2)2时获得,为4.35%;其次,bg-11培养基氮源为nh4hco3时虾青素含量为4.06%。
因此,本发明创新的优化了两步法策略,有效平衡了生物量和虾青素含量的同步快速积累。特别是jnu35最佳的培养条件为第一阶段,以改良的bg-11培养基且氮源为co(nh2)2培养18天,获得生长旺盛的细胞;第二阶段更换到不添加氮源的改良的bg-11培养基,同时通过更换培养反应器管径为
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
序列表
<110>暨南大学
<120>高产虾青素的雨生红球藻jnu35及其培养方法与应用
<160>3
<170>siposequencelisting1.0
<210>1
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>1
aacctggttgatcctgccagt21
<210>2
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>2
tgatccttctgcaggttcacctac24
<210>3
<211>1557
<212>dna
<213>雨生红球藻jnu35(haematococcuspluvialisjnu35)
<400>3
ggaaataagcatgcatgtctaagtataaactgcttatacggtgaaactgcgaatggctca60
ttaaatcagttatagtttatttgatggtactttactcggataaccgtagtaattctagag120
ctaatacgtgcgtatatcccgacttctggaagggacgtatttattagataaaaggccagc180
cgggcttgcccgacctatggcgaatcatgataacttcacgaatcgcacggccttgcgccg240
gcgatgtttcattcaaatttctgccctatcaactttcgatggtaggatagaggcctacca300
tggtggtaacgggtgacggaggattagggttcgattccggagagggagcctgagaaacgg360
ctaccacatccaaggaaggcagcaggcgcgcaaattacccaatcccgacacggggaggta420
gtgacaataaataacaataccgggcatcaatgtctggtaattggaatgagaacaatttaa480
atcccttaacgagtatccattggagggcaagtctggtgccagcagccgcggtaattccag540
ctccaatagcgtatatttaagttgttgcagttaaaaagctcgtagttggatttcgggtgg600
gttccagcggtctgcctctggtatgtactgctgtggcctacctttctgccggggacgtgt660
tcctgggcttcattgtccgggactcgaattcggcgaggatactttgagtaaaacagcgtg720
ttcaaagcaagcctacgctctgaatgcattagcatggaatatcacgataggactctggcc780
tatcttgttggtctgtaggaccggagtaatgattaagagggacagtcgggggcattcgta840
tttcattgtcagaggtgaaattcttggatttatgaaagacgaacttctgcgaaagcattt900
gccaaggatgttttcattaatcaagaacgaaagttgggggctcgaagacgattagatacc960
gtcgtagtctcaaccataaacgatgccgactagggattggcaggtgttttattgatgacc1020
ctgccagcaccttatgagaaatcaaagtttttgggttccggggggagtatggtcgcaagg1080
ctgaaacttaaaggaattgacggaagggcaccaccaggcgtggagcctgcggcttaattt1140
gactcaacacgggaaaacttaccaggtccagacacgggaaggattgacagattgagagct1200
ctttcttgattctgtgggtggtggtgcatggccgttcttagttggtgggttgccttgtca1260
ggttgattccggtaacgaacgagacctcagcctgctaaatagtcaagcgtaccttggtac1320
gcgcctgacttcttagagggactattgacgtttagtcagtggaagtgtgaggcaataaca1380
ggtctgtgatgcccttagatgttctgggccgcacgcgcgctacactgatgcattcagcga1440
gcctatccttggccgagaggtccgggtaatctttgaaactgcatcgtgatggggatagat1500
tattgcaattattagtcttcaacgaggaatgcctagtaagcgcgatcatcgcttgca1557
- 还没有人留言评论。精彩留言会获得点赞!