聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料及应用的制作方法
本发明涉及生物医学工程技术领域,具体涉及一种聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料及其在维持干细胞干性中的应用。
背景技术:
干细胞治疗技术在基因治疗、自身免疫性疾病、脑部和神经系统疾病治疗、心血管疾病治疗中显示出巨大的临床应用前景。其中,自体成体干细胞移植的优势尤为突出。
成体干细胞是指存在于一种已经分化组织中的未分化细胞。在特定条件下,成体干细胞或者产生新的干细胞,或者按一定的程序分化,产生各种特异的细胞类型。与胚胎干细胞相比,成体干细胞具有诸多的优势,例如:(1)由于每个个体的主要组织相容性复合体(mhc)不同,同种异体胚胎干细胞及其分化组织细胞用于临床会引起免疫排斥,因而限制了其临床应用;而成体干细胞可从患者自身获得,而不存在组织相容性的问题,治疗时可避免长期使用免疫抑制剂对患者的伤害。(2)虽然胚胎干细胞能分化成各种细胞类型,但这种分化是“非定位性”的,目前尚不能控制胚胎干细胞在特定的部位分化成相应的细胞,当前的做法容易导致畸胎瘤;而成体干细胞在应用时不存在上述问题。然而成体干细胞在机体中数量有限,需要体外扩增以满足临床需求。传统的平皿培养存在接触抑制现象,细胞增殖率低,且极易分化或老化,严重影响了干细胞的数量和质量。因此,开发一种新型的维持成体干细胞干性的培养方法迫在眉睫。
微球是指由天然或合成的高分子材料(如明胶、壳聚糖、聚乳酸等)制成,粒径在1-1000微米之间。微球的制备方法主要有乳化/溶剂挥发法、喷雾干燥法、超临界二氧化碳法以及微流控法等。制备方法的不同导致制备得到的微球的形貌、结构、性能等都存在差异。目前微球主要用于药物缓释、细胞支架和细胞注射等领域,还未有利用微球促进成体干细胞增殖、并维持成体干细胞干性的报道。
技术实现要素:
针对上述现有技术,本发明的目的是提供一种聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料。本发明的聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料具有良好的细胞相容性,能够促进成体干细胞增殖,细胞存活率在98%以上,且能维持成体干细胞的干性,采用本发明的聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料扩增后的成体干细胞具有良好的分化潜能,可以分化为成骨、脂肪以及软骨细胞。
为实现上述目的,本发明采用如下技术方案:
本发明的第一方面,提供一种聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料的制备方法,包括以下步骤:
(1)将聚乳酸和碳酸钙溶解于二氯甲烷中,制得第一溶液;
(2)采用微流控技术将第一溶液滴入聚乙烯醇水溶液中,在搅拌条件下获得包含碳酸钙的聚乳酸微球;
(3)将包含碳酸钙的聚乳酸微球浸入k2hpo4溶液中,于20-30℃恒温水浴下反应3-7天,收获微球,洗涤,干燥,即制备得到聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料。
步骤(1)中,所述第一溶液中,聚乳酸的重量百分含量为1-10%,聚乳酸的分子量为5万-50万,碳酸钙的重量百分含量为1-10%。
步骤(2)中,所述采用微流控技术将第一溶液滴入聚乙烯醇水溶液中,具体为:微通道的孔径为40-400μm,滴入速度为0.01ml/min-3ml/min。
步骤(2)中,所述聚乙烯醇水溶液的浓度为1mg/ml-10mg/ml。
步骤(2)中,搅拌的速度为100rpm-1000rpm。
步骤(3)中,所述k2hpo4溶液的浓度为0.01mol/l-0.25mol/l,ph值为6.8-7.2。
本发明的第二方面,提供上述方法制备的聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料。所述聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料的直径为50-400μm。
本发明的第三方面,提供上述聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料在如下1)-3)至少一项中的应用:
1)促进成体干细胞增殖、并维持成体干细胞干性;
2)成体干细胞的体外扩增;
3)制备促进成体干细胞增殖、并维持成体干细胞干性的培养体系。
本发明的第四方面,提供一种能够促进成体干细胞增殖、并维持成体干细胞干性的培养体系,所述培养体系以上述的聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料为有效成分。
本发明的第五方面,提供一种体外扩增成体干细胞的方法,包括以下步骤:将成体干细胞接种至上述培养体系中,进行扩增培养。
本发明的有益效果:
(1)本发明的聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料,其制备条件温和,无需高温、高压反应条件,制备的复合微球材料粒径均一、形态可控。
(2)本发明的聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料具有良好的细胞相容性,能够促进成体干细胞增殖,细胞存活率在98%以上,且能维持成体干细胞的干性,采用本发明的聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料扩增后的成体干细胞具有良好的分化潜能,可以分化为成骨、脂肪以及软骨细胞。
附图说明:
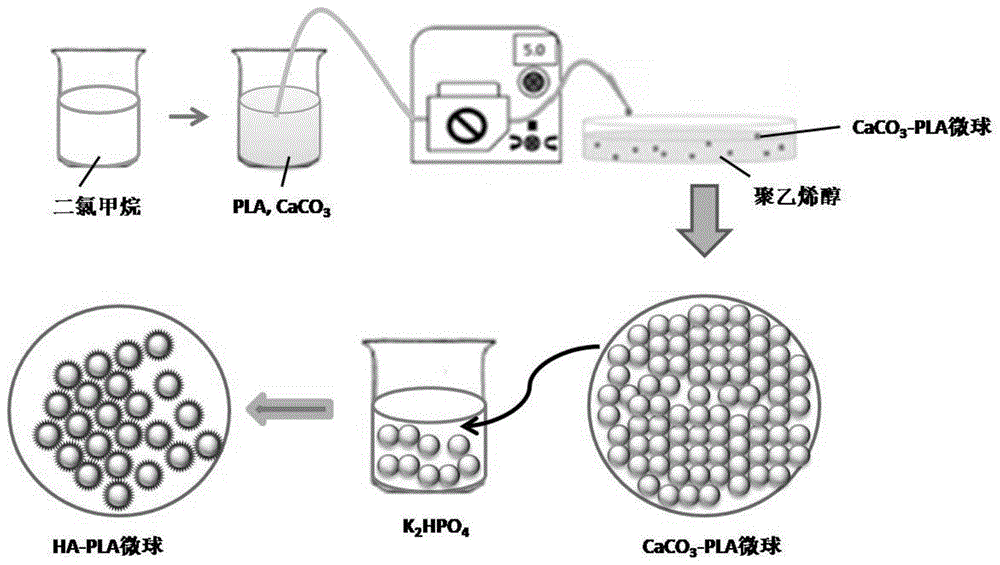
图1:本发明的聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料的制备流程图。
图2:本发明的聚乳酸-羟基磷灰石微米纳米复合微球的结构示意图。
图3:cck8染色显示生长在聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料上的脂肪间充质干细胞的增殖情况;其中,正常组为生长在培养皿中的细胞;材料组1-3分别为生长在实施例1-3获得的聚乳酸-羟基磷灰石微米纳米多级结构复合微球的细胞。
图4:在不同材料上培养脂肪间充质干细胞7天后的am-pi染色;其中,正常组为生长在培养皿中的细胞;材料组为生长在实施例3获得的聚乳酸-羟基磷灰石微米纳米多级结构复合微球的细胞。绿色为钙黄素染色,红色为pi染色。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
正如背景技术部分介绍的,现有的成体干细胞体外扩增方法,其细胞繁殖率低,且在增殖培养的过程中极易分化或老化,严重影响成体干细胞的数量和质量。
基于此,本发明的目的是提供一种新型的能够促进成体干细胞增殖、且能维持干细胞干性的培养方法。
传统的微球一般是用于药物缓释、细胞支架和细胞注射等领域,特别是作为药物的载体,目前还未有关于微球在干细胞增殖和干细胞干性维持中的报道。而本发明首次提出可以利用特定形貌和结构组成的聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料来促进成体干细胞的增殖,并维持干细胞的干性。
在本发明的一种实施方案中,给出了聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料的制备方法(如图1所示),包括以下步骤:
以聚乳酸微球为基础单位,在其表面合成羟基磷灰石纳米结构;具体为:
将聚乳酸和caco3溶解于二氯甲烷中,采用微流控技术,将溶液滴入聚乙烯醇水溶液中,在搅拌条件获得包含caco3的聚乳酸微球,将微球浸入k2hpo4溶液中,于20-30℃恒温水浴下反应3-7天,用去离子水清洗三次,再用无水乙醇清洗后,真空干燥,获得表面包被羟基磷灰石纳米结构的聚乳酸微球(如图2所示)。
羟基磷灰石因具有良好的生物相容性目前被广泛用作组织工程,特别是骨科相关研究。羟基磷灰石的获取方法主要有水热法、化学沉积法、溶胶-凝胶法等,其中,水热法需要高温高压条件;溶胶-凝胶法需要碱性条件且要高温处理;这些方法均不适合用于在聚乳酸凝胶上生长羟基磷灰石。
为实现在聚乳酸微球表面生长羟基磷灰石纳米结构,本发明是将聚乳酸和碳酸钙溶解于二氯甲烷中,形成第一溶液;然后采用微流控技术将第一溶液滴入聚乙烯醇水溶液中,在搅拌条件下获得包含碳酸钙的聚乳酸微球;然后将包含碳酸钙的聚乳酸微球浸入k2hpo4溶液中,于20-30℃恒温水浴下反应3-7天,表面的碳酸钙会与k2hpo4反应,形成覆盖在聚乳酸表面的羟基磷灰石。
上述整个制备过程的反应条件温和,聚乳酸微球没有经过高温熔化处理,仍是实心的微球。另外,通过控制第一溶液中聚乳酸的浓度以及采用微流控技术,使制备的复合微球材料粒径均一、形态可控。
经试验验证,采用本发明方法制备的具有特定结构组成和形貌的聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料可以促进成体干细胞的增殖,并维持干细胞的干性。
为了使得本领域技术人员能够更加清楚地了解本申请的技术方案,以下将结合具体的实施例详细说明本申请的技术方案。
本发明实施例中所用的试验材料均为本领域常规的试验材料,均可通过商业渠道购买得到。
实施例1:聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料的制备
将10g聚乳酸(分子量为10万)和5gcaco3溶解于100ml二氯甲烷中,采用微流控技术(微通道为400μm),将溶液滴入聚乙烯醇水溶液中,滴入速度为0.5ml/min;在搅拌条件(搅拌速度为500rpm)获得包含caco3的聚乳酸微球。
将包含caco3的聚乳酸微球浸入k2hpo4溶液(浓度为0.1mol/l,ph值为7.0)中,于25℃恒温水浴下反应5天,收获微球,用去离子水清洗三次,再用无水乙醇清洗后,真空干燥,即制备得到聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料。
实施例2:聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料的制备
将5g聚乳酸(分子量为50万)和1gcaco3溶解于100ml二氯甲烷中,采用微流控技术(微通道为600μm),将溶液滴入聚乙烯醇水溶液中,滴入速度为3ml/min;在搅拌条件(搅拌速度为1000rpm)获得包含caco3的聚乳酸微球。
将包含caco3的聚乳酸微球浸入k2hpo4溶液(浓度为0.05mol/l,ph值为6.8)中,于20℃恒温水浴下反应7天,收获微球,用去离子水清洗三次,再用无水乙醇清洗后,真空干燥,即制备得到聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料。
实施例3:聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料的制备
将5g聚乳酸(分子量为30万)和10gcaco3溶解于100ml二氯甲烷中,采用微流控技术(微通道为800μm),将溶液滴入聚乙烯醇水溶液中,滴入速度为0.5ml/min;在搅拌条件(搅拌速度为100rpm)获得包含caco3的聚乳酸微球。
将包含caco3的聚乳酸微球浸入k2hpo4溶液(浓度为0.25mol/l,ph值为7.2)中,于30℃恒温水浴下反应3天,收获微球,用去离子水清洗三次,再用无水乙醇清洗后,真空干燥,即制备得到聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料。
试验例1:
将人源脂肪间充质干细胞接种在实施例1-实施例3制备的聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料上,分别培养1、3、5天后,利用cck8染色试剂盒,检测细胞增殖率,发现与对照材料(培养皿)相比,在微球上生长的细胞增殖率显著升高,而且随着培养时间的延长,微球促进细胞生长的效果愈发显著,说明材料具有很好的生物相容性(图3);钙黄素-pi细胞死活染色显示在微球上生长的细胞均为钙黄素染色阳性(染色为绿色,代表活细胞),而极少细胞为pi染色阳性(染色为红色,代表死细胞)(图4),表明在聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料上生长的细胞保持良好的生物活性,细胞存活率高达98%以上。在成骨和成脂诱导液的作用下,微球上收获的脂肪间充质干细胞能够分化为成骨和脂肪细胞。
结果表明,本发明制备的聚乳酸-羟基磷灰石微米纳米多级结构复合微球材料能够促进脂肪间充质干细胞的增殖,并能够维持细胞的干性。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!