基于ABCB1基因的小菜蛾对Bt杀虫蛋白Cry1Ac抗性的检测方法及其试剂盒与流程
本发明涉及生物领域,具体涉及小菜蛾对bt杀虫蛋白cry1ac抗性的实时荧光定量pcr检测方法及其试剂盒。
背景技术:
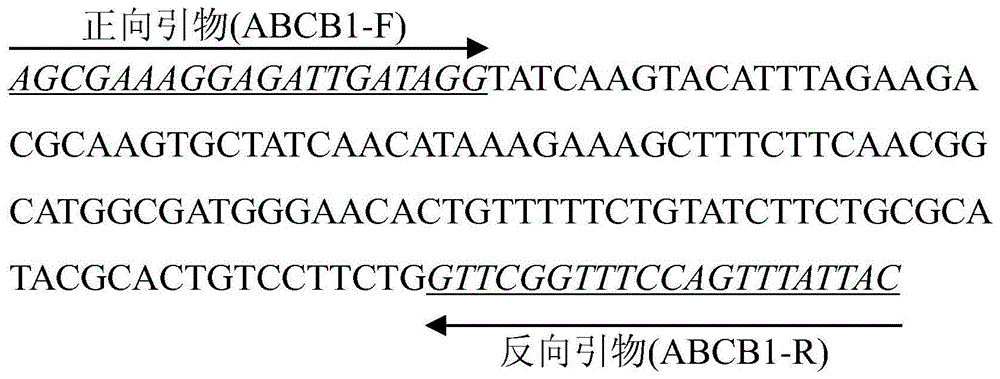
:小菜蛾plutellaxylostella(l.),属于鳞翅目(lepidoptera)菜蛾科(plutellidae),是目前世界上为害十字花科蔬菜和作物的重要农业害虫之一。作为鳞翅目昆虫中分布最广的农业害虫,小菜蛾最早起源于地中海地区的十字花科作物上,后逐渐扩散到世界各地。在我国,小菜蛾也逐年从南向北扩散,受害严重时叶片呈网状,使得十字花科蔬菜作物品质下降、减产、甚至绝收。据报道,小菜蛾在全世界范围内每年造成约40-50亿美元的经济损失,而使用杀虫剂防治小菜蛾是一种简单有效的方法,同时化学农药的大规模以及不合理使用使得其对多种不同类型的杀虫剂产生了不同程度的抗药性,且抗性谱极广,故而田间化学防治小菜蛾变得艰难。苏云金芽孢杆菌(bacillusthuringiensis,bt)作为一种革兰氏阳性杆状细菌,能产生多种杀虫晶体蛋白,是目前世界上用量最大的微生物杀虫剂,同时多种bt杀虫蛋白基因已被克隆转入到多种重要棉粮作物中。截止到目前,利用bt制剂和bt作物在防治害虫危害、化学农药减施增效和生态环境保护等方面发挥了重要的作用。然而,害虫对bt抗药性的产生正在严重危害着bt杀虫剂的可持续使用。小菜蛾是世界上第一个被报道在田间对bt制剂产生抗性的田间害虫,因而可以作为害虫bt抗性分子机制研究的模型材料。因此,小菜蛾bt抗性关键基因的鉴定以及bt杀虫蛋白的作用方式及机制研究对于bt制剂和bt作物的可持续使用、增加农民经济收入和保障人类饮食结构方面具有重要的理论和实践意义。随着分子生物学技术的飞速发展,荧光定量pcr技术(realtime-quantitativepolymerasechainreaction,rt-qpcr)已广泛应用于基础科学研究、临床诊断、疾病研究及药物研发等领域,同时也应用于转录水平上昆虫bt抗药性靶标基因的表达量检测。定量pcr技术是在pcr反应体系中加入荧光基团,利用荧光信号累积实时监测整个pcr进程,最后通过特定数学原理(在pcr指数扩增时期,荧光信号达到所设定阈值所经的循环数ct值与该模板的起始拷贝数存在线性关系)对未知模板进行定量分析的方法。相较于传统的小菜蛾毒力生物测定等常规性检测方法而言,实时荧光定量pcr具有特异性好,线性关系好、线性范围宽,操作简便、安全、自动化程度高,速度快、高通量的优点,使得其成为昆虫抗药性靶标基因转录水平表达量检测的首选方法,在抗药性检测上日益显示出强大的优势。abc转运蛋白(abctransporter)是一类跨膜转运蛋白超家族,它广泛存在于各种生物体中。据报道,abc转运蛋白在昆虫对异源生物质(包括杀虫剂等)的转运方面发挥着重要作用。昆虫中abc转运蛋白有abca到h共8个亚家族,其中abcb、abcc、abcg家族基因被报道在昆虫抗药性中发挥了重要作用。例如abcb1(p-glycoprotein)基因在多种昆虫如棉铃虫、埃及伊蚊、黑腹果蝇、青杨叶甲、甜菜夜蛾等被报道参与昆虫对杀虫剂的抗性过程,这就为害虫田间检测提供了很好的靶标基因。根据本实验室敏感和抗性种群中肠转录组、rna-seq和最近的rt-qpcr检测以及基因功能研究发现,abcb1基因表达量的下调与bt杀虫蛋白cry1ac抗性密切相关,那么利用rt-qpcr技术检测abcb1表达量的下降水平则可以作为一种有效检测小菜蛾对btcry类杀虫蛋白抗性的好方法。值得注意的是,小菜蛾早期抗药性分子检测与诊断技术的开发将为其抗药性风险评估和抗药性检测、监测及预警提供技术手段,同时在降低害虫危害、农药减施增效、保护生态环境、增加农民经济收入和保障人类饮食结构等方面具有重要的意义。因此,建立一种快速、简便、准确、可靠以及高效的小菜蛾bt抗性检测手段就显得尤为迫切,而为了更好的监测田间小菜蛾对bt杀虫蛋白cry1ac的抗性情况,开发出更有效的小菜蛾bt杀虫蛋白cry1ac抗性检测手段,本发明人开展了该研究内容。技术实现要素:本发明针对现有小菜蛾bt杀虫蛋白cry1ac抗性检测技术中存在的灵敏度低、检测周期长、重复性差及材料要求高等问题,通过特异性实时荧光定量pcr引物筛选及其反应体系的优化等步骤,建立一种快速准确的实时荧光定量pcr分子检测方法及简便、可靠、准确、快速、高效的检测小菜蛾bt抗性的检测试剂盒,为小菜蛾bt抗性有效检测提供有效工具。本发明的一个目的是提供一种用于检测小菜蛾对bt杀虫蛋白cry1ac抗性的特异性pcr引物对,所述引物对的序列:正向引物序列如seqidno.2所示,反向引物序列如seqidno.3所示。所述特异性引物对是以小菜蛾四龄幼虫中肠abc转运蛋白超家族中abcb亚家族abcb1基因的保守片段区(tmd跨膜区)为靶目标序列设计得到的靶标基因特异性引物对。本发明还提供一种用于检测小菜蛾对bt杀虫蛋白cry1ac抗性的pcr检测试剂盒,其特征在于:所述试剂盒包含所述的特异性pcr引物对。进一步地,本试剂盒中还包括本发明人实验室已发表的以小菜蛾持家基因核糖体蛋白rpl32基因的保守片段区为靶目标序列设计得到的内参基因rpl32特异性引物序列(正向引物序列:5′-ccaatttaccgccctacc-3′;反向引物序列:5′-taccctgttgtcaatacctct-3′),用于校正样品间实验误差。本试剂盒中含有特异性引物,逆转录酶,dnase,rnase抑制剂,dntp混合物,mgcl2溶液,热启动taqdna聚合酶,荧光定量反应液,buffer缓冲液,rnase-free水等。此外,本试剂盒还包括符合该试剂盒要求的阳性对照及阴性对照样品。本发明还提供一种检测小菜蛾对bt杀虫蛋白cry1ac抗性的pcr检测方法,具体包括以下步骤:(1)提取待测小菜蛾的rna样品,并反转录为cdna模板;(2)将所述cdna模板加入到含有上述特异性引物对的pcr反应液中得到pcr反应体系;(3)进行实时荧光定量pcr检测;所述实时荧光定量pcr检测的扩增程序为:95°c预变性10min,95°c变性15sec,55°c退火30sec,72°c延伸30sec,40个循环。pcr过程完成后,按1.6°c•s-1的升温速率从72°c升至95°c进行融解曲线的分析验证,具体过程为:95°c进行15s,然后60°c进行1min,按0.15°c•s-1的升温速率从60°c升至95°c,最后95°c进行1s。所述的方法,所述待测的小菜蛾rna样品为小菜蛾四龄幼虫中肠rna样品。所述的方法,本发明使用abiquantstudio3实时荧光定量pcr仪进行检测。本发明使用abiquantstudio3实时荧光定量pcr仪进行检测。abiquantstudio3实时荧光定量pcr仪进行结果分析时,基线设置取3-15个循环的荧光信号。为便于比较,待测样品、阴性对照及阳性对照的所有扩增曲线的阈值均设定为0.096612(位于扩增曲线对数期中间位置,其它仪器基线和阈值设定可根据仪器作相应调整)。对上述步骤中实时荧光定量pcr反应产物进行荧光定量检测,在特定的波长条件下,根据荧光检测的抗敏样品间各自靶标基因abcb1与内参基因rpl32之间的ct值差值(即δct值)来判断结果。若所述待测小菜蛾中肠样品产生典型的“s”型扩增曲线及单峰融解曲线,且δct值≥5,则说明所述小菜蛾待测样品对bt杀虫蛋白cry1ac产生抗性;若δct值≤4,则说明待测小菜蛾样品未对bt杀虫蛋白cry1ac产生抗性。若δct值位于两者中间,则建议重做,样品对bt杀虫蛋白抗性产生与否视重做结果而定。本发明系选择小菜蛾中肠abcb1基因的保守片段区(tmd跨膜区)为靶标序列,根据该基因的特点和荧光定量pcr引物设计的原则,设计了一对特异性引物,与本发明人实验室已报道的内参基因rpl32特异性引物共同建立了一种用于小菜蛾bt杀虫蛋白cry1ac抗性检测的实时荧光定量pcr试剂盒及其检测方法。与生物测定技术等常规性检测方法相比,本发明所提供的小菜蛾bt杀虫蛋白抗性检测实时荧光定量pcr检测试剂盒及其使用方法,具有如下优点及效果:(1)检测周期短。传统的生物测定方法至少需要48小时,而本方法仅需3小时就能完成,并且一次可以同时检测多个样品,特别适合大批量样品的快速检测。(2)特异性强。本发明利用abcb1基因的保守片段区(tmd跨膜区)为靶序列,设计了一对特异性引物,对靶序列进行特异性扩增,通过将待测样品和阴性对照间abcb1表达量差异比较即可测定待测样品是否产生抗性;而传统的生物测定方法则是设置不同梯度的bt杀虫蛋白cry1ac浓度处理试虫进而根据死亡情况粗略判断小菜蛾是否对bt杀虫蛋白cry1ac产生抗性,相较于基因检测而言这种方法特异性差得多。(3)灵敏度和准确度高。相比较于传统的粗略及重复性差的生物测定结果而言,通过检测实时荧光定量pcr荧光定量确定抗性靶标基因表达量来判断小菜蛾是否产生抗性检测方法更加灵敏、准确性更高。(4)材料要求少。小菜蛾传统的生物测定中一次测定至少需要200头标准试虫,而且试虫的饲养及挑取需要投入一定的人力、物力和财力。本发明方法则只需要少量试虫即可进行,甚至可以单头检测。综上所述,本发明的方法可替代传统的生物测定方法,它可以简便、准确、快速、特异的检测出供试小菜蛾是否具有bt抗性,对田间小菜蛾bt抗性的监测、监控及预警具有重要意义。本发明所提供的小菜蛾对bt杀虫蛋白cry1ac抗性的pcr检测方法,快速简便,准确可靠,需人力及样品量少,检测数量大,灵敏度高和特异性强,因而能有效的检测小菜蛾对bt杀虫蛋白的抗性,适合于田间小菜蛾对bt杀虫蛋白cry1ac抗性的早期快速诊断,同时可用于田间小菜蛾bt杀虫蛋白cry1ac抗性的实时监控和预警预报,应用前景广泛。附图说明图1是本发明中所用特异性引物对扩增小菜蛾幼虫中肠abcb1基因cdna片段序列(157-bp),其中斜体加下划线为扩增时使用的引物,分别是正向引物(abcb1-f)和反向引物(abcb1-r),箭头标明了上下游引物的方向。图2是使用标准品梯度稀释进行实时荧光定量pcr所得到的标准扩增曲线。其中,横坐标代表循环数(cycle),纵坐标代表第n次pcr循环时的荧光信号强度(rn),图中平行且远离横坐标的直线代表荧光阈值,字母代表样品cdna的5个2×梯度稀释浓度。图3是根据图2得出的数据所绘制出的标准曲线。其中,横坐标代表标准样品cdna浓度的对数值,纵坐标代表循环阈值即ct值。图4为实例1的检测小菜蛾bt杀虫蛋白cry1ac抗性的实时荧光定量pcr检测结果。其中,a为对bt杀虫蛋白cry1ac敏感小菜蛾种群dbm1ac-s的4龄幼虫中肠cdna样品;b为对bt杀虫蛋白cry1ac产生抗性的小菜蛾种群sz-r的4龄幼虫中肠cdna样品。图5是实施例2的检测小菜蛾bt杀虫蛋白cry1ac抗性的实时荧光定量pcr检测结果。其中,a为实施例1中对bt敏感的小菜蛾种群dbm1ac-s的4龄幼虫中肠cdna阴性对照样品;b为实施例1中对bt杀虫蛋白cry1ac产生抗性的小菜蛾种群sz-r的4龄幼虫中肠cdna阳性对照样品;c为对btk制剂产生抗性的小菜蛾种群sh-r的4龄幼虫中肠cdna待测样品;d为对bt杀虫蛋白cry1ac产生抗性的近等基因系小菜蛾种群dbm1ac-r的4龄幼虫中肠cdna待测样品;e为对bt杀虫蛋白cry1ac产生抗性的小菜蛾种群nil-r的4龄幼虫中肠cdna待测样品。具体实施方式以下结合具体实例对本发明做进一步描述与说明,但本发明的保护范围并不仅限于此。实验前材料样品准备:(1)小菜蛾bt杀虫蛋白敏感种群(dbm1ac-s):该小菜蛾种群在中国农业科学院蔬菜花卉研究所昆虫组昆虫饲养室内使用无虫甘蓝苗和萝卜苗饲养法继代饲养至今,期间从未接触过任何杀虫剂,对bt制剂敏感。(2)小菜蛾bt杀虫蛋白cry1ac抗性种群(dbm1ac-r):该小菜蛾种群在中国农业科学院蔬菜花卉研究所昆虫组昆虫饲养室内使用无虫甘蓝苗和萝卜苗饲养法饲养至今。同时在继代饲养期间,在3龄幼虫期使用btcry1ac原毒素进行抗性汰选和维持。(3)小菜蛾bt杀虫蛋白cry1ac抗性近等基因系种群(nil-r):该种群利用dbm1ac-s和dbm1ac-r两种群进行连续6代的杂交和回交,其后代连续使用btcry1ac原毒素汰选,成功建立了与dbm1ac-s相对应的btcry1ac高抗小菜蛾近等基因系nil-r种群。之后该种群在中国农业科学院蔬菜花卉研究所昆虫组昆虫饲养室内使用无虫甘蓝苗和萝卜苗饲养法饲养至今。在继代饲养期间,在3龄幼虫期使用btcry1ac原毒素进行抗性汰选和维持。(4)深圳汰选种群(sz-r):该种群于2003年采自广东省深圳地区的甘蓝田中,之后在中国农业科学院蔬菜花卉研究所昆虫组昆虫饲养室内使用无虫甘蓝苗和萝卜苗饲养法饲养至今,同时在继代饲养期间,在3龄幼虫时期使用btcry原毒素进行抗性汰选和维持。(5)上海汰选种群(sh-r):该种群于2005年采自上海市郊区的甘蓝田中,之后在中国农业科学院蔬菜花卉研究所昆虫组昆虫饲养室内使用无虫甘蓝苗和萝卜苗饲养法饲养至今,在继代饲养期间,在3龄幼虫期使用btk制剂(16000iu/mg的可湿性粉剂)进行抗性汰选和维持。以上所用的5个种群:小菜蛾bt杀虫蛋白敏感种群(dbm1ac-s)、小菜蛾bt杀虫蛋白cry1ac抗性种群(dbm1ac-r)、小菜蛾bt杀虫蛋白cry1ac抗性近等基因系种群(nil-r)、深圳汰选种群(sz-r)和上海汰选种群(sh-r)。上述五个小菜蛾种群均在养虫室内进行隔离饲养,首先将蛹放入成虫饲养笼中(大小视蛹量而定),笼四周以80目的纱网包围;待到成虫羽化后,笼内挂浸过10%蜂蜜水的脱脂棉球一个,为成虫补充营养;最后使用新鲜的无虫甘蓝苗接孵化后的幼虫进行继代饲养。饲养温度是25±1°c,相对湿度为65%左右,光周期为光照:黑暗=16h:8h。实施例1利用实时荧光定量pcr技术对dbm1ac-s及sz-r的4龄幼虫中肠cdna样品的检测及本检测试剂盒和其使用方法的建立。1.以小菜蛾中肠abcb1基因的保守片段区(tmd跨膜区)为靶序列(序列如seqidno.1所示),根据实时荧光定量pcr设计的原则,设计特异性荧光定量引物如下:正向引物(qb1-f):5′-agcgaaaggagattgatagg-3′(seqidno.2)反向引物(qb1-r):5′-gtaataaactggaaaccgaac-3′(seqidno.3)该特异性引物扩增abcb1保守tmd1区域片段序列如图1所示,其扩增条带大小为157bp,符合实时荧光定量pcr反应要求。同时使用本发明人实验室已报道的rpl32特异性引物(guoetal.,mapksignalingpathwayaltersexpressionofmidgutalpandabccgenesandcausesresistancetobacillusthuringiensiscry1actoxinindiamondbackmoth,plosgenetics,2015,11(4):e1005124)扩增该内参基因保守区域片段,其扩增条带大小为120bp,也符合实时荧光定量pcr反应要求。两个基因扩增片段经测序验证和序列比对后确认其特异性。2.提取两种群中肠rna样品,并反转录为cdna模板,在包括步骤1所述的特异性引物的实时荧光定量pcr反应体系内进行反应;(1)小菜蛾中肠rna提取步骤如下:取两种群四龄幼虫,使用解剖镊冰上解剖中肠,并使用0.7%nacl溶液中清洗干净。②将中肠组织放入玻璃匀浆器内,并向匀浆器中加入lml的trizol试剂充分研磨匀浆,匀浆后将液体倒入1.5ml离心管内,冰上放置5min。③向离心管内加入300μl氯仿,剧烈震荡15s,冰上放置5min,4°c条件下12000rpm离心10min。④吸取上清于新的离心管中,加入400μl异丙醇,轻轻颠倒混匀,冰上静置10min,4°c条件下12000rpm离心10min。⑤弃上清,加入1ml75%乙醇洗涤沉淀。4°c条件下8000rpm离心5min。⑥rna自然干燥后,加入50μl水溶解,-80°c保存。测定od260/od280值,同时电泳检测rna是否降解,选择合适的条件和试剂进行反转录实验或者-80°c保存备用。(2)反转录合成cdna模板下面以日本takara公司去基因组的primescriptrt试剂盒为例,实验过程如下:使用前按照说明书将试剂盒各组分解冻,震荡并离心混匀。②去除基因组dna反应:表1反转录反应(冰上进行):表2(3)实时荧光定量pcr标准曲线的建立:将样品cdna模板标准品依次进行5个梯度2倍稀释,稀释倍数依次为1:1,1:2,1:4,1:8和1:16,然后采用sybrgreeni嵌合荧光法进行实时荧光定量pcr:荧光定量pcr反应体系20μl组成如下:表3试剂体系2×superrealpremixplus*10μl10μm正向引物0.5μl10μm反向引物0.5μlcdna模板1μl50×roxreferencedye0.4μlrnase-freeddh2o至20μl*该产品为天根生化科技(北京)有限公司superrealpremixplus(sybrgreen)试剂盒。荧光定量pcr反应条件为:95°c预变性10min,95°c变性15sec,55°c退火30sec,72°c延伸30sec,40个循环。pcr过程完成后,按1.6°c•s-1的升温速率从72°c升至95°c进行融解曲线的分析验证,具体过程为:95°c进行15s,然后60°c进行1min,按0.15°c•s-1的升温速率从60°c升至95°c,最后95°c进行1s。最终得到的荧光定量标准扩增曲线如图2所示;其中,横坐标代表循环数(cycle),纵坐标代表第n次pcr循环时的荧光信号强度(rn),图中平行且远离横坐标的直线代表荧光阈值,a、b、c、d、e字母代表样品cdna的5个稀释浓度。最终得到的标准曲线如图3所示;其中,横坐标代表标准样品cdna浓度的对数值,纵坐标代表循环阈值即ct值。(4)实时荧光定量pcr反应过程:实时荧光定量pcr反应过程的体系及条件如上面步骤(3)所述。3.检测本发明使用abiquantstudio3实时荧光定量pcr仪进行检测。4.结果分析abiquantstudio3实时荧光定量pcr仪进行结果分析时,基线设置取3-15个循环的荧光信号。为便于比较,待测样品(供试小菜蛾种群4龄幼虫中肠cdna样品)、阴性对照(对bt杀虫蛋白敏感的小菜蛾种群dbm1ac-s的4龄幼虫中肠cdna样品)及阳性对照(对bt杀虫蛋白cry1ac产生抗性的小菜蛾种群sz-r的4龄幼虫中肠cdna样品)的所有扩增曲线的阈值均设定为0.096612(位于扩增曲线对数期中间位置,其它仪器基线和阈值设定可根据仪器作相应调整)。对于上述步骤中对上述步骤中荧光定量pcr反应产物进行实时荧光定量检测,如图4中所示,在特定的波长条件下,根据荧光检测的抗敏样品间各自靶标基因abcb1与内参基因l32之间的ct值差值(即δct值)判断结果,可知两样品产生了典型的“s”型扩增曲线,且dbm1ac-s的样品的δct值为4.17±0.07(sem),sz-r的样品的δct值为5.06±0.11(sem)。通过统计学分析,两者之间的表达量差异达到了极显著水平,由此,通过bt抗敏样品间该基因的表达量差异可知,可以很明显的区分出两者,那么区分标准可初步设定为:δct值≥5,则说明待测样品已对bt杀虫蛋白产生抗性;若δct值≤4,则说明待测样品为敏感种群,尚未对bt杀虫蛋白产生抗性;若δct值位于两者中间,则建议重做,样品对bt杀虫蛋白抗性产生与否视重做结果而定。实施例2通过其他三个bt抗性小菜蛾种群dbm1ac-r,nil-r及sh-r验证实施例1中的试剂盒及检测方法的可用性,具体实验过程如实施例1所示。最终的实时荧光定量pcr反应检测结果如图5中所示,其中,a为实施例1中对bt杀虫蛋白敏感的小菜蛾种群dbm1ac-s的4龄幼虫中肠cdna阴性对照样品;b为实施例1中对bt杀虫蛋白cry1ac产生抗性的小菜蛾种群sz-r的4龄幼虫中肠cdna阳性对照样品;c为对btk产生抗性的小菜蛾种群sh-r的4龄幼虫中肠cdna待测样品;d为对bt杀虫蛋白cry1ac产生抗性的小菜蛾种群dbm1ac-r的4龄幼虫中肠cdna待测样品;e为对bt杀虫蛋白cry1ac产生抗性的小菜蛾近等基因系种群nil-r的4龄幼虫中肠cdna待测样品。在特定的波长条件下,根据荧光检测的抗敏样品间各自δct值判断结果,可知两样品产生了典型的“s”型扩增曲线,且sh-r样品的δct值为5.34±0.08(sem),dbm1ac-r样品的δct值为5.84±0.03(sem),nil-r样品的δct值为5.91±0.04(sem)。通过分析,相对于dbm1ac-s阴性对照,三者的表达量均以达到了极显著水平,与sz-r阳性对照水平相当。由此可知,该区分标准设定合理,通过该实时荧光定量pcr检测试剂盒,可以很明显的区分出bt杀虫蛋白cry1ac抗性及敏感小菜蛾。序列表<110>中国农业科学院蔬菜花卉研究所<120>基于abcb1基因的小菜蛾对bt杀虫蛋白cry1ac抗性的检测方法及其试剂盒<160>3<210>1<211>157<212>dna<400>1agcgaaaggagattgataggtatcaagtacatttagaagacgcaagtgctatcaacataaagaaagctttcttcaacggcatggcgatgggaacactgtttttctgtatcttctgcgcatacgcactgtccttctggttcggtttccagtttattac<210>2<211>20<212>dna<400>2agcgaaaggagattgatagg<210>3<211>21<212>dna<400>3gtaataaactggaaaccgaac当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1