一种异源二聚体蛇毒蛋白的制备方法与流程
本发明涉及重组蛋白的制备方法,特别涉及血栓治疗的重组蛋白药物异源二聚体蛇毒蛋白的制备方法。
背景技术:
心脑血管疾病尤其是血栓引起的脑梗塞和心机梗塞严重威胁着人类健康,影响患者的生存质量。这类疾病是目前世界上的第三大致死因素,不仅在急性发作期给病人的生命带来极大的威胁,而且由于极易发生的愈后不良,导致物力、财力的巨大耗费。因此,对这类疾病寻找新的安全有效的药物迫在眉睫,而蛇毒对凝血系统的作用越来越受到人们的重视,蛇毒中某些成分是治疗上述疾病的有效药物。
尖吻蝮蛇蛇毒抗血小板溶栓素是在中国科大生命学院多年对蛇毒蛋白组分分离、纯化和活性研究的基础上发现的一种C型凝集素样蛋白,命名为Agkisacutacin,中文名为抗血小板溶栓素。Agkisacutacin为异源二聚体,两个亚基表观分子量非常接近,均在14-15kDa左右。经MALDI-TOF MS精确测定了Agkisacucetin的分子量为30kDa。通过氨基酸N端序列测定、LC-MS和Agkisacucetin蛋白的晶体结构等方法,最终得到Agkisacucetin的序列和晶体结构。Agkisacutacin具有抑制血小板聚集的活性,前期的研究为将该蛋白开发成新型一类抗血栓药物奠定了重要基础。
目前Agkisacutacin主要来源是天然蛇毒的提取,天然蛇毒来源有限,纯化步骤复杂,且得率较低,因此限制了Agkisacutacin作为抗血栓药物的科学研究和临床应用。
技术实现要素:
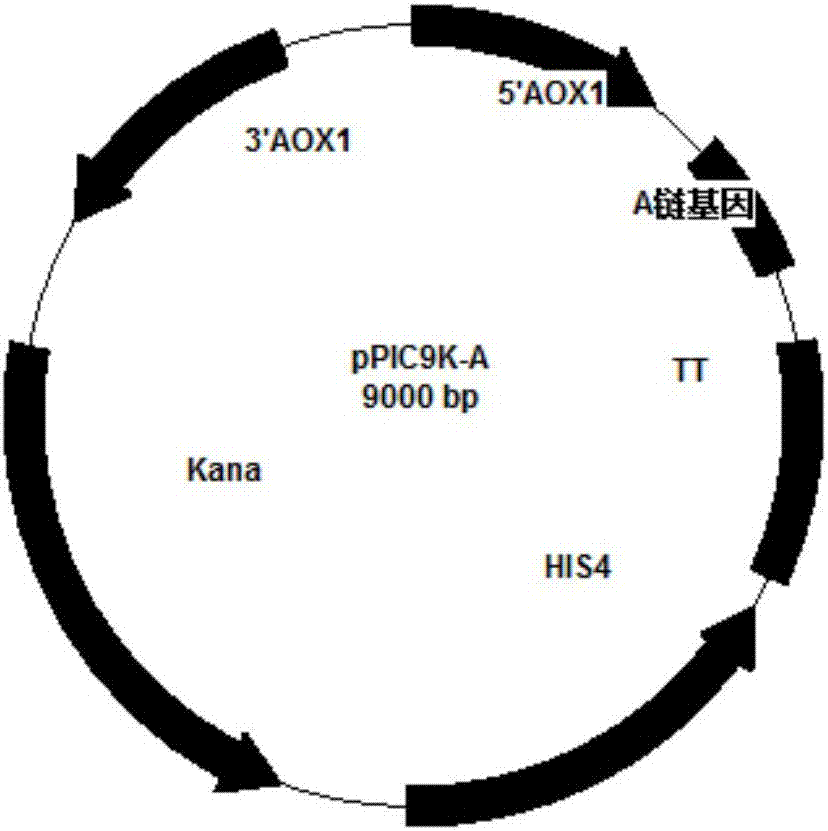
本发明的一个目的是提供重组质粒pPIC9K-A,如图1所示,其中Agkisacutacin A链基因序列如SEQ ID NO.1所示;质粒pUCZ-B,如图2所示,其中Agkisacutacin B链基因序列如SEQ ID NO.2所示。
本发明还提供一种转化体,含有重组质粒pPIC9K-A、质粒pUCZ-B之一或其组合。
本发明还提供转化体,其表达重组异源二聚体蛇毒蛋白,所述异源二聚体蛇毒蛋白由A链、B链两条肽链组成,其中,A链氨基酸序列如SEQ ID NO.3所示,B链氨基酸序列如SEQ ID NO.4所示。
作为优选,所述转化体为细胞株毕赤酵母菌株。
特别的,在本发明的实施例部分,提供保藏编号为CCTCC No.M2016358的细胞株,分类命名为巴斯德毕赤酵母GS115。其表达重组异源二聚体蛇毒蛋白,所述异源二聚体蛇毒蛋白由A链、B链两条肽链组成,A链氨基酸序列如SEQ ID NO.3所示,B链氨基酸序列如SEQ ID NO.4所示。
本发明还提供所述质粒、所述转化体在制备血栓治疗药物中的用途。
本发明还提供一种大量表达重组异源二聚体蛇毒蛋白的方法,包含以下几个步骤:
Batch阶段:取权利要求4-6任一项所述的转化体二级种接入含pH4.0~6.0的基础盐培养基中,添加甘油至4%,扩增菌体,溶解氧含量DO急剧上升时,batch阶段结束;
转化期:持续补充含有10-15ml/L PTM1的50%甘油溶液,流速为10-15ml/h/L,这个过程维持至湿重在190-200g/L;
甲醇诱导阶段:当湿重达到190-200g/L时,停止甘油流加,按恒定甲醇流速限制性流加含有12ml/L PTM1的甲醇溶液;搅拌速度800-1200rpm,总共发酵70-90小时,湿重达400-600g/L;湿重g/L是指每升培养液中含有的菌体重量。
蛋白纯化:发酵结束后,调节发酵液pH至8.0,经过高速离心、过柱,纯化得到重组异源二聚体蛇毒蛋白。
作为优选,整个过程温度为28-34℃。
本发明还提供所述方法制备的重组蛋白。
本发明采用全基因合成方式,由已知的Agkisacutacin的蛋白序列和结构形式获得其编码基因,发现甲醇利用型毕赤酵母一个是理想的Agkisacutacin表达系统,通过重组表达获得大量高纯度Agkisacutacin。实验验证酵母表达的重组Agkisacutacin为一异源二聚体蛋白,且具有生物学活性。
本发明首次利用巴斯德毕赤酵母表达Agkisacutacin,并进行了中试规模的发酵工艺研究,在高密度发酵条件下表达量超过10mg/L;通过三步纯化,纯度达到95%以上。此外本发明还为Agkisacutacin的生产提供了一种简单但是稳健的发酵工艺。
生物材料保藏说明
保藏编号为CCTCC No.M2016358的细胞株于2016年6月30日保藏于中国典型培养物保藏中心,地址为中国武汉市武汉大学,分类命名为巴斯德毕赤酵母GS115(Pichia pastoris GS115)。
附图说明
图1为Agkisacutacin A链表达载体结构示意图;
图2为Agkisacutacin B链表达载体结构示意图;
图3为Agkisacutacin的表达菌株Western Blot检测结果;
图4为Agkisacutacin的高表达菌株Western Blot检测结果;
图5为重组Agkisacutacin中试规模的发酵表达条件时间曲线;
图6为重组Agkisacutacin中试规模的双链、A链、B链不同诱导时间的表达情况;
图7示蛋白Agkisacutacin的鉴定;
图8示蛋白Agkisacutacin的纯化;
图9示重组Agkisacutacin的GP1b结合活性检测结果。
具体实施方式
本发明公开了一种异源二聚体蛇毒蛋白的制备方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的产品、方法已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
下面结合实施例,进一步阐述本发明:
1.实验材料
1.1菌株与质粒
P.pastoris菌株GS115、pPIC9K载体购自Invitrogen公司,pUCZ载体(Zeocin抗性)由本室构建。
1.2试剂
Yeast nitrogen base(YNB)购自BD公司;RPMI-1640培养基购自Hyclone公司;胎牛血清购自Gibco公司;Yeast extract和Trypton购自OXOID公司;BCA蛋白检测试剂盒购自Pierce公司;d-Sorbitol、d-biotin、质粒抽提试剂盒、PCR产物回收试剂盒、胶回收试剂盒、DNA聚合酶、T4DNA链接酶、限制性内切酶、蛋白marker和PAGE配置相关试剂购自上海生工;PHA和Endoglycosidase H(Endo H)购自Sigma-Aldrich公司;EZ-ECL化学发光检测试剂盒购自Biological Industries公司;其他化学试剂购自国药集团。含硅泡敌购自江苏赛欧信越消泡剂有限公司;抗Agkisacutacin抗体1B9来源于兆科公司。
1.3仪器
电子分析天平和pH计购自梅特勒-托利多公司;漩涡振荡仪购自Scientific Industries公司;电泳仪,垂直电泳槽、水平电泳槽、凝胶成像系统购自天能公司;半干转膜仪、电转仪购自Bio-Rad公司;化学发光检测仪购自UVITEC公司;高压灭菌锅购自Hirayama公司;台式冷冻离心机(Centrifuge 5810R、Centrifuge 5415R)购自eppendorf公司;超净工作台、摇床、恒温培养箱购自上海智诚公司;PCR仪购自德国Biometra公司;酶标仪(BLX-800)购自Bio-Tek公司;微量移液器购自法国Gilson公司;细胞培养箱购自Themo公司;AKTA explorer、Labscale TFF System和Pellicon XL(10kD)购自Millipore公司;115Benchtop Fermentor购自New Brunswick Scientific公司,大灭菌锅;Flex Stand system和0.45μm microfiltration cartridge购自GE healthcare;LTQ linear IT MS购自Thermo;EttanTM MDLC HPLC system购自GE healthcare;
1.4引物
1.AgkiA-Fw-Xho1:TCTCTCGAGAAAAGAGATGTCGATTGTCTCCCTGGTTGGTC
2.AgkiA-Rv-Not1-ng:ATATGCGGCCGCTTATGGCGGGGACTTGCAGACGAAAG
3.AgkiB-Fw-EcoR1:CTGAATTCGGTTTCTGTTGTCCCTTGCGTTGTTCG
4.AgkiB-Rv-Not1-ng:ATATGCGGCCGCTTATAGCTTGAACTTGCAGACGAAATAG
2.实验方法
2.1Agkisacutacin A链表达载体构建
一、具有EcoR1与Not1酶切位点的A链目的基因的扩增
全基因合成A链DNA序列,在引物AgkiA-Fw-Xho1和AgkiA-Rv-Not1-ng的引导下进行PCR扩增,PCR反应条件为:先94℃2分钟;然后94℃30秒,55℃40秒,72℃30秒,共32个循环;最后72℃10分钟。反应结束后,对PCR产物进行1%琼脂糖凝胶电泳检测,得到一条大小约396bp的条带,与预期结果相符。用PCR产物回收试剂盒回收目的条带。
二、重组Agkisacutacin A链的毕赤酵母表达载体的构建
用限制性内切酶EcoR1和Not1对上步获得的PCR产物进行双酶切,再将酶切片段与经相同酶双酶切的质粒pPIC9K用T4DNA连接酶进行连接,将连接产物转化大肠杆菌DH5α感受态细胞,筛选阳性重组子,提质粒,酶切鉴定,在将鉴定后的阳性克隆命名为pPIC9K-A,并送上海生工测序,测序结果显示插入pPIC9K的EcoR1和Not1的识别位点间的DNA序列与预期结果完全一致。
2.2Agkisacutacin B链表达载体构建
一、具有EcoR1与Not1酶切位点的B链目的基因的扩增
全基因合成B链DNA序列,在引物AgkiB-Fw-EcoR1和AgkiB-Rv-Not1-ng的引导下进行PCR扩增,PCR反应条件为:先94℃2分钟;然后94℃30秒,55℃40秒,72℃30秒,共32个循环;最后72℃10分钟。反应结束后,对PCR产物进行1%琼脂糖凝胶电泳检测,得到一条大小约381bp的条带,与预期结果相符。用PCR产物回收试剂盒回收目的条带。
二、重组Agkisacutacin B链的毕赤酵母表达载体的构建
用限制性内切酶EcoR1和Not1对上步获得的PCR产物进行双酶切,再将酶切片段与经相同酶双酶切的质粒pPIC9K用T4DNA连接酶进行连接,将连接产物转化大肠杆菌DH5α感受态细胞,筛选阳性重组子,提质粒,酶切鉴定,在将鉴定后的阳性克隆命名为pPIC9K-B,并送上海生工测序,测序结果与预期结果完全一致。将该克隆质粒使用BamH1和Not1进行双酶切,回收小片段,将回收的小片段与经相同酶双切的质粒pUCZ用T4DNA连接酶进行连接,将连接产物转化大肠杆菌DH5α感受态细胞,筛选阳性重组子,提质粒,酶切鉴定,在将鉴定后的阳性克隆命名为pUCZ-B,并送上海生工测序,测序结果与预期结果完全一致。
2.3重组Agkisacutacin表达克隆的筛选
将毕赤酵母菌株GS115在YPD平板划线。两天后,将长出的单克隆挑到YPD液体培养基中培养。两天后,酵母生长为乳白色,将此一级种接入YPD液体培养基中,此为二级种。使用此二级种制备酵母感受态,向其中电转化入已经用Sal1酶线性化的pPIC9K-A质粒,涂MD平板。48-72小时后,将平板上长出的单克隆挑入MGY液体培养基中培养,两天后,将该培养物1500g离心,弃上清,向其中加入pH5.0的BMMY培养基,诱导72小时,在此过程中,每24小时补充一次100%的甲醇,使BMMY培养基中甲醇浓度维持在0.5%。诱导结束之后,12000g离心,收集上清,SDS-PAGE检测A链蛋白是否表达,筛选出表达A链的单克隆。
将此表达A链蛋白的GS115单克隆在MD板划线。两天后,将长出的单克隆挑到MGY液体培养基中培养。两天后,酵母生长为乳白色,将此一级种接入YPD液体培养基中,此为二级种。使用此二级种制备酵母感受态,向其中电转化入已经用Spe1酶线性化的pUCZ-B质粒,涂添加抗生素Zeocin的MD平板。48-72小时后,将平板上长出的单克隆挑入添加抗生素Zeocin的MGY液体培养基中培养,两天后,将该培养物1500g离心,弃上清,向其中加入pH5.0的BMMY培养基,诱导72小时,在此过程中,每24小时补充一次100%的甲醇,使BMMY培养基中甲醇浓度维持在0.5%。诱导结束之后,12000g离心,收集上清,使用抗Agkisacutacin单克隆抗体进行Western Blot检测双链蛋白是否表达,筛选出表达双链的单克隆毕赤酵母GS115,其保藏编号为CCTCC No.M2016358,于2016年6月30日保藏于中国典型培养物保藏中心,分类命名为巴斯德毕赤酵母GS115(Pichia pastoris GS115)。
2.4重组Agkisacutacin的发酵表达
(1)一级种:从冻存的工作菌种库接种到4ml加入Zeocin的MGY培养基(MGY+Z),30℃,250rpm培养36-48h至OD600=2-6,此为发酵一级种;
(2)二级种:接1ml从1级种到200ml pH5.0BMGY中,30℃,250rpm培养12-18h,至OD600=2-6,此为发酵二级种;
(3)发酵准备:发酵罐组装及相关试剂准备、灭菌等工作;
(4)Batch阶段:将二级种接入含4L pH5.0的基础盐培养基的14L发酵罐中,使用含有4%甘油的基础盐培养基(pH 5.0)在batch阶段扩增菌体,培养温度30℃。等到DO急剧上升时,batch阶段结束。
(5)转化期:当DO开始急速上升时意味着原有培养基中甘油耗尽,需要持续补充含有12ml/L PTM1的50%甘油溶液,流速为12ml/h/L,这个过程维持4h至湿重在190g/L附近;
(6)甲醇诱导阶段:当湿重达到190g/L附近时,停止甘油流加,溶解氧会迅速上升,随后开始按恒定甲醇流速限制性流加含有12ml/L PTM1的甲醇溶液。温度控制在30℃;搅拌速度1000rpm左右,总共发酵80小时左右,湿重达500g/L左右。
2.5重组Agkisacutacin的纯化
(1)固液分离:发酵结束之后,使用NaOH缓缓地将发酵液pH调节到8.0,10000g,20min离心,收集上清液;
(2)样品的澄清:使用Flex Stand system0.22μm过滤澄清。
(3)蛋白捕获:离子交换柱捕获发酵液中的重组Agkisacutacin。使用Flexstand超滤/过滤系统将发酵液透析除盐,除盐后的样品流过CM FF柱,使用30%的buffer B洗脱样品。
(4)精细纯化:将30%Elution中的部分样品,通过Q HP进一步纯化,梯度洗脱,连续收集各峰样品,通过SDS-PAGE检测重组Agkisacutacin纯度。
(5)保存:用PBS冻存蛋白备用。
2.6重组Agkisacutacin的活性检测
(1)天然提取的Agkisacutacin可以结合GP1b位点,我们进行了重组Agkisacutacin与重组GPⅠb结合能力的检测实验。
(2)天然提取的Agkisacutacin可以抗血小板凝集,我们进行了重组Agkisacutacin抑制血小板凝集的实验。
3实验结果
3.1Agkisacutacin表达载体的构建,如图1、图2所示。
Agkisacutacin A链全长132个氨基酸,我们将A链的编码序列连接到毕赤酵母α-Factor信号肽3’末端,克隆到pPIC9K酵母表达载体中。这样通过甲醇诱导AOXⅠ启动子驱动其下游蛋白的表达。
Agkisacutacin B链全长127个氨基酸,我们将B链的编码序列连接到毕赤酵母α-Factor信号肽3’末端,克隆到pUCZ酵母表达载体中。这样通过甲醇诱导AOXⅠ启动子驱动其下游蛋白的表达。
3.2Agkisacutacin表达菌株的筛选
经过多次筛选之后,得到表达Agkisacutacin的克隆,Western Blot检测结果如图3所示。
对其中的1号克隆进行复筛,得到7个表达克隆,使用Western Blotting检测这些克隆中Agkisacutacin表达情况,均有效地表达出重组Agkisacutacin,见图4。
3.3重组Agkisacutacin中试规模的发酵表达
恒定甲醇流速限制性流加甲醇进行表达菌分批补料培养(fed-batch cultivation)。首先使用含有4%甘油的基础盐培养基(pH 5.0)在batch阶段扩增菌体,培养温度30℃。等到DO急剧上升时,batch阶段结束,菌体湿重达到134.7g/L。随后进入转换期即甘油流加期,经过约4个小时的生长菌体湿重进一步增加,达到193.6g/L。此时停止流加甘油,菌体呼吸活力下降,DO迅速上升;随后开始进行甲醇诱导,菌体呼吸活力恢复,DO开始逐渐下降。在甲醇诱导阶段,因为菌体对甲醇有一个适应阶段(2-4小时),因此需要在这段时间内逐步提高甲醇浓度,避免甲醇过量积累对菌体产生毒性。整个发酵过程非常稳定,各个参数都稳定在设定范围之内。发酵结束之后,OD600超过300,菌体湿重达到511.5g/L。检测结果表明整个发酵过程中,菌体的死亡率一直维持较低的水平,甲醇浓度也稳定在极低水平,维持菌体的限制性生长,见图5、图6。尽管菌体湿重在诱导过程中一直在增加,但是蛋白的表达量在培养80小时(或诱导60小时)就基本达到平衡,不再累计。因此在此时结束发酵比较适合。
3.4Agkisacutacin纯化与鉴定
发酵结束之后,调节发酵液pH至8.0,经过高速离心和Flexstand0.22um过滤澄清,用BCA测定发酵液中总蛋白含量为1.6g/L,并通过SDS-PAGE估算rAgkisacutacin的浓度超过100mg/L。由于本工程中心目前尚无rAgkisacutacin检测的ELISA试剂盒,因此暂时无法准确定量。
由于rAgkisacutacin没有携带任何tag,且我们工程中心没有rAgkisacutacin抗体亲和层析柱,因此我们尝试使用离子交换柱捕获发酵液中的rAgkisacutacin。使用Flexstand超滤/过滤系统将发酵液透析除盐,除盐后的样品流过CM FF柱,使用10%和30%的buffer B洗脱样品(前期已使用1ml小型离子交换柱初步摸索过纯化条件),从检测结果可知,rAgkisacutacin主要在30%的Elution中(通过还原条件下+DTT的SDS-PAGE中15kDa位置是否有两条紧密相连的条带,来确定该样品中是否含有rAgkisacutacin,通过非还原条件下SDS-PAGE看蛋白纯度)。10%的Elution也含有少量rAgkisacutacin,且A链含量比B链高,因此10%的Elution中应该有少量AA同源二聚体(图7A)。将30%Elution中的部分样品,通过Q HP进一步纯化,梯度洗脱出现5个峰,其中两个峰连续收集了2-3管样品(P1和P2),通过观察还原条件下SDS-PAGE中15kDa位置的两条带发现,rAgkisacutacin主要在P2峰中,特别是P2-2样品,杂质最少;P3峰中A链含量比B链高,因此会有AA同源二聚体污染;P1、P4、P5不含A、B链(图7B)。
由于P2-2样品主要含有两条带,且位置相差较大,因此我们采用分子筛进行纯化。与预期一致,这两条带可以很好的分离开来,经检测确认分子筛中P2为我们所需的目的蛋白rAgkisacutacin,非还原条件一下为一条均匀的带,还原条件下为两条含量基本一致的带(图8,P1’和P2’分别表示P1和P2的峰尖)。目前尚未对上述分子筛中P2和P2’进行纯度鉴定,目测应该可以达到90%的纯度。经初步估算,从1L发酵液中,大约可以获得纯化样品10mg。
3.5Agkisacutacin活性测定
对纯化产物进行了GPⅠb结合活性检测和抗血小板凝集活性检测两个方面的实验。GPⅠb结合活性检测结果表明,重组Agkisacutacin可以与重组GPⅠb很好的结合,估算相对亲和力常数为10-7M(如图9)。抗血小板凝集活性由兆科公司进行检测,实验结果表明,当蛋白量达到2ug时,在检测系统中可以100%抑制血小板聚集;当蛋白量为1ug时无抑制活性。上述实验均定性地表明,酵母来源的重组Agkisacutacin具有生物学活性和生理功能。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!