美洲大蠊wingless基因全长鉴定及应用的制作方法
本发明涉及一种基因的克隆与功能鉴定,尤其涉及美洲大蠊wingless基因全长克隆与功能鉴定及应用,属于生物技术领域。
背景技术:
美洲大蠊是中国南方地区最常见的蜚蠊,能进入室内危害,是优势卫生害虫之一。它们能在室内的任何地方被发现,如脏的床垫、床单表明,软垫的家具,地毯,它们在厨房里活动频繁[1]。目前,化学防治仍是蟑螂防治的一项重要手段。随着化学杀虫剂的大量使用,蟑螂迅速产生了抗药性,并且越来越严重[2]。同时由于化学杀虫剂的使用,会生态环境产生的严重的影响和破坏作用。因此,利用分子生物信息技术来防制蟑螂具有非常广阔的应用前景[3]。目前,已有多种昆虫基因被报道对杀虫剂的效果起到一定的调控作用,如重组的HaSNPV几丁质酶有望作为Bt杀虫剂的增效剂[4],昆虫的钠离子通道基因对杀虫剂抗性具有一定的影响机制[5],中华按蚊CYP6基因家族中的多个基因均对杀虫剂的抗药性起到一定的调控作用[6]等。
Wnt基因在1982年被Nusse和他的团队[7]首次报道,当时被命名为int-1基因,这个基因的非正常激活会诱发癌症。随后在果蝇中发现了与int-1同源的基因wingless基因(wg),它们被共同定义为“wnt”基因[8]。Wnt基因家族的成员在多个物种中被检测出来,从无脊椎的线虫至脊椎动物,在人中共发现了19个wnt家族的基因[9],在果蝇中发现了7个wnt家族的基因,蜂中发现了7个wnt家族的基因,蚊中发现了6个wnt家族的基因,在赤拟谷盗中发现了9个wnt家族的基因[10][11]。Wnt家族的基因编码一个大的分泌半胱氨酸-富集蛋白家族,在动物发育中作为细胞间信号分子发挥重要的作用。许多wnt蛋白由350至380个氨基酸组成,有100多个保守的残基分散在整个序列中。这些蛋白的起始处是一条疏水信号的序列,接着是一段可以被识别到的信号肽。每个蛋白都有一至多个N-糖基化位点以及多达24个半胱氨酸残基形成二硫键[12]。通过自分泌或旁分泌途径,wnt配体结合至各种跨膜受体上,驱动wnt信号传导途径,从而触发靶标基因在细胞间的调控转录。
Wnt信号通路通过wnt蛋白激活,涉及成年动物发育过程中的胚胎发育、细胞增殖和分化等。这一个过程需要“从头至尾”的调控,来确定神经嵴的正确分化,从而形成脑、心脏、肾脏以及性别分化等[13]。这个精确系统的破坏会导致发育障碍。果蝇和赤拟谷盗中的wnt家族基因都被报道出来了[14],这些在胚胎发育过程中的wnt基因现在也已有报道了[15],尤其是典型的wingless/wnt1基因的极性功能已多被报道[13]。然而,我们目前对wingless基因在美洲大蠊胚胎发育时期及后胚胎发育时期的作用功能知之甚少。我们想要了解wingless基因在美洲大蠊从幼虫发育至成虫期间的功能。既然有多个研究结果证实wingless基因涉及昆虫的胚胎发育、细胞增殖和分化等过程,那么wingless基因的这些功能能否应用在杀虫剂的制备中,制备出具有阻碍昆虫繁殖等功能的杀虫剂值得我们探索和研究。无论是寻找新基因,还是研究已知基因,或是开展基因功能的研究,又或者是使特定基因表达以期得到基因编码的蛋白质等方面的研究,获得目的基因的全长cDNA是前提条件和首要目标。
此外,在分子生物学研究中基因探针是必不可少的重要的工具。由于在系统进化上人和哺乳类遗传距离较近,其基因探针具有较大的通用性,所以医学发展起来的人基因探针为哺乳动物研究带来了许多方便。而无脊椎动物的分子生物学研究一向十分薄弱,因此可用于昆虫的基因探针来源困难,基因探针的选择和使用对昆虫分子生物学研究至为关键[16]。
参考文献:
[1]de Blay,F.,Sanchez,J.,Hedelin,G.,Perez-Infante,A.,Verot,A.,Chapman,M.and Pauli,G.1997.Dust and airborne exposure to allergens derived from cockroach(Blattella germanica)in low-cost public housing in Strasbourg(France).J Allergy Clin Immunol 99:107-112.
[2]孙俊,褚宏亮,杨维芳,张爱军,刘慧.2011.我国蟑螂抗药性现状与检测方法的研究.中华卫生杀虫药械,1:12-17.
[3]王福山,徐柏林.2002.蟑螂的生物信息防制.口岸卫生控制,7(1):19-21.
[4]王芳,顾奇伟,武家才,张传溪.2004.HaSNPV几丁质酶基因在大肠杆菌和昆虫细胞中的表达及其产物对Bt杀虫剂的增效作用.中国生物化学与分子生物学报,20(6):792-797.
[5]陈斌,鲜鹏杰,乔梁.2015.昆虫钠离子通道基因突变及其与杀虫剂抗性关系的研究进展.昆虫学报,58(10):1116-1125.
[6]唐尧.2014.中华按蚊CYP6基因家族的鉴定、特征及与抗药性相关的表达分析.重庆师范大学.
[7]Nusse,R.and Varmus,H.E.1982.Many tumors induced by the mouse mammary tumor virus contain a provirus integrated in the same region of the host genome.Cell 31:99-109.
[8]Rijsewijk,F.,Schuermann,M.,Wagenaar,E.,Parren,P.,Weigel,D.and Nusse,R.1987.The Drosophila homology of the mouse mammary oncogene int-1is identical to the segment polarity gene wg.Cell 50:649-657.
[9]Garriock,R.J.,Warkman,A.S.,Meadows,S.M.,D'Agostino,S.and Krieg,P.A.2007.Census of vertebrate Wnt genes:isolation and developmental expression of Xenopus Wnt2,Wnt3,Wnt9a,Wnt9b,Wnt10a,and Wnt16.Dev Dyn 236:1249-1258.
[10]Bolognesi,R.,Beermann,A.,Farzana,L.,Wittkopp,N.,Lutz,R.,Balavoine,G.,Brown,S.J.andR.2008a.Tribolium Wnts:evidence for a larger repertoire in insects with overlapping expression patterns that suggest multiple redundant functions in embryogenesis.Dev Genes Evol 218:193-202.
[11]Murat,S.,Hopfen,C.and McGregor,A.P.2010.The function and evolution of Wnt genes in arthropods.Arthropod Struct Dev 39:446-452.
[12]Cho,S.-J.,Valles,Y.,Giani,V.C.,Seaver,E.C.and Weisblat,D.A.2010.Evolutionary dynamics of the wnt gene family:a lophotrochozoan perspective.Mol Biol Evol 27:1645-1658.
[13]Agholme,F.and Aspenberg,P.2011.Wnt signaling and orthopedics,an overview.Acta Orthop 82:125-130.
[14]Murat,S.,Hopfen,C.and McGregor,A.P.2010.The function and evolution of Wnt genes in arthropods.Arthropod Struct Dev 39:446-452.
[15]Neumann,C.J.and Cohen,S.M.1997.Long-range action of Wg organizes the dorsal-ventral axis of the Drosophila wing.Development 124:871-880.
[16]王瑛,陈晓峰.1996.基因探针及其在昆虫学上的应用.中国生物工程杂志,16(3):28-32.
技术实现要素:
本发明的目的在于提供美洲大蠊wingless基因全长cDNA、其编码蛋白、所述美洲大蠊wingless基因全长cDNA的克隆方法及应用;
本发明的目的还在于提供一种美洲大蠊wingless基因的原位杂交探针。
为了实现上述目的,本发明的技术方案具体如下:
本发明提供了美洲大蠊wingless基因全长cDNA,命名为PaWg,该基因序列已递交GenBank数据库,登录号为KJ680328;所述的cDNA全长序列共1,456bp,其开放阅读框(ORF)包含1,194个碱基,编码397个氨基酸,其核苷酸序列如序列表中SEQ ID NO.1所示。该基因序列编码的蛋白质氨基酸序列如序列表中SEQ ID NO.2所示。该蛋白的理论等电点PI为9.46,分子量为4.4kD,是个稳定的亲水性蛋白。该蛋白的第1-21位氨基酸序列是一段信号肽,位点21与22之间存在一个酶切位点。同时该蛋白可能包含2个N-糖基化位点,分别在107和343位点的天冬酰胺上。
本发明提供了上述美洲大蠊wingless基因全长cDNA的克隆方法,包括如下步骤:
1)对从美洲大蠊样本中提取的总RNA进行反转录制备cDNA;
2)以步骤1)中获得的cDNA为模板,简并引物F1(如SEQ ID NO.3所示)和R1(如SEQ ID NO.4所示)为上游引物和下游引物,进行RT-PCR扩增;
优选地,其PCR反应条件如下:94℃3min;94℃30sec,60℃30sec,72℃1min,35cycles;72℃10min;4℃∞保存;
3)在对步骤2)中扩增所得的PCR产物进行回收、连接、转化,以及鉴定和测序;
4)将步骤1)中所获得的RNA作为模板,构建RACE cDNA文库;获得的产物为5'-RACE-Ready cDNA和3'-RACE-Ready cDNA,可分别作为5'-RACE和3'-RACE反应的模板;
5)根据步骤3)中所获得的基因序列设计3'RACE和5'RACE引物,分别以步骤4)中所获得的5'-RACE-Ready cDNA和3'-RACE-Ready cDNA为模板,并使用UPM引物,其核苷酸序列为:5’-AAGCAGTGGTATCAACGCAGAGT-3’,进行5'-RACE或3'-RACE巢式PCR扩增美洲大蠊wingless基因的全长序列;
所述的3'-RACE和5'-RACE引物的核苷酸序列分别为:
3’RACE-F1:(如SEQ ID NO.5所示);
3’RACE-F2:(如SEQ ID NO.6所示);
5’RACE-R1:(如SEQ ID NO.7所示);
5’RACE-R2:(如SEQ ID NO.8所示)。
优选地,第一轮PCR反应条件为:94℃30s,72℃3min,5个循环;94℃30s,68℃30s,72℃3min,5个循环;94℃30s,65℃30s,72℃3min,15个循环;72℃10min;4℃保存;优选地,第二轮PCR反应条件为:94℃3min;94℃30s,65℃30s,72℃2min,20个循环;72℃10min;4℃保存。
6)回收、连接和转化步骤5)中扩增所得的第一次巢式PCR的5’RACE和3’RACE的PCR产物;
7)将步骤3)中获得的wingless基因序列与步骤6)中获得的5’RACE基因序列进行拼接,根据拼接好的基因序列设计第二次巢式PCR的5'RACE引物,并以步骤4)中所获得的5'-RACE-Ready cDNA为模板,第二次巢式PCR扩增美洲大蠊wingless基因的全长序列;所述的第二次巢式PCR的5'-RACE引物的核苷酸序列分别为:
5’RACE-R3:(如SEQ ID NO.9所示);
5’RACE-R4:(如SEQ ID NO.10所示)。
第二次巢式PCR反应的第一轮PCR和第二轮PCR反应条件如上。
8)在对步骤7)中扩增所得的第二次巢式PCR的5’RACE的PCR产物进行回收、连接、转化,以及鉴定和测序;
9)将步骤3)中获得的wingless基因序列、步骤6)中获得的5’RACE和3’RACE基因序列与步骤8)中获得的5’RACE基因序列进行拼接,得到wingless基因全长序列,经BLAST比对验证其为美洲大蠊wingless(PaWg)基因全长cDNA序列。此序列已递交进入GenBank数据库,登录号为KJ680328。
我们利用基因体外转录技术制备出了美洲大蠊wingless基因的原位杂交探针,首先以美洲大蠊雄性成虫胸部组织cDNA样品为模板,制备含T7启动子的DNA模板;随后以含T7启动子的DNA为模板,使用体外转录试剂盒(Riboprobe in vitro Transcription Systems,Promega)制备wingless基因原位杂交的探针,同时,使用地高辛标记的UTP对NTP进行修饰;最后将标记探针应用在美洲大蠊胚胎的RNA干扰中,从而确认wingless基因在美洲大蠊胚胎发育过程中的功能作用。
本发明提供了该基因、蛋白以及其克隆方法在制备蟑螂杀虫剂以及生物探针方面的应用。
本发明的技术方案达到了如下的有益效果:
1)本发明获得了美洲大蠊wingless基因全长cDNA序列,并得出该基因及其编码蛋白质的功能,为美洲大蠊wingless基因相关研究与应用奠定了基础。
2)本发明使用SMART技术,构建美洲大蠊性腺组织和胸部组织的SMART RACE cDNA文库,为筛选和克隆美洲大蠊生殖发育相关基因及翅发育相关基因的全长cDNA奠定了基础。
3)我们利用基因体外转录技术制备出了美洲大蠊wingless基因的原位杂交探针,通过这个技术的广泛推广应用,可制备出其他多种昆虫的wingless基因探针,从而应用在增强天敌昆虫的翅发育功能作用上,增加天敌昆虫的飞行能力,增强其捕食害虫的能力。
附图说明
图1是美洲大蠊胸部总RNA的提取。M.DL 2000Marker;1.总RNA。
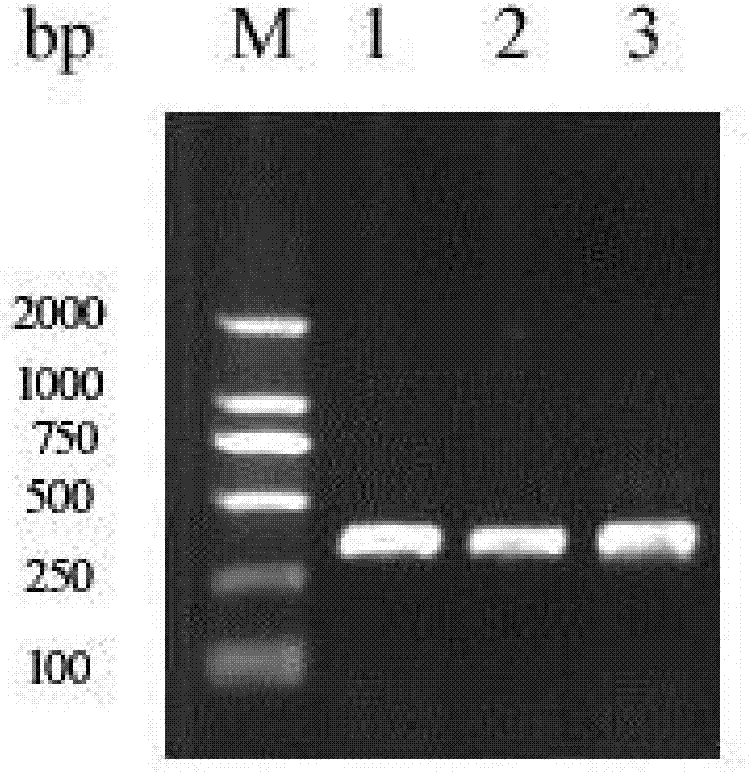
图2是wingless基因片段的扩增。M.DL 2000Marker;1-3.PCR产物(平行实验)。
图3是wingless基因3’RACE的扩增结果。M.DL2000Marker;1.3’RACE PCR产物。
图4是wingless基因5’RACE扩增结果。M.DL2000Marker;1.5’RACE第一次巢式PCR产物;2.5’RACE第二次巢式PCR产物。
图5是美洲大蠊PaWg基因的核苷酸序列和氨基酸序列。图中,推导的加尾信号用方框表示;星号指示终止密码子;信号肽序列用单下划线表示;预测的N-糖基化位点用双下划线表示。
图6是PaWg蛋白理化性质。
图7是PaWg蛋白疏水性分析结果。
图8是使用TMHMM工具对PaWg蛋白的跨膜区分析结果。
图9是PaWg蛋白信号肽分析。
图10是PaWg蛋白的N-糖基化位点分析。
图11是PaWg蛋白的O-糖基化位点分析。
图12是PaWg蛋白质的二级结构预测结果。
图13是含T7启动子的DNA模板。M.DL2000Marker,1.Wg(T7)-F2和Wg-R2为上、下游引物扩增出的PCR产物,2.Wg-F1和Wg(T7)-R1为上、下游引物扩增出的PCR产物。
图14是wingless基因的dsRNA。M.DL2000Marker,1.dsRNA。
图15是RT-PCR分析wingless基因的表达。(A)wingless基因在4个生长发育时期的mRNA水平:1.卵,2.早期幼虫,3.晚期幼虫,4.成虫;(B)RNAi敲除wingless基因:Congtrol.未进行注射的野生型,GFP.使用GFP的dsRNA进行注射,RNAi.使用wingless的dsRNA进行注射。
图16是RANi干扰前后美洲大蠊前后翅表型的改变。图中,S1.野生型美洲大蠊幼虫发育而成的翅,S2.六龄期幼虫受干扰后发育成的前翅,S3.六龄期幼虫受干扰后发育成的后翅,S4.七龄期幼虫受干扰后发育成的前翅,S5.七龄期幼虫受干扰后发育成的后翅,S6.八龄期幼虫受干扰后发育成的前翅,S7.八龄期幼虫受干扰后发育成的后翅,S8.九龄期幼虫受干扰后发育成的前翅,S9.九龄期幼虫受干扰后发育成的后翅。
图17是wingless基因探针。M.DL2000Marker,1.探针。
图18是美洲大蠊胚胎原位杂交。S10.早期胚胎的头部、胸部第一体节和第二体节的背面,S11.晚期胚胎的胸部第一体节、第二体节和第三体节的背面,S12.早期胚胎,S13.晚期胚胎中的触角,S14.晚期胚胎中的下唇须,S15.晚期胚胎中的中足和后足,S16.晚期胚胎中的中足腿,S17.晚期胚胎中的后足。
具体实施方式
为了阐明本发明的技术方案及技术目的,下面结合附图及具体实施方式对本发明做进一步的介绍。
实施例1:
本实施例1中,对美洲大蠊的wingless基因全长进行了克隆。其具体步骤如下:
1.1提取组织样品的总RNA:
提取美洲大蠊卵荚、早期幼虫、晚期幼虫和雄性成虫胸部组织样品的总RNA,其总RNA的提取按照RNeasy Mini Kit(Qiagen公司)说明书于生物安全柜上操作;然后,将提取的总RNA溶于无RNA酶的水中,经琼脂糖凝胶电泳检测完整性和核酸与蛋白质定量检测仪测定纯度与浓度后,保存于-70℃冰箱备用。
其电泳检测结果如图1所示:从电泳图片中可以看出,两条明显的条带分别为28s,18s,说明提取的RNA完整,无降解,可以用于RT-PCR的扩增。
1.2制备组织样品cDNA:
取步骤1.1中所获得的美洲大蠊卵荚、早期幼虫、晚期幼虫和雄性成虫胸部组织样品的总RNA样品,使用反转录试剂盒Super SMARTTM PCR cDNA Synthesis Kit,按试剂盒说明书进行反转录制备cDNA。cDNA样品经琼脂糖凝胶电泳检测完整性和核酸与蛋白质定量检测仪测定纯度后,保存于-20℃冰箱备用。
1.3美洲大蠊wingless基因编码区部分片段的克隆:
1.3.1设计采用PCR方法扩增美洲大蠊wingless基因片段的引物:
从NCBI上下载多条与美洲大蠊较为近缘的物种的wingless基因序列,经过序列比对之后,选取wingless基因保守区域,用Primer 5.0软件设计简并引物Sense primer(F1):5’-AAGGATCGCTTCGACGGCGCGTC-3’(SEQ ID NO.3)和Antisense primer(R1):5’-CCGCAACACATsAGrTCrCAnCC-3’(SEQ ID NO.4),在美洲大蠊中采用PCR方法扩增wingless基因片段。
1.3.2 RT-PCR扩增:
以步骤1.2中所获得的美洲大蠊雄性成虫胸部组织cDNA样品为模板,简并引物F1和R1分别为上游引物(Forward Primer)和下游引物(Reverse Primer),按照r-Taq DNA聚合酶(TaKaRa)说明书的方法进行RT-PCR扩增,并根据引物调整PCR的退火温度和循环次数如下:
配制总量为25μl的PCR反应液,包括:1μl模板cDNA、2μl dNTP Maxture(2.5μm)、 0.5μl Forward Primer(10μm)、0.5μl Reverse Primer(10μm)、2.5μl 10×Ex Taq Buffer(Mg2+Free)、2μl MgCl2(25mM)、0.2μl TaKaRa Ex Taq(5U/μl)和16.3μlddH2O。
PCR反应条件如下:94℃3min;94℃30sec,60℃30sec,72℃1min,35cycles;72℃10min;4℃∞保存。
1.3.3目的片段(PCR产物)的回收与连接:
使用GenClean柱式琼脂糖凝胶DNA回收试剂盒纯化PCR产物,将回收的DNA与pMDl9-T载体连接,16℃反应过夜;5倍稀释样品后,进行连接反应。
1.3.4转化:
取10μl连接产物加入到100μl大肠杆菌感受态细胞DH5α中,轻轻混匀后冰浴30min;42℃热激45秒,冰中放置2min;随后,加入SOC培养基800μl,37℃、250转摇床培养1h;取摇床培养后的SOC培养液100μl均匀涂布于Amp+的LB平板上;在37℃恒温培养箱中正置平板30min,然后倒置培养过夜;置平板于4℃中进行蓝白斑筛选。
1.3.5鉴定与测序:
a)挑克隆:
用灭菌的10μl枪头在超净台中挑取单克隆至LB Amp+液体培养基中,37℃、250转摇床培养4-6小时。
b)菌落PCR:
取0.5μl细菌培养液作为PCR反应的模板,使用通用M13-F和M13-R引物,进行PCR扩增。其中,PCR反应液总量为15μl,包括:1.5μl 10×PCR Buffer、1.2μl Mg2+、1.5μl dNTP Mix、0.15μl M13-F、0.15μl M13-R、0.15μl r-Taq、0.5μl菌液和9.85μl灭菌水。其PCR反应程序为:94℃3min;94℃30sec,55℃30sec,72℃30sec,30个循环;72℃8min。反应结束后,用1%琼脂糖凝胶电泳对PCR产物进行检测,随后进行测序,其中得到一段290bp长的序列(如图2所示),经NCBI的Blast程序(Altschul,S.F.,Madden,T.L.,A.A.,Zhang,J.,Zhang,Z.,Miller,W.and Lipman,D.J.1997.Gapped BLAST and PSI-BLAST:a new generation of protein database search programs.Nucleic Acids Res 25:3389-3402)进行同源性比对分析后证实该片段为wingless基因序列,为我们所需要的目的片段。
1.4. RACE cDNA文库的构建:
将步骤1.1中所获得的RNA作为模板,使用试剂盒SMARTTM RACE cDNA Amplification Kit构建RACE cDNA文库,操作步骤按试剂盒的说明书进行。获得的产物为5'-RACE-Ready cDNA和3'-RACE-Ready cDNA,可分别作为5'-RACE和3'-RACE反应的模板。
1.5. RACE法扩增wingless基因全长:
根据步骤1.3中所获得的290bp长的wingless基因序列设计3'RACE和5'RACE引物,扩增美洲大蠊wingless基因的全长序列。所述的3'-RACE和5'-RACE引物的核苷酸序列如下:
3’RACE-F1:5’-GAGCCTTCCCCAGGGTTCTGCGAGC-3’;(SEQ ID NO.5)
3’RACE-F2:5’-GACTCGGTATCCAAGGCACGCACGG-3’;(SEQ ID NO.6)
5’RACE-R1:5’-CCCTGGGGAAGGCTCCAAGTAGACC-3’;(SEQ ID NO.7)
5’RACE-R2:5’-TTCTTCTTACCACCGACGCCGCTGC-3’。(SEQ ID NO.8)
用SMARTerTM RACE cDNA Amplification Kit试剂盒(Clontech),分别以步骤1.4中所获得的5'-RACE-Ready cDNA或3'-RACE-Ready cDNA为模板,以基因特异性引物和UPM引物(5’-AAGCAGTGGTATCAACGCAGAGT-3’)进行5'-RACE或3'-RACE巢式PCR扩增反应。
其中,第一轮PCR反应液体系为:5.0μl 10×Advantage 2PCR buffer、1.0μl 50×dNTP Mix(2.5mmol/L)、5.0μl 10×UPM(10μmol/L)、1.0μl 5'RACE-R1/3'RACE-F1(10μmol/L)、2.5μl RACE-Ready cDNA、1.0μl 50×Advantage 2polymerase Mix和34.5μl PCR-Grade water。其PCR反应条件为:94℃30s,72℃3min,5个循环;94℃30s,68℃30s,72℃3min,5个循环;94℃30s,65℃30s,72℃3min,15个循环;72℃10min;4℃保存。
随后,将第一轮PCR产物5μl加入245μl的水中稀释,作为第二轮PCR反应的模板。第二轮PCR反应液体系为:5.0μl 10×Advantage 2PCR buffer、1.0μl 50×dNTP Mix(2.5mmol/L)、1.0μl 10×NUP(10μmol/L)、1.0μl 5'RACE-R2/3'RACE-F2(10μmol/L)、5.0μl RACE-Ready cDNA、1.0μl 50×Advantage 2polymerase Mix和36.0μl PCR-Grade water。其PCR反应条件为:94℃3min;94℃30s,65℃30s,72℃2min,20个循环;72℃10min;4℃保存。
再次,电泳检测PCR结果,并且对获得的PCR产物进行克隆、测序:
将测出的序列用DNAStar软件的Seqman程序查找目的序列,然后将5’RACE及3’RACE获得的序列和步骤1.3中获得的wingless基因序列进行拼接,由于5’RACE第一次巢式PCR的产物较短,因此根据该5’RACE获得的序列,设计了5’RACE第二次巢式PCR的引物(5’RACE-R3:5’-TTCTTGACGCATCTCCGAGGAAACG-3’(SEQ ID NO.9)和5’RACE-R4:5’-GGAGAACTTGAAGCCGTAGCCGATG-3’(SEQ ID NO.10)),按上述方法,进行第二次巢式PCR扩增。其PCR电泳结果如图3和图4所示。
经过第一次巢式PCR获得了一条230bp长的特异条带(见图3),条带经切胶回收、克隆测序以及同源性比对,证实该230bp的片段为wingless基因的3’端序列;
经过第一次巢式PCR获得了一条280bp长的特异条带(见图4),条带经切胶回收、克隆测序以及同源性比对,证实该280bp的片段为wingless基因的5’端序列。将第一次巢式PCR获得的5’端序列与wingless基因中间序列进行拼接,获得了一条450bp长的序列,根据这450bp长的序列,设计5’端第二次巢式PCR的引物(5’RACE-R3和5’RACE-R4),经过第二次巢式PCR得到一条800bp长的特异条带(见图4),条带经切胶回收、克隆测序以及同源性比对,证实该800bp的片段为wingless基因的5’端序列。最后将这两次巢式PCR获得的序列进行拼接,最终得到wingless基因的5’端序列为1,020bp。
最后,将5’端序列、3’端序列和步骤1.3中所获得的wingless基因序列进行序列拼接,得到一条长为1,456bp的wingless基因全长序列,经BLAST比对验证其为美洲大蠊wingless(PaWg)基因全长cDNA序列。此序列已递交进入GenBank数据库,登录号为KJ680328。
实施例2:
本实施例2中,对实施例1中所获得的美洲大蠊wingless(PaWg)基因全长cDNA序列进行了序列分析。
用NCBI的BLAST程序将PaWg基因全长cDNA序列进行全长完整性验证。使用ORF Finder(www.ncbi.nlm.nih.gov/gorf/)对PaWg cDNA的开放阅读框(open reading frame,ORF)进行查找及相应的氨基酸序列翻译。
该基因序列全长1,456bp,预测该序列的开放阅读框包含1,194个碱基,编码397个氨基酸,5’UTR的长度为157bp,3’UTR的长度为105bp。翻译的起始密码子为ATG,终止密码子为TGA(位于1349-1351位),其后有加尾信号AATAAA(图5)。将推导的氨基酸序列进行Blastx同源性比对分析后发现,本实验得到的PaWg基因与其他物种的wingless基因在氨基酸水平分享68-76%的同源性(表1),其中PaWg基因与致倦库蚊(Culex quinquefasciatus)、地中海果实蝇(Ceratitis capitata)、欧洲熊蜂(Bombus terrestris)、佛罗里达弓背蚁(Camponotus floridanus)、黑脉金斑蝶(Danaus plexippus)、家蚕(Bombyx mori)和豌豆蚜虫(Acyrthosiphon pisum)的wingless基因的同源性达76%。
表1 PaWg基因的BLAST同源性检索结果:
(接上页表1)
实施例3:
本实施例3中,分析了PaWg蛋白质的基本性质:
3.1 PaWg蛋白质理化性质分析:
采用ProtParam工具(http://us.expasy.org/tools/protparam.html)在线工具进行PaWg 蛋白的理化性质分析(Gasteiger,E.,Hoogland,C.,Gattiker,A.,Wilkins,M.R.,Appel,R.D.and Bairoch,A.2005.Protein identification and analysis tools on the ExPASy server.Methods Mol Biol 112:531-552),使用Compute pI/Mw在线工具(http://www.expasy.org/tools/pi_tool.html)进行分子量与等电点的预测,依次给出了PaWg蛋白的氨基酸数(Number of amino acids)、分子量(Molecular weight)、理论等电点(Theoretical pI)、氨基酸组分(Amino acid composition)、正/负电荷残基总数(Total number of positively/negatively charged residues)、原子总数(Total number of atoms)、原子组成(Atomic composition)、分子式(Formula)、不稳定指数(Instability index)、脂肪指数(Aliphatic index)、消光系数(Extinction coefficients)、估计的半衰期(Estimated half-life)、总平均亲水性(Grand average of hydropathicity,GRAVY)。
ProtParam预测PaWg蛋白理化性质结果如图6。结果显示:该蛋白的理论等电点PI为9.46,分子量为4.4kD。原子总计包括6,078个原子,分子式为C1891H3010N592O551S34;在组成PaWg蛋白的20种氨基酸中,甘氨酸(Gly)所占的比例最高,达到10.6%,色氨酸(Trp)和酪氨酸(Tyr)所占的比例最低,均为2.0%;脂肪指数为65.09;PaWg蛋白的不稳定指数为39.37,根据GRP(Guruprasad-Reedy-Pandit)方法(Guruprasad,K.,Reddy,B.B.and Pandit,M.W.1990.Correlation between stability of a protein and its dipeptide composition:a novel approach for predicting in vivo stability of a protein from its primary sequence.Protein Eng 4:155-161),推测PaWg蛋白稳定。
3.2 PaWg蛋白质疏水性分析:
使用ProtScale在线程序(http://us.expasy.org/cgi-bin/protscale.pl)进行疏水性分析(Gasteiger,E.,Hoogland,C.,Gattiker,A.,Wilkins,M.R.,Appel,R.D.and Bairoch,A.2005.Protein identification and analysis tools on the ExPASy server.Methods Mol Biol 112:531-552)。分析得到值使用的是Kyte-Doolittle法(坎贝尔(Campbell A.M.),海尔(Heyer L.J.)著,孙之荣(主译).2007.探索基因组学、蛋白质组学和生物信息学.北京:科学出版社)来判断氨该基酸是亲水性或疏水性氨基酸(见图7)。其中,氨基酸的疏水性用高正值表示,氨基酸的亲水性用低负值表示。
图7所示为PaWg蛋白的疏水性分析结果。表明PaWg蛋白属于亲水性蛋白。推测PaWg氨基酸在位点9-18之间和位点86处含疏水性区域。
3.3 PaWg蛋白质跨膜区分析:
使用在线TMHMM Server v.2.0在线工具(http://www.cbs.dtu.dk/services/TMHMM/)进行跨膜区的预测,结果如图8所示,表明PaWg蛋白不含有跨膜区。
3.4 PaWg蛋白质信号肽分析:
使用在线SignalP 4.1Server工具(www.cbs.dtu.dk/services/SignalP)进行信号肽的预测分析(Bendtsen,J.,Nielsen,H.,von Heijne,G.and Brunak,S.2004.Improved prediction of signal peptides:SignalP 3.0.J Mol Biol 340:783-795)。
其分析结果如图9所示:PaWg蛋白的信号肽预测结果表明,第1-21位氨基酸序列是一段信号肽,21与22之间存在一个酶切位点。
3.5 PaWg蛋白质N-糖基化位点及O-糖基化位点分析:
使用在线软件NetNGlyc 1.0Server和在线DictyOGlyc 1.1server工具(http://www.cbs.dtu.dk/services/DictyOGlyc/)对美洲大蠊的PaWg蛋白的N-糖基化位点和O-糖基化位点进行了预测。
N-糖基化位点预测结果如图10。从结果我们可以看出,该蛋白可能包含两个N-糖基化位点,分别在107和343位点的天冬酰胺上。O-糖基化位点预测结果如图11,结果表明,该蛋白不包含O-糖基化位点。
3.6 PaWg蛋白质的二级结构预测:
使用PORTER服务器(http://distill.ucd.ie/porter/)进行二级结构的预测(Pollastri,G.and Mclysaght,A.2005.Porter:a new,accurate server for protein secondary structure prediction.Bioinformatics 21:1719-1720)。
结果如图12所示,上一行为PaWg氨基酸序列,下一行为与之对应的二级结构,其中C表示coil(无规则卷曲),H表示helix(α螺旋),E表示extended(β-折叠),预测结果表明PaWg蛋白的二级结构组分中,α螺旋(H)占33.75%<45%,β-折叠(E)占10.33%>5%,因此PaWg不属于全α型蛋白。
实施例4:
本实施例4中,使用RNA干扰(RNAi)对实施例1中所获得的美洲大蠊wingless基因进行了功能测定。
4.1含T7启动子的DNA模板的制备:
其具体步骤如下:
1)以美洲大蠊雄性成虫胸部组织cDNA样品为模板,使用wg-F1(CGACAACATCGGCTACGGCT)和wg(T7)-R1(TAATACGACTCACTATAGGGCCTCTGCACCACGGACACCT)作为第一对上、下游引物,以wg(T7)-F2(TAATACGACTCACTATAGGGCGACAACATCGGCTACGGCT)和wg-R2(CCTCTGCACCACGGACACCT)作为第二对上、下游引物,分别进行反转录PCR扩增,制备单链上含T7启动子(TAATACGACTCACTATAGG)的DNA模板,方法详见实施例1.2。
2)目的片段的回收与连接:详见实施例1.3.3;
3)转化:方法详见实施例1.3.4;
4)鉴定与测序:方法实施例1.3.5。
结果如图13所示。结果表明,以美洲大蠊雄性成虫胸部组织cDNA样品为模板,使用这两对引物分别可以扩增出两条550bp左右长度的含T7启动子的DNA模板,但是引物二聚体较多。随后将PCR产物进行切胶、纯化、克隆,得到单一的PCR产物,送去上海生工公司进行测序,序列片段经过Blast比对之后,确认为wingless基因。
4.2美洲大蠊wingless基因dsRNA的制备:
分别以4.1中获得的两条含T7启动子的单链DNA为模板,按T7RiboMAXTM Express RNAi System试剂盒的说明书进行操作,制备美洲大蠊wingless基因的dsRNA。
结果如图14所示。结果表明,美洲大蠊wingless基因的dsRNA的片段大小与4.1中扩增出的DNA模板大小一致,约为550bp。经检测该dsRNA的浓度为6,354ng/μl,OD260/280=2.05。
4.3注射wingless基因的dsRNA进行RNA干扰:
首先取美洲大蠊卵荚、早期幼虫、晚期幼虫和成虫胸部组织的cDNA样品(方法见实施例1中1.2),分别使用wingless基因和内参基因β-actin的荧光定量PCR反应特异引物(F:TTACCACCACTGCCGAACGA,R:CCTCTGGACAACGGAACCTC),按照实时定量试剂盒(PrimeScript RT Reagent Kit,TaKaRa)的说明书进行qRT-PCR,来检测wingless基因在美洲大蠊各发育阶段的表达情况,具体操作步骤方法如下:
1、qRT-PCR反应标准曲线分析。制备梯度稀释的cDNA模板,按10倍梯度列稀释。操作方法按实时定量试剂盒(PrimeScript RT Reagent Kit,TaKaRa)重复三次进行,结束后电泳检测PCR产物的特异性。随后作标准曲线图:横坐标是模板拷贝数的对数,纵坐标是各浓度的Ct值。
2、根据标曲,以β-actin基因作内参基因,进行wingless基因的qRT-PCR反应,反应体系与标曲的反应体系一致。反应程序也与标曲的反应程序一致,反应重复三次。反应结束后采用比较Ct值的方法RATE=2-ΔΔCT(Livak,K.J.and Schmittgen,T.D.2001.Analysis of Relative Gene Expression Data Using Real-Time Quantitative PCR and the 2-ΔΔCTMethod.Methods 25:402-408)来分析wingless基因的表达水平。Ct值取三次重复反应的平均值。使用SPSS 17.0对表达数据进行统计分析,其中P值小于0.05被认为表达差异明显。
取美洲大蠊6-9龄期幼虫各5只及10只未受精的雌性成虫,使用美国Hamilton注射进样针(配33号针头),在美洲大蠊幼虫及成虫第一对翅原基的部位(身体一侧),注射3μl(3μg/μl) 的wingless基因的dsRNA,3小时之后,在美洲大蠊个体的身体另一侧,注射同样剂量的dsRNA,进行wingless基因的RNA干扰。经过RNA干扰后的个体,同样进行qRT-PCR实验来检测wingless基因的表达情况。随后将美洲大蠊幼虫个体分别置于玻璃瓶中养殖,将美洲大蠊雌性个体与正常的雄性成虫一一配对,单独置于玻璃瓶中养殖,定期更换食物和水。待美洲大蠊幼虫发育为成虫时,观察其翅膀的发育情况。待美洲大蠊干扰后的雌性成虫与正常雄性成虫交配产出卵荚之后,观察被干扰后的胚胎发育情况,同时观察由干扰卵荚产出的幼虫翅原基的发育情况。
为了排除非特异性影响的可能性,我们另外使用了水母绿荧光蛋白(Green Fluorescent Protein,GFP)的一段长为720bp的序列(Chesebro,J.,Hrycaj,S.,Mahfooz,N.and,A.2009.Diverging functions of Scr between embryonic and post-embryonic development in a hemimetabolous insect,Oncopeltus fasciatus.Dev Biol 329:142-151.),对美洲大蠊的幼虫及成虫进行注射,以作为wingless基因注射的对照组(Hrycaj,S.,Chesebro,J.andA.2010.Functional analysis of Scr during embryonic and post-embryonic development in the cockroach,Periplaneta americana.Dev Biol 341:324-334.)。GFP蛋白的注射方法及注射部位与wingless基因完全一致。
结果如图15所示,我们发现内参基因β-actin在美洲大蠊各个发育阶段均有等量的表达,而wingless基因虽然在美洲大蠊各个发育阶段中都能检测出来,但是由图15(A)可知,wingless基因在卵荚、早期幼虫和晚期幼虫中具有较高的表达量,而在成虫中wingless基因的表达量降低。在GFP蛋白对照组中,经GFP基因注射的美洲大蠊幼体发育为成虫之后,其翅膀的表型与野生型一致,没有发生特异性的表型改变。待GFP基因的dsRNA和wingless基因的dsRNA注射美洲大蠊10天后,我们再次提取各注射虫体的RNA,反转录之后进行RT-PCR验证wingless基因的表达情况,RT-PCR的产物经电泳检测,结果如图15(B)所示。我们发现未进行注射的野生型美洲大蠊体内wingless基因正常表达,经过GFP基因的dsRNA注射后的美洲大蠊也能正常表达wingless基因,且经过GFP-dsRNA注射后的美洲大蠊,其体内的wingless基因的表达量与野生型中的相等。然而,经过wingless基因的dsRNA注射后的美洲大蠊,其体内的wingless基因无表达。此结果说明,经过wg-dsRNA注射之后的美洲大蠊,其体内的wingless基因被干扰从而无法正常表达,表明注射后的美洲大蠊体内wingless基因被成功敲除。
被wingless基因干扰后的各龄期幼虫,发育至成虫后,其翅均有明显的表型改变,结果如图16所示。野生型美洲大蠊的翅呈长椭圆状,翅面较平整、翅脉清晰、翅边缘完整(图16,S1)。而幼虫被干扰后发育出的翅,都有缺失或是弯曲折叠现象。我们在各龄期中选取较有代表性的表型改变现象作分析。六龄期幼虫被干扰后发育出的翅,缺陷最为明显,两侧前翅均有缺失、断裂。一侧前翅的翅尾弯曲、折叠,另一侧前翅发育不完全,长度明显小于野生型翅(图16,S2);而两侧后翅的表型变化更为明显,明显后翅发育不完全、存在翅尾断裂、弯曲折叠、翅脉不清晰的表型改变(图16,S3)。七龄期幼虫被干扰后发育出的翅,两侧前翅发育较为完全,无缺失的现象,但是翅脉纹路不清晰,有多余的纹路出现,且翅尾有弯曲折叠现象(图16,S4);但是两侧后翅与六龄期幼虫一样,明显发育不完全,小于野生型的翅,同时也出现了翅边缘不完整、断裂、弯曲折叠的表型改变,但是表型改变的现象较好与六龄期幼虫(图16,S5)。八龄期幼虫被干扰后发育出的翅,前翅发育不完全,一侧发育出较小的前翅,且翅面不平整、翅脉纹路不清晰、有多余纹路出现,翅尾断裂、有弯曲折叠的表型改变(图16,S6);后翅发育的较为完整,无明显的翅发育较小的现象,同时相比较于六龄期和七龄期的幼虫,八龄期幼虫后翅翅尾断裂现象减少,但是翅脉纹路仍然不清晰(图16,S7)。九龄幼虫,是我们实验室养殖中的末龄期幼虫,是幼虫发育为成虫最关键的一个龄期。九龄幼虫被干扰后发育的翅,其表型改变的情况明显好转于其他各龄期的幼虫。前翅发育完全,翅脉纹路清晰,翅面平整,翅边缘较为完整,仅有部分翅尾断裂的现象(图16,S8);而后翅也能够发育得较为完整,翅脉较为清晰,仅翅尾有部分断裂不完整的表型改变(图16,S9)。
同时我们发现受到wg-dsRNA干扰后的雌虫,大多不能产卵。即使有少量的卵荚产出,但干扰型产出的卵荚长度普遍短于野生型雌虫产出的卵荚长度,卵荚内卵的数量也少于野生型卵荚内卵的数量。同时,受干扰后的雌虫产出的卵荚不能正常孵化出一龄幼虫。
我们的研究结果表明wingless基因在美洲大蠊各龄期幼虫的翅发育过程中都起着至关重要的作用。Wingless基因不仅决定着美洲大蠊翅发育过程中有无翅的形成,同时在翅形状、翅脉纹路、翅的平整性等多个翅发育功能方面也起着关键性的作用。Wingless基因对龄期小的幼虫的干扰作用更大。Wingless基因对每一龄期幼虫进行干扰之后,其后翅的表型改变都比前翅表型的改变更为明显。因此我们推测wingless基因对后翅发育的影响作用要大于对前翅发育的影响。Wingless基因的缺失,将会直接导致美洲大蠊前翅和后翅发育不完全,以及翅表型的改变。
另外,由于注射wg-dsRNA之后的美洲大蠊雌性成虫的卵子受到干扰,无法与野生型雄性的精子结合形成受精卵,因此我们推测wingless基因在美洲大蠊的受精卵形成过程中也起到一定的作用。同时受干扰后的美洲大蠊卵荚的低孵化率,也表明wingless基因在美洲大蠊的胚胎发育早期阶段起作用,导致早期胚胎的死亡。
基于以上结论可以得出,该美洲大蠊wingless基因全长cDNA序列可以用于杀虫剂的制备,以防治农业害虫和城市卫生害虫。通过制备含有wingless蛋白缺失的杀虫剂,喷洒城市卫生害虫蟑螂时,杀虫剂与蟑螂表皮或附器接触后渗入虫体,通过RNA干扰的作用,在蟑螂体内发挥功效,抑制蟑螂的翅膀发育,以及生殖功能的发育,导致蟑螂无法飞行,降低蟑螂的行动能力;同时抑制雌性蟑螂的生殖能力,使雌性蟑螂无法繁殖后代,降低蟑螂的繁殖能力。
4.4美洲大蠊wingless基因体外转录:
以美洲大蠊wingless基因的含T7启动子的DNA为模板,使用体外转录试剂盒(Riboprobe in vitro Transcription Systems,Promega)制备该基因原位杂交的探针,其具体方法见该试剂盒操作说明;随后将标记探针应用在RNA干扰中。同时,使用地高辛标记UTP对NTP进行修饰。
美洲大蠊wingless基因探针制备的结果如图17所示。结果表明,该片段长度与DNA模板长度一致,约为550bp。探针经过紫外分光光度计进行定量,经检测探针浓度为1,229ng/μl,OD260/280=2.06,检测结果表明该探针的质量较好,可用于后续原位杂交实验。
4.5美洲大蠊胚胎的原位杂交:
收集各个发育时期的美洲大蠊卵荚,提取出卵荚中的胚胎,使用甲醇、PBST溶液、50μg/ml蛋白酶K溶液、甲醛、杂交液、用地高辛标记的RNA探针、显色试剂盒(Promega)等进行美洲大蠊胚胎的原位杂交实验,最后用80%甘油浸泡胚胎,显微镜观察,-20℃保存。
其具体步骤如下:
1)收集各个发育时期的美洲大蠊卵荚,在操镜台中使用干净、灭菌的剪刀和镊子,小心的提取出卵荚中的胚胎,置于Embryo Wash Solution中进行清洗。
2)另准备一个小瓶,加入5ml 3.7%甲醛和5ml正庚烷,甲醛和正庚烷不相互溶解并分层,上层是正庚烷;
3)转移已脱壳的美洲大蠊胚胎进入瓶中,美洲大蠊胚胎会位于两层液相之间;
4)间或剧烈震荡15~20min;
5)吸去下层液相,但不要吸去两层液相之间的美洲大蠊胚胎;
6)加入等体积的甲醇,剧烈震荡2min;使卵膜破裂;
7)静置1min,吸去上层液相及两层液相之间的胚胎;
8)加甲醇洗胚胎三次,每次5min;
9)-20℃保存,或继续以下实验;
以下的步骤须避免Rnase污染:
10)用PBST洗胚胎三次,每次5min;
11)用50μg/ml蛋白酶K对胚胎进行处理,8-15min;
12)用PBST洗胚胎四次,每次3min;
13)用10%甲醛/PBST混合处理胚胎1-2h,震荡;
14)用PBST洗胚胎五次,每次5min;
15)用杂交液等体积混合PBST,洗胚胎一次,10min;
16)用杂交液洗胚胎一次,10min;
17)用新鲜的杂交液进行预杂交,48℃水浴1-2h;
18)在新的EP管中加入新鲜杂交液200μl,加用地高辛标记的RNA探针,探针的终浓度为2ng/μl,沸水浴杂交液5min,冰浴2min;
19)吸去预杂交用的杂交液,加入含探针的杂交液,水浴48℃至少24-48h;
20)用48℃新鲜杂交液浸泡12-36h;
21)用新鲜预热杂交液洗胚胎3次,每次20min;
22)用杂交液等体积混合PBST,洗胚胎一次,10min;
23)用PBST洗胚胎四次,每次10min;
24)步骤21、步骤22、步骤23在48℃水浴中进行;
25)在PBST中稀释抗地高辛抗体,抗体室温下孵育胚胎2h以上;
26)用PBST洗胚胎四次,每次10min;
27)用AP Buffer洗胚胎三次,每次3min;
28)用显色试剂盒进行显色;
29)用PBST洗胚胎三次,每次3min;
30)分别用25%、50%、75%、90%的乙醇和无水乙醇各洗胚胎一次;
31)用二甲苯与无水乙醇等体积混合处理胚胎一次,1h;
32)用无水乙醇洗胚胎若干次,洗去二甲苯;
33)用80%甘油浸泡胚胎,显微镜观察,-20℃保存。
结果如图18所示。结果表明,在美洲大蠊胚胎发育的早期阶段,wingless基因在美洲大蠊的唇基部、触角基部、胸部和腿基部都有表达,而到了胚胎发育的晚期阶段,wingless基因的表达开始后移,在唇末梢、触角中部、胸部、腿节及腹部都有表达,其中腹部的表达更为明显:
1)wingless基因在胸部的发育:由图18,S10可以看出,在美洲大蠊胚胎发育的早期阶段,wingless基因首先在胸部第一体节中开始进行表达,在胸部第二体节和第三体节中均无表达,表明wingless基因在胸部的表达是从第一体节逐渐开始的。而在美洲大蠊胚胎发育的完期阶段(图18,S11),wingless基因的表达从第一体节延伸到了第二体节和第三体节中。
2)wingless基因在头部的发育:我们对wingless基因在美洲大蠊胚胎中头部的不同发育时期也做了比较。我们发现在早期胚胎中,wingless基因在触角的基部有表达,结果如图18,S12所示。而在晚期胚胎的发育中,我们发现wingless基因在触角中的表达向触角中部迁移,结果如图18,S13所示。
另外,我们发现在美洲大蠊胚胎发育的早期,wingless基因在下唇须的基部有表达,结果如图S12所示;而在胚胎发育的晚期,wingless基因在下唇须中的表达则是向下唇须的末梢部迁移,尤其是在下唇须的末梢部位,wingless基因的表达尤为强烈,结果如图18,S14所示。
3)wingless基因在腿部的发育:我们在美洲大蠊胚胎发育的早期阶段发现,wingless仅在前足的基部有一定的表达,在中足和后足的基部均未发现有wingless的表达,结果如图18,S12所示。在美洲大蠊胚胎发育的晚期阶段,我们发现wingless基因在前足、中足和后足中均有表达,且在各足的关节处表达尤为强烈,结果如图18,S15、S16和S17所示。S16表明wingless在中足的关节处表达量增加,而图S17表明wingless在后足的关节处有强烈的表达。
实验结果标明,在美洲大蠊胚胎发育过程中,wingless基因在美洲大蠊的胸部、头部和腿部均有明显的功能作用。在胸部发育过程中,wingless基因主要作用于胸部体节外侧,引起美洲大蠊的翅发育的分阶段进行,首先是前翅翅原基在早期胚胎中进行发育,接着是后翅翅原基在中后期胚胎发育中进行。在头部发育过程中,wingless基因对美洲大蠊触角发育、下唇须的延伸、以及足关节的形成和足关节的延伸都起着一定的调控作用。wingless基因调控了美洲大蠊整个胚胎发育时期。
基于以上结论可以得出,该美洲大蠊wingless基因全长cDNA序列可以用于生物探针的制备:70年代以来,我国已成功地大量饲养赤眼蜂、平腹小蜂、草蛉、七星瓢虫、丽蚜小蜂、食蚜瘿蚊、小花蝽、智利小植绥螨、西方盲走螨、侧沟茧蜂等捕食或寄生性天敌昆虫。通过wingless基因在昆虫蟑螂体内的研究基础,可以为研究其他捕食或寄生性天敌昆虫的wingless基因奠定重要的基础。从而通过制备捕食或寄生性天敌昆虫的wingless基因探针,在人工繁殖天敌昆虫时,利用wingless基因探针,使这类天敌昆虫的wingless基因充分发挥作用,增加天敌昆虫的翅发育功能,增强它们的飞行能力,从而能够更有效的发挥它们的天敌作用。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,本发明要求保护范围由所附的权利要求书、说明书及其等效物界定。
SEQUENCE LISTING
<110> 扬州大学
<120> 美洲大蠊wingless基因全长鉴定及应用
<160> 10
<170> PatentIn version 3.5
<210> 1
<211> 1456
<212> DNA
<213> Periplaneta americana
<400> 1
acaaatcggt agctgtcgga tcggttcggc aggtctcgtg ggggcggcat cggtcgccat 60
ctcctccccc gcccccgcta actcgctttc atttttttct ggcgtctgtg cggtgccggc 120
tggtgctcgt aggtgctcct ggtgtctcca tgtgacgatg aagtggtcca gtgcaccttt 180
ggtgctgatg accctgctga tggccctcgt caccctcgcc gaggaggtgg ccagcaagaa 240
caaggccggg cgcggacgcg gcagcaagtg gtgggggatt gcgaaagccg gcgagcccaa 300
caacttgctt ccgcagacgc cgggcgcgct ctacatggac ccggccgtgc acgccattct 360
gcggcggaag cagagacgtc tagttcggga gaacccggga gttcttgtgg cggtagccaa 420
aggtgctaac caggccatcg tagaatgcca gttccagttt cgaaacagga ggtggaactg 480
ctcgacaaga aattttctac gaggcaaaaa tctcttcgga aaaattgttg acagaggttg 540
tcgggagacg gcgttcatat acgcgatcac aagtgcgggc gtgacacacg ccatcgcgcg 600
ggcgtgcagc gagggcagca tcgagtcgtg cacgtgtgat tacagccacc aggcgcgggc 660
gccgcaggtg acgtccgtgc ccggcctgcg cgactgggag tgggcgggct gctccgacaa 720
catcggctac ggcttcaagt tctcccgcga attcgtcgat accggcgagc gggggcgcaa 780
cctccgcgag aagatgaatc tccacaacaa tgaggccggc agagcgcacg tttcctcgga 840
gatgcgtcaa gaatgtaagt gccacggcat gtctggctcc tgcacggtca agacctgctg 900
gatgcggctg cccagcttcc gagtcgtagg cgacaacctc aaggatcgct tcgacggcgc 960
gtccagagtg atggtgagta acgcgggcag cctgcgcggc cagggtggta gcggcggcag 1020
cggcgtcggt ggtaagaaga acagatacaa cttccaactg aaaccctaca acccggacca 1080
caagccgccc ggccccaaag acctggtcta cttggagcct tccccagggt tctgcgagcg 1140
caacccgaga ctcggtatcc aaggcacgca cggacgtcag tgcaacgata cgtcgatagg 1200
cgtggatggt tgcgacctca tgtgttgtgg gcgaggatat agaactcatg aggtgtccgt 1260
ggtgcagagg tgtgcgtgca tgttccactg gtgctgcgaa gtcaagtgca acctctgtcg 1320
gacaaagaaa accattcaca cgtgtctgtg agtggtgaaa aagaaacaat tcacccatac 1380
tagtgagtgc tgcaaataaa acaatccaca cgtgtctgtg agtggtggaa aaaaaaaaaa 1440
aaaaaaaaaa aaaaaa 1456
<210> 2
<211> 397
<212> PRT
<213> Periplaneta americana
<400> 2
Met Lys Trp Ser Ser Ala Pro Leu Val Leu Met Thr Leu Leu Met Ala
1 5 10 15
Leu Val Thr Leu Ala Glu Glu Val Ala Ser Lys Asn Lys Ala Gly Arg
20 25 30
Gly Arg Gly Ser Lys Trp Trp Gly Ile Ala Lys Ala Gly Glu Pro Asn
35 40 45
Asn Leu Leu Pro Gln Thr Pro Gly Ala Leu Tyr Met Asp Pro Ala Val
50 55 60
His Ala Ile Leu Arg Arg Lys Gln Arg Arg Leu Val Arg Glu Asn Pro
65 70 75 80
Gly Val Leu Val Ala Val Ala Lys Gly Ala Asn Gln Ala Ile Val Glu
85 90 95
Cys Gln Phe Gln Phe Arg Asn Arg Arg Trp Asn Cys Ser Thr Arg Asn
100 105 110
Phe Leu Arg Gly Lys Asn Leu Phe Gly Lys Ile Val Asp Arg Gly Cys
115 120 125
Arg Glu Thr Ala Phe Ile Tyr Ala Ile Thr Ser Ala Gly Val Thr His
130 135 140
Ala Ile Ala Arg Ala Cys Ser Glu Gly Ser Ile Glu Ser Cys Thr Cys
145 150 155 160
Asp Tyr Ser His Gln Ala Arg Ala Pro Gln Val Thr Ser Val Pro Gly
165 170 175
Leu Arg Asp Trp Glu Trp Ala Gly Cys Ser Asp Asn Ile Gly Tyr Gly
180 185 190
Phe Lys Phe Ser Arg Glu Phe Val Asp Thr Gly Glu Arg Gly Arg Asn
195 200 205
Leu Arg Glu Lys Met Asn Leu His Asn Asn Glu Ala Gly Arg Ala His
210 215 220
Val Ser Ser Glu Met Arg Gln Glu Cys Lys Cys His Gly Met Ser Gly
225 230 235 240
Ser Cys Thr Val Lys Thr Cys Trp Met Arg Leu Pro Ser Phe Arg Val
245 250 255
Val Gly Asp Asn Leu Lys Asp Arg Phe Asp Gly Ala Ser Arg Val Met
260 265 270
Val Ser Asn Ala Gly Ser Leu Arg Gly Gln Gly Gly Ser Gly Gly Ser
275 280 285
Gly Val Gly Gly Lys Lys Asn Arg Tyr Asn Phe Gln Leu Lys Pro Tyr
290 295 300
Asn Pro Asp His Lys Pro Pro Gly Pro Lys Asp Leu Val Tyr Leu Glu
305 310 315 320
Pro Ser Pro Gly Phe Cys Glu Arg Asn Pro Arg Leu Gly Ile Gln Gly
325 330 335
Thr His Gly Arg Gln Cys Asn Asp Thr Ser Ile Gly Val Asp Gly Cys
340 345 350
Asp Leu Met Cys Cys Gly Arg Gly Tyr Arg Thr His Glu Val Ser Val
355 360 365
Val Gln Arg Cys Ala Cys Met Phe His Trp Cys Cys Glu Val Lys Cys
370 375 380
Asn Leu Cys Arg Thr Lys Lys Thr Ile His Thr Cys Leu
385 390 395
<210> 3
<211> 23
<212> DNA
<213> 人工引物序列
<400> 3
aaggatcgct tcgacggcgc gtc 23
<210> 4
<211> 23
<212> DNA
<213> 人工引物序列
<220>
<221> misc_feature
<222> (21)..(21)
<223> n is a, c, g, or t
<400> 4
ccgcaacaca tsagrtcrca ncc 23
<210> 5
<211> 25
<212> DNA
<213> 人工引物序列
<400> 5
gagccttccc cagggttctg cgagc 25
<210> 6
<211> 25
<212> DNA
<213> 人工引物序列
<400> 6
gactcggtat ccaaggcacg cacgg 25
<210> 7
<211> 25
<212> DNA
<213> 人工引物序列
<400> 7
ccctggggaa ggctccaagt agacc 25
<210> 8
<211> 25
<212> DNA
<213> 人工引物序列
<400> 8
ttcttcttac caccgacgcc gctgc 25
<210> 9
<211> 25
<212> DNA
<213> 人工引物序列
<400> 9
ttcttgacgc atctccgagg aaacg 25
<210> 10
<211> 25
<212> DNA
<213> 人工引物序列
<400> 10
ggagaacttg aagccgtagc cgatg 25
- 还没有人留言评论。精彩留言会获得点赞!