用于沉默昆虫保幼激素结合蛋白基因的物质在防治棉花害虫中的应用的制作方法
本发明涉及用于沉默昆虫保幼激素结合蛋白基因的物质在防治棉花害虫中的应用。
背景技术:
目前防治棉花虫害的主要手段是种植Bt转基因棉花和应用化学杀虫剂相结合的方法。Bt毒蛋白可以杀死一些主要的以作物为食的害虫种群,而对脊椎动物和其它生物无害。然而,近年来在实验室或者种植Bt转基因作物的大田中都发现对Bt蛋白产生抗性的害虫。其他一些问题也逐渐引起关注,如化学杀虫剂使用造成的环境污染,害虫抗药性的增加等问题。为了解决这些问题科学家们在寻找更有效的抗虫技术方面做了很多尝试,包括天敌的利用,基于天然产物的杀虫剂的使用,Bt种植区避难所的设置等等,但上述手段均收效甚微。综上所述,亟待一种对环境安全,种群特异性强,对作物性状没有不良影响的新抗虫方法出现。
昆虫的生长发育、蜕皮、变态、滞育、生殖、多型现象等生理过程以及行为反应等都离不开激素的参与。昆虫激素已成为杀虫剂研究与开发的一个重点领域,不同于以往作用于神经系统的传统杀虫剂,其作用毒性低、污染少、对天敌和有益生物影响小,有助于可持续农业的发展、有利于无公害绿色食品生产、有益于人类健康。
保幼激素(juvenile hormone,JH)是一种低分子量、脂溶性、非蛋白质的萜烯类化合物,已经证明有7种天然JH存在,具体如下:(1)JH0,(2)JHI,(3)JHII,(4)JHIII,(5)4-methyl-JHI,(6)JHIII-bisepoxide,(7)mehtylfamesoate。其中(1)、(2)、(3)、(5)存在于鳞翅目中,(6)存在于双翅目中,(7)存在于蟑螂中,(4)在所有昆虫中都存在。JH由咽侧体合成和释放,是节肢动物特有的激素,未见于其它动物中。
技术实现要素:
本发明的目的是提供用于沉默昆虫保幼激素结合蛋白基因的物质在防治棉花害虫中的应用。
本发明提供了一种培育抗虫性提高的转基因植物的方法,包括如下步骤:在出发植物中导入特异DNA分子,得到抗虫性提高的转基因植物;所述特异DNA分子包括正义片段、反义片段以及位于它们之间的间隔片段;所述正义片段如序列表的序列2自5’末端第17至499位核苷酸所示;所述反义片段与所述正义片段反向互补。
所述特异DNA分子中,自上游至下游依次包括:所述正义片段、所述间隔片段和所述反义片段。
所述特异DNA分子具体可如序列表的序列2或序列表的序列6所示。
所述特异DNA分子具体可通过重组表达载体导入所述出发植物;所述重组表达载 体是在表达载体中插入所述特异DNA分子得到的重组质粒。
所述重组表达载体中,所述特异DNA分子具体可存在于如下表达盒中:采用序列表的序列4自5’末端第12至295位核苷酸所示的启动子,序列表的序列5自5’末端第14至194位核苷酸所示的终止子。
可用现有的植物表达载体构建含有所述特异DNA分子的重组表达载体。所述植物表达载体包括双元农杆菌载体和可用于植物微弹轰击的载体等。所述植物表达载体还可包含外源基因的3’端非翻译区域,即包含聚腺苷酸信号和任何其它参与mRNA加工或基因表达的DNA片段。所述聚腺苷酸信号可引导聚腺苷酸加入到mRNA前体的3’端。使用所述特异DNA分子构建重组表达载体时,在其转录起始核苷酸前可加上任何一种增强型启动子或组成型启动子,它们可单独使用或与其它的植物启动子结合使用;此外,使用所述特异DNA分子构建重组表达载体时,还可使用增强子,包括翻译增强子或转录增强子,但必需与编码序列的阅读框相同,以保证整个序列的正确翻译。所述翻译控制信号和起始密码子的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用植物表达载体进行加工,如加入可在植物中表达的编码可产生颜色变化的酶或发光化合物的基因、具有抗性的抗生素标记物或是抗化学试剂标记基因等。从转基因植物的安全性考虑,可不加任何选择性标记基因,直接以逆境筛选转化植株。
所述表达载体具体可为植物表达载体pCAMBIA2300。所述特异DNA分子具体可插入所述表达载体的EcoRI和HindIII酶切位点之间。
所述方法中,所述重组表达载体可通过使用Ti质粒、Ri质粒、植物病毒载体、直接DNA转化、显微注射、电导、农杆菌介导等常规生物学方法转化植物细胞或组织,并将转化的植物组织培育成植株。所述特异DNA分子具体可通过所述重组质粒导入所述目的植物中。
本发明还保护另一种培育抗虫性提高的转基因植物的方法,包括如下步骤:在出发植物中表达特异RNA,得到抗虫性提高的转基因植物;所述特异RNA为序列表中的序列3所示的RNA。
以上任一所述方法中,所述抗虫具体可为抗棉铃虫。
以上任一所述方法中,所述抗虫可体现为促进虫的死亡和/或抑制存活下来的虫的体重增加。
以上任一所述方法中,所述出发植物具体可为如下a1)-a6)中的任意一种:a1)双子叶植物;a2)单子叶植物;a3)锦葵科(Malvaceae)植物;a4)棉属植物;a5)陆地棉(Gossypium hirsutum);a6)泗棉3号。
本发明还保护序列表的序列2或序列表的序列6所示的DNA分子。
本发明还保护将序列表的序列2或序列表的序列6所示的DNA分子插入植物表达载体pCAMBIA2300得到的重组质粒。所述DNA分子具体可插入植物表达载体pCAMBIA2300的EcoRI和HindIII酶切位点之间。
本发明还保护序列表中的序列3所示的RNA。
本发明还保护所述DNA分子、所述重组质粒或所述RNA在培育抗虫植物中的应用。所述抗虫具体可为抗棉铃虫。所述抗虫可体现为促进虫的死亡和/或抑制存活下来的虫的体重增加。所述植物具体可为如下a1)-a6)中的任意一种:a1)双子叶植物;a2)单子叶植物;a3)锦葵科(Malvaceae)植物;a4)棉属植物;a5)陆地棉(Gossypium hirsutum);a6)泗棉3号。
RNA干扰(RNA interference,RNAi)是一种新发现的基因调控机制,是由与靶基因序列同源的双链RNA(dsRNA)所诱导的一种特异性基因沉默现象。有研究表明将dsRNA直接注射进昆虫的卵、血腔或局部组织,可引发远距离靶基因的特异性沉默。此外,除了直接注射dsRNA,还可以通过饲喂dsRNA的方法诱导昆虫产生RNAi现象。目前已有研究表明饲喂相应靶基因的dsRNA已成功降低苹浅褐卷蛾(Epiphyaspostvittana)幼虫羧酸酯酶表达水平、蜜蜂(Apismellifera)的雷帕霉素靶蛋白(targetof rapamycin,amTOR)的表达水平及棉铃虫(Helicoverpaarmigera)P450基因的表达水平。因而,以RNAi技术为基础开发新的害虫防治方法,为农业害虫的防治提供了高特异性和环境安全的新策略。
昆虫激素在昆虫的生长发育中起着极其重要的作用。调节昆虫发育的昆虫激素,其合成、运输和代谢途径中所涉及的关键基因多数具有很强的物种特异性,即与其他物种的基因同源性低,尤其是与人类基因相比几乎没有同源性,这在很大程度上降低了RNAi技术的“脱靶效应”,从而为应用安全性方面提供了保障。因此,在植物中表达昆虫激素相关基因的dsRNA,其优点在于只对植食性的昆虫有抑制作用,同时还可以根据昆虫激素相关基因的物种特异性,通过表达不同序列的dsRNA对某一种或某一属昆虫的生长发育产生影响,从而达到精确、安全的控制虫害的目的。
本发明对于植食性昆虫的生物防治、植物抗虫基因工程具有重要的应用价值。
附图说明
图1为干扰载体PRP:dsJHBP的结构示意图。
图2为部分再生植株的PCR鉴定结果.
图3为死亡率结果。
图4为体重结果。
图5为Ha-JHBP基因的表达水平。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
植物表达载体pCAMBIA2300:CAMBIA公司;详细序列见GenBank:AF234315.1,网址:http://www.ncbi.nlm.nih.gov/nuccore/7638145。
根癌农杆菌EHA105:公众可以从中国科学院遗传与发育生物学研究所获得;参考文献:Hood EE,Gelvin SB,Melchers S,Hoekema A(1993)New Agrobacterium helper plasmids for gene transfer to plants(EHA105).Trans Res 2:208-218。
陆地棉(Gossypium hirsutum)品种泗棉3号:公众可以从中国科学院遗传发育生物学研究所获得;参考文献:Shen-Jie Wu,Hai-Hai Wang,Fei-Fei Li,Tian-Zi Chen,Jie Zhang,Yan-Jie Jiang,Yezhang Ding,Wang-Zhen Guo,Tian-Zhen Zhang.Enhanced Agrobacterium-mediated Transformation of Embryogenic Calli of Upland Cotton via Efficient Selection and Timely Subculture of Somatic Embryos.Plant Molecular Biology Reporter.2008Sep 26(3):174-185。
棉铃虫(Helicoverpaarmigera):公众可以从中国科学院遗传与发育生物学研究所获得;参考文献:Wu KM,Lu YH,Feng HQ,Jiang YY,Zhao JZ.Suppression of cotton bollworm in multiple crops in China in areas with Bt toxin-containing cotton.Science.2008Sep 19;321(5896):1676-8。
MSB0液体培养基:含MS培养基的无机盐、B5培养基的有机物、30g/L葡萄糖和0.75g/LMgCl2,补水至1L。
MSB培养基:含MS培养基的无机盐、B5培养基的有机物、30g/L葡萄糖、2.5g/L phytalgel和1.1g/L MgCl2,补水至1L。
共培养培养基:以MS培养基为基础培养基,另加入终浓度为0.1mg/L的IAA(吲哚乙酸)、终浓度为1mg/L的6-BA(6-苄氨基嘌呤)、终浓度为100μM的AS(乙酰丁香酮)。
MSB2培养基:含MS培养基的无机盐、B5培养基的有机物、30g/L葡萄糖、1.5g/L phytalgel、1.1g/L MgCl2和3.8g/L KNO3,补水至1L。
筛选培养基:以MS培养基为基础培养基,另加入终浓度为0.1mg/L的IAA(吲哚乙酸)、终浓度为1mg/L的6-BA(6-苄氨基嘌呤)、终浓度为400mg/L的Cef(头孢霉素)、终浓度为100mg/L的Kan(卡那霉素)。
分化培养基(pH6.5):含MS培养基的无机盐、B5培养基的有机物、30g/L葡萄糖、 4g/L phytalgel、1.1g/L MgCl2和1.9g/L KNO3,补水至1L。
再生培养基:以MS培养基为基础培养基,另加入终浓度为1mg/L的6-BA(6-苄氨基嘌呤)、终浓度为400mg/L的Cef(头孢霉素)、终浓度为100mg/L的Kan(卡那霉素)。
生根培养基:以MS培养基为基础培养基,另加入终浓度为200mg/L的Cef(头孢霉素)、终浓度为100mg/L的Kan(卡那霉素)。
MS培养基配方如下:
B5培养基配方如下:
实施例1、干扰载体PRP:dsJHBP的构建
一、重组质粒pC2300PN的构建
在植物表达载体pCAMBIA2300中插入棉花曲叶病毒(CLCuV)互补链启动子PRP和T-NOS终止子,获得质粒pC2300PN。
1、将序列表的序列4自5’末端第12至295位核苷酸所示的双链DNA分子插入植物表达载体pCAMBIA2300的EcoRI和PstI酶切位点之间,得到重组质粒pCAMBIA2300-PRP。
2、将序列表的序列5自5’末端第14至194位核苷酸所示的双链DNA分子插入重组质粒pCAMBIA2300-PRP的PstI和HindIII酶切位点之间,得到重组质粒pC2300PN。
经测序,对重组质粒pC2300PN进行结构描述如下:以植物表达载体pCAMBIA2300为骨架载体,在EcoRI和PstI酶切位点之间插入了序列表的序列4自5’末端第12至295位核苷酸所示的双链DNA分子,在PstI和HindIII酶切位点之间插入了序列5自5’末端第14至194位核苷酸所示的双链DNA分子。
二、干扰载体PRP:dsJHBP的构建
1、人工合成序列表的序列2所示的双链DNA分子。
序列表的序列2中,第17至499位核苷酸为HaJHBP基因区段(JHBP S),第504至704位核苷酸为内含子(intron),第713至1195位核苷酸为所述HaJHBP基因区段的反向互补序列(JHBP A)。HaJHBP基因如序列表的序列1所示。
2、用限制性内切酶PstI酶切步骤1得到的双链DNA分子,回收酶切产物。
3、用限制性内切酶PstI酶切重组质粒pC2300PN,回收载体骨架。
4、将步骤2得到的酶切产物与步骤3得到的载体骨架连接,得到重组质粒,即为干扰载体PRP:dsJHBP。
经测序,对干扰载体PRP:dsJHBP进行结构描述如下:在植物表达载体pCAMBIA2300的EcoRI和HindIII酶切位点插入了序列表的序列6所示的双链DNA分子。干扰载体PRP:dsJHBP的结构示意图见图1。干扰载体PRP:dsJHBP表达序列表的序列3所示的RNA。
实施例2、转基因棉花的获得和抗虫性鉴定
一、转基因棉花的获得
1、将干扰载体PRP:dsJHBP电击导入根癌农杆菌EHA105,得到重组农杆菌。
2、取步骤1得到的重组农杆菌,用含100μmol/L AS的MSB0液体培养基悬浮,然后转接入含100μmol/L AS的MSB液体培养基,28℃振荡培养至OD600nm=0.5,然后用含100μmol/L AS的MSB液体培养基稀释至OD600nm=0.3-0.7,得到农杆菌侵染液。
3、切割泗棉3号的茎段,将7cm左右的下胚轴茎段浸泡于步骤2得到的农杆菌侵染液5-8min,然后用滤纸吸干,放在铺有一层灭菌滤纸的共培养培养基上,22-25℃共培养2天(下胚轴切段两端切口长出的愈伤组织)。
4、完成步骤2后,切取愈伤组织,在MSB2培养基上进行连续继代,直至出现黄绿色或灰绿色、米粒状的胚性愈伤。
5、取步骤4得到的胚性愈伤,在筛选培养基上培养10天。
6、完成步骤5后,取成活的胚性愈伤,依次在分化培养基、再生培养基和生根培养基上培养,得到再生植株。
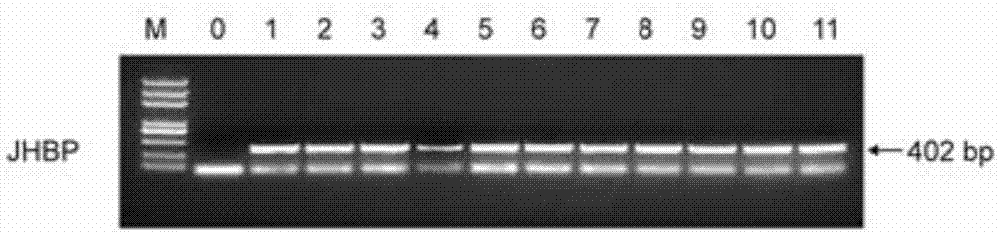
7、提取再生植株叶片的基因组DNA,采用P1和P2组成的引物对进行PCR鉴定,如果PCR扩增产物中具有约402bp条带,该再生植株为PCR鉴定阳性,为转基因棉花。
P1:5’-GGCTTGGGACTGGTCTATGAT-3’;
P2:5’-TAAAGCCACCTTGTTAGTCTCGT-3’。
部分再生植株的PCR鉴定结果见图2(0代表泗棉3号,1至11代表不同的再生植株)。
二、对照转基因棉花的获得
用pC2300PN载体代替干扰载体PRP:dsJHBP,其它同步骤一,得到转空载体棉花,作为转基因棉花的对照。
三、棉花的抗虫性检测(饲喂试验)
待测植株为步骤一获得的转基因棉花(转基因株系1或转基因株系2)、步骤二获得的转空载体棉花或泗棉3号。
1、将待测植株置于温室培养(生长温度为25℃,光照周期为16h光照/8h黑暗)。
2、每个培养皿放入2片待测棉花的嫩叶和6头2龄棉铃虫幼虫,加纸覆盖以防害虫逃逸,分别于第6天、第10天以及蛹期,统计棉铃虫的累计死亡率以及成活的棉铃虫的平均体重。
进行三次重复试验,每次重复试验中每种待测植株设置5个培养皿,数据结果取平均值。
累计死亡率结果见图3。饲喂转基因棉花的棉铃虫的死亡率重明显高于饲喂转空 载体棉花的棉铃虫和饲喂泗棉3号的棉铃虫。饲喂转空载体棉花的棉铃虫和饲喂泗棉3号的棉铃虫各个时间的累计死亡率没有显著差异。
体重结果见图4。饲喂转基因棉花的棉铃虫的幼虫体重明显小于饲喂转空载体棉花的棉铃虫的幼虫体重。饲喂转空载体棉花的棉铃虫的幼虫体重和饲喂泗棉3号的棉铃虫的幼虫体重没有显著差异。
4、分组处理的第10天,取存活的棉铃虫,提取总RNA并反转录为cDNA,采用QRT-PCR的方法检测Ha-JHBP基因的表达水平。
用于检测Ha-JHBP基因的引物如下:
P3:5’-ATTGCTTGCATTTGCGAGTTGTGT-3’;
P4:5’-TCCGGGAAACCATTGCTTGT-3’。
用于检测内参ACTIN基因的引物如下:
P5:5’-CCTGGTATTGCTGACCGTATGC-3’;
P6:5’-CTGTTGGAAGGTGGAGAGGGAA-3’。
结果见图5。饲喂转基因棉花的棉铃虫体内Ha-JHBP基因的mRNA水平显著低于饲喂于转空载体棉花的棉铃虫,说明取食转基因棉花植株叶片可以降低棉铃虫体内Ha-JHBP基因的表达量。
- 还没有人留言评论。精彩留言会获得点赞!