一种可高效应用的N-糖基化褐藻胶裂解酶突变体及基因工程菌构建方法与流程
本发明涉及一种糖基化修饰的海洋褐藻酸裂解酶及其应用,属于生物技术领域。本发明提供的褐藻胶裂解酶可广泛应用于海藻加工利用的食品、医药、农业等领域。
背景技术:
褐藻寡糖是褐藻胶经降解产生的一类具有抗肿瘤、免疫调节、降血糖血脂等多种生物活性的高附加值低聚糖,在食品、医药、饲料等领域具有重要应用。以褐藻胶裂解酶作为工具酶酶解制备褐藻寡糖的过程具有反应条件温和、过程可控、得率高等优点,已逐渐成为制备褐藻寡糖的主要方式。
目前,已经从海洋动植物及环境样品中分离获得各类产褐藻胶裂解酶的微生物,种类丰富且性能多样。因从海洋来源样品中获取,大部分产酶微生物具有生长条件特殊、产酶量低等特点,大大限制了酶的发展和应用。为解决目前褐藻胶裂解酶存在的缺陷,已有多个产酶基因通过基因工程菌的构建,实现了外源表达,培养条件得以简化,且产酶量有所提升。但普遍仍存在表达水平较低、酶活不高等问题。需要进一步选择或改进酶的改造方法以进一步提升酶的应用潜力。
糖基化是生物体内广泛存在与发生的蛋白质翻译后修饰过程,包括了n位糖基化、o位糖基化、c位甘露糖化以及gpi(glycophosphatidlyinositol)锚定连接,尤以n位糖基化最为普遍。研究表明,n位糖基化对酶的结构、功能、稳定性、相互作用等方面具有显著影响,是一种有效的人工进行酶后修饰的手段,在酶的改造、蛋白药物、抗体工程等各个领域均有广泛应用。近年来,随着对空肠弯曲杆菌(campylobacterjejuni)蛋白n-糖基化修饰研究的不断深入,利用大肠杆菌重建原核糖基化系统为酶的糖基化修饰和糖蛋白的可控制备提供了条件。大肠杆菌具有遗传背景清晰、生长快、操作简单等特点,是酶的表达和改造的理想宿主。利用大肠杆菌体系进行酶的糖基化修饰,提升酶的催化性能,改善酶的稳定性,对于酶的改造及其应用具有重要的理论研究价值和应用前景。
技术实现要素:
本发明的目的是提供一种能高效应用的n-糖基化褐藻胶裂解酶突变体及基因工程菌构建方法。
所述突变体,是在褐藻胶裂解酶aly-cob的基础上,在其n端引入载体蛋白yebf进行融合表达,同时引入n×dqnat重复序列片段(n为1~10)作为n-糖基化位点,与来源空肠弯曲菌糖基化修饰体系pgl基因簇共表达,形成以糖链galnac2(glc)galnac3bac修饰的突变体nacob。
所述突变体,在本发明的一种实施方式中,是在aly-cob的n端引入载体蛋白yebf与1×dqnat序列,突变经修饰得到的褐藻胶裂解酶命名为nacob1,其氨基酸序列如seqidno.1所示。
seqidno.1:
所述突变体,在本发明的一种实施方式中,是在aly-cob的n端引入载体蛋白yebf与4×dqnat序列,突变经修饰得到的褐藻胶裂解酶命名为nacob4,其氨基酸序列如seqidno.2所示。
seqidno.2:
所述cobetiasp.来源褐藻胶裂解酶,发生n-糖基化突变前的氨基酸序列如seqidno.2所示,由于不同cobetiasp.菌株来源的褐藻胶裂解酶序列仅有个别氨基酸的差异,因此,该方法不仅适用于seqidno.2序列,且对氨基酸序列相似性达到80%以上的褐藻胶裂解酶序列均适用于本专利。
所述表达载体为pet28a(+)、pet24b、pacyc、pmaf10、psp73其中的一种。
所述基因工程菌是以大肠杆菌为宿主构建的,可以是e.colibl21(de3)、clm24、clm37中的任意一种。
所述基因工程菌,在本发明的一种实施方式中,其构建方法是:将质粒ptrc与载体蛋白yebf及糖基化dqnat重复序列片段构建重组质粒,酶切后连接编码所述褐藻胶裂解酶的核苷酸序列,与含糖基化体系的pacycpgl质粒共同电转入e.colibl21(de3)感受态细胞中进行表达与糖基化。
本发明提供了一种提高褐藻胶裂解酶稳定性的方法,是将褐藻胶裂解酶n端进行n-糖基化突变和修饰。
本发明的有益效果:
本发明的经过n-糖基化突变修饰的褐藻胶裂解酶,酶的表达与菌体生长不受n-糖基化影响。发酵培养24h后,酶活提高7%以上,40℃下温度稳定性提高了15%以上。
本发明的褐藻胶裂解酶可广泛用于海藻加工相关的食品、医药、化工、农业等领域。
附图说明
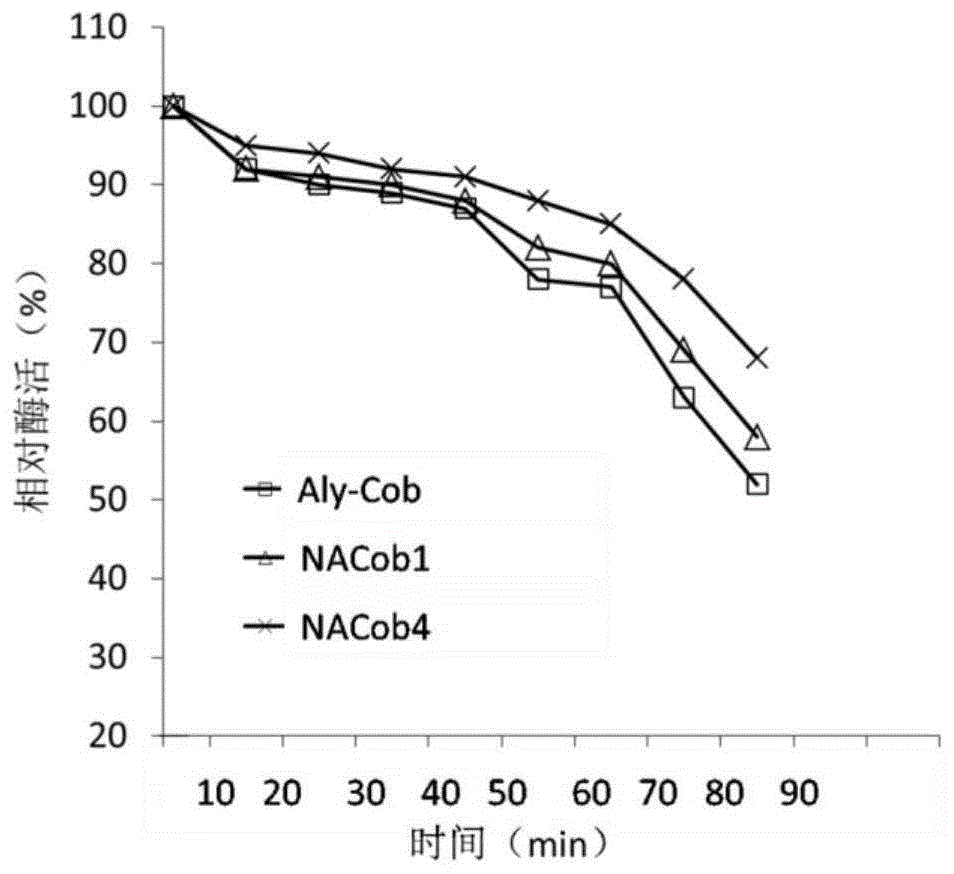
图1:糖基化前后褐藻胶裂解酶的温度稳定性对比
具体实施方式
实施例1:引入n-糖基化位点的突变酶nacob1及工程菌构建
本发明在褐藻胶裂解酶aly-cob的n端设计引入n-糖基化位点1×dqnat,并与载体蛋白yebf融合表达,经与糖基化pglb质粒共表达后,产生n-糖基化修饰改造的褐藻胶裂解酶nacob1(氨基酸序列如seqidno.1)。
具体方法如下:
(1)将质粒ptrc99a用xbai与hindiii双酶切,引入编码糖基化位点dqnat及6×his基因序列,构建重组质粒,经xbai与sali双酶切后,插入yebf(ncbi:b1847)基因序列,形成ptrc-yebf-gly-his质粒,经xbai和ecori双酶切后,插入aly-cob编码基因,形成重组载体ptrc-yebf-gly-aly-cob-his;
(2)将构建的表达质粒与携带空肠弯曲菌n-糖基化基因簇的pacycpgl质粒,电击转化至大肠杆菌e.coliclm24共表达,然后将转化子接种到含有氯霉素(20μg/ml)和甲氧苄啶(100μg/ml)的lb培养基中,培养16-20h后,添加异丙基硫代半乳糖苷(iptg,0.01mm)诱导表达24h;
(3)离心收集发酵上清,通过镍柱子纯化重组酶nacob1。
实施例2:引入n-糖基化位点的突变酶nacob4及工程菌构建
方法与实施例1类似,不同在于糖基化位点为4×dqnat,所得突变酶命名为nacob4(氨基酸序列如seqidno.2)。
实施例3:糖基化修饰前后酶活的比较
采用dns法测定发酵上清中的褐藻胶裂解酶活性(表1)。糖基化修饰后,褐藻胶裂解酶的活力得以少量提升,酶活nacob4>nacob>aly-cob,其中nacob4酶活提高了12.6%。
表1糖基化修饰前后褐藻胶裂解酶酶活
实施例4:糖基化修饰前后酶稳定性的比较
将糖基化修饰前后的酶液分别在40℃保温30min,测定残留的酶活力,将最高酶活力定义为100%。每10min取样测定样品残余酶活力。最终确定糖基化修饰后,褐藻胶裂解酶的稳定性得到提高,尤其是nacob4,其40℃稳定性比aly-cob提高了26%(图1)。
- 还没有人留言评论。精彩留言会获得点赞!