一种单链核酸适配体及其用途的制作方法
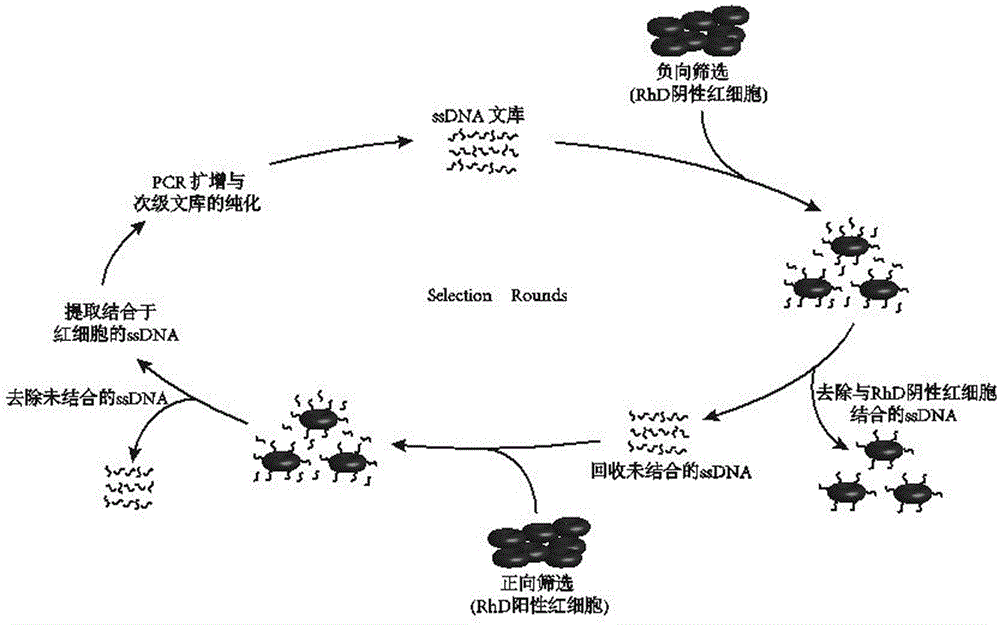
本发明属于生物医学与临床医学
技术领域:
。具体而言,本发明涉及一种单链核酸适配体及其用途。
背景技术:
:在临床输血实践中,rh血型系统是临床意义最为显著的血型系统之一,也是人类36个血型系统中最复杂、最富多态性的血型系统。rh血型系统不合的输血可因同种免疫而引起溶血病、肾功能衰竭等输血不良反应,甚至死亡。rh血型系统抗原由rhd和rhce基因控制编码,目前已发现54种抗原。rhd抗原是rh血型系统抗原中免疫原性最强,临床意义最为显著的抗原,也是影响临床用血安全的主要因素。以往的研究显示,rhd阴性患者输注30μlrhd阳性红细胞即可产生同种抗-d。为保障输血安全,rhd阴性患者只能输注阴性血液。但在我国汉族人群中,rhd阴性个体仅占0.1%-0.4%。随着临床用血量日益增加,rhd阴性血液供应经常出现短缺,严重影响rhd阴性患者的日常输血治疗,尤其是在急性失血的情况下,会威胁患者生命。相反地,rhd阳性血却十分丰富,将rhd阳性红细胞改造成阴性红细胞,则可解决rhd阴性临床供血短缺的问题。以细胞为靶标的指数富集的配体系统进行技术(cellsystematicevolutionofligandsbyexponentialenrichment,cell-selex)的出现为实现rhd通用血的改造提供了可能。通过cell-selex筛选可获得识别某一靶分子的核酸适配体,其具有特异性强、亲和力高、体积小等优点,而且可通过基因合成或pcr扩增的方法大量获得,成本低廉,且对人体无毒性。核酸适配体已在高灵敏检测分析、诊断、蛋白质相互作用、抗感染新药研发及难治性病毒感染性疾病(如aids、hbv、hsv、rabiesvirus等)等方面得到广泛应用。技术实现要素:发明人通过红细胞消减指数富集的配体系统进化技术,意外地筛选出一种能与rhd抗原高亲和力、高特异性结合并能够遮蔽其抗原性的单链核酸(ssdna)适配体,可实现rhd血型“改造”达到血液通用的目的,紧急情况下可为rhd阴性稀有血型患者提供“血型相容”的红细胞。从而,本发明提供了一种单链核酸适配体,其能与rhd抗原特异性结合,遮蔽rhd抗原性,将rhd阳性红细胞转变为rhd阴性红细胞。其能制备成治疗剂,在无法及时获得rhd阴性血液时,使用本治疗剂将rhd阳性红细胞改造成阴性红细胞,用于rhd阴性患者的急救输血。为了完成上述目的,本发明一方面提供了一种单链核酸适配体,所述适配体满足:(1)具有由seqidno:1所示核苷酸序列、40bp随机核苷酸序列和seqidno:2所示核苷酸序列依次连接组成5'-agagacggacacaggatgagc-n40-ccttccccaagacagcatcca-3’所示的通式;(2)能特异性与rhd抗原结合。在本发明的一些实施方案中,所述随机核苷酸序列选自seqidno:3-14中的一种。在本发明的一些具体实施方案中,所述随机核苷酸序列选自seqidno:3、seqidno:4、seqidno:6、seqidno:7和seqidno:11中的一种。在本发明的一个具体实施方案中,所述随机核苷酸序列选自seqidno:3和seqidno:4中的一种。本发明的第二方面提供一种单链核酸适配体组合物,其包括至少两种单链核酸适配体,任一适配体满足:(1)具有由seqidno:1所示核苷酸序列、40bp随机核苷酸序列和seqidno:2所示核苷酸序列依次连接组成5'-agagacggacacaggatgagc-n40-ccttccccaagacagcatcca-3’所示的通式;(2)能特异性与rhd抗原结合。在本发明的一些实施方案中,所述随机核苷酸序列选自seqidno:3-14中的至少两种。在本发明的一些实施方案中,所述随机核苷酸序列选自seqidno:3、seqidno:4、seqidno:6、seqidno:7和seqidno:11中的至少两种。在本发明的一些实施方案中,所述随机核苷酸序列分别为seqidno:3和seqidno:4。本发明的第三方面提供本发明第一方面所述的适配体或本发明第二方面所述的适配体组合物在制备用于将rhd阳性红细胞改造成rhd阴性红细胞的改造剂中的用途。本发明第四方面提供一种用于将rhd阳性红细胞改造成rhd阴性红细胞的改造剂,所述改造剂包括本发明第一方面所述的适配体或本发明第二方面所述的适配体组合物。本发明的有益效果本发明的单链核酸适配体是由82个碱基组成的小分子物质,可特异性地与rhd抗原结合,可以有效遮蔽红细胞rhd抗原,使其失去生物活性,阻断与同种抗体的特异性结合,避免因同种免疫引起的溶血性输血反应,可以用于rhd阴性患者紧急情况时的非同型输血。附图说明图1为实施例1的红细胞消减selex筛选rhd抗原特异性ssdna核酸适配体的制备方法流程图。图2为实施例1中次级文库制备效果的琼脂糖凝胶电泳图,从左至右依次为:marker;1为步骤五的对称pcr扩增产物;2为步骤六的不对称pcr扩增产物;3为步骤七的在步骤二的产物基础上纯化后的产物。图3为实施例2有效性验证中经不同ssdna全长序列遮蔽rhd抗原后的荧光强度变化,其中横坐标为ssdna编号,纵坐标为荧光强度。图4为实施例2亲和力验证中rhd阳性红细胞与seqidno:15、seqidno:16结合后荧光强度的变化,其中横坐标为ssdna全长序列的浓度,纵坐标为荧光强度。图5为实施例2中seqidno:15与seqidno:16联合使用遮蔽rhd抗原效果,从左至右依次为:a为流式细胞术检验结果;b为未经seqidno:15与seqidno:16联合处理的显微镜下观察结果;c为seqidno:15与seqidno:16浓度为500pmol时显微镜下观察结果。具体实施方式为了使本发明所解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。实施例以下例子在此用于示范本发明的优选实施方案。本领域内的技术人员会明白,下述例子中披露的技术代表发明人发现的可以用于实施本发明的技术,因此可以视为实施本发明的优选方案。但是本领域内的技术人员根据本说明书应该明白,这里所公开的特定实施例可以做很多修改,仍然能得到相同的或者类似的结果,而非背离本发明的精神或范围。除非另有定义,所有在此使用的技术和科学的术语,和本发明所属领域内的技术人员所通常理解的意思相同,在此公开引用及他们引用的材料都将以引用的方式被并入。那些本领域内的技术人员将意识到或者通过常规试验就能了解许多这里所描述的发明的特定实施方案的许多等同技术。这些等同将被包含在权利要求书中。实施例1本实施例提供了一种红细胞消减selex筛选rhd抗原特异性ssdna核酸适配体的制备方法,其制备流程及主要制备参数见图1,表1,包括如下步骤:表1红细胞消减selex参数步骤一:负向筛选。在1.5ml离心管中,依次加入100μl浓度为2.0×106/μlrhd-红细胞生理盐水悬液、950μl血液保存液ⅲ(cpda-i保存液)、15.2μl鲑鱼精dna及100μlssdna文库,室温(25℃)下孵育30min。5000rpm,2min离心去除红细胞(rbc),上清液转移至另一洁净的1.5ml离心管中,用于正向筛选。所述ssdna文库由82bp组成,文库中间为40bp的随机序列,两侧是分别由21bp组成的引物结合区,其中5'端结合区为:5'-agagacggacacaggatgagc-3'(seqidno:1)3'端结合区为:5'-ccttccccaagacagcatcca-3'(seqidno:2)由此组成5'-agagacggacacaggatgagc-n40-ccttccccaagacagcatcca-3’所示的通式。ssdna文库由takara公司合成。鲑鱼精dna购于lifetechnologies公司(salmonspermdna,货号:am9680,批号:1502041)。步骤二:正向筛选。在经负向筛选的文库中加入100μl浓度为2.0×104/μlrhd+红细胞生理盐水悬液,室温下,孵育60min。离心去上清,在红细胞扣上加入400μl生理盐水及100μl红细胞磁化液重悬红细胞,置于磁力架上,静置2min。吸去上清。重复洗涤5次,每次均需转管。所述红细胞磁化液购于diagast公司(magnelys,批号:581000)。步骤三:结合于rhd+红细胞的ssdna提取。在去除上清的红细胞中,加入200μl无核酸酶水,95℃,5min。加入300μllysis/bindingbuffer。颠倒离心管4~6次,室温孵育5min。加入150μl异丙醇(isopropanol)。再加入50μl(2mg)悬浮的磁珠。在mixer上室温孵育10min。放在磁力架上,静置2min,吸去上清液。加入850μlwashingbuffer1(使用前要按说明加入异丙醇),颠倒离心管3~4次,重悬磁珠。在磁力架上静置1min,去除上清。重复洗涤一次后加入450μlwashingbuffer2,然后将磁珠悬液转移至另一支洁净的离心管中。磁力架上静置2min,去上清。重复洗涤一次,但不用再转管。全部吸除剩余液体后,在磁力架上晾干磁珠,使乙醇全部挥发。室温下约需10~15min。加入100μlelutionbuffer,用加样器重悬磁珠,70℃,3min。去除磁珠,上清液即为ssdna。所述ssdna提取试剂购于购于lifetechnologies公司(dynabeadssilaneivralna,批号:37011d)。步骤四:ssdna浓度定量检测。采用荧光定量法对上清液中ssdna浓度进行检测。反应体系为:8μlh2o,pcrgrad,10μlmastermix,1μlssdna模板,1μl浓度均为10pmol/μl上、下游混合引物。扩增条件严格按试剂盒说明书进行。所述ssdna荧光定量检测试剂购于roche公司(lightcycler480sybrgreenimaster,批号:04707516001)。步骤五:次级文库的扩增与纯化。使用生物素标记的上、下游引物对ssdna文库进行pcr扩增,获得携有生物素的dsdna,为不对称pcr提供足够的模板。pcr反应体系如下:所述taq酶选自promega公司的型号为m1665s的试剂盒。所述生物素标记上游引物为:5’-biotin-agagacggacacaggatgagc-3’;所述生物素标记下游引物为:5’-biotin-tggatgctgtcttggggaagg-3’;其中,biotin为生物素,引物由takara公司合成。扩增条件:第一阶段:94℃5min第二阶段:(11个循环)94℃30s59℃30s72℃30s第三阶段:72℃5min4℃保存,得到获得携有生物素的dsdna扩增产物。步骤六:以步骤五得到的携有生物素的dsdna扩增产物为模板,使用无生物素标记的上游引物,以及生物素标记的下游引物,两者物质的量之比为20:1,进行不对称pcr扩增。经过不对称pcr扩增后所得到的dsdna、副产品均携有生物素,而ssdna却不含生物素。所述amplitaqgoldfastpcrmastermix(2×)来自lifetechnologies公司的4390939试剂盒。所述上游引物为5’-agagacggacacaggatgagc-3’;所述生物素标记下游引物为5’-biotin-tggatgctgtcttggggaagg-3’;其中,biotin为生物素,上述引物由takara公司合成。按下列条件进行扩增:第一阶段:95℃10min第二阶段:(30个循环)96℃3s59℃3s68℃3s第三阶段:72℃10s4℃保存,得到扩增产物,此扩增产物包括均携有生物素的dsdna和副产品,以及不含生物素的ssdna。步骤七:最后在步骤六的扩增产物中加入链霉亲和素磁珠,去除扩增产物中所有携带生物素的dsdna和副产品,从而获得高纯度、高浓度的ssdna。取步骤六的扩增产物1.5倍体积的链霉亲和素磁珠(paramagneticparticles,promega,z5482),用pbs-tween(ph7.4,with0.02%tween-20)洗涤3次,在磁力架上贴壁30s,去除上清。将ssdna扩增产物转移至磁珠管中,室温摇摆孵育20min。在磁力架上吸出上清液,上清液即为所需要的ssdna次级文库。结果检测:使用高分辨琼脂糖凝胶电泳检测ssdna的纯度,结果见图2。实施例2本实施例提供了通过实施例1的ssdna次级文库筛选能够与rhd抗原特异性结合并遮蔽其抗原性的单链核酸适配体的方法:步骤一:筛选出的ssdna序列库测序在实施例1得到的ssdna筛选文库的两端添加测序接头序列:ccatctcatccctgcgtgtctccgactcag;cctctctatgggcagtcggtgat。经pcr扩增后使用iontorrentpersonalgenomemachine半导体测序仪进行测序(由美国lifetechnologies上海分公司完成)。根据测序结果,我们将中间有目标序列、两端有接头且接头完全匹配的序列作为验证对象,筛选出在序列库中占优势的ssdna随机序列,见表2,其筛选标准为:ssdna序列库中拷贝数>1000,且可变区长度为40bp的序列。表2优势ssdna核酸适配体可变区碱基序列序列编号随机片段碱基序列(5′→3′)seqidno:3ggcctggtctgttagccgggtagcagccccggcacctattseqidno:4gggtagcagccccgcggagggtcggctataagaaccaagaseqidno:5ctattccccacgtcacttttcccgtaggttggactcgaccseqidno:6ggtgcaggggggtcggagaagaggttgaggggagaggggtseqidno:7acggcctctgtataatgctggccttgacgcttgtcccttgseqidno:8acggcctctgtacaatgctggccttgacgcttgtcccttgseqidno:9tacaccaatctcccccctacattctcccaccagcactccaseqidno:10gggtagcagccccgcggagggtcggctataagaactaggaseqidno:11gggtagcagccccgcggagggtcggctataagaaccaggaseqidno:12gggtagcagccccgcggagggtcagctataagaaccaggaseqidno:13gggtagcagccccgcggagggtcggctataggaaccaggaseqidno:14ctattccccacgtcacttttcccgtaggctggactcgacc步骤二:对步骤一筛选出的ssdna的随机序列进行多项指标验证1、有效性验证(遮蔽rhd抗原性的能力验证)在微量反应板中加入rhd阳性红细胞(4×106红细胞/孔),分别加入筛选出的单特异性ssdna全长序列500pmol,室温下(25℃)孵育60min。然后加入50μl经标化的单克隆抗-d[128倍稀释,效价为512(1024,score109)],室温下孵育30min。生理盐水洗涤3次后,加入100μl1000倍稀释的fitc标记的羊抗人igg(f(ab′)2荧光二抗,室温下孵育15min后使用生理盐水洗涤3次,加入200μl生理盐水,混匀,使用流式细胞术检测红细胞荧光强度。同时设置阳性对照和空白对照,各做3个平行孔。阳性对照的制备方法是用生理盐水替代上述试验中的ssdna。rhd阳性红细胞与fitc-羊抗人igg(f(ab′)2孵育后的红细胞作为空白对照。上述单克隆抗-d购自上海血液生物医药有限责任公司(批号:20160725);上述羊抗人igg(f(ab′)2荧光抗体购自jackson公司(goatf(ab`)2antihumanigg:fitc,批号:125089);上述流式检测采用的流式细胞仪为美国bd公司的facscantoii;上述筛选出的单特异性ssdna全长序列由上海生工生物工程股份有限公司合成。结果分析:以阳性对照荧光强度为参照,观察试验组荧光强度下降程度。使用ibmspssstatistics22软件,采用单因素方差分析(one-wayanova)比较各均值差异是否显著,p<0.05为差异有统计学意义。图3示出了各ssdna全长序列遮蔽rhd抗原从而阻断抗-d与rhd抗原结合后荧光强度变化情况,从图可以看出:中间随机序列由seqidno:3、seqidno:4组成的ssdna全长序列具有显著的遮蔽rhd抗原的作用,与阳性对照相比统计学差异显著(p值均<0.05)。结论:通过筛选得2种有效的ssdna随机序列,其ssdna的全长序列如表3所示:表3经筛选有效的ssdna全长序列2、亲和力的验证在96孔板中加入100μl0.2%rhd+红细胞生理盐水悬液,然后在不同孔中分别加入alexafluor488标记单特异性ssdnaseq1和seq2,使每种ssdna的终浓度达到200nmol/l、400nmol/l、800nmol/l、1000nmol/l和1200nmol/l。37℃摇摆孵育60min。4500rcf(labofuge400r,heraeusinstruments),离心5min。甩掉板中的液体。用生理盐水洗涤3次,最后一次离心去上清后,加入200μl生理盐水,使用流式细胞术检测红细胞荧光强度。上述alexafluor488标记单特异性ssdna由上海生工生物工程股份有限公司合成。检测结果:图4示出了seqidno:15、seqidno:16与rhd阳性红细胞结合后荧光强度的变化,根据荧光强度变化情况,采用graphpadprimsv6软件计算解离常数(dissociationconstant,kd)。数据分析复合非线性拟合分析要求,使用如下公式计算kd值:bmax为最大结合率,x为各ssdna全长序列的浓度,y为与x值对应的荧光强度值。由此计算得出seqidno:15、seqidno:16的kd值分别为:580.5±142.0nm和737.7±161.8nm。结论:亲和力由高至低依次为:seqidno:15、seqidno:16。3、ssdna遮蔽rhd抗原的剂量效应关系分别采用流式法及间接抗球蛋白试验法(iat)对ssdna遮蔽rhd抗原的剂量效应关系进行分析。流式法:在微量反应板中加入100μlrhd+细胞生理盐水悬液(4×106红细胞/孔),按200pmol、300pmol、400pmol、500pmol的梯度分别加入seqidno:15、seqidno:16,37℃孵育60min。用生理盐水洗涤3次,加100μl人源抗-d,37℃孵育30min,用生理盐水洗涤3次,加入100μl1000倍稀释的fitc标记的羊抗人igg(f(ab′)2荧光二抗,室温下孵育15min后使用生理盐水洗涤3次,加入200μl生理盐水,混匀,使用流式细胞术检测红细胞荧光强度。同时设备阳性对照与空白对照。阳性对照的制备方法是用生理盐水替代上述试验中的ssdna。rhd阳性红细胞与fitc-羊抗人igg(f(ab′)2孵育后的红细胞作为空白对照。间接抗球蛋白法:在微量反应板中加入100μlrhd+细胞生理盐水悬液(4×106红细胞/孔),按200pmol、300pmol、400pmol、500pmol的梯度分别加入seqidno:15、seqidno:16,37℃孵育60min。用生理盐水洗涤3次,加100μl人源抗-d,37℃孵育30min,用生理盐水洗涤3次,加入100μl抗球蛋白试剂,1000g离心15s,重悬后滴片,显微镜(日本奥林巴斯公司的奥林巴斯bx43型显微镜)下观察结果并记录。同时设置阳性对照和空白对照,阳性对照的制备方法是用生理盐水替代上述试验中的ssdna。阳性对照的制备方法是用生理盐水替代上述试验中的人源抗-d。上述人源抗-d由产生抗-d的志愿者提供;上述抗球蛋白试剂购自上海血液生物医药有限责任公司(批号:20141203)。上述羊抗人igg(f(ab′)2荧光抗体购自jackson公司(goatf(ab`)2antihumanigg:fitc,批号:125089);上述流式检测采用的流式细胞仪为美国bd公司的facscantoii;上述筛选出的单特异性ssdna全长序列由上海生工生物工程股份有限公司合成。检测结果:上述试验结果如表4,图5所示。表4根据表4,图5可以看出随着ssdna浓度的升高,当seqidno:15、seqidno:16均达到500pmol时均可完全遮蔽rhd抗原,使试验结果呈阴性。结论:seqidno:15和seqidno:16联合使用当浓度均达到500pmol时均可完全遮蔽红细胞rhd抗原,使iat试验结果由处理前的阳性转变为阴性结果。5、单核细胞单层试验(mma)采用密度梯度离心法提取6人份外周血单核细胞,用rpmi1640洗涤1次,将6份单核细胞混合,并调节细胞浓度至5×106个细胞/ml。在腔室玻片中加入50μl混合单核细胞,于co2培养箱中37℃孵育60min,使细胞贴壁。用生理盐水轻轻冲洗掉未贴壁细胞,在不同孔中分别加入100μl浓度为1×107个细胞/ml的试验组、阳性对照组、阴性对照组红细胞,于co2培养箱中37℃孵育90min。玻片经生理盐水洗涤3次后,进行瑞氏-姬姆萨染色。显微镜下观察500个单核细胞,以3%吞噬/粘附率为阳性检出限,判断各组试验结果。上述试验组红细胞为rhd阳性红细胞与seqidno:15和seqidno:16各500pmol37℃孵育60min,用生理盐水洗涤3次后,加入2倍体积的人源抗-d,混合后在37℃孵育60min。生理盐水洗涤5次后,用rpmi1640调节细胞浓度至1×107个细胞/ml。阳性对照组的制备方法是用生理盐水替代上述seqidno:15和seqidno:16。阴性对照是用rhd阴性红细胞替代上述rhd阳性红细胞。检测结果:试验组单核细胞吞噬/粘附率为2.5%,阳性对照组为19.5%,阴性对照组为2.2%。阳性检出限为3%。结论:seqidno:15和seqidno:16联合使用,当浓度均达到500pmol时可完全遮蔽红细胞rhd抗原,使mma试验结果呈限性反应。可认为经seqidno:15和seqidno:16处理的rhd阳性红细胞输注到rhd阴性患者体内后不会因同种免疫引起溶血性输血不良反应。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。序列表<110>深圳大学总医院<120>一种单链核酸适配体及其用途<130>kh19-1-153<160>16<170>siposequencelisting1.0<210>1<211>21<212>dna<213>人工序列(artificialsequence)<400>1agagacggacacaggatgagc21<210>2<211>21<212>dna<213>人工序列(artificialsequence)<400>2ccttccccaagacagcatcca21<210>3<211>40<212>dna<213>人工序列(artificialsequence)<400>3ggcctggtctgttagccgggtagcagccccggcacctatt40<210>4<211>40<212>dna<213>人工序列(artificialsequence)<400>4gggtagcagccccgcggagggtcggctataagaaccaaga40<210>5<211>40<212>dna<213>人工序列(artificialsequence)<400>5ctattccccacgtcacttttcccgtaggttggactcgacc40<210>6<211>40<212>dna<213>人工序列(artificialsequence)<400>6ggtgcaggggggtcggagaagaggttgaggggagaggggt40<210>7<211>40<212>dna<213>人工序列(artificialsequence)<400>7acggcctctgtataatgctggccttgacgcttgtcccttg40<210>8<211>40<212>dna<213>人工序列(artificialsequence)<400>8acggcctctgtacaatgctggccttgacgcttgtcccttg40<210>9<211>40<212>dna<213>人工序列(artificialsequence)<400>9tacaccaatctcccccctacattctcccaccagcactcca40<210>10<211>40<212>dna<213>人工序列(artificialsequence)<400>10gggtagcagccccgcggagggtcggctataagaactagga40<210>11<211>40<212>dna<213>人工序列(artificialsequence)<400>11gggtagcagccccgcggagggtcggctataagaaccagga40<210>12<211>40<212>dna<213>人工序列(artificialsequence)<400>12gggtagcagccccgcggagggtcagctataagaaccagga40<210>13<211>40<212>dna<213>人工序列(artificialsequence)<400>13gggtagcagccccgcggagggtcggctataggaaccagga40<210>14<211>40<212>dna<213>人工序列(artificialsequence)<400>14ctattccccacgtcacttttcccgtaggctggactcgacc40<210>15<211>82<212>dna<213>人工序列(artificialsequence)<400>15agagacggacacaggatgagcggcctggtctgttagccgggtagcagccccggcacctat60tccttccccaagacagcatcca82<210>16<211>82<212>dna<213>人工序列(artificialsequence)<400>16agagacggacacaggatgagcgggtagcagccccgcggagggtcggctataagaaccaag60accttccccaagacagcatcca82当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种基于CRISPR‑Cas9系统的基因编辑载体及其应用的制造方法与工艺
- 一种基于CRISPR/Cas9技术制备水稻OsPIL15突变体的方法及应用与流程
- 检测黄曲霉毒素M1的核酸适配体、传感器、试剂盒及应用的制造方法与工艺
- 一组肌酸激酶同工酶核酸适配体及其应用的制造方法与工艺
- 用于抑制KRAS靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 用于抑制EIF4E靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 用于抑制VEGFA靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 一种新型向导RNA表达盒及在CRISPR/Cas系统中的应用的制造方法与工艺
- 一种具备双单链末端PCR产物的获得方法及其检测方法与流程
- 一种通过生物技术扩增脱氧胸苷三磷酸的方法与流程