一种降解黄曲霉毒素B1的菌株及其应用的制作方法
本发明属于微生物领域,尤其涉及一种降解黄曲霉毒素B1的菌株及其应 用。
背景技术:
黄曲霉毒素是一类主要由黄曲霉、寄生曲霉等曲霉产生的次级代谢产 物,具有极强的致癌、致畸、致突变性。目前已鉴定出的黄曲霉毒素种类有 20多种,其中黄曲霉毒素B1(AFB1)的毒性最强,1993年被国际癌症研究机 构(International Agency for Research on Cancer,IARC)归为一级致 癌物。其危害的靶器官主要是肝脏,长期摄入会引起肝癌,并引发肾脏、胃 肠器官的癌变。
花生粕是提取花生油后的副产品,蛋白质含量达48%,是我国重要的植 物来源蛋白饲料。然而,花生粕在储存过程中极易污染黄曲霉毒素,在很大 程度上限制了其在饲料领域的应用。我国饲料卫生标准(GB13078-2017)规 定花生粕中黄曲霉毒素B1的限量标准为≤50μg/kg。传统的去除花生粕中黄 曲霉毒素的方法主要有物理法和化学法,包括吸附法、紫外线照射法、碱处 理法、臭氧法、氨化法等,但都存在效果差、营养损失大、适口性差等缺点。 近几年,生物脱毒法由于具有条件温和、提高产品营养和适口性好等特点逐 渐得到业内广泛认可。
目前用于花生粕生物脱毒的微生物主要有乳酸菌、酵母菌、枯草芽孢杆 菌等。乳酸菌和酵母菌主要通过菌体对毒素的吸附作用,使毒素在通过胃肠 道时不被吸收,直接排出体外。这种吸附作用存在可逆性,在一定条件下会 解吸附,不是根本意义上的脱毒。枯草芽孢杆菌产生的酶对黄曲霉毒素有一 定的降解作用,但是脱毒效果不稳定且发酵产物适口性差,很难大规模应用。
技术实现要素:
本发明针对上述现有技术存在的不足,提供一种降解黄曲霉毒素B1的菌 株及其应用。
本发明解决上述技术问题的技术方案如下:
一种降解黄曲霉毒素B1的菌株,其保藏编号为CGMCC No.17142。
本发明的第二个目的在于提供上述菌株CGMCC No.17142在降低发霉花 生粕中黄曲霉毒素B1的应用。
本发明的第三个目的在于提供上述菌株的分离方法,步骤如下:
(1)将采集自山东省莱阳市花生种植基地的土壤在无菌生理盐水中摇 床震荡10-20min,制备菌悬液;其中,土壤与无菌生理盐水的用量比为10g: (80-120)mL;
(2)将步骤(1)的菌悬液用无菌生理盐水进行梯度稀释后,涂布在酵 母膏胨葡萄糖琼脂培养基平板上,在35-40℃条件下培养24h;
(3)挑取平板上形态不同的单菌落,采用平板划线法纯化,纯化后的 菌株采用黄曲霉毒素降解实验筛选,得到高效降解黄曲霉毒素B1的菌株 CGMCC No.17142。
其中,步骤(2)中所述的梯度稀释具体操作为:步骤(2)中所述的梯 度稀释具体操作为:取步骤(1)的菌悬液静置5min,取上层清液1mL,用 无菌生理盐水进行逐级稀释10-1、10-2、10-3、10-4、10-5、10-6,取不同稀释 度的菌悬液,分别吸取100μL均匀涂布于培养基平板上。
本发明的第四个目的在于提供一种降解黄曲霉毒素B1的方法,将菌株 CGMCC No.17142的培养液、菌悬液、发酵液或代谢产物,与含有黄曲霉毒素 B1的物料混合。
进一步,菌株CGMCC No.17142用于降低发霉花生粕中黄曲霉毒素B1的 方法,步骤如下:
(1)将污染有黄曲霉毒素B1的花生粕粉碎,与麸皮按照重量比1: (0.1-0.15)混合,高压蒸汽灭菌;
(2)将菌株CGMCC No.17142接种于液体YPD培养基中,在35-40℃条 件下培养24h,作为菌种培养液;
(3)将步骤(2)的菌种培养液按照1-10%的接种量接入冷却后的花生 粕麸皮混合物料,调整料水比为1:(0.5-1),混合均匀;在32-37℃条件 下发酵24h,在40-45℃条件下继续发酵24h,在48-53℃条件下继续发酵 24-36h;将发酵后的物料烘干、粉碎。
【生物保藏说明】
本发明所用的菌株,其保藏编号为CGMCC No.17142;生物材料:LH-F001; 分类命名:鲁梅利杆菌(Rummeliibacillus stabekisii);已于2019年01 月08日保藏于中国微生物菌种保藏管理委员会普通微生物中心,其地址为: 北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。
本发明的有益效果是:
本发明的菌株具有高效降解黄曲霉毒素B1的作用,将其应用于发霉花生 粕中,发酵3-4天,降解率可达到90%以上,脱毒的花生粕中黄曲霉毒素B1含量低于国家限量标准。该菌株作为降解黄曲霉毒素B1的生物材料,可开发 成生物脱毒剂,对饲料、养殖工业具有很好的应用前景。
附图说明
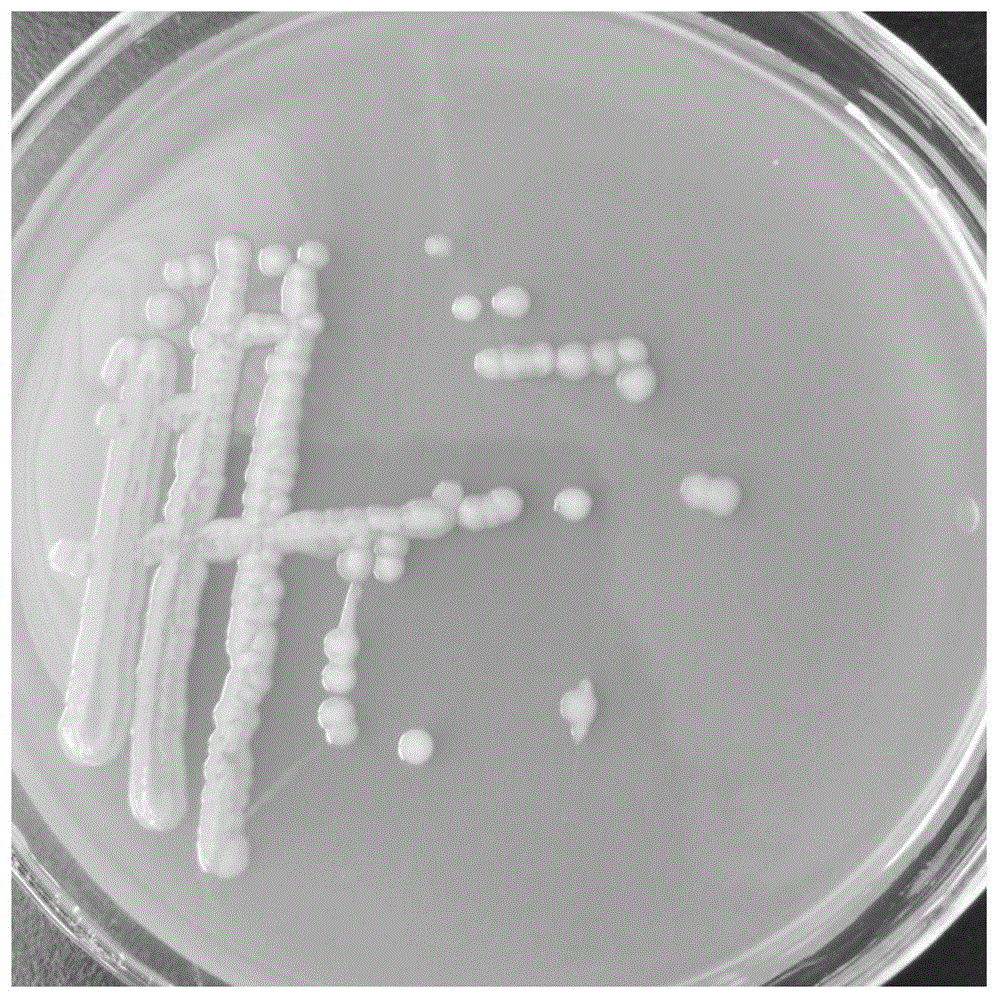
图1示菌株LH-F001的平板培养性状;
图2示黄曲霉毒素标准品(5μg/kg)的高效液相图谱;
图3示发霉花生粕发酵前(上图)、后(下图)黄曲霉毒素B1的高效液 相图谱;
图4示不同发酵时间黄曲霉毒素B1的降解率。
具体实施方式
以下结合实例对本发明的原理和特征进行描述,所举实例只用于解释本 发明,并非用于限定本发明的范围。
实施例1菌株LH-F001的分离与鉴定
一、菌株的分离纯化
(1)将采集自山东省莱阳市花生种植基地的土壤10g在100mL无菌生 理盐水中摇床震荡10-20min,制备菌悬液;
(2)取步骤(1)的菌悬液静置5min,取上层清液1mL,用无菌生理盐 水进行逐级稀释10-1、10-2、10-3、10-4、10-5、10-6,取不同稀释度的菌悬液, 分别吸取100μL均匀涂布于酵母膏胨葡萄糖琼脂培养基平板上,在37℃条 件下培养24h;
(3)挑取平板上形态不同的单菌落,采用平板划线法纯化,纯化后的 菌株采用黄曲霉毒素降解实验筛选,得到高效降解黄曲霉毒素B1的菌株,命 名为LH-F001。
将所得菌株LH-F001在YPD培养基上、在37℃条件下培养24h,见图1, 菌落呈圆形、半透明、边缘整齐。革兰氏染色镜检阳性,菌体有芽孢。
二、菌株的鉴定
提取LH-F001的总DNA,利用细菌16S rDNA通用引物进行PCR扩增,将 扩增产物测序,经NCBI数据库同源序列比对分析,菌株LH-F001与Rummeliibacillus stabekisii strain PP9(2016)(GenBank登录号为 CP014806.1)同源性为100%,判定该菌株为鲁梅利杆菌Rummeliibacillus stabekisii。
实施例2菌株LH-F001在降解黄曲霉毒素B1中的应用
一、菌种培养液
菌株LH-F001接种于液体YPD培养基中,在37℃条件下培养24h,作为 菌种培养液,用于后续黄曲霉毒素B1的降解实验。
二、菌株LH-F001用于降低发霉花生粕中黄曲霉毒素B1的方法,步骤如 下:
(1)取180g污染有黄曲霉毒素B1的花生粕粉碎,加入20g麸皮,混合 均匀后置于1L烧杯中,高压蒸汽灭菌;
(2)将菌株LH-F001接种于液体YPD培养基中,在37℃条件下培养24h, 作为菌种培养液;
(3)将步骤(2)的菌种培养液以10%(v/w)的接种量接入冷却后的花 生粕麸皮混合物料,调整料水比为1:0.6,混合均匀,用8层纱布包裹烧杯 口;将烧杯置于培养箱中,在37℃条件下发酵24h,45℃条件下继续发酵24h, 在50℃条件下继续发酵36h;将发酵后的花生粕烘干、粉碎。
三、检测黄曲霉毒素B1
1、检测方法:称取样品20.00g,使用甲醇:水(体积比6:4)溶液进 行萃取,萃取液经免疫亲和柱净化提取后,用高效液相色谱(柱后碘液衍生) 对样品进行检测。
样品为黄曲霉毒素标准品(5μg/kg)、上述步骤(1)的污染有黄曲霉 毒素B1的花生粕、步骤(3)发酵后的花生粕、对照样品;其中,对照样品 为上述步骤(1)的污染有黄曲霉毒素B1的花生粕不接种菌株LH-F001,调 整料水比为1:0.6,混合均匀,用8层纱布包裹烧杯口;将烧杯置于培养箱 中,在37℃条件下发酵24h,45℃条件下继续发酵24h,在50℃条件下继续 发酵36h所得。
2、检测结果:
步骤(1)的污染有黄曲霉毒素B1的花生粕中黄曲霉毒素B1含量为 219.87μg/kg;步骤(3)发酵后的花生粕中黄曲霉毒素B1含量降低至 15.17μg/kg,降解率达93.1%;对照样品中黄曲霉毒素B1的含量为 197.88μg/kg。
高效液相色谱检测图谱及降解效果见图2、图3。
可见,脱毒后发酵花生粕中黄曲霉毒素B1含量远低于国家对饲料的限量 要求(≤50μg/kg),适合应用于对发霉花生粕中黄曲霉毒素B1的工业化脱 毒处理。
AFB1降解率(%)=(发酵前原料AFB1含量-发酵后残留AFB1含量)/发酵 前原料AFB1含量×100。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明 的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发 明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!