甲醇利用慢型毕赤酵母菌株及其制备方法和应用与流程
本申请涉及基因工程和发酵工程领域,具体而言,涉及一种甲醇利用慢型菌株及其制备方法和应用。
背景技术:
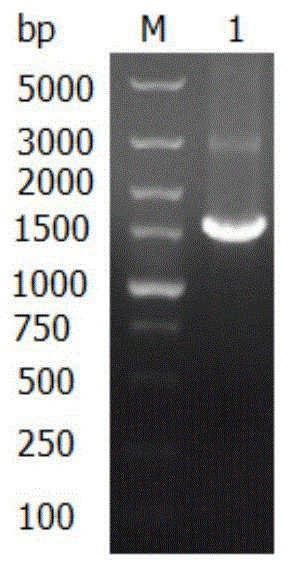
:植酸酶是催化植酸及植酸盐水解成肌醇和无机磷酸盐的一类酶,将其添加到单胃动物植物性饲料中,可以释放植酸中的无机磷以及被植酸络合的Ca2+、Mg2+、Zn2+等矿物质和一些蛋白质,从而解除植酸抗营养作用、提高动物饲料的营养价值,改善动物的生产性能,同时减少了动物粪便中植酸磷的含量,降低了磷对环境的污染程度,因此植酸酶对提高养殖业的经济效益及环保效益具有十分重要意义。作为真核生物,毕赤酵母(Komagataellapastoris,曾用名Pichiapastoris)具有高等真核表达系统的许多优点:如蛋白加工、折叠、翻译后修饰等。不仅如此,操作与E.coli及酿酒酵母同样简单。同为酵母,毕赤酵母具有与酿酒酵母相似的分子及遗传操作优点,且它的外源蛋白表达水平是后者的十倍以至百倍。这些特点使毕赤酵母成为非常有用的蛋白表达系统。毕赤酵母是甲醇营养型酵母,可利用甲醇作为其唯一碳源。甲醇代谢的第一步是:醇氧化酶(AOX)利用氧分子将甲醇氧化为甲醛,生成过氧化氢。为避免过氧化氢的毒性,甲醛代谢主要在一个特殊的细胞器-过氧化物酶体-里进行,使得有毒的副产物远离细胞其余组分。由于醇氧化酶与O2的结合率较低,因而毕赤酵母代偿性地产生大量的酶,过氧化物酶体可以占据细胞内多达80%,醇氧化酶含量可达蛋白的30%。而调控产生醇氧化酶的启动子也正是驱动外源基因在毕赤酵母中表达的启动子。GS115菌株含有aox1基因,这种菌株能快速利用甲醇作为碳源和能源,能在甲醇培养基中以野生型速率生长,因此称为甲醇利用快型菌株(Mut+)。GS115菌株同时含有aox2基因,aox2基因与aox1基因同源性92%,其编码的蛋白与aox1基因编码的蛋白有97%同源性,能缓慢利用甲醇。在实际发酵生产中,甲醇的成本超过整个发酵成本的50%,如果能够降低甲醇用量,则可以降低发酵成本。技术实现要素:本发明提供一种甲醇利用慢型毕赤酵母(Komagataellapastoris)菌株,该菌株命名为appaT75,于2016年1月18日保藏于中国微生物菌种保藏管理中心(CGMCC),保藏地址:北京市朝阳区北辰西路1号院3号,保藏号:CGMCCNo.12056。本发明提供一种前述甲醇利用慢型毕赤酵母菌株在生物发酵领域的应用,具体用于发酵生产植酸酶。进一步的,发酵过程中用氨水将pH值维持在4.5~5.0之间,当甘油耗尽后,流加质量分数为50%的甘油,流加速率为10~20mL/L/h,将菌体湿重维持在220~250g/L,然后开始甲醇诱导,甲醇流速控制在2mL/L/h~3.5mL/L/h之间,期间控制甲醇在培养基中的浓度在0.05%以内,整个发酵过程中通气比为1:1~1:3。进一步的,用本发明的甲醇利用慢型毕赤酵母菌株发酵的方法包括:(1)一级种子罐培养基配方:甘油30g/L~50g/L,磷酸二氢铵30g/L~50g/L,磷酸二氢钾2g/L~5g/L,硫酸钾10g/L~20g/L,硫酸镁5g/L~15g/L,硫酸钙0.5g/L~2g/L,氢氧化钾0.5g/L~2g/L,PTM14.37g/L;接种量0.5%~2%,通气量40m3/h,搅拌转速300rpm,培养过程中pH值维持在5.0;培养周期15~25h,待甘油耗尽,溶氧回升后移种二级种子罐;(2)二级种子罐培养基配方:甘油30g/L~50g/L,磷酸二氢铵30g/L~50g/L,磷酸二氢钾2g/L~5g/L,硫酸钾10g/L~20g/L,硫酸镁5g/L~15g/L,硫酸钙0.5g/L~2g/L,氢氧化钾0.5g/L~2g/L,PTM14.37g/L;培养周期10~15h,待甘油耗尽,溶氧回升后移种发酵罐;接种量10%,通气量400m3/h,搅拌转速为200rpm,培养过程中pH值维持在5.0.培养周期为8~12h,待甘油耗尽,溶氧回升后移种发酵罐;(3)发酵罐培养基配方:甘油30g/L~50g/L,磷酸二氢铵30g/L~50g/L,磷酸二氢钾2g/L~5g/L,硫酸钾10g/L~20g/L,硫酸镁5g/L~15g/L,硫酸钙0.5g/L~2g/L,氢氧化钾0.5g/L~2g/L,PTM14.37g/L;发酵过程中用氨水将pH值维持在4.5~5.0之间,培养温度29~30℃之间,当甘油耗尽后,流加质量分数为50%的甘油,流加速率为10~20mL/L/h,将菌体湿重维持在220~250g/L,然后开始甲醇诱导,甲醇流速控制在2mL/L/h~3.5mL/L/h之间,期间控制甲醇在培养基中的浓度在0.05%以内;整个发酵过程中搅拌转速为130rpm,通气比为1:1~1:3;整个发酵过程采用循环水进行降温。本发明通过同源重组的方法敲除aox1基因以改变菌体利用甲醇的速度。在实际发酵生产中,本发明的菌株发酵能力与原有菌株接近,但生产能耗大幅降低,整个发酵过程中冰机成本降低10%~12%,甲醇成本降低10%~12%,单罐发酵成本降低约20%~24%,可用于植酸酶的高效生产。附图说明图1是KanMX片段扩增结果电泳图,其中M代表DL5000DNAMarker,序号1代表KanMX片段;图2是AA片段扩增结果电泳图,其中M代表DL5000DNAMarker,序号1代表HindIII和BamHI双酶切后的pUC19质粒;序号2代表AA片段;图3是BB片段琼扩增结果电泳图,其中M代表DL5000DNAMarker,序号1代表BB片段;图4是重组质粒的酶切验证结果电泳图,其中M代表DL5000DNAMarker,图A中序号1为质粒pUC-A用KpnI和EcoRI双酶切结果;图B中序号1为质粒pUC-AB用BamHI和KpnI双酶切结果;图C中序号1为质粒pUC-AKB用BamHI和KpnI双酶切结果;图5是AA-KanMX-BB片段扩增结果电泳图,其中M代表DL5000DNAMarker,序号1代表AA-KanMX-BB基因片段;图6是以Δ上游/Δ下游引物筛选验证重组菌株电泳图,其中M代表DL5000DNAMarker,序号1代表以重组菌株Δ2基因组为PCR模板扩增结果,序号2代表以appaT菌株基因组为PCR模板扩增结果;图7是以a-因子引物/3'AOX引物验证重组菌株的植酸酶基因电泳图,其中M代表DL5000DNAMarker,序号1代表以Δ2菌株基因组为PCR模板扩增结果,序号2代表以appaT菌株基因组为PCR模板扩增结果。具体实施方式下列实施例中未注明具体条件的实验方法,通常按照常规条件,如《分子克隆实验指南》(MolecularCloning:ALaboratoryManual,2002)中所述的条件进行。本发明的实施例中使用了以下菌株和质粒:appaT菌株:一株毕赤酵母菌株,作为构建甲醇利用慢型毕赤酵母菌株的出发菌株和受体菌,实验室保存。pUC19质粒:用于构建重组质粒,由天津科技大学郭学武老师赠送。大肠杆菌DH5a感受态细胞:重组质粒导入DH5a中,完成质粒的扩增,实验室保存。下述实施例及其具体说明用于解释本发明,并不构成对本发明的不当限定。实施例1甲醇利用慢型毕赤酵母菌株的构建方法1.构建重组质粒pUC-AKB1.1目的片段的获得表1引物序列引物名称序列(5′→3′)序列表中编号酶切位点AA-UCCCAAGCTTATTACACCCGAACATCACSEQID№:1HindIIIAA-DCGCGGATCCATCAGCAGTATTCCCACCSEQID№:2BamHIBB-UCGGGGTACCGACCTCTAATGCCTACGGSEQID№:3KpnIBB-DCCGGAATTCCACGGACAAGTCACCAACSEQID№:4EcoRIK-UCGCGGATCCCAGCTGAAGCTTCGTACGCSEQID№:5BamHIK-DCGGGGTACCGCATAGGCCACTAGTGGATCTGSEQID№:6KpnIΔ上游CAGACTAAACTGGCTGACGSEQID№:7Δ下游CTACAAACCCTACATACCTCSEQID№:8a-因子引物CTACTATTGCCAGCATTGCTGCTSEQID№:93'AOX引物GAGGATGTCAGAATGCCATTTGCCSEQID№:10设计一对验证引物K-U和K-D,具体引物序列参见表1。以appaT菌株基因组为模板,利用引物K-U和K-D未扩增出Kan抗性片段,表明appaT菌株不含有卡那霉素抗性基因(KanMX)。以质粒pUG6基因组为模板,利用引物K-U和K-D扩增KanMX基因片段,其电泳图如图1所示,所得KanMX片段大小为1613bp。根据NCBI上已知的aox1基因及上下游基因序列,设计两对引物,一对为AA-U和AA-D,另一对为BB-U和BB-D,具体引物序列参见表1。以appaT基因组为模板,利用引物AA-U和AA-D扩增AA片段(即aox1基因启动子的一部分,作为同源重组片段的上游同源臂),其电泳图如图2所示,所得AA片段大小为403bp。利用引物BB-U和BB-D扩增BB片段(即aox1基因自身的一部分片段,作为同源重组片段的下游同源臂),其电泳图如图3所示,所得BB片段大小为331bp。1.2.重组质粒的构建与验证1.2.1重组质粒pUC-A构建与验证将pUC19质粒(2686bp)和AA片段用HindIII和BamHI双酶切后,用DNA连接酶进行连接,并转化大肠杆菌DH5a感受态细胞。提取大肠杆菌中的质粒,对重组质粒进行HindIII和BamHI双酶切验证,其电泳图如图4A所示,得到片段大小分别是2686bp和403bp,证明重组质粒pUC-A构建成功。1.2.2重组质粒pUC-AB构建与验证将BB片段与pUC-A质粒用KpnI和EcoRI双酶切,用DNA连接酶进行连接,并转化大肠杆菌DH5a感受态细胞。提取大肠杆菌中的质粒,对重组质粒进行KpnI和EcoRI双酶切验证,其电泳图如图4B所示,得到片段大小分别为3089bp和331bp,证明重组质粒pUC-AB构建成功。1.2.3重组质粒pUC-AKB构建与验证将KanMX片段与pUC-AB质粒用BamHI和KpnI双酶切,用DNA连接酶进行连接,并转化大肠杆菌DH5a感受态细胞。提取大肠杆菌中的质粒,对重组质粒进行BamHI和KpnI双酶切验证,其电泳图如图4C所示,得到片段大小分别为3420bp和1613bp,证明重组质粒pUC-AKB构建成功。2.重组片段的获得以重组质粒pUC-AKB为模板,以AA-U和BB-D为引物,扩增片段AA-KanMX-BB片段,其电泳图如图5所示,片段大小为2347bp。3重组菌株的构建和验证3.1.毕赤酵母感受态的制备(1)挑取毕赤酵母(所用毕赤酵母为appaT菌株)受体菌的单菌落于5mLYPD液体培养基中,30℃,200rpm摇床培养16h。(2)以1%接种量转接到100mLYPD液体培养基,30℃,200rpm摇床培养至OD600为1.3-1.5。(3)将所得培养液4℃,5000rpm离心5min,弃上清。(4)用100mL预冷的无菌水将菌体重悬。(5)重复步骤(3)。(6)用50mL预冷的无菌水将菌体重悬。(7)重复步骤(3)。(8)用20mL,1mol/L山梨醇洗涤1次,重复步骤(3)。(9)沉淀溶于200uL,1mol/L山梨醇,以备转化。3.2.毕赤酵母的转化在80uL毕赤酵母感受态细胞中加入待转化片段(即步骤2所得重组片段)1-5ug,冰上放置15min。迅速转入0.2cm电击杯中,电击参数1500V,200Ω,25uF,电击时间5s,电击后向电击杯中迅速加入900uL山梨醇(山梨酸的浓度1mol/L),30℃静置培养1h,涂平板(含G418,1mg/ml)。3.3重组菌株构建结果验证3.3.1将电击转化的毕赤酵母重组菌株,通过G418抗性(具有KanMX的酵母菌株表现为一定浓度的G418抗性)进行筛选。再以Δ上游(KanMX基因的675bp处)和Δ下游(染色体上aox1基因下游744bp处)为引物进行PCR筛选验证,以appaT菌株基因组做对照。如图6所示,以Δ上游和Δ下游为引物,以appaT菌株基因组为模板,没有PCR产物;重组菌株Δ2因发生了同源重组,以Δ上游和Δ下游为引物能扩增出2206bp条带。3.3.2同时,以a-因子引物和3'AOX为引物(植酸酶基因的前端为a-因子序列,后端为3'AOX序列)进行PCR筛选验证,以appaT菌株基因组做对照。如图7所示,以appaT菌株基因组为PCR模板PCR产物大小为1.4kb左右,以Δ2菌株基因组为PCR模板PCR产物大小为1.4kb左右,说明植酸酶基因在基因组上,没有被替换掉。证明重组菌株构建正确。将构建正确的重组菌株Δ2命名为appaT75,于2016年1月18日保藏于中国微生物菌种保藏管理中心(CGMCC),保藏号:CGMCCNo.12056。4.重组菌株摇瓶发酵结果将得到的重组菌株Δ2、appaT菌株分别在G418平板中三区划线,挑取平板上的单菌落,接种到30mLYPD液体培养基中,进行种子活化。取500uL种子液,接种到50mLBMGY种子培养基中,30℃,200rpm培养20h,将培养液离心,弃上清,将菌体转接到25mLBMMY发酵培养基中(含0.5%甲醇),每间隔24h,向培养基中加入0.5%的甲醇,培养68h。发酵结果见下表2:表2重组菌株摇瓶发酵结果从表2中可以看出,重组菌株Δ2与appaT菌株的生产植酸酶的性能并不相同,appaT菌株发酵68小时,酶活为557U/mL,而Δ2菌株酶活为621U/mL,是appaT酶活的1.11倍。考虑菌体湿重对酶活的影响,计算可得Δ2菌株的比酶活是appaT菌株的1.38倍。说明Δ2菌株有较好的发酵性能。实施例2重组菌株发酵生产一级种子罐培养基配方:甘油30g/L,磷酸二氢铵30g/L,磷酸二氢钾2g/L,硫酸钾10g/L,硫酸镁5g/L,硫酸钙0.5g/L,氢氧化钾0.5g/L,PTM14.37g/L。培养条件:接种量0.5%,通气量40m3/h,搅拌转速300rpm,培养过程中pH值维持在5.0。培养周期25h。种子成熟后,全部移种二级种子罐。二级种子罐培养基配方:甘油30g/L,磷酸二氢铵30g/L,磷酸二氢钾2g/L,硫酸钾10g/L,硫酸镁5g/L,硫酸钙0.5g/L,氢氧化钾0.5g/L,PTM14.37g/L。培养条件:接种量10%,通气量400m3/h,搅拌转速200rpm,培养过程中pH值维持在5.0。培养周期8h,种子成熟后全部移种发酵罐。发酵罐培养基配方:甘油30g/L,磷酸二氢铵30g/L,磷酸二氢钾2g/L,硫酸钾10g/L,硫酸镁5g/L,硫酸钙0.5g/L,氢氧化钾0.5g/L,PTM14.37g/L。培养条件:发酵过程中用氨水将pH值维持在4.5,培养温度29℃,当甘油耗尽后,流加质量分数为50%的甘油,流加速率为15mL/L/h,将菌体湿重维持在220g/L,然后开始甲醇诱导,甲醇流速控制在2.5mL/L/h。整个发酵过程中通气比维持在1:1.5,搅拌转速为130rpm。诱导160h,放罐酶活在21500U/mL,放罐菌体湿重在320g/L,整个发酵过程中甲醇用量约为18t。该菌株发酵能力同原有菌株接近,但生产能耗大幅降低,整个发酵过程中冰机成本降低3万元,甲醇成本降低3万元,单罐发酵成本降低约6万元。实施例3一级种子罐培养基配方:甘油:40g/L,磷酸二氢铵:50g/L,磷酸二氢钾5g/L,硫酸钾20g/L,硫酸镁15g/L,硫酸钙2g/L,氢氧化钾2g/L,PTM14.37g/L。培养条件:接种量2%,通气量40m3/h,搅拌转速300rpm,培养过程中pH值维持在5.0。培养周期19h。种子成熟后,全部移种二级种子罐。二级种子罐培养基配方:甘油:40g/L,磷酸二氢铵:50g/L,磷酸二氢钾5g/L,硫酸钾20g/L,硫酸镁15g/L,硫酸钙2g/L,氢氧化钾2g/L,PTM14.37g/L。培养条件:接种量10%,通气量400m3/h,搅拌转速200rpm,培养过程中pH值维持在5.0。培养周期9h,种子成熟后全部移种发酵罐。发酵罐培养基配方:甘油:50g/L,磷酸二氢铵:50g/L,磷酸二氢钾5g/L,硫酸钾20g/L,硫酸镁15g/L,硫酸钙2g/L,氢氧化钾2g/L,PTM14.37g/L。培养条件:发酵过程中用氨水将pH值维持在5.0,培养温度29℃,当甘油耗尽后,流加质量分数为50%的甘油,流加速率为20mL/L/h,将菌体湿重维持在250g/L,然后开始甲醇诱导,甲醇流速控制在3.5mL/L/h。整个发酵过程中通气比维持在1:1.8,搅拌转速为140rpm。诱导160h,放罐酶活在24500U/mL,放罐菌体湿重在380g/L,整个发酵过程中甲醇用量20t。该工艺新菌株发酵能力比原有菌株略有提高,但生产能耗大幅降低,整个发酵过程中冰机成本降低2.5万元,甲醇成本降低2.5万元,单罐发酵成本降低约5万元。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 用甲醇酵母(Pichia Pastoris)生产神经营养素-3(NT-3)的方法及应用的制作方法
- Brca1诱导剂吲哚-3-甲醇在制备放射损伤防护药物中的应用的制作方法
- 高效表达d-氨基酸氧化酶的甲醇酵母
- 一种重组Mut<sup>s</sup>型甲醇营养型毕赤酵母生产脂肪酶的方法
- 杂色云芝漆酶在甲醇毕赤酵母中异源表达发酵工艺的制作方法
- 抗内毒素短肽在毕氏酵母中的诱导表达方法、表达的抗内毒素短肽及应用的制作方法
- 诱导提高生防酵母对果实病害防治效力方法及所用培养基的制作方法
- 可利用非甲醇碳源诱导aox1启动子表达外源蛋白的毕赤酵母菌株的制作方法
- 用甲醇酵母(Pichia pastoris)生产人脑源性神经营养因子BDNF的方法及应用的制作方法
- 一种用甲醇酵母制备抑肽酶衍生物的新方法