一种水溶性雷公藤甲素衍生物及其制备方法和用途与流程
本发明涉及医药技术领域,尤其涉及一种水溶性雷公藤甲素衍生物及其制备方法和用途。
背景技术:
雷公藤甲素又称雷公藤内酯醇,是从卫矛科雷公藤属植物中分离出来的一种环氧二萜内酯化合物,是传统中药植物雷公藤的主要活性成分,具有抗炎、免疫抑制、抗生育和抗肿瘤等作用。雷公藤甲素抗肿瘤作用引起了广泛关注。在低浓度条件下(~nm),雷公藤甲素不仅能抑制肿瘤生长,而且还能增强多种化疗药物的抗肿瘤效应。雷公藤甲素水溶性差,治疗窗窄,对消化系统、泌尿生殖系统和血液系统等有较大的毒副作用,限制了其在临床上的研究和开发。
技术实现要素:
本发明通过前药原理在雷公藤甲素的19位游离羟基上引入醌丙酰基后得到的衍生物。化合物结构上引入羧基,增加了化合物在水中的溶解度。此外由于肿瘤组织中醌氧化还原酶(nad(p)h:quinoneoxidoreductase-1,nqo1)相较于正常组织大量表达。因此药物经吸收分布后,在肿瘤组织中可以经noq1还原后自发水解成雷公藤甲素,提高了药物的选择性,从而降低雷公藤甲素对正常组织的毒性。具备良好的临床发展前景。
(如下所示):
本发明采取的技术方案是:
本发明的水溶性雷公藤甲素衍生物的化学结构式如下式(i)所示:
其中:n=2,3,4……,n为大于1的正整数。
本发明的水溶性雷公藤甲素衍生物的制备方法的合成路线如下:
所述方法的具体步骤如下:
(1)化合物1(香豆素衍生物)的合成:以氢醌类化合物为反应原料,加入摩尔数为1-2倍的丙烯酸衍生物,在50-100℃的条件下进行反应,反应时间为2-24小时,反应使用的溶剂为甲基磺酸。反应完毕后,依次用乙酸乙酯萃取,纯水,饱和碳酸氢钠水溶液以及饱和盐水洗涤,无水硫酸钠干燥,减压蒸干,用氯仿-正己烷重结晶得到目的化合物。
(2)化合物2的合成:以第一步反应得到的香豆素衍生物为原料,加入摩尔数1-3倍的溴水,在25℃的条件下反应24小时,反应溶剂为乙酸。反应完毕后减压蒸干,残留物通过二氯甲烷进行萃取,水洗,无水硫酸钠干燥,减压蒸干得到目的化合物。
(3)化合物3的合成:以第二步产物和甲醇为原料,于0℃加入摩尔1.5-3倍的二氯亚砜,在25℃条件下反应1-3小时。用吸附剂为固定相进行分离纯化,洗脱液经回收干燥得到化合物3。
(4)化合物4的合成:在化合物3的甲醇溶液中,分多次加入摩尔2.5-5倍量的叠氮化钠水溶液,室温反应24小时后减压蒸干,残留物通过二氯甲烷进行萃取,水洗,无水硫酸钠干燥,用吸附剂为固定相进行分离纯化,洗脱液经回收干燥得到化合物4。
(5)化合物5的合成:化合物4溶于二氯甲烷中,分多次加入等摩尔量的三苯基膦反应1小时,减压除去溶剂后,加入含乙酸的四氢呋喃的水溶液加热回流4小时后减压蒸干,残留物通过乙酸乙酯进行萃取,饱和nahco3和盐水洗涤,无水硫酸钠干燥,用吸附剂为固定相进行分离纯化,洗脱液经回收干燥得到化合物5。
(6)化合物6的合成:在化合物5的甲醇水溶液中加入摩尔2-4倍的氢氧化锂,于室温反应24小时后,减压除去甲醇,调节水溶液ph至2.0,过滤,得到化合物6。
(7)化合物7的合成:在化合物6的二氯甲烷溶液中加入摩尔2倍的boc酸酐,于室温反应4小时后,减压除去二氯甲烷,用吸附剂为固定相进行分离纯化,洗脱液经回收干燥得到化合物7。
(8)化合物8的合成:以雷公藤甲素为原料,加入摩尔数为1.5-2倍的化合物7和1-4倍摩尔比的二环己基碳二亚胺(dcc)以及催化当量的4-二甲氨基吡啶(dmap),在20-60℃条件下反应,反应48小时后减压蒸干,残留物通过乙酸乙酯进行萃取,水洗,无水硫酸钠干燥,用吸附剂为固定相进行分离纯化,洗脱液经回收干燥得到化合物8。
(9)化合物9的合成:在化合物8的二氯甲烷溶液中加入三氟乙酸(tfa)于室温反应4-8小时后,用吸附剂为固定相进行分离纯化,洗脱液经回收干燥得到化合物9。
(10)化合物10的生物合成:在化合物9的二氯甲烷溶液中缓慢滴加烷烃二酸,于65℃反应2-4小时后,减压除去二氯甲烷,调节水溶液ph至2.0,过滤,得到化合物10。
式(ii)。
进一步地,上述技术方案,步骤(1)所述氢醌类化合物为2,3,5位被-ch3,nh2,och3,x等取代的对苯二酚类化合物。
进一步地,上述技术方案,步骤(1)所述丙烯酸衍生物为β位上的氢原子被1-2个甲基或氨基取代的烯酸类化合物,优选为3-甲基-2-丁烯酸或丙烯酸。
进一步地,上述技术方案,步骤(10)所述烷烃二酸为丙二酸酐、丁二酸酐、戊二酸酐、己二酸酐、庚二酸酐、或辛二酸酐等中的任一种。该步骤中所述氢醌类化合物上的氨基与所述烷烃二酸形成酰胺键。
本发明的水溶性雷公藤甲素衍生物可以用于制备抗肿瘤药物。
一种抗肿瘤药物,所述抗肿瘤药物包括本发明上述所述的水溶性雷公藤甲素衍生物。
本发明的积极效果如下:
本发明通过在雷公藤甲素游离的羟基上引入醌丙酸结构。由于化合物结构上含有一游离的羧基,方便化合物成盐,提高了化合物的水溶性。同时肿瘤组织中醌氧化还原酶(nad(p)h:quinoneoxidoreductase-1,nqo1)相较于正常组织大量表达。因此药物经吸收分布后,在肿瘤组织中可以还原后自发水解成雷公藤甲素,提高了药物的选择性,从而降低雷公藤甲素对正常组织的毒性。本发明在保持雷公藤甲素生物活性的前提下,降低雷公藤甲素的毒副作用,使雷公藤甲素能够安全有效地应用于临床。
附图说明
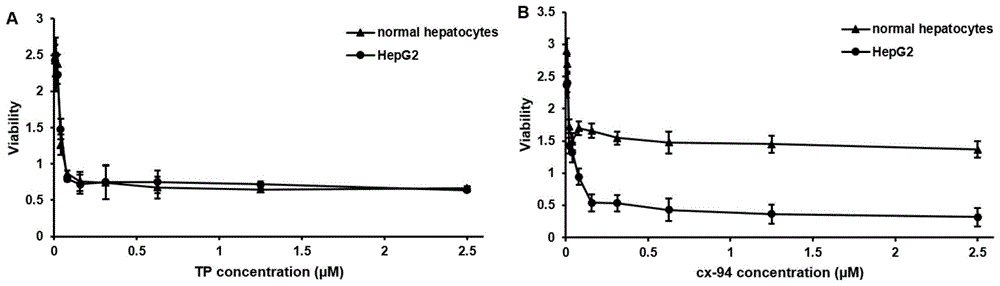
图1.(a)tp对hepg2细胞的药理活性和对正常肝细胞的毒性,(b)cx-94对hepg2细胞的药理活性和对正常肝细胞的毒性。(n=6)
图2.cx-94与hepg2细胞匀浆液温孵0h(a)和1h(b)后色谱图。(c)cx-94代谢转化生成xc-01与tp。
图3.cx-94在人肝微粒体(a)和人血浆(b)中的代谢稳定性(n=3)。
图4.icr小鼠体内尾静脉注射给予1.5mg/kgcx-94后雷公藤甲素和cx-94平均血药浓度-时间曲线(n=6)。
具体实施方式
下面的实施例是对本发明的进一步详细描述。
实施例1
本实施例的水溶性雷公藤甲素衍生物的制备方法具体包括如下步骤:
(1)1.0g(6.58mmol)氢醌与0.54g(7.50mmol)丙烯酸混合后一次性加入到10ml甲烷基磺酸,于70℃加热搅拌18h,tlc检测反应完全,停止搅拌,加入125ml水,依次用乙酸乙酯萃取,纯水,饱和碳酸氢钠水溶液以及饱和盐水洗涤,无水硫酸钠干燥,减压蒸干。用氯仿-正己烷重结晶,得到黄色固体即为化合物xc-01,收率约为67%。[m+h]+:221.0;1hnmr,600mhz(cdcl3)δ6.45(q,1h),3.04(s,2h),1.96(m,3h),1.92(m,3h),1.41(s,6h)。
(2)1.1g(5mmol)步骤(1)的化合物溶于40ml乙酸溶液中;取0.57ml(11mmol)溴水滴加入上述溶液中于室温搅拌反应24小时后,减压蒸干,残留物通过二氯甲烷进行萃取,水洗,无水硫酸钠干燥,减压蒸干得到黄色固体化合物。收率约为70%。[m-h]-:313.0;1hnmr(600mhz,cdcl3)δ3.04(s,2h),2.19(s,3h),2.16(s,3h),1.44(s,6h)。
(3)每1.2g(3.9mmol)步骤(2)得到的黄色固体化合物溶于12ml甲醇中,在冰浴中慢慢滴加0.56ml(8mmol)二氯亚砜,滴加完毕于室温继续搅拌3小时后减压蒸干,残留物通过吸附剂为固定相进行分离纯化,洗脱液经回收干燥得到黄色固体化合物。收率约为64%。[m+h]+:329;1hnmr(600mhz,cdcl3)δ3.56(s,3h),2.98(s,2h),2.14(s,3h),2.14(s,3h),1.43(s,6h)。
(4)每1.44g(4.36mmol)步骤(3)得到的黄色固体化合物溶于15ml甲醇溶液中;取0.85g(13.1mmol)叠氮化钠化合物溶于5ml水中,分多次加入上述溶液中于室温反应24小时后减压蒸干,残留物通过二氯甲烷进行萃取,水洗,无水硫酸钠干燥,用吸附剂为固定相进行分离纯化,洗脱液经回收干燥得到黄色固体化合物。收率约为85%。[m+h]+:292.0;1hnmr(500mhz,cdcl3)δ3.63(s,3h),2.99(s,2h),2.16(s,3h),1.89(s,3h),1.41(s,6h)。
(5)每1.22g(4.17mmol)步骤(4)得到的化合物溶于25ml二氯甲烷中;分多次加入1.1g(4.17mmol)三苯基膦于室温反应1小时后,减压除去溶剂。加入含15ml乙酸,15ml四氢呋喃的水溶液加热回流4小时后减压蒸干,残留物通过乙酸乙酯进行萃取,饱和nahco3和盐水洗涤,无水硫酸钠干燥,用吸附剂为固定相进行分离纯化,洗脱液经回收干燥得到红色固体化合物。收率约为60%。[m+h]+:266.0;1hnmr(600mhz,cdcl3)δ4.61(s,2h),3.56(s,3h),2.94(s,2h),2.19(s,3h),1.84(s,3h),1.43(s,6h)。
(6)每1.3g(4.9mmol)步骤(5)得到的红色固体化合物溶于16ml甲醇和4ml水的混合溶液中;通过加入360mg(15mmol)氢氧化锂于室温反应24小时后,减压除去甲醇,调节水溶液ph至2.0,过滤,得到紫色固体化合物。收率约为90%。[m+h]+:252.0;1hnmr,600mhz,(cdcl3)δ11.98(s,1h),6.32(s,2h),2.80(s,2h),2.07(s,3h),1.72(s,3h),1.35(s,6h)。
(7)每1.26g(5.0mmol)紫色固体化合物溶于15ml二氯甲烷中;通过滴加2.18g(10.0mmol)的(boc)2o酸酐于室温反应4小时后,减压除去二氯甲烷,用吸附剂为固定相进行分离纯化,洗脱液经回收干燥得到紫色固体化合物。收率约为82%。[m+h]+:352.0;1hnmr,600mhz,(cdcl3)δ11.98(s,1h),6.31(s,1h),2.82(s,2h),2.07(s,3h),1.72(s,3h),1.44(s,9h),1.37(s,6h)。
(8)每527mg(1.5mmol)步骤(7)得到的紫色固体对应物和360mg(1mmol)雷公藤甲素溶于15ml二氯甲烷中,通过加入824mg(4mmol)dcc和127mg(1mmol)dmap于60℃下搅拌48h,反应完毕后过滤,收集滤液,滤液挥干,乙酸乙酯复溶,过滤,滤液挥干得到紫色固体化合物。收率约为30%。[m+h]+:695.0;1hnmr,600mhz(cdcl3)δ6.39(s,1h),5.30(s,1h),4.97(s,1h),4.19(d,2h),3.84(d,1h),3.56(d,1h),3.49(d,1h),3.02(s,2h),2.65(m,1h),2.24(s,3h),2.12(m,2h),1.99(s,3h),1.97(s,3h),1.86(m,2h),1.55(m,1h),1.49(s,3h),1.46(s,9h),1.22(m,1h),1.01(s,3h),0.90(d,3h),0.80(d,3h)。
(9)每694mg(1mmol)步骤(8)得到的紫色固体对应物溶于15ml二氯甲烷中,通过加入5mltfa于室温搅拌4-8小时,减压除去二氯甲烷,用吸附剂为固定相进行分离纯化,洗脱液经回收干燥得到紫色固体化合物。收率约为67%。[m+h]+:594.0;1hnmr,600mhz(cdcl3)δ6.34(s,2h),5.30(s,1h),4.97(s,1h),4.19(d,2h),3.84(d,1h),3.56(d,1h),3.49(d,1h),3.02(s,2h),2.65(m,1h),2.16(s,3h),2.12(m,2h),1.96(s,3h),1.94(s,3h),1.86(m,2h),1.55(m,1h),1.49(s,3h),1.22(m,1h),1.01(s,3h),0.90(d,3h),0.80(d,3h)。
(10)每594mg(1mmol)步骤(9)得到的紫色固体对应物溶于15ml二氯甲烷中,通过加入5ml缓慢滴加150mg(1.5mmol)丁二酸酐,于65℃反应2-4小时后,减压除去二氯甲烷,用吸附剂为固定相进行分离纯化,洗脱液经回收干燥得到紫色固体化合物。收率约为67%。[m-h]-:692.0;1hnmr,600mhz(cdcl3)δ6.38(s,1h),5.31(s,1h),4.99(s,1h),4.19(d,2h),3.84(d,1h),3.57(d,1h),3.49(d,1h),3.12(s,2h),2.64(m,1h),2.42(s,4h),2.19(s,3h),2.14(m,2h),1.96(s,3h),1.91(s,3h),1.86(m,2h),1.54(m,1h),1.49(s,3h),1.22(m,1h),1.15(s,3h),0.90(d,3h),0.81(d,3h)。
(11)每594mg(1mmol)步骤(9)得到的紫色固体对应物溶于15ml二氯甲烷中,通过加入5ml缓慢加入171mg(1.5mmol)戊二酸酐,于65℃反应2-4小时后,减压除去二氯甲烷,用吸附剂为固定相进行分离纯化,洗脱液经回收干燥得到紫色固体化合物。收率约为67%。[m-h]-:706.0;1hnmr,600mhz(cdcl3)δ6.39(s,1h),5.34(s,1h),4.97(s,1h),4.29(d,2h),3.86(d,1h),3.59(d,1h),3.49(d,1h),3.12(s,2h),2.65(m,1h),2.46(s,4h),2.18(s,3h),2.12(m,2h),2.06(s,3h),1.97(s,3h),1.92(s,2h),1.86(m,2h),1.55(m,1h),1.49(s,3h),1.24(m,1h),1.21(s,3h),0.92(d,3h),0.84(d,3h)。
实施例2
本实施例的水溶性雷公藤甲素衍生物的制备方法具体包括如下步骤:
(1)每1.0g(6.58mmol)氢醌对应与0.85g(7.50mmol)3-甲基-2-丁烯酸混合后一次性加入到10ml甲烷基磺酸,于70℃加热搅拌4h,tlc检测反应完全,停止搅拌,加入125ml水,依次用乙酸乙酯萃取,水,饱和碳酸氢钠水溶液以及饱和盐水洗涤,无水硫酸钠干燥,减压蒸干,用氯仿-正己烷重结晶,得到黄色固体。[m+h]+:221.0;1hnmr,600mhz(cdcl3)δ6.45(q,1h),3.04(s,2h),1.96(m,3h),1.92(m,3h),1.41(s,6h)。
(2)6.6g(30mmol)步骤(1)的化合物溶于200ml乙酸溶液中;取3.4ml(66mmol)溴水滴加入上述溶液中于室温搅拌反应24小时后,减压蒸干,残留物通过二氯甲烷进行萃取,水洗,无水硫酸钠干燥,减压蒸干得到黄色固体化合物。[m-h]-:313.0;1hnmr(600mhz,cdcl3)δ3.04(s,2h),2.19(s,3h),2.16(s,3h),1.44(s,6h)。
(3)每4.88g(15.5mmol)步骤(2)得到的黄色固体化合物溶于50ml甲醇中,在冰浴中慢慢滴加2.25ml(31mmol)二氯亚砜,滴加完毕于室温继续搅拌3小时后减压蒸干,残留物通过吸附剂为固定相进行分离纯化,洗脱液经回收干燥得到黄色固体化合物。[m+h]+:329;1hnmr(600mhz,cdcl3)δ3.56(s,3h),2.98(s,2h),2.14(s,3h),2.14(s,3h),1.43(s,6h)。
(4)每2.87g(8.72mmol)步骤(3)得到的黄色固体化合物溶于30ml甲醇溶液中;取1.7g(26.2mmol)叠氮化钠化合物溶于10ml水中,分多次加入上述溶液中于室温反应24小时后减压蒸干,残留物通过二氯甲烷进行萃取,水洗,无水硫酸钠干燥,用吸附剂为固定相进行分离纯化,洗脱液经回收干燥得到黄色固体化合物。[m+h]+:292.0;1hnmr(500mhz,cdcl3)δ3.63(s,3h),2.99(s,2h),2.16(s,3h),1.89(s,3h),1.41(s,6h)。
(5)每2.43g(8.35mmol)步骤(4)得到的化合物溶于50ml二氯甲烷中;分多次加入2.19g(8.35mmol)三苯基膦于室温反应1小时后,减压除去溶剂。加入含30ml乙酸,30ml四氢呋喃的水溶液加热回流4小时后减压蒸干,残留物通过乙酸乙酯进行萃取,饱和nahco3和盐水洗涤,无水硫酸钠干燥,用吸附剂为固定相进行分离纯化,洗脱液经回收干燥得到红色固体化合物。[m+h]+:266.0;1hnmr(600mhz,cdcl3)δ4.61(s,2h),3.56(s,3h),2.94(s,2h),2.19(s,3h),1.84(s,3h),1.43(s,6h)。
(6)每1.3g(4.9mmol)步骤(5)得到的红色固体化合物溶于16ml甲醇和4ml水的混合溶液中;通过加入360mg(15mmol)氢氧化锂于室温反应24小时后,减压除去甲醇,调节水溶液ph至2.0,过滤,得到紫色固体化合物。[m+h]+:252.0;1hnmr,600mhz,(cdcl3)δ11.98(s,1h),6.32(s,2h),2.80(s,2h),2.07(s,3h),1.72(s,3h),1.35(s,6h)。
(7)每1.26g(5.0mmol)紫色固体化合物溶于15ml二氯甲烷中;通过滴加2.18g(10.0mmol)的boc酸酐于室温反应4小时后,减压除去二氯甲烷,用吸附剂为固定相进行分离纯化,洗脱液经回收干燥得到紫色固体化合物。[m+h]+:352.0;1hnmr,600mhz,(cdcl3)δ11.98(s,1h),6.31(s,1h),2.82(s,2h),2.07(s,3h),1.72(s,3h),1.44(s,9h),1.37(s,6h)。
(8)每527mg(1.5mmol)步骤(7)得到的紫色固体对应物和360mg(1mmol)雷公藤甲素溶于15ml二氯甲烷中,通过加入824mg(4mmol)dcc和127mg(1mmol)dmap于60℃下搅拌48h,反应完毕后过滤,收集滤液,滤液挥干,乙酸乙酯复溶,过滤,滤液挥干得到紫色固体化合物。[m+h]+:695.0;1hnmr,600mhz(cdcl3)δ6.39(s,1h),5.30(s,1h),4.97(s,1h),4.19(d,2h),3.84(d,1h),3.56(d,1h),3.49(d,1h),3.02(s,2h),2.65(m,1h),2.24(s,3h),2.12(m,2h),1.99(s,3h),1.97(s,3h),1.86(m,2h),1.55(m,1h),1.49(s,3h),1.46(s,9h),1.22(m,1h),1.01(s,3h),0.90(d,3h),0.80(d,3h)。
(9)每694mg(1mmol)步骤(8)得到的紫色固体对应物溶于15ml二氯甲烷中,通过加入5mltfa于室温搅拌4小时,减压除去二氯甲烷,用吸附剂为固定相进行分离纯化,洗脱液经回收干燥得到紫色固体化合物。[m+h]+:594.0;1hnmr,600mhz(cdcl3)δ6.34(s,2h),5.30(s,1h),4.97(s,1h),4.19(d,2h),3.84(d,1h),3.56(d,1h),3.49(d,1h),3.02(s,2h),2.65(m,1h),2.16(s,3h),2.12(m,2h),1.96(s,3h),1.94(s,3h),1.86(m,2h),1.55(m,1h),1.49(s,3h),1.22(m,1h),1.01(s,3h),0.90(d,3h),0.80(d,3h)。
(10)每594mg(1mmol)步骤(9)得到的紫色固体对应物溶于15ml二氯甲烷中,通过加入5ml缓慢滴加150mg(1.5mmol)丁二酸酐,于65℃反应2-4小时后,减压除去二氯甲烷,用吸附剂为固定相进行分离纯化,洗脱液经回收干燥得到紫色固体化合物。[m-h]-:692.0;1hnmr,600mhz(cdcl3)δ6.38(s,1h),5.31(s,1h),4.99(s,1h),4.19(d,2h),3.84(d,1h),3.57(d,1h),3.49(d,1h),3.12(s,2h),2.64(m,1h),2.42(s,4h),2.19(s,3h),2.14(m,2h),1.96(s,3h),1.91(s,3h),1.86(m,2h),1.54(m,1h),1.49(s,3h),1.22(m,1h),1.15(s,3h),0.90(d,3h),0.81(d,3h)。
实施例1制得的产物各项性能检测如下:
1.cx-94水溶性检测
称取一定量的cx-94,用乙腈溶解并稀释成一系列浓度梯度的cx-94溶液,通过lc-ms/ms检测cx-94的含量并制备标准曲线;另取一定量的cx-94用水制备成cx-94的过饱和溶液,该饱和溶液用0.22μm的滤膜过滤,收集滤液,采用lc-ms/ms检测cx-94的浓度。结果表明cx-94在水中的溶解度为4.52mg/ml,对比tp在水中的溶解度仅为17μg/ml。目的化合物的水溶性提高了265倍。
2.体外药理活性和毒性检测
分别取冻存的hepg2细胞和正常的肝细胞,复苏,调整细胞密度为按每孔1x105细胞分别接种于96孔板,当细胞融合达60%~70%时,换不含血清培养液培养24h作同步化处理。随后,细胞被随机分阴性对照组,阳性对照组(0.01,0.02,0.04,0.08,0.16,0.31,0.625,1.25,2.5μm雷公藤甲素处理细胞),cx-94(0.01,0.02,0.04,0.08,0.16,0.31,0.625,1.25,2.5μm)给药组。48h后每孔加入5mg/mlmtt20μ1培养4h,弃去上清液,每孔分别加入二甲亚砜150μl,室温下震荡15min,待黄色结晶溶解后,用酶标仪测定570nm处吸光度值(od)。
正常肝细胞给药后结果见图1:不同浓度雷公藤甲素(图1a),cx-94(图1b)分别与正常肝细胞和肝癌细胞温孵后对细胞的毒性。结果显示对比雷公藤甲素(ic50=38.9nm),cx-94(ic50=1250nm)对正常肝细胞毒性分别降低了32倍。表明通过本方法对雷公藤甲素的结构修饰可以降低雷公藤甲素对正常肝细胞的毒性。相同浓度的cx-94和雷公藤甲素对hepg2的ic50分别为38.4nm和36.9nm,表明通过本方法对雷公藤甲素的结构修饰得到的化合物cx-94可以保留雷公藤甲素对hepg2肝癌细胞的药理活性。
3.hepg2细胞裂解液体外代谢转化
人肝癌细胞hepg2细胞用含10%胎牛血清的dmem培养基于37℃,5%co2以及饱和湿度的二氧化碳培养箱内培养。收集对数生长期细胞,pbs洗涤后匀浆,匀浆液于8000×g,4℃离心20min后收集上清液,bca法测细胞裂解液蛋白浓度,于-80℃冰箱储存。
总体积为100μl反应体系中包含10μg/ml的化合物cx-94,1mg/mlhepg2细胞裂解液,1mmnadph,50mmpbs缓冲液。样品体外温孵1h后,通过加于2倍乙腈终止反应。样品通过12000×g,于4℃离心20min后取上清液进样,通过uplc检测雷公藤甲素的生成。结果见图2.cx-94在hepg2裂解液中能被代谢转化生成tp和xc-01。
4.体外代谢稳定性研究
将人肝微粒体与cx-94共温孵,cx-94终浓度为10μm,温孵体系为100μl,包括磷酸盐缓冲液(50mm,ph7.4),肝微粒体(1mg/ml),mgcl2(5mm)。通过加入10μl浓度为20mm的nadph(终浓度为1mm)启始反应,37℃温孵0、5、10、20、30、40及60min后加入200μl乙腈震终止反应。样品漩涡震荡混匀于4℃,12000rpm下离心10min,取上清,lc-ms/ms进样分析。
cx-94(终浓度为10μm)与人血浆于37℃分别温孵0、5、10、20、30、40及60min后加入两倍体积的乙腈后终止反应,样品漩涡震荡混匀于4℃,12000rpm下离心10min,取上清,lc-ms/ms进样分析。结果见图3.cx-94在血浆中和肝微粒体中代谢稳定,其代谢半衰期期大于1小时。
5.小鼠体内药代动力学研究
小鼠尾静脉注射给药(1.5mg/kgcx-94)后分别于2,5,10,20,40min,1,2,3,4,8,18小时心脏取血。取另一组小鼠口服灌胃给与1.5mg/kg的cx-94后分别于10,30min,1,2,3,4,5,6,8,24小时心脏取血。收集的血浆置于已肝素化的1.5mlep管中,于1000g,4℃离心10min,取上清液即得血浆。按体积比加入2倍的乙腈涡旋混合震荡后于12000g,4℃离心10min,取上清进样,lc-ms/ms法检测血浆中cx-94含量。以血浆中化合物浓度为纵坐标,以取血时间为横坐标作图。并计算药代动力学参数。研究结果表明,作为一个前药,cx-94在小鼠体内能很快被代谢转化生成tp。
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
- 还没有人留言评论。精彩留言会获得点赞!