一种具有增强免疫活性的青蛤多糖及其制备方法和应用与流程
本发明涉及活性多糖技术领域,具体涉及一种具有增强免疫活性的青蛤多糖、提取方法及其在增强免疫的功能食品或药品中的应用。
背景技术:
青蛤(cyclinasinensis),又称黑蛤、铁蛤、圆蛤、蛤蜊、牛眼蛤,广泛分布于辽宁、河北、山东、江苏、浙江、福建、广东、广西以及海南岛等地,是我国南北沿海习见和主要的食用双壳贝类,在我国滩涂贝类养殖中占有重要的经济地位。青蛤不但具有食用价值,而且还具有药用价值,是非常重要的海洋药物;《神农本草经》、《本草纲目》等均将青蛤作为一种常用药物收录其中。青蛤具有很高的营养及药用价值,故青蛤资源的开发利用一直受到人们的重视。
现代医学、分子生物学及细胞生物学的发展,使人们认识到免疫系统紊乱不仅会产生诸多疾病,且与人体衰老和中老年人多发病如肿瘤、高血压、糖尿病甚至精神病发生均有密切关系。因此,寻找高效的免疫调节剂已成为当代新药或功能保健品的发展方向之一。诸多的免疫调节剂中,多糖类最为引人注目,多糖具有突出的免疫调节活性,且对机体正常细胞和组织基本没有毒性,可作为开发免疫调节药物及功能性食品的重要来源。但目前具有免疫活性的多糖来源极其有限,因此,亟需开发新的具有高免疫活性的多糖解燃眉之急。
技术实现要素:
本发明的目的在于提供一种青蛤多糖,以青蛤贝肉为原料,通过脱脂、双酶法酶解、季铵盐络合沉淀、纯化等过程制备得到一种多糖成分。主链结构为→4)-α-d-glcp-(1→,1μg/ml的剂量即可增强免疫活性。
为实现上述目的,本发明提供了一种具有增强免疫活性的青蛤多糖,所述青蛤多糖的主链由→4)-α-d-glcp(1→构成,所述青蛤多糖结构中→4)glc(1→和→4,6)glc(1→的比例为6.8:1,分子量为380kda,单糖组成为甘露糖:葡萄糖=1:35。
所述具有增强免疫活性的青蛤多糖的制备方法,包括步骤:
s1、制备脱脂粉:取青蛤肉冻干后破碎成青蛤粉,使用丙酮对所述青蛤粉进行脱脂,干燥得脱脂粉;
s2、酶解:取步骤s1所述脱脂粉,每克脱脂粉中加入2~5ml0.05mol/l的半胱氨酸-edta二钠溶液和15~25ml0.05mol/l、ph=8的k2hpo4缓冲液,再加入胰蛋白酶干粉,37℃、100~150rmp振荡酶解2~5h,得混合溶液1;向所述混合液1中加入木瓜蛋白酶干粉,65℃、100~150rmp振荡酶解1~5h得混合液2;
其中,所述胰蛋白酶的添加量为每克脱脂粉加入1250~7500u的胰蛋白酶;所述木瓜蛋白酶的添加量为每克脱脂粉加入10000~60000u的木瓜蛋白酶;
s3、灭酶:将步骤s2所述混合溶液2加热,使酶失活,冷却到室温,离心取上清液;
s4、络合沉淀:向步骤s3所述上清液中加入质量百分浓度(m/m)0.1%~15%的氯化十六烷基吡啶溶液(cpc),室温放置2~48h,离心取沉淀1;
其中,所述质量浓度(m/m)0.1~15%氯化十六烷基吡啶溶液的添加量为:以步骤s2所述脱脂粉的添加量为参照,每克脱脂粉对应添加1~2ml质量浓度(m/m)0.1~15%氯化十六烷基吡啶溶液;
s5、醇沉:取步骤s4所述沉淀1,每克沉淀1溶解于10~20mlnacl-乙醇混合溶液,再加入25~35ml体积分数70%~100%(v/v)乙醇溶液,4℃放置2h以上,离心取沉淀2;
其中,所述nacl-乙醇混合溶液为1~5mol/lnacl溶液和体积分数70%~100%(v/v)乙醇以体积比100:15混合所得溶液;
s6、除杂质:将步骤s5所述沉淀2用乙醇洗涤,然后经过透析除盐,得粗糖溶液;
s7、冻干:取步骤s6所得粗糖溶液冻干得到青蛤粗糖;
s8、纯化:将步骤s7所述青蛤粗糖溶解于去离子水,使用deae-纤维素柱纯化,依次用去离子水、0.01mnacl、0.02mnacl和0.05mnacl溶液各洗脱2~5个柱体积,收集0.05mnacl溶液洗脱部分,经透析后冻干,得到青蛤多糖。
优选方式下,步骤s1所述制备脱脂粉具体为:取青蛤肉冻干,所述冻干条件为:冻干机冷阱温度-60℃,真空度1~10pa,样品冻干时间≥4h;将冻干后的青蛤破碎成青蛤粉,按料液比3:10g/ml向所述青蛤粉中加入丙酮,100~500rpm搅拌0.5~2h,静置2~24h,去除上层丙酮,所得沉淀于通风橱中干燥至质量恒定,得脱脂粉;
优选方式下,步骤s3所灭酶具体为:将所述混合液2,100℃加热2~10min,4~30℃、3000~10000r/min离心5~60min取上清液。
优选方式下,步骤s4所述离心具体为:4~30℃、3000~10000r/min离心5~60min。
优选方式下,步骤s5所述离心为:3000~15000r/min离心5~60min。
优选方式下,步骤s6所述除杂质具体为:将所述沉淀2用乙醇洗涤,每克沉淀2加入1~20ml浓度大于50%(v/v)的乙醇洗涤,然后倾倒出乙醇溶液,该洗涤操作重复1~5次后,所得沉淀3每克用10~20ml水溶解,再使用500~10000da透析袋分别用流动自来水、去离子水(透析袋中每1毫升的样品对应使用20毫升去离子水透析)透析24小时以上,所得溶液为粗糖溶液。
优选方式下,步骤s7所述冻干具体为:冻干机冷阱温度-60℃,真空度1~10pa,每毫升样品冻干时间≥3h。
优选方式下,步骤s8所述透析后冻干具体为:将所述0.05mnacl溶液洗脱部分使用500~10000da透析袋,分别用流动自来水、去离子水透析24小时以上,得多糖溶液;将所述多糖溶液冻干得青蛤多糖;其中,每毫升透析内液对应使用20ml去离子水透析;所述冻干的参数为:冻干机冷阱温度-60℃,真空度1~10pa,多糖溶液冻干时间≥4h。
如无特殊说明,本发明所述室温均指25℃。
本发明还提供了所述具有增强免疫活性的青蛤多糖的应用,以所述青蛤多糖作为活性成分,用于制备增强免疫的功能食品或药物。
所述青蛤多糖作为制备增强免疫功能食品的应用;所述青蛤多糖作为制备增强免疫功能药物的应用。
本发明的另一个目的是提供一种能够增强免疫功能的食品,在制做食品时加入青蛤多糖;一种能够增强免疫功能的药物,在制药时加入青蛤多糖。
本发明的有益效果是:
巨噬细胞(raw246.7)是机体先天和后天免疫的关键,其具有吞噬功能,能主动吞噬和清除颗粒性外来抗原或直接杀伤病原微生物,通过产生的一氧化氮(no)等分子杀伤靶细胞,同时产生多种生物活性物质发挥其免疫调节作用。
采用griess法检测raw246.7产生的no,结果表明,本发明制备的青蛤多糖具有显著促细胞生成no的作用,相对于空白组细胞只产生低浓度的no,浓度大于等于1μg/ml青蛤多糖处理后的细胞生成no浓度显著高于空白组,且产生no的量与青蛤多糖剂量呈正相关。
附图说明
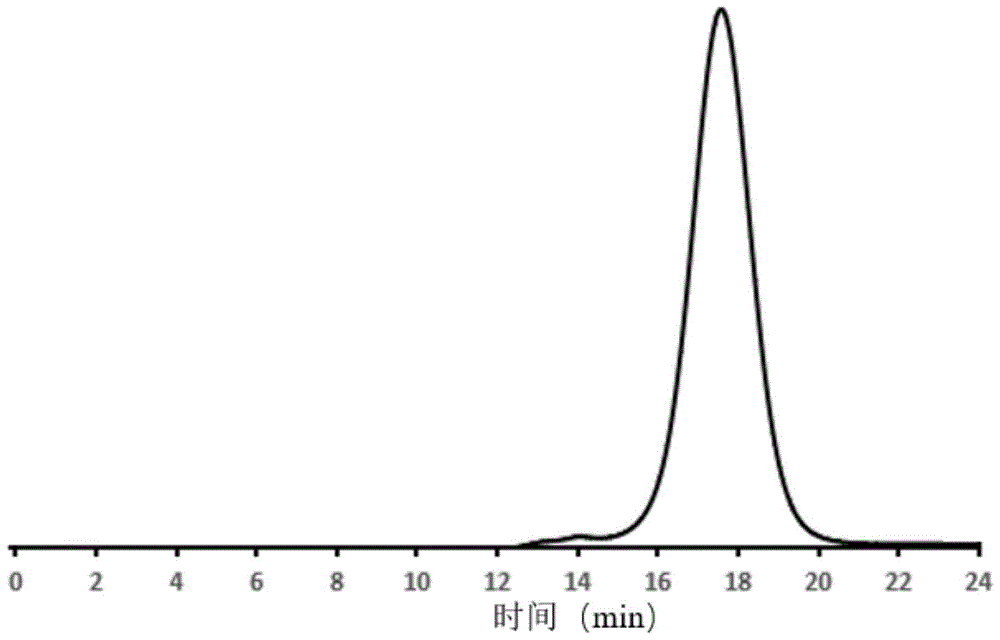
图1是实施例1中青蛤多糖相对分子质量分布曲线;
图2是实施例1中包含rha(鼠李糖)、fuc(岩藻糖)、ara(阿拉伯糖)、xyl(木糖)、man(甘露糖)、glc(葡萄糖)、gal(半乳糖)、glcn(氨基葡萄糖)、galn(氨基半乳糖)、gala(半乳糖醛酸)、glca(葡萄糖醛酸)衍生物的气相色谱(gc)图;
图3是实施例1中气相色谱分析青蛤多糖的单糖组成;
图4是实施例1中青蛤多糖甲基化后gc-ms分析的总离子流图;
图5是实施例1中图4中tr为21.059min峰的质谱图;
图6是实施例1中图4中tr为24.6min峰的质谱图;
图7是实施例1中青蛤多糖1hnmr谱图;
图8是实施例1中青蛤多糖13cnmr谱图;
图9是实施例1中青蛤多糖hsqc谱图;
图10是实施例1中青蛤多糖1h-1hcosy谱图;
图11是实施例1所得青蛤多糖的结构图;
图12是实施例2中青蛤多糖对raw264.7细胞增殖的影响;
图13是实施例3中no标准曲线;
图14是实施例3中青蛤多糖促no生成的量效关系。
具体实施方式
以下结合附图和实施例,对本发明的具体实施方式进行更加详细的说明,以便能够更好地理解本发明的方案以及其各个方面的优点。然而,以下描述的具体实施方式和实施例仅是说明的目的,而不是对本发明的限制。
实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
本发明提供了一种青蛤多糖,其所述多糖的主链由→4)-α-d-glcp(1→构成。
优选地,根据前述的多糖,其中,所述多糖的结构为
更优选地,根据前述的多糖,其中,所述多糖的分子量为200~400kda。
本发明还提供了前述多糖的提取方法,其中,所述提取方法包括:
(1)将青蛤干粉于丙酮溶液中搅拌0.5~2小时,静置过夜,将上层有机试剂去除并风干;
(2)向每克风干样品中加入2~5ml0.05mol/l的半胱氨酸-edta二钠溶液,15~25ml0.05mol/l,ph=8的k2hpo4缓冲液,再向脱脂粉中加入相对于脱脂粉质量1%(m/m)的胰蛋白酶干粉,37℃、100~150rmp振荡酶解2~5h,得混合溶液1;向所述混合液1中加入相对于脱脂粉质量1%(m/m)木瓜蛋白酶干粉,65℃100~150rmp振荡酶解1~5h得混合溶液2,该胰蛋白酶的添加量为每克脱脂粉加入0.01g125~750u/mg;所述木瓜蛋白酶的添加量为每克脱脂粉加入0.01g1000~6000u/mg;(3)步骤(2)所述混合溶液100℃灭酶2~10min,冷却到室温,离心,转速3000~10000r/min,时间5~60min,温度4~30℃,取上清液;
(4)向上清液中,对应1g步骤(2)风干样品中加入1.0~2.0ml0.1~15%的氯化十六烷基吡啶溶液(cpc),室温放置2~48h后,离心,转速3000~10000r/min,时间5~60min,温度4~30℃,取沉淀;
(5)将每克沉淀溶解于10~20mlnacl-乙醇混合溶液,该混合溶液为1~5mol/lnacl和70~100%乙醇以体积比100:15混合所得溶液,再加入25~35ml70~100%(v/v)乙醇溶液,4℃放置2h以上,离心,转速3000~15000r/min,时间5~60min,取沉淀;
(6)将每克沉淀用1~20ml浓度大于50%的乙醇洗1~5次后,用水溶解,再使用500~10000da透析袋分别用流动自来水、去离子水透析24小时以上;
(7)将透析后的溶液冻干得到青蛤粗糖;
(8)将青蛤粗糖加样于依次用去离子水、0.01、0.02和0.05mnacl平衡过的deae-纤维素柱,收集0.05mnacl洗脱部分,冻干,得到青蛤多糖。
本发明还提供了前述多糖在制备增强免疫的功能食品或药物中的应用。
巨噬细胞(raw246.7)是机体先天和后天免疫的关键,其具有吞噬功能,能主动吞噬和清除颗粒性外来抗原或直接杀伤病原微生物,通过产生的一氧化氮(no)等分子杀伤靶细胞,同时产生多种生物活性物质发挥其免疫调节作用。
采用griess法检测raw246.7产生的no,结果表明,青蛤多糖具有显著促细胞生成no的作用,相对于正常生长的对照组细胞只产生低浓度的no,1μg/ml青蛤多糖处理后的细胞生成no浓度极显著高于空白组,l0μg/ml浓度组细胞产生no的浓度最高。
下述实施例中使用的rpmi-1640培养基购自于vwr,商品号:45000-604);青链霉素混合液购自于corning,商品号:mt30002ci)、优级胎牛血清购自于vwr,商品号:340b17。
实施例1
一种具有增强免疫活性青蛤多糖的制备方法,包括步骤:
s1、制备脱脂粉:新鲜青蛤取肉,冻干(冷阱温度-60℃,真空度1~10pa),所述青蛤肉冻干时间≥4h,破碎成青蛤粉(300g);向300g青蛤粉中加入1000ml丙酮,磁力搅拌器100rpm搅拌30min,静置24h后去除上层丙酮,所得沉淀在通风橱中干燥至质量恒定,得脱脂粉(280g);
s2、酶解:取步骤s1所述280g脱脂粉加入700ml、0.05mol/l的半胱氨酸-edta二钠溶液和5740ml0.05mol/l、ph=8的k2hpo4缓冲溶液,再加入2.8g250u/mg胰蛋白酶,37℃水浴、100rpm震荡酶解4h,得混合液1;向所述混合液1中加入2.8g2000u/mg木瓜蛋白酶65℃水浴、100rpm震荡酶解3h,得混合液2;
s3、灭酶:将步骤s2所述混合液2在100℃水浴5min灭酶,4℃、4000r/min离心20min,取上清液;
s4、络合沉淀:向步骤s3所述上清液中加入448ml质量百分浓度(m/m)10%的氯化十六烷基吡啶溶液,室温下放置24h后,20℃、8000r/min离心15min,取沉淀1;
s5、醇沉:取步骤s4所述沉淀1共150g,加入2250mlnacl-乙醇混合溶液,再加入4500ml体积分数95%的乙醇溶液,4℃放置24h,20℃、8000r/min离心5min取沉淀2;所述nacl-乙醇混合溶液为3mol/lnacl溶液和体积分数(v/v)95%的乙醇按体积比100:15混合所得溶液;
s6、除杂质:将步骤s5所述沉淀2(共6g),用120ml85%(v/v)乙醇洗涤,然后倾倒出乙醇溶液,所述洗涤操作共重复3次,室温条件下乙醇挥干后得沉淀3(3.5g),所述沉淀3用70ml蒸馏水溶解,使用3500da透析袋流动自来水透析24小时,再将流动自来水替换成去离子水透析24h(透析袋中每1毫升的样品对应20毫升去离子水),得粗糖溶液;
s7、冻干:将步骤s6所述粗糖溶液-60℃、真空度1pa冻干70h,得青蛤粗糖(3g);
s8、纯化:取0.2g步骤s7所述青蛤粗糖溶解于1ml去离子水中,吸附到用500ml去离子水平衡过的deae-纤维素柱,柱体积为400ml,依次用去离子水、0.01、0.02和0.05mnacl溶液各洗脱2~5个柱体积,收集0.05mnacl溶液洗脱部分,收集的溶液分别用3500da透析袋,流动自来水透析24h,再使用去离子水透析24h(每1毫升透析袋体积对应20毫升去离子水);最后将透析所得溶液于-60℃、真空度1pa冻干70h,得到青蛤多糖(csp)。
采用苯酚硫酸法测定本实施例制得的csp的总糖含量为95%;采用tsk凝胶色谱法检测得本实施所得csp的分子量为380kda,如图1所示。
采用气相色谱法分析混标(图2)与本实施例所得csp的单糖组成,结果如图3所示,csp的单糖组成为甘露糖:葡萄糖=1:35。
图4是本实施例所得csp甲基化后gc-ms分析的总离子流图。将gc-ms上各色谱峰的质谱图和出峰时间与相关文献相比较并结合部分甲基化糖醇乙酸酯的电离规律进行解析,可知21.059min的色谱峰为2,3,6-me3-glc(图5),而24.6min2,3-me2-glc(图6),二者的峰面积比为6.8:1,说明csp结构中,→4)glc(1→和→4,6)glc(1→的比例为6.8:1。
图7、图8、图9、图10分别是青蛤多糖的1hnmr、13cnmr、hsqc(异核单量子相干,heteronuclearsingleqauntumcoherence)、1h-1hcosy(化学位移相关谱1h-1hchemicalshiftcorrelationspectroscopy)谱图。其中,1hnmr(图7)中,5.4ppm处的宽单峰为端基氢的质子信号,3.40-5.50ppm的信号峰为糖环上的其它质子信号,与文献(carbohydratepolymers,2011,84:851-857.)中α-1,4-glc残基信号一致。13cnmr(图8)中,100ppm左右的1个碳信号为端基碳原子的信号,可知构型是α-型,60ppm为c-6信号。hsqc图谱(图9)可以反映直接相连的h、c核之间的耦合关系。结合1h-1h-cosy(图10)将糖环质子的化学位移进行归属后,再通过hsqc可进一步将碳的化学位移进行归属。最终实现所有的碳氢信号的准确归属(表1),与文献(carbohydratepolymers,2011,84:851-857.)中α-1,4-glc的核磁信号一致,说明α-1,4-glc是csp的主要单糖残基,这也与甲基化分析结果一致。因此,推测csp的结构如图11所示。
表1csp主链1h和13cnmr的化学位移
实施例2
本实施例用于评估实施例1制备的青蛤多糖csp对细胞的毒性分析。具体实验方法如下:
取100μl对数生长期密度为50×104个/ml的raw264.7细胞接种于96孔培养板,7个剂量处理组添加的完全培养基(所述完全培养基为:rpmi-1640培养基(vwr,45000-604)中含1%(v/v)青链霉素混合液(corning,mt30002ci)、10%(v/v)优级胎牛血清(vwr,340b17)中csp的浓度分别为0.8mg/ml、0.5mg/ml、0.2mg/ml、0.1mg/ml、0.05mg/ml、0.02mg/ml和0.01mg/ml,阳性对照含有5μg/mllps的完全培养基,各孔加含或不含csp的培养基体积为200μl,每个组别设置6个复孔;于37℃、5%co2培养箱中孵育24h后,每孔加入200μlmtt(0.5mg/ml)的磷酸盐缓冲溶液,相同条件避光孵育4h后吸去各孔液体,分别添加150μldmso,使用酶标仪振荡10min,最后于540nm波长处测定各孔od值进而得知细胞增殖活力。
如图12所示,培养基中csp质量浓度高于0.05mg/ml时对raw264.7细胞存活有影响,故选取10,5,2,1,0.4,0.2μg/ml共6组质量浓度作为后续实验剂量。
实施例3
活化后的巨噬细胞分泌no是杀死肿瘤细胞及病原微生物的重要途径。多糖能够刺激巨噬细胞,诱导巨噬细胞释放no,进而影响其免疫调节。本实验采用griess法测定csp对raw264.7细胞no产生量的影响,具体操作方法如下:
将对数生长期的raw264.7细胞进行计数,调整细胞悬液密度为1x106/ml,以100μl/孔加入96孔板中,37℃、5%co2培养24h使细胞充分贴壁;分成csp浓度0.2μg/ml、0.4μg/ml、1μg/ml、2μg/ml、5μg/ml、10μg/ml共6个剂量处理组、空白对照组和阳性对照组,每个组别设置6个复孔;所述6个剂量处理组添加的完全培养基中csp的浓度分别为0.2μg/ml、0.4μg/ml、1μg/ml、2μg/ml、5μg/ml和10μg/ml,空白对照组中不添加csp,所述阳性对照组的培养基中含有2μg/mllps,各孔加含或不含csp的培养基体积为200μl;于37℃、5%co2培养箱中孵育24h后,在新的96孔板的孔中分别加入50μl浓度为80μmol/l、40μmol/l、20μmol/l、10μmol/l、5μmol/l和2.5μmol/lnano2标准品、各组细胞培养上清液,然后向各孔中依次加入50μlgriess试剂i和50μlgriess试剂ii用酶标仪于540nm处检测各孔吸光度值。以标准品的浓度为横坐标,对应吸光度值为纵坐标,绘制标准曲线(图12),根据标准曲线计算各组细胞中的no浓度,可知0.2μg/ml、0.4μg/ml、1μg/ml、2μg/ml、5μg/ml、10μg/ml对应的一氧化氮浓度分别为0.8μm、1.2μm、3.4μm、5.8μm、10.9μm、11.7μm、27μm;其中,所述griess试剂i:100ml水中加入2g磺胺和2.77ml磷酸;griess试剂ii:100ml水中加入1-萘乙烯二胺。
如图13所示,空白对照组中raw264.7细胞no分泌水平较低,在培养基中加入2μg/ml脂多糖(lps,阳性对照组)的细胞no分泌量与空白对照组相比有显著增加(p<0.05)。相比于空白对照组,当培养基中的csp质量浓度≥1μg/ml时可以明显提高no分泌量。
以上实施例仅为本发明的示例性实施例,不用于限制本发明,本发明的保护范围由权利要求书限定。本领域技术人员可以在本发明的实质和保护范围内,对本发明做出各种修改或等同替换,这种修改或等同替换也应视为落在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!