双-(10-去氧双氢青蒿素)-间苯三酚缀合物的制备方法和应用与流程
本发明涉及药物化学技术领域,具体涉及10-去氧双氢青蒿素10-位碳与间苯三酚及其衍生物的苯环通过碳碳键相连的制备方法和应用。
背景技术:
青蒿素是从中药青蒿(artemisiaannual.)中分离、提取的含有过氧基团的倍半萜内酯。青蒿素及其衍生物蒿甲醚、青蒿琥酯、双氢青蒿素等在临床上用于治疗疟疾,具有高效、速效、低毒的特点。除了它们的抗疟作用以外,在多年来的临床和实验室研究中发现,青蒿素及其衍生物还具有优良的抗肿瘤活性。这类化合物在体外实验中不仅对白血病、结肠癌有效,对其他癌症如黑色素瘤、乳腺癌、卵巢癌、前列腺癌、肾癌等均具有良好的活性。此外,青蒿素及其衍生物除了抗疟和抗癌作用以外,还具有优良的免疫抑制活性。
在癌症治疗中,绝大多数化学药物均具有较强的毒副作用,而青蒿素是一种非常安全的药物。众多研究论文均报道青蒿素衍生物,特别是双氢青蒿素二聚体、三聚体具有抑制多种肿瘤细胞增殖、抗肿瘤血管生成,对耐药的肿瘤细胞没有交叉耐药性等特点(investnewdrugs(2013)31:230–246;j.med.chem.(2016)59:7360-7388)。
由于我国人口老龄化加剧、生态环境遭受破坏、不健康生活方式及食品安全问题凸现,我国肿瘤发病率多年持续上升,已成为一个必须高度重视的公共卫生问题乃至社会问题。根据国际癌症研究署预测,如不采取有效措施,我国癌症发病数和死亡数到2020年将上升至400万人和300万人;2030年将上升至500万人和350万人。
免疫抑制剂是一类具有免疫抑制作用的药物,主要功能为抑制机体异常的免疫反应,应用于自身免疫性疾病和过敏反应及器官移植后排斥反应的治疗。自身免疫性疾病是由于自身免疫应答过强或持续时间过长以至破坏自身正常组织结构并引起的相应临床症状;过敏反应即为机体抗原持续刺激或同一抗原再次刺激后产生的一种以生理功能紊乱和组织损伤为主要表现的病理性免疫反应;临床器官移植手术后,受者免疫系统可识别移植物抗原并产生应答,移植物中免疫细胞也可以识别受者组织抗原并产生免疫应答,此为移植排异反应。这些症状都是机体“不适当”的免疫应答引起的,而免疫抑制剂在一定程度上能够起到治疗的作用,在临床上得到了广泛的应用。
迄今为止,系统性红斑狼疮(systemiclupuserythematosus,sle)仍缺乏优良的治疗药物,这种状况已成为当今国际公认的医学难题。sle作为一种典型的全身性难治性致死性自身免疫性疾病,它的发病机制及调控机理仍不十分清楚,这给治疗和免疫干预手段的设计带来了极大困难。目前国内外对此病的经典治疗方法是使用激素和免疫抑制剂。激素治疗能暂时使症状缓解,但长期应用易诱发感染并产生诸多副作用,而且停药后易复发。虽然免疫抑制剂的出现和使用增加了临床对sle疾病进程的干预和治疗手段,但是现有的免疫抑制药物均非针对sle研发的药物,除了价格昂贵外,长期使用还会产生较多毒副作用。由于sle患者不同个体、不同疾病阶段、不同脏器受累的疾病机制的异质性,极大地影响了狼疮药物研发以及疾病的干预治疗效果。2011年美国fda批准了benlysta(belimumab)成为首只治疗系统性红斑狼疮的抗体药物,用于治疗中等发病程度的狼疮,然而一些临床数据显示benlysta的疗效是微弱的,并且随着治疗时间的延长其疗效作用递减,benlysta的疗效还需长期临床应用的确认,其价格也远高于现有药物。因此,针对系统性红斑狼疮等自身免疫性疾病,研究和开发具有我国自主知识产权、高效低毒的新型免疫抑制剂已成为当今医学和药学研究的紧迫课题。
青蒿素及其衍生物在临床和实验室的研究中不断被证明具有良好的抗癌和治疗自身免疫性疾病活性。为了研究和获得抗癌及治疗自身免疫性疾病活性更高的青蒿素衍生物,药物工作者一直尝试在青蒿素母体结构上引入新的基团,合成了大量新的青蒿素类化合物。通过对这些新型青蒿素衍生物的研究,可以找到适用于临床的高效、低毒抗癌以及治疗自身免疫性疾病的药物。
技术实现要素:
本发明要解决的技术问题是提供一种两分子10-去氧双氢青蒿素的10-位碳与间苯三酚或其衍生物的苯环通过碳碳键相连接的化合物,该双-(10-去氧双氢青蒿素)-间苯三酚缀合物或其衍生物作为新的抗癌和治疗自身免疫性疾病的制剂,可以有效抑制和消除癌细胞以及治疗自身免疫性疾病,单用或与其他相关药物联用,用于治疗多种癌症和自身免疫性疾病相关病症。
为了解决上述技术问题,本发明通过如下技术方案实现:
本发明的一个方面,提供了一种具有通式(i)的10-去氧双氢青蒿素10-位碳与间苯三酚或其衍生物的苯环通过碳碳键相连接的化合物或其异构体、或其可药用盐、或其前药分子,
其中,两分子10-去氧双氢青蒿素10-位碳原子与间苯三酚或其衍生物的苯环通过碳碳键相连而形成新的双-(10-去氧双氢青蒿素)-间苯三酚缀合物;
通式(i)中,两分子10-去氧双氢青蒿素的10-位碳通过碳碳键与苯环相连;10-去氧双氢青蒿素10-位碳的构型可以是α或β构型。
通式(i)中,r1、r2、r3可以相同也可以不相同。
通式(i)中,r1包括-oh,以及–xr4
其中x为醚(-o-)、羧酸酯(-coo-)、碳酸酯(-ocoo-)、磺酸酯(-oso2-)、亚磺酸酯(-oso-)、磷酸酯(-opo3-)、亚磷酸酯(-opo2-)、氨基甲酸酯(-oconh-)、异脲(-ocnhnh-);
r4为1-15个碳的烷基、烯基,炔基及其衍生物;1-15个碳并含1-6个卤素的卤代烷基、卤代烯基或卤代炔基及其衍生物;1-15个碳原子的芳基、卤代芳基、酚或多元酚及其衍生物;芳香羧酸及其衍生物;萘基或萘酚类衍生物;1-15个碳原子的醇或多元醇及其衍生物;1-15个碳原子的羧酸,多元羧酸,氨基酸及其衍生物;1-15个碳原子的磺酸及其盐;1-15个碳原子的胺、胺盐、季胺盐;1-15个碳原子的酰胺;1-15个碳原子的卤代烷氧基;1-15个碳原子的烷氧基醇或烷氧基多元醇;1-15个碳原子的烷氧基醇或烷氧基多元醇的醚、羧酸酯、磺酸酯或硫酸酯及其盐;2-15个碳原子的烷氧基羧酸,烷氧基多元羧酸,烷氧基氨基酸及其盐;2-15个碳原子的烷氧基磺酸及其盐;2-15个碳原子的烷氧基胺或其胺盐和季胺盐;2-15个碳原子的烷氧基酰胺;含3-15个碳原子的烷氧基烯烃;含3-15个碳原子的烷氧基炔烃;含3-20个碳原子的氨基酸及其衍生物;含3-20个碳原子的氨基醇及其衍生物;4-15个碳的环烷基醚;含有1-4个杂原子的五元-八元的杂环或并杂环及其衍生物;
通式(i)中,r2包括-oh,-yr5。其中y为醚(-o-)、羧酸酯(-coo-)、碳酸酯(-ocoo-)、磺酸酯(-oso2-)、亚磺酸酯(-oso-)、磷酸酯(-opo3-)、亚磷酸酯(-opo2-)、氨基甲酸酯(-oconh-)、异脲(-ocnhnh-);
r5为1-15个碳的烷基、烯基,炔基及其衍生物;1-15个碳并含1-6个卤素的卤代烷基、卤代烯基或卤代炔基及其衍生物;1-15个碳原子的芳基、卤代芳基、酚或多元酚及其衍生物;芳香羧酸及其衍生物;萘基或萘酚类衍生物;1-15个碳原子的醇或多元醇及其衍生物;1-15个碳原子的羧酸,多元羧酸,氨基酸及其衍生物;1-15个碳原子的磺酸及其盐;1-15个碳原子的胺、胺盐、季胺盐;1-15个碳原子的酰胺;1-15个碳原子的卤代烷氧基;1-15个碳原子的烷氧基醇或烷氧基多元醇;1-15个碳原子的烷氧基醇或烷氧基多元醇的醚、羧酸酯、磺酸酯或硫酸酯及其盐;2-15个碳原子的烷氧基羧酸,烷氧基多元羧酸,烷氧基氨基酸及其盐;2-15个碳原子的烷氧基磺酸及其盐;2-15个碳原子的烷氧基胺或其胺盐和季胺盐;2-15个碳原子的烷氧基酰胺;含3-15个碳原子的烷氧基烯烃;含3-15个碳原子的烷氧基炔烃;含3-20个碳原子的氨基酸及其衍生物;含3-20个碳原子的氨基醇及其衍生物;4-15个碳的环烷基醚;含有1-4个杂原子的五元-八元的杂环或并杂环及其衍生物;
通式(i)中,r3包括-oh,-zr6。其中z为醚(-o-)、羧酸酯(-coo-)、碳酸酯(-ocoo-)、磺酸酯(-oso2-)、亚磺酸酯(-oso-)、磷酸酯(-opo3-)、亚磷酸酯(-opo2-)、氨基甲酸酯(-oconh-)、异脲(-ocnhnh-);
r6为1-15个碳的烷基、烯基,炔基及其衍生物;1-15个碳并含1-6个卤素的卤代烷基、卤代烯基或卤代炔基及其衍生物;1-15个碳原子的芳基、卤代芳基、酚或多元酚及其衍生物;芳香羧酸及其衍生物;萘基或萘酚类衍生物;1-15个碳原子的醇或多元醇及其衍生物;1-15个碳原子的羧酸,多元羧酸,氨基酸及其衍生物;1-15个碳原子的磺酸及其盐;1-15个碳原子的胺、胺盐、季胺盐;1-15个碳原子的酰胺;1-15个碳原子的卤代烷氧基;1-15个碳原子的烷氧基醇或烷氧基多元醇;1-15个碳原子的烷氧基醇或烷氧基多元醇的醚、羧酸酯、磺酸酯或硫酸酯及其盐;2-15个碳原子的烷氧基羧酸,烷氧基多元羧酸,烷氧基氨基酸及其盐;2-15个碳原子的烷氧基磺酸及其盐;2-15个碳原子的烷氧基胺或其胺盐和季胺盐;2-15个碳原子的烷氧基酰胺;含3-15个碳原子的烷氧基烯烃;含3-15个碳原子的烷氧基炔烃;含3-20个碳原子的氨基酸及其衍生物;含3-20个碳原子的氨基醇及其衍生物;4-15个碳的环烷基醚;含有1-4个杂原子的五元-八元的杂环或并杂环及其衍生物;
通式(i)中,r2、r3也可以通过其他基团形成环状结构。
本发明通式(i)中,双-(10-去氧双氢青蒿素)-间苯三酚缀合物或其衍生物的异构体包括其所有的异构体,如位置异构体,立体异构体和光学异构体。
优选的,所述通式(i)双-(10-去氧双氢青蒿素)-间苯三酚缀合物或其衍生物包括下述具体结构的化合物:
在本发明中,双-(10-去氧双氢青蒿素)-间苯三酚缀合物或其衍生物的可药用盐,包括锂盐,钾盐,钠盐,钙盐,镁盐,或者与天然的和非天然的有机含氮化合物形成的有机盐;与盐酸,硫酸,磷酸等无机酸生成的盐;与苹果酸,马来酸,甲磺酸等有机酸生成的盐。
在本发明中,双-(10-去氧双氢青蒿素)-间苯三酚缀合物或其衍生物的前药分子,是指药物经化学结构修饰后得到的在体内能迅速转化为上述通式(i)所示母体化合物的化合物,设计前药分子的目的在于增加药物的生物利用度,加强靶向性,降低药物的毒性和副作用等。
在本发明的另一方面,双-(10-去氧双氢青蒿素)-间苯三酚缀合物或其衍生物还包括其与其他药物的组合物,其含有治疗有效量的上述双-(10-去氧双氢青蒿素)-间苯三酚缀合物或其衍生物或其异构体、或其可药用盐、或其前药分子,以及一种或多种药学上可接受的载体、稀释剂或赋形剂。
上述可接受的载体是无毒的、能辅助施用并且对结合物的治疗效果没有不利影响。此类载体可以是本领域的技术人员通常能得到的任何固体赋形剂、液体赋形剂、半固体赋形剂或者在气雾剂组合物中的气体赋形剂。固体药物赋形剂包括淀粉、纤维素、滑石、葡萄糖、乳糖、蔗糖、明胶、麦芽、稻米、面粉、白垩、硅胶、硬脂酸镁、硬脂酸钠、甘油硬脂酰酯、氯化钠、无水脱脂乳等。液体和半固体赋形剂可以选自甘油、丙二醇、水、乙醇和各种油,包括那些源于石油、动物、植物或人工合成的油,例如,花生油、豆油、矿物油、芝麻油等、优选的液体载体,特别是用于可注射溶液的,包括水、盐水、葡萄糖水溶液和甘醇。另外还可以在组合物中加入其它辅剂如香味剂、甜味剂等。
本发明的药物或药物组合物可以通过口服或其他给药方式给药,如注射,透皮给药,喷雾给药,直肠给药,阴道给药等。优选的给药方式是注射或口服,它可根据疾病程度调节。
本发明的药物组合物可以和其他抗癌药物联合用药,所述的其他抗癌剂包括阿霉素类、博莱霉素、长春碱类、紫杉烷类、依托泊苷、5-氟尿嘧啶、环磷酰胺、甲氨蝶呤、顺铂、维甲酸、替莫唑胺、放线菌素、伊马替尼、吉非替尼、索拉非尼、厄洛替尼、舒尼替尼、阿法替尼、卡博替尼、奥斯替尼、利妥昔单抗、西妥昔单抗、曲妥珠单抗、尼伏单抗、潘利珠单抗、阿替珠单抗、度伐单抗、和/或阿维单抗等;
本发明的药物组合物可以和其他治疗自身免疫性疾病药物联合用药,所述的其他治疗自身免疫性疾病药物包括以下几种:
(1)抗代谢类:硫唑嘌呤(aza)、氨甲喋呤、霉酚酸酯(mmf)等;
(2)烃化剂:环磷酰胺等;
(3)皮质固醇类:强的松、地塞米松等;
(4)抗生素类:csa、fk506、雷帕霉素等;
(5)抗体类:抗淋巴细胞球蛋白(alg)、单克隆t淋巴细胞抗体(okt3)等;
(6)中草药:雷公藤多苷、冬虫夏草制剂等。
本发明药物组合物的各种剂型可以按照药学领域的常规方法制备。例如使该化合物与一种或者多种载体混合,然后将其制成所需的剂型,如片剂、药丸、胶囊、半固体、粉末、缓释剂型、溶液、混悬液、配剂、气雾剂等。
在本发明的另一方面,还提供了上述双-(10-去氧双氢青蒿素)-间苯三酚缀合物或其衍生物的制备方法,对通式(i)所述化合物,双氢青蒿素在路易斯酸或质子酸的催化下和间苯三酚及其衍生物进行取代反应。
上述反应中,路易斯酸或质子酸包括三氟化硼乙醚、四氯化锡、三氟乙酸、酸性树脂、磷钨酸、樟脑磺酸等;反应所使用的溶剂可以是质子溶剂,非质子溶剂或混合溶剂。优选为:乙醚,二氯甲烷,二氯乙烷,四氢呋喃,乙腈,乙二醇二甲醚。反应温度在摄氏温度-78~140℃度。
上述反应的粗产物可以用溶剂提取法,沉淀法,结晶法进一步纯化,也可以用柱层析法进行纯化,填料用硅胶,大孔树脂或氧化铝,洗脱剂可以用石油醚-丙酮,石油醚-乙酸乙酯,石油醚-二氯甲烷不同比例的混合。
在本发明的另一方面,还提供了上述双-(10-去氧双氢青蒿素)-间苯三酚缀合物或其衍生物或其异构体、或其可药用盐、或其前药分子在制备治疗癌症和自身免疫性疾病相关病症的药物中的应用。
上述癌症包括脑癌、脑胶质瘤、子宫内膜癌、卵巢癌、宫颈癌、乳腺癌、结肠癌、肺癌、前列腺癌、肝癌、白血病、淋巴癌、皮肤癌、基底细胞瘤、血管瘤、子宫癌、喉癌、胃癌、唇癌、食道癌、鼻咽癌、胆囊癌、胰腺癌、肾癌、舌癌、膀胱癌、黑素瘤、脂肪瘤、甲状腺癌、胸腺癌、骨癌等。
上述自身免疫性疾病包括红斑狼疮、类风湿关节炎、多发性硬化症、银屑病、人体器官移植后抗排斥反应等自身免疫性疾病。
本发明的双-(10-去氧双氢青蒿素)-间苯三酚缀合物或其衍生物,合成简单,化学稳定性好,毒性小,在体外试验中对肿瘤细胞显示出非常强的抑制活性。本发明的双-(10-去氧双氢青蒿素)-间苯三酚缀合物或其衍生物的抗癌活性和免疫抑制活性远远高于传统的青蒿素、双氢青蒿素、蒿甲醚、青蒿琥酯、β-氨基蒿乙醚马来酸盐(sm934)等青蒿素衍生物,作为癌症治疗药物和免疫抑制药物有广阔的应用前景。
附图说明
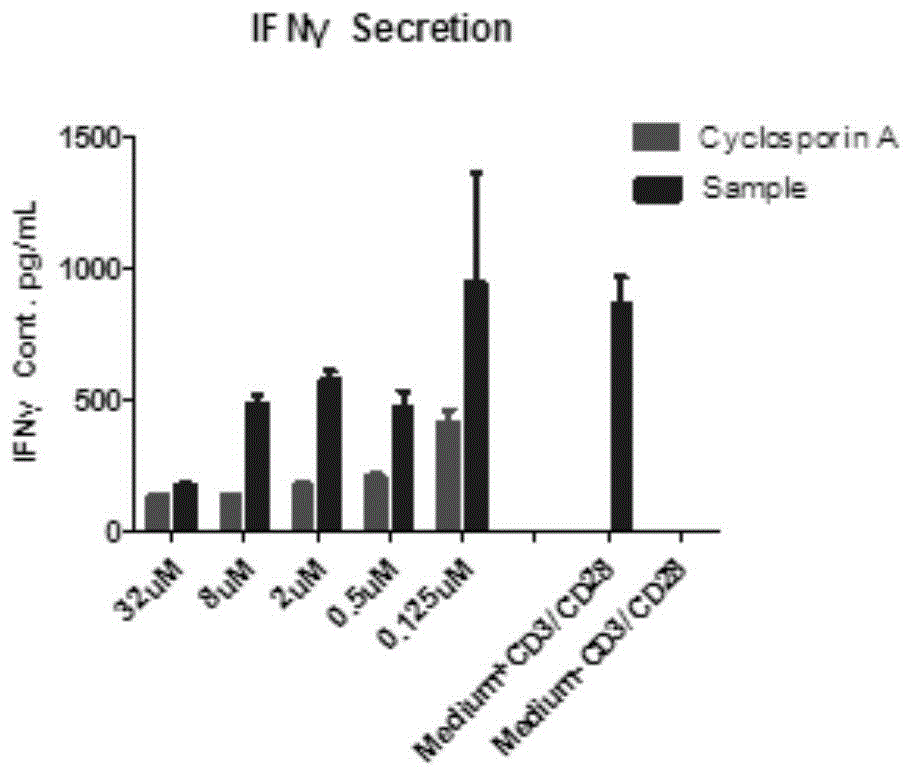
图1为2,6-双-(α-10-去氧双氢青蒿素)-1,3,5-间苯三酚对ifn-γ的抑制作用示意图。
具体实施方式
实施例12,6-双(α-10-去氧双氢青蒿素)-1,3,5-间苯三酚的制备:
方案:
步骤:
氮气保护下,将569毫克双氢青蒿素(2.0毫摩尔)和126毫克间苯三酚(1.0毫摩尔)溶于50毫升无水乙醚中,-78℃下将1毫升三氟化硼乙醚缓慢滴加至反应瓶中。滴加完毕后,溶液温度自然升至室温后搅拌过夜。薄层硅胶色谱监测至反应结束后,将30毫升饱和碳酸氢钠水溶液滴入反应瓶中,用30毫升乙酸乙酯萃取三次。有机相合并后依次用50毫升水、50毫升饱和食盐水洗涤,经无水硫酸镁干燥后减压浓缩,残余物经硅胶柱层析纯化(洗脱剂:石油醚/乙酸乙酯=3/1)得316毫克白色固体,收率48%。
1hnmr(400mhz,cdcl3)δ8.52(s,1h),8.25(s,1h),5.86(s,1h),5.42(s,1h),5.40(s,1h),5.21(d,j=11.2hz,1h),5.06(d,j=11.2hz,1h),4.53(s,1h),2.73-2.88(m,2h),2.38-2.50(m,2h),2.00-2.10(m,2h),1.85-1.97(m,2h),1.70-1.84(m,4h),1.22-1.65(m,16h),1.02-1.12(m,2h),0.94-1.02(m,6h),0.73(d,j=7.2hz,3h),0.67(t,j=7.2hz,3h).
13cnmr(101mhz,cdcl3)δ156.50,154.68,153.08,106.61,104.98,104.95,103.65,95.88,91.94,91.84,81.39,81.32,71.48,71.35,51.56,45.92,45.83,37.52,36.00,34.24,34.18,31.48,30.86,26.92,26.03,26.00,24.91,24.88,21.29,21.08,20.30,20.27,13.46,13.35.
hrms(esi)calcdfor[m+na]+=681.3251,found:[m+na]+=681.3246
实施例22,6-双-(α-10-去氧双氢青蒿素)-1,3,5-间苯三酚对肿瘤细胞的抑制作用实验目的:利用cck-8法验证青蒿素衍生物样品2,6-双(α-10-去氧双氢青蒿素)-1,3,5-间苯三酚对pc3细胞(前列腺癌细胞)、hela细胞(宫颈癌细胞系)、jurkat细胞(急性t细胞白血病细胞)、786-o(肾透明细胞腺癌)以及mcf-7(乳腺癌细胞)的增殖毒性。
实验方法:将样品配成400μm,向下依次稀释成100μm,25μmm,6.25μmol/l,1.56μm,0.39μm,0.1μm,0.02μm,0.006μm。细胞处理72小时后,每孔加10μlcck-8溶液。放回培养箱继续培养2h后,用全自动酶标仪于450nm波长处测定o.d值。用graphpadprism7处理数据,算出ic50。
实验结果:
表1
实施例32,6-双-(α-10-去氧双氢青蒿素)-1,3,5-间苯三酚对t细胞的增殖抑制作用
实验目的:通过检测2,6-双(α-10-去氧双氢青蒿素)-1,3,5-间苯三酚对人cd4+t细胞和人cd8+t细胞的增殖抑制活性,初步评价其免疫抑制活性
实验方法:用人总t细胞分离试剂盒(easyseptmhumantcellisolationkit,stemcell,negativeselection)从外周血单核细胞(pbmc)中分离t细胞,用celltraceviolet(thermofisher)标记t细胞,加入immunoculttmhumancd3/cd28tcellactivator(stemcell),同时加入化合物2,6-双-(α-10-去氧双氢青蒿素)-1,3,5-间苯三酚与对照样品环孢素a(csa),孵育120h,使用流式细胞仪(celesta,bd)分析cd4+t细胞与cd8+t细胞的增殖情况,同时设置celltraceviolet标记的t细胞+immunoculttmhumancd3/cd28tcellactivator(medium+cd3/cd28)和celltrace标记的t细胞不加immunoculttmhumancd3/cd28tcellactivator(mediumwocd3/cd28)两组作为系统对照,观察化合物2,6-双-(α-10-去氧双氢青蒿素)-1,3,5-间苯三酚对人cd4+t细胞与人cd8+t细胞的增殖抑制活性以及对t细胞的细胞毒性作用。
实验结果:
表2
实施例42,6-双-(α-10-去氧双氢青蒿素)-1,3,5-间苯三酚对ifn-γ的抑制作用
实验目的:ifn-γ主要由th1细胞分泌,其生物学功能为诱导cd4+t细胞转变为th1细胞,促进t、b淋巴细胞的分化等。ifn-γ分泌水平的升高能够促进炎症的发生及机体组织的损伤,从而加重自身免疫性疾病的病情。将待测化合物与人t细胞共孵育120h,检测细胞上清液中ifn-γ的浓度,初步判断化合物2,6-双-(α-10-去氧双氢青蒿素)-1,3,5-间苯三酚对人t细胞ifn-γ分泌的抑制活性。
实验方法:用人总t细胞分离试剂盒(easyseptmhumantcellisolationkit,stemcell,negativeselection)从外周血单核细胞(pbmc)中分离t细胞,用celltraceviolet(thermofisher)标记t细胞,加入immunoculttmhumancd3/cd28tcellactivator(stemcell)cd3/cd28激活剂抗体扩增t细胞后,将同时加入化合物2,6-双(α-10-去氧双氢青蒿素)-1,3,5-间苯三酚与对照样品环孢素a(csa),孵育120h作用于t细胞。120小时后,离心,取上清,采用ifn-γ试剂盒(humanifn-γelisakit,dakewe),通过酶联免疫吸附试验(elisa)检测培养液上清液中t细胞分泌的ifn-γ的浓度,以此来观察2,6-双(α-10-去氧双氢青蒿素)-1,3,5-间苯三酚对ifn-γ的抑制活性。
实验结果如图1所示。
在32μm时,环孢素a与2,6-双-(α-10-去氧双氢青蒿素)-1,3,5-间苯三酚均有较强的抑制ifn-γ分泌的作用,此时ifn-γ的浓度约为200pg/ml。随着浓度的降低,二者对ifn-γ的分泌抑制作用逐渐减弱,显示出浓度依赖性。2,6-双-(α-10-去氧双氢青蒿素)-1,3,5-间苯三酚在0.5μm浓度下对ifn-γ的抑制可达到相同浓度环孢素a的50%。
实施例52,6-双-(α-10-去氧双氢青蒿素)-1,3,5-间苯三酚对pha刺激人pbmc体外增殖抑制活性
实验方法:分离人外周血单个核细胞(peripheralbloodmononuclearcell,pbmc),调整细胞浓度为1×106/ml,100μl每孔,种入96孔板中。将2,6-双-(α-10-去氧双氢青蒿素)-1,3,5-间苯三酚溶解至合适浓度的母液,以1:4梯度稀释,得到5个浓度梯度(2μm,0.5μm,0.125μm,0.031μm,0.008μm),加入到对应的孔中,每个浓度设置三复孔,阳性对照孔为2μmcsa,阴性对照孔为rpmi-1640完全培养基(rpmi1640+10%fbs+1%penicillin-streptomycin+55μmβ巯基乙醇),同时每孔加入1μg/mlpha刺激pbmc细胞。培养箱中孵育72h后,每孔加入ctg,检测细胞的增殖情况。数据用graphpadprism6.0软件进行分析。
实验结果:在pha刺激人pbmc增殖体系中,2,6-双-(α-10-去氧双氢青蒿素)-1,3,5-间苯三酚可以显著抑制pbmc的增殖,并呈现一定程度的剂量依赖性,ic50为0.029μm。
以上所述实施例仅表达了本发明的实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!