一种利用土著PAHs降解菌群落去除农田土壤中USEPAPAHs的方法与流程
本发明涉及环境工程微生物技术领域,具体是涉及一种利用土著pahs降解菌群落去除农田土壤中usepapahs的方法。
背景技术:
多环芳烃(pahs)是一种环境中广泛存在的一类难降解、高风险有机污染物。现发现已知的pahs多达几百种,由于其有致癌、致畸、致突变的“三致”效应,且在土壤中具有分布广、隐蔽性大、治理困难等特点。其中16种被美国环保署列为优先控制的pahs。由于污水灌溉、大气沉降、石化泄露等造成我国及全球土壤pahs污染日趋严重。根据全国土壤污染调查公报显示,全国土壤中pahs超标率达到1.4%。
目前常见的土壤中pahs去除方法,主要通过物理或化学方法将土壤中pahs固定或分解。但是由于农田土壤的特殊应用,常用的物理或化学方法并不能够适用于修复农田土壤pahs污染。因此利用微生物修复这一具有低能耗、高效和环境安全的生物技术修复农田土壤具有实际意义。然而,仅以某一种或某几种纯培养的微生物作用于污染土壤,尽管有一定的降解效果,但不仅微生物用量大,而且不利于天然土壤微生物种群的平衡。目前,尚未发现利用驯化、富集土著pahs降解菌同时去除农田土壤中美国环保署优先控制的多环芳烃(usepapahs)的方法。
技术实现要素:
本发明旨在填补利用土著pahs降解菌群落同时去除农田土壤中美国环保署优先控制的多环芳烃(usepapahs)的方法技术应用的空白,提供一种利用土著pahs降解菌群落去除农田土壤中usepapahs的方法。
本发明的技术方案是:
一种利用土著pahs降解菌群落去除农田土壤中usepapahs的方法,包括以下步骤:
步骤一、土著pahs降解菌群落的制备:
(1)将土壤悬浊液加入预先配制的含有pahs的土壤浸出液中,对土壤中的细菌通过以pahs为唯一碳源进行驯化;
(2)监测驯化过程中参与pahs降解的细菌rhdα基因的丰度以及细菌群落的变化,驯化过程中nida和nahac的含量满足要求的做为一级种子液;
所述nida引物的正向引物序列和反向引物序列如seqidno.1及seqidno.2所示,
seqidno.1:ttcccgagtacgagggatac
seqidno.2:tcacgttgatgaacgacaaa;
所述nahac引物的正向引物序列及反向引物序列如seqidno.3和seqidno.4所示,
seqidno.3:acttggttccggagttgatg
seqidno.4:caggtcagcatgctgttgtt;
所述土著pahs降解菌群落的组成为:无色菌属(achromobacter)、类诺卡氏菌属(nocardioides)、甲基菌属(methylobacillus)、假单胞菌属(pseudomonas)、假黄色单胞菌属(pseudoxanthomonas)、根瘤菌属(rhizobium)、嗜甲基菌属(methylophilus)和志贺氏杆菌(shinella),该群落拥有广泛的降解谱,其在土壤浸出液中对于10种pahs都具有良好的降解效率;
(3)将所述一级种子液经扩大培养得到二级种子液;
步骤二、土壤接种:
将上述二级种子液接种于土壤,通过提高土壤中nida和nahac基因含量即可降低土壤pahs含量。
进一步地,在上述方案中,属水平上,所述土著pahs降解菌群落各降解菌的组成比例分别为:achromobacter(0.72–25.45%)、nocardioides(0.02%–19.88%)、methylobacillus(7.55–22.91%)、pseudomonas(6.18–30.03%)、pseudoxanthomonas(3.06–10.74%)rhizobium(0.37–8.56%)、methylophilus(2.35–14.34%)和shinella(0.97–10.56%);
门水平上,所述土著pahs降解菌群落的各降解菌的组成比例分别为:proteobacteria(78.58–99.54%),actinobacteria(0.14–19.96%),bacteroidetes(0.23–1.80%),verrucomicrobia(0.08–0.33%);
进一步地,在上述方案中,所述土著pahs降解菌群落的监测方法为:每隔两天采样一次并进行细菌群落结构鉴定和rhdα基因含量检测。
进一步地,在上述方案中,所述土著pahs降解菌群落的制备方法具体为:
(1)土壤浸出液的制备:将未污染的土壤和水以1:10的比例混合并搅拌均匀,静置2h后将上清液5000rpm/min离心10min以去除不溶性杂质,121℃高温灭菌20min后室温保存;
(2)一级种子液:按照10%的接种量将污染土壤的悬浊液接种到土壤浸出液中,再加入终浓度为30mgl-1的10种pahs经驯化、富集后,每隔两天将培养液5000rpm/min离心后一部分提取其基因组dna,另一部分加入终浓度为30%的甘油后冷冻保存为一级种子液;
(3)细菌群落的鉴定和rhdα基因含量的测定:经16srrna基因高通量测,测定该细菌群落16srrna基因v3-v4区;经qpcr鉴定其中nida和nahac和基因拷贝数;
(4)二级种子液:将所选的一级种子液经过lb培养基扩大培养后,8000rpm/min4℃离心5min,弃去上清液,加入蒸馏水,再次离心,该操作重复三次,以充分洗去菌体中残留的lb培养基;最后用蒸馏水调整菌悬液浓度od600,4℃保存备用为二级种子液。
优选地,在上述方案中,所述一级种子液od600值不小0.5。
优选地,在上述方案中,所述一级种子液中nida和nahac基因拷贝数分别达到至少3000和10000个每毫升。
优选地,在上述方案中,所述二级种子液浓度od600值为0.2-1.0。
进一步地,所述的pahs为以下10种pahs:萘、苊烯、苊、菲、蒽、荧蒽、芘、苯并[a]蒽和
进一步地,所述接种方式为按照每1kg土接种100ml,将二级种子液直接喷洒到土壤并搅拌均匀。
与现有技术相比,本发明的有益效果体现在:
(1)本发明能够有效的去除usepapahs,尤其对高环pahs去除率较高(2)本发明可以在去除usepapahs的同时并不引入任何化学试剂或者非土著的细菌。
附图说明
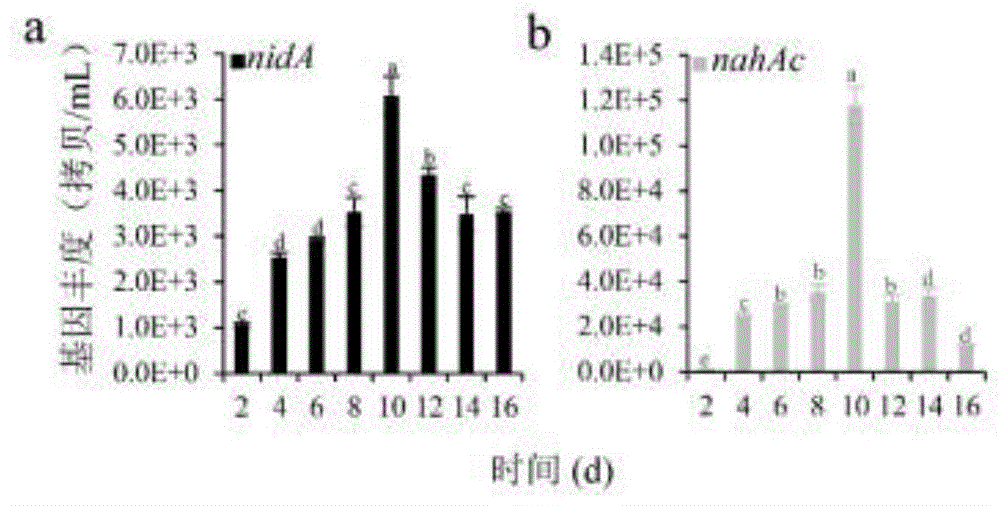
图1是一级种子液中rhdα基因丰度;其中,图a为nida的基因丰度,图b为nahac的基因丰度;
图2是加入不同含量的土著pahs降解菌群落对于土壤中pahs降解的影响结果图;
图3是第35天土壤中不同环数多环芳烃的降解效率;
图4是加入不同含量土著pahs降解菌群落的土壤中rhdα基因含量变化。
具体实施方式
下面结合实施例对本发明做进一步说明,但本发明的保护范围不限于此。
1、土著pahs降解菌群落的制备:
(1)土壤浸出液的制备:将未污染的土壤和水以1:10的比列混合并搅拌均匀,静置2h后将上清液5000rpm/min离心10min以去除不溶性杂质,121℃高温灭菌20min后室温保存。
(2)一级种子液:按照10%的接种量将污染土壤的悬浊液接种到土壤浸出液中,再加入终浓度为30mgl-1的10种pahs经16天驯化、富集。每隔两天采样一次,将培养液5000rpm/min离心后一部分提取其基因组dna,另一部分加入终浓度为30%的甘油后冷冻保存为一级种子液。
(3)细菌群落的鉴定和rhdα基因含量的测定:经16srrna基因高通量测,测定该细菌群落16srrna基因v3-v4区。经qpcr鉴定其中nida和nahac基因拷贝数。
(4)二级种子液:合适的一级种子液经过lb培养基扩大培养后,8000rpm/min4℃离心5min,弃去上清液,加入蒸馏水,再次离心,该操作重复三次,以充分洗去菌体中残留的lb培养基制得od600值为0.0、0.2、0.5和1.0的土著pahs降解菌群落储备液,4℃保存备用为二级种子液。其中od600值为0.0的二级种子液仅含蒸馏水用于对照试验。
将上述二级种子液按照每千克土100ml为标准接种到受pahs污染的农田土中。每隔七天采样一次持续35天,并测定土壤中pahs及nida和nahac的含量。
2、一级种子液群落结构分析
(1)pcr扩增:以一级种子液基因组dna为模版,使用16srrnav3-v4区域的特异性引物、takara公司高保真酶进行pcr,确保产物特异性。
(2)pcr产物纯化:产物使用1.5%浓度的琼脂糖凝胶进行电泳检测,利用axygen公司的胶回收试剂盒回收目的条带。
(3)测序及生物信息学分析:将pcr产物建库后用miseqpe350进行测序,并进一步分析其群落结构。
3、待测土壤pahs含量的测定:
将土壤经真空冷冻干燥后充分研磨,-80℃保存待测。
取上述制备好的土壤样品于20ml玻璃离心管中,分别加入10ml二氯甲烷,水浴超声处理30min,静置30min,将所有上清液过层析柱(上层2g无水硫酸钠,下层2g硅胶)净化并用10ml体积比为1:1的二氯甲烷和正己烷溶液洗脱;洗脱液40℃恒温下浓缩至干,用甲醇定容到2ml,过0.22μm孔径有机相滤膜后,hplc/uv-fld分析。
4、待测样品nida和nahac含量的测定:
(1)一级种子液中,nida和nahac基因含量的测定
以一级种子液基因组dna为模版,分别使用nida和nahac基因特异性引物、诺唯赞公司aceqqpcrsybrgreenmastermix进行qpcr实验,测定一级种子液中上述两个基因的含量。
其中nida引物序列为:
正向引物:ttcccgagtacgagggatac
反向引物:tcacgttgatgaacgacaaa;
nahac引物序列为:
正向引物:acttggttccggagttgatg
反向引物:caggtcagcatgctgttgtt。
(2)待测土壤中nida和nahac含量的测定
取0.25g新鲜的土壤,按照强力土壤dna提取试剂盒说明书提取土壤总dna,-20℃保存。土壤中nida和nahac测定方法同(1)中一级种子液中方法。
表1不同天的数细菌群落组成。
由表1和图1可知,在16天的驯化过程中第10天的群落结构以及nida和nahac的含量满足要求被选为合适的一级种子液。该一级种子液achromobacter、nocardioides、methylobacillus、pseudomonas、pseudoxanthomonas、rhizobium、methylophilus和shinella的含量分别为25.45%、13.26%、10.68%、10.36%、6.02%、3.07%、4.73%和2.10%;nida和nahac的基因丰度为6083和11770。
由图2和图3可知,加入od600值为0.2、0.5和1.0的二级种子液均可以明显降低污染土壤中的pahs含量,其pahs含量从95.23mgkg-1分别降低到了29.85、28.09和23.41mgkg-1。其中,2-3和4-5环pahs的降解效率并不与加入的菌量成正相关,但6环pahs降解效率与加入的菌量成正相关。因此,在降解含2-5环pahs较多的土壤时,二级种子液浓度为0.2即可;而降解6环pahs较多的土壤时,二级种子液的浓度可设置为1.0。
由图4可知,加入od600值为0.2、0.5和1.0的二级种子液可以明显提高参与pahs降解、具有编码双加氧酶α亚基功能的nida和nahac基因丰度。上述两个基因丰度的提高加快土壤中pahs降解的效率。
可见,本发明的一种利用驯化、富集的土著pahs降解菌群落去除农田土壤中usepapahs的方法,能够有效的去除土壤中usepapahs,总去除率高达68%以上,且对土壤理化性质无不良影响,具有环保、高效的特点。
根据以上描述,本领域技术人员可以容易地确定本发明的必要特性,并且在不背离其精神和范围的情况下,可以做出本发明的多种变化和修改以使其适应多种用途和情况。因此,其他实施方案也在权利要求的范围内。
序列表
<110>南京农业大学
<120>一种利用土著pahs降解菌群落去除农田土壤中usepapahs的方法
<130>无
<170>patentinversion3.5
<210>1
<211>20
<212>dna
<213>人工序列
<221>misc_feature
<222>(1)..(20)
<223>根据实验要求而设计,作为nida正向引物
<400>1
ttcccgagtacgagggatac20
<210>2
<211>20
<212>dna
<213>人工序列
<221>misc_feature
<222>(1)..(20)
<223>根据实验要求而设计,作为nida反向引物
<400>2
tcacgttgatgaacgacaaa20
<210>3
<211>20
<212>dna
<213>abramisbrama
<221>misc_feature
<222>(1)..(20)
<223>根据实验要求而设计,作为nahac的正向引物
<400>3
acttggttccggagttgatg20
<210>4
<211>20
<212>dna
<213>abramisbrama
<221>misc_feature
<222>(1)..(20)
<223>根据实验要求而设计,作为nahac的反向引物
<400>4
caggtcagcatgctgttgtt20
- 还没有人留言评论。精彩留言会获得点赞!