一种增强谷氨酰胺酶耐盐性的方法与流程
本发明涉及一种增强谷氨酰胺酶耐盐性的方法,属于生物工程技术领域。
背景技术:
酱油作为东方传统食品,同时也是中式餐饮中常用的调味品。谷氨酸被认为是酱、酱油等大豆发酵食品中主要的鲜味氨基酸。在酱油酿造业中,通常利用谷氨酰胺酶水解酱油发酵原料中的谷氨酰胺生成谷氨酸,因此影响酱油发酵中谷氨酸得率的关键因素是酱油曲料中的谷氨酰胺酶的酶活力。酱油发酵过程中,在谷氨酰胺酶活力不高的情况下,部分谷氨酰胺会转变成一种无鲜味的物质——焦谷氨酸,此转化过程不可逆且影响酱油的口感和品质;当谷氨酰胺酶活力较高时,谷氨酰胺会尽可能多地转化成谷氨酸,提高酱油鲜味。由于谷氨酰胺酶的酶学性质、菌种制曲环境、微生物菌相、安全性等方面存在差异,不同的谷氨酰胺酶对酱油谷氨酸含量的提高效果有显著性差距。
由于酱油发酵的温度和盐浓度一般较高,耐盐耐热型谷氨酰胺酶更符合产业需求。酱油主要发酵菌株曲霉菌和米曲霉产生的谷氨酰胺酶在盐份高于15%(w/v)的条件下被显著抑制,而15-18%的盐浓度是生产酱油的常用条件。在酱油酿造过程中,如何提高谷氨酰胺酶活力、热稳定性和耐盐性,有效提高酱油中谷氨酸含量,进而提高酱油鲜味,已经成为酱油酿造业学者的目标。目前,关于提高谷氨酰胺酶耐盐性的方法甚少。alexandra等对食品级乳酸菌(lactobacilli)进行筛选,得到了一株产谷氨酰胺酶的鼠李糖乳杆菌(lactobacillusrhamnosus)。该酶具有较高盐耐受性,即在5%(w/v)盐的存在下该酶活性增加两倍,在15%(w/v)盐的存在下该酶保留90%活性。韩铭海等筛选得到一株高产谷氨酰胺酶菌株,属于柠檬酸细菌属(citrobacter),该酶对nacl有较好的耐性。大多数研究都侧重筛选菌株从而得到耐盐性较高的谷氨酰胺酶,这样的方法周期性长、目的性弱。目前,无有效的蛋白质改造的策略来提高酶的耐盐性,特别是分子改造提高耐盐性的技术非常罕见。
自组装双亲短肽(self-assemblingpeptide,sap)是一类亲疏水氨基酸交替分布,能自发组装成纳米结构的短肽,其特有的两亲性质使得其在水中能形成水凝胶,从而对目的蛋白或其他小分子进行固定化。sap通过linker与酶融合,得到融合酶,融合后的sap通过强化分子间疏水作用使酶分子形成刚性更强的寡聚体,提高酶热稳定性。大量研究显示,在蛋白n或c端融合sap,能降低末端柔性,提高蛋白的热稳定性。中国专利cn102660570a公开了一种提高酶热稳定性的方法,是通过将双亲短肽与重组酶进行融合表达获得热稳定性提高的重组酶。
技术实现要素:
本发明的第一个目的是提供一种产谷氨酰胺酶(ybgj)的重组枯草芽孢杆菌,融合表达了谷氨酰胺酶与双亲短肽,所述双亲短肽包括aeak或lelk,所述aeak含seqidno.1所示的氨基酸序列,所述lelk含seqidno.2所示的氨基酸序列。
在本发明的一种实施方式中,以pp43nmk为表达载体。
在本发明的一种实施方式中,ybgj的氨基酸序列如seqidno.3所示。
在本发明的一种实施方式中,ybgj基因的genbankid为938416。
在本发明的一种实施方式中,表达宿主包括b.subtiliswb600。
本发明的第二个目的是提供一种增强谷氨酰胺酶耐盐性的方法,融合表达了谷氨酰胺酶与双亲短肽aeak或lelk,所述aeak含seqidno.1所示的氨基酸序列,所述lelk含seqidno.2所示的氨基酸序列。
本发明的第三个目的是提供一种生产谷氨酰胺酶的方法,应用了上述的重组枯草芽孢杆菌进行发酵。
在本发明的一种实施方式中,挑取工程菌单菌落接入种子培养基中,培养温度35-38℃,摇床转速180-220r/min,培养5-12h;按1-5%的接种量接入发酵培养基中,培养温度35-38℃,摇床转速180-220r/min,培养15-25h。
本发明的第四个目的是提供上述重组枯草芽孢杆菌的构建方法,所述方法包括以下步骤:
(1)重组酶表达质粒的构建:将ybgj基因克隆至大肠杆菌-枯草芽孢杆菌穿梭质粒pp43nmk质粒的p43启动子的下游,构建得到重组酶的表达质粒pp43nmk-ybgj;
(2)融合双亲短肽的重组酶表达质粒的构建:根据双亲短肽和ptlinker的氨基酸序列,化学合成相应的dna序列,并将其克隆至pp43nmk-ybgj质粒的p43启动子下游,构建成为pp43nmk-saps-ptlinker-ybgj质粒;
(3)融合双亲短肽的重组酶表达菌株的构建:将重组质粒pp43nmk-saps-ptlinker-ybgj转化到枯草芽孢杆菌宿主中,构建表达ybgj的枯草芽孢杆菌基因工程菌。本发明的第五个目的是提供上述的重组枯草芽孢杆菌在酱油生产中的应用。
在本发明的一种实施方式中,ptlinker的氨基酸序列如seqidno.4所示。
本发明的第六个目的是提供上述的一种增强谷氨酰胺酶耐盐性的方法在酱油生产中的应用。
本发明的第七个目的是提供上述的一种生产谷氨酰胺酶的方法在酱油生产中的应用。
本发明的有益效果:
本发明为解决ybgj耐盐性差,无法在酱油发酵过程中保持较高的酶活力的问题,提供一种提高ybgj耐盐性的方法,通过在ybgj的n端融合表达sap,得到耐盐性提高的两个融合酶aeak-ybgj和lelk-ybgj。通过酶学性质分析,融合酶aeak-ybgj和lelk-ybgj半衰期(t1/2,55℃)较出发菌株分别提高58%、69%。在18%nacl溶液中处理120min的残余酶活分别提高6.4倍和7倍;在20%nacl环境中相对酶活分别提高0.6倍和1倍,两个融合酶耐盐性均得到提高。
附图说明
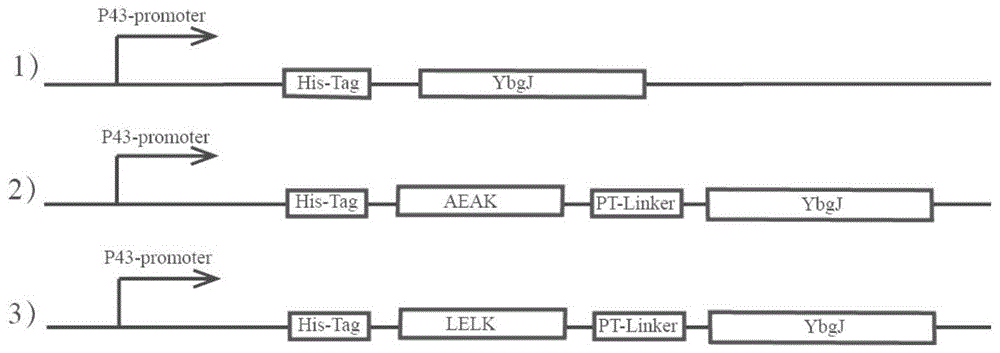
图1:融合酶表达框。
图2:在不同nacl浓度下ybgj和融合酶的耐盐性,其中,ybgj(■),aeak-ybgj(▲),lelk-ybgj(□);a):无naclb):10%naclc):15%nacld):18%nacl。
图3:融合酶的耐盐性,其中,ybgj(■),aeak-ybgj(▲),lelk-ybgj(□)。
图4:ybgj和融合酶在盐溶液中的储存稳定性,其中,ybgj(■),aeak-ybgj(▲),a:0%nacl;b:5%nacl;c:10%nacl;d:15%nacl。
图5:酱油发酵模型中谷氨酸的产量,其中,ybgj(■),aeak-ybgj(▲),lelk-ybgj(□)。
具体实施方式
(一)培养基
lb种子培养基(g/l):酵母粉5,胰蛋白胨10,nacl10;
tb发酵培养基(g/l):酵母粉24,胰蛋白胨12,甘油4,k2hpo416.43,kh2po42.31,调节ph至7.0,于121℃,0.08mpa下灭菌20min。固体培养基是在液体培养基中加2%的琼脂。
实施例1重组酶表达质粒pp43nmk-ybgj的构建
以b.subtilis168基因组为模板,利用引物p1、p2(如表1)扩增获得目的片段ybgj基因(genbankid:938416)。目的片段经柱回收后与克隆载体pmd18-t连接,转化至e.colijm109,利用菌落pcr技术获取阳性转化子。挑取2-3株阳性菌送上海生工测序,本实施例中涉及的所有测序工作均由上海生工完成。将测序正确的重组质粒命名为t-ybgj。
利用引物p3、p4,以pp43nmk质粒为模板扩增表达载体。利用引物p5、p6,以t-ybgj质粒为模板扩增目的片段。表达载体和目的片段均需经过柱回收后再利用一步克隆试剂盒连接,转化至大肠杆菌(e.colijm109),菌落pcr挑取阳性转化子送测序,将重组质粒命名为pp43nmk-ybgj。
表1引物
实施例2融合酶表达质粒的构建
通过化学合成dna序列获得aeak-ptlinker,lelk-ptlinker。设计引物(表1),利用一步克隆试剂盒将其克隆至pp43nmk-ybgj质粒的p43启动子下游,连接产物转化感受态e.colijm109。挑选阳性转化子,测序验证,得到质粒pp43nmk-aeak-ybgj和pp43nmk-lelk-ybgj。所需的引物均由上海生物工程股份有限公司合成。表达框如图1所示。
实施例3融合双亲短肽的重组酶表达菌株的构建
将测序正确的质粒pp43nmk-ybgj,pp43nmk-aeak-ybgj和pp43nmk-lelk-ybgj转化至b.subtiliswb600,得到表达菌株b.subtiliswb600/pp43nmk-ybgj,b.subtiliswb600/pp43nmk-aeak-ybgj和b.subtiliswb600/pp43nmk-lelk-ybgj。
实施例4发酵生产ybgj,aeak-ybgj和lelk-ybgj及纯酶液的制备
培养方法:种子培养,挑取工程菌单菌落接入装有种子培养基的装液量为20ml的三角瓶(250ml)中,培养温度37℃,摇床转速200r/min,培养8h;发酵培养,按2%的接种量接入装有发酵培养基的装液量为25ml的三角瓶(250ml)中,培养温度37℃,摇床转速200r/min,培养15h。
发酵结束后,将发酵液在4℃,7000r·min-1条件下离心15min后收集菌体,用磷酸盐缓冲液(ph7.5,20mmk2hpo4-kh2po4缓冲液)将菌体重悬后超声破碎30min(工作1s,暂停2s),于4℃,7000r·min-1条件下离心15min即得粗酶液。将粗酶液经0.22μm滤膜过滤后使用histraptmhp5ml(ge)进行纯化。使用a液(20mmol·l-1的磷酸盐缓冲液,用0.22μm滤膜过滤)平衡预装柱,以1ml·min-1的流速上样,上样量15ml。再用10倍柱体积的a液洗脱非特异性结合杂质,随后用b液(称取17g咪唑固体溶解于a液中,定容至500ml,用0.22μm滤膜过滤)洗脱结合蛋白。通过对纯化洗脱条件的优化,8%洗脱缓冲液洗脱出杂蛋白,35%洗脱缓冲液洗脱出目标蛋白。收集穿透峰、洗脱峰,利用sds-page检测ybgj纯化情况。
实施例5ybgj酶活测定
采用奈氏试剂法测定ybgj的活力。利用磷酸盐缓冲液配制底物(l-谷氨酰胺,1.2g·110ml-1,74mm),取1100μl底物于37℃保温10min后,加入100μl稀释到适当倍数的粗酶液,37℃反应10min后加入100μl终止剂(1.5mol·l-1三氯乙酸,称取49.02g定容至200ml)终止反应。在37℃保温10min的1100μl底物中加入上述100μl粗酶液与100μl终止剂的混合液,于37℃保温10min,所得溶液即为吸光度检测的对照。反应结束后,12000r·min-1离心2min,取100μl上清,加入3400μl去离子水和500μl奈氏试剂(0.09mol·l-1khgi4与2.5mol·l-1koh的混合溶液称为奈斯勒试剂。称取28.06gkoh,加100ml水溶解,冷却后称取14.16gkhgi4,koh溶液加到khgi4中定容至200ml。静置12h后再使用),混匀后在波长436nm下测定吸光度。
酶活力的定义:在37℃,ph为7.5条件下每分钟催化l-谷氨酰胺产生1μmolnh3所需要的酶量定义为一个酶活力单位。
aeak-ybgj主要在胞内可溶部分,酶活为52u/ml。lelk-ybgj主要在胞内不溶部分,酶活为153u/ml。
对比例
将双亲短肽分别替换为sap2(氨基酸序列为:dwlkafydkvaeklkeafgllpvledwlkafydkvaeklkeaf)、sap3(氨基酸序列为:dwlkafydkvaeklkeafkvqpylddwlkafydkvaeklkeaf)、sap4(氨基酸序列为:dwlkafydkvaeklkeafnggarladwlkafydkvaeklkeaf)、sap5(氨基酸序列为:dwlkafydkvaeklkeafkveplradwlkafydkvaeklkeaf)其余条件同实施例1-5。
得到的重组酶主要在胞内可溶部分,双亲短肽替换为sap2、sap3、sap4、sap5后,得到的重组酶酶活分别为32u/ml、39u/ml、27u/ml、16u/ml。
实施例6酶学参数的测定
半衰期检测(t1/2,min):将纯化后的ybgj和融合酶稀释到同一浓度,放置于55℃水浴保温100min,其中每隔10min取样并按照实例5方法测定ybgj的残余酶活,确定半衰期。
耐盐性检测:
1)利用不同浓度的nacl-磷酸盐缓冲液将纯化后的ybgj和融合酶稀释到同一酶活,放置于50℃水浴保温200min,其中每隔20min取样并按照实例5方法测定ybgj的残余酶活,考察酶耐盐性。
2)在底物谷氨酰胺酶溶液中添加nacl溶液至终浓度分别为0%、5%、10%、15%、18%、20%,按照实施例5中的方法测定ybgj及融合酶的相对酶活考察盐浓度对酶促反应的影响。
3)将ybgj和融合酶分别添加到不同nacl浓度的缓冲液中,25℃下储存,按照实例5方法测定不同时间下残余酶活,考察它们在盐溶液中的储存稳定性,进一步评估融合酶的耐盐性。
如图2所示,在无nacl存在的环境中,ybgj在80min后几乎完全失活。在10%nacl存在的环境中,处理相同时间,ybgj的残余酶活有小幅度增长。但是当盐浓度提高,ybgj的残余酶活迅速下降,这表明ybgj活性在高浓度nacl环境中会被抑制。融合酶aeak-ybgj、lelk-ybgj能有效提高在nacl环境中的耐盐性。随着nacl浓度提高,融合酶的残余酶活显著提高。在18%nacl的环境中保温时,前80min融合酶残余酶活与相比总体呈现上升趋势,残余酶活达到120%,随后两者的残余酶活均降低。这表明蛋白n端融合saps能提高ybgj的耐盐性,但这种耐受高盐的特性只能维持在一定的时间内。
如图3所示,随着盐浓度的增加,ybgj的相对酶活下降较快,高盐环境抑制ybgj的酶促反应,该酶在20%nacl环境中活性仅剩25%。与ybgj相比,融合酶aeak-ybgj和lelk-ybgj的相对酶活下降的幅度减小,高盐环境对融合酶酶促反应的抑制作用得到缓解。aeak-ybgj和lelk-ybgj在20%nacl环境中相对酶活分别提高0.6倍和1倍。研究发现融合酶lelk-ybgj对抗盐环境的能力更强。
如图4所示,无nacl存在的缓冲溶液中,ybgj及aeak-ybgj储藏时间都比较短,ybgj储藏五天时残余酶活基本为0。在5%和10%nacl存在的缓冲溶液中,ybgj储藏过程中残余酶活降低缓慢,在储存14天时,ybgj残余酶活仍有30%。但随着盐浓度的增加,ybgj储藏过程中酶活丧失较快。在储存稳定性实验中,相比于ybgj,在储藏前期融合酶aeak-ybgj的残余酶活降低缓慢。若要进行短时间储藏,融合酶aeak-ybgj更适合在10%左右nacl的缓冲溶液中储藏6-8天。
km和kcat测定:配制0、10、20、30、40、50、60、70、80、90、100mm的不同浓度的l-谷氨酰胺溶液,加入过量的酶液,按照实例5测定酶活力,并用matlab软件拟合y=ax/(b+x)曲线,b=km、a=vmax,再计算得到kcat值、kcat/km值。
表2ybg、aeak-ybgj和lelk-ybgj的酶学性质。
注:p值用于判断ybgj和融合酶之间酶学参数的统计学显着性。
实施例7酱油发酵模拟体系的构建
酱油发酵模拟体系(5ml)中包含大豆蛋白分离物、nacl、碱性蛋白酶、复合风味酶、谷氨酰胺酶。0.5g大豆蛋白分离物(spi)溶于100mmtris-hcl(ph8.0)中,定容至5ml,再加入500μl碱性蛋白酶,经60℃水浴2h后加入500μl复合风味,50℃继续水浴4h。结束后,90℃,10min终止蛋白酶活性。将模拟体系在4℃,12000r·min-1条件下离心15min,收集上层样品,定容至5ml,用作生物转化反应的底物。
根据fields的方法(参考文献:fieldsr.therapiddeterminationofaminogroupswithtnbs[j].methodsinenzymology,1972,25(464-468).)利用三硝基苯磺酸(tnbs)测定α-氨基含量以检测大豆蛋白分离物被酶解的程度,使用l-亮氨酸作为标准样品。在上层样品中加入nacl至终浓度为15%,调节ph至5。将制备得到的ybgj及突变体纯酶液(2u)添加到模拟体系中,45℃水浴保温,在不同的时间点取出1ml反应液,90℃,10min终止酶反应。利用谷氨酸脱氢酶检测谷氨酸的含量。
如图5所示,相比于添加ybgj的酱油发酵模拟体系,添加融合酶有效地增加了谷氨酸的含量。在ph为5的酱油发酵模型中,反应5h时,添加aeak-ybgj和lelk-e3c/e5-5f/d213t模型中的谷氨酸的含量分别比添加ybgj提高69%和114%。随着反应时间的延长,谷氨酰胺酶逐渐失活,谷氨酸含量的增长逐渐减慢。比较图中的3条曲线,发现在5-10h的发酵模型中,谷氨酸增长速率为lelk-ybgj>aeak-ybgj>ybgj。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
sequencelisting
<110>江南大学
<120>一种增强谷氨酰胺酶耐盐性的方法
<160>20
<170>patentinversion3.3
<210>1
<211>16
<212>prt
<213>人工序列
<400>1
alaglualaglualalysalalysalaglualaglualalysalalys
151015
<210>2
<211>16
<212>prt
<213>人工序列
<400>2
leugluleugluleulysleulysleugluleugluleulysleulys
151015
<210>3
<211>327
<212>prt
<213>bacillussubtilis
<400>3
metlysgluleuilelysgluhisglnlysaspileasnproalaleu
151015
glnleuhisasptrpvalglutyrtyrargprophealaalaasngly
202530
glnseralaasntyrileproalaleuglylysvalasnaspsergln
354045
leuglyilecysvalleugluproaspglythrmetilehisalagly
505560
asptrpasnvalserphethrmetglnserileserlysvalileser
65707580
pheilealaalacysmetserargglyileprotyrvalleuasparg
859095
valaspvalgluprothrglyaspalapheasnserileileargleu
100105110
gluileasnlysproglylyspropheasnprometileasnalagly
115120125
alaleuthrilealaserileleuproglygluseralatyrglulys
130135140
leuglupheleutyrservalmetgluthrleuileglylysargpro
145150155160
argilehisglugluvalpheargserglutrpgluthralahisarg
165170175
asnargalaleualatyrtyrleulysgluthrasnpheleugluala
180185190
gluvalglugluthrleugluvaltyrleulysglncysalametglu
195200205
serthrthrgluaspilealaleuileglyleuileleualahisasp
210215220
glytyrhisproilearghisgluglnvalileprolysaspvalala
225230235240
lysleualalysalaleumetleuthrcysglymettyrasnalaser
245250255
glylystyralaalaphevalglyvalproalalysserglyvalser
260265270
glyglyilemetalaleuvalproproseralaargarggluglnpro
275280285
pheglnserglycysglyileglyiletyrglyproalaileaspglu
290295300
tyrglyasnserleuthrglyglymetleuleulyshismetalagln
305310315320
glutrpgluleuserilephe
325
<210>4
<211>17
<212>prt
<213>人工序列
<400>4
prothrproprothrthrprothrproprothrthrprothrprothr
151015
pro
<210>5
<211>43
<212>prt
<213>人工序列
<400>5
asptrpleulysalaphetyrasplysvalalaglulysleulysglu
151015
alapheglyleuleuprovalleugluasptrpleulysalaphetyr
202530
asplysvalalaglulysleulysglualaphe
3540
<210>6
<211>43
<212>prt
<213>人工序列
<400>6
asptrpleulysalaphetyrasplysvalalaglulysleulysglu
151015
alaphelysvalglnprotyrleuaspasptrpleulysalaphetyr
202530
asplysvalalaglulysleulysglualaphe
3540
<210>7
<211>43
<212>prt
<213>人工序列
<400>7
asptrpleulysalaphetyrasplysvalalaglulysleulysglu
151015
alapheasnglyglyalaargleualaasptrpleulysalaphetyr
202530
asplysvalalaglulysleulysglualaphe
3540
<210>8
<211>43
<212>prt
<213>人工序列
<400>8
asptrpleulysalaphetyrasplysvalalaglulysleulysglu
151015
alaphelysvalgluproleuargalaasptrpleulysalaphetyr
202530
asplysvalalaglulysleulysglualaphe
3540
<210>9
<211>34
<212>dna
<213>人工序列
<400>9
atgaaagaattgataaaagagcaccagaaagaca34
<210>10
<211>28
<212>dna
<213>人工序列
<400>10
ttaaaaaatgctgagctcccattcctgc28
<210>11
<211>35
<212>dna
<213>人工序列
<400>11
tacattcctctcttacctataatggtaccgctatc35
<210>12
<211>35
<212>dna
<213>人工序列
<400>12
agcttggcgtaatcatggtcatagctgtttcctgt35
<210>13
<211>71
<212>dna
<213>人工序列
<400>13
gtaagagaggaatgtacacatgcaccaccaccaccaccacaaagaattgataaaagagca60
ccagaaagaca71
<210>14
<211>47
<212>dna
<213>人工序列
<400>14
accatgattacgccaagctttaaaaaatgctgagctcccattcctgc47
<210>15
<211>61
<212>dna
<213>人工序列
<400>15
caccccgactccgaccccaatgaaagaattgataaaagagcaccagaaagacataaaccc60
g61
<210>16
<211>49
<212>dna
<213>人工序列
<400>16
accatgattacgccaagctttaaaaaatgctgagctcccattcctgcgc49
<210>17
<211>38
<212>dna
<213>人工序列
<400>17
agcttggcgtaatcatggtcatagctgtttcctgtgtg38
<210>18
<211>24
<212>dna
<213>人工序列
<400>18
tggggtcggagtcggggtggtcgg24
<210>19
<211>35
<212>dna
<213>人工序列
<400>19
ctagaactagaactgaaactcaaactcgaactaga35
<210>20
<211>24
<212>dna
<213>人工序列
<400>20
tggggtcggagtcggggtggtcgg24
- 还没有人留言评论。精彩留言会获得点赞!