一种促进细胞分泌外泌体的方法及应用与流程
本发明涉及生物材料、组织工程和再生医学领域,尤其涉及一种促进细胞分泌外泌体的方法及应用。
背景技术:
组织创伤在临床上一直面临着庞大的病患队伍,虽然人体组织具有一定的自我修复能力,但是当创伤面积过大、患者身体虚弱、机体功能差或创面局部环境紊乱不利于其自身修复,例如血管被严重破坏、血液及营养供给不足时,创伤便无法正常修复,而长时间未正常修复的创面不仅严重影响病患的生活质量,甚至还会引起身体的其他病变,进一步危害患者健康。因此,寻找一种能够促进组织创伤快速、有效修复的方法一直是临床研究的热点方向。
生物材料已被广泛应用于组织工程和再生医学,而生物材料作用于组织细胞则最主要以其自身携带的活性信号进行刺激。已有广泛研究显示,生物材料,如生物活性硅酸盐陶瓷、静电纺丝纤维膜、水凝胶等,能够明显促进皮肤创伤、骨缺损和骨-软骨组织等的修复。然而,直接应用生物材料于组织创伤部位进行治疗则面临着免疫排斥、材料毒性、材料降解和浓度难把握等困难。
细胞,尤其是干细胞,在正常组织的新陈代谢及受损组织的自我修复过程中发挥的作用越来越被重视,利用细胞移植进行促进组织创伤修复已成为再生医学领域一种重要的手段。从大量的临床研究结果来看,在组织创面进行细胞移植能够明显促进受损组织再生和功能恢复,而进一步的研究发现,移植的细胞主要通过分泌各种分子、生长因子、细胞因子、蛋白、细胞外微囊泡等成分并作用于其他参与组织修复的细胞,继而激活这些参与组织修复的细胞使其快速表达相关功能蛋白,进行细胞-细胞间旁分泌交流机制,最终实现促进组织创伤快速修复。
然而,近些年的研究发现,细胞治疗存在着诸多缺点,如细胞来源有限、细胞移植密度难以把握、移植细胞引起组织创面组织过度增生甚至形成肿瘤、免疫排斥反应等。外泌体是细胞分泌的具有多种生物功能的纳米囊泡,是重要的细胞分泌物和细胞-细胞间进行旁分泌交流的信号载体。外泌体中装载有多种蛋白、磷酯类、供体细胞全部基因组、mrna、microrna等,可通过胞吞胞饮、受体结合、配体介导等多种方式被受体细胞捕获内化,并对受体细胞产生一定的生物学效应,从而实现细胞-细胞间的旁分泌交流。在初期的研究中,研究者发现病变组织或细胞分泌的外泌体在成分上与正常组织分泌的外泌体明显不同,因此外泌体也一度被作为临床疾病诊断的重要指标,而且外泌体诊断具有超微创甚至完全无创的优势。而最近几年的研究发现,所有细胞都能分泌外泌体,而同一种细胞在不同条件下分泌的外泌体,其携带的生物信息和具备的生物功能也明显不同。在组织工程和再生医学领域的研究中,众多结果显示,用外泌体进行组织创伤治疗具有与细胞移植治疗同水平的促进组织修复功能,而且避免了细胞移植治疗的诸多缺陷,如免疫排斥等。但是细胞在常规培养条件下分泌外泌体的能力有限,且其功能往往单一。
因此,本领域的技术人员致力于开发一种能够促进细胞分泌数量更多且具有更强促进组织修复功能的外泌体的方法。
技术实现要素:
有鉴于现有技术的上述缺陷,本发明所要解决的技术问题是如何提供一种促进细胞分泌数量更多且具有更强促进组织修复功能的外泌体的方法
为实现上述目的,本发明提供了一种促进细胞分泌外泌体的方法,所述方法采用生物材料活性信号对细胞进行刺激。
进一步地,所述生物材料活性信号为生物材料活性化学信号、生物材料活性结构信号和生物材料活性力学信号中的任意一种或多种。
进一步地,所述外泌体由具有组织修复功能的干细胞、成体细胞及免疫细胞分泌而得。
进一步地,所述方法包括以下步骤:
步骤1、将生物活性玻璃加入无血清间充质干细胞培养液中培养,无菌过滤收集滤液即得到生物活性玻璃浸提液;
步骤2、利用高速旋转滚筒收集聚己内酯/外消旋聚乳酸(pcl/pdlla)电纺丝得到定向静电纺丝纤维膜;
步骤3、用所述无血清间充质干细胞培养液按1:128比例稀释所述生物活性玻璃浸提液,并继续培养间充质干细胞一段时间,收集培养上清液;
步骤4、将步骤2所述定向静电纺丝纤维膜裁剪成适宜大小,灭菌处理后置于培养皿,加入间充质干细胞悬浮液,用完全间充质干细胞培养液培养1天,弃掉旧培养液,加入所述无血清间充质干细胞培养液继续培养所述间充质干细胞一段时间,收集培养上清液;
步骤5、将所述定向静电纺丝纤维膜裁剪成适宜大小,灭菌处理后置于,加入所述间充质干细胞悬浮液,用所述完全间充质干细胞培养液培养1天,弃掉旧培养液,用所述无血清间充质干细胞培养液按照1:128比例稀释步骤1中所述生物活性玻璃浸提液,并继续培养所述间充质干细胞一段时间,收集培养上清液;
步骤6、采用超速-梯度离心法提取步骤3、4、5中收集到的所述培养上清液中的所述外泌体,即得到所述间充质干细胞分别经所述生物材料活性化学信号、所述生物材料活性结构信号和生物材料活性化学/结构组合信号刺激产生的所述外泌体。
进一步地,所述生物活性玻璃浸提液稀释后的ca离子浓度为65.05±0.35μg/ml,si离子浓度为1.01±0.07μg/ml。
进一步地,所述高速旋转滚筒的转速为2000r/min。
进一步地,每平方厘米所述定向静电纺丝纤维膜上加入的所述间充质干细胞的数量为1×104~3×104。
进一步地,所述聚己内酯/外消旋聚乳酸(pcl/pdlla)电纺丝通过将质量比为1:1的pcl和pdlla以4.8%的质量体积比溶解于体积比为4:1的dmf和thf中,利用静电纺丝设备以10kv电压、0.02ml/min流量和12cm接收距离的条件下制备而得。
进一步地,所述定向静电纺丝纤维膜裁剪后还需紫外照射灭菌和酒精浸泡。
本发明还提供上述的促进细胞分泌外泌体的方法在制备促进创伤修复外泌体材料中的应用。
本发明中细胞培养环境、培养器皿及培养技术相比于常规细胞培养皆无额外要求,通过在细胞培养过程中加入生物材料活性信号刺激细胞使其快速分泌释放外泌体,这些外泌体具有产量高、促进组织修复功能强的特点,能够促进外泌体对应受体细胞快速表达其功能基因并合成相应蛋白,如间充质干细胞来源的外泌体,可促进其受体细胞脐静脉内皮细胞快速表达血管内皮生长因子(vegf)、血管内皮生长因子受体(kdr)、内皮型一氧化氮合酶(enos)等成血管相关的生长因子和蛋白;而脐静脉内皮细胞来源的外泌体,可促进其受体细胞骨髓间充质干细胞快速表达碱性磷酸酶(alp)、骨钙素(oc)、胶原蛋白-1(col-i)等成骨相关基因及蛋白,促进受体细胞进行快速功能分化,从而促进创面快速修复。在实际应用中,用该方法得到的间充质干细胞外泌体能够促进脐静脉内皮细胞在体外快速成网状生长,并且在体内小鼠皮下快速生成更多微小血管;用该方法得到的脐静脉内皮细胞外泌体能够促进骨髓间充质干细胞快速成骨分化。
以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
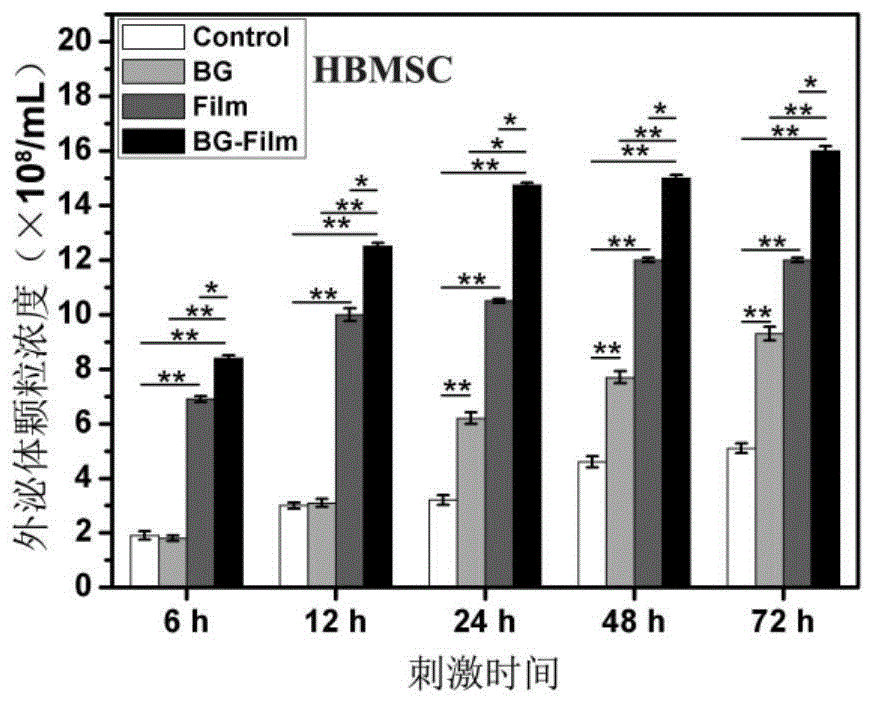
图1是实施例1的bg化学信号、pcl/pdlla定向静电纺纤维膜结构信号和组合信号刺激骨髓间充质干细胞产生外泌体颗粒浓度随时间的变化规律图;
图2是实施例1的bg化学信号、pcl/pdlla定向静电纺纤维膜结构信号和组合信号刺激脐静脉内皮细胞产生外泌体颗粒浓度随时间的变化规律图;
图3是实施例2的没有外泌体作用脐静脉内皮细胞24h后vwf染色结果图;
图4是实施例2的bg化学信号刺激骨髓间充质干细胞产生的外泌体作用脐静脉内皮细胞24h后vwf染色结果图;
图5是实施例2的常规条件下骨髓间充质干细胞产生的外泌体作用脐静脉内皮细胞24h后vwf染色结果图;
图6是实施例2的bg化学信号刺激骨髓间充质干细胞产生的外泌体作用脐静脉内皮细胞48h后pcr结果图;
图7是实施例3的没有外泌体注射到小鼠皮下7天后微小血管生成情况图;
图8是实施例3的bg化学信号刺激骨髓间充质干细胞产生的外泌体注射到小鼠皮下7天后微小血管生成情况图;
图9是实施例3的常规条件下骨髓间充质干细胞产生的外泌体注射到小鼠皮下7天后微小血管生成情况图;
图10是实施例4的bg化学信号刺激脐静脉内皮细胞产生的外泌体作用骨髓间充质干细胞48h后pcr结果图;
图11是实施例4的没有外泌体作用骨髓间充质干细胞7天后alp染色结果图;
图12是实施例4的bg化学信号刺激脐静脉内皮细胞产生的外泌体作用骨髓间充质干细胞7天后alp染色结果图;
图13是实施例4的常规条件下脐静脉内皮细胞产生的外泌体作用骨髓间充质干细胞7天后alp染色结果图。
具体实施方式
以下参考说明书附图介绍本发明的多个优选实施例,使其技术内容更加清楚和便于理解。本发明可以通过许多不同形式的实施例来得以体现,本发明的保护范围并非仅限于文中提到的实施例。
实施例1
以生物材料活性信号刺激细胞产生的外泌体:
步骤1、制备生物活性玻璃(bg)离子浸提液,分别将1gbg粉体加入到5ml无血清间充质干细胞培养液(mscm)及5ml无血清内皮细胞培养液(ecm)中,在细胞培养箱中孵育24h,收集上清液,经0.22μm无菌滤器过滤收集滤液,即制得bg离子浸提液,在4℃储存备用。
步骤2、制备定向静电纺丝纤维膜,将质量比为1:1的pcl和pdlla以4.8%的质量体积比溶解于体积比为4:1的dmf和thf中,利用静电纺丝设备以10kv电压、0.02ml/min流量和12cm接收距离的条件进行电纺丝,以2000r/min旋转的高速滚筒接收得到定向静电纺丝纤维膜,将其裁剪成直径为150mm的圆片,紫外照射灭菌30min以上,75%酒精浸泡30min以上后,超净台中晾干,常温无菌储存备用。
步骤3、制备细胞分泌的外泌体悬液,设立如表1的实验组,将人骨髓间充质干细胞(hbmsc)消化传代,按照2×104个hbmsc/平方厘米的细胞密度播种在直径为150mm的两个无菌培养皿(实验组a和b)中和铺有定向静电纺丝纤维膜的培养皿(实验组c和d)中,用间充质干细胞完全培养液培养24h后,弃掉旧培养液,用无菌pbs洗涤3遍,加入20ml经37℃预热过的无血清mscm,在实验组b和d中分别加入156μlbg浸提液(用无血清mscm按1:128比例稀释步骤1中制备的bg离子浸提液),继续培养6、12、24、48和72h后,收集各实验组的细胞培养上清液,即得到人骨髓间充质干细胞分泌的外泌体悬液。
将人脐静脉内皮细胞(huvec)消化传代,按照4×104个huvec/平方厘米的细胞密度播种在直径为150mm的两个无菌培养皿(实验组a和b)中和铺有定向静电纺丝纤维膜的培养皿(实验组c和d)中,用内皮细胞完全培养液培养24h后,弃掉旧培养液,用无菌pbs洗涤3遍,加入20ml经37℃预热过的无血清ecm,在实验组b和d中分别加入156μlbg浸提液(用无血清ecm按1:128比例稀释步骤1中制备的bg离子浸提液),继续培养6、12、24、48和72h后,收集各实验组的细胞培养上清液,即得到人脐静脉内皮细胞分泌的外泌体悬液。
表1细胞培养实验分组及标记
步骤4、提取外泌体,将步骤3中收集到的细胞培养上清液在4℃环境下依次进行300×g10min,2000×g20min,10000×g30min离心并弃掉离心沉淀,0.22μm无菌滤器过滤收集滤液,100000×g2h超速离心,收集离心沉淀并用pbs洗涤3遍,最后的离心沉淀即为各培养条件下细胞分泌的外泌体,将其各自收集在200μl无菌pbs溶液中,即得到外泌体浓缩液,短期(1~2天)储存于4℃,长期(>2天)储存于-80℃备用。
步骤5、测量外泌体颗粒浓度,取少许步骤4中提取的外泌体浓缩液,按照1:10比例稀释后用纳米流式仪检测各组外泌体的颗粒浓度。
如图1和图2所示,hbmsc和huvec两种细胞在bg化学信号、pcl/pdlla静电纺丝纤维膜结构信号及其组合信号的刺激下,均能分泌比对照条件下明显更高浓度的外泌体,且呈现出相同的增长规律;而且,从外泌体浓度增加结果来看,这三种刺激信号促进细胞分泌外泌体的能力为:bg-film>film>bg。
实施例2
hbmsc来源外泌体促进huvec体外成血管分化能力验证:
根据实施例1所示的方法,收集bg刺激48h和常规条件下hbmsc分泌的外泌体,分别记作hbmsc-bg-exosome和hbmsc-control-exosome,4℃储存备用。
消化传代huvec,按照4×104huvec/平方厘米细胞密度将其分别接种到无菌6孔培养板和铺有细胞爬片的48孔板中,用完全ecm培养24h后,pbs洗涤3遍,用无血清ecm将hbmsc-bg-exosome和hbmsc-control-exosome稀释到1×108个/ml,第一个6孔板中每孔加入2ml的hbmsc-bg-exosome外泌体稀释液,第二个6孔板中每孔加入2ml的hbmsc-control-exosome外泌体稀释液,第三个6孔板中不加外泌体稀释液,第一个48孔板中每孔加入0.5ml的hbmsc-bg-exosome外泌体稀释液,第二个48孔板中每孔加入0.5ml的hbmsc-control-exosome外泌体稀释液,第三个48孔板中不加外泌体稀释液,将孔板置于培养箱中继续培养。
培养24h后,取出48孔板,弃掉旧培养液,pbs洗涤3次后,经4%多聚甲醛(pfa)室温固定30min以上,然后依次进行pbs洗涤、0.5%tritonx-100透膜10min、1%bsa封闭1h、兔抗人-血管假性血友病因子一抗(vwf,1:1000稀释)37℃孵育2h并4℃过夜、羊抗兔-488二抗(1:200稀释)室温孵育2h、4'6-二脒基吲哚(dapi,5μg/ml)室温孵育10min、pbs洗涤,然后取出细胞爬片,用激光共聚焦荧光显微镜观察拍照,结果如图3、图4和图5所示,可以清楚地看到,相比于不加外泌体的对照组(control)和hbmsc-control-exosome组,huvec在hbmsc-bg-exosome刺激的作用下能够形成更明显的网状结构,呈现出更明显的血管化趋势。
培养48h后,取出6孔板,弃掉旧培养液,pbs洗涤3次后,用omgae.z.n.a核酸提取试剂盒提取各组mrna,经nanodrop测得浓度后,用omga反转录试剂盒经温度30℃(10min)、42℃(20min)、99℃(5min)、4℃(5min)反转录,然后用gapdh为内参,用sybrgreen作为荧光标记进行定量-实时pcr测试(q-rt-pcr),检测各组huvec经hbmsc源外泌体作用后其血管化相关基因vegf、kdr和enos的表达水平,结果如图6所示,相比于其他两组,hbmsc-bg-exosome组能够更明显地促进huvec表达vegf、kdr和enos,呈现出更明显的成血管分化。
实施例3
hbmsc来源外泌体促进huvec体内皮下成血管能力验证:
根据实施例1所示的方法,收集bg刺激48h和常规条件下hbmsc分泌的外泌体,分别记作hbmsc-bg-exosome和hbmsc-control-exosome,4℃储存备用。
在三只昆明小鼠背部,用剃毛机剃掉一小区域的毛,第一只小鼠注射50μl含颗粒浓度为1×108/mlhbmsc-bg-exosome的pbs溶液,第二只注射50μl含颗粒浓度为1×108/mlhbmsc-control-exosome的pbs溶液,第三只注射不含有外泌体的pbs溶液作为对照(control),1周后,断颈处死实验小鼠,取其外泌体注射区皮肤,对其内侧微小血管进行观察拍照,发现hbmsc-bg-exosome能够促进小鼠皮下长出更多微小血管,结果示于图7、图8和图9。
实施例4
huvec来源外泌体促进hbmsc体外成骨分化能力验证:
根据实施例1所示的方法,收集bg刺激48h和常规条件下huvec分泌的外泌体,分别记作huvec-bg-exosome和huvec-control-exosome,4℃储存备用。
消化传代hbmsc,按照2×104hbmsc/平方厘米细胞密度将其分别接种到无菌6孔培养板和48孔板中,用完全mscm培养24h后,pbs洗涤3遍,用无血清mscm将huvec-bg-exosome和huvec-control-exosome稀释到1×108个/ml,第一个6孔板中每孔加入2ml的huvec-bg-exosome外泌体稀释液,第二个6孔板中每孔加入2ml的huvec-control-exosome外泌体稀释液,第三个6孔板中不加外泌体稀释液,第一个48孔板中每孔加入0.5ml的huvec-bg-exosome外泌体稀释液,第二个48孔板中每孔加入0.5ml的huvec-control-exosome外泌体稀释液,第三个48孔板中不加外泌体稀释液,将孔板置于培养箱中继续培养。
培养48h后,取出6孔板,弃掉旧培养液,pbs洗涤3次后,用omgae.z.n.a核酸提取试剂盒提取各组mrna,经nanodrop测得浓度后,用omga反转录试剂盒经温度30℃(10min)、42℃(20min)、99℃(5min)、4℃(5min)反转录,然后用gapdh为内参,用sybrgreen作为荧光标记进行定量-实时pcr测试(q-rt-pcr),检测各组hbmsc经huvec源外泌体作用后其成骨分化相关基因alp、oc、runx2和col-i的表达水平,结果如图10所示,相比于不加外泌体的对照组(control)和huvec-control-exosome组,huvec-bg-exosome组能够更明显地促进hbmsc表达成骨分化相关的基因,呈现出更明显的成骨分化。
培养7天后,取出48孔板,弃掉旧培养液,pbs洗涤3次后,经4%多聚甲醛(pfa)室温固定30min以上,用试剂盒室温染色2h,用光学显微镜观察拍照,显示huvec-bg-exosome能够更明显地促进hbmsc分泌表达alp,显示出明显的成骨分化,结果显示在图11、图12和图13。
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!