一种生物催化合成含单甲基半环的烷基吡嗪方法与流程
本发明涉及一种生物催化合成含单甲基半环的烷基吡嗪方法,具体涉及利用苏氨酸脱氢酶(tdh)生物催化合成含单甲基半环的烷基吡嗪方法,属于生物合成技术领域。
背景技术:
烷基吡嗪是一类支链带有烷基基团的含氮杂环化合物,作为重要的风味物质,主要贡献食品中的坚果味,烤肉味和烤面包味。烷基吡嗪具有极低的阈值,发酵的大豆中四甲基吡嗪(2,3,5,6-tetramethylpyrazine,ttmp)的阈值为10ppm,2,5-二甲基吡嗪(2,5-dimethylpyrazine,2,5-dmp)在食品中只添加1-2ppm,就可以起到明显的增香作用。由于阈值低,烷基吡嗪可以显示出强烈的气味特性,是我国gb2760-86规定允许使用的香精物质,在食品工业中主要用作调味的食品添加剂和一些香料中间体。
烷基吡嗪除了具有独特的风味价值之外,在医药方面也具有重要价值,可用作药物或医药中间体。ttmp被发现可以作为药物治疗一些疾病,例如中风、心肌细胞损伤、膝骨关节炎等。另外,ttmp还可以作为其他生物药物的前体来源,例如,4-(2,3,5,6-ttmp-1)-4'-去甲表鬼臼是一种具有较强抗肿瘤活性的新型化合物,ttmp-2'o-阿魏酸钠可以提供神经保护,防止神经炎症和脑损伤。2,5-dmp可以作为抗菌类药物5-甲基吡嗪-2-羧酸的重要合成原料。
在烷基吡嗪的生产方面,其主要通过化学方法合成,以2,5-dmp的化学合成为例,目前2,5-dmp的化学合成方法主要包括液相法和气相法:
(1)由含有活泼亚甲基的酮类化合物合成:用亚硝酸处理含有活泼亚甲基的酮,得到异亚硝基酮,异亚硝基酮经氢气还原为α-氨基酮,两分子α-氨基酮再脱水生成二氢吡嗪衍生物。由于此环不稳定,有很强的芳构化趋势,易于脱氢生成烷基吡嗪。该方法是常用的合成烷基吡嗪类物质的方法,但该反应步骤较多,从经济角度考虑,不适用于大规模工业化生产。
(2)在铵盐存在条件下,由丙烯醛在甘油加热中反应制得:该方法收率较低。
(3)α-二胺和α-二酮缩合氧化法:将1,2-丙二胺和α-羰基丙醛进行缩合,生成2,5-二甲基二氢吡嗪,再经空气氧化,制得2,5-dmp。这种二步法生产吡嗪的缺点是如果第二步脱氢不完全则会由于缩合产物与吡嗪很难用物理方法分离而使产品带有不愉快气味,因此对脱氢催化剂和反应条件的要求较高,在工业上的应用逐渐减少。
(4)α-二胺和α-乙醇胺合成法:由α-二胺和α-乙醇胺合成2,5-dmp,该反应路线短,工艺简单,但其选择性差,不能得到单一产物,产品分离提纯困难。
(5)烷基哌嗪为原料合成:烷基吡嗪类化合物可由烷基哌嗪类化合物在不预还原的锌催化剂上气相脱氢合成,该反应工艺路线较短,反应收率高,但原料不易得到,需要通过环合反应制备。
(6)α-二胺和环氧丙烷合成:在脱水脱氢催化剂存在下进行的气固相接触催化反应。该方法所用原料环氧丙烷廉价易得,但反应产物是2,5-dmp和2,6-dmp的混合物,产品分离难度较大。
(7)α-二胺和α-二醇合成法:该方法原料价格低廉,易于得到,催化剂容易制备,反应路线短,工艺简单,但反应产物是2,5-dmp和2,6-dmp的混合物,产品分离难度较大。
(8)由异丙醇胺合成。以异丙醇胺为原料,在催化剂作用下经气固相接触催化反应制备2,5-dmp。此方法反应步骤简单,反应条件容易控制板,原料廉价易得,反应收率较高,反应副产物相对较少,有一定的应用价值。
由于化学合成普遍存在严峻的环保问题,并且可能存在不希望的副产物,使得分离提纯相对困难,另外,反应条件一般较剧烈,设备要求较高,且产品不是天然的,这些因素都促使风味化合物生产公司将注意力集中在生物来源的风味化合物上。
在风味化合物微生物合成研究领域遇到的第一个绊脚石便是普遍缺乏生化知识,虽然可能存在合理的假设,但通常缺少使用标记前体的证据以及所涉及的酶和基因的鉴定。烷基吡嗪作为一种重要的风味化合物,尽管对于烷基吡嗪微生物来源的研究已经探索了很长时间,但是对于其合成机制的认知还是非常有限的。目前,只有ttmp的微生物合成机制被阐明:首先,b.subtilis以d-葡萄糖为底物,经糖酵解途径生成丙酮酸,后者在α-乙酰乳酸合酶及α-乙酰乳酸脱羧酶催化作用下生成乙偶姻;同时,原材料蛋白在蛋白质水解酶作用下生成氨基酸,后者继而生成氨,或者在铵盐存在的情况下,乙偶姻与氨/铵可以通过非酶促反应生成2-氨基-3-丁酮,继而2-氨基-3-丁酮经过脱水缩合与氧化反应生成ttmp。
基于ttmp微生物合成机制的解析以及ttmp重要的经济价值,近年来,对于ttmp微生物发酵法生产的研究已成为一个热点。2010年,zhu等人使用内源前体筛选策略从高温大曲中分离出一株可以产生高水平的ttmp的野生型菌株枯草芽孢杆菌,通过研究不同的碳源和氮源以及发酵条件,实现了>4.08g·l-1的ttmp的生产。同年,zhu等人通过应用所提出的补料分批策略,在烧瓶和发酵罐实验中ttmp浓度可分别达7.46和7.34g·l-1,分别与批次ttmp发酵相比增加了55.1和29.0%。2018年,xiao等人发现了一种新的温度控制两步法制备ttmp,具有较高的生产收率和生产效率,最终获得了8.34g·l-1的ttmp。
然而,ttmp和2,5-dmp的微生物合成途径完全不同,无法按照已有的ttmp合成途径解析确定2,5-dmp合成过程。
综上,目前市场上烷基吡嗪的生产方法主要通过化学方法合成,但化学法合成存在缺陷。虽然也有微生物菌株能够合成潜在有价值的风味化合物,但是其产量往往很低;而且由于缺乏关于生化途径,酶和代谢调节的知识,使得利用生物技术生产风味化合物的发展受到阻碍。
技术实现要素:
为了解决上述至少一个问题,本发明提供了一种生物催化合成含单甲基半环烷基吡嗪的方法,以利用苏氨酸脱氢酶(tdh)生物催化合成单甲基半环烷基吡嗪。本发明通过全细胞催化、同位素示踪、纯酶催化、基因敲除与回补,确定了苏氨酸脱氢酶对生物合成单甲基半环烷基吡嗪具有重要功能,尤其,苏氨酸脱氢酶也涉及到2,5-dmp、三甲基吡嗪(tmp)的微生物合成中,并可以l-苏氨酸为唯一底物合成2,5-dmp。
本发明提供的生物催化合成含单甲基半环烷基吡嗪的方法,是以苏氨酸脱氢酶催化合成烷基吡嗪。
在一种实施方式中,所述含单甲基半环烷基吡嗪为2,5-dmp或者三甲基吡嗪(tmp),还可以是2-甲基吡嗪、2,5-dmp、2,6-dmp、2-乙基-5-甲基吡嗪、2-乙基-6-甲基吡嗪、2,5-二甲基-3-乙基吡嗪、3,5-二甲基-2-乙基吡嗪、2,5-二甲基-3-异丁基吡嗪、2-丁基-3,5-dmp和2,5-二甲基-3-戊基吡嗪。
在一种实施方式中,所述催化合成,是以含有l-苏氨酸的原料作为底物合成。
在一种实施方式中,所述催化合成是以l-苏氨酸为唯一底物进行催化合成。
在一种实施方式中,所述催化合成是以l-苏氨酸和d-葡萄糖为底物生成tmp。
在一种实施方式中,所述苏氨酸脱氢酶的为具有催化活性的苏氨酸脱氢酶。
在一种实施方式中,所述苏氨酸脱氢酶为b.subtilis、b.licheniformis、b.amyloliquefaciens、p.putida、e.coli、a.candidus或者a.uvarum来源的苏氨酸脱氢酶。
在一种实施方式中,所述苏氨酸脱氢酶tdh的序列与genebankid分别为np_389581(b.subtilis168)、wp_085959523(b.licheniformisatcc14580)、wp_014470388(b.amyloliquefaciensdsm7)、wp_064301272(p.putida)、np_418073(e.colik-12)、xp_024673913(a.candidus)、xp_025487049(a.uvarum)的序列相同。
在一种实施方式中,所述苏氨酸脱氢酶催化合成可以是直接酶催化(粗酶催化、纯酶催化、固定化酶催化),或者是以能够合成苏氨酸脱氢酶的微生物进行全细胞转化。
在一种实施方式中,所述能够合成苏氨酸脱氢酶的微生物,可以是野生型菌株,也可以是重组菌株。
在一种实施方式中,所述能够合成苏氨酸脱氢酶的微生物,可以是芽孢杆菌(比如地衣芽孢杆菌、枯草芽孢杆菌等),也可以是酵母菌(比如毕赤酵母、酿酒酵母等),还可以是大肠杆菌。
在一种实施方式中,所述催化合成,是使用酶催化进行合成。可选地,所述酶催化体系为:在缓冲液体系中,添加苏氨酸脱氢酶、nad+、l-苏氨酸。可选地,总反应体系为200μl,其中50mmol·l-1tris-hcl缓冲液(ph10.0),100μl;20mmol·l-1nad+溶液,20μl;100mmol·l-1l-苏氨酸溶液,20μl,37℃恒温10min,加入适量酶液(2.65mg·ml-1,60μl)。
在一种实施方式中,所述催化合成是采用全细胞催化。可选地,是将表达苏氨酸脱氢酶的微生物菌体重悬在含有l-苏氨酸的缓冲液中(可选地,缓冲液还含有nad+)进行催化合成。
可选地,所述催化合成是合成2,5-dmp。具体是:将表达苏氨酸脱氢酶的微生物菌体,使用含l-苏氨酸(5g·l-1)的tris-hcl-nacl缓冲液悬浮菌体至od600nm为3.0,然后于37℃、200rpm条件下进行反应。
可选地,所述催化合成是合成tmp。具体是:将表达苏氨酸脱氢酶的微生物菌体,使用0.85%的生理盐水对菌体洗涤并用含l-苏氨酸5g·l-1的tris-hcl-nacl缓冲液悬浮菌体,悬浮菌体od600nm至3.0,在37℃、200rpm下进行反应。
在一种实施方式中,所述催化合成,具体是:以l-苏氨酸为底物,或同时以l-苏氨酸和d-葡萄糖为底物生成tmp。将菌株培养后离心,使用生理盐水对菌体洗涤并用含不同添加底物(l-苏氨酸5g·l-1、d-葡萄糖10g·l-1、磷酸氢二铵3g·l-1)的tris-hcl-nacl缓冲液悬浮菌体,悬浮菌体od600nm至3.0。所有体系的体积均为1ml,反应容器为10ml离心管,各体系在37℃、200rpm下进行反应2d。
在一种实施方式中,所述催化合成,是利用重组表达了苏氨酸脱氢酶的枯草芽孢杆菌重组菌进行全细胞催化合成。
在一种实施方式中,所述枯草芽孢杆菌重组菌,b.subtilis168为宿主、pma0911为载体,表达了来源于b.subtilis、b.licheniformis、b.amyloliquefaciens或e.coli的苏氨酸脱氢酶。可选地,所述苏氨酸脱氢酶tdh的序列与genebankid分别为np_389581(b.subtilis168)、wp_085959523(b.licheniformisatcc14580)、wp_014470388(b.amyloliquefaciensdsm7)、np_418073(e.colik-12)的序列相同。
在一种实施方式中,所述全细胞催化合成是:在含有5.83g/l的l-苏氨酸的lbt液体培养基中发酵24h,生成的2,5-dmp。可选地,具体是:将菌株在lb平板上进行活化,37℃过夜培养,挑取单菌落至lb试管中,37℃、200rpm摇床培养12h获取种子液。抗性为硫酸卡那霉素(50μg·ml-1),按1%接种量转接至50mllbt培养基(250ml摇瓶,50μg·ml-1硫酸卡那霉素)进行培养24h。
本发明的优点和效果:
本发明采用全细胞催化、同位素示踪、纯酶催化、基因敲除与回补等方法确定了苏氨酸脱氢酶对生物合成单甲基半环烷基吡嗪(包括2,5-dmp、tmp)具有重要功能。本发明还发现,苏氨酸脱氢酶tdh催化苏氨酸生成氨基丙酮的步骤不仅适用于2,5-dmp,还适用于其他含单甲基半环的烷基吡嗪,并已证明苏氨酸脱氢酶tdh参与到含单甲基半环的2,3,5-三甲基生物合成过程中。
在此基础上,本发明构建了可以利用l-苏氨酸高产2,5-dmp的菌株,该菌株重组表达了苏氨酸脱氢酶(tdh),实现了2,5-dmp高效的生物转化。
附图说明
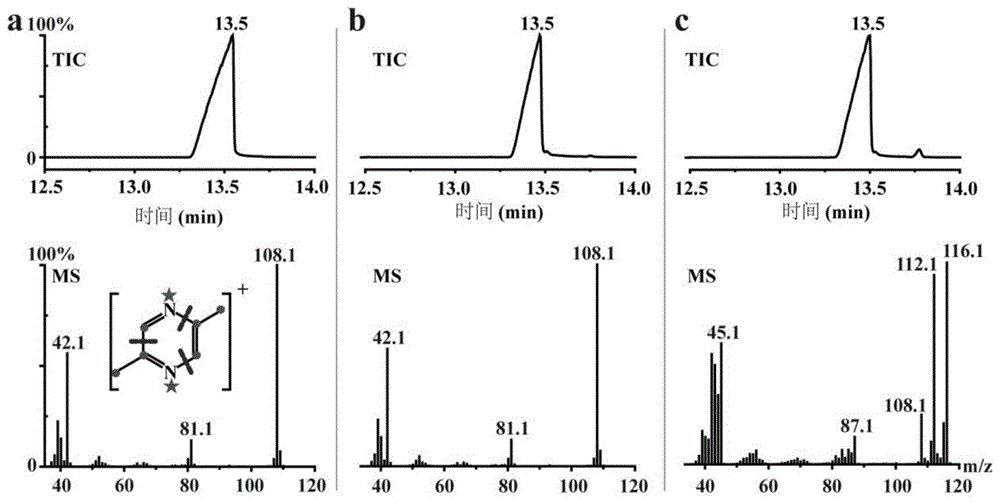
图1b.subtilis168发酵液中2,5-dmp的定性分析注:a,2,5-dmp标准品;b,b.subtilis168利用l-苏氨酸产2,5-dmp;c,b.subtilis168利用[u-13c,15n]-l-苏氨酸产2,5-dmp。
图2b.subtilis168全细胞催化l-苏氨酸产2,5-dmp;注:■,无菌的添加l-苏氨酸缓冲液;●,缓冲液催化体系;▲,添加l-苏氨酸缓冲液催化体系。
图3tdh催化l-苏氨酸的活性检测。
图4氨基丙酮opa衍生化反应。
图5tdh催化l-苏氨酸体系中氨基丙酮和2,5-dmp的检测。
图6tdh基因敲除菌株与回补菌株的构建;注:(a)tdh基因敲除整合片段的pcr验证。(b)重组质粒pma0911-tdh示意图。(c)重组质粒pma0911-tdh的酶切验证。(d)菌株b.subtilis168δtdh与b.subtilis168δtdh/pma0911-tdh的pcr验证。m,marker;甬道1,tdh基因敲除整合片段;甬道2,重组质粒pma0911-tdh;甬道3,b.subtilis168/pma0911;甬道4,b.subtilis168δtdh;甬道5,b.subtilis168δtdh/pma0911-tdh。
图7基因工程菌株b.subtilis168/pma0911、b.subtilis168δtdh和b.subtilis168δtdh/pma0911-tdh利用l-苏氨酸为底物合成2,5-dmp的能力;注:■,b.subtilis168/pma0911;●,b.subtilis168δtdh;▲,b.subtilis168δtdh/pma0911-tdh。
图8b.subtilis168发酵液中tmp的定性分析;注:a,tmp标准品;b,添加[u-13c4,15n]-l-苏氨酸和[u-13c6]-d-葡萄糖的发酵液;c,添加l-苏氨酸和[u-13c6]-d-葡萄糖的发酵液;d,添加[u-13c4,15n]-l-苏氨酸和d-葡萄糖的发酵液;e,添加l-苏氨酸和d-葡萄糖的发酵液。
图9b.subtilis168全细胞催化不同底物合成tmp的能力。
图10基因工程菌株b.subtilis168/pma0911、b.subtilis168δtdh和b.subtilis168δtdh/pma0911-tdh利用l-苏氨酸和d-葡萄糖为底物合成tmp的能力。
图11提出的tmp微生物合成机制;注:em,糖酵解途径;als,α-乙酰乳酸合酶;aldc,α-乙酰乳酸脱羧酶。
图12根据2,5-dmp溶液浓度与峰面积的变化拟合的2,5-dmp标准曲线。
图13利用uplc定量检测发酵液中2,5-dmp的色谱图。
具体实施方案
2,5-dmp的检测:采用超高效液相色谱(uplc)对2,5-dmp进行定量检测,具体条件如下:
色谱柱watersbehc18(100mm×2.1mm,1.7μmparticle)对样品中的2,5-dmp进行液相分离。流动相a为0.1%甲酸溶液(如无特殊说明,涉及到的百分数为体积分数),流动相b为色谱级甲醇。流动相洗脱梯度:初始,31%b;0-3min,31%-69%b;3-10min,31%b;运行时间为10min。流速为0.20ml·min-1,紫外检测波长为275nm。上样量1μl。
lb基本培养基(gl-1):蛋白胨10.0,酵母粉5.0,氯化钠10.0,固体培养基添加2%的琼脂粉,121℃灭菌20min。根据需要添加抗性,氨苄青霉素100μgml-1、硫酸卡那霉素50μgml-1、壮观霉素100μgml-1。
lbt培养基:lb培养基中添加5gl-1的l-苏氨酸。配制浓度浓缩1.11倍的lb基本培养基,按所需体积的9/10进行分装,121℃灭菌20min。配制50gl-1的l-苏氨酸水溶液,采用灭菌的0.22μm水系针头式滤器过滤除菌,按所需体积的1/10添加至灭菌的浓缩1.11倍的lb培养基中。
lbtg培养基:lb培养基中同时添加5g·l-1的l-苏氨酸,10g·l-1的d-葡萄糖和3g·l-1的磷酸氢二铵。配制浓度浓缩1.25倍的lb基本培养基,按所需体积的4/5进行分装,121℃灭菌20min。配制同时含25g·l-1的l-苏氨酸、50g·l-1的d-葡萄糖和15g·l-1的磷酸氢二铵水溶液,采用灭菌的0.22μm水系针头式滤器过滤除菌,按所需体积的1/5添加至灭菌的浓缩1.25倍的lb培养基中。
基因说明
表1本发明涉及的基因
其中,tdh,l-苏氨酸脱氢酶(l-threonine-3-dehydrogenase);kbl,2-氨基-3-酮丁酸coa连接酶(2-amino-3-ketobutyratecoaligase);aao,假定的氨基丙酮氧化酶(putativeaminoacetoneoxidase);nox,nadh氧化酶(nadhoxidase);spc,壮观霉素抗性基因。
引物说明
表2引物总览表
注:下划线标注部分为限制性内切酶识别序列;tdh,l-苏氨酸脱氢酶编码基因;kbl,2-氨基-3-酮丁酸coa连接酶编码基因;aao,假定的氨基丙酮氧化酶编码基因;spc,壮观霉素抗性基因;nox,nadh氧化酶编码基因。
下面是对本发明进行具体描述。
实施例1:l-苏氨酸可以作为2,5-dmp微生物合成的唯一底物来源
1、同位素示踪实验
分别添加1g·l-1的l-苏氨酸或[u-13c,15n]-l-苏氨酸至lb培养基中,37℃、200rpm培养b.subtilis168至2d,利用gc-ms对发酵液中的2,5-dmp进行定性分析,获取的总离子图(tic)和质谱图(ms)如图1所示。在添加l-苏氨酸和[u-13c,15n]-l-苏氨酸的发酵样品中,均在保留时间为13.5min(图1b,c)处有色谱峰出现,与标准品2,5-dmp的保留时间一致(图1a)。l-苏氨酸添加样品中检测到的化合物质谱(图1b)与2,5-dmp标准品质谱(图1a)完全吻合,表明发酵样品中该出峰时间的化合物为2,5-dmp。
[u-13c,15n]-l-苏氨酸添加的发酵样品中检测到的2,5-dmp质谱(图1c)与标准品(图1a)相比,质谱峰出现了移位,分子离子的质荷比116.1与108.1相差8,根据推测的2,5-dmp裂解模式(图1a),可以在图1c的质谱图中找到相对应的同位素标记的碎片离子(42.1→45.1,82.1→87.1),说明在该发酵样品中,分子离子质荷比为116.1的2,5-dmp所有的碳原子和氮原子均被同位素标记,即2,5-dmp所有的碳原子和氮原子均来自于[u-13c,15n]-l-苏氨酸,由此可以得出结论,l-苏氨酸可以作为2,5-dmp微生物合成的唯一底物来源。另外,在[u-13c,15n]-l-苏氨酸添加的发酵样品中还出现了相对丰度较高的质谱峰112.1,与质谱峰108.1相比相差4,由于在lb培养基中包含丰富的氨基酸和其他碳源、氮源,[u-13c,15n]-l-苏氨酸可能只提供了2,5-dmp一个单甲基半环的来源,而另一个单甲基半环可能来源于lb培养基中的l-苏氨酸或其他碳源、氮源,由此生成的2,5-dmp分子离子的质荷比为112.1。
2、全细胞催化实验
lb培养基中物质较为复杂,因此,不能排除其他因素参与或辅助2,5-dmp的微生物合成。为了确定2,5-dmp微生物合成机制中除l-苏氨酸之外,无其他因素的参与,按照如下的方法,对b.subtilis168进行了全细胞催化:
获取b.subtilis168种子液,按1%接种量接种至50mllbt培养基(250ml摇瓶)中培养1d,取适量菌液进行离心(12000rpm,5min),使用0.85%的无菌生理盐水对菌体洗涤两次。使用含l-苏氨酸(5g·l-1)的tris-hcl-nacl缓冲液和tris-hcl-nacl缓冲液(对照组)悬浮菌体至od600nm为3.0,无悬浮菌体的含l-苏氨酸(5g·l-1)的tris-hcl-nacl缓冲液作为另一对照组。所有体系的体积为1ml,反应容器为10ml离心管。将所有体系放于37℃、200rpm条件下进行反应,分别于0h、12h、24h、36h、48h进行取样。
对样品中2,5-dmp的产量、l-苏氨酸的剩余量以及细胞的密度(od600nm)进行了测定,结果如图2所示。在只有l-苏氨酸作为唯一碳源和氮源的实验组中(菌体悬浮于含5g·l-1的l-苏氨酸的tris-hcl-nacl缓冲液),随着l-苏氨酸的不断消耗,2,5-dmp的积累量不断增加,而在无菌体系或无l-苏氨酸催化体系,均不产2,5-dmp。另外,在tris-hcl-nacl缓冲液中,l-苏氨酸是稳定存在的。菌体在tris-hcl-nacl缓冲液和在含5g·l-1的l-苏氨酸的tris-hcl-nacl缓冲液中的细胞密度(od600nm)变化差异不大,说明在不添加l-苏氨酸的tris-hcl-nacl缓冲液中,无2,5-dmp的生成并不是因为菌体因无碳源和氮源而迅速死亡。以上结果说明,在只有l-苏氨酸作为唯一底物而无其他碳源或氮源参与的情况下,菌体依然可以利用l-苏氨酸生成2,5-dmp,进一步证明了l-苏氨酸可以作为微生物合成2,5-dmp的唯一底物来源。
实施例2:tdh对微生物利用l-苏氨酸合成2,5-dmp的影响
来源于b.subtilis168的tdh(np_389581)在体外可以实现从l-苏氨酸到2,5-dmp的转化。
1、tdh的外源表达与纯化
按照如下方法构建重组质粒pet-28a-tdh:
以b.subtilis168基因组dna为模板,使用引物tdh-f/r进行tdh基因的pcr扩增,获取基因片段tdh。对纯化的基因片段tdh和质粒pet-28a分别进行双酶切(bamhi/hindiii),对酶切产物柱纯化。对酶切的基因片段tdh和质粒pet-28a进行连接,并转化到e.colibl21(de3)感受态细胞。对转化子进行重组质粒提取,对所提取的质粒进行双酶切验证(bamhi/hindiii),,挑选出阳性克隆送至天霖生物科技(无锡)有限公司进行测序。选取序列一致的,表明表达载体pet-28a-tdh构建成功,成功获得tdh外源表达菌株e.colibl21(de3)/pet-28a-tdh。
利用菌株e.colibl21(de3)/pet-28a-tdh实现tdh的外源表达,并对粗酶液进行纯化。
2、tdh的纯酶催化
tdh可以在辅酶nad+的参与下催化l-苏氨酸生成2-氨基乙酰乙酸,后者是一种极其不稳定的化合物,可以自发脱羧生成氨基丙酮。因此可以利用nad+被还原成nadh所引起的340nm处吸光度的变化,确定来源于b.subtilis168中的tdh对底物l-苏氨酸具有催化作用。依照以下的酶活测定方法:
辅酶nad+被还原后,会引起340nm吸光度的增加,因此可以通过测定反应过程中340nm处吸光度的变化确定来源于b.subtilis168的tdh对l-苏氨酸是否具有催化作用。测定酶活的标准条件:总反应体系为200μl,其中50mmol·l-1tris-hcl缓冲液(ph10.0),100μl;20mmol·l-1nad+溶液,20μl;100mmol·l-1l-苏氨酸溶液,20μl,37℃恒温10min,加入适量酶液(2.65mg·ml-1,60μl)混匀后,酶标仪检测340nm处吸光度的变化。蛋白含量采用bradford法测定,以bsa为标准蛋白。定义1个酶活单位(u)为每分钟催化还原1μmol辅酶nad+的酶量。
利用酶标仪扫描340nm处的吸光度变化见图3。从图3可以看出,来源于b.subtilis168的tdh对于l-苏氨酸确实具有催化作用。
将1ml各物质浓度相同的反应体系于2ml离心管中在37℃,200rpm条件下反应4h,对反应体系进行opa衍生,氨基丙酮的衍生化反应如图4所示。利用uplc-tq-s-ms对其进行检测(mrm检测模式,250→190),以确定氨基丙酮的生成,结果如图5所示。在确定了tdh对l-苏氨酸确实具有催化作用的前提下,从图5可以看出,在该反应体系中有氨基丙酮的生成,说明tdh可以催化l-苏氨酸生成氨基丙酮。此外,在该体系中,2,5-dmp也被检测到,由此可知,在仅有tdh存在的情况下,便可以在体外实现从l-苏氨酸到2,5-dmp的转化,因此推断在以l-苏氨酸为底物的2,5-dmp微生物合成机制中,tdh是一个关键酶。该结果对于后续通过优化纯酶催化条件从而实现从l-苏氨酸到2,5-dmp的高效生物催化具有指导意义。
3、tdh编码基因tdh敲除菌株与回补菌株的构建及发酵验证
a、tdh基因敲除菌株b.subtilis168δtdh的构建
为了进一步确定基因tdh在微生物以l-苏氨酸为底物合成2,5-dmp途径中的作用,对b.subtilis168中的基因tdh进行了敲除。采用两步融合pcr构建出tdh基因敲除整合片段(图6a),经确认的tdh基因敲除整合片段转化至b.subtilis168感受态细胞中,挑取阳性转化子,利用验证引物δtdh-f/r进行菌液pcr验证,验证结果如图6d甬道4所示,确认tdh基因敲除成功,即tdh基因敲除菌株b.subtilis168δtdh构建成功。
基因敲除方法如下:
(1)b.subtilis168中基因tdh敲除整合片段的构建
采用两步融合pcr的方法,进行三片段融合,构建目的基因敲除整合片段。以基因tdh敲除整合片段构建为例,具体方法如下:首先,根据ncbi公布的b.subtilis168基因组信息获取目的基因上游或下游基因区域(约1000bp),依据获取的目标基因区域分别设计引物δtdh-f1/r2和δtdh-f3/r4,以b.subtilis168基因组dna为模板,分别pcr扩增出目的基因tdh的上下游基因片段,并通过胶回收纯化,分别得到dna片段tdh-1和tdh-3。以质粒p7s6为模板,设计引物spc-f/r扩增lox71-spc-lox66壮观霉素抗性基因表达盒,并通过胶回收对扩增片段进行纯化,获取壮观霉素基因片段spc-2。将片段tdh-1、tdh-3和spc-2按摩尔比1:1:1的比例融合(各片段总量不超过50ng),加入5μl2×primerstarmaxdnapolymerase,最终融合体系为10μl,pcr融合程序为:98℃,3min;[98℃,1min;52℃,2min;72℃,(片段总长/1000)min],15个循环;72℃,10min。第二步pcr以第一步融合pcr产物为模板,重新设计一对巢式pcr引物δtdh-f5/r6,以提高pcr的特异性扩增。pcr程序为:98℃,1min;[98℃,30s;55℃,10s;72℃,(片段总长/1000)min],30个循环;72℃,10min。
(2)b.subtilis168中基因tdh敲除整合片段的转化
巢式pcr产物直接转化b.subtilis168感受态,涂布于壮观霉素(100μg·ml-1)抗性平板,37℃过夜静置培养至出现单菌落。
(3)b.subtilis168基因tdh敲除菌株的pcr验证
挑取若干单菌落分别接种于含1mllb液体培养基(壮观霉素抗性,100μg·ml-1)的2ml离心管中,37℃,200rpm振荡培养至液体浑浊,取1μl菌液进行pcr验证,验证引物为δtdh-f/r。没有目的条带的转化子为阳性转化子,将其转接至含有壮观霉素(100μg·ml-1)抗性的lb试管中,37℃,200rpm过夜培养,20%甘油保菌。
b、tdh基因回补菌株b.subtilis168δtdh/pma0911-tdh的构建
(1)表达质粒pma0911-tdh的构建
根据相应的基因序列设计引物tdh-f1/r2,以b.subtilis168基因组dna为模板,分别进行pcr扩增。对pcr产物进行胶回收。使用限制性内切酶对质粒pma0911进行线性化酶切(ndei/bamhi),纯化的pcr产物与酶切质粒进行连接,连接体系转化至e.colijm109感受态细胞中,提取重组质粒进行双酶切验证(ndei/bamhi),挑选出阳性克隆送至天霖生物科技(无锡)有限公司进行测序。
(2)基因回补菌株的构建
将测序正确的重组质粒pma0911-tdh分别转入b.subtilis168δtdh感受态细胞中,将质粒pma0911转入b.subtilis168感受态细胞中。37℃过夜静置培养至出现单菌落,挑取若干单菌落接种振荡培养至液体浑浊,取1μl菌液进行pcr验证,验证引物分别为δtdh-f/r和δkbl-f/r。将含有目的条带的转化子转接至lb试管(硫酸卡那霉素抗性,50μg·ml-1)中继续培养,37℃,200rpm,从而获取基因回补菌株b.subtilis168δtdh/pma0911-tdh,20%甘油保菌。
ctdh敲除菌株与回补菌株的构建及发酵验证
利用lbt培养基对菌株b.subtilis168δtdh、b.subtilis168δtdh/pma0911-tdh以及对照菌株b.subtilis168/pma0911进行发酵验证,从而确定tdh在微生物以l-苏氨酸为底物合成2,5-dmp中的作用。具体发酵条件如下:
获取b.subtilis168δtdh和b.subtilis168δtdh/pma0911-tdh、b.subtilis168δkbl/pma0911-kbl、b.subtilis168/pma0911(硫酸卡那霉素抗性,50μg·ml-1)种子液,按1%接种量放大培养至50ml含有相应抗性的lbt培养基中(250ml摇瓶),37℃、200rpm条件下培养5d,取样时间间隔1d,取样体积1ml。样品处理:取50μl样品进行4倍稀释,测定od600nm,剩余样品进行离心,12000rpm,5min,取上清液,-20℃保存等待检测。
对不同时间发酵液中2,5-dmp的生成量、l-苏氨酸的剩余量以及菌体的生长情况(od600nm)进行测定,结果如图7所示。与菌株b.subtilis168/pma091相比较,b.subtilis168δtdh利用l-苏氨酸生物合成2,5-dmp的能力显著下降,在整个发酵过程中几乎没有2,5-dmp的生成。b.subtilis168δtdh的生长状况与菌株b.subtilis168/pma091一致,说明b.subtilis168δtdh几乎不产2,5-dmp的原因不是因为菌株的生长缺陷。当携带tdh基因的含有组成型启动子的质粒pma0911-tdh重新导入b.subtilis168δtdh中(b.subtilis168δtdh/pma0911-tdh),随着l-苏氨酸的不断消耗,2,5-dmp的生成量显著增加,发酵3d,2,5-dmp积累量最高为482.1mg·l-1,由于tdh的过表达,菌株b.subtilis168δtdh/pma0911-tdh利用l-苏氨酸生成2.5-dmp的能力远远高于菌株b.subtilis168/pma0911(38.8mg·l-1,5d),尽管在发酵过程中该菌株的od600nm相对较低。
基于tdh纯酶催化和tdh基因敲除菌株与回补菌株发酵实验结果可以得出结论,在微生物利用l-苏氨酸为底物合成2,5-dmp的机制中,tdh是一个关键酶。
实施例3:tdh涉及到三甲基吡嗪(tmp)的微生物合成
1、同位素示踪验证tmp微生物合成的底物来源
利用同位素示踪的方法对tmp是否可以来源于l-苏氨酸和d-葡萄糖进行了验证,通过在含有nh4+的lb培养基中分别添加[u-13c4,15n]-l-苏氨酸和[u-13c6]-d-葡萄糖、l-苏氨酸和[u-13c6]-d-葡萄糖、[u-13c4,15n]-l-苏氨酸和d-葡萄糖、l-苏氨酸和d-葡萄糖,对b.subtilis168进行培养(培养条件:将b.subtilis168活化获取种子液,以1%接种量转接至2ml分别添加[u-13c4,15n]-l-苏氨酸(1g·l-1)和[u-13c6]-d-葡萄糖(2g·l-1)、[u-13c4,15n]-l-苏氨酸(1g·l-1)和d-葡萄糖(2g·l-1)、l-苏氨酸(1g·l-1)和[u-13c6]-d-葡萄糖(2g·l-1)、l-苏氨酸(1g·l-1)和d-葡萄糖(2g·l-1)的含有3g·l-1磷酸氢二铵的lb试管中,37℃、200rpm条件下培养),2d后取样,利用uplc-esi/q-tofms对发酵液中的tmp进行定性分析,采用msscan模式,以tmp标准品做对照。
tmp的定性、定量检测方法
(1)tmp的定性分析:采用uplc-esi/q-tof-ms对发酵液样品中的tmp进行定性分析。色谱柱为watersbehc18(100mm×2.1mm,1.7μmparticle),流动相a为质谱级甲醇,b为0.1%甲酸溶液。流动相洗脱梯度:初始,95%b;0.10-5.00min,95%-90%b;5.00-8.00min,90%-80%b;8.00-10.00min,80%-60%b;10.00-12.00min,60%-0%b;12.10-15min,95%b;运行时间15min。流速为0.3ml·min-1。质谱方法:采用正离子模式,二级质谱分析。mstune参数:脱气速度700l·h-1,脱气温度400℃,锥孔气流50l·h-1,源温度100℃,毛细管电压3.5kv,锥孔电压20v,碰撞电压6v,数据收集时间1s,质荷比范围50-1000,质谱采用正离子模式,一级质谱分析。
(2)tmp的定量检测:采用uplc-tq-s-ms对tmp进行定量检测,色谱柱为watersbehc18(100mm×2.1mm,1.7μmparticle),流动相a为0.1%甲酸溶液,流动相b为色谱级乙腈。流动相洗脱梯度:初始,10%b;0-8.5min,10%-50%b;8.6-10min,100%b;10.1-12min,10%b;运行时间12min。流速为0.20ml·min-1。质谱方法:采用正离子模式,二级质谱检测。mstune参数:脱气速度500l·h-1,脱气温度350℃,锥孔气流50l·h-1,源温度150℃,毛细管电压3.5kv,锥孔电压25v,碰撞电压25v,数据收集时间0.3s,质荷比范围40-400。利用daughters检测模式获取tmp标准品的质谱,选取离子对123→82,采用多反应监测(multiplereactionmonitoring,mrm)检测模式对tmp进行检测。
tmp标准品的色谱图和质谱图如图8a所示,tmp的出峰时间为4.8min,荷质比为123.12。利用相同的液相和质谱条件,对各发酵样品进行检测,由于发酵液中tmp的含量太低,在样品的总离子图(tic)中,4.8min处没有较为明显的色谱峰,因此,对tic进行了提取目标分子离子处理,发现在与标准品一致的保留时间处,各样品均出现明显的色谱峰,见图8b-e。随后,获取各样品对应保留时间处的ms质谱图,见图8b-e,在添加l-苏氨酸和[u-13c6]-d-葡萄糖(图8c)或[u-13c4,15n]-l-苏氨酸和d-葡萄糖(图8d)的发酵液中,均出现了质荷比为127的质谱峰,而在添加l-苏氨酸和d-葡萄糖的发酵液中(图8e),仅有质荷比为123的质谱峰,表明在添加同位素标记的d-葡萄糖或同位素标记的l-苏氨酸的发酵体系中,tmp的相对分子质量均增加了4(m+4),这说明同位素标记的d-葡萄糖或同位素标记的l-苏氨酸均参与了tmp的生成,并分别可以提供4个同位素标记的原子,这说明tmp单甲基半环可能来源于l-苏氨酸代谢生成的氨基丙酮,双甲基半环可能来源于d-葡萄糖代谢生成的2-氨基-3-丁酮。
另外,在添加[u-13c4,15n]-l-苏氨酸和d-葡萄糖(图8d)的发酵体系中,出现了质荷比为131的质谱峰,tmp的相对分子质量增加了8,说明tmp有8个原子来源于l-苏氨酸。有研究报道,在arthrobacterglobiformis的l-苏氨酸代谢中,氨基丙酮可以通过胺氧化酶的催化作用生成丙酮醛,而丙酮醛可以在细菌细胞中通过一系列酶促反应生成丙酮酸。因此,在该发酵体系中,l-苏氨酸可能会经过代谢过程生成丙酮酸,进而贡献tmp双甲基半环前体2-氨基-3-丁酮(4个c被同位素标记),而tmp单甲基半环前体氨基丙酮(3个c和1个n被同位素标记)同样来源于l-苏氨酸,由此,在添加[u-13c4,15n]-l-苏氨酸和d-葡萄糖的发酵体系中,tmp的质谱峰中出现了质荷比为131的分子离子(m+8)。该结果说明微生物可以单独利用l-苏氨酸为底物生成tmp。
在添加[u-13c4,15n]-l-苏氨酸和[u-13c6]-d-葡萄糖的发酵液中(图8b),质荷比为131的质谱峰的丰度明显高于添加[u-13c4,15n]-l-苏氨酸和d-葡萄糖的发酵液中该质荷比的丰度(图8d),说明在添加[u-13c4,15n]-l-苏氨酸和[u-13c6]-d-葡萄糖的发酵液中,tmp生成不只仅来源于[u-13c4,15n]-l-苏氨酸的代谢。由于在添加l-苏氨酸和[u-13c6]-d-葡萄糖的发酵液中没有质荷比131的质谱峰出现(图8c),说明微生物不能单独利用[u-13c6]-d-葡萄糖为底物生成tmp。因此可以推断在添加[u-13c4,15n]-l-苏氨酸和[u-13c6]-d-葡萄糖的发酵液中,部分tmp的合成可能来源于l-苏氨酸和d-葡萄糖的同时参与,即tmp含有单甲基的半环来源于l-苏氨酸代谢生成的氨基丙酮(3个c和1个n被同位素标记),而含有双甲基的半环可能来源于d-葡萄糖代谢生成的2-氨基-3-丁酮(4个c被同位素标记),由此使得tmp的质荷比增加了8。该结果说明微生物可以同时利用l-苏氨酸和d-葡萄糖为底物生成tmp。
2、全细胞催化验证tmp微生物合成的底物来源
为了进一步确定微生物可以单独以l-苏氨酸为底物,或同时以l-苏氨酸和d-葡萄糖为底物生成tmp。按照如下方法对b.subtilis168进行了全细胞催化:将b.subtilis168在lb平板上进行活化,37℃过夜培养,挑取单菌落至lb试管中,37℃、200rpm摇床培养12h获取种子液。将b.subtilis168种子液按1%接种量转接至lbt培养基中培养1d,取适量菌液进行离心(12000rpm,5min),使用0.85%的生理盐水对菌体洗涤两次并用含不同添加底物(l-苏氨酸5g·l-1、d-葡萄糖10g·l-1、磷酸氢二铵3g·l-1)的tris-hcl-nacl缓冲液悬浮菌体,不添加底物的tris-hcl-nacl悬浮菌液和无菌的含l-苏氨酸(5g·l-1)、d-葡萄糖(10g·l-1)和磷酸氢二铵(3g·l-1)的tris-hcl-nacl缓冲液分别作为对照,悬浮菌体od600nm至3.0。所有体系的体积均为1ml,反应容器为10ml离心管,各体系在37℃、200rpm下进行反应,2d后取样,12000rpm,离心5min,取上清液利用uplc-tq-s-ms进行tmp的定量检测。
结果如图9所示。在均没有添加l-苏氨酸的全细胞催化样品1号、2号、3号和5号中不产tmp,而在单独添加了l-苏氨酸的4号样品中,可以明显看出有tmp的生成,比较4号和6号样品,发现同时添加l-苏氨酸和d-葡萄糖可以明显提高tmp的积累量,这些结果说明单独的l-苏氨酸可以作为tmp合成的底物来源(样品4号),而b.subtilis168不能单独利用d-葡萄糖生成tmp(样品3号),但是若有l-苏氨酸存在的情况下,d-葡萄糖的添加可以增加tmp的生成量(样品6号),因为d-葡萄糖的添加增加了tmp双甲基半环的前体2-氨基-3-丁酮的生成,使得2-氨基-3-丁酮与氨基丙酮发生脱水缩合发应的几率增加,从而增加了tmp的生成量。以上结果与同位素示踪实验结果一致。
比较6号样品和8号样品,发现在d-葡萄糖和l-苏氨酸同时存在的情况下,磷酸氢二铵的添加可以促进tmp的生成。在只有l-苏氨酸存在的全细胞催化体系中,磷酸氢二铵的添加却抑制了tmp的生成。另外,由样品9可以看出,磷酸氢二铵、d-葡萄糖和l-苏氨酸之间不会发生化学反应生成tmp,说明tmp的生成需要b.subtilis168的参与。
3、tdh对微生物合成tmp的影响
无论微生物只利用l-苏氨酸还是同时利用l-苏氨酸和d-葡萄糖合成tmp,如果tmp单甲基半环的前体是氨基丙酮,那么l-苏氨酸到氨基丙酮过程中的关键酶tdh在b.subtilis168利用l-苏氨酸或同时利用l-苏氨酸和d-葡萄糖为底物合成tmp的途径中应该也是一个关键酶。
利用lbtg培养基对菌株b.subtilis168/pma0911、b.subtilis168δtdh和b.subtilis168δtdh/pma0911-tdh进行培养,2d后取样,检测tmp的生成量以及菌株的生长情况(od600nm),如图10所示。结果说明tdh在b.subtilis168利用l-苏氨酸或同时利用l-苏氨酸和d-葡萄糖合成tmp的过程中起着决定性的作用,证明了b.subtilis168不管是利用l-苏氨酸或者是同时利用l-苏氨酸和d-葡萄糖为底物合成tmp,从l-苏氨酸到氨基丙酮的代谢过程均起到了决定性的作用,即tdh是b.subtilis168利用l-苏氨酸或同时利用l-苏氨酸和d-葡萄糖为底物合成tmp途径中的一个关键酶,这也间接表明了氨基丙酮是tmp单甲基半环的前体。
基于以上结果与分析,提出了tmp以l-苏氨酸为底物或同时以l-苏氨酸和d-葡萄糖为底物的微生物合成机制,如图11所示。tmp单甲基半环可以来源于l-苏氨酸代谢生成的氨基丙酮,同时双甲基半环可以来源于d-葡萄糖代谢生成的2-氨基-3-丁酮;另外,单独的l-苏氨酸可以同时参与tmp单甲基半环前体(氨基丙酮)和双甲基半环前体(2-氨基-3-丁酮)的生成,进而生成tmp;而单独的d-葡萄糖只能参与tmp双甲基半环前体(2-氨基-3-丁酮)的生成,故不能单独作为tmp微生物合成的底物来源。2,5-dmp微生物合成机制中的关键酶tdh决定了tmp单甲基半环前体(氨基丙酮)的生成,因此,该酶在tmp微生物合成机制中也是一个关键酶。
实施例4:以l-苏氨酸为发酵底物的产2,5-dmp菌株的构建及发酵
1、不同来源的tdh表达载体的构建
本实施例以b.subtilis168为出发菌种,首先选取不同种属来源的tdh(表1),并分别外源表达,通过检测2,5-dmp产量,来筛选具有催化优势的tdh,并获得2,5-dmp增产菌种。
选取的b.subtilis168(np_389581)、b.licheniformisatcc14580(wp_085959523)、b.amyloliquefaciensdsm7(wp_014470388)、e.colik-12(np_418073)。
分别提取b.subtilis168、b.licheniformisatcc14580、b.amyloliquefaciensdsm7全基因组,并以此为模板分别进行tdh编码基因tdh的克隆。选用b.subtilis外源表达质粒pma0911为载体,双酶切(ndei/ecori)后的质粒与pcr扩增的tdh编码基因tdh经胶回收纯化后进行连接,构建tdh表达重组质粒。另外,因e.colik-12的tdh编码基因tdh密码子优化后进行全基因合成,并构建到表达载体pma0911上。
对构建的重组质粒进行双酶切(ndei/ecori)验证和基因测序。选择测序正确的,说明不同来源的tdh表达载体pma0911-tdh构建成功。
2、tdh表达菌株的构建
将验证正确的不同种属来源的tdh表达载体pma0911-tdh分别转入b.subtilis168感受态中,对阳性转化子进行菌液pcr验证,与理论上的pcr产物长度一致的,表明以b.subtilis168为宿主,不同种属来源的tdh外源表达菌株构建成功。将含有来源于b.subtilis168、b.licheniformisatcc14580、b.amyloliquefaciensdsm7、e.colik-12来源的tdh的重组菌,分别命名为,b.subtilis168/pma0911-tdh(b.s)、b.subtilis168/pma0911-tdh(b.l)、b.subtilis168/pma0911-tdh(b.a)、b.subtilis168/pma0911-tdh(e.c)。
3、重组菌的发酵验证
对构建成功的工程菌株进行发酵验证,在含有5.83g/l的l-苏氨酸的lbt液体培养基中发酵24h,测定细胞生长量(od600)、生成的2,5-dmp和消耗的l-苏氨酸。
将菌株在lb平板上进行活化,37℃过夜培养,挑取单菌落至lb试管中,37℃、200rpm摇床培养12h获取种子液。抗性为硫酸卡那霉素(50μg·ml-1),按1%接种量转接至50mllbt培养基(250ml摇瓶,50μg·ml-1硫酸卡那霉素)进行培养,24h后取样。样品处理:取50μl样品进行4倍稀释,测定od600nm,剩余样品进行离心,12000rpm,5min,取上清液,-20℃保存等待检测。
结果显示,各基因工程菌的od600无明显差别,不同种属来源的tdh外源表达菌株积累2,5-dmp能力具有显著性差异,来源于e.colik-12的tdh外源表达菌株b.subtilis168/pma0911-tdh(e.c)利用l-苏氨酸消耗量最高,积累2,5-dmp浓度最高,发酵24h后,2,5-dmp的积累量高达527.43mg/l,生产强度为21.98mg/(l·h),转化率可达9%。此外,来源于b.subtilis168、b.licheniformisatcc14580、b.amyloliquefaciensdsm7的tdh外源表达菌株发酵24h后,2,5-dmp的积累量分别约300mg/l、350mg/l、360mg/l。
实施例5:利用uplc定量检测发酵液中2,5-dmp
2,5-dmp的定量分析:采用超高效液相色谱(uplc)对2,5-dmp进行定量检测,具体条件如下:色谱柱watersbehc18(100mm×2.1mm,1.7μmparticle)对样品中的2,5-dmp进行液相分离。流动相a为0.1%甲酸溶液(如无特殊说明,涉及到的百分数为体积分数),流动相b为色谱级甲醇。流动相洗脱梯度:初始,31%b;0-3min,31%-69%b;3-10min,31%b;运行时间为10min。流速为0.20ml·min-1,紫外检测波长为275nm。上样量1μl。
配制不同浓度梯度的2,5-dmp标准品溶液,根据浓度与峰面积的变化,利用origin软件拟合出2,5-dmp标准曲线,进而根据待测样品中相应出峰时间的峰面积计算出2,5-dmp的含量。结果如图12所示,利用此方法所获得的标准曲线为y=0.00004312*x-1.19126(其中,y代表2,5-dmp浓度,单位是mg/l,x代表峰面积,单位是μv*s,r2为1),标准品检测的线性范围:27mg/l-1725mg/l。
以如下发酵液为例:在添加1g/l的l-苏氨酸的lb培养基(lb的配方:5g/l酵母粉,10g/l蛋白胨,10g/l氯化钠)中,37℃、200rpm培养b.subtilis168至2d,离心取发酵上清液。结果如图13所示,可以明显看出,在复杂的发酵液体系中,2,5-dmp可以实现有效分离。
sequencelisting
<110>江南大学
<120>一种生物催化合成含单甲基半环的烷基吡嗪方法
<160>24
<170>patentinversion3.3
<210>1
<211>33
<212>dna
<213>人工序列
<400>1
cgccggatccatgcagagtggaaagatgaaagc33
<210>2
<211>36
<212>dna
<213>人工序列
<400>2
cgccaagcttttatggaattaaaattacttttccgc36
<210>3
<211>35
<212>dna
<213>人工序列
<400>3
ggagcgatttacatatgatgcagagtggaaagatg35
<210>4
<211>41
<212>dna
<213>人工序列
<400>4
cgactctagaggatccttatggaattaaaattacttttccg41
<210>5
<211>20
<212>dna
<213>人工序列
<400>5
tcaaaacgaaccttccagtc20
<210>6
<211>43
<212>dna
<213>人工序列
<400>6
aatgtatgctatacgaacggtatcaggaatgggaacttcagtc43
<210>7
<211>44
<212>dna
<213>人工序列
<400>7
agcatacattatacgaacggtaattacccatcagtttccattag44
<210>8
<211>20
<212>dna
<213>人工序列
<400>8
atatgctccggctcttcaag20
<210>9
<211>20
<212>dna
<213>人工序列
<400>9
gctcagcggagttgtcattg20
<210>10
<211>20
<212>dna
<213>人工序列
<400>10
ggcgcaaataatcgatcagc20
<210>11
<211>22
<212>dna
<213>人工序列
<400>11
taccgttcgtatagcatacatt22
<210>12
<211>22
<212>dna
<213>人工序列
<400>12
taccgttcgtataatgtatgct22
<210>13
<211>20
<212>dna
<213>人工序列
<400>13
ctcataaaagtgaaagccgc20
<210>14
<211>20
<212>dna
<213>人工序列
<400>14
aactgatcaactgagacacc20
<210>15
<211>35
<212>dna
<213>人工序列
<400>15
ggagcgatttacatatgatgcagagtggaaagatg35
<210>16
<211>41
<212>dna
<213>人工序列
<400>16
gcttgtcgacgaattcttatggaattaaaattacttttccg41
<210>17
<211>40
<212>dna
<213>人工序列
<400>17
ggagcgatttacatatgatgttgggaggaaagatgaaagc40
<210>18
<211>41
<212>dna
<213>人工序列
<400>18
gcttgtcgacgaattcttatggaatcagaatgactttgccg41
<210>19
<211>42
<212>dna
<213>人工序列
<400>19
ggagcgatttacatatgatgttggacggaaatatgaaagcgc42
<210>20
<211>41
<212>dna
<213>人工序列
<400>20
gcttgtcgacgaattcctacggtatcagtacgactttgccg41
<210>21
<211>37
<212>dna
<213>人工序列
<400>21
ctgggattaagaattcatgaaagttacggtggtcggc37
<210>22
<211>37
<212>dna
<213>人工序列
<400>22
cgactctagaggatcctcacgcattaacgctttgtgc37
<210>23
<211>20
<212>dna
<213>人工序列
<400>23
tgctgaataaaagatacgag20
<210>24
<211>20
<212>dna
<213>人工序列
<400>24
ttcaccgtcatcaccgaaac20
- 还没有人留言评论。精彩留言会获得点赞!