一种具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物及其制备方法与流程
本发明属于大麦深加工、高值化领域,具体涉及一种具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物及其制备方法。
背景技术:
在现有的研究抑制α-葡萄糖苷酶活性物质的专利中,原料取材大多来源于名贵中药材、深海动植物以及受季节、地域影响的草本植物,一是取材不易、成本较高,二是产量较低,无法满足市场的需求。大麦是一种主要的粮食和饲料作物,也是酿造啤酒的主要原料。麦芽根是啤酒工业麦芽生产过程中生成的主要副产物。大麦发芽以后烘干,经过除根工艺得到,实际生产中副产物麦芽根的数量约占大麦总投料量的3-4%。我国是啤酒产销大国,2017年我国啤酒总产量约4401.5万吨,麦芽根总量有10万吨以上,非常可观。然而麦芽根资源没有得到充分合理的利用,通常都是直接作为饲料。麦芽根中蛋白质含量为25-34%(其中酶类占2-3%),脂肪1.6-2.2%,粗纤维6-10%,非氮浸出物35-44%,水分<7.0%。麦芽根中的矿质元素k、p、mg、ca、fe含量较高,分别为1813、935、720、240、38.3mg/100g,其氨基酸组成非常符合fao推荐的必需氨基酸模式。这些新的研究,为麦芽根的综合利用提供了更多的方向。本发明属于大麦深加工、高值化领域,具体涉及一种具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物及其制备方法。
糖尿病是一种慢性的终身性疾病,患者的前期特征是餐后血糖浓度较高,持续性餐后高血糖可能会引起血管损伤、代谢障碍等,并产生多种并发症,如心脏病、高血压、肺结核、尿毒症等。随着生活方式的不断变化和饮食的不规律,糖尿病的发病率日益增多,目前是仅次于肿瘤、心血管疾病的世界第三大疾病,并且有年轻化、扩大化的发展趋势。人体血糖主要来源于饮食,而饮食中碳水化合物主要成分为淀粉,但是淀粉和双糖分子链段较大,不能够被直接吸收进入人体血循环,而是需要经过淀粉酶和小肠绒毛上的多种α-葡萄糖苷酶的协同作用下生成单糖(葡萄糖及果糖)后才能被吸收。因此可以通过控制α-淀粉酶和α-葡萄糖苷酶两种酶促反应来减少葡萄糖的来源。
刘红雨等研究发现苦瓜降糖多肽是从苦瓜中分离提取出的一部分表现出明显降血糖功效的多肽,其具有种类丰富、含量多、降血糖效果持续时间长、安全性好等优点。周锋等利用中性蛋白酶、碱性蛋白酶和氨肽酶进行了复配酶解条斑紫菜蛋白制备α-葡萄糖苷酶抑制剂,并对粗品进行离子交换层析、凝胶层析和monoq阴离子交换层析的分离纯化,最终获得一种肽类α-葡萄糖苷酶抑制剂。alanconnolly等从啤酒花颗粒中提取出一种肽,通过体外实验表明该肽具有抑制α-葡萄糖苷酶、血管紧张素转化酶和dpp-ⅳ的活性,是一种很好的防治ⅱ型糖尿病和高血压的功能食品配料。
然而,对于麦芽根蛋白水解物抑制α-葡萄糖苷酶活性尚未有相关的报道。
技术实现要素:
为了克服现有技术存在的上述不足,本发明的目的是提供一种具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物及其制备方法。
本发明提供了一种具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物的制备方法,该方法能够得到一种具有潜在降血糖活性的麦芽根蛋白水解物。该水解物多肽含量>85%(质量百分比),通过体外验证具有良好的抑制α-葡萄糖苷酶活性。本发明提供的制备方法,工艺简单,整个工艺流程均可达食品级要求,可应用于药品、保健品和食品等领域当中。
本发明的目的至少通过如下技术方案之一实现。
本发明提供的一种具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物的制备方法,包括:以麦芽根干粉为原料,采用粉碎过筛、蛋白酶酶解、低温高速离心、大孔树脂吸附、柱层析、冷冻干燥,得到具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物。该水解物多肽含量>85%(质量百分比),对α-葡萄糖苷酶的抑制率>50%。
本发明提供的一种具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物的制备方法,包括如下步骤:
(1)粉碎过筛:将干麦芽根粉碎后过筛,得到麦芽根干粉;
(2)蛋白酶酶解:将麦芽根干粉与去离子水混合均匀,形成混悬液1,在混悬液1中加入蛋白酶进行恒温酶解反应(为了反应充分,可以适当摇瓶振荡混悬液),得到混悬液2;
(3)低温高速离心处理:加热混悬液2,冷却至室温后,低温高速离心处理,取上清液,得到提取液1;
(4)过滤分离:用滤纸过滤分离提取液1,取滤液,调节滤液ph为弱碱性,得到提取液2;
(5)大孔树脂吸附:使用大孔树脂吸附步骤(4)所述提取液2,然后加入乙醇溶液解吸大孔树脂中所吸附的物质,得到提取液3;
(6)冷冻干燥:对提取液4进行冷冻干燥,得到所述具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物。
进一步地,步骤(1)所述过筛是过60-80目筛。
进一步地,步骤(2)所述麦芽根干粉与水的料液比为1:10-1:20g/ml。
进一步地,步骤(2)所述蛋白酶包括碱性蛋白酶;所述蛋白酶的加入量为麦芽根干粉质量的的0.4-1%;步骤(2)所述恒温酶解反应的温度为50-55摄氏度,恒温酶解反应的时间为3-4h。
进一步地,步骤(3)所述加热的温度为90-100摄氏度,加热的时间为10-15min。
进一步地,步骤(3)所述低温离心处理的温度为4-10摄氏度,所述低温离心处理的转速为8000-10000rpm,所述低温离心处理的时间为10-15min。
进一步地,步骤(4)所述调节滤液的ph为中性或弱碱性,使调节后的滤液ph值为7.0-7.5.
进一步地,步骤(5)所述大孔树脂为ab-8型大孔吸附树脂;所述乙醇溶液的浓度为20%-40%(v/v)。
优选地,步骤(6)所述提取液3可以先采用葡聚糖凝胶柱进行柱层析处理再冷冻干燥,使提取液3进一步地纯化,所述葡聚糖凝胶柱为sephadexg-50凝胶柱。
进一步地,步骤(6)得到的麦芽根蛋白水解物多肽含量>85%(质量百分比),具有抑制α-葡萄糖苷酶的活性。
本发明提供一种由上述的制备方法制得的具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物。
与现有技术相比,本发明具有如下优点和有益效果:
(1)本发明提供的具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物是一种含麦芽根小分子活性物质的麦芽根蛋白水解物,其具有良好抑制α-葡萄糖苷酶活性,该提取物多肽含量>85%(质量百分比);
(2)本发明提供的制备工艺流程均可达食品级要求;
(3)本发明提供的具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物,经过体外验证具有良好的抑制α-葡萄糖苷酶活性,可用于制备降血糖类保健品或辅助性治疗药物。
附图说明
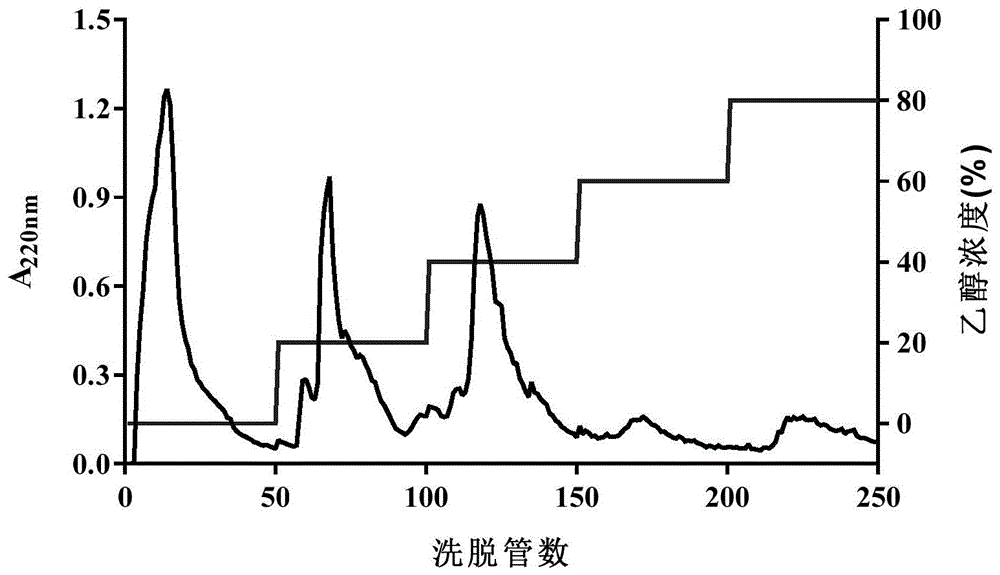
图1为实施例1-3所得具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物(经大孔树脂吸附)的洗脱曲线。
图2为实施例1-3所得具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物(经大孔树脂吸附)对α-葡萄糖苷酶的抑制活性柱状图。
图3为实施例3所得具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物二次洗脱(先经大孔树脂吸附后经柱层析)的曲线。
图4为实施例3所得具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物经一次洗脱和二次洗脱后的产物对α-葡萄糖苷酶的抑制活性柱状图。
具体实施方式
以下结合附图和实例对本发明的具体实施作进一步说明,但本发明的实施和保护不限于此。需指出的是,以下若有未特别详细说明之过程,均是本领域技术人员可参照现有技术实现或理解的。所用试剂或仪器未注明生产厂商者,视为可以通过市售购买得到的常规产品。
实施例1
用粉碎机将麦芽根制成干粉,过60目筛,得到麦芽根干粉,按照1:10的料液比加入去离子水,混合均匀,其中麦芽根干粉的质量为10g,去离子水的体积为100ml,形成混悬液1。在混悬液1中加入麦芽根干粉质量的0.4%的碱性蛋白酶,在50℃恒温条件下进行酶解反应,酶解时间为3h,得到混悬液2。然后加热混悬液2,加热的温度为90℃,加热的时间为15min,冷却至室温后,在4℃低温条件下进行离心处理,离心处理的转速为8000rpm,离心处理的时间为15min,取上清液,得到提取液1。过滤分离提取液1,取滤液,然后调节滤液ph=7,得到提取液2。使用ab-8大孔树脂吸附所述提取液2,加入20%(v/v)乙醇溶液解吸ab-8大孔树脂中所吸附的物质,得到提取液3。对提取液3进行冷冻干燥,得到所述具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物。经福林酚法测定,在实施例1得到的麦芽根蛋白水解物中,多肽占的质量百分比为87.4%。
实施例2
用粉碎机将麦芽根制成干粉,过80目筛,得到麦芽根干粉,按照1:15的料液比加入去离子水,混合均匀,其中麦芽根干粉的质量为10g,去离子水的体积为150ml,形成混悬液1。在混悬液1中加入麦芽根干粉质量的0.6%的碱性蛋白酶,在50℃恒温条件下进行酶解反应,酶解时间为4h,得到混悬液2。然后加热混悬液2,加热的温度为95℃,加热的时间为10min,冷却至室温后,在7℃低温条件下进行离心处理,离心处理的转速为8000rpm,离心处理的时间为15min,取上清液,得到提取液1。过滤分离提取液1,取滤液,然后调节滤液ph=7.5,得到提取液2。使用ab-8大孔树脂吸附所述提取液2,加入20%(v/v)乙醇溶液解吸ab-8大孔树脂中所吸附的物质,得到提取液3。对提取液3进行冷冻干燥,得所述具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物。经福林酚法测定,在实施例2得到的麦芽根蛋白水解物中,多肽占的质量百分比为89.1%。
实施例3
用粉碎机将麦芽根制成干粉,过80目筛,得到麦芽根干粉,按照1:20的料液比加入去离子水,混合均匀,其中麦芽根干粉的质量为10g,去离子水的体积为200ml,形成混悬液1。在混悬液1中加入麦芽根干粉质量的1%的碱性蛋白酶,在55℃恒温条件下进行酶解反应,酶解时间为4h,得到混悬液2。然后加热混悬液2,加热的温度为100℃,加热的时间为10min,冷却至室温后,在10℃低温条件下进行离心处理,离心处理的转速为10000rpm,离心时间为10min,取上清液,得到提取液1。过滤分离提取液1,取滤液,然后调节滤液ph=7.5,得到提取液2。使用ab-8大孔树脂吸附所述提取液2,加入40%(v/v)乙醇溶液解吸ab-8大孔树脂中所吸附的物质,得到提取液3。对提取液3进行冷冻干燥,得到所述具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物。经福林酚法测定,在实施例3得到的麦芽根蛋白水解物中,多肽占的质量百分比为89.5%。
实施例4
用粉碎机将麦芽根制成干粉,过80目筛,得到麦芽根干粉,按照1:20的料液比加入去离子水,其中麦芽根干粉的质量为10g,去离子水的体积为200ml,形成混悬液1。在混悬液1中加入麦芽根干粉质量的1%的碱性蛋白酶,在55℃恒温条件下进行酶解反应,酶解时间为4h,得到混悬液2。然后加热混悬液2,加热的温度为100℃,加热的时间为10min,冷却至室温后,在10℃低温条件下进行离心处理,离心处理的转速为10000rpm,离心处理的时间为10min,取上清液,得到提取液1。采用滤纸过滤分离提取液1,取滤液,调节滤液ph=7.5,得到提取液2。加入40%(v/v)乙醇溶液解吸ab-8大孔树脂中所吸附的物质,得到提取液3。采用葡聚糖凝胶sephadexg-50柱将提取液3进一步纯化,得到提取液4。对提取液4进行冷冻干燥,得到所述具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物。经福林酚法测定,在实施例4得到的麦芽根蛋白水解物中,多肽占的质量百分比为90.01%。
实施效果测试:
检测实施例1-4制得的麦芽根蛋白水解物进行体外α-葡萄糖苷酶的抑制活性。
(1)检测原理
对硝基苯-α-葡萄糖苷(4-nitrophenylα-d-glucopyranoside,缩写为pnpg)作为α-葡萄糖苷酶的特异性底物。pnpg经α-葡萄糖苷酶水解产生对硝基苯酚,在405nm呈特异性吸收。通过对比抑制剂加入前后体系中对硝基苯酚的生成量,即可了解抑制剂对α-葡萄糖苷酶活性的抑制作用。
(2)检测所需试剂
0.1mol/lpbs缓冲液(ph为7.0,不含质量百分比浓度为0.2%的bsa);0.01mol/lpbs缓冲液(ph为7.0,含质量百分比浓度为0.2%bsa);0.01mol/lpbs缓冲液(ph为7.0,不含bsa);2.5mmol/l的底物pnpg溶液;0.3u/mlα-葡萄糖苷酶溶液;0.2mol/lna2co3溶液。
(3)样品组:
依次在96孔板中添加(2)所述的3种pbs缓冲液20μl,实施例1-4制得的麦芽根蛋白水解物样品各20μl,浓度为0.3u/mlα-葡萄糖苷酶溶液20μl,然后37℃孵育5min,再加入2.5mmol/lpnpg溶液20μl,然后37℃反应30min,最后加入0.2mol/lna2co3溶液80μl于96孔板中,使用酶标仪检测。
背景组:依次在96孔板中添加(2)所述的3种pbs缓冲液40μl,实施例1-4制得的麦芽根蛋白水解物样品各20μl,然后37℃孵育5min,再加入2.5mmol/lpnpg溶液20μl,然后37℃反应30min,最后加入0.2mol/lna2co3溶液80μl于96孔板中,使用酶标仪检测。
阴性组:依次在96孔板中添加(2)所述的3种pbs缓冲液40μl,浓度为0.3u/mlα-葡萄糖苷酶溶液20μl,然后37℃孵育5min,再加入2.5mmol/lpnpg溶液20μl,然后37℃反应30min,最后加入0.2mol/lna2co3溶液80μl于96孔板中,使用酶标仪检测。
空白组:依次在96孔板中添加(2)所述的3种pbs缓冲液80μl,,然后37℃孵育35min,最后加入0.2mol/lna2co3溶液80μl于96孔板中,使用酶标仪检测。
每组做3个平行,于酶标仪中检测405nm处的吸光度,以此计算出样品的酶抑制率。
计算公式:酶抑制率%=[1-(od样品-od背景)/(od阴性-od空白)]
实验结果分析
1.大孔吸附树脂实验结果分析:
以ab-8型大孔吸附树脂分别对实施例1-3得到的具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物进行初级纯化,以体积分数为30%的乙醇溶液为洗脱液,分别收集洗脱液,洗脱曲线如图1所示,在220nm处测定吸光度,测定前将洗脱液稀释10倍,最终得到3个实施例的洗脱组分。分别收集这3个洗脱组分,分别记为mrp1、mrp2、mrp3。如图2所示为在同样浓度(1mg/ml,以多肽计)条件下mrp、mrp1、mrp2及mrp3对α-葡萄糖苷酶的抑制活性对比,mpr为实施例3制得的具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物(没有经过初级纯化),实施例1、实施例2及实施例4制得的具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物没有经过初级纯化时的效果与实施例3相似,即实施例1、2、3及4未初级纯化前的具有抑制α-葡萄糖苷酶活性的麦芽根蛋白水解物之间没有显著性差异,故取实施例3得到的mrp与纯化后的mrp1、mrp2、mrp3进行对比。其中,测得mrp1的抑制率为29.82%,mrp2为7.98%,mrp3为51.96%;实施例4效果与实施例3相似,可参照图1及图2。对比实施例3纯化前样品mrp、实施例1样品mrp1、实施例2样品mpr2及实施例3样品mrp3的抑制活性,发现实施例3样品mrp3组分的活性较好。因此,选择mrp3组分进行下一步sephadexg-50凝胶纯化。
2.柱层析实验结果分析:
将mrp3通过sephadexg-50凝胶柱层析进行进一步的纯化,检测洗脱液在220nm波长下的吸光值(测定前将洗脱液稀释10倍),收集洗脱组分,洗脱曲线如图3所示,命名为mrp3-1。福林酚法检测mrp、mrp3、mrp3-1三种组分的多肽含量,结果显示mrp的多肽含量为30.45%±1.45%,mrp3的多肽含量为72.04%±2.12%,mrp3-1的多肽含量为89.36%±1.56%。可见,在分别经过大孔吸附树脂和葡聚糖凝胶sephadexg-50柱层析纯化后,得到多肽组分的纯度显著提高。如图4所示,在分别经过大孔吸附树脂和葡聚糖凝胶sephadexg-50柱层析两级纯化后,实施例3提供的样品溶液(1mg/ml,以多肽计)对α-葡萄糖苷酶抑制率,从mrp的43.91%提高到mrp3的51.96%,以及mrp3-1的57.89%。说明,经过每一次纯化,其多肽组分的α-葡萄糖苷酶抑制活性逐渐升高。其他实施例的效果与实施例3相似,可参照图3及图4。
本发明实施例可见,整个制备工艺流程简单、各环节均可达食品级要求,制备成本低。
以上实施例仅为本发明较优的实施方式,仅用于解释本发明,而非限制本发明,本领域技术人员在未脱离本发明精神实质下所作的改变、替换、修饰等均应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!