利用β‑葡萄糖苷酶提高菇渣产氢和产糖的方法及其应用与流程
本发明属于微生物发酵领域,特别涉及一种利用β-葡萄糖苷酶提高菇渣产氢和产糖的方法及其应用。
背景技术:
随着人类社会的进步,作为人类赖以生存和发展的物质基础,能源的需求量也日益剧增。目前世界上的能源供应大部分都是化石能源,但是由于其不可再生、储量有限和环境污染问题制约着人类社会的进步。能源和环境危机将可再生能源推向了研究热潮,希望其可以替代化石能源,支撑人类社会对能源的需求。以可木质纤维素为原料,利用微生物或者其他手段将其转化为可以直接利用的生物乙醇或者氢气,由于可再生性和环境友好性被人们寄予厚望,受到众多研究者的重视。实现木质纤维素高效转化的第一步是将聚合形式的纤维素和半纤维素分解为可发酵性的糖,同时也是生物质能源化的限速步骤,该过程通常利用纤维素酶进行,但是由于酶的生产成本高,利用微生物直接转化木质纤维素的方法受到大家的青睐。提高微生物的降解效率和转化效率可以有效降低生物质能源的生产成本,加速生物能源的工业化进程。
原材料和酶的成本在生物燃料生产中占据较大比重,因此如何选择所使用的原材料和酶以降低生物燃料的成本是研究人员的研究方向。以农业废弃物——菇渣为原料,利用联合加工工艺直接进行微生物的转化,可以大幅降低原料成本和酶的生产成本,同时还可以解决废弃菇渣对环境的污染问题,对生物燃料的生产具有重要的意义。
技术实现要素:
本发明的首要目的在于克服现有技术的缺点与不足,提供一种利用β-葡萄糖苷酶提高菇渣产氢和产糖的方法。该方法以菇渣为原料,仅仅通过洗涤粉碎等前期处理,利用嗜热厌氧梭菌(Clostridium thermocellum)厌氧发酵过程中添加β-葡萄糖苷酶和低浓度的表面活性剂提高菇渣的发酵产氢和生物糖化效率。
本发明的另一目的在于提供所述利用β-葡萄糖苷酶提高菇渣产氢和产糖方法的应用。
本发明的目的通过下述技术方案实现:一种利用β-葡萄糖苷酶提高菇渣产氢和产糖的方法,包括以下步骤:在发酵培养基中接种嗜热厌氧梭菌,并添加物质A进行厌氧发酵,提高产氢和生物糖化效率;物质A为β-葡萄糖苷酶和表面活性剂中的一种或两种。
所述的物质A优选为β-葡萄糖苷酶、或是β-葡萄糖苷酶和表面活性剂的组合。
所述的表面活性剂优选为Triton X-100。
所述的表面活性剂的浓度优选为125g/L。
所述的表面活性剂的添加时间优选为发酵第82h添加。
所述的表面活性剂的添加量优选为按终浓度为质量(g)体积(ml)比0.25%计算。
所述的表面活性剂优选通过如下操作步骤得到:将表面活性剂溶液装入能密封的容器中密封,抽真空、充惰性气体及灭菌。
所述的能密封的容器优选为血清瓶。
所述的惰性气体优选为氮气。
所述的充惰性气体的具体操作优选为:充0.01MPa氮气3次。
所述的灭菌的条件优选为:115℃灭菌20min。
所述的β-葡萄糖苷酶为嗜热厌氧梭菌本身的β-葡萄糖苷酶。
所述的β-葡萄糖苷酶的添加时间为:发酵第0h和/或发酵第82h时添加,优选为0h添加后82h再补加一次。
所述的β-葡萄糖苷酶的添加量优选为按1g菇渣配比10~11Uβ-葡萄糖苷酶计算;更优选为每50mL厌氧发酵体系中含30Uβ-葡萄糖苷酶。
所述的β-葡萄糖苷酶优选通过如下制备方法制备得到:对嗜热厌氧梭菌的β-葡萄糖苷酶基因进行克隆,再将该β-葡萄糖苷酶基因重组到表达载体中,将得到的重组表达载体转化入宿主细胞进行表达,得到β-葡萄糖苷酶。
所述的克隆的步骤优选如下:以嗜热厌氧梭菌的DNA或cDNA为模板,通过以下引物进行PCR,得到β-葡萄糖苷酶基因;
引物1:5`-CAGTCCATGGCAAAGATAAC-3`;
引物2:5`-CGAGCTCGAAACCGTTGTTTTTGATTAC-3`。
所述的表达载体优选为原核表达载体;更优选为pET-30a载体。
所述的宿主细胞优选为原核宿主细胞;更优选为大肠杆菌BL21。
所述的发酵培养基为以菇渣为碳源的培养基。
所述的发酵培养基的组成为A液、B液、C液、D液和E液按体积比40:2:1:1:1混合得到,pH值约为7.0,其中:
A液中含有60g/L的菇渣作为碳源;B液中含有柠檬酸钾50g/L、一水柠檬酸31.25g/L、硫酸钠25g/L、磷酸二氢钾25g/L和碳酸氢钠62.5g/L;C液中含有氯化铵75g/L、尿素250g/L和酵母抽提物50g/L;D液中含有六水氯化镁50g/L、氯化亚铁四水合物5g/L、二水氯化钙10g/L和L-半胱氨酸盐酸盐一水物50g/L;E液中含有二盐酸吡哆胺1g/L、对氨基苯甲酸0.2g/L、D-生物素0.1g/L、维生素B12 0.1g/L和维生素B1 0.2g/L;A液、B液、C液、D液、和E液中的溶剂为去离子水。
所述的菇渣优选通过如下方法制备得到:将菇类生产后的废弃物用清水洗涤至中性后烘干至恒重,粉碎得到,菇类生产后的废弃物包括菇类的培养基以及被废弃的菇体。
所述的粉碎的程度为能过200目筛。
所述的嗜热厌氧梭菌为能够直接降解纤维素的嗜热厌氧梭菌,优选为嗜热厌氧梭菌ATCC 27405。
所述的嗜热厌氧梭菌为处于对数生长期的嗜热厌氧梭菌,接种体积量优选为相当于发酵培养基体积的10%。
所述的处于对数生长期的嗜热厌氧梭菌通过如下步骤制备得到:将嗜热厌氧梭菌在种子液培养基中经活化和扩大培养,得到处于对数生长期的嗜热厌氧梭菌。
所述的种子液培养基组成为:A1液、B液、C液、D液和E液按体积比40:2:1:1:1混合得到,其中:
A1液中含有3g/L的纤维素作为碳源;B液中含有柠檬酸钾50g/L、一水柠檬酸31.25g/L、硫酸钠25g/L、磷酸二氢钾25g/L和碳酸氢钠62.5g/L;C液中含有氯化铵75g/L、尿素250g/L和酵母抽提物50g/L;D液中含有六水氯化镁50g/L、氯化亚铁四水合物5g/L、二水氯化钙10g/L和L-半胱氨酸盐酸盐一水物50g/L;E液中含有二盐酸吡哆胺1g/L、对氨基苯甲酸0.2g/L、D-生物素0.1g/L、维生素B12 0.1g/L和维生素B1 0.2g/L;A1液、B液、C液、D液、和E液中的溶剂为去离子水。
所述的活化的条件优选为:在西林瓶中加入种子液培养基,再接种嗜热厌氧梭菌,于55~60℃摇床培养48~72h。
所述的放大的条件优选为:在血清瓶中加入种子培养基培养48~72h,再接种经活化后的嗜热厌氧梭菌,于55~60℃摇床培养48~72h或OD600=1.1~1.3。
所述的厌氧发酵优选通过如下操作步骤实现:在能密封的发酵容器中加入发酵培养基,密封,抽真空,充惰性气体,灭菌,再接种嗜热厌氧梭菌进行厌氧发酵。
所述的发酵的温度优选为55℃,摇床转速优选为150rpm,发酵的时间优选为168h收集氢气或发酵液。
所述的能密封的容器优选为血清瓶。
所述的惰性气体优选为氮气。
所述的充惰性气体的具体操作优选为:充0.01MPa氮气3次。
所述的灭菌的条件优选为:115℃灭菌20min。
所述的利用β-葡萄糖苷酶提高菇渣产氢和产糖的方法在微生物发酵领域中的应用。
所述的微生物发酵领域中的应用是指嗜热厌氧梭菌转化菇渣、甘蔗渣中的应用。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明发酵使用的原料为农业生产后的废弃物——菇渣,具有较高的总纤维素(纤维素及半纤维素)含量,不需要经过复杂的酸碱预处理即可直接被微生物水解和利用,进行氢气或生物糖化的发酵,显著降低了生产成本,解决废弃菇渣所造成的环境污染问题,实现菇渣变废为宝,具有可行性,具有极其广阔的应用推广前景。
(2)本发明通过嗜热厌氧梭菌的集成生物工艺进行生物制氢或糖化省去了酶解糖化过程酶的生产成本,可以有效降低投资费用和生产成本。
(3)本发明通过添加β-葡萄糖苷酶可以显著提高氢气的产量;共同添加β-葡萄糖苷酶和表面活性剂可以显著提高还原糖的积累量和底物的利用率以及生产效率,降低生产成本,是一种高效环境友好型的产氢和生物糖化耦合工艺。
附图说明
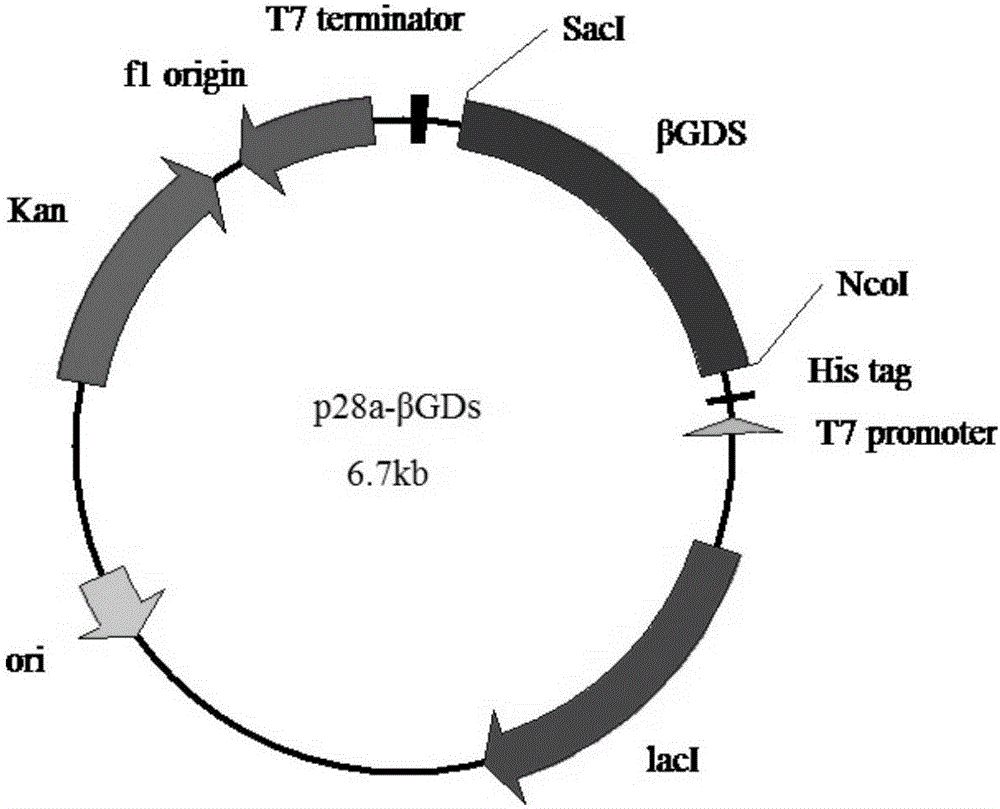
图1为β-葡萄糖苷酶的表达载体图谱。
图2为β-葡萄糖苷酶诱导表达后的SDS-PAGE检测,其中,泳道1为蛋白Marker;泳道2为诱导前BL21总蛋白;泳道3为诱导后BL21总蛋白。
图3为是否添加β-葡萄糖苷酶对嗜热厌氧梭菌产氢的差异,其中,CK:不添加β-葡萄糖苷酶产氢;A:0h添加β-葡萄糖苷酶产氢;B:0h添加β-葡萄糖苷酶并在82h补加β-葡萄糖糖苷酶产氢;C:82h添加β-葡萄糖苷酶产氢。
图4为是否添加β-葡萄糖苷酶和表面活性剂对嗜热厌氧梭菌产糖的差异,其中,CK:82h只添加β-葡萄糖苷酶产糖;CK-T:82h添加表面活性剂产糖;A:0h添加β-葡萄糖苷酶同时82h添加表面活性剂产糖;B:0h添加β-葡萄糖苷酶并在82h补加β-葡萄糖糖苷酶和表面活性剂产糖;C:82h添加β-葡萄糖苷酶同时82h添加表面活性剂产糖。
具体实施方式
下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1利用β-葡萄糖苷酶提高菇渣产氢和产糖的方法
1、β-葡萄糖苷酶的克隆方法:
(1)嗜热厌氧梭菌菌体的获得:将-80℃保存的嗜热厌氧梭菌(ATCC 27405)经10mL西林瓶于55~60℃摇床(150rpm)活化48~72h,接着在100ml的血清瓶于55~60℃摇床(150rpm)放大培养48~72h(OD600=1.1~1.3)后8000rpm离心10min收集菌体。其中,活化和放大的培养基采用种子培养基,种子培养基主要成份为A1、B、C、D和E液(pH值约为7.0),5种成分按40:2:1:1:1(v/v)用无菌注射器混合,溶剂为去离子水,A1液以3g/L的纤维素作为碳源;B液:柠檬酸三钾盐50g/L、一水柠檬酸31.25g/L、硫酸钠25g/L、磷酸二氢钾25g/L、碳酸氢钠62.5g/L;C液:氯化铵75g/L、尿素250g/L、酵母抽提物50g/L;D液:六水氯化镁50g/L、四水氯化亚铁5g/L、二水氯化钙10g/L、L-半胱氨酸盐酸盐一水物50g/L;E液:二盐酸吡哆胺1g/L、对氨基苯甲酸0.2g/L、D-生物素0.1g/L、维生素B12 0.1g/L、维生素B1 0.2g/L。
(2)嗜热厌氧梭菌基因组的提取:利用收集到的菌体提取嗜热厌氧梭菌的基因组,参考OMEGA公司的细菌基因组提取试剂盒(货号:D3350-01)提取嗜热厌氧梭菌的基因组,提取方法和步骤参考公司提供的说明书进行操作。
(3)嗜热厌氧梭菌β-葡萄糖苷酶的PCR扩增与鉴定:根据NCBI已经报道的嗜热厌氧梭菌β-葡萄糖苷酶序列(>gi|40664:361-1707)设计PCR引物(引物1和引物2),以上述提取的DNA模板在PCR仪(BIOER公司)进行PCR扩增,反应所用的引物、组分和扩增条件如下:
引物1:5`-CAGTCCATGGCAAAGATAAC-3`
引物2:5`-CGAGCTCGAAACCGTTGTTTTTGATTAC-3`
PCR扩增体系(25μL)组成如下:
扩增条件:94℃变性5min,再用94℃1min、52.8℃1min、72℃2min进行30个循环,最后72℃10min。再用琼脂糖凝胶电泳检测,结果显示扩增得到大小约1350bp的片段,用多功能DNA纯化回收试剂盒(离心柱型)(OMEGA)回收,把回收片段亚克隆到pMD-18T(TaKaRa公司产品)中,连接产物转化到用CaCl2法处理的大肠杆菌DH5α,在含氨苄青霉素(终浓度为100μg/ml)的LB固体平板上过夜培养,挑取平板上生长的菌落,通过菌落PCR验证阳性克隆。将验证阳性的克隆子接入LB液体培养基(含100μg/ml氨苄青霉素)中过夜培养,用高纯质粒小量制备试剂盒(离心柱型)(OMEGA)提取质粒,经NcoⅠ和SacⅠ酶切再进一步进行验证,测序(上海生工生物工程有限公司)。测序结果显示所扩增得到的片段大小为1347bp,通过其编码的氨基酸序列在Genebank数据库中用Blast程序进行同源检索,检索结果表明与该片段为嗜热厌氧梭菌的β-葡萄糖苷酶。
2、β-葡萄糖苷酶的诱导表达方法:
(1)β-葡萄糖苷酶表达菌株的构建:由于β-葡萄糖苷酶基因克隆时已经在其两端添加上了NcoⅠ和SacⅠ酶切位点,因此用限制性内切酶NcoⅠ和SacⅠ酶切连接上β-葡萄糖苷酶基因的pMD-18T(TaKaRa公司)载体,回收1350bp左右的片段即可,同时用限制性内切酶NcoⅠ和SacⅠ酶切pET-30a(Invitrogen)载体,回收载体片段,将回收的两个片段用T4连接酶在16℃连接4h,连接产物转化大肠杆菌DH5α,通过质粒提取和PCR筛选阳性克隆,并进行测序鉴定,筛选鉴定出重组质粒,命名为p28a-βGDs(如图1所示)。提取重组质粒p30a-βGDs,转化到用CaCl2法处理的大肠杆菌BL21,在含卡那霉素(50μg/ml)的LB固体平板上过夜培养,挑取平板上生长的菌落,通过菌落PCR验证阳性克隆。
(2)β-葡萄糖苷酶的诱导表达:将上述验证正确的阳性克隆子接种于5ml含卡那霉素(50μg/ml)的LB培养基中,37℃、150rpm振荡培养过夜后按1%(v/v)的接种量转接至400ml的LB培养基中,37℃、220rpm震荡培养至菌体OD值达到0.6,添加IPTG(IPTG的终浓度为1mM)进行诱导,继续培养3h后离心收集菌体,用超声波(300W,打4s停5s破碎40min)进行破碎后,10000rpm离心收集上清作为酶液。将未诱导的菌体上清和诱导后菌体的上清进行SDS-PAGE验证,结果如图2所示,说明β-葡萄糖苷酶诱导表达成功。
3、β-葡萄糖苷酶的酶活测定:
(1)对硝基苯酚标准曲线的绘制:将购买的对硝基苯酚(阿拉丁)配制成不同浓度(0-200μM)后用酶标仪(Thermo Fisher)测定OD405的吸光值,做出对硝基苯酚浓度和OD之间的标准曲线。
(2)酶解底物对硝基苯基-β-D-吡喃半乳糖苷体系的配置:将购买的对硝基苯基β-D-吡喃半乳糖苷(阿拉丁)用pH 6.0、0.1M的磷酸缓冲液配制成50mM的母液,使用时用pH6.0、0.1M的磷酸缓冲液稀释成5mM的工作浓度。
(3)酶活性的测定:取5-10μL稀释后的酶液(上述β-葡萄糖苷酶的诱导表达获得的酶液),用5mM的对硝基苯基β-D-吡喃半乳糖苷体系补足至100μl,于50℃反应15min,加200μL浓度为1M的碳酸钠终止液,利用酶标仪测定OD405的吸光值,将经沸水灭活的相同稀释度的酶液按上述方法处理做空白对照,根据释放出对硝基苯酚的量计算酶的活性(每分钟分解对硝基苯基-β-D-吡喃半乳糖苷产生1μmol对硝基苯酚定义为1个酶活单位U),得到的酶活是为17.21U/ml。
4、利用β-葡萄糖苷酶提高菇渣发酵产氢的方法:
(1)嗜热厌氧梭菌种子液的制备:将-80℃保存的嗜热厌氧梭菌((ATCC27405)经10mL西林瓶于55~60℃摇床(150rpm)活化48~72h,接着在100ml的血清瓶于55~60℃摇床(150rpm)放大培养48~72h,OD600为1.1~1.3,得到种子液,其中,活化和放大的培养基采用种子培养基,种子培养基的主要成份为A、B、C、D和E液,5种成分按40:2:1:1:1(v/v)用无菌注射器混合,溶剂为去离子水。A液以3g/L的纤维素作为碳源;B液:柠檬酸三钾盐50g/L、一水柠檬酸31.25g/L、硫酸钠25g/L、磷酸二氢钾25g/L、碳酸氢钠62.5g/L;C液:氯化铵75g/L、尿素250g/L、酵母抽提物50g/L;D液:六水氯化镁50g/L、四水氯化亚铁5g/L、二水氯化钙10g/L、L-半胱氨酸盐酸盐一水物50g/L;E液:二盐酸吡哆胺1g/L、对氨基苯甲酸0.2g/L、D-生物素0.1g/L、维生素B12 0.1g/L、维生素B1 0.2g/L。
(2)发酵培养基的制备及灭菌:发酵培养基中添加60g/L的菇渣为碳源替代种子培养基中A液中的3g/L纤维素,其他成分和用量同种子培养基,得到发酵培养基,其中,菇渣的制备方法为:将菇类生产后的废弃物用清水洗涤至中性后烘干至恒重,粉碎过200目筛。将43.25毫升的发酵培养基装入100ml血清瓶中,用胶塞和铝盖密封并重复抽真空和充0.01MPa的氮气3次,最后在115℃下灭菌20min;
(3)β-葡萄糖苷酶添加促进菇渣发酵产氢:将步骤(1)制备好的种子液按终体积10%(v/v)的接种量(即5ml)注射入上述发酵培养基中,同时添加30U的无菌β-葡萄糖苷酶(体积为1.75mL)进行嗜热厌氧发酵,发酵温度为55℃,摇床转速为150rpm,发酵168h后终止发酵,测定氢气的产量为51.72mM;测得葡萄糖产量为0.15g/L,木糖产量为0.11g/L,纤维二塘的产量为0.03g/L(测定方法参考:Cheng J,Zhu M.A novel anaerobic co-culture system for bio-hydrogen production from sugarcane bagasse[J].Bioresource technology,2013,144:623-631)。
效果实施例1β-葡萄糖苷酶添加时间对菇渣发酵产氢的影响
(1)嗜热厌氧梭菌种子液的制备同实施例1。
(2)发酵培养基的制备及灭菌同实施例1。
(3)添加β-葡萄糖苷酶促进菇渣的微生物产氢发酵:将制备好的种子液按终体积10%(v/v)的接种量(即5ml)注射入上述的45ml、43.25ml、41.5ml发酵培养基中,以不添加酶为空白对照,设置3个对比试验,终体积为50ml,其中:
①不添加β-葡萄糖苷酶产氢:将制备好的种子液按10%(v/v)的接种量注射入上述45ml发酵培养基中,发酵温度为55℃,摇床转速为150rpm,发酵168h后终止发酵,测定氢气的产量为40.07mM;
②0h添加β-葡萄糖苷酶产氢:同实施例1;
③0h添加β-葡萄糖苷酶并在82h补加β-葡萄糖糖苷酶产氢:在发酵初始阶段添加30U的无菌β-葡萄糖苷酶并在82h继续补加30U的无菌β-葡萄糖苷酶,发酵温度为55℃,摇床转速为150rpm,发酵168h后终止发酵,测定氢气的产量为55.96mM;
④82h添加β-葡萄糖苷酶产氢:在接种开始发酵后的82h添加30U的无菌β-葡萄糖苷酶发酵温度为55℃,摇床转速为150rpm,发酵168h后终止发酵,测定氢气的产量为54.65mM。
结果如图3所示,可以看出0h添加β-葡萄糖苷酶氢气的产量(51.72mM),相对于不添加酶的氢气产量(40.07mM)相比提高了29%;0h添加β-葡萄糖苷酶并在82h补加β-葡萄糖糖苷酶的氢气产量(55.96mM),与不添加酶的氢气产量相比提高了40%;只在82h添加β-葡萄糖苷酶的氢气产量(54.65mM),与不添加酶的氢气产量相比提高了36%。结果可以说明:0h添加β-葡萄糖苷酶并在82h补加β-葡萄糖苷酶最有利于提高氢气的产量;0h添加β-葡萄糖苷酶的氢气产量低于82h添加β-葡萄糖苷酶的氢气产量,说明添加β-葡萄糖苷酶的时间晚于接种的时间更有利于提高氢气的产量;三组实验与对照相比,氢气的产量均有明显的提高,说明添加β-葡萄糖苷酶可以显著提高热纤梭菌的氢气产量。
效果实施例2利用β-葡萄糖苷酶和表面活性剂提高菇渣生物糖化效率的方法
(1)嗜热厌氧梭菌种子液的制备同实施例1。
(2)发酵培养基的制备及灭菌同实施例1。
(3)表面活性剂溶液的配制及灭菌:配制125g/L的Triton X-100水溶液;将装有表面活性剂(Triton X-100)的血清瓶用胶塞和铝盖密封并重复抽真空和充0.01MPa的氮气3次,最后在115℃下灭菌20min。
(4)利用β-葡萄糖苷酶和表面活性剂进行微生物还原糖生产的方法:将制备好的种子液按终体积10%(v/v)的接种量(即5mL)注射入上述发酵培养基(每个血清瓶含44ml或43.25ml或42.25ml或40.5ml的发酵培养基)中,以只在82h添加β-葡萄糖苷酶为空白对照,设置4个对比试验,终体积为50ml,其中:
①只在82h添加β-葡萄糖苷酶进行产糖:将制备好的种子液按10%(v/v)的接种量注射入上述43.25ml发酵培养基中,发酵温度为55℃,摇床转速为150rpm,发酵168h后终止发酵,用HPLC的方法测定发酵液中葡萄糖含量为0.11g/L,木糖为0.05g/L,纤维二糖为0.04g/L;
②82h添加表面活性剂产糖:将制备好的种子液按10%(v/v)的接种量注射入上述44ml发酵培养基中,发酵温度为55℃,摇床转速为150rpm,发酵82h时添加1ml的表面活性剂溶液(Triton X-100,125g/L),继续发酵至168h后终止发酵,测定发酵液中葡萄糖含量为2.58g/L,木糖为1.15g/L,纤维二糖为0.22g/L;
③0h添加β-葡萄糖苷酶并在82h添加表面活性剂产糖:将上述制备好的种子液按10%(v/v)的接种量注射入上述42.25ml的发酵培养基中,在发酵初始阶段添加30U的无菌β-葡萄糖苷酶,并在82h添加1ml的表面活性剂溶液(Triton X-100,125g/L),发酵温度为55℃,摇床转速为150rpm,发酵168h后终止发酵,测定发酵液中葡萄糖含量为2.81g/L,木糖为1.23g/L,纤维二糖为0.25g/L;
④0h添加β-葡萄糖苷酶并在82h补加β-葡萄糖糖苷酶和表面活性剂产糖:
在发酵初始阶段添加30U的无菌β-葡萄糖苷酶并在82h补加30U的无菌β-葡萄糖苷酶,同时添加1ml的表面活性剂溶液(Triton X-100,125g/L),发酵温度为55℃,摇床转速为150rpm,发酵168h后终止发酵,测定发酵液中葡萄糖含量为3.38g/L,木糖为1.46g/L,纤维二糖为0.20g/L;
⑤82h添加β-葡萄糖糖苷酶和表面活性剂产糖:在发酵开始后的82h添加30U的无菌β-葡萄糖苷酶并添加1ml的表面活性剂溶液(Triton X-100,125g/L),发酵温度为55℃,摇床转速为150rpm,发酵168h后终止发酵,测定发酵液中葡萄糖含量为3.42g/L,木糖为1.41g/L,纤维二糖为0.22g/L。
结果如图4所示,0h添加β-葡萄糖苷酶并在82h添加表面活性剂的还原糖总量与82h添加表面活性剂相比提高了9%;0h添加β-葡萄糖苷酶并在82h补加β-葡萄糖糖苷酶和表面活性剂的还原糖总量与82h添加表面活性剂相比提高了提高了28%,82h添加β-葡萄糖苷酶并在82h添加表面活性剂的还原糖总量与82h添加表面活性剂相比提高了28%,与0h添加β-葡萄糖苷酶并在82h补加β-葡萄糖糖苷酶和表面活性剂的还原糖总量相当。说明了β-葡萄糖苷酶与表面活性剂共同添加对还原糖产量的提高具有明显的促进作用,并且β-葡萄糖苷酶与表面活性剂同时添加对还原糖的积累效果较好,可以显著提高还原糖的积累量。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!