一种制备ADAMTSL-3/punctin-2多克隆抗体的方法与流程
本发明涉及生物
技术领域:
,具体涉及一种制备adamtsl-3/punctin-2多克隆抗体的方法。
背景技术:
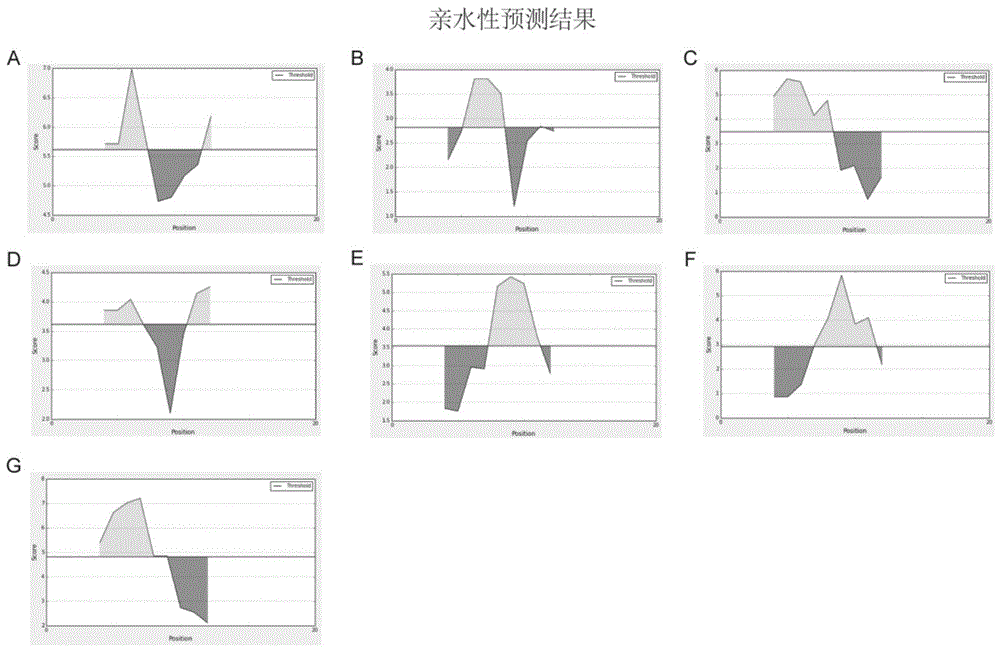
:punctin蛋白是含有adamts样(adisintegrin-likeandmetalloproteasewiththrombospondintype1motifsuperfamily-like,adamtsl)结构域的细胞外基质蛋白之一,由于在细胞中表达后沉积呈点状(punctatedeposition)而得名punctin。adamts蛋白酶是一种分泌的锌离子金属蛋白。adamtsl蛋白与adamts蛋白的辅助结构域相似但不具有蛋白酶活性。最近对adamts蛋白的研究表明其辅助结构域具有调控、前肽修饰与糖基化等功能,adamtsl蛋白在可能在细胞外基质中行驶调控功能。adamtsl-3/punctin-2(后简称punctin-2)是一种分泌型的糖蛋白,主要位于细胞外基质(ecm)中,在人体的组织中广泛存在。目前市面上并没有可以有效检测punctin-2的抗体。多克隆抗体的制备通常对目的蛋白进行表达与纯化后作为抗原,连同佐剂通过静脉、腹腔、肌肉,皮内、皮下或淋巴结内注射进行免疫动物;经动物多次免疫后,收集动物的抗血清来获取抗体,再通过琼脂扩散试验或酶联免疫吸附试验进行抗体的效价质量评价。而目的蛋白经表达获取抗原与目的蛋白本身的大小有直接的联系,蛋白分子量较大的蛋白在进行表达比较困难,表达量通常较低或不易表达。punctin-2蛋白分子量大小约为180kda,以punctin-2的全长蛋白表达作为抗原比较困难,punctin-2蛋白表达量较低,不利于punctin-2多克隆抗体的制备。技术实现要素:有鉴于此,本发明的目的在于针对现有技术的问题,提供一种制备adamtsl-3/punctin-2多克隆抗体的方法。为实现本发明的目的,本发明采用如下技术方案:一种制备adamtsl-3/punctin-2多克隆抗体的方法,小鼠punctin-2多肽片段与载体蛋白偶联,偶联后的多肽免疫动物收集血清.其中,所述小鼠punctin-2多肽片段的氨基酸序列如cys-seqidno.1或seqidno.2所示。作为优选,所述载体蛋白为血蓝蛋白、牛血清白蛋白或鸡卵白蛋白。更优选为血蓝蛋白。在一些实施方案中,本发明所述的方法中,所述免疫的动物为新西兰大白兔。作为优选,本发明所述的方法中,所述免疫方法为偶联后的多肽用1×pbs溶解后与等体积弗氏佐剂混合后分次免疫新西兰大白兔。在一些具体实施例中,所述免疫新西兰大白兔每次免疫的时间、剂量及弗氏佐剂种类具体为免疫次数免疫时间免疫剂量免疫佐剂首次免疫0天2mg弗氏完全佐剂二次免疫14天1mg弗氏不完全佐剂三次免疫35天1mg弗氏不完全佐剂四次免疫52天1mg弗氏不完全佐剂五次免疫64天1mg弗氏不完全佐剂作为优选,本发明所述的方法还包括纯化步骤。在一些具体实施方案中,所述纯化具体为通过hitrapproteinahp纯化柱,借助akta900蛋白纯化仪进行纯化。作为优选,本发明所述的方法纯化过程中收集穿透峰处的洗脱液。由上述技术方案可知,本发明所述制备adamtsl-3/punctin-2多克隆抗体的方法通过选取合适的抗原多肽,合成多肽,与载体蛋白偶联后作为免疫原,进行动物免疫后收集抗血清,进而纯化获取抗体,克服大分子蛋白表达的难点。纯化利用获取的抗体用于免疫印迹、免疫染色和免疫沉淀实验,来辅助研究punctin-2在哺乳动物中枢神经系统的功能。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。图1示多肽a-g亲水性预测结果图;图2示多肽a-g线性表位预测结果图;图3示d与g抗原在第三次及第五次免疫后血清elisa检测结果;图4示d与g抗原在首次及第三次免疫后抗血清westernblot检测结果;图5示g抗原免疫后纯化所得抗体elisa及westernblot检测结果。具体实施方式本发明公开了adamtsl-3/punctin-2多克隆抗体的制备。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及产品已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
发明内容、精神和范围内对本文所述的方法进行改动或适当变更与组合,来实现和应用本发明技术。为实现本发明的目的,本发明采用如下技术方案:一种制备adamtsl-3/punctin-2多克隆抗体的方法,小鼠punctin-2多肽片段与载体蛋白偶联,偶联后的多肽免疫动物收集血清。申请人在nationalcenterforbiotechnologyinformation(ncbi)网站上查找小鼠punctin-2的蛋白序列,并和人源punctin-2氨基酸序列进行序列比对,通过序列比对,设计特异性针对小鼠的punctin-2多肽。同时根据小鼠punctin-2蛋白序列,利用dnastar(v7.1)分析氨基酸的α螺旋、β折叠片及β转角;结合ncbi网站比对结果,初步选择小鼠免疫多肽片段。再使用抗原多肽在线预测网站immuneepitopedatabaseandanalysisresource(iedb)对氨基酸序列的亲水性、抗原表位进行预测。综合分析共选择2条punctin-2多肽合成并用于后续的动物免疫。其中,所述小鼠punctin-2多肽片段的氨基酸序列为cys-gktervpknptvkns(cys-seqidno.1)或crtsegndnswefkn(seqidno.2)。单独的多肽通常太小不足以激起充分的免疫反应,而带有很多抗原表位的载体蛋白有利于刺激辅助性t细胞,进一步诱导b细胞免疫反应。小鼠punctin-2多肽片段与载体蛋白偶联作为一个整体来激起免疫反应产生针对多肽的抗体。作为优选,所述载体蛋白为血蓝蛋白、牛血清白蛋白或鸡卵白蛋白。更优选为血蓝蛋白。血蓝蛋白(keyholelimpethemocyanin,klh),是在某些软体动物、节肢动物(蜘蛛和甲壳虫)的血淋巴中发现的一种游离的蓝色呼吸色素。血蓝蛋白含两个直接连接多肽链的铜离子,与含铁的血红蛋白类似,它易于氧结合,也易与氧解离,是已知的惟一可与氧可逆结合的铜蛋白,氧化时呈青绿色,还原时呈白色,其分子量450000~130000。klh比bsa有更高的免疫原性。在一些实施方案中,本发明所述的方法中,所述免疫的动物为新西兰大白兔。作为优选,本发明所述的方法中,所述免疫方法为偶联后的多肽用1×pbs溶解后与等体积弗氏佐剂混合后分次免疫新西兰大白兔。在一些实施方案中,本发明所述的方法经首次免疫及4次增强免疫后,进行兔血清的采集。在一些具体实施例中,所述免疫新西兰大白兔每次免疫的时间、剂量及弗氏佐剂种类具体为免疫次数免疫时间免疫剂量免疫佐剂首次免疫0天2mg弗氏完全佐剂二次免疫14天1mg弗氏不完全佐剂三次免疫35天1mg弗氏不完全佐剂四次免疫52天1mg弗氏不完全佐剂五次免疫64天1mg弗氏不完全佐剂本发明所述的方法中,所述抗血清的收集为在最后一次免疫后将兔子麻醉,通过颈动脉采集兔子的全血。收集后的全血经离心后取血清,保存备后续实验使用。取血结束,将兔子尸体进行无害化处理;进一步的,还包括punctin-2抗血清的检测与验证。具体为通过elisa检测所得抗血清的效价;通过westernblot检测抗血清的特异性。作为优选,本发明所述的方法还包括纯化步骤。在一些具体实施方案中,所述纯化具体为通过hitrapproteinahp纯化柱,借助akta900蛋白纯化仪进行纯化。作为优选,本发明所述的方法纯化过程中收集穿透峰处的洗脱液。纯化后的抗血清通过elisa检测所得纯化后抗体的效价;通过westernblot进一步检测抗体的特异性。由上述技术方案可知,本发明所述制备adamtsl-3/punctin-2多克隆抗体的方法通过选取合适的抗原多肽,合成多肽,与载体蛋白偶联后作为免疫原,进行动物免疫后收集抗血清,进而纯化获取抗体,克服大分子蛋白表达的难点。纯化利用获取的抗体用于免疫印迹、免疫染色和免疫沉淀实验,来辅助研究punctin-2在哺乳动物中枢神经系统的功能。为了进一步理解本发明,下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。如无特殊说明,本发明实施例中所涉及的试剂均为市售产品,均可以通过商业渠道购买获得。实施例1、抗原多肽的预测、合成及偶联在nationalcenterforbiotechnologyinformation(ncbi)网站上查找小鼠punctin-2的蛋白序列,并和人源punctin-2氨基酸序列进行序列比对,通过序列比对,设计特异性针对小鼠的punctin-2多肽。同时根据小鼠punctin-2蛋白序列,利用dnastar(v7.1)分析氨基酸的α螺旋、β折叠片及β转角;结合ncbi网站比对结果,初步选择了以下几个多肽片段:a:71-85ryddqtsrnahseed-cysb:394-408yypenvkpkpklkecc:650-664lqekdsemtydweya-cysd:1166-1180cys-gktervpknptvknse:1261-1275cys-kmqirnptrkeqgiyf:915-929cys-rrvyiqtreekrinlg:1077-1091crtsegndnswefkn再使用抗原多肽在线预测网站immuneepitopedatabaseandanalysisresource(iedb)对氨基酸序列的亲水性(图1)及抗原表位进行预测(图2)。表1多肽亲水性比较序号氨基酸序列亲水性平均评分aryddqtsrnahseed5.613byypenvkpkpklkec2.817clqekdsemtydweya3.490dgktervpknptvkns3.614ekmqirnptrkeqgiy3.543frrvyiqtreekrinl2.908gcrtsegndnswefkn4.819表2多肽线性表位比较序号氨基酸序列线性表位平均评分aryddqtsrnahseed1.445byypenvkpkpklkec1.047clqekdsemtydweya0.681dgktervpknptvkns1.394ekmqirnptrkeqgiy0.636frrvyiqtreekrinl-0.185gcrtsegndnswefkn1.041根据预测结果及评分(表1及表2)综合分析选择d肽段与g肽段2条多肽(d:1166-1180cys-gktervpknptvkns;g:1077-1091crtsegndnswefkn)合成(武汉戴安生物技术有限公司合成)。合成的多肽与klh(血蓝蛋白)载体蛋白偶联,用于后续实验。合成的多肽与klh载体蛋白偶联由武汉戴安生物技术有限公司完成。偶联蛋白可以避免多肽被迅速降解,增强抗原多肽的免疫原性。如果多肽靠近蛋白序列的n端,那就要把cys添加在合成多肽的c端,若多肽靠近c端则把cys加在合成多肽的n端,若多肽某一端包含了cys则可以直接偶联。实施例2、以偶联后的多肽为抗原免疫新西兰大白兔分别取2mg偶联klh后的多肽d与g于600μl的1×pbs中混匀,同时取等体积的弗氏佐剂(参照表3配置所需的乳化的抗原;弗氏不完全佐剂f5506,弗氏完全佐剂f5881;sigma)混合,用搅拌器充分乳化。取上述乳化的抗原多肽少许,滴入装有超纯水的培养皿中,静置10min,观察乳化剂是否扩散,对乳化效果进行检测。经观察,2个抗原乳化充分,可以用于后续实验。乳化结束后的抗原乳化剂再转移至1ml注射器后,立即放置在已预冷的冰盒中,进行动物的免疫。初次免疫前,将所有大白兔进行编号,并通过耳缘静脉抽血约1ml血液,血液在室温下静置45min后,10000rpm室温离心15min,取上清即为血清。初次免疫使用抗原(2mg)与弗氏完全佐剂的乳化剂进行免疫。对兔子背部注射部位的毛发进行修剪后,用医用酒精对兔子皮肤表面进行消毒处理;然后将兔子背部的皮肤揪起呈现褶皱三角体,将注射器刺入兔的皮下,平行进针深度大约1cm,此时需要左右挑动针头,确认针头能否左右摆动,能轻松摆动说明针头处于皮下位置(要格外注意,不要将针头注入皮下的肌肉组织中),然后缓慢的推动注射器的活塞,将抗原注射0.2-0.3ml至皮下。因抗原乳化后较为浓稠,注入时需要缓慢注射,注射结束后不要立刻拔掉针头,可以稍等片刻后再将针头拔出,防止抗原外溢。二次免疫:免疫方法与初次免疫相同,具体时间及剂量如表3。三次免疫免疫方法与初次免疫相同,具体时间剂量如表3。四次免疫免疫前,先采取耳缘静脉取血的方式对兔进行采血取样,具体操作同上述方法。免疫方法与初次免疫相同,具体时间剂量如表3。五次免疫免疫方法与初次免疫相同,具体时间剂量如表3。免疫后,采取耳缘静脉取血的方式对兔进行采血取样,具体操作,同上述方法。表3免疫时间与剂量表免疫次数免疫时间免疫剂量免疫佐剂首次免疫0天2mg弗氏完全佐剂二次免疫14天1mg弗氏不完全佐剂三次免疫35天1mg弗氏不完全佐剂四次免疫52天1mg弗氏不完全佐剂五次免疫64天1mg弗氏不完全佐剂血清采集74天------实施例3、抗体效价检测在进行过三次免疫后对血清中的是否含有相应抗体和抗体的效价是否达标进行检测。实验采用了不同浓度的抗原多肽对酶标板进行了包被,具体实验操作如下:(1)包被:用包被缓冲液溶解抗原多肽稀释至4μg/ml、8μg/ml、12μg/ml,在酶标板中每孔加入100μl。4℃条件下包被过夜(或者37℃包被2h),然后用200μlpbst清洗一遍,30s。(2)封闭:每孔加入120μl封闭液,37℃摇床孵育1h,弃上清。(3)加样:使用1×pbs作为稀释液来对血清进行稀释,稀释倍数为100、300、900、2700、8100、24300,每个稀释3个重复加入酶标板。37℃摇床孵育1h。(4)用200μlpbst清洗两次,每次30s.(5)将二抗hrp-rabbit用封闭液按1:2000进行稀释,每孔加入50μl,室温下孵育1h。(6)用200μlpbst清洗两次,每次30s,洗涤4-5次。(7)反应:每孔加入100μltmb底物溶液进行显色反应,37℃孵育15min。(8)终止读数:每孔使用50μl1mnaoh终止反应,读取od450数值,od值在1.0左右即有效价。由图4a-c可看出在4μg/ml、8μg/ml、12μg/ml的不同抗原包被浓度下,d抗原及g抗原抗血清效价曲线没有明显的差异,说明血清中存在抗体,而且抗体的效价很高。同时,确定后续抗原包被量为4μg/ml。在第五次免疫后,采用同样的方式,发现d及g抗血清有较高效价(图4d)。实施例4、抗血清特异性检测:(1)培养的hek293t细胞生长至80%左右可以进行转染。转染3.5cm培养皿培养的细胞,在1.5ml离心管中加入100μlopti-mem(gibco,usa)基础培养基,3μgpunctin-2质粒,加入三倍质量即9μg的pei转染试剂,轻轻吹打混匀,室温静置30min;逐滴均匀地添加到培养皿中,微微晃动培养皿使其分布均匀,同时以未转染hek293t细胞为对照。将细胞放回细胞培养箱培养,37℃、5%co2培养48小时后收取蛋白样品。(2)培养箱取出细胞,用1×pbs清洗2遍,加入1mlpbs,用细胞刮刮下细胞,转移到1.5ml离心管,15000g离心3min,弃上清。向细胞沉淀中加入700ullysisbuffer,置冰放置30min(每10min用枪头吹打一次),进行裂解。取上述细胞裂解液20000g,4℃离心10min。上清转移到新的离心管。(3)将上述细胞蛋白进行bca定量(thermo,usa;实验操作可参照thermo官网货号23227说明书操作),测定蛋白浓度,后续上样每孔均上样20ug总蛋白。(4)westernblot检测抗血清的特异性:(a)实验前将垂直电泳槽、玻璃片、制胶模具、转膜盘和转膜仪清洗干净、晾干,玻璃片上不能看到杂质。(b)将玻璃片对准固定,并放置在制胶板上固定,将玻璃片中间灌满ddh2o,放置5min,看液面有无下降,以此检查玻璃板下方的密封性,防止发生胶液泄露。(c)配制sds-page下层分离胶根据目的蛋白的分子量大小选择最佳分离胶浓度,再依照配方表进行配置。本实验配制的是10%的分离胶。分离胶的各种试剂加入到15ml离心管内,最后加入temed和过硫酸铵后,应立即将离心管盖拧紧,轻轻上下颠倒混匀,尽量避免摇起气泡,然后将分离胶液加入两片玻璃板中间,将液面加入到玻璃板高度的3/4左右,然后立即用移液枪沿玻璃板两侧的边沿缓慢的加入ddh2o,进行压胶。之后静置30min以上,等待分离胶凝固。(d)配制sds-page上层浓缩胶在下层分离胶凝固后,将用于压胶的水倒出,并用吸水纸吸干残留的水分。然后参照配方表配制上层浓缩胶,胶液混匀后加入到玻璃板内,然后将制胶的梳子插入到两块玻璃板之间,静置30min,等待浓缩胶凝固。(e)样品处理在之前的细胞裂解液中加入适量的3×samplebuffer,使样品中sb稀释至1,将混有3×samplebuffer的样品在95℃金属浴5min,然后在震荡仪上震荡,最后放置在冰上冷却。(f)电泳将凝固的sds-page配制胶转移到电泳槽内,先向两块胶板与电极构成的内槽中加入电泳液,检测内槽是否密封,在无漏液的情况下,继续向电泳槽的内槽中加入电泳液,加满内槽电泳液后电泳液溢出至外槽,电泳液加入到电泳槽所标注的刻度即可停止加液。向上垂直拔出上层浓缩胶中的梳子,根据梳子梳孔的大小选择合适的上样量(本实验上样量为20μl)。上样结束后80v电压电泳30min,然后将电压调至110v,电泳60-70min。(g)转膜取出转膜盘,倒入transferbuffer,将电泳结束的胶板取出,放置在蒸鱼盘内,用小撬板在液体中小心撬开玻璃板,去掉上层的浓缩胶,将下层分离胶平铺转移到转印滤纸上,将滤纸和胶放置在转模夹的负极,然后将准备好的nc膜在transferbuffer中浸湿,将膜仔细平铺到胶上(注意:尽量不要产生气泡,手套不要触碰到膜与胶直接接触的那一面,而且膜在胶上不要移动),将另一张转印滤纸浸湿,覆盖在膜上,用50ml离心管的管身稍用力,在膜的一侧滚动到另一侧,将内部的气泡赶出,然后将转模夹合拢夹住。转膜过程中,胶在负极,膜在正极。将转膜槽内放入小型冰盒,然后灌满转膜液;转膜槽放置在盆里,周围铺满碎冰,再放入4℃层析柜中,为转膜过程所放出的热进行降温,防止膜被烧坏。将电泳仪调为恒流状态350ma,转120min-130min。(h)封闭转膜结束之后,将nc膜放入盒子中,加入封闭液覆盖膜表面,室温条件下,在脱色摇床上轻摇,封闭1h。(i)一抗孵育封闭结束之后,将膜转移到抗体孵育袋中,用封闭液(5%脱脂奶粉)按一定比例稀释抗血清,混合均匀后加入孵育袋中,并用封口机进行密封。将孵育袋压在翻转摇床上,摇床放置在4℃层析柜中,孵育16h。孵育结束后,用1×tbst清洗膜3-5次,每次5min。(j)二抗孵育清洗结束后,用封闭液稀释二抗hrp-rabbit(1:2000),再次放置到孵育袋中孵育,室温摇动孵育1h。孵育结束后,用1×tbst清洗膜5次,每次5min。(k)蛋白检测二抗孵育清洗结束之后,nc膜用用thermofisher化学发光试剂盒进行显色,用化学发光仪拍照。如图4,d抗原及g抗原在第三次免疫后相比首次免疫前,其抗血清通过westernblot能够看出在180kda左右检测到punctin-2蛋白,阴性血清结果虽存在部分杂带,但在脑匀浆中没有看到明显的条带。d抗原免疫后血清目的条带较弱。所以,我们选择g抗原免疫后的血清进行纯化。实施例5、punctin-2抗体的纯化及检测:punctin-2抗体通过hitrapproteinahp(gehealthcare,usa)纯化柱,借助akta900蛋白纯化仪(akta,usa)进行纯化。纯化后抗体elisa及westernblot步骤同上述操作。本实验在g抗原免疫后抗体纯化上样前,将抗血清用1×pbs进行稀释,然后使用0.22μm滤器过滤后上样。抗体纯化洗脱过程中(共用18ml洗脱液洗脱纯化柱收集抗体;洗脱液配方:18.45ml0.1m一水柠檬酸+13.55ml0.1m柠檬酸钠,ph4.1)总共收集了8个样品管(洗脱过程中根据仪器显示,将穿透峰洗回基线,共收集8管,每管1.5ml),后续对不同管收集到的样品进行效价检测。由图5a可以看出,在收集到的前4个样品管中的抗体效价是明显高于后四个样品管。随后加大稀释浓度,对前四个样品进行检测,通过图5a-b可以看出,在收集过程中,02和03收集到较多的抗体,而且效价明显高于01(图5a)和04,而且在稀释27000倍时仍旧可以检测出,说明抗体纯化的效价是足够用于后续实验的。使用市售某公司punctin-2抗体进行对比,我们可以看出,纯化后抗体的在hek293t细胞、n2a细胞和脑匀浆样本中进行检测,都清晰的检测出了与punctin-2大小近似的条带,在人源punctin-2中没有检测到近似条带,因为我们采用的抗原是鼠源的,所以人源蛋白表达的情况下,未检测出相关条带,是与我们的实验相符的(图5c-d)。综上所述,我们成功制备具有免疫活性的punctin-2抗体,可用于普通westernblot实验。序列表<110>湖南大学深圳研究院<120>一种制备adamtsl-3/punctin-2多克隆抗体的方法<130>mp1916742<160>2<170>siposequencelisting1.0<210>1<211>15<212>prt<213>鼠源(mouseoriginal)<400>1glylysthrgluargvalprolysasnprothrvallysasnser151015<210>2<211>15<212>prt<213>鼠源(mouseoriginal)<400>2cysargthrsergluglyasnaspasnsertrpgluphelysasn151015当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1