一种水稻生长素输出蛋白OsPIN1b抗体的制备方法及其应用与流程
本发明涉及生物技术领域,具体涉及一种水稻生长素输出蛋白ospin1b抗体的制备方法及其应用。
背景技术:
生长素是最早被发现的一种植物激素,极性运输的特性是其区别于多种植物激素的独有特征。目前,人们普遍认为生长素输入输出载体在细胞质膜上的不均匀分布实现了生长素的极性运输,并建立了生长素在植物体内的梯度分布。生长素的极性运输参与了植物许多重要的生长发育过程,其中包括植物的分枝、向性生长和根系的生长发育等。生长素及其极性运输不仅影响植物的形态特征,而且和矿质元素的吸收、运输和分布之间存在着密切的联系。
pin蛋白家族是目前研究较多的生长素输出载体,pin蛋白是一种跨膜蛋白,它在细胞膜上的极性定位决定了生长素的空间分布。在拟南芥中,一共从pin基因家族中克隆到了8个基因;水稻中预测到12个pin的同源基因。ospin1在根原基和维管组织中表达,沉默ospin1的转基因植株中,不定根的发生和发育受到抑制,说明ospin1在依赖生长素的不定根发生过程中起着重要作用。本发明为检测水稻生长素输出蛋白ospin1b在细胞膜中的定位、分布及细胞胞吞,研究制备了一种水稻生长素输出蛋白ospin1b的多克隆抗体,为进一步开展及分析水稻生长素输出蛋白ospin1b功能奠定基础。
目前,已克隆获得水稻生长素输出载体基因ospin1b并成功转化了多种水稻品种,其在水稻根尖中高表达;通过调节水稻根尖组织活性,影响生长素的运输及根原基的伸长。有研究推测ospin1b基因可能参与水稻根的向地性。
制备水稻生长素输出载体ospin1b抗体,有利于进一步通过免疫组化、免疫印迹等方法观察水稻及其它植物中生长素输出蛋白ospin1b的细胞膜定位,揭示生长素极性运输调控植物生长发育的作用机制,进一步阐明植物激素相互作用与植物发育的内在联系,从而利用生长素调控植物生长发育奠定实验基础。
本发明首次公开了水稻生长素输出蛋白ospin1b的抗体的制备方法以及该抗体的免疫组化应用。
技术实现要素:
本发明的目的在于填补水稻生长素输出蛋白ospin1b检测领域的空白,提供了一种针对水稻生长素输出蛋白ospin1b的多克隆抗体的制备方法。
本发明所要解决的问题是提供一种水稻生长素输出蛋白ospin1b的多克隆抗体的制备方法,本发明采用以下技术方案:
一种水稻生长素输出蛋白ospin1b的多克隆抗体的制备方法,包括如下步骤:
1)通过生物信息学分析水稻oryzasativasubsp.japonica(nipponbare)基因ospin1b(loc_os02g50960oros02g0743400)表达的蛋白ospin1b。
2)从抗体编码蛋白ospin1b中选取一段多肽序列qssrnptprgssfnc,具体方法为:根据肽链结构复杂程度,易氧化程度、合成难度、氨基酸类别和分布等,最终确定抗体编码蛋白第244-258位15个氨基酸作为合成多肽的氨基酸序列,其中第258位氨基酸由h→c,序列为qssrnptprgssfnc。
3)按照步骤2中的多肽序列合成多肽;
4)将多肽与载体偶联后得到多肽抗原;
5)将多肽抗原注射入新西兰白兔,初次免疫4周后,每隔2周进行1次加强免疫,共处理三次,经血清分离纯化获得水稻生长素输出蛋白ospin1b多克隆抗体,所述抗体igg浓度为0.51mg/ml;
6)间接elisa法对多克隆抗体的效价进行评价。
经测试,抗体用1:20000倍稀释时,检测值为0.718,为合格的兔多克隆抗体。
本发明还将上述水稻生长素输出蛋白ospin1b抗体应用于免疫印迹试验。
本发明还将上述水稻生长素输出蛋白ospin1b抗体应用于检测水稻、玉米、油菜、马铃薯、小麦和大豆根尖表皮细胞中生长素输出蛋白ospin1b的细胞定位及分布规律。
本发明还将上述水稻生长素输出蛋白ospin1b抗体应用于检测水稻生长素输出蛋白ospin1b的细胞胞吞。
本发明通过对水稻的抗体编码蛋白ospin1b进行分析对比选取特异性多肽序列qssrnptprgssfnc,根据本段多肽序列进行合成得到多肽,该多肽与bsa偶联得到多肽抗原,用该多肽抗原多次免疫新西兰白兔,首次获得特异性的生长素输出蛋白ospin1b的多克隆抗体。利用本发明所提供的方法制备的ospin1b多克隆抗体,能够特异性识别水稻生长素输出蛋白ospin1b,能够实现水稻根尖表皮细胞及胚中生长素输出蛋白ospin1b的细胞膜定位,以及识别水稻生长素输出蛋白ospin1b的分布及细胞胞吞情况,在生长素输出蛋白pin1的检测和功能鉴定、研究中具有广泛用途。另外,本抗体还可对油菜、玉米、马铃薯、小麦和大豆的根及胚中生长素输出蛋白pin1进行细胞膜定位。
附图说明
图1为免疫印记图(westernblot);
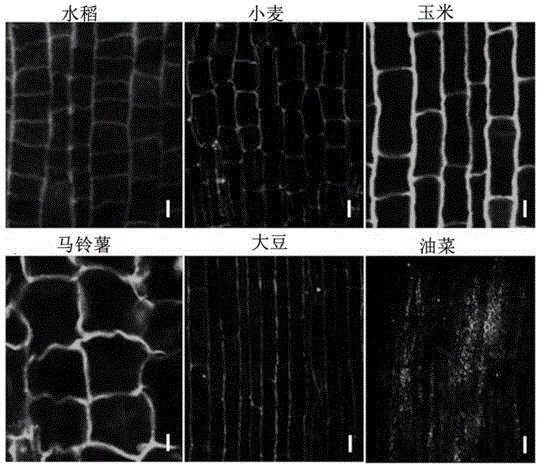
图2为免疫组织化学图:用制备的抗体anti-rabbitospin1bantibody检测六大粮食作物水稻、玉米、油菜、马铃薯、小麦和大豆根尖中pin1蛋白的细胞膜定位,bar=10μm;
图3为免疫组织化学图:用制备的抗体anti-rabbitospin1bantibody检测粮食作物水稻、玉米、小麦和大豆胚细胞中pin1蛋白的细胞膜定位,bar=10μm;
图4为免疫组织化学图:利用制备的抗体anti-rabbitospin1bantibody,检测两种水稻品种lth和nipponbare根尖表皮细胞中ospin1b蛋白的细胞胞吞,bar=10μm。
具体实施方式
实施例1:
本实施例提供的一种水稻生长素输出蛋白ospin1b的多克隆抗体的制备方法,包括如下步骤:
1)通过生物信息学分析水稻oryzasativasubsp.japonica(nipponbare)基因ospin1b(loc_os02g50960oros02g0743400)表达蛋白ospin1b。
2)从抗体编码蛋白ospin1b中选取一段多肽序列qssrnptprgssfnc,具体方法为:根据多肽结构复杂程度,易氧化程度、合成难度、氨基酸类别和分布等,最终确定抗体编码蛋白第244-258位15个氨基酸作为合成多肽的氨基酸序列,其中第258位氨基酸由h→c,序列为qssrnptprgssfnc。
3)按照步骤2中的多肽序列,利用多肽合成仪合成多肽,具体程序为:1.脱fmoc保护树脂,使其暴露出氨基。脱保护试剂是用dmf配制的20%pip;2.将氨基酸用dmf溶解;3.程序依次自主抽取氨基酸溶液各4ml;4.每次上样4ml的氨基酸溶液,程序抽取羧基活化剂0.4mhbtu(用dmf配制),氨基羧基缩合剂0.8mdiea(用dmf配制),使得后一个经活化暴露出羧基的氨基酸与前一个经过脱保护暴露出氨基的氨基酸进行缩合作用,这样形成了二肽。以此方式循环,直至最后一个氨基酸缩合至肽链的末端。合成过程中的每一步都需要用dmf、dcm洗脱保护基团并将未参与反应的氨基酸残留从反应体系中洗脱。
4)用spdp连接法将合成的多肽与bsa进行偶联:4.6mgspdp溶解于740uldmso,终浓度为20mm。0.1008gbsa溶解于2mlpbs-edta溶液中,室温静置1h。使用脱盐柱洗脱多余的spdp。4mg多肽加入偶联好的bsa-spdp体系中室温过夜。通过羧基或氨基端残基将多肽和bsa多肽耦连载体耦联,得到多肽抗原;
5)将多肽抗原注射入健康新西兰白兔,初次免疫4周后,每隔2周进行1次加强免疫,共处理三次,注射途径与初次免疫相同,耳源静脉采血、分离血清,proteing柱分离纯化igg抗体:pbs(ph7.4)平衡proteing亲和柱,以0.1mgly-hcl(ph3.0)洗脱,pbs(ph7.4)透析。获得水稻生长素输出蛋白ospin1b多克隆抗体,所述抗体igg浓度为0.51mg/ml;
6)间接elisa法对多克隆抗体的效价进行评价,具体步骤如下:
a.包被:将抗原ospin1b以1μg/ml的浓度,在酶标板上用移液枪每孔加入200μl,在4℃过夜;
b.封闭:加入1%的bsa溶液200μl,在37℃条件下温育1小时;
c.稀释:将兔多克隆抗体分别以1:200,1:1000,1:5000,1:10000,1:20000,1:60000,1:240000稀释度稀释;
d.加样:加入稀释好的兔多克隆抗体50μl/孔后,放置在恒温箱内37℃条件下温育1小时;
e.洗涤:用洗涤剂tbst以200μl/孔洗涤孔2遍;
f.加酶标二抗:在每个孔内加入以1:5000的稀释的羊抗兔hrp液作为酶标二抗使用,并在37℃条件下温育45min后用用tbst以200μl/孔洗涤3遍;
g.显色:在每个孔内加入100μltmb显色液,37℃显色10分钟;
i.终止:加入2摩尔/升的硫酸50微升/孔,酶标仪读取各孔吸光值。
检测结果:抗体用1:20000倍稀释时,检测值为0.718,为合格的兔多克隆抗体。
实施例2:
ospin1b抗体在免疫印迹中的应用:
检测结果:如图1所示,westernblot检测ospin1b蛋白在水稻根组织中的表达,水稻根组织样品1:500倍稀释,蛋白在65kd处显示出目标条带。
实施例3:
ospin1b抗体在六种不同粮食作物根尖表皮细胞中的定位。
1.试验作物:水稻、玉米、油菜、马铃薯、小麦和大豆;
2.实验材料:microcloth、4%多聚甲醛、pbs缓冲液(ph7.4)、tritonx-100、崩溃酶driselase、dmso、nonidet-p40、bsa、无菌水、封片剂。一抗:anti-ospin1bantibody;
二抗:donkeyanti-rabbitigg(h+l)-alexafluor488coupled。
3.实验步骤
a.材料的获得:水培六大粮食作物7天,待作物长出根后,取根尖1cm左右,用无菌水清洗干净。置于里面包有microcloth的24孔板内,再用pbs吹洗三次。
b.向装有组织的孔内加入1ml4%多聚甲醛固定液,于真空状态下室温固定1h;用1mlpbs+0.5%tritonx-100吹洗5次,再用双蒸水吹洗2次,每次吹洗均为10min;最后将组织浸泡于双蒸水,37℃放置12min。
c.用1ml2%崩溃酶(driselase)于37℃处理1h,用1ml的pbs+0.5%tritonx-100吹洗5次,每次12min;加入1ml渗透液(含10%dmso和2%nonidet-p40),室温处理1.5h,pbs吹洗6次,每次10min。
d.加1ml2%bsa溶液,于37℃封闭1h;加入1ml一抗(1:200倍稀释),于4℃放置过夜;用1mlpbs+0.5%tritonx-100吹洗5次,每次12min。
e.加入1ml二抗(1:500倍稀释),于37℃放置4h;用1mlpbs+0.5%tritonx-100吹洗5次,每次12min。
f.在载玻片上滴一滴封片剂,将处理的材料放入其中,压片后用激光共聚焦显微镜观察。
4.实验结果:从图2可以看出ospin1b抗体能很好的与水稻ospin1b蛋白结合,该抗体与六大粮食作物中pin1蛋白的结合能力不一样,玉米、马铃薯的结合能力较强,小麦和大豆次之,与油菜几乎不能产生免疫反应,证明该抗体同时对水稻、玉米、马铃薯、小麦、大豆等适用。另外,可以通过ospin1b抗体与pin1蛋白的结合位置对pin1输出蛋白进行作物根系中的细胞膜定位。
实施例4
实验材料取自水稻、玉米、小麦和大豆四种粮食作物胚:将四种作物的种子用水浸泡过夜,第二天用解剖刀去除种壳,取出种子中的种胚,其它实验步骤与实施例3相同。
实验结果:从图3可以看出,ospin1b抗体也能与水稻、小麦胚细胞膜上的pin1蛋白结合,且与小麦胚细胞膜上的pin1蛋白结合能力较好,在细胞膜上能清楚的看到绿色荧光。说明制备的ospin1b抗体不仅适用于检测根部pin1蛋白定位,还可用于检测pin1蛋白在不同植物胚中的细胞定位,这为揭示植物生长素输出载体蛋白pin家族调控生长素的极性运输与植物发育机制奠定理论基础。
实施例5:
利用ospin1b抗体检测不同水稻品种lth和nipponbare根尖中ospin1b蛋白的细胞胞吞:在免疫组化实验之前,先对水稻根尖用蛋白转运抑制剂brefeldina(bfa)进行处理,完成后观察不同水稻根尖表皮细胞内ospin1b蛋白聚集形成的bfa小体。
1.材料及试剂:
水稻lth、水稻nipponbare、0.25μm的bfa溶液、microcloth、4%多聚甲醛、pbs缓冲液(ph7.4)、tritonx-100、崩溃酶driselase、dmso、nonidet-p40、bsa、、无菌水、封片剂;
一抗:anti-rabbitospin1bantibody;
二抗:donkeyanti-rabbitigg(h+l)-alexafluor488coupled。
2.实验方法:
a.在免疫组化实验之前,先对水稻根尖用蛋白转运抑制剂brefeldina(bfa)进行处理,完成后观察不同水稻表皮细胞内ospin1b蛋白聚集形成的bfa小体。
b.用剃须刀刀片切下水稻苗的胚根根尖1cm,用镊子小心的将根尖放入含有1mlddh2o的二十四孔板的孔中,用1ml移液枪小心地吹洗,注意不要伤到根;吸出液体再加入1mlddh2o将根尖浸泡15min左右,确保根尖表面的培养基被清洗干净,不影响药剂进入根尖细胞;
c.吸出液体再加入1ml0.25μm的bfa溶液,黑暗[用锡纸将二十四孔板包起来]处理90min;处理完成后,将水稻根尖取出,置于里面包有microcloth的24孔板内,用pbs吹洗三次。
d.加入1ml4%多聚甲醛固定液,于真空状态下室温固定1h;用1ml的pbs+0.5%tritonx-100溶液吹洗5次,再用双蒸水吹洗2次,每次吹洗均为10min;最后将组织浸泡于双蒸水,37℃放置12min。
e.用1ml2%的崩溃酶(driselase)溶液于37℃处理1h,用1ml的pbs+0.5%tritonx-100溶液吹洗5次,每次12min;加入1ml渗透液(含10%dmso和2%nonidet-p40),室温处理1.5h,pbs吹洗6次,每次10min。
f.加入1ml2%bsa,于37℃封闭1h;加入1ml一抗(1:200倍稀释),于4℃放置过夜;用1ml的pbs+0.5%tritonx-100溶液吹洗5次,每次12min。
g.加入1ml二抗(1:500倍稀释),于37℃放置4h;用1ml的pbs+0.5%tritonx-100溶液吹洗5次,每次12min。
h.在载玻片上滴一滴封片剂,将处理的水稻根尖组织放入其中,压片后用激光共聚焦显微镜观察。
3.实验结果:
图4可以看出,丽江新团黑谷lth、日本晴nipponbare两种水稻根在蛋白转运抑制剂bfa作用下,在水稻根细胞内ospin1b抗体与水稻中的ospin1蛋白结合形成bfa小体。实验结果成功验证了ospin1b抗体能很好的用于检测不同水稻中生长素输出蛋白ospin1b的细胞胞吞实验,从而有助于研究生长素的极性运输机制,为生长素输出载体与植物生长发育关系提供理论基础。
- 还没有人留言评论。精彩留言会获得点赞!