小鼠原代肝细胞的分离方法及其制得的小鼠原代肝细胞与应用与流程
本发明涉及原代细胞分离技术领域,具体而言,涉及一种小鼠原代肝细胞的分离方法及其制得的小鼠原代肝细胞与应用。
背景技术:
小鼠原代肝细胞在生命科学技术领域应用广泛,其制备技术是目前许多科学实验中的基本流程,应用非常广泛。
目前,小鼠原代肝细胞的分离方法有以下几种:(1)液氮研磨法:该方法因使用到液氮成本较高,而且研磨时部分组织会粘在研钵和研棒上产生一定的肝组织浪费,同时在液氮研磨过程中经常由于补充液氮不及时可能导致研钵内干涸进而导致细胞受热而活性降低甚至死亡,进一步降低分离制得的原代肝细胞的细胞活性,以及存活肝细胞收率,不适于原代肝细胞的大量在制备。(2)胰酶消化法:该方法应用胰酶成本较高,而且在胰酶消化过程中,经常出现外部细胞消化过度,而内部细胞难以消化的现象,降低了分离制得的原代肝细胞的细胞活性,以及存活肝细胞收率。(3)离体灌流法:该方法在分离肝脏时,容易发生菌类污染,无菌操作不便利,而且经常导致肝被膜破碎,导致灌流失败。此外,灌流时采用后腔静脉进行灌注,后腔静脉较粗,灌流液从较粗血管进入较细的血管的过程中,可能由于灌流液速度和动力发生改变,从而导致肝细胞破损,而且灌流过程中一旦血管破损由于血压过大会导致出血过多,不易于灌流针刺入和结扎,降低实验效率,延长实验时间,时间的延长导致得到的原代肝细胞的活性降低,同时也降低存活肝细胞的收率,而且现有的灌流液经常导致消化不完全,这进一步降低了分离制得的存活肝细胞的收率。
因此,开发一种有效提高分离制得的原代肝细胞的细胞活性,使分离的细胞能够更迅速贴壁,同时能够有效提高存活肝细胞的收率,降低小鼠肝细胞的制备成本,适宜于大量小鼠原代肝细胞的制备,而且不易造成菌类污染的小鼠原代肝细胞分离方法具有重要的科研价值和实际应用价值。
有鉴于此,特提出本发明。
技术实现要素:
本发明的目的之一在于提供小鼠原代肝细胞的分离方法,该方法将麻醉小鼠依次进行腹腔暴露、肝周管结扎、原位三步灌流和细胞分离得到小鼠原代肝细胞;原位三步灌流依次包括第一灌流,第二灌流和第三灌流;第一灌流,用第一灌流液去除红细胞,并对血液进行抗凝;第二灌流,用第二灌流液去除抗凝剂,并对肝组织进行初步消化;第三灌流,用第三灌流液进一步消化。该小鼠原代肝细胞的分离方法能有效提高分离的到的小鼠原代细胞的活性,使其贴壁更迅速,原代细胞收率高,适合较大的实验用量需求,并且分离过程中不易产生菌类污染;此外,该方法兼具程序简单,成本低的优势。
本发明目的之二在于提供上述小鼠原代肝细胞分离方法制得的小鼠原代肝细胞。
本发明的目的之三在于提供上述小鼠原代肝细胞在细胞生物学试验或病毒学试验中的应用。
为了实现本发明的上述目的,特采用以下技术方案:
第一方面,提供了一种小鼠原代肝细胞的分离方法,包括如下步骤:将麻醉小鼠依次进行腹腔暴露、肝周管结扎、原位三步灌流和细胞分离得到小鼠原代肝细胞;
原位三步灌流依次包括第一灌流灌流,第二灌流和第三灌流;
第一灌流,用第一灌流液去除红细胞,并对血液进行抗凝;
第二灌流,用第二灌流液去除抗凝剂,并对肝组织进行初步消化;
第三灌流,用第三灌流液进一步消化。
优选地,在本发明方案基础上,原位灌流的灌流血管为肝门静脉。
优选地,在本发明方案基础上,第三灌流,用第三灌流液对小鼠肝脏进行灌流以后,还包括用pbs对小鼠肝脏进行灌流清洗的步骤;
优选地,pbs的温度为36-37℃;
优选地,小鼠原代肝细胞的分离方法还包括在第二灌流以后用37℃的pbs预热小鼠肝脏的步骤;
优选地,第三灌流液为iv型胶原酶溶液,温度为37℃,iv型胶原酶溶液的浓度为0.03-0.05%;
优选地,iv型胶原酶溶液的浓度为0.048%;
优选地,第一灌流液、第二灌流液和第三灌流液分别灌流150-200ml。
优选地,在本发明方案基础上,肝周管结扎,结扎的肝周管包括:胆总管、胃十二指肠动脉、脾动脉、胃左动脉和后腔动脉;
优选地,肝周管结扎依次结扎胆总管、胃十二指肠动脉、脾动脉、胃左动脉和后腔动脉;
优选地,肝周管结扎包括如下步骤:
(1)结剪断十二指肠韧带;
(2)结扎胆总管;
(3)结扎胃十二指肠动脉,追踪肝总动脉血液流经方向,直到暴露脾动脉与胃左动脉;
(4)结扎并剪断脾动脉与胃左动脉,暴露腹腔动脉干;
(5)将肝脏下翻,暴露背侧肝脏与膈肌,分离肝脏镰状韧带与左右三角韧带;
(6)结扎胃左静脉,并在胰腺颈部双重结扎,并在结扎之间剪断胰腺(7)结扎后腔静脉;
(8)上翻肝脏,分离肝门静脉周围淋巴组织,暴露肝门静脉,然后注射肝素100u。
优选地,在本发明方案基础上,细胞分离依次包括肝组织分离和细胞筛分离;
肝组织分离包括如下步骤:将消化灌流后的肝脏分离至麻醉小鼠体外,浸入37℃的pbs溶液中,然后去除肝脏包膜、结缔组织和血管,再用移液器反复吹打,得到小鼠肝脏匀浆液;
细胞筛分离包括如下步骤:将匀浆液依次过100目、200目和400目细胞筛,得到细胞悬液,对细胞悬液进行固液分离,得到小鼠原代肝细胞;
优选地,固液分离方法为离心,所述离心转速为450-550g,离心时间为4-10min,首次离心后再用pbs重悬后离心,重复1-3次;
优选地,离心转速为500g;
优选地,离心是时间为5min。
优选地,在本发明方案基础上,原位灌流采用微量注射泵;
优选地,原位灌流的灌流速度为1.2-1.5ml/min。
优选地,在本发明方案基础上,第一灌流,将第一灌流液灌流至肝脏开始膨胀时,刺破后腔静脉,释放第一灌流液;
优选地,第一灌流过程中,轻拍肝脏表面。
优选地,在本发明方案基础上,肝周管结扎后还包括进行留置针放置,留置针放置包括如下步骤:
将预置缝线环绕肝门静脉背侧,并用留置针穿刺如肝门静脉,拔除留置针的硬针,然后用预置缝线固定留置针;然后放置肝素帽,并连接头皮针;
优选地,腹腔暴露,包括在麻醉小鼠腹部行mercedes手术切口的步骤;
优选地,第一灌流液以质量百分比计包括:nacl0.7-0.9%、kcl0.03-0.05%、nah2po4·2h2o0.007-0.008%、na2hpo4·12h2o0.014-0.016%、egta0.018-0.02%、nahco30.03-0.04%、hepes0.023-0.024%、glucose0.08-0.1%,青-链霉素0.8-1.5%,余量为水。
优选地,第一灌流液以质量百分比计包括:nacl0.8%、kcl0.04%、nah2po4·2h2o0.0078%、na2hpo4·12h2o0.0151%、egta0.019%nahco30.035%、hepes0.238%、glucose0.09%,青-链霉素1%,余量为水;
优选地,第二灌流液以质量百分比计包括:nacl0.7-0.9%、kcl0.03-0.05%、cacl20.05-0.06%、nah2po4·2h2o0.007-0.008%、na2hpo4·12h2o0.014-0.016%、hepes0.23-0.24%、nahco30.03-0.04%,青-链霉素0.8-1.5%,余量为水;
优选地,第二灌流液以质量百分比计包括:nacl0.8%、kcl0.04%、cacl20.056%、nah2po4·2h2o0.0078%、na2hpo4·12h2o0.0151%、hepes0.238%、nahco30.035g,青-链霉素1%,余量为水。
第二方面,提供了小鼠原代肝细胞分离方法制得的小鼠原代肝细胞。
第三方面,提供了小鼠原代肝细胞在细胞生物学试验或病毒学试验中的应用;
优选地,细胞生物学实验包括:细胞毒性试验、细胞凋亡试验、氧化应激试验、细胞自噬试验或病毒侵染试验。
与已有技术相比,本发明具有如下有益效果:
(1)本发明的小鼠原代肝细胞的分离方法,该方法采用原位三步灌流对小鼠肝脏进行灌流,原位灌流相对于现有技术中的离体灌流不易造成菌类污染,不易造成肝被膜的破坏,灌流成功率高,有效降低成本;此外,本发明采用三步灌流的方式对小鼠肝脏进行灌流,依次包括第一灌流,第二灌流和第三灌流。该方法相对于现有技术,将灌流分为三步,第二灌流过程中去除抗凝剂,并初步消化,第三灌流过程中进一步消化,这种灌流方式细胞消化效果更好,有效缓解了细胞过度消化和消化不充分的现象,分离制得的原代肝细胞的细胞活性得到提高,分离的肝细胞能够更迅速贴壁,配合原位灌流的方法,更有效提高存活肝细胞的收率。此外,该方法能够一次性获得大量的原代肝细胞,适合较大规模的实验应用,并且兼具程序简单,成本低的优势。
(2)本发明的小鼠原代肝细胞分离方法制得的小鼠原代肝细胞贴壁迅速,细胞活性高;本发明的小鼠原代肝细胞能够在细胞生物学试验或病毒学试验中应用。
附图说明
图1为本发明实施例1暴露肝门静脉图;
图2为本发明实施例1肝门静脉灌流图;
图3为本发明实施例1制得的小鼠原代肝细胞12h贴壁图;
图4为本发明对比例1制得的小鼠原代肝细胞12h贴壁图;
图5为本发明对比例2制得的小鼠原代肝细胞12h贴壁图;
图6为本发明实施例1制得的原代细胞在试验例中对照组及1、10、100、1000nmt-2剂量组培养24h的细胞活性(%);
图7为本发明对比例1制得的原代细胞在试验例中对照组及1、10、100、1000nmt-2剂量组培养24h的细胞活性(%);
图8为本发明对比例2制得的原代细胞在试验例中对照组及1、10、100、1000nmt-2剂量组培养24h的细胞活性(%)。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。
根据本发明的第一方面,提供了一种小鼠原代肝细胞的分离方法,包括如下步骤:将麻醉小鼠依次进行腹腔暴露、肝周管结扎、原位三步灌流和细胞分离得到小鼠原代肝细胞;
原位三步灌流依次包括第一灌流,第二灌流和第三灌流;
第一灌流,用第一灌流液去除红细胞,并对血液进行抗凝;
第二灌流,用第二灌流液去除抗凝剂,并对肝组织进行初步消化;
第三灌流,用第三灌流液进一步消化。
腹腔暴露,即暴露出小鼠腹腔,进而暴露小鼠肝脏的过程;肝周血管结扎,是指将肝脏周围不用于灌流的主要血管进行结扎,进而对后续灌流过程灌流液的流向进行一定的控制;原位三步灌流,原位是相对离体灌流而言,是不取下肝脏直接进行灌流的方法,三步灌流是指灌流过程分为三个步骤,分别用不同的灌流液进行灌流,即第一灌流,第一灌流液中含有抗凝剂,防止血液凝固,抗凝同时去除红细胞的灌流过程,第一灌流液流经小鼠肝脏的血管,将红细胞去除,从而有效避免避免后续分离得到的细胞中混有红细胞;第二灌流,第二灌流液含有抗凝剂和消化酶,能够防止肝脏中的血液发生凝固,避免血液凝固对血管造成堵塞,进而对后续消化灌流过程产生阻碍,是抗凝并同时进行初步消化的过程;第三灌流,第三灌流液中主要含有消化酶,经过一些毛细血管,能够更充分地作用于肝细胞,是进一步消化的过程,相对传统的同时进行抗凝和消化,消化液能更充分地作用于肝细胞,消化更迅速,更充分,消化效果更好,后续获得的细胞活性更好,贴壁更迅速;典型但非限制性的消化液例如为:iv型胶原酶、ii型胶原酶、胰蛋白酶等。这三个过程是依次进行的,先在抗凝的同时去除红细胞,然后去除残留抗凝剂,并进行初步消化,再进行进一步消化。
在一种优选的实施方式中,原位灌流的灌流血管为肝门静脉。
现有技术中经常采用后腔静脉进行灌注,但是后腔静脉较粗,一旦操作时刺破血管由于血压过大,会导致出血过多,不易于灌流针刺入和结扎,因此,对操作人员的技术要求较高,而且操作需要谨慎,耗时往往较长。肝门静脉易寻找,而且固定方便,不易滑脱,穿刺过程中出血量较少,不会影响穿刺视野,提高了灌流的效率,而且肝门静脉对相对容易刺入灌流针,结扎容易,操作便利,进一步节省了操作时间,这样有利于后续获得的肝细胞的活性,制得的肝细胞贴壁更迅速。
在一种优选的实施方式中,第三灌流,用第三灌流液对小鼠肝脏进行灌流以后,还包括用pbs对小鼠肝脏进行灌流清洗的步骤。用pbs(phosphatebufferedsaline)即磷酸盐缓冲液进行清洗,能够去除残留的第三灌流液含有的消化酶,防止细胞过度消化。
优选地,pbs的温度为36-37℃;pbs的温度在36-37℃于小鼠的肝组织温度接近,能够有效维持肝组织细胞活性。
优选地,小鼠原代肝细胞的分离方法还包括在第二灌流以后用37℃的pbs预热小鼠肝脏的步骤;在第二灌流以后,用37℃的pbs对小鼠肝脏进行预热,防止操作过程中肝脏组织逐渐冷却,一方面维持细胞活性,更重要的是37℃预热,在37℃条件下消化酶的活性最好,能够迅速消化肝组织细胞,使酶的活性充分发挥,提高消化效率。
优选地,第三灌流液为iv型胶原酶溶液,温度为37℃,iv型胶原酶溶液的浓度为0.03-0.05%。市售常见的iv型胶原酶通常包含至少7种蛋白酶成分,它对小鼠肝脏组织的消化作用良好,消化的过程引起细胞死亡量较少,消化后收获的活细胞收率高,消化过程较为温和,消化效果好,收获的细胞活性好,贴壁迅速。温度为37℃更接近小鼠体温,对于肝脏组织的刺激较小,有利于保留肝细胞的活性,iv型胶原酶溶液浓度控制在0.03-0.05%,消化更充分,且不易引起细胞死亡,消化效果好,不易过度消化,灌流后细胞活性更好。典型但非限制性的iv型胶原酶的浓度例如为:0.03%、0.04%或0.05%等。
优选地,iv型胶原酶溶液的浓度为0.048%。当iv型胶原酶浓度为0.048%时,消化效果更好,无需消化过长时间,后续获得的细胞活性更好地保持,贴壁更迅速。
优选地,第一灌流液、第二灌流液和第三灌流液分别灌流150-200ml。根据实际经验,第一灌流液,抗凝并去除红细胞,根据小鼠的肝脏血液量和肝脏体积,通常灌流150-200ml即可充分去除红细胞,更多的第一灌流液进行灌流会浪费更多时间,不利于细胞活性的保持。为了避免肝脏中的血管因凝固而堵塞,尤其是一些细小的血管,堵塞会造成后续消化不充分,影响存活细胞的收率,浪费肝脏组织,第二灌流液中也加入抗凝剂,在初步消化的同时也起到抗凝作用,根据实际经验,灌流150-200ml即可。第三灌流液,其实质是用起到消化作用的消化液进行灌流,灌流150-200ml通常能够较为充分消化小鼠肝组织。典型但非限制性第一灌流液、第二灌流液和第三灌流液的分别灌流例如:150ml、160ml、170ml、180ml、190ml或200ml等。
在一种优选的实施方式中,肝周管结扎,结扎的肝周管包括:胆总管、胃十二指肠动脉、脾动脉、胃左动脉和后腔动脉;上述肝周管包含是肝周围的主要血管和胆管,将上述肝周管结扎能够更好地控制灌流液的流向,灌流更迅速,更充分。
优选地,肝周管结扎依次结扎胆总管、胃十二指肠动脉、脾动脉、胃左动脉和后腔动脉;
优选地,肝周管结扎包括如下步骤:
(1)结剪断十二指肠韧带;
(2)结扎胆总管;
(3)结扎胃十二指肠动脉,追踪肝总动脉血液流经方向,直到暴露脾动脉与胃左动脉;
(4)结扎并剪断脾动脉与胃左动脉,暴露腹腔动脉干;
(5)将肝脏下翻,暴露背侧肝脏与膈肌,分离肝脏镰状韧带与左右三角韧带;
(6)结扎胃左静脉,并在胰腺颈部双重结扎,并在结扎之间剪断胰腺(7)结扎后腔静脉;
(8)上翻肝脏,分离肝门静脉周围淋巴组织,暴露肝门静脉,然后注射肝素100u。
按照上述步骤进行结扎,其实质是由外向内的顺序进行结扎,在结扎过程中肝脏游离性增加,不易导致肝脏被膜破裂。灌流成功率高,不易造成肝组织浪费。
在一种优选的实施方式中,细胞分离依次包括肝组织分离和细胞筛分离;
肝组织分离包括如下步骤:将消化灌流后的肝脏分离至麻醉小鼠体外,浸入37℃的pbs溶液中,然后去除肝脏包膜、结缔组织和血管,再用移液器反复吹打,得到小鼠肝脏匀浆液;
细胞筛分离包括如下步骤:将匀浆液依次过100目、200目和400目细胞筛,得到细胞悬液,对细胞悬液进行固液分离,得到小鼠原代肝细胞;
肝组织的分离即分离整体肝脏组织的过程,细胞筛分离是获得分散的细胞的过程。这个过程中,先将肝脏分离,然后放入37℃的pbs溶液中能更好地保持肝脏细胞的活性,除去肝脏包膜、结缔组织和血管组织,消化过的组织在反复吹打过程中很容易破碎,然后得到小鼠肝脏匀浆液。
优选地,所述固液分离方法为离心,所述离心转速为450-550g,离心时间为4-10min,首次离心后再用pbs重悬后离心,重复1-3次;离心能够较为迅速的分离细胞,有利于保持原代肝脏细胞的活性,迅速获得高活性的小鼠原代肝脏细胞,此外,离心力过大容易造成细胞损伤,离心力过小细胞不易沉降,pbs重悬后,重复离心2-3次,沉降更完全。
优选地,离心转速为500g;以500g转速细胞沉降速度较快又不易造成损伤。
优选地,离心是时间为5min;离心时间不宜过长或过短,过长容易对细胞造成损伤,过短容易沉降不完全,5min的离心时间相对保证了沉降的完全性,又不会造成细胞损伤。
在一种优选的实施方式中,原位灌流采用微量注射泵。采用微量注射泵,能够更好地对流速进行控制,灌流效果更好,而且微量注射泵成本较低。
优选地,原位灌流的灌流速度为1.2-1.5ml/min。灌流速度在1.2-1.5ml/min之间,过快容易破坏肝脏组织内部的血管,而且灌流用到的各种灌流液不能充分作用于肝组织,尤其是消化过程,灌流速度的控制非常重要,当灌流速度在1.2-1.5ml/min时候,消化较为充分,而且对细胞的破坏较小,典型但非限制性的灌流速度例如为:1.2ml/min、1.3ml/min、1.4ml/min或1.5ml/min等。在一种优选的实施方式中,第一灌流,将第一灌流液灌流至肝脏开始膨胀时,刺破后腔静脉,释放第一灌流液;这个过程是将肝脏组织内部血管里的红细胞去除的过程。
优选地,第一灌流过程中,轻拍肝脏表面。轻拍肝脏表面,能促进肝脏组织内部的液体流动,有效避免红细胞去除液在灌流过程中流动不畅造成的红细胞去除效果不好,加速肝内血细胞排出。
在一种优选的实施方式中,肝周管结扎后还包括进行留置针放置,留置针放置包括如下步骤:
将预置缝线环绕肝门静脉背侧,并用留置针穿刺如肝门静脉,拔除留置针的硬针,然后用预置缝线固定留置针;
将预置缝线环绕肝门静脉背侧,并用留置针穿刺如肝门静脉,拔除留置针的硬针,然后用预置缝线固定留置针;应用留置针能有效避免普通硬针在灌流过程中由于一些机械碰撞或运动导致的血管被刺破现象的发生,进而导致灌流的失败,能够有效提高成功灌流的概率,避免不必要的浪费,节省肝脏组织。
然后放置肝素帽,并连接头皮针;肝素帽是与留置针相连的装置,可以防止液体回流并具有一定的抗凝血作用。
优选地,腹腔暴露,包括在麻醉小鼠腹部行mercedes手术切口的步骤;该切口更加充分暴露腹腔脏器,便于手术和灌流。
优选地,第一灌流液以质量百分比计包括:nacl0.7-0.9%、kcl0.03-0.05%、nah2po4·2h2o0.007-0.008%、na2hpo4·12h2o0.014-0.016%、egta0.018-0.02%、nahco30.03-0.04%、hepes0.023-0.024%、glucose0.08-0.1%,青-链霉素0.8-1.5%,余量为水。
第一灌流液里加入青-链霉素0.8-1.5%进一步降低了灌流过程中受菌类污染的概率,egta起到抗凝作用,其余的盐共同组成中性的灌流液,同时具有一定的缓冲作用,对细胞具有一定保护作用。
优选地,第一灌流液以质量百分比计包括:nacl0.8%、kcl0.04%、nah2po4·2h2o0.0078%、na2hpo4·12h2o0.0151%、egta0.019%nahco30.035%、hepes0.238%、glucose0.09%,青-链霉素1%,余量为水。优选特定组方的第一灌流液,能够更好地发挥抗凝作用,抗生素浓度以及盐溶液浓度更合理,对细胞保护作用更好。
优选地,第二灌流液以质量百分比计包括:nacl0.7-0.9%、kcl0.03-0.05%、cacl20.05-0.06%、nah2po4·2h2o0.007-0.008%、na2hpo4·12h2o0.014-0.016%、hepes0.23-0.24%、nahco30.03-0.04%,青-链霉素0.8-1.5%,余量为水。
第二灌流液里加入青-链霉素0.8-1.5%同样是降低菌类污染概率,cacl2起到去除egta的作用,其余的盐共同组成中性的灌流液,具有一定的缓冲作用,对细胞具有一定保护作用。
优选地,第二灌流液以质量百分比计包括:nacl0.8%、kcl0.04%、cacl20.056%、nah2po4·2h2o0.0078%、na2hpo4·12h2o0.0151%、hepes0.238%、nahco30.035g,青-链霉素1%,余量为水。
优选特定组方的第二灌流液,能够更好地发挥清楚第一灌流后残留的第一灌流液当中的抗凝剂,同时对抗生素浓度以及盐溶液浓度进行优化,对细胞保护作用更好。
根据本发明的第二方面,提供了小鼠原代肝细胞分离方法制得的小鼠原代肝细胞。
本发明提供的小鼠原代肝细胞分离方法制得的小鼠原代肝细胞贴壁迅速,细胞活性高。
根据本发明的第三方面,提供了小鼠原代肝细胞在细胞生物学试验或病毒学试验中的应用。
本发明提供的小鼠原代肝细胞能够在细胞生物学试验或病毒学试验中应用。
优选地,细胞生物学实验包括:细胞毒性试验、细胞凋亡试验、氧化应激试验、细胞自噬试验或病毒侵染试验。
下面通过具体的实施例和对比例进一步说明本发明,但是,应当理解为,这些实施例仅仅是用于更详细地说明之用,而不应理解为用于以任何形式限制本发明。
实施例1
实施例1应用试剂配制如下:
第一灌流液:称取1.6gnacl、0.08gkcl、0.0156gnah2po4·2h2o、0.0302gna2hpo4·12h2o、0.038gegta、0.07gnahco3、0.476ghepes、0.18gglucose,青-链霉素0.5g,加超纯水定容至200ml。
第二灌流液:称取1.6gnacl、0.08gkcl、0.112gcacl2、0.0156gnah2po4·2h2o、0.0302gna2hpo4·12h2o、0.07gnahco3、0.476ghepes、青-链霉素0.5g,加超纯水定容至200ml。
消化液:0.048%的iv型胶原酶。
一种小鼠原代肝细胞的分离方法,包括如下步骤:
腹腔暴露:将icr小鼠按照0.3mg/g陆眠宁进行腹腔注射,待完全麻醉后固定于手术台。先用75%酒精消毒全身消毒,然后将无菌纱布覆盖小鼠周围仅暴露术部,mercedes手术切口(人字形切口),随后剪开肌肉与腹膜,暴露腹腔。
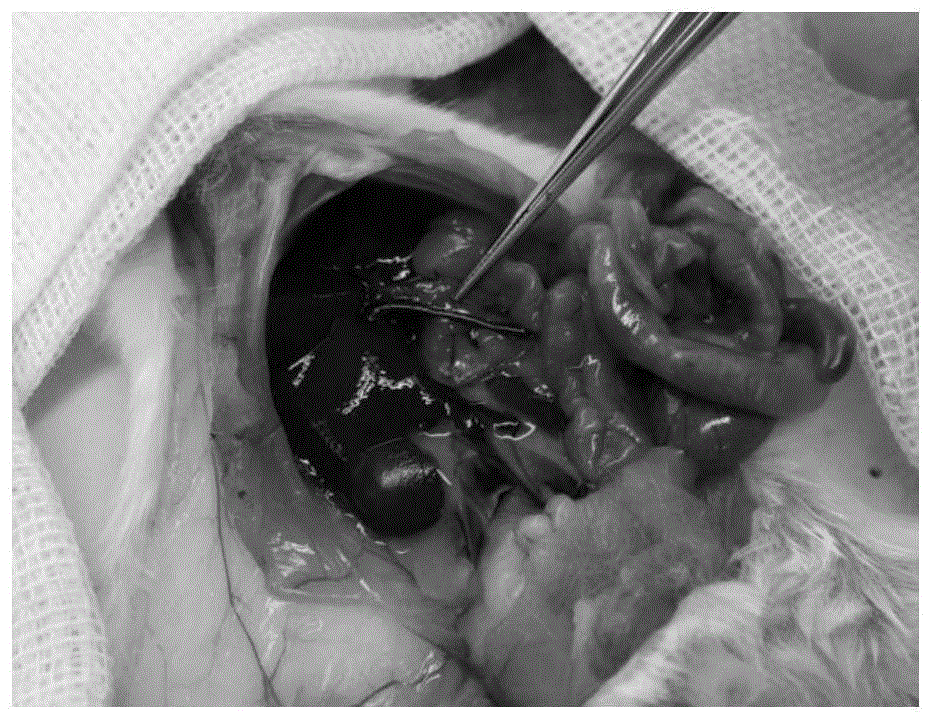
肝周管结扎:(1)结剪断十二指肠韧带;(2)结扎胆总管;(3)结扎胃十二指肠动脉,追踪肝总动脉血液流经方向,直到暴露脾动脉与胃左动脉;(4)结扎并剪断脾动脉与胃左动脉,暴露腹腔动脉干;(5)将肝脏下翻,暴露背侧肝脏与膈肌,分离肝脏镰状韧带与左右三角韧带;(6)结扎胃左静脉,并在胰腺颈部双重结扎,并在结扎之间剪断胰腺(7)结扎后腔静脉;(8)上翻肝脏,分离肝门静脉周围淋巴组织,暴露肝门静脉,见附图1,图1为暴露肝门静脉图,然后注射肝素100u。
原位三步灌流:将预置缝线环绕门静脉背侧,并用26号留置针穿刺入门静脉见附图2,肝门静脉灌流图,拔除留置针内部的硬针,然后用预置缝线固定留置针。放置肝素帽,并连接头皮针。采用微量注射泵以1.5ml/min速度灌流第一灌流液200ml,当肝脏开始膨胀时用针头刺破后腔静脉,释放第一灌流液,第一灌流过程中,用手轻轻拍打肝脏表面至肝内血细胞完全灌流出肝脏;然后用微量注射泵以1.5ml/min速度灌流第二灌流液200ml;将提前配制的0.048%的iv型胶原酶和pbs置于37℃水浴锅中预热,用预热的pbs浸泡原位肝脏,用微量注射泵以1.5ml/min速度用0.048%iv型胶原酶进行第三灌流的,同样灌流200ml步骤。用微量注射泵以1.5ml/min速度泵入pbs将iv型胶原酶清除。
细胞分离:将消化后的肝脏分离至体外,并浸泡入37℃pbs中,将分离的小鼠肝脏转至细胞间,并置于灭菌平皿上,用眼科镊取出肝脏包膜,分离结缔组织和血管,然后向分离后的肝组织中加入pbs,用移液枪反复吹打小鼠肝脏组织至无明显结块,得到小鼠肝脏匀浆液。然后将小鼠肝脏匀浆液分别过100目、200目及400目细胞筛;收集细胞悬液,细胞悬液转至10ml离心管中,500g离心5min,pbs重悬后离心,重复3次,弃上清液。
制得的小鼠原代肝细胞经dmem培养基,37℃,5%co2培养12h,见附图3,制得的小鼠原代肝细胞12h贴壁图。
对比例1
对比例1与实施例1的区别仅在于,采用离体灌流的方式进行灌流。
制得的小鼠原代肝细胞经培养12h贴壁,见附图4。
对比例2
对比例2与实施例1的区别仅在于,灌流分为两步,将抗凝液和消化液混合,抗凝灌流和消化灌流统一进行。
制得的小鼠原代肝细胞经培养12h,见附图5。
试验例
将实施例1和对比例1-2获得的小鼠原代肝细胞分别以浓度为5×105个·ml-1细胞接种96孔细胞培养板,每孔200μl,置于5%co2恒温培养箱中,37℃培养,然后分别于0h、24h、48h及72h,显微镜观察细胞状态。
将实施例1和对比例1-2获得的小鼠原代肝细胞以浓度为5×105个·ml-1细胞接种96孔细胞培养板,每孔200μl,置于5%co2恒温培养箱中,37℃培养12小时后,进行t-2毒性实验。各实施例得到的小鼠原代细胞接种10个孔,实验分为五组,每组2个孔,分别是:对照组、1、10、100及1000nmt-2毒素剂量组,用不同浓度t-2毒素处理贴壁后的细胞,并于处理后的24h,进行毒性试验,利用mtt法测定24h,不同毒素组肝细胞的细胞活性,活性测定结果见图6-8;图6为本发明实施例1制得的原代细胞在试验例中对照组及1、10、100、1000nmt-2剂量组培养24h的细胞活性(%);图7为本发明对比例1制得的原代细胞在试验例中对照组及1、10、100、1000nmt-2剂量组培养24h的细胞活性(%);图8为本发明对比例2制得的原代细胞在试验例中对照组及1、10、100、1000nmt-2剂量组培养24h的细胞活性(%)。
由是实施例1和对比例1的检测结果对比可见,采用离体灌流的方式,制得的小鼠原代细胞贴壁效果相对较差,视野中贴壁细胞较少,制得的原代活性较差,贴壁较慢,细胞存活率更低。
由实施例1和对比例2的检测结果对比可见,采用两步灌流的方式,即将抗凝灌流和消化灌流统一进行,制得的小鼠原代肝细胞经培养以后,视野中贴壁细胞相对较少,制得的原代活性较差,贴壁较慢,细胞存活率更低。
尽管已用具体实施例来说明和描述了本发明,然而应意识到,在不背离本发明的精神和范围的情况下可以做出许多其它的更改和修改。因此,这意味着在所附权利要求中包括属于本发明范围内的所有这些变化和修改。
- 还没有人留言评论。精彩留言会获得点赞!
- 对人肝癌细胞株具有抑制效果的买麻藤提取液的制备方法
- 一种妇康宁片的应用及制备方法
- 一种胆石通利片的制备方法及其在制备抑制肝癌细胞Hepa1-6细胞增殖药物中的应用的制作方法
- 一种青梅感冒片的制备方法及其在抑制肝癌细胞h22细胞增殖药物中的应用的制作方法
- 一种青梅感冒片的制备方法及其在抑制肝癌细胞Hepa1-6细胞增殖药物中的应用的制作方法
- 一种原位移植性小鼠肝癌模型及其制备方法和应用的制作方法
- 可自发绿色荧光能转移的人肝癌细胞系的制作方法
- 癌毒方在制备调控肝癌细胞TLRs/NF-κB信号转导药物中的应用的制作方法
- 黄萱益肝片的制备方法及其在制备抑制肝癌细胞Hepa1-6细胞增殖药物中的应用的制作方法
- 一种黄萱益肝片的制备方法及其在制备抑制肝癌细胞h22细胞增殖药物中的应用的制作方法