L-硒代蛋氨酸在动物细胞抗氧化中应用的方法及其产品与流程
本发明涉及动物细胞培养技术领域,具体而言,涉及一种l-硒代蛋氨酸在动物细胞抗氧化中应用的方法及其产品。
背景技术:
动物机体或动物细胞受到体内或体外有害刺激,如一些氧化性物质的刺激时,能够产生氧化应激反应,这种氧化应激反应,会引起细胞内一系列物质的变化,例如:细胞内谷胱甘肽(gsh)含量降低,谷胱甘肽过氧化物酶(gpx)的活性降低,细胞内ros水平升高,进而诱导细胞内丙二醛(mda)的产生,细胞内mda水平升高,诱导细胞产生氧化应激,使细胞出现氧化损伤现象,如细胞间隙增大,细胞受损,从而降低细胞活性甚至引起细胞死亡。
目前,广泛应用抗氧化剂来应对动物细胞的氧化损伤,常见的例如应用单质se、nac或vc等,但是这些抗氧化剂虽然具有较强的抗氧化性,但是添加量的控制要非常严格,过量极易导致细胞发生毒性作用,导致细胞受损。因此,提供一种使细胞在氧化应激的作用下依然保持较高的细胞活性,能够有效降低细胞氧化损伤,缓解细胞由于受氧化损伤产生的一些参数变化,提高细胞活性,并且对细胞毒性低的技术方案,具有重要的实际应用价值。
有鉴于此,特提出本发明。
技术实现要素:
本发明的目的之一在于提供一种l-硒代蛋氨酸在动物细胞抗氧化中应用的方法,该方法向动物细胞的培养体系中加入l-硒代蛋氨酸工作液,使动物细胞的培养体系中l-硒代蛋氨酸的终浓度为0.5-1.5μm;l-硒代蛋氨酸工作液的浓度为5-15μm。该l-硒代蛋氨酸在动物细胞抗氧化中应用的方法缓解了现有技术缺乏一种有效降低细胞氧化损伤,提高细胞抗氧化能力,维持细胞活性,对细胞毒性低,操作简便,成本低的动物细胞抗氧化方法。
本发明目的之二在于提供包含l-硒代蛋氨酸的动物细胞抗氧化剂,该动物细胞抗氧化剂,对动物细胞的毒性低,添加量要求相对粗放,成本低。
本发明目的之三在于提供包含l-硒代蛋氨酸或上述包含l-硒代蛋氨酸的动物细胞抗氧化剂的动物细胞培养基,应用该培养基培养动物细胞,动物细胞能够更好地应对氧化应激。
本发明的目的之四在于提供包含l-硒代蛋氨酸或包含l-硒代蛋氨酸的动物细胞抗氧化剂的药品或饲料添加剂,该药品或饲料添加剂被动物服用后,可使动物更好地应对体内外的氧化应激,提高机体对氧化刺激的防御能力。
为了实现本发明的上述目的,特采用以下技术方案:
第一方面,一种l-硒代蛋氨酸在动物细胞抗氧化中应用的方法,方法包括如下步骤:向动物细胞的培养体系中加入l-硒代蛋氨酸工作液,使动物细胞的培养体系中l-硒代蛋氨酸的终浓度为0.5-1.5μm;
l-硒代蛋氨酸工作液的浓度为5-15μm。
优选地,在本发明方案的基础上,l-硒代蛋氨酸在动物细胞抗氧化中应用的方法,动物细胞的培养体系包括培养0-48h的动物细胞的培养体系。
优选地,在本发明方案的基础上,l-硒代蛋氨酸在动物细胞抗氧化中应用的方法,动物细胞包括贴壁细胞、半贴壁细胞或悬浮细胞。
优选地,在本发明方案的基础上,l-硒代蛋氨酸在动物细胞抗氧化中应用的方法,动物细胞的培养体系中l-硒代蛋氨酸的终浓度为0.8-1.2μm;
优选地,动物细胞的培养体系中l硒代蛋氨酸的浓度为0.9μm。
优选地,在本发明方案的基础上,l-硒代蛋氨酸在动物细胞抗氧化中应用的方法,细胞培养体系包括氧化应激处理过的细胞培养体系;
优选地,氧化应激处理包括如下步骤:向培养6-24h的动物细胞培养体系中加入t-2毒素,使t-2毒素的终浓度为0-200nm且不包括0,然后继续培养10-20h;
优选地,t-2毒素的浓度为30-90nm;
优选地,t-2毒素的浓度为55nm。
优选地,在本发明方案的基础上,l-硒代蛋氨酸在动物细胞抗氧化中应用的方法,动物细胞包括贴壁细胞;
优选地,贴壁细胞包括肉鸡原代肝细胞或猪肾细胞;
优选地,猪肾细胞为pk15细胞。
优选地,在本发明方案的基础上,l-硒代蛋氨酸在动物细胞抗氧化中应用的方法,动物细胞的培养体系为培养20-30h的动物细胞的培养体系;
优选地,l-硒代蛋氨酸工作液的浓度为12μm。
第二方面,一种包含l-硒代蛋氨酸的动物细胞抗氧化剂;
优选地,动物细胞抗氧化剂还包括单质se、nac或vc中的一种或几种。
第三方面,一种包含l-硒代蛋氨酸或上述l-硒代蛋氨酸的动物细胞抗氧化剂的动物细胞培养基。
第四方面,一种包含l-硒代蛋氨酸或上述l-硒代蛋氨酸的动物细胞抗氧化剂的药品或饲料添加剂。
与已有技术相比,本发明具有如下有益效果:
(1)本发明的一种l-硒代蛋氨酸在动物细胞抗氧化中应用的方法,该方法向动物细胞的培养体系中加入l-硒代蛋氨酸工作液,使动物细胞的培养体系中l-硒代蛋氨酸的终浓度为0.5-1.5μm;为动物细胞培养体系中提供了l-硒代蛋氨酸,能有效缓解细胞由于受氧化损伤产生的一些参数变化,提高细胞的抗氧化损伤能力,有效维持细胞活性,对细胞的毒性较低,并且操作简便,成本较低。l-硒代蛋氨酸工作液的浓度为5-15μm,更便于在实际应用中添加比例的调控,使用方便。该l-硒代蛋氨酸在动物细胞抗氧化中应用的方法提供了一种l-硒代蛋氨酸在动物细胞抗氧化中用途和具体使用方案。
(2)本发明的包含l-硒代蛋氨酸的动物细胞抗氧化剂对动物细胞的毒性低,添加量要求相对粗放,成本低;本发明的包含l-硒代蛋氨酸或上述包含l-硒代蛋氨酸的动物细胞抗氧化剂的动物细胞培养基在动物细胞培养中应用,能使动物细胞更好地应对氧化应激;本发明的包含l-硒代蛋氨酸或包含l-硒代蛋氨酸的动物细胞抗氧化剂的药品或饲料添加剂,动物服用后,可使动物更好地应对体内外的氧化应激。
附图说明
图1为本发明实施例1得到的细胞he染色图片;
图2为本发明实施例2得到的细胞he染色图片;
图3为本发明实施例3得到的细胞he染色图片;
图4为本发明实施例4得到的细胞he染色图片;
图5为本发明实施例5得到的细胞he染色图片;
图6为对比例1得到的细胞he染色图片;
图7为对比例2得到的细胞he染色图片;
图8为对比例3得到的细胞he染色图片;
图9为对比例4得到的细胞he染色图片;
图10为对比例5得到的细胞he染色图片;
图11为本发明实施例1-5与对比例1-5的细胞活性图;
图12为本发明实施例1-5与对比例1-5中mda含量的测定结果;
图13为本发明实施例1-5与对比例1-5中谷胱甘肽含量测定结果;
图14为本发明实施例1-5与对比例1-5中谷胱甘肽过氧化物酶活性测定结果图。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。
根据本发明的第一方面,提供了一种l-硒代蛋氨酸在动物细胞抗氧化中应用的方法,方法包括如下步骤:向动物细胞的培养体系中加入l-硒代蛋氨酸工作液,使动物细胞的培养体系中l-硒代蛋氨酸的终浓度为0.5-1.5μm;l-硒代蛋氨酸工作液的浓度为5-15μm。
l-硒代蛋氨酸工作液,将l-硒代蛋氨酸溶解于水中配制的用于日常储存的较高浓度的工作液,其浓度为5-15μm,典型但非限制性的l-硒代蛋氨酸工作液的浓度例如为:5μm、6μm、7μm、8μm、9μm、10μm、11μm、12μm、13μm、14μm或15μm等。l-硒代蛋氨酸工作液在使用时依据动物细胞的培养体系的终浓度要求,按比例稀释到培养体系中或培养基中,使动物细胞的培养体系中l-硒代蛋氨酸的终浓度为0.5-1.5μm,典型但非限制性的l-硒代蛋氨酸的终浓度例如为:0.5μm、0.6μm、0.7μm、0.8μm、0.9μm、1.0μm、1.1μm、1.2μm、1.3μm、1.4μm或1.5μm等。
在一种优选的实施方式中,l-硒代蛋氨酸在动物细胞抗氧化中应用的方法,动物细胞的培养体系包括培养0-48h的动物细胞的培养体系。
根据不同种类动物细胞的生长速率、生长周期或接种浓度的不同,动物细胞的培养体系一般绝大多数在0-48h能够达到对数期或稳定期,同时不至于过度老化,因此,选择培养0-48h的动物细胞的培养体系会显示出明显的抗氧化应激效果,典型但非限制性的动物细胞的培养体系包括培养例如为:4h、8h、10h、12h、14h、16h、18h、20h、22h、24h、28h、30h、32h、34h、36h、38h、40h、42h、44h、46h或48h等的动物细胞培养体系。
在一种优选的实施方式中,l-硒代蛋氨酸在动物细胞抗氧化中应用的方法,动物细胞包括贴壁细胞、半贴壁细胞或悬浮细胞。
l-硒代蛋氨酸在贴壁细胞、半贴壁细胞或悬浮细胞的培养中均能够实现其抗氧化应激的效果,使细胞在氧化损伤下维持更高的细胞活性。
在一种优选的实施方式中,l-硒代蛋氨酸在动物细胞抗氧化中应用的方法,动物细胞的培养体系中l-硒代蛋氨酸的终浓度为0.8-1.2μm。
l-硒代蛋氨酸的终浓度为0.8-1.2μm时,不仅能够实现较好的抗氧化应激的效果,而且多种试验中未发现任何细胞毒性,有利于细胞活性的维持,同时,应用的l-硒代蛋氨酸的剂量小,有效降低成本。
优选地,动物细胞的培养体系中l-硒代蛋氨酸的浓度为0.9μm。经多次试验摸索,当动物细胞培养体系中l-硒代蛋氨酸的浓度为0.9μm时,能够使绝大多数常见的细胞较好地抵抗氧化损伤。典型但非限制性的动物细胞例如为:肉鸡原代肝细胞或pk15细胞。
在一种优选的实施方式中,l-硒代蛋氨酸在动物细胞抗氧化中应用的方法,细胞培养体系包括氧化应激处理过的细胞培养体系。
氧化应激处理过的细胞培养体系,通常会在一定时间内产生较为典型的氧化应激现象,因此用氧化应激处理过的细胞培养体系辅以l-硒代蛋氨酸进行培养,能够发现l-硒代蛋氨酸显著缓解细胞由于氧化应激而产生的各种参数变化,典型但非限制性的变化参数例如为:细胞内谷胱甘肽(glutathione,gsh)的含量、谷胱甘肽过氧化物酶(glutathioneperoxidase,gsh-px,也写为gpx)的活性、细胞内活性氧(reactiveoxygenspecies,ros)的含量或细胞内戊二醛(malondialdehyde,mda)的含量等。
优选地,氧化应激处理包括如下步骤:向培养6-24h的动物细胞培养体系中加入t-2毒素,使t-2毒素的终浓度为0-200nm且不包括0,然后继续培养10-20h。
通常在6-24h左右,细胞处于较好的生长状态,抗氧化应激能力较强,这个时候加入t-2毒素进行刺激,能够产生较为明显的氧化应激现象。t-2毒素属于真菌次级代谢产物,是a类单端孢霉稀族毒素中毒性最强的一种真菌毒素,也是一种常见的危害较为严重的霉菌毒素,结构式为4β,15-二乙酰氧基-8α-(3-甲基丁酰氧基)-3α-羟基-12,13-环氧单孢霉-9-烯,分子式为c24h34o9,由于t-2少量摄入便可以造成机体的毒性反应,因此t-2适合作为毒素来源标准品,t-2毒素的终浓度为0-200nm且不包括0较为合理;同时现实场景中,机体细胞较少摄入过大量的t-2毒素或与其相似的毒素,因此,较少的情况需要应激过大的毒素浓度,只需确定一般场景下,应用l-硒代蛋氨酸的浓度的抗氧化效果即可,典型但非限制性的t-2毒素的终浓度例如为:10nm、20nm、30nm、40nm、50nm、60nm、70nm、80nm、90nm、100nm、110nm、120nm、130nm、140nm、150nm、160nm、170nm、180nm、190nm或200nm。
优选地,t-2毒素的浓度为30-90nm。通常t-2毒素的浓度在30-90nm涵盖了绝大多数t-2氧化应激场景的体内浓度或体外浓度。典型但非限制性的t-2毒素的浓度例如为:30nm、40nm、50nm、60nm、70nm、80nm、或90nm等。
优选地,t-2毒素的浓度为55nm。在t-2浓度为55nm时,实验室常用的细胞即可产生较强的氧化应激反应,有利于应用氧化应激处理后细胞进行细胞的毒性或细胞凋亡相关机理的研究,为科研中的一些实验做为铺垫。
在一种优选的实施方式中,l-硒代蛋氨酸在动物细胞抗氧化中应用的方法,动物细胞包括贴壁细胞。贴壁细胞更便于后续对于细胞氧化应激现象的染色观察对比,例如观察细胞间隙的大小、细胞形状的变化或细胞的数量等。
优选地,贴壁细胞包括肉鸡原代肝细胞或猪肾细胞。肉鸡原代肝细胞为贴壁细胞,肝脏是t-2毒素产生毒性作用的主要靶器官之一,因此l-硒代蛋氨酸在动物细胞抗氧化中的应用在肉鸡原代肝细胞的应用效果更为明显。此外,猪肾细胞也是贴壁细胞,而且肾脏也是t-2毒素产生毒性作用较为主要的靶器官,同理,l-硒代蛋氨酸在动物细胞抗氧化中的应用在猪肾细胞中效果也较为明显。
优选地,猪肾细胞为pk15细胞。pk15细胞是实验室常用细胞,应用广泛,l-硒代蛋氨酸在pk15细胞中的抗氧化中应用方法对于科研实验具有极高的应用指导意义。例如在研究细胞的毒性及细胞凋亡相关机理中的应用。
在一种优选的实施方式中,l-硒代蛋氨酸在动物细胞抗氧化中应用的方法,动物细胞的培养体系为培养20-30h的动物细胞的培养体系。培养20-30h的细胞绝大多数处于对数期,活性较好。
优选地,l-硒代蛋氨酸工作液的浓度为12μm。l-硒代蛋氨酸工作液的浓度为12μm,l-硒代蛋氨酸工作液配制以后,放置时间过长或者保存不当,容易引起其抗氧化性的降低,因此,摸索一个较为适合的工作液浓度,在该浓度下,去除损失,依然能够方便按比例添加(使用较为方便进行粗略计算),使其终浓度在合理范围,有利于动物细胞培养体系中动物细胞活性的维持。
第二方面,提供了一种包含l-硒代蛋氨酸的动物细胞抗氧化剂。
l-硒代蛋氨酸可以用于制备动物细胞的抗氧化剂,进而用来缓解动物细胞的氧化损伤。
优选地,动物细胞抗氧化剂还包括单质se、nac或vc中的一种或几种。
l-硒代蛋氨酸还可以与其他动物细胞抗氧化剂进行组合,根据不同的应用场景和使用效果要求,进行不同种类和/或比例的搭配。
第三方面,提供了一种包含l-硒代蛋氨酸或上述l-硒代蛋氨酸的动物细胞抗氧化剂的动物细胞培养基。
应用包含l-硒代蛋氨酸或上述l-硒代蛋氨酸的动物细胞抗氧化剂的动物细胞培养基培养动物细胞,动物细胞能够更好地应对氧化应激。
第四方面,提供了一种包含l-硒代蛋氨酸或上述l-硒代蛋氨酸的动物细胞抗氧化剂的药品或饲料添加剂。
包含l-硒代蛋氨酸或上述l-硒代蛋氨酸的动物细胞抗氧化剂的药品或饲料添加剂动物服用后,可使动物更好地应对体内外的氧化应激,提高机体对氧化刺激的防御能力。
下面通过具体的实施例和对比例进一步说明本发明,但是,应当理解为,这些实施例仅仅是用于更详细地说明之用,而不应理解为用于以任何形式限制本发明。
实施例中的肉鸡原代肝细胞由以下方法制备得到:
购买市售35日龄健康白羽aa肉鸡,麻醉后向翼下静脉注射3ml200u肝素钠,新洁而灭溶液洗涤全身,把肉鸡保定于手术台上。打开腹腔,暴露肝脏;结扎肝周血管,将所有结扎后的血管剪断,分离结缔组织,将整个肝敢出,用37℃的d-hank’s缓冲液(无葡萄糖)冲洗肝表面血凝块,并置于37℃青-链霉素的生理盐水中,然后进行灌流,在鸡肝腹侧找到肝门静脉,剪开一个小口将去除头皮针头的导管插入静脉中,并结扎,然后将事先配制并预热的灌流a液缓缓灌入肝脏。当肝脏缓慢膨胀后,用针头刺入后腔静脉使缓冲液流出,当肝脏逐渐变为土黄色时候,灌流b液,b液灌流500ml后停止灌流,然后用浓度为0.05%iv胶原酶灌流消化肝细胞,整个消化过程在37℃水浴锅中缓慢进行,消化过程灌流450ml后停止消化。分离肝组织,去除结缔组织与血管,然后向得到的肝组织中加入d-hank’s缓冲液,并用移液枪反复吹打至无明显结块,随后肝细胞匀浆液分别过100目、200目和500目细胞筛,然后转入50ml离心管中,600g离心3min,去除上清液,重复3次离心过程,然后加入15mldmem细胞全培养基,获得散在肝细胞悬液。倒置显微镜下计数,dmem全培养基稀释至5×105个/ml,得到肉鸡肝细胞悬液。实施例中的肉鸡肝细胞的培养体系为上述肉鸡肝细胞悬液经过培养得到。
实施例1
肉鸡肝细胞悬液经过培养24h后,细胞贴壁,以得到的肉鸡原代肝细胞的培养体系作为动物细胞的培养体系。(注:用肉鸡肝细胞悬液铺6孔板和96孔板;其中6孔板后续用于he染色观察细胞形态,丙二醛含量测定,谷胱甘肽含量测定,谷胱甘肽过氧化酶含量测定;96孔板用于细胞活性测定;均培养24h作为后续实验中的肉鸡原代肝细胞培养体系。)
不用t-2毒素处理肉鸡原代肝细胞的培养体系(即用0nmt-2毒素氧化应激处理),培养12h,然后肉鸡肝细胞的培养体系中添加浓度为中添加12μm的l-硒代蛋氨酸工作液,调整肉鸡肝细胞培养体系中l-硒代蛋氨酸的终浓度为0.9μm。
实施例2
实施例2与实施例1的区别仅在于,氧化应激处理:用10nmt-2毒素处理肉鸡原代肝细胞的培养体系。
实施例3
实施例3与实施例1的区别仅在于,氧化应激处理:用20nmt-2毒素处理肉鸡原代肝细胞的培养体系。
实施例4
实施例4与实施例1的区别仅在于,氧化应激处理:用50nmt-2毒素处理肉鸡原代肝细胞的培养体系。
实施例5
实施例5与实施例1的区别仅在于,氧化应激处理:用100nmt-2毒素处理肉鸡原代肝细胞的培养体系。
对比例1
对比例1与实施例1的区别仅在于,不加入l-硒代蛋氨酸工作液。
实施例2
对比例2与实施例2的区别仅在于,不加入l-硒代蛋氨酸工作液。
实施例3
对比例3与实施例3的区别仅在于,不加入l-硒代蛋氨酸工作液。
实施例4
对比例4与实施例4的区别仅在于,不加入l-硒代蛋氨酸工作液。
实施例5
对比例5与实施例5的区别仅在于,不加入l-硒代蛋氨酸工作液。
试验例
将实施例1-5和对比例1-5继续培养24h,进行如下试验。
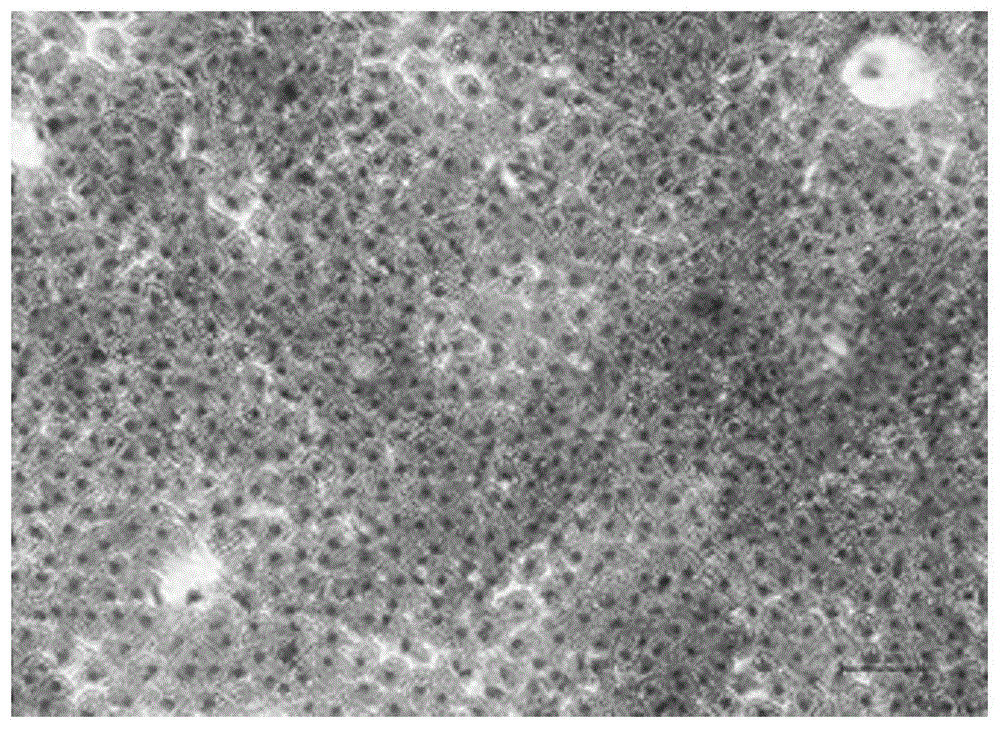
he(hematoxylin-eosinstaining,he)染色观察细胞形态:将上述继续培养24h后的细胞培养体系,弃掉上清液,然后用然后用4%中性甲醛溶液固定细胞30min,再用pbs缓冲液清洗细胞3次,每次5min,向细胞中加入苏木素染色液染色5min,d-hank’s缓冲液清洗细胞3次,每次5min,接着用伊红染色液染色5min,d-hank’s缓冲液清洗细胞3次,每次5min,最后将细胞置于d-hank’s缓冲液中,在倒置显微镜下观察细胞形态。如图1-5分别为实施例1-5得到的he染色图片;其中,图1为实施例1得到的细胞he染色图片;图2为实施例2得到的细胞he染色图片;图3为实施例3得到的细胞he染色图片;图4为实施例4得到的细胞he染色图片;图5为实施例5得到的细胞he染色图片;图6-10分别为对比例1-5得到的细胞he染色图片,图6为对比例1得到的细胞he染色图片;图7为对比例2得到的细胞he染色图片;图8为对比例3得到的细胞he染色图片;图9为对比例4得到的细胞he染色图片;图10为对比例5得到的细胞he染色图片。
细胞活性测定:用上述96孔板培养的细胞,向其中加入5mg/ml噻唑蓝(mtt),20μl/孔,置于5%co2,37℃培养箱中共孵育4h;去除培养液上清,向细胞中加入150μl二甲基亚砜(dimethylsulfoxide,dmso),然后震荡混匀,去除培养液上清,向细胞中加入150μl二甲基亚砜(dmso),然后震荡混匀,根据测定的od值,计算细胞活性。细胞活性(%)=od试验组/od空白组100%。如图11为实施例1-5与对比例1-5的细胞活性图。
丙二醛含量测定:丙二醛(malondialdehyde,mda),细胞刮刮取贴壁细胞,并用预冷d-hank’s缓冲液重悬,转置空白离心管中。在冰上将细胞超声破碎至无可见细胞沉淀。然后4℃,12000g离心5min。将上清转移至另一离心管中,向离心管中加入tba,并于95℃水浴30min。流水冷却并离心,取上清于530nm吸光度测定其od值。然后利用bca试剂盒测定细胞样品中蛋白质含量,最后换算细胞中丙二醛含量。(丙二醛试剂盒a003-4-1与bca试剂盒a045-4-2购自南京建成生物工程研究所)
如图12为实施例1-5与对比例1-5中mda含量的测定结果。
注:*表示同一毒性剂量下,不同组之间比较差异显著(p<0.05),**表示同一毒性剂量下,不同组之间比较差异极显著(p<0.01)
谷胱甘肽(glutathione,gsh)含量测定:按照上述方法获得破碎细胞,并收集上清。根据谷胱甘肽试剂盒说明书(a061-1-1,购自南京建成生物工程研究所),测定并计算谷胱甘肽含量。
如图13为实施例1-5与对比例1-5中谷胱甘肽含量测定结果。
注:*表示同一毒性剂量下,不同组之间比较差异显著(p<0.05),**表示同一毒性剂量下,不同组之间比较差异极显著(p<0.01)
谷胱甘肽过氧化物酶(glutathioneperoxidase,gsh-px,简称gpx)活性测定:
按照上述方法获得破碎细胞,并收集上清。用bca试剂盒测定细胞中总蛋白含量。根据谷胱甘肽过氧化物酶试剂盒说明书(a005-1-2,购自南京建成生物工程研究所),测定并计算谷胱甘肽过氧化物酶活性。
如图14为实施例1-5与对比例1-5中谷胱甘肽过氧化物酶活性测定结果图。
由图1和图6、图2和图7、图3与图8、图4与图9、图5与图10的的显示结果对比可见,在相同t-2毒素的剂量下,实施例中加入l-硒代蛋氨酸抗氧化组细胞与对比例中未加入l-硒代蛋氨酸的组细胞比较,细胞数量明显增多,而且细胞间空隙明显减少。此外从图1-10综合显示结果对比可见,随毒素剂量增加,细胞数量逐渐减少,细胞间隙增加,细胞固缩,而且细胞由不规则多边形逐渐变为圆形。由此可见,l-硒代蛋氨酸在动物细胞抗氧化中应用的方法,能够有效降低细胞氧化损伤,提高细胞抗氧化能力,维持细胞活性,对细胞毒性低。
由图11中对比例1-5与实施例1-5的细胞活性对比可见,实施例1-4的细胞中添加l-硒代蛋氨酸,可显著升高细胞活性;实施例5中的细胞活性也有一定程度的提高。实施例1-5相比对比例1-5,细胞活性明显得到提高。
由图12中对比例1-5与实施例1-5的mda含量的比较,结果显示,向实施例1的细胞中添加l-硒代蛋氨酸,细胞中mda含量显著下降(p<0.05),而向实施例2-4细胞中加入l-硒代蛋氨酸,细胞中mda含量极显著下降(p<0.01)。
由图13可见,实施例1与对比例1相比,实施例1的gsh高于对比例1,此外,实施例2与对比例2,实施例3与对比例3,实施例4与对比例4,实施例5与对比例5之间的对比结果可见,在10、20、50及100nmt-2毒素剂量下,加入l-硒代蛋氨酸的细胞中gsh含量均显著高于未加入l-硒代蛋氨酸组(p<0.05)。其中20和50nmt-2毒素剂量下,加入l-硒代蛋氨酸组gsh含量极显著高于未加入l-硒代蛋氨酸的对比例组(p<0.01)。
由图14可见,实施例1与对比例1,实施例2与对比例2,实施例3与对比例3,实施例4与对比例4,实施例5与对比例5之间的对比结果可见,向细胞中添加l-硒代蛋氨酸可显著提高细胞中gpx活性(p<0.05)
尽管已用具体实施例来说明和描述了本发明,然而应意识到,在不背离本发明的精神和范围的情况下可以做出许多其它的更改和修改。因此,这意味着在所附权利要求中包括属于本发明范围内的所有这些变化和修改。
- 还没有人留言评论。精彩留言会获得点赞!