一种用于铜离子检测的点亮型近红外荧光探针及制备方法与流程
本发明涉及铜离子催化裂解酰胺键释放荧光团的近红外cu2+检测探针分子的制备。该类探针分子通过荧光点亮的方式实现cu2+的检测,除此之外还具有良好的水溶性,专一性,响应时间短等优势,从而为污水以及疾病相关的铜离子检测提供可靠方法。
背景技术:
在生命所必需的各种微量元素中,金属离子在细胞能量产生、催化辅因子、氧传递、平衡和信号转导等生理过程中起着至关重要的作用。除锌、铁离子外,铜在人体中也占有很高的比例。尽管如此,一些相关研究报告表明过量摄入铜可导致多种疾病,包括孟克斯综合征、阿尔茨海默病、威尔逊病、帕金森病等。除此之外,由于工业污水的排放,河流和土壤环境容易受到铜离子的污染。因此,迫切需要开发一种快速监测铜离子的高选择性、高灵敏度的方法。
与其他传统方法相比,荧光分析法检测cu2+具有实时、无创、便捷、廉价等优点。因此,最近几十年开发了大量用于铜离子检测的荧光探针。然而,许多荧光传感器都是基于荧光猝灭效应对铜离子产生响应,容易导检测效果不理想和假阳性结果,这样就造成较强的生物组织背景干扰。此外,在实际操作过程中还存在着水溶性差、光谱不理想、检测灵敏度低等问题。因此,构建一种新型荧光“点亮”型探针是检测cu2+的一种重要策略,当与铜离子响应后荧光会明显增强,会显著提高检测的信噪比。
早期研究表明,以罗丹明为基础的内螺环酰胺结构是检测cu2+的可靠方法。罗丹明衍生物能与cu2+配位,因为螺环内酰胺键是一个富电子中心,对cu2+具有很高的亲和力,但是并未有人报道单独的酰胺键是否能够与铜离子响应。碱性蓝3(bb-3)/亚甲基蓝(mb)是一类普通的近红外染料,其最大发射范围为600-700nm。基于bb-3/mb近红外染料优异的发光特性,我们以酰胺键为铜离子特异性识别单元,首次实现了通过铜离子结合酰胺键使其断裂从而释放荧光团,从而开发了一种合成简便、响应迅速、灵敏度高的cu2+检测荧光探针分子的制备方法。
技术实现要素:
本发明所要解决的技术问题是:提供一种用于铜离子检测的点亮型近红外荧光探针,以及合成简便、响应迅速、灵敏度高的cu2+响应荧光探针的合成方法。该类探针将会提供一种新型的铜离子响应方式,同时也为污水以及疾病相关的铜离子浓度检测提供了可能。
本发明解决其技术问题采用以下的技术方案:
本发明提供的用于铜离子检测的点亮型近红外荧光探针,其结构式为:
上述结构中r为n,n-二甲基或n,n-二乙基,m为硫或氧,x为不同的吸电子基团、供电子基团或氢原子。
所述的荧光探针,其分子能够特异性结合cu2+。
所述的荧光探针,其分子能够特异性结合cu2+并通过催化裂解酰胺键释放荧光团。
所述的近红外荧光探针的分子,可以采用不同的吸电子基团和供电子基,这样可以验证不同活性基团取代探针响应cu2+的能力。
本发明提供的上述的荧光探针,用于制备响应迅速、非侵入式的特异性检测cu2+的近红外荧光探针。
本发明提供的用于铜离子检测的点亮型近红外荧光探针的制备方法,采用以下合成路线方法制备所述的荧光探针:
上述合成路线中:bm是亚甲基蓝或碱性蓝-3,化合物1是亚甲基蓝或碱性蓝-3酰氯化后的产物,化合物2是对位不同取代基苯胺,bm-x是方案实施后得到的一系类目标荧光探针分子,r为n,n-二甲基或n,n-二乙基,m为硫或氧,x为不同的吸电子基团、供电子基团或氢原子。
所述的制备方法,其特征在于制备过程是:
(1)制备化合物1:
将8.0ml的1eq化合物bm与4eq碳酸钠混合水溶液搅拌均匀,再加入4.0ml二氯甲烷持续升温到40℃,然后在氮气气氛下,缓慢滴加10.0ml的4eq连二亚硫酸钠水溶液到上述反应体系,持续反应一小时。之后在氮气保护下将上述反应液移入装有4eq的碳酸钠烧瓶中,在冰水浴条件下缓慢滴加三光气(0.6eq)的二氯甲烷(8.0ml)溶液,持续升温至40℃反应3h。或者是将上述反应液经过冰水浴处理再滴加用二氯甲烷(8ml)溶解的0.6eq双(三氯甲基)碳酸酯持续反应1h。反应结束后,反应液用二氯甲烷-水的体系进行萃取,滤液用无水硫酸钠干燥,柱层析分离。
(2)制备化合物bm-x:
将1eq的化合物1,4eq的碳酸钠和4eq的化合物2,加入5.0ml二氯甲烷溶剂中,在40℃下薄层色谱跟踪直至反应完全,柱层析得到最终化合物。
本发明通过调整苯胺对位官能团的取代基设计合成对cu2+响应的探针分子,从而实现铜离子检测平台构筑。
本发明采用以下方法调整苯胺对位官能团的取代基设计合成对cu2+响应的探针分子:
本发明提供的上述方法制备的荧光探针,用于制备特异性结合铜离子后释放荧光团的探针,特别是用于特异性响应铜离子。用在应用过程中,cu2+通过催化裂解酰胺键,释放出具有荧光发射的氧化态碱性蓝-3或亚甲基蓝。
本发明与现有技术相比,具有以下主要的优点:
1.首次利用了碱性蓝-3(bb-3)/亚甲基蓝(mb)的氧化态形式与还原态形式前后荧光变化的特性设计cu2+响应探针。合成步骤简单,合成的探针分子具有水溶性好,良好的cu2+响应特异性以及较低的检测限,为实现水体以及疾病相关的cu2+检测提供了可能。
2.本发明设计方法首次以酰胺键作为cu2+响应位点,通过调整苯胺对位官能团的取代基设计合成对cu2+响应的探针分子,实现了cu2+检测探针的平台构筑。
3.该类探针分子经过铜离子特异性结合酰胺键之后使其催化断裂从而释放bb-3/mb,提供了一种新型的铜离子响应方式,同时也为水体以及疾病相关的铜离子浓度检测提供了可能。
附图说明
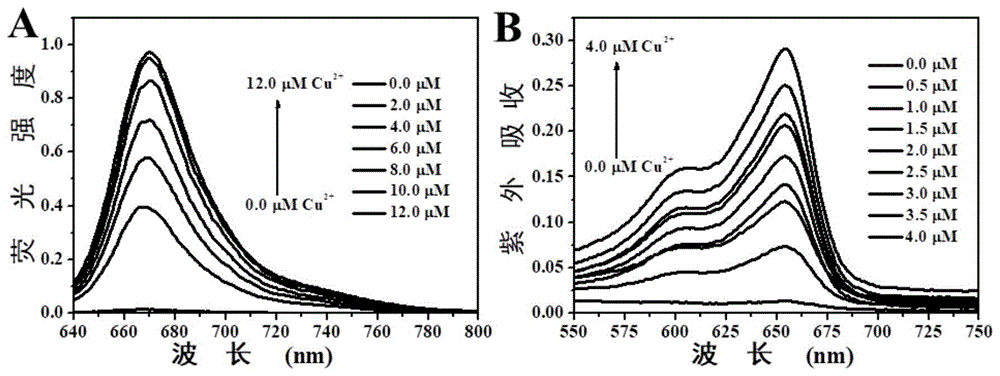
图1为bm-1对不同浓度cu2+的荧光与吸收增强光谱,反应时间2min,探针浓度10μm,图a是施例1分子bm-1在cu2+的浓度为0-12μm下的荧光滴定曲线,图b是施例1分子bm-1在cu2+的浓度为0-4μm下的紫外吸收滴定曲线。
图2为bm-1对不同浓度cu2+的荧光增强光谱与相应的线性拟合曲线,反应时间2min,探针浓度10μm,cu2+的浓度为0-1.4μm。图2中,图a是施例1分子bm-1的荧光滴定曲线图,图b是施例1分子bm-1的滴定线性拟合图。
图3为bm-1在添加4μmcu2+之后的高效液相质谱,显示出探针分子与铜离子响应之后释放出荧光团bb-3。
图4为化合物bm-1在氮气与空气气氛下对2-4.0μmcu2+的响应时间,探针浓度10μm,氮气预先通气25min再用液体石蜡液封。图4中,图a是施例1分子bm-1在空气气氛中对2-4.0μmcu2+的响应时间图,图b是施例1分子bm-1在氮气气氛中对2-4.0μmcu2+的响应时间图。
图5为化合物bm-1分别在氮气、空气和氧气气氛下对4.0μmcu2+的响应时间,探针浓度10μm,氮气与氧气预先通气25min再用液体石蜡液封。图5中,图a是施例1分子bm-1在空气气氛中对4.0μmcu2+的响应荧光增强图,图b是施例1分子bm-1在氮气气氛中对4.0μmcu2+的响应荧光增强图,图c是施例1分子bm-1在氧气气氛中对4.0μmcu2+的响应荧光增强图,图d是施例1分子bm-1在三种气氛中对4.0μmcu2+的响应时间图。
图6为化合物bm-1在金属螯合剂edta存在下对4.0μmcu2+检测结果示意图,探针浓度10μm,响应时间为5min。
图7为化合物bm-1对5种不同活性物种的特异性检测结果示意图,探针浓度10μm,cu2+浓度为2μm,其他活性物种浓度为分别选用cu2+浓度的1倍和500倍浓度。
图8为化合物bm-1对不同阳离子选择性测试结果示意图,探针浓度10μm,cu2+浓度为2μm,其他阳离子物种浓度为20μm。
图9为化合物bm-1对不同阴离子选择性测试结果示意图,探针浓度10μm,cu2+浓度为2μm,其他阴离子物种浓度为20μm。
图10为化合物bm-1对不同氨基酸选择性测试结果示意图,探针浓度10μm,cu2+浓度为2μm,其他氨基酸物种浓度为20μm。
图11为化合物bm-1在不同ph值条件下对cu2+响应的荧光与吸收测试结果示意图,探针浓度10μm,cu2+浓度为2μm,ph值范围为2-10。
图12为化合物bm-1在ph=5的条件下对不同阳离子和阴离子选择性测试结果示意图,探针浓度10μm,,cu2+浓度为2μm,其他阴阳离子物种浓度为20μm。
图13为化合物bm-1在ph=9的条件下对不同阳离子和阴离子选择性测试结果示意图,探针浓度10μm,,cu2+浓度为2μm,其他阴阳离子物种浓度为20μm。
图14为化合物bm-1在不同还原性物质存在的条件下对cu2+响应的荧光测试结果示意图,探针浓度10μm,cu2+浓度为2μm,乙酰半胱氨酸(nac)与谷胱甘肽(gsh)浓度为0-20μm,甲醛与葡萄糖浓度为0-200μm。
图15为化合物bm-1在不同溶剂中对cu2+响应的荧光测试结果示意图,探针浓度10μm,cu2+浓度为4μm,溶剂选择为二甲基亚砜,甲醇,丙酮,乙腈,四氢呋喃和pbs溶液。
图16为化合物bm-1经过0.1μmcu2+预处理一天后的发光母核bb-3在不同溶剂中的荧光光谱示意图,探针浓度10μm,溶剂选择为二甲基亚砜,甲醇,丙酮,乙腈,四氢呋喃和pbs溶液。
图17为发光母核bb-3在三种不同缓冲体系的高浓度cu2+条件下的稳定性测试结果示意图,探针浓度10μm,cu2+浓度为20μm,缓冲体系分别为磷酸缓冲溶液(pbs)、rpmi-1640培养基、高糖培养基(dmem)。
图18为化合物bm-1的细胞毒性实验,选用不同浓度的探针与hela细胞共孵育3和6小时,得到的细胞存活率。探针浓度0-30μm,缓冲体系为高糖培养基(dmem)。
图19为化合物bm-1的细胞共聚焦成像实验,用20μm探针与hela细胞共孵育20min,再分别与20μm和50μm的铜离子共孵育20min,通过共聚焦显微镜得到相应的成像图像。
具体实施方式
本发明提供一种用于铜离子检测的点亮型近红外荧光探针及制备方法,该方法涉及铜离子裂解酰胺键释放荧光团的近红外cu2+检测探针分子的制备,可以通过调整苯胺对位官能团的取代基设计合成一系列对cu2+响应的探针分子。该类探针分子通过荧光开启的方式实现cu2+的检测,除此之外还具有良好的水溶性,选择性,响应时间短等优势,从而为污水以及疾病相关的铜离子检测提供可靠方法。
下面结合实施例及附图对本发明作进一步说明,但不限定本发明。
以制备了两个化合物bm-1和bm-4为案例做详细的说明。
实施例1(bm-1):
化合物4的制备:将碱性蓝-3(1.00g,0.7mmol)和碳酸钠(297mg,2.8mmol)溶解在水(8ml)和二氯甲烷(4ml)中,并将该混合物在40℃下搅拌。氮气保护下,滴加用水(10ml)溶解的连二亚硫酸钠(487mg,2.8mmol)。滴加完毕后,将混合物在40℃和氮气保护下搅拌直至溶液变黄。在氮气保护下将上述反应液移入装有(297mg,2.8mmol)的碳酸钠烧瓶中,在冰水浴条件下缓慢滴加三光气(125mg,0.42mmol)的二氯甲烷(8.0ml)溶液,持续升温至40℃反应3h。反应完毕后将反应混合物倒入50ml冰水中,搅拌,用二氯甲烷(50ml×3)萃取。合并有机相,用食盐水(50ml×3)洗涤,无水硫酸钠干燥后在旋转蒸发仪上除去溶剂,柱层析分离提纯就可以得到化合物4(白色固体,产率=66.8%;淋洗剂体积比为乙酸乙酯:石油醚=1:40)。
1hnmr(400mhz,cdcl3)δ=7.38(d,j=9.7hz,2h),6.39(dd,j=5.6,2.6hz,4h),3.33(t,j=7.1hz,8h),1.16(t,j=7.1hz,12h).
hr-ms(esi,m/z):calcdforc21h26n3o2cl[m+h]+,388.1747,found388.1787.
化合物bm-1的制备:向100ml的schlenk管中加入化合物4(50.0mg,0.13mmol),na2co3(55.4mg,0.52mmol),n,n-二甲基苯胺(71.0mg,0.52mmol),加入溶剂二氯甲烷(5.0ml)。反应液在40℃下薄层色谱直至反应完全。反应结束后,反应液冷却到室温,减压浓缩,薄层色谱板分离提纯就可以得到化合物bm-1(草绿色固体,产率=63.6%;淋洗剂体积比为乙酸乙酯:石油醚=1:2)。
1hnmr(400mhz,cdcl3)δ=7.39(d,j=9.5hz,2h),7.26(d,j=2.0hz,2h),7.07(s,1h),6.69(d,j=9.0hz,2h),6.42(dd,j=6.6,2.7hz,4h),3.34(q,j=7.0hz,8h),2.89(s,6h),1.17(t,j=7.0hz,12h)。
13cnmr:(100mhz,cdcl3),δ=153.7,152.4,147.6,146.6,128.4,125.1,121.8,117.8,113.4,106.7,100.0,44.6,41.1,12.5。
hr-ms(esi,m/z):calcdforc29h37n5o2[m+h]+,488.3021,found488.2981。
实施例2(bm-4):
化合物5的制备:将亚甲基蓝(5.00g,15.63mmol)和na2co3(6.63g,62.52mmol)溶解在水(50ml)和二氯甲烷(25ml)中,并将该混合物在40℃下搅拌。氮气保护下,滴加用水(70ml)溶解的连二亚硫酸钠(10.89g,62.52mmol)。滴加完毕后,将混合物在40℃和氮气保护下搅拌直至溶液变黄。将混合物用冰水浴冷却,向其中滴加用二氯甲烷(20ml)溶解的双(三氯甲基)碳酸酯(2.78g,9.38mmol)。滴加完毕后,将混合物再搅拌1小时。反应完毕后将反应混合物倒入300ml冰水中,搅拌,用二氯甲烷(150ml×3)萃取。合并有机相,用食盐水(150ml×3)洗涤,无水硫酸钠干燥后在旋转蒸发仪上除去溶剂,得到产物粗品,然后通过柱色谱纯化,得到化合物5(蓝灰色固体,产率=52%;乙酸乙酯:石油醚体积比=1:10)。
1hnmr(400mhz,cdcl3)δ=7.42(s,2h),6.72(s,2h),6.65(d,j=8.0hz,2h),2.98(s,12h).
13cnmr(100mhz,cdcl3)δ=149.9,149.4,134.0,128.0,110.8,110.3,77.3,40.6.
化合物bm-4的制备:向100ml的schlenk管中加入化合物5(50.0mg,0.144mmol),na2co3(61.4mg,0.576mmol),n,n-二甲基苯胺(78.6mg,0.576mmol),加入溶剂二氯甲烷(5.0ml)。反应液在40℃下薄层色谱跟踪直至反应完全。反应结束后,反应液冷却到室温,减压浓缩,柱层析分离提纯就可以得到化合物bm-4(黑色固体,产率=58.3%;乙酸乙酯:石油醚体积比=1:5)。
1hnmr(400mhz,cdcl3)δ=7.45(d,j=8.8hz,2h),7.25(d,j=9.0hz,2h),6.78(s,1h),6.73(d,j=2.8hz,2h),6.66(dd,j=8.0,3.6hz,4h),2.95(s,12h),2.88(s,6h).
13cnmr(100mhz,cdcl3)δ=153.7,149.0,147.5,134.3,128.7,128.2,127.2,121.6,113.4,111.3,111.0,41.2,40.7.
hr-ms(esi,m/z):calcdforc25h29n5os[m+h]+,448.2143,found448.2126.
具体bm选用亚甲基蓝(mb)以及碱性蓝-3(bb-3)为例,我们用荧光的方法探索了bb-3以及mb的衍生物bm-x是否能够响应铜离子。如果可以响应铜离子,在加入铜离子前后荧光和吸收光谱会发生明显发生变化。以bm-1为例,通过合成的目标产物对不同浓度的铜离子进行检测所得到的荧光和吸收光谱的变化曲线(附图1),我们可知该类探针随着铜离子浓度的增加光谱变化越发明显。根据0-1.4μmcu2+进行荧光滴定所得的荧光光谱(附图2),再通过公式lod=3σ/k(σ为空白测量的标准差(n=11),k为线性方程的斜率)计算出bm-1对cu2+传感的检出限为1.93nm,较低的检测限可以保证该类探针在生物体内的有效应用。这些结果表明,bm-1对cu2+的反应性可以通过荧光分光光度法测定。
由实施案例合成的化合物bm-1为例,探针bm-1可以与cu2+快速结合然后通过分子内电荷转移机制将氨基胺裂解反应释放bb-3该分子,通过反应后的质谱分析表明bb-3被有效释放出来(附图3)。除此之外,为测试bm-1对cu2+的响应能力(附图4),分别选择在空气和氮气条件下测试bm-1对2-4μm铜离子的响应时间。由实验结果可得,随着铜离子浓度增加,氮气气氛与空气气氛下对cu2+的响应时间随着cu2+离子的浓度增加两者之间的响应时间差距逐渐缩小。为了进一步验证氧气对cu2+的干扰,选择三种不同气氛对bm-1响应4.0μmcu2+的能力进行验证(附图5)。实验结果证明在空气气氛下要比氮气气氛下响应更为迅速,验证了微量氧气能够加快响应时间。但是,在空气气氛与氧气气氛下bm-1对cu2+的响应时间比较证明在富氧条件下会加快铜离子的响应时间。在乙二胺四乙酸(edta,作为一种金属螯合剂)存在下,加入4.0μmcu2+后bm-1的荧光强度随反应时间的延长变化不大(附图6)。这些实验结果说明铜离子对bm-1的酰胺键催化断裂是起主导作用,氧气是起到一个协同催化的作用。
探针的选择性是评价其性能的一个重要参数,以化合物bm-1为例研究该类探针分子对cu2+响应的特异性。这里我们探索了探针bm-1对各种分析物的选择性,包括2μm和1mmros/rns(附图7):h2o2,t-buooh,no,roo·和·oh;20μm常见的阳离子(附图8):fe3+,ni2+,mg2+,fe2+,al3+,ca2+,k+,nh4+,cd2+,mn2+,co2+,zn2+和na+;20μm常见的阴离子(附图9):ch3coo-,co32-,so42-,cl-,f-,i-,no2-,s2o42-和no3-;20μm一系列的氨基酸(附图10):pro,ser,ala,gln,val,thr,lle,gly,tyr,met,trp,phe,cys,glu和lys。只有在bm-1的pbs溶液中加入2.0μmcu2+(ph=7.4,1%etoh)才能引起荧光强度的显著变化,排除这些物质对cu2+检测的干扰。在人体的不同组织环境之间有不同的ph值,我们进一步探索了该类探针分子在不同ph下的探针的cu2+响应能力,通过发射(在669nm处)和吸收(在654nm处)光谱表示(附图11)。实验结果证明在ph=7时该类探针具有最强的响应能力,适宜在人体环境应用,而且在ph=5-9之间都有很好响应能力。除此之外,我们进一步验证了bm-1在酸性溶液(ph=5)和碱性溶液(ph=9)中对阴阳离子的选择性(附图12和13),实验结果表明即在两者环境中该类探针依旧表现出良好的响应性与特异性。
为了保证bm-1探针在细胞水平上的有效应用,对几种细胞还原剂的干扰进行了研究,包括乙酰半胱氨酸(nac)、谷胱甘肽(gsh)、甲醛、葡萄糖,这些物质可能对cu2+检测造成干扰。我们为了验证还原性物质是否会影响cu2+检测,选择这四种物质通过实验进行验证(附图14)。实验结果表明即使分别选用10倍的nac与gsh、100倍的甲醛与葡萄糖也不会对铜离子的检测造成干扰。之后为了展示该类探针优异的响应性能,我们选择了在不同溶剂中进行响应性实验(附图15),结果表明即使在二甲基亚砜,甲醇,丙酮,乙腈和四氢呋喃溶液中bm-1依旧能够有效的响应cu2+。除此之外,在不同溶剂中发光母核碱性蓝-3也表现出良好的荧光发射(附图16)。最后,我们还探索了发光母核bb-3在不同缓冲体系中的稳定性(附图17),结果表明即使在20μmcu2+浓度下,发光母核bb-3在以上缓冲体系中的荧光强度基本保持不变,表明该类探针能够在复杂的生理环境中实现cu2+检测。综上所述,bm-1对cu2+的响应呈现良好的选择性和响应性,能够实现在生理水平上进行cu2+检测的可能。
受上述结果的启发,我们进一步论证了bm-1在活体细胞中监测cu2+的实际应用。首先,采用甲基噻唑基四唑(mtt)法研究bm-1(0-30μm)在hela细胞中的细胞毒性(附图18)。结果表明,bm-1探针对cu2+的生物显像应是安全的(细胞存活率>90%)。之后为了验证探针在细胞中的实际应用(附图19),我们采用20μm的bm-1预先在细胞培养箱中与hela细胞共孵育20min,然后用不同浓度的cu2+(分别为20和50μm)再次孵育20min。实验结果显示,我们可以观察到在加入铜离子后红色通道中有明显的荧光信号,随着铜离子的浓度增加信号增强,这些结果表明该类探针具有良好的细胞膜通透性以及生物成像能力。
本发明的优点在于首次利用了碱性蓝-3(bb-3)/亚甲基蓝(mb)的氧化态与还原态前后荧光变化的特性设计cu2+响应探针。合成的探针分子具有良好的cu2+响应特异性以及较低的检测限,能够实现细胞环境中微量的cu2+检测。除此之外,本发明设计方法可以通过调整苯胺对位官能团的取代基设计合成一系类对cu2+响应的探针分子,实现cu2+检测探针的平台构筑。该类探针分子利用新型的响应方式,通过cu2+与酰胺键进行配位结合之后催化断键从而实现分析物的检测。经过铜离子响应之后释放的bb-3/mb具有很好的发光性质,能够在特定区域实现荧光成像,为实现生理水平上的cu2+检测提供了可能。
上述实施例为本发明的优选例,并不用来限制本发明,凡在本发明的原则之内,所做的任何修改、变化、变通或替换方案,均在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!