金属有机框架材料及其制备方法、以及包含其的吸附装置与流程
本发明关于一种金属有机框架材料及其制备方法,特别是关于一种在低湿下具有良好吸附性的金属有机框架材料。
背景技术:
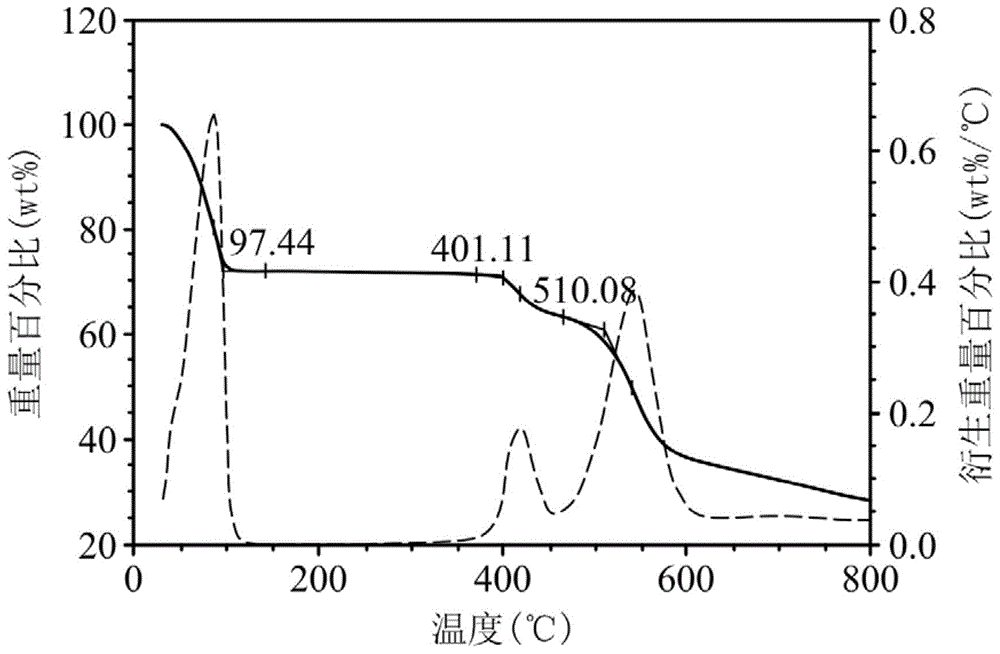
:水气吸附剂目前被广泛用于压缩空气系统中的吸附式干燥机。外界空气经过空气压缩机后会处于湿度高于80%相对湿度(rh)的状态,需先经由冷冻式干燥机移除压缩空气中大部分的水分,再经由吸附式干燥机移除压缩空气中的少量残余水分。压缩空气经过冷冻式干燥机处理后,湿度会降至约30%rh以下,再经由吸附式干燥机移除压缩空气中的少量残余水分。因此,适用于前述设备的吸附剂必须于极低的相对湿度环境下仍具有高水气吸附率,这对设备的体积、建置成本、运作效率皆有很大的帮助。传统水气吸附剂4a沸石,虽然在低湿环境下仍有不错的水气吸附率,然而其高度的亲水性增加了水气脱附的难度。一般而言,4a沸石需要在140~160℃或更高的温度下才能使水气脱附。然而,高温脱附不仅会使吸附剂再生时产生大量的能耗,也增加使用时的不便。在此考虑下,需要可低温脱附且可于低湿环境下吸附水气的吸附剂。然而,目前的吸附剂局限于在低湿下吸附量小和脱附温度需高于140℃的现况,增加了设备建置费用与运作成本,而且设备能耗高。因此,业界亟需一种新颖的金属有机框架材料,以解决现有技术所遭遇到的问题。技术实现要素:根据本发明的一个方面,本方面提供一种金属有机框架材料,包括3,5-吡啶二羧酸;以及金属离子,其中所述金属离子是铝离子、铬离子、或锆离子,其中所述3,5-吡啶二羧酸与所述金属离子配位。根据本发明的另一方面,本发明提供一种金属有机框架材料的制备方法,用以制备上述金属有机框架材料。所述金属有机框架材料的制备方法包含:提供组合物,其中所述组合物包括3,5-吡啶二羧酸、金属化合物、及溶剂;以及,对所述组合物进行加热,以使所述3,5-吡啶二羧酸与所述金属化合物反应,获得所述金属有机框架材料。根据本发明的又一方面,所述溶剂包括选自由有机溶剂、和水组成的群组中的至少一种。附图说明图1为本发明实施例1的热重分析测试图。图2为本发明实施例1的等温吸附曲线测试图。图3为本发明实施例1、商品编号a520、活性氧化铝及4a沸石粉末在不同湿度下的吸附测试图。图4为本发明实施例1及商品编号a520在30%rh下的吸附测试图。图5为本发明实施例1在80%rh下之吸附测试图。图6为本发明吸附装置之示意图。其中,附图标记为:100吸附装置;120载体;140吸附材料。具体实施方式本发明的实施方式提供一种金属有机框架材料与其制备方法、以及包含该金属有机框架材料的吸附装置。本方面所述的金属有机框架材料在低湿下具有快速吸湿效果,这里所定义的低湿条件是指在25℃的温度下相对湿度为30%rh以下。所述金属有机框架材料可进一步被配置于载体之上,作为吸附装置,用于吸附式干燥机,达到在低湿环境下快速吸湿的目的。根据本发明的实施方式,本发明提供一种金属有机框架材料。所述金属有机框架材料包括3,5-吡啶二羧酸;以及金属离子,其中所述金属离子是铝离子、铬离子、或锆离子,其中所述3,5-吡啶二羧酸与所述金属离子配位。所述3,5-吡啶二羧酸与所述金属离子的摩尔比介于3:1至1:2。若3,5-吡啶二羧酸与金属离子的摩尔比低于1:2,则无法形成孔洞材料,使得吸水率过低;若3,5-吡啶二羧酸与金属离子的摩尔比高于3:1,同样地亦无法形成孔洞材料,使得吸水率变差。根据本发明的实施方式,本发明提供一种上述金属有机框架材料的制备方法。首先,提供组合物,其中所述组合物包括3,5-吡啶二羧酸、金属化合物、及溶剂。接着,对所述组合物进行加热以使所述3,5-吡啶二羧酸与所述金属化合物反应,获得所述金属有机框架材料。根据本发明的实施方式,其中所述3,5-吡啶二羧酸与所述金属化合物的摩尔比介于3:1至1:2之间,例如2:1、或1:1。根据本发明的实施方式,其中所述金属化合物可为选自由铝盐、铬盐、和锆盐组成的群组中的至少一种。其中所述金属化合物可为选自由硝酸铝、硫酸铝、氯化铝、磷酸铝、硝酸铬、磷酸铬、硝酸锆、磷酸锆、和氯氧化锆组成的群组中的至少一种。根据本发明的实施方式,其中所述金属化合物在所述组合物中的初始浓度可为0.15mol/l至0.66mol/l之间,以所述组合物的体积为基准。根据本发明的实施方式,加热的温度可为约100℃至150℃,例如110℃至140℃。此外,加热的时间可为1至66小时。根据本发明的实施方式,所述溶剂包括选自由有机溶剂、和水组成的群组中的至少一种。根据本发明的一些实施方式,所述溶剂是有机溶剂。根据发明的一些实施方式,该溶剂是水。根据发明的一些实施方式,所述溶剂可由水和有机溶剂组成,其中有机溶剂与水的重量比可为1:99至99:1之间(例如:1:99至1:29、1:99至1:1、10:90至2:1、或1:1至99:1)。举例来说,有机溶剂与水的重量比可为4:1、2:1、1:1、1:2、1:4、或1:8。本发明所述的有机溶剂可为选自由n,n-二甲基甲酰胺、n,n-二乙基甲酰胺、和n,n-二甲基乙酰胺组成的群组中的至少一种。根据本发明的一些实施方式,该溶剂是选自由水、n,n-二甲基甲酰胺、n,n-二乙基甲酰胺、和n,n-二甲基乙酰胺组成的群组中的至少一种。根据本发明的实施方式,所述组合物可由3,5-吡啶二羧酸、金属化合物、及有机溶剂组成。当所述组合物由3,5-吡啶二羧酸、金属化合物、及有机溶剂组成时,加热的温度可为约100℃至150℃(例如120℃至140℃);加热的时间可为12至66小时,例如12至48小时、或24至48小时;以及,所述金属化合物在此组合物中的初始浓度可为0.15mol/l至0.33mol/l之间,以所述组合物的体积为基准。根据本发明的实施方式,当溶剂为水时,所述组合物还包括碱金属氢氧化物。换言之,所述组合物可由3,5-吡啶二羧酸、金属化合物、水、以及碱金属氢氧化物组成。所述碱金属氢氧化物包括选自由氢氧化锂(lithiumhydroxide)、氢氧化钠(sodiumhydroxide)、和氢氧化钾(potassiumhydroxide)组成的群组中的至少一种。根据本发明的实施方式,当溶剂为水时,所述组合物还包括碱金属氢氧化物以及铝酸盐。换言之,所述组合物可由3,5-吡啶二羧酸、金属化合物、水、碱金属氢氧化物、以及铝酸盐组成。所述铝酸盐包括选自由铝酸锂(lithiumaluminate)、铝酸钠(sodiumaluminate)、铝酸钾(potassiumaluminate)、铝酸镁(magnesiumaluminate)、和铝酸钙(calciumaluminate)组成的群组中的至少一种。此外,所述铝酸盐在所述组合物中的初始浓度介于0.05mol/l至0.20mol/l(例如介于0.05mol/l至0.15mol/l)之间,以所述组合物的体积为基准。根据本发明的实施方式,所述组合物不包含酒精。根据本发明的某一实施方式,当溶剂为水时,所述组合物不包含酒精。根据本发明的实施方式,当溶剂为水时,加入碱金属氢氧化物的目的在于中和组合物中的3,5-吡啶二羧酸,以维持组合物(水溶液)接近中性(即组合物的ph值为6-8之间),形成可溶于水的组合物。基于上述原因,所述碱金属氢氧化物与所述3,5-吡啶二羧酸的摩尔比可为1.8至2.2,例如为2。因此,当碱金属氢氧化物与3,5-吡啶二羧酸的摩尔过低或过高时,或者碱金属氢氧化物无法完全中和组合物中的3,5-吡啶二羧酸,或者所述组合物中存在过量的碱金属氢氧化物,二者均使得所述组合物的ph值无法保持在6-8之间,导致所得金属有机框架材料对水气的吸附率较差,甚至无法得到金属有机框架材料。根据本发明的实施方式,当溶剂为水时,加入铝酸盐于组合物中可在3,5-吡啶二羧酸与金属化合物反应时抑制结晶状副产物的生成,以避免结晶状副产物影响所得金属有机框架材料的吸水率。根据本发明的实施方式,当溶剂为水时,3,5-吡啶二羧酸与金属化合物反应后所产生的废液不包含有机溶剂,除了可降低处理废液的成本外,亦可降低对环境的污染。另一方面,当组合物由3,5-吡啶二羧酸、金属化合物、水、碱金属氢氧化物、以及铝酸盐组成时,加热的温度可为约100℃至150℃(例如110℃至130℃);加热的时间可为2至3小时;以及,所述金属化合物在所述组合物中的初始浓度可为0.15mol/l至0.66mol/l之间,以所述组合物的体积为基准。如此一来,当溶剂为水时,本发明所述的金属有机框架材料的制备时间可大幅缩短,增加金属有机框架材料的生产效率。根据本发明的实施方式,当溶剂由水及有机溶剂组成,且有机溶剂与水的重量比为1:29至1:99时,所述组合物还包括碱金属氢氧化物以及铝酸盐。根据本发明的一些实施方式,当有机溶剂与水的重量比为1:29至1:99时,若所述组合物不包含碱金属氢氧化物和/或铝酸盐,则所得金属有机框架材料对水气的吸附率较差,甚至无法得到金属有机框架材料。此外,所述铝酸盐在该组合物中的初始浓度介于0.05mol/l至0.20mol/l之间(例如介于0.05mol/l至0.15mol/l),以所述组合物的体积为基准。根据本发明的实施方式,本发明提供一种吸附装置(100)。所述吸附装置包含载体(120),以及吸附材料(140)。所述吸附材料(140)可配置于所述载体(120)上。所述吸附材料可包括3,5-吡啶二羧酸,以及金属离子,其中所述金属离子是铝离子、铬离子、或锆离子,其中所述3,5-吡啶二羧酸与所述金属离子配位。根据本发明的实施方式,所述吸附装置在30%rh(相对湿度)及25℃的环境放置30分钟后其对水气的吸附率可达18wt%至40wt%。在此,本发明所述的对水气的吸附率由下式所决定:w1为材料吸湿后的重量,w0为80℃下材料脱附水气之后所得到的重量。根据本发明的实施方式,所述吸附材料除了可应用于低湿环境下,更可使用在吸附式干燥机,如高压空气干燥机、塑料干燥机中。且所述吸附材料也可作为吸附剂用以移除特定的极性有害小分子或气体。为了让本发明的上述和其他目的、特征、和优点能更明显易懂,下文特举数实施例,作详细说明如下:金属有机框架材料的制备例制备例1首先,将硝酸铝(al(no3)3·9h2o)(0.015mol)、3,5-吡啶二羧酸(0.015mol)、72毫升的水与18毫升的n,n-二甲基甲酰胺混合,其中3,5-吡啶二羧酸与硝酸铝的摩尔比为1:1。接着,将所得组合物在120℃下均匀搅拌反应48小时。接着,让反应冷却至室温后,得到黄色沉淀。将上述黄色沉淀以水清洗并过滤得到黄色固体。接着,将所得的黄色固体置于烘箱内干燥至隔夜,干燥温度约为140℃。干燥后,将黄色固体研磨成粉状。接着,利用真空烘箱对该粉状固体进行真空干燥,其中真空干燥的温度约为140℃,时间约持续6小时。降至室温后,得到金属有机框架材料(淡黄色粉末)(1)。以比表面积与孔隙度分析仪(specificsurfaceareaandporosimetryanalyzer)测量金属有机框架材料的比表面积为1133m2/g,水气吸附率为34.48wt%。水气吸附率计算方法如下:w1为在30%rh(相对湿度)及25℃的环境放置30分钟后的重量,w0为80℃下材料脱附水气之后所得到的重量。制备例2依制备例1所述的方式进行,除了将3,5-吡啶二羧酸与硝酸铝的摩尔比由1:1增加至2:1,得到金属有机框架材料(2),水气吸附率为34.96wt%。制备例3依制备例1所述的方式进行,除了将3,5-吡啶二羧酸与硝酸铝的摩尔比由1:1增加至3:1,得到金属有机框架材料(3),水气吸附率为33.81wt%。制备例4依制备例1所述的方式进行,除了将3,5-吡啶二羧酸与硝酸铝的摩尔比由1:1增加至4:1,得到金属有机框架材料(4),水气吸附率为13.4wt%。制备例5依制备例1所述的方式进行,除了将3,5-吡啶二羧酸与硝酸铝的摩尔比由1:1降低至1:2,得到金属有机框架材料(5),水气吸附率为28.42wt%。制备例6依制备例1所述的方式进行,除了将3,5-吡啶二羧酸与硝酸铝的摩尔比由1:1降低至1:3,得到金属有机框架材料(6),水气吸附率为17.85wt%。制备例7依制备例1所述的方式进行,除了将水由72毫升增加至87毫升、以及将n,n-二甲基甲酰胺由18毫升降低至3毫升,得到金属有机框架材料(7),水气吸附率为34.90wt%。制备例8依制备例1所述的方式进行,除了将水与n,n-二甲基甲酰胺的添加体积由72毫升与18毫升调整成81毫升与9毫升,得到金属有机框架材料(8),水气吸附率为35.20wt%。制备例9依制备例1所述的方式进行,除了将水由72毫升增加至76.5毫升、以及将n,n-二甲基甲酰胺由18毫升降低至13.5毫升,得到金属有机框架材料(9),水气吸附率为34.30wt%。制备例10依制备例1所述的方式进行,除了将水由72毫升增加至75毫升、以及将二甲基甲酰胺由18毫升降低至15毫升,得到金属有机框架材料(10),水气吸附率为35.66wt%。制备例11依制备例1所述的方式进行,除了将水由72毫升降低至67.5毫升、以及将二甲基甲酰胺由18毫升增加至22.5毫升,得到金属有机框架材料(11),水气吸附率为34.99wt%。制备例12依制备例1所述的方式进行,除了将水由72毫升降低至54毫升、以及将n,n-二甲基甲酰胺由18毫升增加至36毫升,得到金属有机框架材料(12),水气吸附率为31.17wt%。制备例13依制备例1所述的方式进行,除了将水由72毫升降低至30毫升、以及将n,n-二甲基甲酰胺由18毫升增加至60毫升,得到金属有机框架材料(13),水气吸附率为29.61wt%。制备例14依制备例1所述的方式进行,除了以90毫升的二甲基甲酰胺取代72毫升的水与18毫升的n,n-二甲基甲酰胺,得到金属有机框架材料(14),水气吸附率为20.94wt%。制备例15依制备例1所述的方式进行,除了将硝酸铝替换成硫酸铝(al2(so4)3·18h2o)之外,并调整3,5-吡啶二羧酸与硫酸铝的摩尔比至2:1,得到金属有机框架材料(15),水气吸附率为25.3wt%。制备例16依制备例1所述的方式进行,除了将硝酸铝替换成氯氧化锆(zrocl2·8h2o)(3,5-吡啶二羧酸与氯氧化锆的摩尔比为1:1),得到金属有机框架材料(16)。制备例17依制备例1所述的方式进行,除了将硝酸铝替换成硝酸铬(cr(no3)3·9h2o)(3,5-吡啶二羧酸与硝酸铬的摩尔比为1:1),得到金属有机框架材料(17),水气吸附率为22.05wt%。比较例1依制备例1所述的方式进行,除了将硝酸铝替换成硝酸铁(fe(no3)3·9h2o)(3,5-吡啶二羧酸与硝酸铁的摩尔比为1:1),得到金属有机框架材料(18),水气吸附率为0.79wt%。比较例2依制备例1所述的方式进行,除了将硝酸铝替换成硝酸铜(cu(no3)2·3h2o)(3,5-吡啶二羧酸与硝酸铜的摩尔比为1:1),得到金属有机框架材料(19),水气吸附率为0.66wt%。比较例3依制备例1所述的方式进行,除了将3,5-吡啶二羧酸替换成2,6-吡啶二羧酸(2,6-吡啶二羧酸与硝酸铝的摩尔比为1:1),得到金属有机框架材料(20),水气吸附率为0wt%。比较例4依制备例1所述的方式进行,除了将3,5-吡啶二羧酸替换成2,4-吡啶二羧酸(2,4-吡啶二羧酸与硝酸铝的摩尔比为1:1),得到金属有机框架材料(21),水气吸附率为9.8wt%。比较例5首先,将硝酸铝(0.015摩尔)、3,5-吡啶二羧酸(摩尔比0.015的)与90毫升的水混合,其中3,5-吡啶二羧酸与硝酸铝的摩尔比为1:1。接着,将所得组合物在120℃下均匀搅拌反应48小时。接着,让反应冷却至室温后,得到黄色沉淀物。将上述黄色沉淀物以水清洗并过滤得到黄色固体。接着,将所得的黄色固体置于烘箱内干燥至隔夜,干燥温度约为140℃。干燥后,将黄色固体研磨成粉状。接着,利用真空烘箱对该粉状固体进行真空干燥,其中真空干燥的温度约为140℃,时间约持续6小时。降至室温后,无法得到金属有机框架材料。表1显示制备例1以及比较例1-5所述金属有机框架材料的水气吸附率。表1水气吸附率(wt%)制备例134.48比较例10.79比较例20.66比较例30比较例49.8比较例5无法得到金属有机框架材料由表1可得知,本发明所述的金属有机框架材料,在使用特定配体(例如3,5-吡啶二羧酸)及适合金属离子,可获得约35wt%的水气吸附率。反之,即便选用结构相似的配体(例如2,4-吡啶二羧酸、或2,6-吡啶二羧酸)仍无法达到水气吸附的效果(如比较例3及4)。若使用不适合的金属离子(例如铁离子或铜离子)搭配特定配体(例如3,5-吡啶二羧酸),所得的金属有机框架材料水气吸附率效果不佳(水气吸附率亦不到1wt%)(如比较例1及2)。此外,由比较例5可得知,在用来制备金属有机框架材料的组合物中若仅有水作为溶剂(即不包含有机溶剂、碱金属氢氧化物、以及铝酸盐),无法获得金属有机框架材料。制备例18首先,将3,5-吡啶二羧酸(9mmol)、氢氧化钠(18mmol)与15.78毫升的水混合,接着加入硝酸铝水溶液(al(no3)3·9h2o)(1m,6.75mmol)与铝酸钠水溶液(naalo2)(0.5m,2.25mmol),得到组合物。其中,在该组合物中,3,5-吡啶二羧酸与硝酸铝的摩尔比为4:3、硝酸铝于组合物中的初始浓度为0.28mol/l、以及铝酸钠于组合物中的初始浓度为0.09mol/l。接着,将所得组合物在130℃下均匀搅拌反应3小时。接着,让反应冷却至室温后,得到沉淀物。将上述沉淀物以水清洗并过滤得到固体。接着,将所得的固体置于烘箱内干燥至隔夜,干燥温度约为80℃。干燥后,将固体研磨成粉状,得到金属有机框架材料(22),水气吸附率为33.65wt%。虽然制备例18与比较例5同样使用水作为溶剂,但由于制备例18用来制备金属有机框架材料的组合物还包含碱金属氢氧化物(即氢氧化钠),因此可维持组合物(水溶液)接近中性,产生可溶于水的组合物。相反,比较例5用来制备金属有机框架材料的组合物,由于不包含碱金属氢氧化物,因此无法得到金属有机框架材料。制备例19依制备例18所述的方式进行,除了不添加铝酸钠水溶液,得到金属有机框架材料(23),水气吸附率为25.43wt%。制备例20依制备例18所述的方式进行,除了将铝酸钠于组合物中的初始浓度由0.09mol/l调整至0.05mol/l,得到金属有机框架材料(24),水气吸附率为32.13wt%。制备例21依制备例18所述的方式进行,除了将铝酸钠于组合物中的初始浓度由0.09mol/l调整至0.07mol/l,得到金属有机框架材料(25),水气吸附率为31.80wt%。制备例22依制备例18所述的方式进行,除了将铝酸钠于组合物中的初始浓度由0.09mol/l调整至0.11mol/l,得到金属有机框架材料(26),水气吸附率为33.47wt%。制备例23依制备例18所述的方式进行,除了将铝酸钠于组合物中的初始浓度由0.09mol/l调整至0.15mol/l,得到金属有机框架材料(27),水气吸附率为27.77wt%。表2显示制备例18至23所述金属有机框架材料的水气吸附率。表2由表2可得知,当用来制备本发明所述的金属有机框架材料的组合物的溶剂为水时,与不具有铝酸钠的组合物相比,具有铝酸钠的组合物(铝酸钠水溶液的初始浓度可介于0.05mol/l至0.15mol/l)可提升所得的金属有机框架材料的水气吸附率。这是因为铝酸钠可在组合物中作为抑制剂,避免在3,5-吡啶二羧酸与金属化合物反应时生成结晶状副产物。制备例24依制备例18所述的方式进行,除了将组合物的反应温度由130℃降低至110℃,得到金属有机框架材料(28),水气吸附率为32.17wt%。制备例25依制备例18所述的方式进行,除了将组合物的反应温度由130℃降低至120℃,得到金属有机框架材料(29),水气吸附率为32.67wt%。由制备例18、24及25可得知,当用来制备金属有机框架材料的组合物其溶液为水时,该组合物的反应温度可为110℃至130℃。制备例26依制备例18所述的方式进行,除了将反应时间由3小时降低至2小时,得到金属有机框架材料(30),水气吸附率为32.31wt%。由制备例18及26可得知,当用来制备金属有机框架材料的组合物其溶液为水时,该组合物的反应时间可为2至3小时。制备例27依制备例18所述的方式进行,除了将硝酸铝替换成氯氧化锆(zrocl2·8h2o),得到金属有机框架材料(31)。制备例28依制备例18所述的方式进行,除了将硝酸铝替换成硝酸铬(cr(no3)3·9h2o),得到金属有机框架材料(32)。制备例29依制备例18所述的方式进行,除了将硝酸铝替换成硫酸铝(al2(so4)3·14h2o),得到金属有机框架材料(33),水气吸附率为30.85wt%。制备例30依制备例18所述的方式进行,除了将硝酸铝替换成氯化铝(alcl3·6h2o),得到金属有机框架材料(34),水气吸附率为33.25wt%。制备例31依制备例18所述的方式进行,除了将3,5-吡啶二羧酸与硝酸铝的摩尔比由4:3调整为2:1,得到金属有机框架材料(35),水气吸附率为31.86wt%。制备例32依制备例18所述的方式进行,除了将3,5-吡啶二羧酸与硝酸铝的摩尔比由4:3调整为1:1,得到金属有机框架材料(36),水气吸附率为30.68wt%。制备例33依制备例18所述的方式进行,除了将3,5-吡啶二羧酸与硝酸铝的摩尔比由4:3调整为1:2,得到金属有机框架材料(37),水气吸附率为30.67wt%。制备例34依制备例18所述方式进行,除了将硝酸铝的初始浓度由0.28mol/l降低至0.22mol/l,得到金属有机框架材料(38),水气吸附率为31.86wt%。制备例35依制备例18所述的方式进行,除了将硝酸铝的初始浓度由0.28mol/l增加至0.33mol/l,得到金属有机框架材料(39),水气吸附率为30.68wt%。制备例36依制备例18所述的方式进行,除了将硝酸铝的初始浓度由0.28mol/l增加至0.56mol/l,得到金属有机框架材料(40),水气吸附率为30.67wt%。制备例37依制备例18所述的方式进行,除了将硝酸铝的初始浓度由0.28mol/l增加至0.66mol/l,得到金属有机框架材料(41),水气吸附率为30.24wt%。由制备例18、34至37可得知,当用来制备金属有机框架材料的组合物的溶剂为水时,硝酸铝在组合物中的初始浓度可为0.22mol/l至0.66mol/l。制备例38依制备例18所述的方式进行,除了在反应前进一步添加3ml的乙醇至该组合物中,得到金属有机框架材料(42),水气吸附率为32.71wt%。制备例39依制备例18所述的方式进行,除了在反应前进一步添加6ml的乙醇至该组合物中,得到金属有机框架材料(43),水气吸附率为33.92wt%。制备例40依制备例18所述的方式进行,除了在反应前进一步添加9ml的乙醇至该组合物中,得到金属有机框架材料(44),水气吸附率为33.88wt%。表3显示制备例18、及38至40所述金属有机框架材料的水气吸附率。表3乙醇添加量(ml)水气吸附率(wt%)制备例18033.65制备例38332.71制备例39633.92制备例40933.88由表3可知,当用来制备金属有机框架材料的组合物其溶剂为水时,乙醇的添加与否对金属有机框架材料的水气吸附率并不会有显著的影响。金属有机框架材料的热重分析实施例1将制备例1所述的金属有机框架材料进行热重分析(thermogravimetricanalysis,tga),观察制备例1水气的脱附量与脱附温度的结果。将制备例1的金属有机框架材料置于热重分析仪中,设定温度(升温速率为10℃/min)观察其重量的损失。由图1可知,制备例1的金属有机框架材料在50℃至100℃时其重量快速下降。在100℃时其重量损失约30wt%。这表示本发明所述金属有机框架材料可用来吸附水气,并在低温下(约50℃)即可进行水气的脱附。由图1可知,本制备例1的金属有机框架材料直到加热温度到达约400℃时,才又观察到重量的损失。这表示本发明所述金属有机框架材料具有高热稳定性(热稳定度可达约400℃以上)。金属有机框架材料的等温吸附曲线测试实施例2图2是以制备例1的金属有机框架材料的等温吸附曲线图。首先,将所述材料于80℃的真空环境下脱附后,接着,再于25℃的真空环境开始逐渐增加水气分压,一次给予0.1分压的水蒸气,让材料慢慢吸附水蒸气(不同的水气分压下),并于特定水气分压时量测样品的水气吸附率。由图2可知,当水气分压增加至0.2时,水气吸附率快速增加至35wt%,之后则缓慢水气分压增加,水气吸附率可达40wt%以上。显示制备例1的金属有机框架材料在低湿条件下具有高的吸湿能力。低湿度条件下吸附速度比较实施例3分别提供制备例1的金属有机框架材料、吸附材料(购自商品编号a520)、活性氧化铝(购自艾克密国际有限公司)、及4a沸石粉末(购自艾克密国际有限公司)进行低湿度环境下吸附测试。首先,将各样品在80℃下干燥脱附30分钟后,置入25℃下30%rh的恒湿机中,吸附30分钟后量测各样品的水气吸附率,再将相对湿度提升至40%,同样吸附30分钟后量测各样品的水气吸附率,依序将相对湿度增加到90%,以获得吸附曲线,结果如图3所示。由图3可知,制备例1的金属有机框架材料在rh30%吸湿30分钟水气吸附率可达至33wt%,相较于吸附材料(购自商品编号a520)在rh30%吸湿30分钟水气吸附率仅有14wt%。由此可知,在相同时间下购自的吸附材料无法在低湿度下达到快速吸湿的效果。从图3中可进一步观察到,传统吸附材料活性氧化铝、4a沸石粉末同样在80℃下干燥脱附30分钟,但因这些材料孔洞小无法在低温下(80℃)将水完全脱附干净,导致孔洞中仍占满水,因此即便在rh在90%的高湿度环境下水气吸附率皆低于6wt%。这表示该些材料在低湿度下吸湿效果差。实施例4以制备例1的金属有机框架材料、吸附材料(购自商品编号a520)进行低湿度环境下吸附时间比较。同样地将制备例1的金属有机框架材料及吸附材料(购自商品编号a520)分别在80℃下干燥脱附30分钟后,置入25℃下30%rh的恒湿机中观察吸湿的变化。如图4及表4所示,制备例1的金属有机框架材料在25分钟时水气吸附率就可以大于30wt%,反观,吸附材料(购自商品编号a520)必须吸湿60分钟才能达到与制备例1一样的结果(水气吸附率达30wt%),证明制备例1的金属有机框架材料可以在低湿环境下,达到快速吸湿的效果。表4实施例5依实施例4所述的方式进行,差异在于将相对湿度由30%rh增加至80%rh。从图5的结果可知,制备例1的金属有机框架材料吸附10分钟后就能达到水气吸附率大于30wt%的效果(吸附30分钟后水气吸附率可达34wt%),证明制备例1的金属有机框架材料在高湿环境下同样具有不错的吸附能力。实施例6将比较例1、比较例3、及比较例4的金属有机框架材料,先在80℃下干燥脱附30分钟,然后分别置于25℃30%rh环境以及25℃80%rh的环境中,并在30分钟后量测水气吸附率,结果如表5所示。表5制备例1比较例1比较例3比较例4rh80%吸湿30分钟34wt%5.43wt%09.8wt%rh30%吸湿30分钟33wt%0.79wt%06.08wt%由表5可得知,本发明所述的金属有机框架材料,在高湿条件下(rh80%)水气吸附率为34wt%,相较于其他比较例具有较佳的效果。本发明所述的金属有机框架材料,即使在低湿条件下(rh30%),水气吸附率仍可达到33wt%。由前述各实施例中得知,本发明所述的金属有机框架材料,在从低湿度环境到高湿度环境中皆具备高水气吸附率(大于30wt%)。此外,相较于传统吸附剂(如4a沸石、活性氧化铝)需要在较高温度(即约100℃)下才可脱附所吸附的水气,本发明所述的金属有机框架材料可在较低温度下(80℃)轻易脱附所吸附的水气,恢复其水气吸附能力,实现了在低湿度环境下快速吸湿及低温脱附的功效。虽然本发明已以数个实施例公开如上,然其并非用以限定本发明,任何本
技术领域:
中具有通常知识者,在不脱离本发明的精神和范围内,当可作任意的更动与润饰,因此本发明的保护范围当视后附的权利要求书所界定者为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1