一种不需要预包被的神经元细胞培养方法与流程
本发明涉及细胞生物学技术领域,具体涉及一种神经元细胞培养方法,特别涉及一种以蝶翅作为神经元细胞培养基质材料、不需要预包被的神经元细胞培养方法。
背景技术:
神经系统的任务是接收、发放、处理、存储和提取信息,这些任务都是通过其基本单位——神经细胞来完成。由于神经元是形态各异、功能复杂、化学性递质繁多的特化细胞,这就决定了神经元培养的特殊性。神经元是一种较难培养成功的细胞,在体外培养的神经元死亡率较高。现有文献和实验技术操作中提及原代神经元的培养,都建议在培养前,对培养基质(如培养皿、培养板、组织工程材料表面等)进行预先包被,否则神经元不能很好地贴壁粘附生长,死亡率高。用于包被的试剂可以是多聚鸟氨酸、多聚赖氨酸、层粘连蛋白、胶原、鼠尾胶等,这些试剂价格比较贵,需要较长的订货时间,并且需要较复杂的前期处理步骤。例如,通常使用的多聚赖氨酸包被,试剂比较贵,需要在培养神经元前多聚赖氨酸全覆盖培养器皿或基质表面30分钟(室温或37度培养箱中),过夜晾干,然后洗两次,或者只洗一次但是要30分钟接着晾干,以备使用。由于神经元对生长的基质材料表面特性比较敏感,因此,材料表面的包被物可能会对神经元生长特点等产生影响,使实验结果产生偏差,影响材料的应用效果。
技术实现要素:
有鉴于此,本发明的目的在于提供一种不需要预包被的神经元细胞培养方法,该方法利用经过处理的蝶翅作为基质材料进行神经元细胞培养,可以不用预先采用多聚赖氨酸等促粘附试剂包被,就可以直接将分离获得的原代神经元在蝶翅表面进行培养,使神经元生长状态良好,存活率高,可以用于常规实验。
为了解决上述问题,本发明提供了一种不需要预包被的神经元细胞培养方法,该方法采用蝶翅作为神经元细胞培养基质材料,具体包括以下步骤:
s1.将蝶翅以1mol/l的hcl溶液浸没浸泡3小时,双蒸水漂洗多次至ph试纸检测溶液呈中性;
s2.将步骤s1处理得到的蝶翅用2mol/l的naoh溶液浸没蝶翅,40-60°烘箱中放置12-16小时,至蝶翅接近透明,双蒸水漂洗至ph试纸检测溶液呈中性;
s3.将步骤s2处理得到的蝶翅在75%乙醇溶液中浸泡消毒灭菌,然后在超净工作台中无风状态紫外线照射15分钟消毒灭菌;
s4.将步骤s3处理得到的蝶翅以灭菌双蒸水漂浮,按培养器皿及实验需求剪出所需性状大小的蝶翅作为细胞培养基质,将所述细胞培养基质转移至滴有灭菌水的玻片或装有灭菌水的培养器皿中使其漂浮铺展,小心从边缘吸去所述细胞培养基质下方的水,使所述细胞培养基质在玻片或培养器皿表面平整铺展;
s5.将步骤s4处理得到的铺展有所述细胞培养基质的玻片或培养器皿在超净台中无风干燥5分钟后,吸取热的液体状的琼脂在蝶翅边缘筑坝一圈,使冷却后的琼脂将所述细胞培养基质封固在玻片或培养器皿上并在所述细胞培养基质周围边缘处形成坝体;
s6.将神经元细胞悬液滴加于所述细胞培养基质表面所述坝体的内部区域,然后置于37°二氧化碳培养箱内培养。
优选的,所述蝶翅为大蓝闪蝶蝶翅、天堂凤蝶蝶翅和绿鸟翼蝶蝶翅中的一种。
优选的,所述神经元细胞悬液的制备方法具体为:从胚胎18天或新出生1天大鼠脑的海马或皮层区域组织中分离获得原代神经元,将所述神经元以dmem/f12培养基重悬,形成神经元细胞悬液;所述dmem/f12培养基中含有10wt%的fbs和1wt%的青霉素-链霉素。
与现有技术相比,本发明将经过处理的蝶翅作为组织工程材料,用作神经元培养基质材料,可以不用预先采用多聚赖氨酸等促粘附试剂包被,就可以直接将分离获得的原代神经元种在蝶翅表面,经光学显微镜、扫描电子显微镜、激光共聚焦显微镜等多种显微镜下观察拍照可见,神经元生长状态良好,存活率高。
附图说明
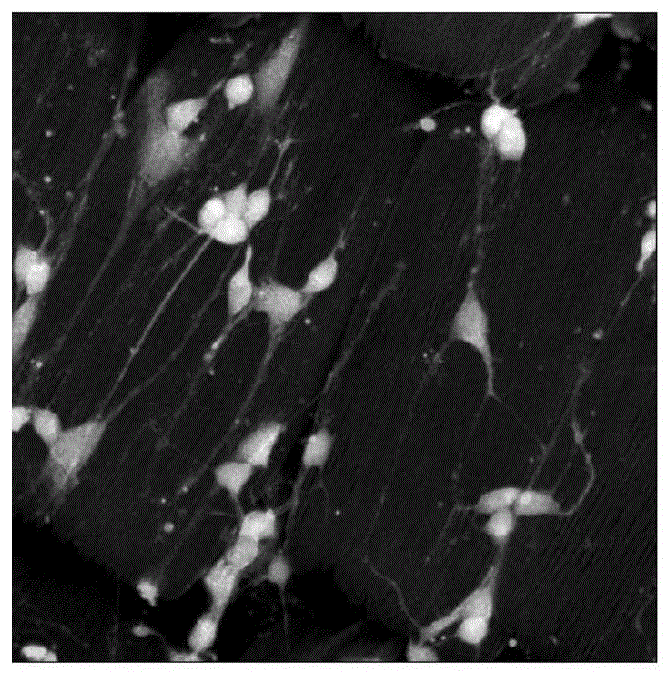
图1为本发明中在大蓝闪蝶上培养的神经元免疫细胞化学染色鉴定图;
图2为本发明中在蝶翅上培养的神经元细胞形态电镜观察。
具体实施方式
为了进一步理解本发明,下面结合实施例对本发明优选实施方案进行描述,但是应当理解,这些描述只是为了进一步说明本发明的特征和优点,而不是对本发明权利要求的限制。
本发明所有原料,对其来源没有特别限制,在市场上购买的或按照本领域技术人员熟知的常规方法制备的即可。
为了进一步理解本发明,下面结合实施例对本发明提供的一种不需要预包被的神经元细胞培养方法进行详细说明,本发明的保护范围不受以下实施例的限制。
实验材料:
新生1天sd大鼠的红皮鼠由南通大学实验动物中心提供。大蓝闪蝶、天堂凤蝶和绿鸟翼蝶均为市售。
细胞种植液:dmem/f12+10%fbs+1%青霉素-链霉素;
无血清培养液:neurobasal+2%b27+1%青霉素-链霉素。
实施例1:将蝶翅处理为细胞培养基质,并在蝶翅边缘筑坝。
分别将大蓝闪蝶、天堂凤蝶和绿鸟翼蝶的蝶翅进行以下处理:
将蝶翅以1mol/l的hcl溶液浸没浸泡3小时,双蒸水漂洗多次至ph试纸检测溶液呈中性;然后用2mol/l的naoh溶液浸没蝶翅,40-60°烘箱中放置12-16小时,至蝶翅接近透明,双蒸水漂洗至ph试纸检测溶液呈中性;再将蝶翅在75%乙醇溶液中浸泡消毒灭菌,然后在超净工作台中无风状态紫外线照射15分钟消毒灭菌;再将蝶翅用灭菌双蒸水漂浮,按培养器皿及实验需求剪出所需性状大小的规则结构区域作为细胞培养基质。
在玻片上预先滴一滴灭菌水,或者再培养皿或培养板中预先加灭菌水,然后用镊子将剪好的蝶翅转移至玻片上或培养器皿(培养板)中,蝶翅漂浮铺展,小心从边缘吸去蝶翅下方的水,使蝶翅在玻片或培养器皿表面平整铺展(不漂浮),然后将放有蝶翅的玻片或培养器皿(培养板)在超净台中无风干燥5分钟,以10微升移液器吸头(玻片上)或100微升移液器吸头(培养器皿或培养板中)吸取热的琼脂液体在蝶翅边缘筑坝一圈,待琼脂冷却后,就可以将蝶翅边缘封固在玻片等培养器皿上,并在蝶翅边缘筑坝。
实施例2:神经元细胞悬液制备
将新生1天红皮鼠置于冰上麻醉后,先用75%酒精浸泡1min消毒,以酒精棉球擦拭鼠头部表面,断头,用无菌眼科剪把皮肤和颅骨剪开,暴露剥离大脑,在其中后1/3的地方轻轻剥离出像月牙状的海马组织,放入盛有预冷无菌pbs的培养皿中,吸管轻轻吹打,使其成为细胞悬液,800rpm离心,5min;吸去上清液,用种植液重悬细胞沉淀,过滤,制成神经元细胞悬液。
实施例3:神经元细胞培养
用细胞计数板计数,将神经元细胞悬液以1×106个/ml密度分别接种在实施例1得到的大蓝闪蝶蝶翅、天堂凤蝶蝶翅和绿鸟翼蝶蝶翅上,于37℃、5%co2细胞培养箱中进行培养。24h后,将种植液全量换成含2%b27的neurobasal无血清培养液培养。细胞培养至48~72h,细胞培养液中每孔加入ara-c20μl(ara-c:浓度为0.3mg/ml,使用时1∶100稀释),摇匀,以后隔3d用neurobasal/b27全量换液。
实施例5:神经元细胞鉴定、观察
利用4%多聚甲醛对分别培养在大蓝闪蝶蝶翅、天堂凤蝶蝶翅和绿鸟翼蝶蝶翅上的神经元细胞进行固定,利用抗神经元细胞表面特异性抗原nf200抗体进行免疫细胞化学染色,对神经元进行鉴定,激光共聚焦显微镜进行细胞形态观察和拍照。结果如图1所示,神经元在未经包被的蝶翅上能很好地贴壁生长,具有典型的神经元形态,具数只不规则的伪足,呈nf200阳性。
利用戊二醛对培养在蝶翅上的神经元细胞进行固定,采用扫描电子显微镜观察神经元细胞胞体表面及突起。结果如图2所示,电镜下,神经元细胞在三种未经包被的不同类型蝶翅上均呈良好贴壁生长状态,从胞体向周围伸出不规则的伪足样突起。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可作出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
- 还没有人留言评论。精彩留言会获得点赞!