一种肿瘤抗原特异性肿瘤浸润性T细胞的分离方法与流程
本发明属于细胞培养技术领域,尤其是涉及一种肿瘤抗原特异性浸润性淋巴细胞的分离培养方法。
背景技术:
目前,肿瘤的治疗进入了一个瓶颈阶段,因此,我们在不断革新传统的肿瘤治疗方法时,应积极寻求新的肿瘤治疗手段。2013年肿瘤免疫疗法被《科学》杂志评为最重大的科学突破,并已成为与手术、放疗和化疗并列的肿瘤第四大治疗模式,肿瘤免疫治疗正在表现出对抗肿瘤的巨大潜力。随着“精准医疗计划“的提出,肿瘤精准细胞免疫治疗也应运而生,并有望成为肿瘤精准治疗的重要突破口,而肿瘤浸润的淋巴细胞(tumorinfiltratinglymphocytes,til)因其对肿瘤细胞具有较强的特异性杀伤作用也成为肿瘤精准细胞免疫治疗的研究热点之一。
til是肿瘤抗原诱导的,主要存在于肿瘤间质的异质性淋巴细胞群,是由nih的rosenberg在90年代中期发明的,他直接从手术切除的肿瘤组织中分离扩增淋巴细胞用于黑色素瘤患者回输,同时配合化疗和高浓度il-2,能够使20%黑色素瘤患者达到完全缓解的状态,持续时间超过3年(rosenbergsa,etal.clincancerres,2011;17(13):4550–7)。随后til的临床应用越来越广泛。2015年,baldanv等利用til联合化疗治疗120例晚期肾癌患者中,总缓解率为38%,其中完全缓解13例(11%)、部分缓解32例(27%),18例部分缓解患者的肿瘤缩小了90%,完全缓解患者无瘤期为7~8个月(brjcancer,2015,112:1510-1518)。deniger等2017年研究纳入11例晚期恶性黑色素瘤患者,非清髓后给予til和trametinib联合治疗,结果3年内11例患者中有7例有临床症状部分缓解,2例患者临床症状完全缓解(clincancerres,2017,23:351-362)。
目前临床应用的til细胞主要来源于两个方面:(1)手术切除的肿瘤组织或淋巴结;(2)癌性胸腹水。从手术样品分离til细胞一般需要经过机械剪切或蛋白酶消化等步骤后,再利用ficoll分离得到单个核细胞,而癌性胸腹水来源的til细胞分离相对简单,可直接通过ficoll进行分离。传统的til细胞的分离培养包括以下步骤:
(1)从肿瘤患者肿瘤组织剪切或消化后或癌性胸腹水中利用ficoll分离得到单个核细胞;
(2)将所得到的单个核细胞加入til细胞培养基中,再加入扩增因子,然后置于37℃、5%co2培养箱中培养,进行til细胞的扩增培养。
2014年,rosenberg连续在顶级期刊science和jci上发表文章,论证til技术有效的原因是因为这些til细胞中存在针对肿瘤抗原的特异性t细胞克隆,主要为cd8+效应性t细胞。这群cd8+til细胞表面tcr包含了一组针对肿瘤相关抗原和独特的新抗原的特异性内源性多克隆库,在适当的环境下,肿瘤内浸润的这些cd8+t细胞是有针对性的抗肿瘤反应的效应器。takashi等的研究发现这群活化了的cd8+til细胞在肿瘤中由于自身ifn-γ分泌的增加及肿瘤免疫抑制微环境的影响,表面持续性高表达pd-1抑制性受体。这群pd-1阳性表达的cd8+til细胞代表了肿瘤中免疫反应性的细胞克隆(grosa,etal.jclininvestig.2014;124(5):2246–59)。而rosenberg等人也再次在体外验证了cd8+pd-1+的til细胞群与cd8+pd-1-的til细胞群相比具有更强肿瘤特异性杀伤活性。macleanhall等发现,这群在肿瘤微环境中pd-1呈高表达的处于免疫抑制状态的til细胞,在体外培养的过程加入抗pd-1抗体进行pd-1信号阻断后,pd-1的表达水平降低至约6.1%左右(macleanhall,journalforimmunotherapyofcancer(2016)4:61)。因此,从肿瘤组织或胸腹水中获取这群cd8+pd-1+的til细胞,再经过体外大量扩增活化,所获取的细胞应用于临床肿瘤特异性免疫治疗或联合其他肿瘤治疗方案是可行的,对于提高免疫评分较低、肿瘤微环境中浸润性淋巴细胞数量较少的“冷”肿瘤免疫治疗的疗效及预防肿瘤术后复发和转移将具有重大的临床意义。
然而,采用传统的方法分离培养的til细胞是以cd4+和cd8+t细胞为主的异质性细胞混合体。因此,本发明针对体外获取的til细胞的异质性,提供了一种肿瘤特异性til细胞的分离培养方法。
技术实现要素:
依上所述,肿瘤周围浸润的细胞中,cd8+pd-1+的til细胞群具有更强肿瘤特异性杀伤活性。本发明以cd8、pd-1作为获取针对肿瘤抗原的til细胞亚群的分选标记,利用流式分选的方法,将cd8+pd-1+til细胞从肿瘤组织或癌性胸腹水获取的til细胞群中分选出来,在体外通过利于cd8+t细胞高效扩增活化的细胞因子组合剂大量扩增该群细胞,获取大量肿瘤特异性的cd8+效应性t细胞。
本发明是通过以下技术方案实现的:
肿瘤抗原特异性肿瘤浸润性t细胞(tumorinfiltratinglymphocytes,til)的分离培养方法,包括以下步骤:
步骤一:肿瘤组织单细胞悬液的制备,即从肿瘤组织块或癌性胸腹水中获取含有肿瘤特异性til细胞的单细胞悬液;
步骤二:将所得的单细胞悬液加入高效扩增剂1中培养1-4d;
步骤三:使用流式分选细胞技术对步骤二中的细胞悬液进行分离,得到肿瘤抗原特异性til细胞;
步骤四:将分选所获得的肿瘤抗原特异性til细胞加入高效扩增剂2在体外继续进行扩增培养,得到大量的具有肿瘤特异性杀伤活性的til细胞。
所述的步骤一具有以下分步骤:
取肿瘤组织块,去除坏死组织和血管、包膜,用无菌剪刀剪成1cm2左右小块组织,再慢慢剪碎简称肉糜状,加入5ml含组织消化酶组合剂的1640细胞培养基,缓慢摇晃4-6小时,可见肿瘤组织已消化成糜状后,用100um细胞滤网过滤去除细胞团块,得到单个细胞悬液;加入50mlgt-t551h3培养基重悬;将肿瘤组织中获得的单个细胞悬液用ficoll淋巴细胞分离液进行密度梯度分离,获得单个核细胞;
或直接取癌性胸腹水用ficoll淋巴细胞分离液进行密度梯度分离,获得单个核细胞沉淀。
所述的步骤二具体操作如下:将所得的单个核细胞沉淀加入gt-t551h3细胞培养基重悬,调整细胞浓度为5×105-1×106/ml,并加入促til细胞高效扩增剂1,置于6孔细胞培养板中,2ml/孔,37℃,5%co2条件下培养1-4d进行快速扩增。
所述步骤三具体操作如下:将步骤二所得的单个核细胞离心收集后,按1×106/ml的浓度将细胞沉淀重悬于pbs缓冲液中,然后按照106细胞加入1ug/ul抗体的比例,加入cd8-ecd抗体5-100ul、pd-1-pe抗体5-100ul、cd4-fitc抗体5-100ul抗体进行标记30分钟,然后加入pbs缓冲液洗涤、重悬后上机检测并按照贝克曼mofloxdp流式分选仪的操作步骤进行分选,收集cd8+pd-1+肿瘤抗原特异性的til细胞。
所述步骤四具体操作如下:
子步骤1:将步骤三所得的cd8+pd-1+til细胞亚群离心后,细胞沉淀加入gt-t551h3细胞培养基调整细胞浓度为1×106/ml,加入促til细胞高效扩增剂2,置于75cm2细胞培养瓶中,37℃,5%co2条件下继续进行培养。
子步骤2:根据细胞扩增的情况进行扩瓶培养,扩增所加的培养基为含有终浓度300u/mlil-2的gt-t551h3培养基;
子步骤3:培养至第15-20天,细胞不再呈指数扩增时,收集获得最终的肿瘤特异性til细胞,利用实时无标记细胞功能分析仪检测杀瘤活性。
所述组织消化酶组合剂在1640细胞培养基中包括以下终浓度成分:2-10mg/ml胶原酶,
0.1-5mg/ml透明质酸酶,10-500u/mldna酶i。
所述促til细胞高效扩增剂1的成分包括il-2、ifn-γ、cd3抗体中的一种或多种;所述gt-t551h3细胞培养基中il-2浓度为1000-5000u/ml,所述的ifn-γ浓度为500-2000u/ml,所述的cd3单抗浓度为0.1-10ug/ml。
所述流式检测肿瘤特异性til细胞细胞标记所用的cd4抗体为fitc荧光染料标记、cd8抗体为ecd荧光染料标记、pd-1为pe荧光染料标记;作为本发明的进一步改进,所述的流式分选肿瘤特异性til细胞所用的标记抗体为cd8、pd-1两种抗体。采用此方案分选出的肿瘤特异性til细胞纯度可达85-95%。
作为对此技术方案的进一步优化,为了提升细胞扩增速度,优化扩增后的细胞功能,所述促til细胞高效扩增剂2为含500-5000u/mlil-2、0.5-300ug/mlil-15、0.5-300ug/mlil-7、0.5-30ug/ml抗pd-1单抗的gt-t551h3细胞培养基,采用此优选的技术方案,使得分选后肿瘤特异性cd8+til细胞在体外获得高效扩增,扩增倍数可达100-1000倍,最大倍数细胞扩增培养时间约15-20天。
进一步地,将上述方法应用于制备肿瘤抗原特异性til细胞中。
与现有技术技术相比,本发明的有益效果为:
til细胞中存在针对肿瘤抗原的特异性t细胞克隆,主要为cd8+效应性t细胞。针对目前体外分离获得的til细胞存在异质性的问题,为了提高分离后的til细胞的肿瘤特异性,本发明技术利用cd8、pd-1两种抗体作为分选针对肿瘤抗原的til细胞克隆的标记,通过流式细胞技术获取cd8+pd-1+til细胞亚群,并在体外利用细胞因子组合剂高效扩增该细胞亚群,从而获得更具有肿瘤特异性的til细胞亚群,以便临床推广应用。
流式细胞术(flowcytometry,fcm)是单克隆抗体、免疫细胞化学技术、荧光标记、激光技术和电子计算机科学等高度发展及综合利用的高技术产物。利用流式细胞术进行细胞分选的优势在于测量速度快,最快可在1秒内计测数万个细胞,有利于减少污染并保持细胞活性,同时流式细胞术可对同一个细胞同时做有关物理、化学特性的近100种参数测定,减少损耗,且所分选出的细胞纯度可达85-95%。为了提高流式分选的细胞得率和活性,以便于后期扩增培养,本发明从肿瘤中分离出til细胞后,先在体外采用大剂量il-2、ifn-γ及cd3抗体进行快速扩增1-4d后,再进行细胞分选。其中cd3抗体可使t细胞增殖,促进其分泌多种细胞因子如il-2、tnf-α、csf、ifn-γ等,而il-2细胞因子对于t细胞活性的持久性和增殖至关重要。
本发明采用高效扩增细胞因子组合剂2包括il-2、il-15、il-7细胞因子与抗pd-1单抗组合,对分选后cd8+pd-1+til细胞亚群进行高效快速扩增。il-15具备一些il-2不具备的优势,如il-15能激活和扩增cd8+t细胞,不激活调节性t淋巴细胞(regulatorytcells,tregs),并解除tregs对t细胞的抑制作用(alenzifq,etal.jmedlife,2011,(04):399-406)。il-7是cd8+t细胞的另一种有效的生长、激活和生存因子,可以提高cd8+t细胞的抗肿瘤能力,而pd-1信号的抑制可增强肿瘤特异性til细胞的扩增(mazzucchellir,etal.nat.rev.immunol.2007,7:144–154)。因此,本发明在传统利用高剂量il-2扩增til细胞的基础上,增加了il-15、il-7两种利于cd8+t细胞高效扩增的细胞因子,并通过抗pd-1抗体来阻断pd-1信号,以提高cd8+til细胞亚群的获得率。
通过本发明技术的改进,获得了纯度较高的肿瘤特异性cd8+til细胞亚群,细胞活性也大大提高,且细胞数量多,操作简单易行,细胞培养周期明显缩短,有望成为实现肿瘤精准细胞免疫治疗的一种手段,便于临床推广使用。体外实验证实利用本发明制备til细胞具有更强的特异性杀伤肿瘤活性,如若应用于临床,或与抗pd-1/pd-l1单抗联合应用,对于提高免疫评分较低的“冷”肿瘤的疗效,延长肿瘤患者术后复发和转移时间,提高患者的生存期和生活质量将具有重大意义。
附图说明
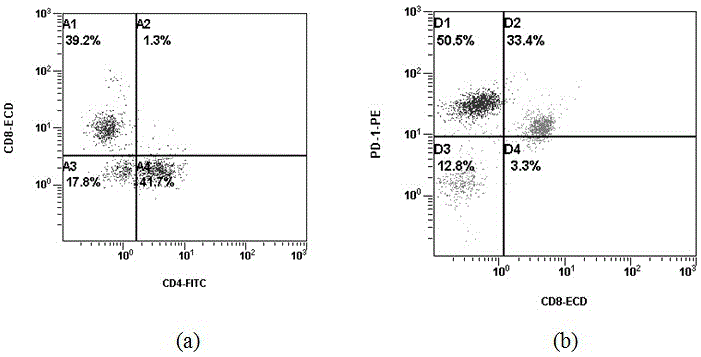
图1实施例1中从黑色素瘤患者肿瘤组织中分离的til细胞表型;其中a为cd4-fitc/cd8-ecd;b为cd8-ecd/pd-1-pe。
图2从实施例1分离的cd8+pd-1+til细胞体外经过il-2、il-15、il-7及抗pd-1抗体扩增培养20天后,显微镜下观察的细胞形态图。
图3流式检测实施例1与其对比例的细胞表型结果;其中a为实施例1中cd8+pd-1+til-il-2+il-15+il-7+pd-1细胞,b为til-il-2+il-15+il-7+pd-1细胞;c为til-il-2细胞。
图4流式检测实施例1与其对比例的细胞内细胞因子分泌能力结果;其中a为实施例1中cd8+pd-1+til-il-2+il-15+il-7+pd-1细胞;b为til-il-2+il-15+il-7+pd-1细胞;c为til-il-2细胞。
图5实施例2中从膀胱癌患者腹水中分离的til细胞表型;其中a为cd4-fitc/cd8-ecd;b为cd8-ecd/pd-1-pe。
图6流式检测实施例2与其对比例的细胞表型结果;其中a为实施例2中cd8+pd-1+til-il-2+il-15+il-7+pd-1细胞;b为til-il-2+il-15+il-7+pd-1细胞;c为til-il-2细胞。
图7流式检测实施例2与其对比例的细胞内细胞因子分泌能力结果;其中a为实施例2中的cd8+pd-1+til-il-2+il-15+il-7+pd-1;b为til-il-2+il-15+il-7+pd-1细胞;c为til-il-2细胞。
图8细胞增殖曲线;
图9rtca检测实施例1与其对比例对同源肿瘤细胞的杀伤活性。
具体实施方式如下
下面结合附图,对本发明的实施做进一步的详细说明。
流式检测til细胞表型的方法,具体操作步骤如下:
取til细胞悬液,pbs将细胞浓度调整为1×106个/ml,按1ug抗体/106个细胞的比例分别加入cd4-fitc、cd8-ecd及pd-1-pe流式标记抗体,避光孵育30min后,加入1mlpbs洗涤细胞两遍后,弃上清,细胞沉淀重悬于1mlpbs中,并上机检测。
流式检测til细胞内细胞因子分泌能力,具体操作步骤如下:
步骤一:收集til细胞,pbs将细胞浓度调整为2×106个/ml,使用pma(10ng/ml)刺激细胞6小时;
步骤二:将细胞重悬于含10%灭活血清的pbs中,封闭fc抗体;
步骤三:cd8-ecd抗体进行细胞表面染色20min,离心500g,5min,弃上清;
步骤四:加入固定剂(剂量参照说明书pnim2716u及pnim3279u,beckman公司),室温暗处孵育15min,加入2-3mlpbs,离心500g,5min,弃上清;
步骤五:加破膜剂(剂量参照说明书),室温暗处孵育10min,加入2-3mlpbs,离心500g,5min,弃上清;加入ifn-γ-pc7及tnf-α-pc5抗体染色30min,加入2-3mlpbs,离心500g,5min,弃上清,500ul含2%多聚甲醛pbs重悬固定细胞,进行流式检测。
实施例1:
黑色素癌患者肿瘤组织中肿瘤抗原特异性til细胞的分离培养,包括以下步骤:
(1)取黑色素瘤患者(王××,女,81岁)肿瘤组织,去除正常组织和坏死组织,用手术剪刀将肿瘤组织剪碎后,加入5ml无血清rpmi1640(含2mg/ml胶原酶、5mg/ml透明质酸酶、100u/mldna酶i),缓慢摇晃孵育约6小时,可见肿瘤组织已消化成糜状,用100um细胞过滤网去除细胞团块,得到单个细胞悬液;
(2)将所得的单个细胞悬液离心沉淀后,细胞沉淀加入50mlgt-t551h3培养基重悬;
(3)取15ml离心管制备2级密度梯度分离液(下层为100%ficoll,上层为75%ficoll与25%rpmi1640的混合液);
(4)将(2)中所得的单个细胞悬液加入(3)中所制备的2级分离液最上层,2000rpm/min离心30min后,取上层与中间层之间的细胞,此为富集的肿瘤细胞;取中间层与下层之间的细胞,此为单个核细胞悬液,所获得的单个核细胞总数约为3×106;
(5)将所得单个核细胞沉淀重悬于加入gt-t551h3细胞培养基调整细胞浓度为5×105/ml,同时加入终浓度5000u/mlil-2、10ug/mlcd3单抗、2000u/mlifn-υ,置于6孔细胞板中培养,2ml/孔,37℃,5%co2条件下培养2d进行快速扩增;
(6)离心收集(5)中的细胞,按1×106/ml的浓度将细胞沉淀重悬于pbs中,约15ml。按照106细胞加入1ug抗体的比例,加入cd4-fitc、cd8-ecd、pd-1-pe抗体各15ul进行标记30分钟后,加入35mlpbs,混匀后,离心收集细胞沉淀,并加入15mlpbs重悬细胞;
(7)按照贝克曼mofloxdp流式分选仪的操作步骤进行细胞表型分析,分选收集肿瘤特异性cd8+pd-1+til细胞;结果如图1所示,在体外培养2d后,til细胞中cd8+细胞比例占39.2%,cd4+细胞比例占41.7%,而cd8+pd-1+til细胞的比例约占33.4%。(8)将所收集的cd8+pd-1+til细胞亚群离心后,细胞沉淀加入gt-t551h3细胞培养基调整细胞浓度为1×106/ml,加入含5000u/mlil-2、0.5ug/mlil-15、0.5ug/mlil-7、1ug/ml抗pd-1单抗的gt-t551h3细胞培养基,置于75cm2细胞培养瓶中,37℃,5%co2条件下继续进行培养;
(9)根据细胞扩增的情况进行扩瓶培养,扩增所加的培养基为含有终浓度300u/mlil-2的gt-t551h3培养基;
(10)在实施例1的细胞(以下简称cd8+pd-1+til-il-2+il-15+il-7+pd-1)培养的第20天,显微镜下观察细胞并拍照(如图2所示)。收集细胞,流式进行细胞表型鉴定,并检测其细胞因子分泌能力水平,并与对比例未分选的til细胞(以下简称til-il-2+il-15+il-7+pd-1)及对比例til细胞仅以5000u/mlil-2细胞因子进行体外扩增(以下简称til-il-2)进行对比,结果如图3和图4所示。
图1所示,从黑色素瘤患者肿瘤组织中分离的til细胞中,cd8+til细胞占39.2%(如图1a所示),其中cd8+pd-1+til的比例高达33.4%(如图1b所示)。采用本技术改进分选出的cd8+pd-1+til细胞在体外经过il-2、il-15、il-7细胞因子及抗pd-1单抗扩增培养20天后,基本为纯化的cd8+t细胞,其中cd8+pd-1+的比例下降为10.2%(如图3a所示),同时与对比例相比细胞内分泌ifn-γ的能力相对较高,约为34%(如图4a所示),说明分选后cd8+til细胞在体外培养的过程中从原先的“耗竭”状态逐渐恢复了细胞的活化功能。
图3a为实施例1中cd8+pd-1+til-il-2+il-15+il-7+pd-1细胞在体外培养20天后,流式鉴定的细胞表型。基本为纯化的cd8+til细胞,其中cd8+pd-1+til细胞的比例下降至10.2%。图3b、图3c分别为实施例1中对照例til-il-2+il-15+il-7+pd-1及til-il-2培养后的细胞表型,从图3b中可见,til-il-2+il-15+il-7+pd-1组中cd8+pd-1+til细胞的比例下降至15.5%;从图3c中可见,对照例til-il-2组细胞培养后cd8+pd-1+的比例高达30.9%。说明流式分选后cd8+pd-1+til细胞经过长时间培养所得的细胞基本为纯化的cd8+til细胞;il-2、il-15、il-7细胞因子及抗pd-1单抗组合有利于cd8+t细胞的扩增;在pd-1阻断剂的作用下,til细胞在体外经过长时间的培养,cd8+pd-1+til的比例会有所下降。
如图4a所示,实施例1培养的cd8+pd-1+til-il-2+il-15+il-7+pd-1细胞内分泌ifn-γ的水平达34.0%,分泌tnf-α的水平较低,约4.5%。如图4b-4c所示,对比例中til-il-2+il-15+il-7+pd-1细胞分泌ifn-γ的水平为20.2%,分泌tnf-α的水平也较低,约6.9%,而对比例til-il-2分泌ifn-γ的水平较低,约19.3%;分泌tnf-α的水平约8.0%。说明il-2、il-15、il-7细胞因子及抗pd-1单抗组合更有利于cd8+til体外细胞活化。
实施例2:
膀胱癌患者腹水中肿瘤抗原特异性til细胞的分离培养,包括以下步骤:
(1)取15ml离心管制备2级密度梯度分离液(下层为100%ficoll,上层为75%ficoll与25%rpmi1640的混合液);
(2)取膀胱癌患者(黄××,女,76岁)癌性腹水100ml,加入(1)中所制备的2级分离液最上层,2000rpm/min离心30min后,取上层与中间层之间的细胞,此为富集的肿瘤细胞;取中间层与下层之间的细胞,此为单个核细胞悬液,离心收集所得的单个核细胞,细胞总数约1×107;
(3)将细胞沉淀重悬于加入gt-t551h3细胞培养基调整细胞浓度为1×106/ml,同时加入5000u/mlil-2、0.1ug/mlcd3单抗、2000u/mlifn-γ,置于6孔细胞板中培养,2ml/孔,37℃,5%co2条件下培养4d进行快速扩增;
(4)离心收集(3)中的细胞,按1×106/ml的浓度将细胞沉淀重悬于pbs中,约100ml。按照106细胞加入1ug抗体的比例,加入cd4-fitc、cd8-ecd、pd-1-pe抗体各100ul进行标记30分钟后,加入370mlpbs,混匀后,离心收集细胞沉淀,并加入100mlpbs重悬细胞;
(5)按照贝克曼mofloxdp流式分选仪的操作步骤进行表型分析(结果如图5),分选并收集肿瘤抗原特异性cd8+pd-1+til细胞;结果表明,在体外培养4d后til细胞中cd8+细胞比例占52.3%,cd4+细胞比例占19.3%,而cd8+pd-1+til细胞的比例约为49.4%。
(6)将所收集的cd8+pd-1+til细胞亚群离心后,细胞沉淀加入gt-t551h3细胞培养基调整细胞浓度为1×106/ml,加入含500u/mlil-2、3ug/mlil-15、3ug/mlil-7、3ug/ml抗pd-1单抗的gt-t551h3细胞培养基,置于75cm2细胞培养瓶中,37℃,5%co2条件下继续进行培养。
(7)根据细胞扩增的情况进行扩瓶培养,扩增所加的培养基为含有300u/mlil-2的gt-t551h3培养基。
(8)大约培养至15天左右,细胞不再呈指数扩增时,收集所培养的cd8+pd-1+til-il-2+il-15+il-7+pd-1细胞,流式进行细胞表型鉴定,并检测其细胞因子分泌能力水平,并与对比例til细胞进行对比,结果如图6和图7所示。
图5a和图5b所示,从膀胱癌患者腹水中分离的til细胞中,cd8+til细胞占52.3%,其中cd8+pd-1+til的比例高达49.4%。采用本技术改进分选出的cd8+pd-1+til细胞在体外经过il-2、il-15、il-7等细胞因子及抗pd-1抗体扩增培养15天后,基本为纯化cd8+t细胞,而其中cd8+pd-1+的比例下降为12.7%(如图6a所示),同时与对比例相比细胞内分泌ifn-γ的能力相对较高,约为44.5%(如图7a所示),说明分选后cd8+til细胞在体外培养的过程中从原先的“耗竭”状态逐渐恢复了细胞的活化功能。
如图6a所示,实施例2中cd8+pd-1+til-il-2+il-15+il-7+pd-1细胞培养后,基本为纯化的cd8+til细胞,其中cd8+pd-1+til细胞中的比例下降为12.7%。图6b和图6c为对照例til-il-2+il-15+il-7+pd-1、til-il-2组的细胞表型,如图6b所示,til-il-2+il-15+il-7+pd-1细胞经过15天培养之后,cd8+pd-1+til细胞的比例降低至15.8%;图6c为对照例til-il-2细胞中cd8+pd-1+til细胞的比例高达42.3%。进一步证明流式分选后cd8+pd-1+til细胞经过长时间培养所得的细胞基本为纯化的cd8+til细胞;il-2、il-15、il-7细胞因子及pd-1阻断剂组合有利于cd8+t细胞的扩增;pd-1阻断剂组合更有利于cd8+til体外细胞活化,在体外经过长时间的培养,cd8+pd-1+til的比例会有所下降。
如图7所示,实施例2中cd8+pd-1+til-il-2+il-15+il-7+pd-1细胞内分泌ifn-γ的水平达44.5%,分泌tnf-α的水平较低,约1.3%(图7a);与实施例相比,对比例til-il-2+il-15+il-7+pd-1细胞分泌ifn-γ的水平较低,约29.6%,分泌tnf-α的水平约0.8%(图7b),而对比例til-il-2细胞分泌ifn-γ的水平比实施例更低,为20.8%,分泌tnf-α的水平分别5.6%(图7c)。进一步说明il-2、il-15、il-7细胞因子及pd-1阻断剂组合更有利于cd8+til细胞体外活化。
实施例3
实时无标记细胞功能分析仪(realtimecellularanalysis,rtca)检测杀瘤活性,具体操作步骤如下:
步骤一:自体肿瘤细胞
取上述实施例1肿瘤组织中获得的细胞悬液加入所制备的2级密度梯度分离液(下层为100%ficoll,上层为75%ficoll与25%rpmi1640的混合液)最上层,2000rpm/min离心30min后,收集最上层与中间层之间的细胞,此为富集的肿瘤细胞;用pbs洗涤细胞两遍后,用含10%fbs的dmem培养基重悬细胞,并调整细胞浓度为2×104/ml,加入到25cm2细胞培养瓶中,37℃,5%co2条件下进行贴壁培养,根据细胞的生长情况进行贴壁细胞的扩增;
步骤二:对比例中未分选til细胞的培养(til-il-2+il-15+il-7+pd-1)
取上述实施例1中于6孔细胞板中培养的未分选的til细胞,根据细胞扩增情况进行扩瓶培养,扩增所加的培养基与实施例1cd8+pd-1+til细胞培养基相同。
步骤三:对比例中til细胞只加入il-2细胞培养(til-il-2)
取上述实施例1中未分选后的til细胞只加入5000u/mlil-2进行扩增培养。
图8为细胞增殖曲线,横坐标表示细胞培养天数,纵坐标表示细胞数。如图所示,在il-2、il-15及il-7细胞因子及pd-1阻断剂的作用下,cd8+til细胞增殖速度最快,而同样培养条件的未分选的til细胞位于其次。然而,在仅有il-2细胞因子作用的情况下,til细胞的增殖速度相对较慢,说明il-2、il-15及il-7细胞因子组合及pd-1阻断剂可促进til细胞增殖,尤其有利于cd8+t细胞的扩增。
步骤四:rtca检测实施例1中cd8+pd-1+肿瘤特异性til细胞(cd8+pd-1+til-il2+il-15+il-7+pd-1)、对比例til-il-2+il-15+il-7+pd-1及对比例til-il-2杀瘤活性,具体操作如下:
子步骤一:向e-plate检测板中加入培养基并测定背景阻抗值;
子步骤二:收集步骤一中所获得的对数期自体肿瘤细胞作为靶细胞并计数,调整细胞悬液浓度,
向e-plate检测板中加入一定体积的细胞,1×105/孔,室温超净台内放置30min;
子步骤三:将加入细胞的e-plate检测板放入检测台上(检测台预先放入培养箱中),进实时动态的细胞增殖检测。
子步骤四:过夜检测后,向各培养孔中分别加入实施例cd8+pd-1+til-il2+il-15+il-7+pd-1、对比例til-il-2+il-15+il-7+pd-1及对比例til-il-2作为效应细胞,效靶比20:1,并继续进行检测,即可获得实时的细胞效应曲线(结果见图9)。
从图9可见,实施例1cd8+pd-1+til-il2+il-15+il-7+pd-1和对比例til-il-2+il-15+il-7+pd-1及til-il-2效应细胞在与靶细胞同等效靶比的情况下,相比于对比例,采用本发明的方法扩增获得的肿瘤抗原特异性cd8+til效应细胞具有更特异的肿瘤杀伤活性。说明采用本发明方案所采用的细胞因子组合可增强cd8+til的肿瘤特异性杀伤活性,将其命名为肿瘤抗原特异性til细胞。
结论:从以上分析结果可见,采用本发明技术分离获得的肿瘤特异性cd8+pd-1+til细胞在体外扩增培养后,细胞被充分活化并迅速扩增,本方法体外扩增培养时间短,操作简单易行,可适用于临床推广。
以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,各实施方式中技术方案可以适当组合,都应当视为属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!