生产免疫偶联物的方法与流程
发明背景发明领域本发明提供制备活性免疫偶联物、包括抗cd22免疫偶联物的方法。合适地,该方法包括分批进料过程和/或柱洗脱过程,相比未利用该方法的其他过程这些过程使得免疫偶联物产率增加。
背景技术:
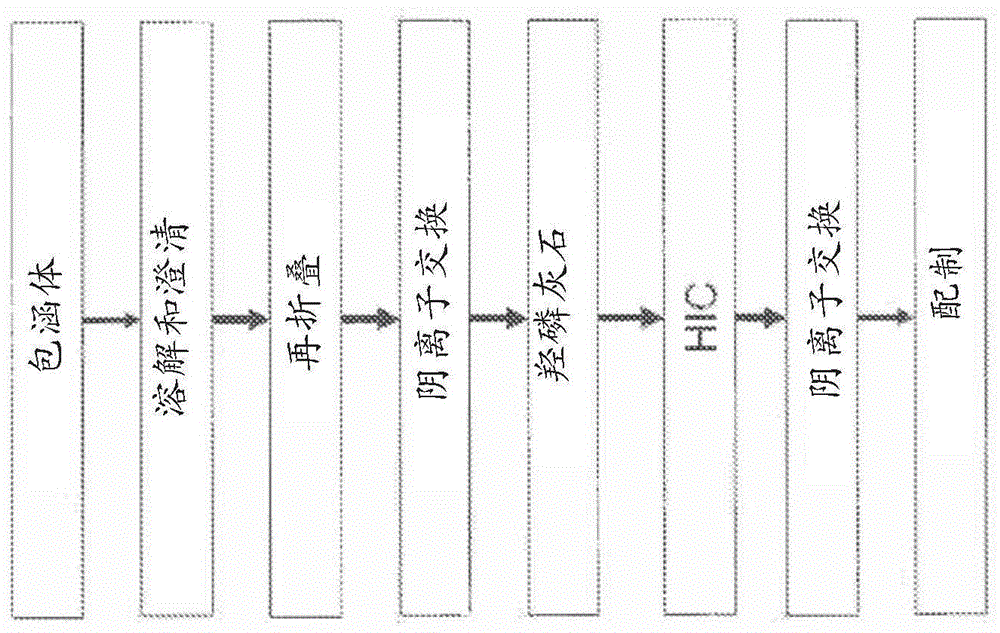
:大规模、经济的蛋白质纯化是生物制药行业生产中的一个重要因素。治疗性蛋白质典型地是使用原核或真核细胞系产生的,这些细胞系经过工程化处理以表达来自一种重组质粒的感兴趣的蛋白质,该质粒包含编码该蛋白质的基因。将所希望的蛋白质从被送至细胞的组分和细胞副产物的混合物中以足够纯度(例如足以用作一种人类治疗物的纯度)进行分离由于多个原因对生物制品制造商提出了严峻的挑战。基于蛋白质的药物产物的制造商必须遵守严格的监管标准,包括极为严格的纯度要求。为了确保安全性,监管机构(如美国食品与药品监督管理局(fda))要求基于蛋白质的药物产品基本上不含杂质,包括与产物相关的污染物(如聚集体)、该重组蛋白的片段和变体以及与过程相关的污染物(如宿主细胞蛋白、培养基组分、病毒、dna以及外毒素)。尽管在生物制药行业可以获得并广泛使用不同的蛋白质纯化方案,但他们典型地包括一个亲和纯化步骤,例如对于抗体而言进行蛋白a纯化,以便达到药学可接受的纯度。开发一个可适用于特定生物分子和不同生物分子两者的纯化方案(该方案是成规模的、可控的,并且提供了高产率的纯化生物分子)将允许在整个药物开发过程的非常早期的阶段将其整合至产品开发过程中。因此,令人希望的并且有利的是提供简单且有效的过程,该过程能产生具有高质量和高安全性的药物物质。发明概述在一个实施例中,提供制备活性免疫偶联物的方法。合适地,该免疫偶联物在一个或多个残基处脱酰胺化,并且该脱酰胺化作用导致该免疫偶联物效力的抑制。合适地,该方法包括在分批进料过程中再折叠该免疫偶联物并且在一个或多个色谱柱上纯化该再折叠的免疫偶联物。在制备活性免疫偶联物的其他实施例中,其中所述免疫偶联物在一个或多个残基处脱酰胺化,并且其中所述脱酰胺化作用导致所述免疫偶联物效力的抑制,该方法包括再折叠所述免疫偶联物并且使用双循环洗脱在离子交换柱上纯化该再折叠的免疫偶联物,其中在第一次洗脱和第二次洗脱之间利用剥离缓冲液剥离该柱,该剥离缓冲液包含乙醇胺、精氨酸、乙二胺四乙酸(edta)、尿素以及二硫苏糖醇(dtt)。在该方法的实施例中,再折叠该免疫偶联物包括具有9.5或更小的ph的再折叠缓冲液。合适地,该免疫偶联物包含抗体或其抗原结合片段,例如抗体或抗原结合片段包括fab、fab'、f(ab')2、fd、单链fv或scfv、双硫化物连接的fv、v-nar结构域、ignar、内抗体(intrabody)、iggδch2、迷你抗体、f(ab')3、四体抗体(tetrabody)、三体抗体(triabody)、双体抗体(diabody)、单一结构域抗体、dvd-ig、fcab、mab2、(scfv)2、或scfv-fc。在示例性中,该抗体或抗原结合片段结合细胞表面受体,合适地是cd22。合适地,免疫偶联物包含毒素,例如毒素包括但不限于绿脓杆菌外毒素、蓖麻毒素、相思豆毒素、白喉毒素及其亚单位,连同肉毒杆菌毒素a至f和变体、以及它们的衍生物。在示例性实施例中,该毒素是绿脓杆菌外毒素或其变体,它合适地具有选自下组的氨基酸序列,该组由以下各项组成:seqidno:16至22。在实施例中,该抗体或其抗原结合片段包含vh和vl序列,合适地该vh序列选自下组,该组由以下各项组成:seqidno:6至11,并且该vl序列选自下组,该组由以下各项组成:seqidno:2以及12至15。在示例性实施例中,该免疫偶联物包含抗cd22抗体或其抗原结合片段以及pe或其变体,合适地该免疫偶联物是moxetumomabpasudotox免疫毒素,该免疫毒素包含seqidno:1的vh-pe38亚单位以及seqidno:2的vl亚单位。在实施例中,该再折叠缓冲液具有9.4的ph。在合适的实施例中,该分批进料过程使用约52ml溶解的包涵体每l再折叠缓冲液每小时至约13ml溶解的包涵体每l再折叠缓冲液每小时的添加速率,更合适地约35ml溶解的包涵体每l再折叠缓冲液每小时至约17ml溶解的包涵体每l再折叠缓冲液每小时的添加速率,或约30ml溶解的包涵体每l再折叠缓冲液每小时至约18ml溶解的包涵体每l再折叠缓冲液每小时的添加速率,或约26ml溶解的包涵体每l再折叠缓冲液每小时的添加速率。合适地,在各种方法中使用的剥离缓冲液包含约30至60mm乙醇胺、约0.25至约0.75m精氨酸、1至3mmedta、约7至9m尿素以及约9至11mmdtt。还提供包含具有小于约25%与约1%之间的脱酰胺化种类的免疫偶联物的组合物,其中该免疫偶联物通过在此披露的各种方法制备。在此还提供制备活性免疫偶联物的方法,其中该免疫偶联物在一个或多个残基处脱酰胺化,并且其中该脱酰胺化作用导致所述免疫偶联物效力的抑制。合适地,该方法包括在分批进料过程中在具有9.5或更小的ph的再折叠缓冲液中再折叠该免疫偶联物,并且使用双循环洗脱在离子交换柱上纯化该再折叠的免疫偶联物,其中在第一次洗脱和第二次洗脱之间利用剥离缓冲液剥离该柱,该剥离缓冲液包含乙醇胺、精氨酸、乙二胺四乙酸(edta)、尿素以及二硫苏糖醇(dtt)。合适地,从该制备方法回收的免疫偶联物的量比利用不包括分批进料再折叠过程和/或在已使用剥离缓冲液剥离的离子交换柱上的双循环洗脱的方法回收的免疫偶联物的量大至少三百%(300%)。参照附图,下文详细地描述了这些实施例的另外的实施例、特征、和优点,连同不同实施例的结构和操作。附图简要说明图1示出如在此所述的用于moxetumomabpasudotox的合适复性和纯化工序流程。图2示出fractogeltmae(m)捕获步骤(循环1)的结果。图3示出羟磷灰石色谱的结果。图4示出苯基650m色谱的结果。图5示出q琼脂糖hp色谱的结果。柱上样量是10.4g/l。图6示出部分纯化的moxetumomabpasudotox的iec分析的结果。图7示出fractogeltmae(m)捕获步骤(循环1)的结果。图8示出羟磷灰石色谱的结果。图9示出苯基650m色谱的结果。图10示出q琼脂糖hp色谱的结果。图11示出fractogeltmae(m)捕获步骤色谱的结果。图12示出fractogeltmae(m)残留色谱的结果。图13示出使用moxetumomabpasudotox包涵体(ib)溶解缓冲液用于柱清洁的fractogeltmae(m)色谱的结果。图14示出利用ib溶解缓冲液的fractogeltmae(m)残留色谱的结果。图15示出利用ib溶解缓冲液的fractogeltmae(m)空白缓冲液色谱的结果。图16示出9次纯化循环之后的fractogeltmae(m)残留色谱的结果。图17示出代表性卡普托蓝(captoblue)琼脂糖色谱的结果。图18示出图17所示卡普托蓝琼脂糖纯化级分的非还原的sds-page分析的结果。图19示出代表性卡普托蓝琼脂糖捕获步骤色谱的结果。发明详细说明应该领会的是在此展示和描述的这些具体的实现方式是实例,并且不旨在以任何方式在其他方面限制本申请的范围。在此提及的这些公开的专利、专利申请、网站、公司名称、以及科学文献特此以其全文形式通过引用而结合,达到如同每个被确切并单独地表明而通过引用结合的相同程度。在此引用的任何参考文件与本说明书的具体传授之间的任何冲突应以有利于后者的方式来解决。同样,在单词或短语的领域理解的定义与如在本说明书中确切传授的该单词或短语的定义之间的任何冲突应以有利于后者的方式来解决。如在本说明书中所使用,单数形式“一个/种(a,an)”以及“该”具体地还涵盖它们所提及的术语的复数形式,除非本内容清楚地另外指明。在此使用术语“约”以意指大约(approximately)、在……的附近(intheregionof)、粗略地(roughly)、或左右(around)。当术语“约”与一个数值范围结合使用时,它通过扩展列举的数值的上限和下限将该范围加以修饰。通常,在此使用术语“约”以将一个数值以高于和低于该规定值的20%的变化加以修饰。在此使用的技术术语和科学术语具有由本申请涉及的领域的普通技术人员通常理解的含义,除非另外定义。在此参考了本领域的普通技术人员已知的不同方法和材料。陈述重组dna技术的一般原理的标准参考作品包括萨姆布鲁克等人,“分子克隆:实验指南”,第2版,冷泉港实验室,纽约(1989)(“molecularcloning:alaboratorymanual,”2nded.,coldspringharborlaboratorypress,newyork(1989));考夫曼等人编,“医学生物学分子和细胞方法手册”,crc出版社,博卡拉顿(1995)(kaufmanetal.,eds.,“handbookofmolecularandcellularmethodsinbiologyinmedicine,”crcpress,bocaraton(1995));以及麦克弗森编,“定向诱变:实用方法”,irl出版社,牛津(1991)(mcpherson,ed.,“directedmutagenesis:apracticalapproach,”irlpress,oxford(1991)),这些作品各自的披露内容以其全文通过引用结合在此。术语“多肽”、“肽”、“蛋白质”以及“蛋白质片段”在此可以互换使用以便表示氨基酸残基的聚合物。这些术语适用于氨基酸聚合物,其中一个或多个氨基酸残基是一种对应的自然产生的氨基酸的人工化学模拟物,并且适用于自然发生的氨基酸聚合物以及非自然发生的氨基酸聚合物。术语“氨基酸”是指自然发生的以及合成的氨基酸,连同与自然发生的氨基酸功能类似的氨基酸类似物以及氨基酸模拟物。自然发生的氨基酸是通过遗传密码编码的那些氨基酸,以及随后被修饰的那些氨基酸,例如羟脯氨酸、γ-羧基谷氨酸盐、以及o-磷酸丝氨酸。氨基酸类似物是指以下化合物,这些化合物具有与自然发生的氨基酸相同的基本化学结构,例如与氢相结合的碳、羰基基团、氨基基团、以及r基团,例如高丝氨酸、正亮氨酸、甲硫氨酸亚砜、蛋氨酸甲基锍。这些类似物能具有经修饰的r基团(例如正亮氨酸)或经修饰的肽骨架,但保留了与自然发生氨基酸相同的基本化学结构。氨基酸模拟物是指以下化学化合物,这些化合物具有不同于通常的氨基酸的化学结构的、但与自然发生的氨基酸的功能相类似的结构。带负电的氨基酸包括天门冬氨酸(或天门冬氨酸盐)以及谷氨酸(或谷氨酸盐)。带正电的氨基酸包括精氨酸、组氨酸以及赖氨酸。在此有待纯化的“组合物”包括感兴趣的多肽以及一种或多种杂质。该组合物可以被“部分纯化”(即已经经受一个或多个纯化步骤,或可以直接从产生该多肽的宿主细胞或生物体中直接获得(例如,该组合物可以包括收获的细胞培养液)。“酸性变体”是多肽或免疫偶联物的变体,它比该感兴趣的多肽更具有酸性(例如,通过阳离子交换色谱确定的)。酸性变体的实例是脱酰胺化的变体。脱酰胺化的蛋白质是以下蛋白质,它们的某些或全部游离酰胺功能基团被羟基化成为羧酸,例如将谷氨酰胺转化成谷氨酸。这一反应的速率取决于一级序列、三维结构、ph、温度、缓冲液类型、离子强度以及其他溶液特性。重要的是,脱酰胺化反应将负电荷导入该分子。如以下进一步说明,这种蛋白质脱酰胺化反应对蛋白质活性可具有一种负影响。如在此所使用,术语“抗体”和“免疫偶联物”在最广泛的意义上可以互换使用,并且包括单克隆抗体(例如,全长或完整的单克隆抗体)、多克隆抗体、多价抗体、多特异性抗体(例如,双特异性抗体,只要它们展示出所希望的生物活性)以及在此说明的抗体片段。术语“双特异性抗体”旨在包括以下任一抗体,它具有两种不同的结合特异性,即该抗体结合了两种不同的表位,这些表位可位于相同的靶抗原或更常见地位于不同的靶抗原上。天然抗体和免疫偶联物通常是约150,000道尔顿的异四聚体糖蛋白质,由两个相同的轻(l)链和两个相同的重(h)链组成。每条轻链通过一个共价二硫键与一条重链相连,而二硫键的数目在不同免疫球蛋白同种型的重链之间变化。每条重链和轻链还具有规律性间隔的链间二硫桥。每条重链在一端具有一个可变结构域(vh),之后跟随多个恒定结构域。每条轻链在一端具有一个可变结构域(vl)并且在另一端具有一个恒定结构域。轻链的恒定结构域与重链的第一恒定结构域对准,并且轻链的可变结构域与重链的可变结构域对准。具体氨基酸残基被认为形成轻链可变结构域与重链可变结构域之间的一个连接(克劳斯尔等人,生物分子学杂志,186,651-66,1985(clothiaetal.,j.mol.biol.186,651-66,1985));诺沃特和哈伯,美国科学院院刊,82,4592-4596(1985)(novotnyandhaber,proc.natl.acad.sci.usa82,4592-4596(1985)))。基于重链的组成,定义了五类人类免疫球蛋白,并且被命名为igg、igm、iga、ige、以及igd。igg类抗体与iga类抗体被进一步分成以下亚类:即,igg1、igg2、igg3及igg4、以及iga1和iga2。igg、iga以及igd抗体中的重链具有三个恒定区结构域,它们被指定为chi、ch2以及ch3,并且igm和ige抗体中的重链具有四个恒定区结构域chi、ch2、ch3以及ch4。因此,重链具有一个可变区以及三个或四个恒定区。免疫球蛋白结构和功能评述于例如哈洛(harlow)等人编,抗体技术实验指南(antibodies:alaboratorymanual),第14章,冷泉港实验室,冷泉港(1988)中。术语“抗体片段”是指完整抗体的一部分,并且指完整抗体的抗原决定可变区。抗体片段的实例包括但不限于:fab、fab'、f(ab')2、fv以及单链fv片段、线性抗体、单链抗体、以及从抗体片段形成的多特异性抗体。在此所使用的术语“单克隆抗体”是指从基本上均质抗体的群体中获得的抗体,即单个抗体,这些抗体包括除了可能自然发生的突变(可能少量存在)之外其他均相同的群体。单克隆抗体是高特异性的并且结合单一抗原。而且,与典型地包括指向不同决定簇(表位)的不同抗体的多克隆制剂相比,每种单克隆抗体指向该抗原上的单一决定簇。抗体“选择性地结合”或“特异性地结合”是指与可替代的物质(包括不相关的蛋白质)相比,该抗体与一个位点反应地或联系地更加频繁、更加快速、持续时间更长、亲和力更大、或以上特点的组合。“选择性地结合”或“特异性地结合”是指抗体与蛋白质以至少约0.1mm,但更通常至少约1μm的kd结合。“选择性地结合”或“特异性地结合”有时是指抗体与蛋白质有时以至少约0.1μm或更好的kd结合,并且在其他时候以至少约0.01μm或更好的kd结合。由于不同物种的同源蛋白之间的序列一致性,特异性结合可包括识别多于一种物种的肿瘤细胞标记蛋白的抗体。在此的抗体特定地包括“嵌合”抗体,在这些抗体中重链和/或轻链的一部分与来源于特定物种或属于特定抗体类型或亚类的抗体中对应的序列一致或同源,而这些链的其余部分与来源于另一物种或属于另一个抗体类型或亚类的抗体、以及这些抗体的片段中对应的序列一致或同源,只要它们展示出令人希望的生物活性(美国专利号4,816,567;以及莫里森等人,美国国家科学院院刊,57:6851-6855(1984))。非人类(例如,鼠类)抗体的“人源化”形式是包含来源于非人类免疫球蛋白的最小序列的嵌合抗体。通常,人源化抗体是人类免疫球蛋白(受体抗体),其中来自该受体的高可变区的残基被来自非人类物种(供体抗体)(如具有所希望的特异性、亲和力以及能力的小鼠、大鼠、兔或非人类的灵长类动物)的高可变区的残基代替。在一些情况下,人类免疫球蛋白的构架区(fr)残基被对应的非人类残基代替。而且,人源化抗体可以包括在该受体抗体或供体抗体中未发现的残基。进行这些修饰以便使抗体性能进一步改进。通常,该人源化抗体将基本上都包括至少一个、并且典型地两个可变结构域,其中所有或基本上所有的高可变环对应于一种非人类免疫球蛋白的那些,并且所有或基本上所有的fr是具有人类免疫球蛋白序列的fr。该人源化抗体可任选地还应当至少包括免疫球蛋白恒定区(fc)的一部分,典型地人类免疫球蛋白的一部分。更多细节参见琼斯等人,自然,327:522-525(1986)(jonesetal.,nature327:522-525(1986));雷切曼(riechmann)等人,自然,332:323-329(1988)(riechmannetal.,nature332:323-329(1988));以及普雷斯塔,现代结构生物学评论,2:593-596(1992)(presta,curr.op.struct.biol.2:593-596(1992))。还请见以下综述文章及其中所引述的参考文献:瓦斯瓦尼和汉密尔顿,变态反应、哮喘和免疫学年报,7:105-115(1998)(allergy,asthma&immunol.7:105-115(1998));哈里斯,生物化学学会会刊,23:1035-1038(1995)(harris,biochem.soc.transactions23:1035-1038(1995));赫尔和格罗斯,现代生物技术评论,5:428-433(1994)(hurleandgross,curr.op.biotech.5:428-433(1994))。“人类抗体”是一种物质,它具有氨基酸序列,该序列对应于由人类产生抗体的序列和/或已使用在此披露的制造人类抗体的任一种技术制造。人类抗体的定义特异性地排除了包括非人类抗原结合残基的人源化抗体。如在此使用的术语“免疫偶联物”或“偶联物”或“免疫毒素”是指以下化合物或其衍生物:其与细胞结合剂(例如,抗cd22抗体或其片段)连接,并且通过以下通式来定义:c-l-a,其中c=细胞毒素,l=连接物,并且a=细胞结合剂(例如,抗cd22抗体或抗体片段)。免疫偶联物还可通过该通式按照以下相反顺序来定义:a-l-c。如在此使用的术语“细胞毒素”或“细胞毒剂”是指抑制或阻止细胞的功能和/或造成细胞破坏的物质。该术语旨在包括放射性同位素(例如,at211、i131、i125、y90、re186、re188、sm153、bi212、p32以及lu的放射性同位素)、化学治疗剂例如甲氨蝶呤、阿霉素、长春花碱(长春新碱、长春碱、依托泊苷)、多柔比星、美法仑、丝裂霉素c、苯丁酸氮芥、柔红霉素或其他嵌入剂、酶类及其片段(如核苷酸分解酶(nucleolyticenzyme)),抗生素类、以及毒素如小分子毒素或细菌、真菌、植物或动物来源的酶活性毒素,包括它们的片段和/或变体,以及以下披露的各种抗肿瘤或抗癌药。细胞毒剂的实例包括但不限于:相思豆毒素、蓖麻毒素、绿脓杆菌外毒素(pe)、白喉毒素(dt)、肉毒杆菌素、或它们的经修饰毒素。例如,pe和dt是高毒性化合物,它们典型地通过肝毒素导致死亡。然而,pe和dt能通过以下方式修饰成用作免疫毒素的形式:去除该毒素的天然靶向组分(例如,pe的结构域la或dt的b链)并且将它替换成不同的靶向部分,例如抗体。在一些实施例中,该毒素是绿脓杆菌外毒素。绿脓杆菌外毒素a(pe)是由绿脓假单胞菌分泌的极具活性的单体蛋白质(分子量为66kd),它在真核细胞中通过催化它的adp-核糖化反应使延伸因子2(ef-2)失活而抑制蛋白质合成(催化已氧化的nad的adp核糖基部分转移至ef-2上)。“pe免疫偶联物”或“pe免疫毒素”是包含抗体或其抗原结合片段以及pe毒素或其变体的免疫偶联物或免疫毒素。所谓从包含多肽以及一种或多种杂质的组合物中“纯化”多肽或免疫偶联物是指通过从该组合物中(完全或部分地)去除至少一种杂质而增加该组合物中多肽的纯度。根据本发明,进行纯化而不使用亲和色谱步骤。术语“色谱”是指以下过程,通过该过程混合物中感兴趣的一种溶质与混合物中的其他溶质由于该混合物的各个溶质在流动相的影响下、或在结合和洗脱过程中通过固定介质的速率不同而分开。术语“离子交换”以及“离子交换色谱”是指以下色谱过程,其中混合物中感兴趣的溶质(如蛋白质)与连接(例如通过共价附接)固相离子交换材料的带电化合物相互作用,这样与混合物中的溶质杂质或污染物相比,所感兴趣的溶质与该带电化合物非特异性更多或更少地相互作用。混合物中污染性溶质比所感兴趣的溶质从该离子交换材料柱更快或更慢洗脱,或相对于感兴趣的溶质与该树脂相结合或从其排除。“离子交换色谱”特异性地包括阳离子交换、阴离子交换、以及混合型色谱。词组“离子交换材料”是指带有负电荷(即,阳离子交换树脂)或正电荷(即,阴离子交换树脂)的固相。电荷可能是通过将一个或多个带电配体附接至该固相(例如通过共价连接)上来提供。可替代地或此外,电荷可以是该固相的固有特性(例如,对于硅胶而言,它带有总体的负电荷)。“阴离子交换树脂”是指带正电的固相,由此具有一个或多个附接到其上的带正电的配体。可以使用附接至适宜形成阴离子交换树脂的固相的任何带正电的配体,如季铵基团,可商购的阴离子树脂,包括deae纤维素、porospi20、pi50、hq10、hq20、hq50、d50(来自应用生物系统公司(appliedbiosystems))、sartobindq(来自赛多利斯集团(sartorius))、monoq、miniq、source15q以及30q、q、deae以及anx琼脂糖fastflow、q琼脂糖highperformance、qaesephadextm以及fastqsepharosetm(通用医疗公司(gehealthcare))、wppei、wpdeam、wpquat(来自j.t.baker公司)、hydrocelldeae以及hydrocellqa(生物实验室公司(biochromlabsinc.))、uosphereq、macro-prepdeae以及macro-prephighq(来自伯乐公司(biorad))、陶瓷hyperdq、陶瓷hyperddeae、trisacrylm以及lsdeae、spherodexlsdeae、qmaspherosills、qmaspherosilm以及mustangq(来自颇尔公司(palltechnologies))、dowexfinemeshstrongbasetypei以及typeii阴离子树脂以及dowexmonosphere77、弱碱阴离子(来自道液体分离公司(dowliquidseparations))、interceptq膜、matrexcellufinea200、a500、q500、以及q800(来自密理博公司(millipore))、fractogelemdtmae、fractogelemddeae以及fractogelemddmae(来自emd公司)、amberlite弱强阴离子交换型i和ii、dowex弱和强阴离子交换型i和ii、diaion弱和强阴离子交换型i和ii、duolite(来自西格玛奥利奇公司(sigma-aldrich))、tskgelq以及deae5pw以及5pw-hr、toyopearlsuperq-650s、650m以及650c、qae-550c以及650s、deae-650m以及650c(来自东曹达公司(tosoh))、qa52、de23、de32、de51、de52、de53、express-iond以及express-ionq(来自沃特曼公司(whatman))。提及“固相”是指一种或多种带电配体可以粘附到其上的非水性基质。固相可以是纯化柱、离散颗粒的非连续相、膜或过滤器等。用于形成该固相的材料的实例包括多糖(如琼脂糖和纤维素);以及其他机械稳定的基质如二氧化硅(例如可控孔度玻璃)、聚(苯乙烯二乙烯基)苯、聚丙烯酰胺,陶瓷颗粒以及上述任何物质的衍生物。术语“特异性结合”如此处所使用以便说明感兴趣的分子与结合至固相基质上的配体之间相互作用,通常是指感兴趣的蛋白质在结合位点上通过蛋白质的空间互补以及配体结构的联合作用而可逆性地结合至一种配体上,在该结合位点上结合有静电力、氢键、疏水作用力、和/或范德华力。空间互补性越大并且在结合位点的其他作用力越强,则蛋白质与其所对应的配体的结合特异性就越大。特异性结合的非限定性实例包括抗体-抗原结合、酶-底物结合、酶-辅因子结合、金属离子螯合、dna结合蛋白-dna结合、调节蛋白-蛋白相互作用等。术语“非特异性结合”如在此所使用以便说明感兴趣的分子与配体或结合到固相基质上的其他化合物之间的相互作用,是指感兴趣的蛋白质在相互作用的位点上通过静电力、氢键、疏水作用力、和/或范德华力与配体或固相基质上的化合物相结合,但是缺少增强非结构作用力效果的结构互补。非特异性相互作用的实例包括但不限于:静电力、疏水作用力、以及范德华力连同氢键。在本发明中所使用的“缓冲液”是一种溶液,它通过加入酸或碱通过其酸碱偶联物组分的作用来抵抗ph的变化。在本发明的方法中可以采用各种缓冲液,这取决于纯化过程中缓冲液所希望的ph以及特定步骤[参见缓冲液:生物系统中缓冲液的制备和使用指导,格弗罗伊d编,calbiochem公司(1975)(buffers.aguideforthepreparationanduseofbuffersinbiologicalsystems,gueffroy,d.,ed.calbiochemcorporation(1975))]。可用于控制本发明的方法中所希望ph范围的缓冲液组分的非限定实例包括乙酸盐、柠檬酸盐、组氨酸、磷酸盐、铵盐缓冲液例如醋酸铵、琥珀酸盐、mes、chaps、mops、mopso、hepes、tris等、连同以下各项的组合:tris-苹果酸-naoh、马来酸盐、氯乙酸盐、甲酸盐、苯甲酸盐、丙酸盐、吡啶、哌嗪、ada、pipes、aces、bes、tes、曲辛、n,n-双(2-羟乙基)甘氨酸(bicine)、taps、乙醇胺、ches、caps、甲胺、哌啶、o-硼酸、碳酸、乳酸、丁二酸、二乙基丙二酸、双苷氨肽、hepps、heppso、咪唑、酚、popso、琥珀酸盐、taps、基于胺的物质、苄胺、三甲基或二甲基或乙基或苯胺、乙二胺、或吗啉(mopholine)。若需要,在缓冲液中可存在额外的组分(添加物),例如可使用盐来调节缓冲液离子强度,例如氯化钠、硫酸钠以及氯化钾;以及其他添加剂例如氨基酸(例如甘氨酸和组氨酸)、离液剂(chaotropes)(例如尿素)、醇类(例如乙醇、甘露醇、甘油、以及苯甲醇)、洗涤剂(见以上)、以及糖类(例如蔗糖、甘露醇、麦芽糖、海藻糖、葡萄糖、以及果糖)。所使用的缓冲液组分以及添加剂、以及浓度可根据本发明所进行的色谱类型而变化。“上样缓冲液”是用来将包括感兴趣的多肽分子以及一种或多种杂质的组合物上样至离子交换树脂上的物质。上样缓冲液具有导电率和/或ph,这样感兴趣的多肽分子(以及通常一种或多种杂质)与该离子交换树脂结合,或这样将感兴趣的蛋白质流动通过柱子同时这些杂质结合树脂。术语“洗涤缓冲液”当在此使用时是指用于在洗脱感兴趣的多肽分子之前洗涤离子交换树脂或将其再平衡的缓冲液。方便地,洗涤缓冲液和上样缓冲液可以是一样的,但不是必须要求的。“洗脱缓冲液”用于将感兴趣的多肽从固相中洗脱。洗脱缓冲液的导电率和/或ph是使感兴趣的多肽从离子交换树脂洗脱。多肽的“pi”或“等电点”是指多肽的正电荷平衡了其负电荷时的ph,pi可以由该多肽的附接碳水化合物的氨基酸残基或唾液酸残基的静电荷来计算或可以通过等电聚焦来确定。提及将分子“结合至”离子交换材料是指在适当条件(ph/导电率)下将该分子暴露于该离子交换材料,这样由于该分子与该离子交换材料的一个或多个带电基团之间的离子相互作用该分子在离子交换材料中或在该材料上是可逆性不能移动的。提及“洗涤”该离子交换材料是指使适宜的缓冲液通过或经过该离子交换材料。将分子(例如,多肽或杂质)从离子交换材料“洗脱”是指通过改变该离子交换材料周围缓冲液的离子强度将该分子从其中去除,这样该缓冲液与该分子竞争该离子交换材料上的带电位点。如在本披露内容和权利要求中所使用,单数形式“一种/个”("a"、"an")和“该”包括复数形式,除非在上下文中的其他地方清楚地指出。应当理解,当用语言“包含”来说明实施例时,还提供了就“由……组成”和/或“主要由……组成”而言所说明的其他类似实施例。如在词组如“a和/或b”中使用的术语“和/或”在此旨在包括“a和b”两者、“a或b”、“a”以及“b”。同样,如在词组如“a、b和/或c”中使用的术语“和/或”旨在包括以下实施例:a、b以及c;a、b或c;a或c;a或b;b或c;a和c;a和b;b和c;a(单独);b(单独);以及c(单独)。绿脓杆菌外毒素以及其他毒素毒素可以与本发明的抗体一起使用以产生免疫毒素。示例性毒素包括蓖麻毒素、相思豆毒素、白喉毒素及其亚单位,连同肉毒杆菌毒素a至f。这些毒素容易地可获得自商业来源(例如,西格玛化学公司,圣路易斯,密苏里州(sigmachemicalcompany,st.louis,mo.))。白喉毒素是从白喉杆菌中分离出的。蓖麻毒素是来自蓖麻(蓖麻子)的凝集素rca60。该术语还提及了它的毒性变体。例如,参见美国专利号5,079,163和4,689,401。蓖麻凝集素(rca)以两种形式存在,根据它们大致的分子量65kd与120kd分别被命名为rca60和rca120(尼克尔森和布劳斯坦(nicholson&blaustein),生物化学与生物物理学报期刊(j.biochem.biophys.acta),266:543(1972))。a链负责使蛋白质合成失活并杀死细胞。b链将蓖麻毒素结合至细胞表面半乳糖残基并且有助于a链转移至细胞溶质内(奥斯尼斯(olsnes)等人,自然,249:621-631(1974)和美国专利号3,060,165)。相思豆毒素包括来自相思豆的毒性凝集素。毒性主要成分相思豆毒素a、b、c以及d具有的分子量是从约63kd至67k,并且由两条二硫化物连接的多肽链a和b组成。a链抑制蛋白合成;b链(相思豆毒素-b)结合至d-半乳糖残基(参见,funatsu等人,农业生物化学,52:1095(1988)(funatsu,etal.,agr.biol.chem.52:1095(1988))以及奥斯尼斯,酶学方法,50:330-335(1978)(olsnes,methodsenzymol.50:330-335(1978)))。在本发明的优选实施例中,该毒素是绿脓杆菌外毒素(pe)。绿脓杆菌外毒素(或外毒素a)是由绿脓杆菌产生的外毒素。如在此使用的术语“绿脓杆菌外毒素”是指全长天然(自然发生的)pe或经修饰的pe。此类修饰可包括但不限于:消除结构域ia、缺失结构域ib、ii和iii中的各种氨基酸、单个氨基酸取代以及在羧基端加入一个或多个序列,例如kdel(seqidno:3)以及redl(seqidno:4)。参见司盖尔(siegall)等人,生物化学杂志(j.biol.chem.),264:14256-14261(1989))。在优选的实施例中,pe的细胞毒性片段保留了天然pe细胞毒性的至少50%、优选75%,更优选至少90%,并且最优选95%。在最优选的实施例中,该细胞毒性片段比天然pe更具有毒性。天然的绿脓杆菌外毒素a(pe)是由绿脓杆菌分泌的极具活性的单体蛋白质(分子量是66kd),它抑制了真核细胞中的蛋白质合成。这种天然pe序列由共同转让的美国专利号5,602,095提供,该专利通过引用结合在此。作用的方法是将延伸因子2(ef-2)的adp核糖化反应失活。该外毒素包含三个联合起效造成细胞毒性的结构结构域。结构域ia(氨基酸1-252)介导细胞的结合。结构域ii(氨基酸253-364)负责易位至细胞溶质中,而结构域iii(氨基酸400-613)介导延伸因子2的adp核糖化作用。结构域b(氨基酸365-399)的功能仍然未确定,尽管它的一个大部分(氨基酸365-380)可缺失而不损失细胞毒性。参见司盖尔等人,(1989),同上。在本发明中使用的pe包括该天然序列、该天然序列的细胞毒性片段、以及该天然pe的保守修饰变体及其细胞毒性片段。在本发明中有用的pe变体描述于us7,355,012以及wo2007/016150以及wo2009/032954中,其各自的披露内容以其全文通过引用结合在此。pe的细胞毒性片段包括以下片段,它们具有细胞毒性,随后在靶细胞中存在或不存在蛋白水解加工或其他加工(例如,作为蛋白或前体蛋白)pe的细胞毒性片段包括pe40、pe38以及pe35。在优选实施例中,pe经修饰来减少或消除非特异性细胞结合,这通常是通过如美国专利号4,892,827中所传授的缺失结构域ia来实现,但也可以例如通过使结构域ia的某些残基突变来实现。例如,美国专利号5,512,658披露,其中存在着结构域ia但结构域ia在位置57、246、247以及249处的碱性残基被酸性残基(谷氨酸或“e”)替代的突变pe展示出极大程度减弱的非特异性细胞毒性。pe的突变形式有时是指pe4e。pe40是pe的一种截短衍生物,如之前本领域所说明,缺失了天然pe分子的结构域ia。参见派(pai)等人,美国国家科学院院刊,55:3358-62(1991);以及近藤(kondo)等人,生物化学杂志,263:9470-9475(1988)。pe35是pe的一种35kd羧基端片段,其中氨基酸残基1-279已经缺失并且该分子以位置280处的met起始,之后跟随天然pe的氨基酸281-364以及381-613。例如,在美国专利5,602,095和4,892,827中披露了pe35和pe40。pe4e是pe的一种形式,其中存在着天然pe的所有结构域,但其中结构域ia在位置57、246、247以及249处的碱性残基被酸性残基(谷氨酸或“e”)替代。在一些优选的实施例中,采用了细胞毒性片段pe38。pe38是一种截短的pe前体蛋白,由氨基酸253-364以及381-613组成,在细胞内加工时它被激活成细胞毒性形式(参见,例如美国专利号5,608,039、7,355,012,以及帕斯坦(pastan)等人,生物化学与生物物理学报,1333:c1-c6(1997),这些各自的披露内容以其全文通过引用结合在此)。如以上所指出,结构域lb中的一些或全部可能缺失,并且剩余部分被连接物连接或被肽键直接连接。结构域ii的氨基部分中有一些可以缺失。并且,c-末端可包含残基609-613的天然序列(redlk)(seqidno:5),或可以包括一种变化物,该变化物被发现维持了该构建体易位至细胞溶质中的能力,例如redl(seqidno:4)或kdel(seqidno:3),以及这些序列的重复。参加,例如美国专利号5,854,044;5,821,238;和5,602,095以及wo99/51643。然而在优选的实施例中,该pe是pe4e、pe40或pe38,pe中的任一种形式(其中非特异性细胞毒性已被消除或降低至一定水平,其中不发生对非靶向细胞的显著毒性),可以在本发明的免疫偶联物中使用,只要它依然能够在靶细胞中易位和ef-2核糖化作用。pe的保守修饰变体pe的保守修饰变体或其细胞毒性片段在氨基酸水平与感兴趣的pe(如pe38)具有至少80%的序列相似性,优选至少85%的序列相似性,更优选地至少90%的序列相似性,并且更优选地至少95%的序列相似性。术语“保守修饰的变体”应用至氨基酸序列和核酸序列。考虑到特定的核酸序列,保守修饰的变体是指以下氨基酸序列,它们编码了相同或基本相同的氨基酸序列,或者如果该核酸不编码一种核酸序列则是指基本相同的核酸序列。由于遗传编码的简并性,大量功能性相同的核酸编码了任一种给定的多肽。例如,密码子gca、gcc、gcg和gcu都编码了氨基酸丙氨酸。因此,在丙氨酸被密码子特异化的每个位置上,还可将该密码子变为所说明的任一种对应的密码子,而不改变编码的多肽。这类氨基酸变化是“沉默变化”,它们是保守修饰变化的一个种类。在此编码多肽的每种核酸序列还说明了核酸的每种可能的沉默变化。技术人员应当认识到,核酸中的每个密码子(除了aug,它通常是甲硫氨酸的唯一密码子)可以被修饰以产生功能相同的分子。因此,编码多肽的核酸的每个沉默变化在每个说明的序列中是固有的。对于氨基酸序列,本领域普通技术人员应当认识到,核酸、肽、多肽或蛋白质序列中的单个取代、缺失或添加(这在经编码的序列中改变、增加或缺失单一氨基酸或小百分数的氨基酸)是“保守修饰的变体”,其中该改变导致一种氨基酸被一种化学上相似的氨基酸取代。本发明所采用的绿脓杆菌外毒素可以通过本领域内的普通技术人员所熟知的测定法来测定所希望的细胞毒性水平。因此,pe的细胞毒性片段以及此类片段的保守修饰变体可以很容易测定细胞毒性。大部分候选pe分子可以通过本发明所熟知的方法同时对细胞毒性进行测定。例如候选分子的亚基团可以测定细胞毒性。这些候选分子的阳性反应亚基可以继续再分类并再次测定,直到识别该所希望的一个或多个细胞毒性片段。此类方法允许快速筛选pe的大量细胞毒性片段或保守变体。抗-cd22/pe免疫偶联物在一个实施例中,感兴趣的多肽包括特异性结合cd22的抗体。“cd22”是指属于ig超家族的限制连接的b细胞抗原。它在60%至70%的b细胞淋巴瘤和白血病中表达,并且不存在于b细胞发育早期阶段的细胞表面或在干细胞上。参见,例如vaickus等人,肿瘤学/血液学评论(crit.rev.oncol/hematol.)77:267-297(1991)。在另一个实施例中,感兴趣的多肽是结合cd22的抗体片段(例如,fab或scfv)。如在此所使用,提及抗体,术语“抗cd22”是指特异性结合cd22的抗体,并且包括提及对抗cd22产生的抗体。在一些实施例中,该cd22是一种灵长类cd22,例如人类cd22。在一个实施例中,该抗体被产生以对抗人类cd22,它是通过被一种非灵长类哺乳动物在引入到编码了人类cd22的cdna的动物中之后而合成的。在另一个实施例中,感兴趣的多肽是包含pe38外毒素的cd22抗体免疫偶联物。cd22/pe38免疫偶联物的一个实例是在国际专利申请公开号wo2012/015912、wo98/41641和wo2003/27135、美国专利号7,541,034、7,355,012、以及美国专利号2007/0189962中说明的moxetumomabpasudotox,所有文献以其全文通过引用结合在此。moxetumomabpasudotox(cat-8015)是一种重组免疫毒素蛋白质,由基于鼠类抗-cd22抗体rfb4的抗体fv片段组成,rfb4与截短形式的绿脓杆菌外毒素蛋白质pe38融合。抗-cd22fv片段由两个结构域vl和vh组成,其中后一个结构域经修饰以便改进与人类cd22靶点的结合。moxetumomabpasudotox蛋白质由两种独立的多肽vl链(seqidno:2)以及vh链(在c端融合至pe38结构域(vh-pe38)(seqidno:1))组成。在本发明中有用的其他vl和vh-pe38序列描述于us7,541,034、7,355,012、2007/0189962和wo2012/015912中,其各自的披露内容以其全文通过引用结合在此。两个结构域经设计每个包含工程化处理的丝氨酸残基,它们允许形成细胞内二硫键。这种特点增加了该融合蛋白的稳定性。moxetumomabpasudotox的vh-p38亚单位(seqidno:1)的氨基酸序列是以下序列:pe38序列以粗体显示,vh结构域与pe38结构域之间的五个氨基酸连接物用下划线显示。moxetumomabpasudotox的vl亚单位(seqidno:2)的氨基酸序列是以下序列:mdiqmtqttsslsaslgdrvtiscrasqdisnylnwyqqkpdgtvklliyytsilhsgvpsrfsgsgsgtdysltisnleqedfatyfcqqgntlpwtfgcgtkleik(seqidno:2)在其他实施例中,该免疫偶联物的vh结构域的氨基酸序列是以下各项中的一个:mevqlvesggglvkpggslklscaasgfafsiydmswvrqtpekclewvayissgggttyypdtvkgrftisrdnakntlylqmsslksedtamyycarhsgygthwgvlfaywgqgtlvtvsa(seqidno:6)mevqlvesggglvkpggslklscaasgfafsiydmswvrqtpekclewvayissgggttyypdtvkgrftisrdnakntlylqmsslksedtamyycarhsgygynwgvlfaywgqgtlvtvsa(seqidno:7)mevqlvesggglvkpggslklscaasgfafsiydmswvrqtpekclewvayissgggttyypdtvkgrftisrdnakntlylqmsslksedtamyycarhsgygttwgvlfaywgqgtlvtvsa(seqidno:8)mevqlvesggglvkpggslklscaasgfafsiydmswvrqtpekclewvayissgggttyypdtvkgrftisrdnakntlylqmsslksedtamyycarhsgygstygvlfaywgqgtlvtvsa(seqidno:9)mevqlvesggglvkpggslklscaasgfafsiydmswvrqtpekclewvayissgggttyypdtvkgrftisrdnakntlylqmsslksedtamyycarhsgygthwgvlfaywgqgtlvtvsa(seqidno:10)mevqlvesggglvkpggslklscaasgfafsiydmswvrqtpekclewvayissgggttyypdtvkgrftisrdnakntlylqmsslksedtamyycarhsgygssygvlfaywgqgtlvtvsa(seqidno:11)在另外的实施例中,该免疫偶联物的vl结构域的氨基酸序列是以下各项中的一个:mdiqmtqttsslsaslgdrvtiscrasqdiarylnwyqqkpdgtvklliyytsilhsgvpsrfsgsgsgtdysltisnleqedfatyfcqqgntlpwtfgcgtkleik(seqidno:12)mdiqmtqttsslsaslgdrvtiscrasqdihgylnwyqqkpdgtvklliyytsilhsgvpsrfsgsgsgtdysltisnleqedfatyfcqqgntlpwtfgcgtkleik(seqidno:13)mdiqmtqttsslsaslgdrvtiscrasqdigrylnwyqqkpdgtvklliyytsilhsgvpsrfsgsgsgtdysltisnleqedfatyfcqqgntlpwtfgcgtkleik(seqidno:14)mdiqmtqttsslsaslgdrvtiscrasqdirgylnwyqqkpdgtvklliyytsilhsgvpsrfsgsgsgtdysltisnleqedfatyfcqqgntlpwtfgcgtkleik(seqidno:15)在某些其他实施例中,该免疫偶联物的pe毒素是一种pe或其变体,它选自以下各项:天然peaeeafdlwnecakacvldlkdgvrssrmsvdpaiadtngqgvlhysmvleggndalklaidnalsitsdgltirleggvepnkpvrysytrqargswslnwlvpighekpsnikvfihelnagnqlshmspiytiemgdellaklardatffvrahesnemqptlaishagvswmaqtqprrekrwsewasgkvlclldpldgvynylaqqrcnlddtwegkiyrvlagnpakhdldikptvishrlhfpeggslaaltahqachlpletftrhrqprgweqleqcgypvqrlvalylaarlswnqvdqvirnalaspgsggdlgeaireqpeqarlaltlaaaeserfvrqgtgndeagaangpadsgdallernyptgaeflgdggdvsfstrgtqnwtverllqahrqleergyvfvgyhgtfleaaqsivfggvrarsqdldaiwrgfyiagdpalaygyaqdqepdargrirngallrvyvprsslpgfyrtsltlaapeaageverlighplplrldaitgpeeeggrletilgwplaertwipsaiptdprnvggdldpssipdkeqaisalpdyasqpgkppredlk(seqidno:16)pe40ggslaaltahqachlpletftrhrqprgweqleqcgypvqrlvalylaarlswnqvdqvirnalaspgsggdlgeaireqpeqarlaltlaaaeserfvrqgtgndeagaanadvvsltcpvaagecagpadsgdallernyptgaeflgdggdvsfstrgtqnwtverllqahrqleergyvfvgyhgtfleaaqsivfggvrarsqdldaiwrgfyiagdpalaygyaqdqepdargrirngallrvyvprsslpgfyrtsltlaapeaageverlighplplrldaitgpeeeggrletilgwplaertvvipsaiptdprnvggdldpssipdkeqaisalpdyasqpgkppredlk(seqidno:17)pe38ggslaaltahqachlpletftrhrqprgweqleqcgypvqrlvalylaarlswnqvdqvirnalaspgsggdlgeaireqpeqarlaltlaaaeserfvrqgtgndeagaangpadsgdallernyptgaeflgdggdvsfstrgtqnwtverllqahrqleergyvfvgyhgtfleaaqsivfggvrarsqdldaiwrgfyiagdpalaygyaqdqepdargrirngallrvyvprsslpgfyrtsltlaapeaageverlighplplrldaitgpeeeggrletilgwplaertwipsaiptdprnvggdldpssipdkeqaisalpdyasqpgkppredlk(seqidno:18)pe35mweqleqcgypvqrlvalylaarlswnqvdqvirnalaspgsggdlgeaireqpeqarlaltlaaaeserfvrqgtgndeagaangpadsgdallernyptgaeflgdggdvsfstrgtqnwtverllqahrqleergyvfvgyhgtfleaaqsivfggvrarsqdldaiwrgfyiagdpalaygyaqdqepdargrirngallrvyvprsslpgfyrtsltlaapeaageverlighplplrldaitgpeeeggrletilgwplaertvvipsaiptdprnvggdldpssipdkeqaisalpdyasqpgkppredlk(seqidno:19)pe-lrrhrqprgweqlptgaeflgdggdvsfstrgtqnwtverllqahrqleergyvfvgyhgtfleaaqsivfggvrarsqdldaiwrgfyiagdpalaygyaqdqepdargrirngallrvyvprsslpgfyrtsltlaapeaageverlighplplrldaitgpeeeggrletilgwplaertvvipsaiptdprnvggdldpssipdkeqaisalpdyasqpgkppredlk(seqidno:20)pe-lr-6xrhrqprgweqlptgaeflgdggdvsfstrgtqnwtverllqahrqleeggyvfvgyhgtfleaaqsivfggvrarsqdldaiwagfyiagdpalaygyaqdqepdaagrirngallrvyvprsslpgfyatsltlaapeaageverlighplplrldaitgpeeaggrletilgwplaertvvipsaiptdprnvggdldpssipdseqaisalpdyasqpgkppredlk(seqidno:21)pe-38(moxetumomabpasudotox)peggslaaltahqachlpletftrhrqprgweqleqcgypvqrlvalylaarlswnqvdqvirnalaspgsggdlgeaireqpeqarlaltlaaaeserfvrqgtgndeagaangpadsgdallernyptgaeflgdggdvsfstrgtqnwtverllqahrqleergyvfvgyhgtfleaaqsivfggvrarsqdldaiwrgfyiagdpalaygyaqdqepdargrirngallrvyvprsslpgfyrtsltlaapeaageverlighplplrldaitgpeeeggrletilgwplaertvvipsaiptdprnvggdldpssipdkeqaisalpdyasqpgkppredlk(seqidno:22)该免疫偶联物的pe毒素与vh或vl结构域直接融合或偶联或经由该vh或vl结构域的n端或c端的连接物融合或偶联。连接物的一个实例是以上针对moxetumomabpasudotox所描述,并且对应于氨基酸序列kasgg(seqidno:23)。额外的连接物可容易地通过本领域已知的技术产生。pe免疫偶联物的表达本发明的pe免疫偶联物稳定表达于细胞如细菌细胞中,并且接着从包涵体中分离。之后,使用如在此所述的下游步骤将从包涵体中分离的pe免疫偶联物进一步纯化。各种宿主表达载体系统可被利用以表达本发明的pe免疫偶联物。此类宿主表达系统代表着通过其可以产生并随后纯化感兴趣的编码序列的运载体,但还代表当用合适的核苷酸编码序列转化或转染时,原位表达本发明的抗体分子的细胞。这些包括但不限于微生物,如用含有抗体编码序列的重组噬菌体dna、质粒dna或粘粒dna表达载体转化的细菌(例如大肠杆菌、枯草杆菌);用含有抗体编码序列的重组酵母表达载体转化的酵母(酵母属、毕赤酵母属);用含有抗体编码序列的重组病毒表达载体(例如,杆状病毒)转化的昆虫细胞系统;用重组病毒表达载体(例如,花椰菜花叶病毒camv;烟草花叶病毒tmv)感染或用含有抗体编码序列的重组质粒表达载体转化的植物细胞系统;或具有重组表达构建体的哺乳动物细胞系统(例如,cos、cho、blk、293、3t3细胞),构建体含有来源于哺乳动物细胞基因组的启动子(例如,金属硫蛋白启动子)或来源于哺乳动物病毒的启动子(例如,腺病毒晚期启动子;疫苗病毒7.5k启动子)。编码vl和vh-pe各个毒素(例如vh-pe38)多肽的dna可以通过本领域所熟知的技术引入一种表达载体中。“载体”是指用于将核酸克隆和/或转移至宿主细胞中的任何运载体。载体可以是可能与另一个dna片段附接的复制子,这样以便产生附接片段的复制。“复制子”是指以下任意一种遗传因子(例如,质粒、噬菌体、粘粒、染色体、病毒),它充当dna体内复制的自动单元,即在其自我控制下能复制。术语“载体”包括用于在体外、活体外或体内将该核酸引入细胞中的运载体。可以使用本领域熟知的大量载体,以便操作核酸,将响应元件和启动子(如可诱导的启动子)整合至基因中等等。可能的载体包括例如质粒,例如pbr322或puc质粒衍生物,或bluescript载体。例如,将对应于响应元件和启动子的dna片段插入合适的载体中能伴随着将合适的dna片段连接至具有互补结合端的选定载体。可替代地,dan分子的末端可以被酶催化修饰或者任意位点通过将核苷酸序列(连接物)连接至该dna末端中而产生。此类载体可进行工程化处理,以便含有可选择的提供细胞选择的标记基因。此类标记允许识别和/或选择宿主细胞,这些细胞表达了该标记所编码的蛋白质。术语“表达载体”是指经设计使得插入核酸序列在转化到宿主中之后表达的载体、质粒或运载体。克隆的基因,即插入的核酸序列,例如编码与pe毒素融合的抗cd22vh、抗cd22vl或抗cd22vh或vl的基因,通常被置于控制元件如启动子、最小启动子、增强子等的控制之下。起始控制区或启动子有助于驱动核酸在所希望的宿主细胞中的表达,它们是众多的且是本领域技术员人所熟知的。能够驱动这些基因的表达的几乎任一种启动子都可用于表达载体中,包括但不限于:病毒启动子、细菌启动子、动物启动子、哺乳动物启动子、合成启动子、组成型启动子、组织特异性启动子、发病或疾病相关启动子、发育特异性启动子、诱导型启动子、光调控启动子;包括但不限于:sv40早期(sv40)启动子区(该启动子包含在劳氏肉瘤病毒(rsv)的3'长末端重复序列(ltr)中)、腺病毒(ad)的e1a或主要晚期启动子(mlp)、人巨细胞病毒(hcmv)的立即早期启动子、单纯疱疹病毒(hsv)胸苷激酶(tk)启动子、杆状病毒ie1启动子、延伸因子1α(ef1)启动子、甘油醛-3-磷酸脱氢酶(gapdh)启动子、磷酸甘油酸激酶(pgk)启动子、泛素c(ube)启动子、白蛋白启动子、小鼠金属硫蛋白-l启动子和转录控制区的调控序列、普遍存在的启动子(hprt、波形蛋白、-肌动蛋白、微管蛋白等)、中间丝(结蛋白、神经丝蛋白、角蛋白、gfap等)的启动子、治疗性基因的启动子(mdr、cftr或viii型因子的启动子等)、发病或疾病相关启动子。另外,这些表达序列可以通过添加增强子或调控序列等来修饰。术语“表达”是指由编码序列所编码的产物的生物产生。在大多数情况下,dna序列(包括编码序列)被转录形成信使rna(mrna)。然后,该信使rna被翻译形成具有相关生物活性的多肽产物。而且,表达过程可涉及进一步加工步骤至rna产物的转录,例如剪接去除内含子、和/或一种多肽产物的转录后加工。vl和vh-pe38多肽合适地表达于细胞中,例如细菌细胞,如大肠杆菌中。这些多肽表达于例如大肠杆菌细胞中,并从包涵体中分离。在某些实施例中,vl和vh-pe38亚单位表达于不同的细胞中。例如,vl表达于一个细胞中的一个第一载体上,而vh-pe38表达于一个不同细胞中的一个第二载体上。在其他实施例中,这些vl和vh-pe38亚单位表达于相同细胞的不同的载体上,例如vl表达于一个细胞中的一个第一载体上,而vh-pe38表达于相同细胞中的一个不同载体上。在某些其他实施例中,vl和vh-pe38亚基表达于相同细胞中的相同载体上。来自细胞的包涵体被回收,溶解,并且将vl和vh-pe38亚基合并以形成免疫偶联物,如在此所述的。制备免疫偶联物的方法在实施例中,在此提供制备活性免疫偶联物,即能够结合所希望的靶标并递送附接至细胞靶向剂(例如,抗体、抗体片段或其他蛋白质)的化合物(例如,免疫毒素)的方法。在此所述的方法适合用于制备在一个或多个残基处脱酰胺化的免疫偶联物。如在此所述,这种脱酰胺化通常导致免疫偶联物效力抑制,并且由此所提供的方法有益于制备适于临床环境的活性免疫偶联物。如在此所述,合适地使用来自细菌(包括大肠杆菌)的表达系统来制备免疫偶联物。来自细胞的包涵体被回收、溶解,并且蛋白质被回收。在实施例中,如在此所述经设计形成免疫偶联物的vl和vh-毒素亚单位是在细菌细胞中制备的。如在此所述,包含所希望的免疫偶联物亚单位的包涵体被溶解、浓缩并澄清。合适的澄清方法在此处以及wo2012/015912的披露内容和实例中予以描述,其披露内容以其全文通过引用结合在此。澄清后,对免疫偶联物实施再折叠。在实施例中,制备免疫偶联物的方法合适地包括使用分批进料过程再折叠免疫偶联物。再折叠后,如在此处以及wo2012/015912中所述的利用一个或多个色谱柱纯化该再折叠的免疫偶联物。如在此所使用的“再折叠”是指从包涵体分离的蛋白质由先前无规取向被折叠成其特征性和功能性三维结构的过程。“分批进料”过程是指其中在一个时间段内以可控速率将溶解的包涵体混合物(含有所希望的免疫偶联物)添加(即,注射或混合)至适合的再折叠缓冲液的再折叠过程。合适地,在整个时间进程内以稳定速率进行添加,但如果需要在该过程中速率也可以变化。这种添加时间进程在此称为“添加速率”,并且合适地以l/h表示。已出乎意料地发现,其中初始存在的免疫偶联物浓度低,随后该浓度在相对长的时间段内增加(合适地在2、3、4、5、6小时等的进程内添加速率固定)的分批进料过程的使用使得相比利用亚单位批量添加(其中浓度初始较高并且不随时间改变)的非分批进料过程,免疫偶联物产率增加。当利用必须被再折叠在一起(即,在稀释溶液中合并在一起)以便形成最终免疫偶联物的在此所述的vl和vh-pe38亚单位时,相比单独的组分蛋白,这种发现尤其令人惊奇。在示例性实施例中,相比利用亚单位批量添加和恒定亚单位浓度的非分批进料过程,回收的免疫偶联物的产率合适地大至少约20%、大至少约30%、大至少约40%、大至少约50%、大至少约60%、大至少约70%、大至少约80%、大至少约90%、大至少约100%、大至少约125%、大至少约150%、大至少约175%、大至少约200%、大至少约300%、大至少约400%、大至少约500%、大至少约600%、大至少约700%、大至少约800%、大至少约900%等。在某些其他实施例中,回收的免疫偶联物的产率合适地大至少约20%、大至少约30%、大至少约40%、大至少约50%、大至少约60%、大至少约70%、大至少约80%、大至少约90%、大至少约100%、大至少约125%、大至少约150%、大至少约175%、大至少约200%、大至少约300%、大至少约400%、大至少约500%、大至少约600%、大至少约700%、大至少约800%、大至少约900%等,其中该免疫偶联物是在分批进料过程中在具有9.5或更小的ph的再折叠缓冲液中再折叠的。在其他实施例中,使用双循环洗脱在离子交换柱上纯化该再折叠的免疫偶联物,其中在第一次洗脱和第二次洗脱之间利用剥离缓冲液剥离该柱,该剥离缓冲液包含乙醇胺、精氨酸、乙二胺四乙酸(edta)、尿素以及二硫苏糖醇(dtt)。在其他实施例中,回收所述免疫偶联物的过程对应于非分批进料过程,不同之处为在分批进料过程中在具有9.5或更小的ph的再折叠缓冲液中进行再折叠,和/或使用双循环洗脱在离子交换柱上纯化所述免疫偶联物,其中在第一次洗脱和第二次洗脱之间利用剥离缓冲液剥离该柱,该剥离缓冲液包含乙醇胺、精氨酸、乙二胺四乙酸(edta)、尿素以及二硫苏糖醇(dtt)。合适地,设定溶解的包涵体的添加速率(l/h),这样使得将溶解的包涵体混合物在大约2至8小时、合适地3至6小时、3至5小时的进程内或更合适地在约4小时的进程内添加至再折叠缓冲液(合适地预冷冻的)。在实施例中,添加是在1至10小时的进程内,使用约100ml溶解的包涵体每l再折叠缓冲液每小时的添加速率至约5ml溶解的包涵体每l再折叠缓冲液每小时的添加速率(约100ml/l/h至约5ml/l/h)。在示例性实施例中,添加是在2至8小时的进程内,使用约52ml溶解的包涵体每l再折叠缓冲液每小时的添加速率至约13ml溶解的包涵体每l再折叠缓冲液每小时的添加速率(约52ml/l/h至约13ml/l/h)。在其他实施例中,添加是在3至6小时的进程内,使用约35ml溶解的包涵体每l再折叠缓冲液每小时的添加速率至约17ml溶解的包涵体每l再折叠缓冲液每小时的添加速率(约35ml/l/h至约17ml/l/h)。在其他实施例中,添加是在3.5至5小时的进程内,使用约30ml溶解的包涵体每l再折叠缓冲液每小时的添加速率至约18ml溶解的包涵体每l再折叠缓冲液每小时的添加速率(约30ml/l/h至约18ml/l/h)。在另外其他实施例中,添加是在约4小时的进程内,使用约26ml溶解的包涵体每l再折叠缓冲液每小时的添加速率(约26ml/l/h)。在其他实施例中,在在此所述的分批进料过程中还可以利用另外的添加速率。还提供用于制备免疫偶联物的另外方法,其中该免疫偶联物在一个或多个残基处脱酰胺化,并且其中该脱酰胺化作用导致该免疫偶联物效力的抑制。合适地,该方法包括使用在此所述或在wo2012/0152912中披露的任何方法再折叠该免疫偶联物。然后利用双循环洗脱在离子交换柱上纯化该再折叠的免疫偶联物。如在此所述,对于柱清洁和再使用,合适地利用剥离缓冲液在再折叠的免疫偶联物的操作循环(即,柱装载、洗涤、洗脱)之间剥离该柱。在示例性实施例中,在此所述的方法中所利用的剥离缓冲液包含缓冲的精氨酸、尿素以及二硫苏糖醇(dtt)。在此所述的方法按照需要还利用3-、4-、5-、6-、7-、8-、9-、10-等个柱循环,在每个连续循环之间利用所述的剥离缓冲液进行剥离。已出人意料地发现,相比在连续循环之间未利用在此所述的剥离缓冲液的洗脱方法和柱,在连续循环之间使用具有在此所述的组合物,合适地包含尿素和精氨酸的剥离缓冲液,使得最终免疫偶联物的产率增加。在实施例中,相比在连续循环之间未利用在此所述的剥离缓冲液的洗脱方法和柱,回收的免疫偶联物的产率合适地大至少约20%、大至少约30%、大至少约40%、大至少约50%、大至少约60%、大至少约70%、大至少约80%、大至少约90%、大至少约100%、大至少约125%、大至少约150%、大至少约175%、大至少约200%、大至少约300%、大至少约400%、大至少约500%、大至少约600%、大至少约700%、大至少约800%、大至少约900%等。在合适的实施例中,可用于在此所述的方法中的剥离缓冲液包含约0.10至约0.9m精氨酸、约5至10m尿素以及约7至15mmdtt。更合适地,剥离缓冲液包含约0.25至约0.75m精氨酸、约7至9m尿素以及约9至11mmdtt。更合适地,剥离缓冲液包含约0.45至约0.55m精氨酸、约7.5至8.5m尿素以及约9.5至10.5mmdtt。更合适地,剥离缓冲液包含约0.50m精氨酸、约8.0m尿素以及约10.0mmdtt。在在此所述的各种方法中,在此所述的再折叠步骤中所利用的再折叠缓冲液具有小于或约10.0,合适地小于或约9.5,并且更合适地小于或约9.4的ph(例如,约10.0、约9.9、约9.8、约9.7、约9.6、约9.5、约9.3、约9.2、约9.1或约9.0的ph)。已出人意料地发现,使用具有小于或约10.0,合适地小于或约9.5,以及更合适地小于约9.4的ph的再折叠缓冲液,相比利用具有大于上述值的ph的再折叠缓冲液的过程,使得最终免疫偶联物的产率增加。在实施例中,相比利用具有大于上述值的ph的再折叠缓冲液的过程,回收的免疫偶联物的产率合适地大至少约20%、大至少约30%、大至少约40%、大至少约50%、大至少约60%、大至少约70%、大至少约80%、大至少约90%、大至少约100%、大至少约125%、大至少约150%、大至少约175%、大至少约200%、大至少约300%、大至少约400%、大至少约500%、大至少约600%、大至少约700%、大至少约800%、大至少约900%等。在在此所述的各种制备方法中,合适地该免疫偶联物包含抗体或其抗原结合片段。如通篇所述,合适地该抗体或抗原结合片段包含fab、fab'、f(ab')2、fd、单链fv或scfv、双硫化物连接的fv、v-nar结构域、ignar、内抗体、iggδch2、迷你抗体、f(ab')3、四体抗体、三体抗体、双体抗体、单一结构域抗体、dvd-ig、fcab、mab2、(scfv)2、或scfv-fc。如在此所述,合适地该免疫偶联物的抗体或抗原结合片段结合细胞表面受体。示例性细胞表面受体包括cd22。在合适的实施例中,根据在此所述的方法制备的免疫偶联物包含毒素。示例性毒素以及制备此类毒素的方法在全文描述。合适地,该毒素选自下组,该组由以下各项组成:绿脓杆菌外毒素、蓖麻毒素、相思豆毒素、白喉毒素及其亚单位,连同肉毒杆菌毒素a至f或变体、或它们的衍生物。在实施例中,该毒素是绿脓杆菌外毒素或其变体。制备绿脓杆菌外毒素(pe)的示例性方法在此处以及wo2012/015912中详细描述。在实施例中,用于在此所述的免疫偶联物中的绿脓杆菌外毒素具有选自下组的氨基酸序列,该组由以下各项组成:seqidno:16至22。合适地,绿脓杆菌外毒素或其变体具有seqidno:22的氨基酸序列。合适地,为免疫毒素的组分的抗体或其抗原结合片段包含vh序列和vl序列。合适地,该vh序列选自下组,该组由以下各项组成:seqidno:6至11,并且该vl序列选自下组,该组由以下各项组成:seqidno:2以及12至15。如通篇所述,制备免疫偶联物的方法合适地用于制备包含抗cd22抗体或其抗原结合片段以及pe或其变体的免疫偶联物。在合适的实施例中,通过在此所述的各种方法制备的免疫偶联物是包含seqidno:1的vh-pe38亚单位以及seqidno:2的vl亚单位的moxetumomabpasudotox免疫毒素。在其他实施例中,提供制备活性免疫偶联物的方法,该方法组合了在此所述的已确定增加活性免疫偶联物的产率的各种方法。合适地,该免疫偶联物在一个或多个残基处脱酰胺化,并且该脱酰胺化作用导致该免疫偶联物效力的抑制。如在此所述,此类方法合适地包括利用分批进料过程在具有9.5或更小的ph的再折叠缓冲液中再折叠免疫偶联物,以及利用双循环洗脱在离子交换柱上纯化该再折叠的免疫偶联物,其中在第一次洗脱和第二次洗脱之间利用剥离缓冲液剥离该柱,该剥离缓冲液包含乙醇胺、精氨酸、乙二胺四乙酸(edta)、尿素以及二硫苏糖醇(dtt)。合适地,在此所述的各种方法提供从这些方法回收的免疫偶联物的量,该量比利用不包括分批进料再折叠过程和/或在已使用所述剥离缓冲液剥离的离子交换柱上的双循环洗脱和/或未利用具有小于9.4的ph的再折叠缓冲液的方法回收的免疫偶联物的量大至少三百%(300%)。在实施例中,相比不包括分批进料再折叠过程和/或在已使用所述剥离缓冲液剥离的离子交换柱上的双循环洗脱和/或未利用具有小于9.4的ph的再折叠缓冲液的方法,回收的免疫偶联物的量合适地大至少约20%、大至少约30%、大至少约40%、大至少约50%、大至少约60%、大至少约70%、大至少约80%、大至少约90%、大至少约100%、大至少约125%、大至少约150%、大至少约175%、大至少约200%、大至少约300%、大至少约400%、大至少约500%、大至少约600%、大至少约700%、大至少约800%、大至少约900%等。如在此所述,合适地该免疫偶联物包含抗体或其抗原结合片段,包括结合细胞表面受体如cd22的免疫偶联物的抗体或抗原结合片段。在合适的实施例中,该免疫偶联物包含一种毒素,合适地为绿脓杆菌外毒素(pe)。合适地,为免疫毒素的组分的抗体或其抗原结合片段包含vh序列和vl序列。合适地,该vh序列选自下组,该组由以下各项组成:seqidno:6至11,并且该vl序列选自下组,该组由以下各项组成:seqidno:2以及12至15。如通篇所述,制备免疫偶联物的方法合适地用于制备包含抗cd22抗体或其抗原结合片段以及pe或其变体的免疫偶联物。在合适的实施例中,通过在此所述的各种方法制备的免疫偶联物是包含seqidno:1的vh-pe38亚单位以及seqidno:2的vl亚单位的moxetumomabpasudotox免疫毒素。在另外的实施例中,提供包含通过在此所述的各种方法制备的免疫偶联物的组合物。合适地,通过此类方法制备的免疫偶联物具有小于约25%与约1%之间的脱酰胺化种类。更合适地,存在小于约25%的脱酰胺化种类,或存在小于约20%的脱酰胺化种类,或存在小于约10%的脱酰胺化种类,或存在小于约5%的脱酰胺化种类,或存在小于约3%的脱酰胺化种类,或存在小于约2%的脱酰胺化种类,或存在小于约1%的脱酰胺化种类。相关领域的普通技术人员容易清楚的将是在不背离任何这些实施例的范围的情况下,可以对在此描述的这些方法和应用做出其他适合的修改和适配。以下这些实例仅仅出于说明的目的被特此包括并不旨在是限制性的。实例实例1:moxetumomabpasudotox的复性和纯化引言cat-8015(moxetumomabpasudotox)是在大肠杆菌包涵体中产生的重组免疫毒素。活性moxetumomabpasudotox的生成合适地利用从失活前体的再折叠以及通过4柱过程对再折叠产物进行的纯化。图1提供了复性和纯化过程的概括。溶解过程的目的是将vh和vl从不可溶包涵体合适地提取并转移到液相中并且在再折叠之前使这两个亚单位都变性。深层过滤将不可溶细胞碎片和包涵体组分从溶解的vh和vl中去除。随后通过切向流过滤将滤液浓缩至固定的渗余物重量,该重量通过渗余物稀释因子和最终再折叠重量来确定。浓缩步骤的功能是为了确保关于vh和vl浓度以及二硫苏糖醇(dtt)与氧化的谷胱甘肽之比方面的恒定再折叠起始条件。4柱纯化过程的目的是为了将正确折叠的活性moxetumomabpasudotox与产物相关的污染物(如错误折叠的产物变体、聚集体、片段以及生物失活产物电荷同种型)以及过程相关的污染物(包括但不限于宿主细胞dna、宿主细胞蛋白以及外毒素)分开。为了实现商业上可获得的过程,将再折叠和纯化产率最大化同时维持产物质量、活性以及安全性。在此描述的方法和程序已经开发用于免疫偶联物,包括moxetumomabpasudotox药物物质的制造。a.材料和方法1.包涵体溶解将产自合适细胞的vh-pe38(vh)和vl包涵体在室温下解冻12至24小时。vh和vlib溶解起始浓度是0.3gvh/l再折叠以及0.07gvl/l再折叠。将包涵体以1:1的vh:vl摩尔比合并,并且通过添加tris/edta缓冲液(50mmtris、20mmedta,ph7.4)将最终vh浓度调整至10g/l。通过向每kg浓度调整的包涵体溶液添加6kg包涵体溶解缓冲液(50mm乙醇胺、8m尿素、0.5m精氨酸、2mmedta、10mmdtt,ph9.3±0.1)来溶解包涵体。溶解在室温下进行90±15分钟,并持续搅拌。2.包涵体澄清和超滤1通过过滤通过一系列深层过滤器而澄清溶解的包涵体(参见,wo2012/059212)。使用5kda分子量截留(mwco)超滤膜,通过切向流过滤将澄清的滤液浓缩至最终再折叠重量的1/10。3.再折叠和超滤/渗滤2通过将澄清并浓缩的包涵体滤液10倍(w/w)稀释至预先冷却(2至8℃)的再折叠缓冲液(50mm乙醇胺、1m精氨酸、2mmedta、1.0mm氧化的谷胱甘肽,ph9.4)中来再折叠moxetumomabpasudotox。设定添加(l/h),使得在4小时的进程内将澄清并浓缩的包涵体滤液添加至预先冷却的再折叠缓冲液中(合适地,溶解的包涵体/l再折叠缓冲液/h)。允许再折叠反应在持续混合下在2至8℃进行48至72小时,并且在浓缩和渗滤之前升温至室温。将该再折叠溶液通过用10kdamwco膜进行切向流过滤来浓缩,并且然后用10个体积的tmae平衡缓冲液(20mm磷酸盐,ph7.4)来渗滤。4.柱色谱a.fractogeltmae(m)色谱将浓缩并渗滤的再折叠溶液无菌过滤通过0.2μm过滤器,并且上样至用10倍柱体积(cv)的tmae平衡缓冲液(20mm磷酸盐缓冲液,ph7.4)平衡的fractogeltmae柱(emd生物科学(emdbiosciences),或等效物)上。在200cm/h的线性流速下执行色谱步骤,除非另外说明。上样后,柱首先用4cvtmae平衡缓冲液(20mm磷酸盐,ph7.4)洗涤,随后用6cv洗涤缓冲液1(20mm磷酸盐、0.1%tritonx-100)以及8cv洗涤缓冲液2(20mm磷酸盐、100mmnacl,ph7.4)洗涤。将产物用3cv洗脱缓冲液(20mm磷酸盐、200mm氯化钠,ph7.4)从柱中洗脱。洗脱后,柱用3cv剥离缓冲液(50mm乙醇胺、0.5m精氨酸、2mmedta、8m尿素、10mmdtt,ph9.3)剥离。在剥离步骤过程中流速可以减小。随后将柱用3cv注射用水(wfi)洗涤并且用3cv再生溶液(2mnacl)再生。将柱用至少3cv消毒溶液(1n氢氧化钠)消毒并且用3cv短期储存溶液(0.1n氢氧化钠)或3cv长期储存溶液(20mm磷酸盐,20%(w/v)乙醇,ph7.4)储存。b.羟磷灰石色谱羟磷灰石色谱步骤作为流动通过的色谱步骤操作。在250cm/h的线性流速下执行色谱步骤,除非另外说明。将捕获步骤的产物上样至陶瓷羟磷灰石柱(伯乐公司(bio-radlaboratories),或等效物)上,该柱用5cv预平衡缓冲液(400mm磷酸盐,200mm氯化钠,ph7.4)以及5cv平衡缓冲液(20mm磷酸钾,200mm氯化钠,ph7.4)平衡。产物收集在流动通过的级分中。上样后,柱用3cv平衡缓冲液洗涤。将柱用3cv预平衡缓冲液再生,用3cv消毒缓冲液(1n氢氧化钠)消毒并于室温下储存在3cv储存缓冲液(10mm磷酸盐,0.1n氢氧化钠)中。c.苯基650m色谱和超滤/渗滤3将羟磷灰石产物用上样制备缓冲液(20mm磷酸盐,1.2m硫酸钠,ph7.4)以1:1比率(w/w)稀释,并且上样至用5cv平衡缓冲液(20mm磷酸盐,0.6m硫酸钠,ph7.4)平衡的苯基650m柱(东曹达公司,或等效物)上。上样后,柱用1cv平衡缓冲液洗涤。产物用从0至100%洗脱缓冲液(20mm磷酸钠,ph7.4)的20cv线性梯度洗脱。柱用2cv注射用水剥离并且用2cv8m尿素再生。将柱用3cv消毒缓冲液(0.5n氢氧化钠)消毒并且用3cv储存缓冲液(20mm磷酸盐,20%(w/v)乙醇,ph7.4)在室温下储存。苯基650m合并产物使用10个体积的10mmtris(ph8.0),使用利用10kdamwco膜进行的切向流过滤来渗滤。d.q琼脂糖hp色谱和超滤/渗滤4将渗滤的苯基650m产物上样至q琼脂糖hp柱(通用医疗公司(gehealthcare),或等效物)上,该柱用5cv预平衡缓冲液(10mmtris,1m氯化钠,ph8.0)预平衡并且用5cv平衡缓冲液(10mmtris,ph8.0)平衡。将柱用1cv平衡缓冲液洗涤并且然后用3cv65%(v/v)平衡缓冲液、35%(v/v)洗脱缓冲液(10mmtris、0.5m氯化钠,ph8.0)洗涤。产物用从65%(v/v)平衡缓冲液、35%(v/v)洗脱缓冲液至45%(v/v)平衡缓冲液、55%(v/v)洗脱缓冲液的10cv线性梯度洗脱。将柱用2cv预平衡缓冲液剥离并且用3cv消毒缓冲液(1n氢氧化钠)消毒。将柱储存在3cv短期储存溶液(0.1n氢氧化钠)或3cv长期储存溶液(20mm磷酸盐,20%(w/v)乙醇,ph7.4)中。使用10kdamwco膜,通过切向流过滤将q琼脂糖hp产物浓缩至1.3至2mg/ml的目标蛋白浓度。将浓缩的q琼脂糖产物用至少六个体积的配制缓冲液(25mm磷酸钠、4%(w/v)蔗糖、8%(w/v)甘氨酸,ph7.40)渗滤。将渗滤的q琼脂糖hp产物用配制缓冲液稀释至0.95至1.05mg/ml的最终蛋白浓度。5.moxetumomabpasudotox药物物质(ds)的配制将渗滤的q琼脂糖hp产物用配制缓冲液稀释至0.95至1.05mg/ml的最终蛋白浓度,并且随后用配制掺料溶液(10%(w/v)聚山梨醇酯-80)调整至0.02%(w/v)聚山梨醇酯-80以便制备该药物物质。将药物物质0.2μm过滤到无菌hdpe瓶中并在≤-70℃下储存。实例2:moxetumomabpasudotox250l再折叠,试验1a.材料和方法1.过滤器和膜c0hc和x0hcmillistak+hcpod过滤器(各0.55m2)来自密理博公司。pellicon2biomax-5(v筛,2m2)以及pellicon2biomax-10(a筛,0.5和2.5m2)切向流过滤膜来自密理博公司。duraporemillipak20、shcopticapxl150以及shcopticapxl300过滤器来自密理博公司。2.色谱介质和仪器fractogeltmae(m)来自emd。羟磷灰石,1型,40μm,来自伯乐公司。苯基650m来自东曹达公司。q琼脂糖hp来自通用医疗公司。fractogeltmae纯化在bpg140x500柱(通用医疗公司)中执行。羟磷灰石以及苯基650m纯化在bpg100x500柱中执行。q琼脂糖hp纯化在密理博quikscale70x550柱(密理博公司)中执行。所有纯化皆在aktapilot色谱系统上执行。3.250l再折叠规模下的复性将3.39kgvh包涵体(ib)浆液以及0.33kgvlib浆液用3.77kgte缓冲液稀释至10g/l的最终vh浓度。将ib在室温下在44.9kgib溶解缓冲液中溶解90分钟。将溶解的ib溶液用与x0hc深层过滤器(0.55m2)串联连接的c0hc深层过滤器(0.55m2)澄清。溶解并澄清的ib溶液使用pellicon2biomax-5(v筛,2m2)膜通过切向流过滤浓缩至25.5kg的最终超滤液(uf)1渗余物重量。将25kguf1渗余物的温度调整至2℃至8℃,并且将其在4小时的进程内在持续搅拌下添加到225kg预先冷却的再折叠缓冲液(ph9.4)中(合适地,26ml溶解的包涵体/l再折叠缓冲液/h)。在66小时后通过将再折叠溶液的温度增加至室温来终止再折叠。再折叠溶液使用pellicon2biomax-10(a筛,2.5m2)膜通过切向流过滤浓缩至24.9kg,并且随后用10个体积的tmae平衡缓冲液渗滤。4.200l再折叠规模下的纯化如上所述执行moxetumomabpasudotox的纯化。将9.9l和9.3l浓缩并渗滤的再折叠溶液上样至填充的fractogeltmae(m)柱(床高:18cm,体积:2.77l)上。执行两个纯化循环(在两个连续洗脱之间利用剥离缓冲液)。将fractogeltmae(m)洗脱级分合并成单个tmae合并产物(7.1kg),并将其上样至羟磷灰石柱(床高:21.8cm;体积:1.71l)上。将羟磷灰石流动通过合并产物用7.91kg上样制备缓冲液1:1稀释,并上样至苯基650m柱(床高:17.5cm;体积:1.37l)上。将苯基650m合并产物(11.6kg)使用pellicon2biomax-10膜(a筛,0.5m2)通过切向流过滤浓缩至8.1kg,并且随后用10个体积的q琼脂糖hp平衡缓冲液渗滤。将浓缩并渗滤的苯基650m产物上样至q琼脂糖hp柱(床高:18.2cm;体积:0.70l)上。将q琼脂糖hp合并产物(2.8kg)使用pellicon2biomax-10(a筛,0.5m2)膜通过切向流过滤浓缩至2g/l,并且随后用7个体积的配制缓冲液渗滤。将浓缩并渗滤的q琼脂糖hp产物用配制缓冲液稀释至1.02g/l(量:4.7kg)的最终蛋白浓度,并且随后用配制掺料溶液调整至0.02%(w/v)聚山梨醇酯-80。将配制的moxetumomabpasudotox用duraporemillipak20过滤器无菌过滤到petg瓶中并且储存在≤-70℃下。b.结果和讨论1.复性溶解、澄清以及uf1步骤产率通过rp-hplc来评价并且示出于表i和ii中。在深层过滤之前和之后通过浊度测量评价澄清效率(表iii)。表i预再折叠单元操作的vh回收率(%)表ii预再折叠单元操作的vl回收率(%)表iii深层过滤单元操作的澄清效率步骤浊度(ntu)溶解的ib溶液(过滤前)32澄清的ib溶液(过滤后)4.3表iv和ii中的数据表明了ib溶解缓冲液组合物在将vh和vl从包涵体中提取并转移至液相中的有效性。两种亚单位都在溶解的ib溶液中定量地回收。cohc-x0hc深层过滤器组实现溶解的ib溶液的浊度的8倍减小,并且产生适宜于进一步通过切向流过滤处理的光学上透明的溶液。澄清步骤产率对vh和vl是相当的(分别为89.4%和78.8%),尽管这两个亚单位的分子量相差4倍。预再折叠单元操作的优化性能通过最终uf1vh产率达到实现0.3gvh/l再折叠的目标再折叠浓度的所需量这一事实得以证明。通过将uf1渗余物10倍稀释到再折叠缓冲液中来起始moxetumomabpasudotox的再折叠。在4小时进程内将uf1渗余物添加到再折叠缓冲液中以最大化再折叠产率。moxetumomabpasudotox再折叠滴度通过lc-ms来测定,moxetumomabpasudotox在ufdf2合并物中的浓度通过rp-hplc来测定。再折叠产率基于再折叠反应中的初始vh浓度、基于稀释比率以及vh在uf1渗余物合并物中的rp-hplc浓度来计算。再折叠滴度、moxetumomabpasudotoxufdf2浓度以及步骤产率示出于表iv中。表iv再折叠和ufdf步骤产率异二聚体蛋白的再折叠呈现一个重大挑战,因为分离的亚单位可以沿着多个非生产性折叠路径行进,并且形成不可溶的聚集体或错误折叠的失活产物变体。因此,异二聚体蛋白的再折叠的特征通常为低的再折叠滴度和步骤产率。在此所述的再折叠条件已谨慎地向着有效利用包涵体起始材料以及最大化再折叠滴度而优化(表iv)。因此,相比之前的再折叠过程,再折叠滴度以及步骤产率高了大约2至3倍。后再折叠切向流过滤单元操作的功能是通过去除再折叠缓冲液组分以及制备再折叠材料用于捕获步骤纯化来终止再折叠。近87%的再折叠moxetumomabpasudotox的步骤产率是在这种类型的单元操作和起始材料的预期范围内。表iii至iv中的数据表明了所披露方法的性能以及此方法用于从适于制造moxetumomabpasudotox药物物质的失活前体生成生物活性moxetumomabpasudotox的能力。2.纯化通过fractogeltmae(m)、羟磷灰石、苯基650m以及q琼脂糖hp色谱在200l再折叠规模下由浓缩并渗滤的再折叠溶液纯化moxetumomabpasudotox。每个纯化步骤的色谱图示出于图2至5中。fractogeltmae(m)色谱图示出,不仅再折叠的moxetumomabpasudotox,而且大部分产物相关的杂质以及过程相关的杂质结合至柱上,并且在柱流动通过级分中几乎未检测到蛋白质。一些疏水结合的杂质利用非离子型去垢剂tritonx-100(洗涤1)从柱中去除,而一些弱离子结合的杂质利用低浓度盐洗(洗涤2)来去除。折叠的moxetumomabpasudotox的洗脱利用缓冲的200mm氯化钠来实现。大部分结合的杂质利用ib溶解缓冲液从fractogeltmae柱上剥离(剥离1)。在利用2m氯化钠进行第二次剥离(剥离2)过程中观察到很少的蛋白质从柱上被洗脱掉,这证明此缓冲液用于柱清洁目的的有效性。图3中的色谱图示出,moxetumomabpasudotox在20mm磷酸盐存在下未结合至羟磷灰石上,并且在流动通过级分中回收。过程相关的污染物如宿主细胞蛋白、dna以及外毒素在这些条件下紧密接合至羟磷灰石上,并且随后利用400mm磷酸盐、200mm氯化钠剥离缓冲液从树脂中去除。该色谱图示出,moxetumomabpasudotox以及产物相关的杂质以及过程相关的杂质结合至苯基650m树脂上,并且在柱流动通过级分中几乎未检测到蛋白质。moxetumomabpasudotox以降低的盐梯度洗脱,并且在60至30ms/cm的导电率范围内从柱中回收。产物和过程相关的杂质利用水洗(剥离)以及8m尿素溶液(再生)从柱中剥离。在0.5n氢氧化钠消毒步骤过程中未见到280nm下吸光度的增加,这一观察证明了后洗脱清洁方案的有效性。图5中的q琼脂糖hp色谱图示出,在现有结合条件下,moxetumomabpasudotox以及产物相关的杂质以及过程相关的杂质结合至柱上。在柱流动通过级分(上样、追踪)或洗涤级分(洗涤)中未检测到蛋白质。moxetumomabpasudotox利用ph8.0下从175mm氯化钠至275mm氯化钠的增加的缓冲盐梯度从柱中回收。在21与24ms/cm之间的非常窄的导电率范围内从柱洗脱掉moxetumomabpasudotox。剩余的杂质利用1m氯化钠剥离以及1n氢氧化钠溶液从柱中洗脱。总蛋白步骤产率通过280nm下的吸光度测量来测定。纯化批次250l3的总蛋白步骤产率示出于v中。表v总蛋白步骤产率表浓缩并渗滤的再折叠溶液(ufdf2产物,tmae上样样品)含有再折叠的moxetumomabpasudotox,还含有其他蛋白质,包括错误折叠且聚集的产物变体以及宿主细胞蛋白。因此,基于280nm吸光度的蛋白浓度测量值对正确折叠的moxetumomabpasudotox不是特定的,并且因此不能反映fractogeltmae(m)捕获步骤的moxetumomabpasudotox的特定产率。相比之下,羟磷灰石纯化步骤的总蛋白和moxetumomabpasudotox步骤产率彼此紧密一致得多,这是因为fractogeltmae(m)合并产物(羟磷灰石上样)(其中大部分产物相关的杂质以及过程相关的杂质已被去除)的纯度增加。同样获得高回收率用于后续纯化以及缓冲液交换步骤。在200l再折叠规模以及纯化规模下,最终纯化产率为4.6g药物物质。表vi示出产物相关的污染物(包括脱酰胺化的moxetumomabpasudotox、聚集体以及片段)的清除。表vi纯化过程中产物相关的污染物的清除amon=单体bagg=聚集体cothers=片段、低分子量蛋白moxetumomabpasudotox的生物活性取决于vh亚单位中天冬酰胺358的脱酰胺化程度。moxetumomabpasudotox的脱酰胺化通过高效液相离子交换色谱(iec)来分析并且与测量的前锋面积%相关联(参见图6)。表vi中的数据表明,tmae产物中moxetumomabpasudotox的iec前锋面积小于5%,并且q琼脂糖hp色谱将iec前锋面积进一步减小至小于2%,从而提供生物活性产物。fractogeltmae(m)色谱使得单体纯度显著增加,并且如通过高效尺寸排阻色谱(hpsec)所测量的从工艺流中去除了大部分低分子量蛋白以及片段。苯基650m色谱提供片段以及聚集体的额外清除,并且生成通过hpsec分析具有99%单体纯度的moxetumomabpasudotox合并产物。表vii示出过程相关的污染物(包括宿主细胞蛋白、dna以及外毒素)的清除。表vii纯化过程中过程相关的污染物的清除表vii表明了fractogeltmae(m)捕获步骤以及羟磷灰石色谱在从moxetumomabpasudotox工艺流中去除过程相关的污染物方面的有效性。fractogeltmae(m)色谱将宿主细胞蛋白浓度降低超过5倍,并且将外毒素浓度降低超过600倍。羟磷灰石色谱进一步将宿主细胞蛋白浓度降低大约8倍,将外毒素浓度降低超过36倍并且将残余dna浓度降低超过1000倍至定量限度以下。苯基650m色谱实现宿主细胞蛋白浓度的另外6.5倍降低,而q琼脂糖hp色谱提供外毒素浓度的另外20倍降低。表vi和vii中的数据表明了在此所述的纯化方法的性能以及这些方法生成适合于临床试验的高质量药物物质的能力。实例3:moxetumomabpasudotox250l再折叠,试验2a.材料和方法1.过滤器和膜c0hc和x0hcmillistak+hcpod过滤器(各0.55m2)来自密理博公司。pellicon2biomax-5(v筛,2m2)以及pellicon2biomax-10(a筛,0.5和2.5m2)切向流过滤膜来自密理博公司。duraporemillipak20、shcopticapxl150以及shcopticapxl300过滤器来自密理博公司。2.色谱介质和仪器fractogeltmae(m)来自emd。羟磷灰石,1型,40m,来自伯乐公司。苯基650m来自东曹达公司。q琼脂糖hp来自通用医疗公司。fractogeltmae纯化在bpg140x500柱(通用医疗公司)中执行。羟磷灰石、苯基650m以及q琼脂糖hp纯化在bpg100x500柱中进行。所有纯化皆在aktapilot色谱系统上执行。3.250l再折叠规模下的复性将3.40kgvhib浆液以及0.33kgvlib浆液用3.77kgte缓冲液稀释至10g/l的最终vh浓度。将ib在室温下在45.0kgib溶解缓冲液中溶解90分钟。将溶解的ib溶液用与x0hc深层过滤器(0.55m2)串联连接的c0hc深层过滤器(0.55m2)澄清。溶解并澄清的ib溶液使用pellicon2biomax-5(v筛,2m2)膜通过切向流过滤浓缩至25.5kg的最终uf1渗余物重量。将25kguf1渗余物的温度调整至2℃-8℃,并且将其在4小时的进程内在持续搅拌下添加到225kg预先冷却的再折叠缓冲液(ph9.4)中(合适地,25ml溶解的包涵体/l再折叠缓冲液/h)。在66小时后通过将再折叠溶液的温度增加至室温来终止再折叠。再折叠溶液使用pellicon2biomax-10(a筛,2.5m2)膜通过切向流过滤浓缩至22.6kg,并且随后用10个体积的tmae平衡缓冲液渗滤。4.200l再折叠规模下的纯化如上所述执行moxetumomabpasudotox的纯化。将9l和8.7l浓缩并渗滤的再折叠溶液上样至填充的fractogeltmae(m)柱(床高:18cm,体积:2.77l)上。执行两个纯化循环,在两个连续洗脱之间利用所披露的剥离缓冲液进行剥离。将fractogeltmae(m)洗脱级分合并成单个tmae合并产物(6.2kg),并将其上样至羟磷灰石柱(床高:21.8cm;体积:1.71l)上。将羟磷灰石流动通过合并产物用6.7kg上样制备缓冲液1:1稀释,并上样至苯基650m柱(床高:17.5cm;体积:1.37l)上。将苯基650m合并产物(10.1kg)使用pellicon2biomax-10膜(a筛,0.5m2)通过切向流过滤浓缩至8.0kg,并且随后用10个体积的q琼脂糖hp平衡缓冲液渗滤。将浓缩并渗滤的苯基650m产物上样至q琼脂糖hp柱(床高:18.2cm;体积:1.4l)上。将q琼脂糖hp合并产物(5.1kg)使用pellicon2biomax-10(a筛,0.5m2)膜通过切向流过滤浓缩至2g/l,并且随后用7个体积的配制缓冲液渗滤。将浓缩并渗滤的q琼脂糖hp产物用配制缓冲液稀释至1.05g/l(量:5.4kg)的最终蛋白浓度,并且随后用配制掺料溶液调整至0.02%(w/v)聚山梨醇酯-80。将配制的moxetumomabpasudotox用duraporemillipak20过滤器无菌过滤到petg瓶中并且储存在≤-70℃下。b.结果和讨论1.复性溶解、澄清以及uf1步骤产率通过rp-hplc来评价并且示出于表viii和ix中。在过滤之前和之后通过浊度测量评价澄清效率(表3.2.2.1-3)。表viii预再折叠单元操作的vh回收率(%)表ix预再折叠单元操作的vl回收率(%)表x深层过滤单元操作的澄清效率步骤浊度(ntu)溶解的ib溶液(过滤前)35.7澄清的ib溶液(过滤后)6.0表viii和ix中的数据示出,如通过rp-hplc分析测量的,vh和vl定量地在uf1渗余物合并物中从初始ib浆液中回收。深层过滤将溶解的ib溶液的浊度降低了大约6倍,并且产生光学上透明的溶液,该溶液在再折叠前通过切向流过滤进一步浓度。通过在4小时的进程内将uf1渗余物10倍稀释到预先冷却的再折叠缓冲液中来起始moxetumomabpasudotox的再折叠。uf1渗余物在添加至再折叠缓冲液的过程中保持在2℃-8℃,以便最大化脱酰胺化产物变体的生成。moxetumomabpasudotox的再折叠滴度通过lc-ms来测定。moxetumomabpasudotox在ufdf2合并物中的浓度通过rp-hplc来测定。再折叠步骤产率基于再折叠反应中的初始vh浓度来计算,该初始vh浓度通过uf1vh浓度以及稀释因子来确定。再折叠以及ufdf2步骤产率示出于表xi中。表xi再折叠和ufdf步骤产率相比之前的moxetumomabpasudotox再折叠过程,再折叠滴度高大约2至3倍。10%的步骤产率与之前的moxetumomabpasudotox再折叠过程相当。后再折叠切向流过滤单元操作的功能是通过去除再折叠缓冲液组分以及制备再折叠材料用于捕获步骤纯化来终止再折叠。表xi中的步骤产率数据示出,再折叠的moxetumomabpasudotox从ufdf2单元操作中定量回收。表iii至iv中的数据表明了所披露方法的性能以及这些方法用于从适于制造药物物质的失活前体生成生物活性免疫偶联物(合适地,moxetumomabpasudotox)的能力。2.纯化通过fractogeltmae(m)、羟磷灰石、苯基650m以及q琼脂糖hp色谱在200l再折叠规模下由浓缩并渗滤的再折叠溶液纯化moxetumomabpasudotox。每个纯化步骤的色谱图示出于图7至10中。fractogeltmae(m)色谱示出,再折叠的moxetumomabpasudotox以及大部分产物相关的杂质以及过程相关的杂质结合至柱上。在上样步骤结束时观察到蛋白质的断裂;这与实例2中的纯化相反,在其中柱上样步骤结束时未检测到蛋白质的断裂。图8中的色谱图示出,moxetumomabpasudotox在20mm磷酸盐存在下未结合至羟磷灰石上,并且在流动通过级分中回收。图9中的色谱图示出,moxetumomabpasudotox以及产物相关的杂质以及过程相关的杂质结合至苯基650m树脂上,并且在柱流动通过级分中几乎未检测到蛋白质。moxetumomabpasudotox以降低的盐梯度洗脱,并且在60至30ms/cm的导电率范围内从柱中回收。图10中的q琼脂糖hp色谱图示出,moxetumomabpasudotox以及产物相关的杂质以及过程相关的杂质结合至柱上。在柱流动通过级分(上样、追踪)或洗涤级分(洗涤)中未检测到蛋白质。moxetumomabpasudotox利用ph8.0下从175mm氯化钠至275mm氯化钠的增加的缓冲盐梯度从柱中回收。在21与24ms/cm之间的非常窄的导电率范围内从柱洗脱掉活性moxetumomabpasudotox。剩余的杂质利用1m氯化钠剥离以及1n氢氧化钠溶液从柱中洗脱。总蛋白质步骤产率通过280nm下的吸光度测量来测定。总蛋白质步骤产率示出于表xii中。表xii蛋白质与moxetumomabpasudotox步骤产率表如上所述,浓缩并渗滤的再折叠溶液(ufdf2产物,tmae上样样品)含有再折叠的moxetumomabpasudotox,还含有其他蛋白质,包括错误折叠且聚集的产物变体以及宿主细胞蛋白。因此,基于280nm吸光度的蛋白浓度测量值对正确折叠的moxetumomabpasudotox不是特定的,并且因此不能反映fractogeltmae(m)捕获步骤的moxetumomabpasudotox的特定产率。相比之下,羟磷灰石纯化步骤的总蛋白和moxetumomabpasudotox步骤产率彼此紧密一致得多,这是因为fractogeltmae(m)合并产物(羟磷灰石上样)(其中大部分产物相关的杂质以及过程相关的杂质已被去除)的纯度增加。对于相同单元操作,实例3的苯基650m以及ufdf3步骤产率与实例2中实现的步骤产率相当。此处,q琼脂糖hp柱的体积从0.7l增加至1.4l,以便降低此纯化步骤的柱上样量。因此,柱上样量从实例2中的10.4g/l树脂降低至实例3中的4.5g/l树脂。q琼脂糖hp步骤产率提高了近20%,从实例2中的69%提高至实例3中的88%。q琼脂糖hp步骤产率相比之前的moxetumomabpasudotoxq琼脂糖hp过程产率高了2至3倍。在200l再折叠规模以及纯化规模下,最终纯化产率为5.6g药物物质。表xiii示出产物相关的污染物(包括脱酰胺化的moxetumomabpasudotox、聚集体以及片段)的清除。表xiii纯化过程中过程相关的污染物的清除amon=单体bagg=聚集体cothers=片段、低分子量蛋白iec前锋面积%、脱酰胺化以及moxetumomabpasudotox生物活性的关联先前已经在上文讨论。表xiii中的数据示出,实例3中羟磷灰石合并产物中的moxetumomabpasudotox的iec前锋面积比实例2中的高超过2倍。苯基650m以及q琼脂糖hp色谱将iec前锋面积降低了大约5%至小于3.5%,产生生物活性的产物。表xiii表明,fractogeltmae(m)色谱使得单体纯度显著增加,并且如通过高效尺寸排阻色谱(hpsec)所测量的从工艺流中去除了大部分低分子量蛋白以及片段。苯基650m色谱提供片段以及聚集体的额外清除,并且生成通过hpsec分析具有99.5%单体纯度的moxetumomabpasudotox合并产物。表xiv示出过程相关的污染物(包括宿主细胞蛋白、dna以及外毒素)的清除。表xiv纯化过程中过程相关的污染物的清除表xiv中的数据表明了fractogeltmae(m)捕获步骤以及羟磷灰石色谱在从moxetumomabpasudotox工艺流中去除过程相关的污染物方面的有效性。fractogeltmae(m)色谱将宿主细胞蛋白浓度降低大约20倍,并且将外毒素浓度降低超过800倍。fractogeltmae(m)色谱实现了将宿主细胞dna清除至定量限度以下。羟磷灰石色谱进一步将宿主细胞蛋白浓度降低大约2倍,并且将外毒素浓度降低超过10倍。苯基650m色谱实现宿主细胞蛋白浓度的近9倍降低,而q琼脂糖hp色谱提供外毒素浓度的另外30倍降低。3.概述对于实例2和3中所述的两种纯化,实现相当的药物物质产率。数据表明了在此所述的复性和纯化方法的再现性以及这些方法生成适合于临床试验的高质量药物物质的能力。相比先前的moxetumomabpasudotox复性和纯化方法,在此所述的方法还有助于总过程产率的显著提高。这些过程改进将在使moxetumomabpasudotox的制造成为经济上可行的过程中起到重要作用。实例4:fractogeltmae(m)清洁方法经济上可行的纯化过程的操作指示,色谱树脂用于多个制备循环。这要求有效的柱清洁方法以及产物连同产物相关的污染物与过程相关的污染物在下一个纯化循环开始之前从柱去除到可接受的水平之下这一证明。再折叠滴度低、但产物相关的杂质与过程相关的杂质(包括聚集体、错误折叠的蛋白、细菌dna、宿主细胞蛋白以及外毒素)浓度高对基于大肠杆菌包涵体的药物物质制造过程中的后再折叠捕获柱提出了重大挑战。对于moxetumomabpasudotox制造过程,发现大部分杂质紧密集合至fractogeltmae(m)树脂上并且未能利用含有2m氯化钠抑或未缓冲的8m尿素的两种洗涤溶液从柱中有效去除。发现ph9.3的含有8m尿素、0.5m精氨酸、50mm乙醇胺、2mmedta以及10mmdtt的缓冲液在将过程相关的污染物与产物相关的污染物从fractogeltmae(m)树脂中去除方面有效。a.材料和方法1.色谱介质和仪器fractogeltmae(m)来自emd。纯化在tricorn5/200柱中执行。所有纯化皆在aktapilot色谱系统上执行。2.fractogeltmae(m)纯化和残留分析如上所述执行fractogeltmae(m)纯化。用浓缩并渗滤的再折叠溶液将fractogeltmae(m)柱上样至20g蛋白/l树脂。对于残留分析,如上运行fractogeltmae柱,但不上样蛋白质,并且在说明时不利用tritonx-100洗涤缓冲液。3.结果和讨论图11示出fractogeltmae捕获步骤色谱图,其使用2mnacl(剥离1)、8m尿素(剥离2)以及1n氢氧化钠作为柱清洁和消毒溶液。fractogeltmae(m)纯化顺序在表xv中描述。表xv图11的fractogeltmae(m)纯化顺序在柱清洁步骤过程中观察到几个峰。随后在相同的柱上执行没有蛋白上样和洗涤1缓冲液的空白运行。表xvi描述了空白运行的fractogeltmae纯化顺序。表xvi图12的fractogeltmae(m)纯化顺序图12示出,当再次用2mnacl(剥离1)以及8m尿素(剥离2)剥离之前清洁的柱时,观察到显著的残留峰。对于根据表xvi实行的至少两个另外的运行观察到相同的曲线,这表明上述清洁和消毒方法未有效从树脂去除产物相关的污染物以及过程相关的污染物。基于含有8m尿素、0.5m精氨酸以及10mmdtt的缓冲液能够溶解大肠杆菌包涵体这一观察,moxetumomabpasudotoxib溶解缓冲液(50mm乙醇胺、8m尿素、0.5m精氨酸、2mmedta、10mmdtt,ph9.5)作为捕获步骤柱清洁溶液进行测试。纯化顺序在表xvii中描述。表xvii图13的fractogeltmae(m)纯化顺序图13示出利用5cv剥离使用moxetumomabpasudotoxib溶解缓冲液的fractogeltmaem捕获色谱图。当用ib溶解缓冲液(剥离1)清洁该柱时观察到非常强的峰;在随后的高盐洗(剥离2)或消毒步骤中几乎没有另外的蛋白质从柱洗脱。图14示出随后的无蛋白质上样的fractogeltmae(m)色谱图。纯化顺序在表xviii中描述。表xviii图14至16的fractogeltmae(m)纯化顺序表xviii图14至16的fractogeltmae(m)纯化顺序未观察到产物相关的污染物以及过程相关的污染物的残留。剥离和消毒步骤过程中观察到的吸收峰是由于ib溶解缓冲液组分的背景吸收(参见图15的利用新树脂的空白缓冲液色谱图)。图16中所见的9次纯化循环之后的fractogeltmae(m)残留色谱图与图15中所见的利用新树脂的空白缓冲液色谱图一致,这表明ib溶解缓冲液有效地将树脂清洁并再生至其原始状态。实例4:卡普托蓝捕获作为阴离子交换捕获的替代方案,使用cibacronblue染料色谱在稍微酸性条件下从后再折叠uf/df2合并物捕获moxetumomabpasudotox。moxetumomabpasudotox与cibacronblue染料配体的相互作用在性质上是多模态的并且是相当强的。moxetumomabpasudotox在cibacronblue树脂上的选择性结合可以利用离子组分以及疏水组分如丙二醇来调整。通过cibacronblue染料对moxetumomabpasudotox的捕获如在此所述。a.材料和方法1.色谱和仪器卡普托蓝琼脂糖是来自通用医疗公司。卡普托蓝琼脂糖纯化是在xk16/20柱(通用医疗公司)中进执行。所有纯化皆在aktaexplorer色谱系统上执行。2.纯化如上所述执行卡普托蓝琼脂糖纯化。将浓缩、渗滤并调整的再折叠溶液上样至卡普托蓝柱(柱体积:39ml)上,直至10gmoxetumomabpasudotox/l树脂的上样量。3.结果和讨论在上样过程中看见流动通过的吸收信号,这可归因于未结合的杂质,而几乎所有的moxetumomabpasudotox产物都被卡普托蓝琼脂糖树脂捕获。图17示出代表性的卡普托蓝捕获步骤色谱图。在图18中的sds-page凝胶中可以见到moxetumomabpasudotox的选择性结合,因为在上样流动通过级分中检测到非常少的moxetumomabpasudotox。卡普托蓝琼脂糖示出高分子量种类的卓越去除。如图18中所见,uf/df2合并物含有高水平的高分子量种类,这些种类也在流动通过级分中以及8m尿素剥离峰中见到,但未在洗脱合并物中检测到。因此,与uf/df2合并物相比,洗脱合并物相当洁净。图19示出第二个代表性的卡普托蓝琼脂糖捕获步骤色谱图。表xix概述了示出于图19中的卡普托蓝琼脂糖纯化的性能。表xix卡普托蓝柱性能概述表xix卡普托蓝柱性能概述uf/df2合并物卡普托蓝合并物sec-其他(%)-11.1%在上样过程中观察到未结合杂质的断裂,随后在氯化钠洗脱梯度过程中观察到洗脱峰。表xix示出,uf/df2合并物含有583.7毫克总蛋白(通过280nm下的吸光度测量),但仅含有58.4毫克moxetumomabpasudotox产物(通过rp-hplc测量)。卡普托蓝合并物含有58.4毫克总蛋白,其中53.5毫克是moxetumomabpasudotox,从而产生仅9.4%的总蛋白产率,但91.7%的moxetumomabpasudotox产率。通过卡普托蓝色谱步骤实现了4.6倍的hcp减少。将丙二醇与氯化钠组合添加到洗脱缓冲液中以调整moxetumomabpasudotox结合。仅利用氯化钠的洗脱产生宽的洗脱峰;然而,氯化钠梯度洗脱中丙二醇的存在锐化了洗脱峰并且增大了产物产率。图17至19表明了在此所述的卡普托蓝琼脂糖纯化方法的再现性以及它们从由完整产物以及错误折叠的聚集的产物变体以及过程相关的杂质组成的复合溶液中选择性地捕获再折叠的免疫偶联物(包括moxetumomabpasudotox)的能力。本申请中所引述的所有文件、专利、期刊论文和其他材料通过引用结合在此。尽管已经结合本发明的若干实施例,参照附图完整地描述本发明,但应理解的是,不同变化和修改对于本领域的技术人员可以是显而易见的。应理解,此类变化和修改都包括在如所附权利要求书所界定的本发明的范围内,除非它们背离该范围。序列表<110>米迪缪尼有限公司<120>生产免疫偶联物的方法<130>moxe-302wo1<140>pct/us2013/076625<141>2013-12-19<150>61/740,111<151>2012-12-20<160>23<170>patentin3.5版<210>1<211>472<212>prt<213>人工序列<220><223>人工序列:合成多肽的描述<400>1metgluvalglnleuvalgluserglyglyglyleuvallysprogly151015glyserleulysleusercysalaalaserglyphealapheserile202530tyraspmetsertrpvalargglnthrproglulyscysleuglutrp354045valalatyrileserserglyglyglythrthrtyrtyrproaspthr505560vallysglyargphethrileserargaspasnalalysasnthrleu65707580tyrleuglnmetserserleulyssergluaspthralamettyrtyr859095cysalaarghisserglytyrglythrhistrpglyvalleupheala100105110tyrtrpglyglnglythrleuvalseralalysalaserglyglypro115120125gluglyglyserleualaalaleuthralahisglnalacyshisleu130135140proleugluthrphethrarghisargglnproargglytrpglugln145150155160leugluglncysglytyrprovalglnargleuvalalaleutyrile165170175alaalaargleusertrpasnglnvalaspglnvalileargalaleu180185190alaserproglyserglyglyaspleuglyglualaileargglugln195200205progluglnalaargleualaleuthrleualaalaalagluserglu210215220argphevalargglnglythrglyasnaspglualaglyalaalaasn225230235240glyproalaaspserglyaspalaleuleugluargasntyrprothr245250255glyalaglupheleuglyaspglyglyaspvalserpheserthrarg260265270glythrglnasntrpthrvalgluargleuleuglnalahisarggln275280285leuglugluargglytyrvalphevalglytyrhisglythrpheleu290295300glualaalaglnserilevalpheglyglyvalargalaargsergln305310315320aspleuaspalailetrpargglyphetyrilealaglyaspproala325330335leualatyrglytyralaglnaspglngluproaspalaargglyarg340345350ileargasnglyalaleuleuargvaltyrvalproargserserleu355360365proglyphetyrargthrserleuthrleualaalaproglualaala370375380glygluvalgluargleuileglyhisproleuproleuargleuasp385390395400alailethrglyprogluglugluglyglyargleugluthrileleu405410415glytrpproleualagluargthrtrpileproseralaileprothr420425430aspproargasnvalglyglyaspleuaspproserserileproasp435440445lysgluglnalaileseralaleuproasptyralaserglnprogly450455460lysproproarggluaspleulys465470<210>2<211>108<212>prt<213>人工序列<220><223>人工序列:合成多肽的描述<400>2metaspileglnmetthrglnthrthrserserleuseralaserleu151015glyaspargvalthrilesercysargalaserglnaspileserasn202530tyrleuasntrptyrglnglnlysproaspglythrvallysleuleu354045iletyrtyrthrserileleuhisserglyvalproserargpheser505560glyserglyserglythrasptyrserleuthrileserasnleuglu65707580glngluaspphealathrtyrphecysglnglnglyasnthrleupro859095trpthrpheglycysglythrlysleugluilelys100105<210>3<211>4<212>prt<213>人工序列<220><223>人工序列:合成肽的描述<400>3lysaspgluleu1<210>4<211>4<212>prt<213>人工序列<220><223>人工序列:合成肽的描述<400>4arggluaspleu1<210>5<211>5<212>prt<213>人工序列<220><223>人工序列:合成肽的描述<400>5arggluaspleulys15<210>6<211>124<212>prt<213>人工序列<220><223>人工序列:合成多肽的描述<400>6metgluvalglnleuvalgluserglyglyglyleuvallysprogly151015glyserleulysleusercysalaalaserglyphealapheserile202530tyraspmetsertrpvalargglnthrproglulyscysleuglutrp354045valalatyrileserserglyglyglythrthrtyrtyrproaspthr505560vallysglyargphethrileserargaspasnalalysasnthrleu65707580tyrleuglnmetserserleulyssergluaspthralamettyrtyr859095cysalaarghisserglytyrglythrhistrpglyvalleupheala100105110tyrtrpglyglnglythrleuvalthrvalserala115120<210>7<211>124<212>prt<213>人工序列<220><223>人工序列:合成多肽的描述<400>7metgluvalglnleuvalgluserglyglyglyleuvallysprogly151015glyserleulysleusercysalaalaserglyphealapheserile202530tyraspmetsertrpvalargglnthrproglulyscysleuglutrp354045valalatyrileserserglyglyglythrthrtyrtyrproaspthr505560vallysglyargphethrileserargaspasnalalysasnthrleu65707580tyrleuglnmetserserleulyssergluaspthralamettyrtyr859095cysalaarghisserglytyrglytyrasntrpglyvalleupheala100105110tyrtrpglyglnglythrleuvalthrvalserala115120<210>8<211>124<212>prt<213>人工序列<220><223>人工序列:合成多肽的描述<400>8metgluvalglnleuvalgluserglyglyglyleuvallysprogly151015glyserleulysleusercysalaalaserglyphealapheserile202530tyraspmetsertrpvalargglnthrproglulyscysleuglutrp354045valalatyrileserserglyglyglythrthrtyrtyrproaspthr505560vallysglyargphethrileserargaspasnalalysasnthrleu65707580tyrleuglnmetserserleulyssergluaspthralamettyrtyr859095cysalaarghisserglytyrglythrthrtrpglyvalleupheala100105110tyrtrpglyglnglythrleuvalthrvalserala115120<210>9<211>124<212>prt<213>人工序列<220><223>人工序列:合成多肽的描述<400>9metgluvalglnleuvalgluserglyglyglyleuvallysprogly151015glyserleulysleusercysalaalaserglyphealapheserile202530tyraspmetsertrpvalargglnthrproglulyscysleuglutrp354045valalatyrileserserglyglyglythrthrtyrtyrproaspthr505560vallysglyargphethrileserargaspasnalalysasnthrleu65707580tyrleuglnmetserserleulyssergluaspthralamettyrtyr859095cysalaarghisserglytyrglyserthrtyrglyvalleupheala100105110tyrtrpglyglnglythrleuvalthrvalserala115120<210>10<211>124<212>prt<213>人工序列<220><223>人工序列:合成多肽的描述<400>10metgluvalglnleuvalgluserglyglyglyleuvallysprogly151015glyserleulysleusercysalaalaserglyphealapheserile202530tyraspmetsertrpvalargglnthrproglulyscysleuglutrp354045valalatyrileserserglyglyglythrthrtyrtyrproaspthr505560vallysglyargphethrileserargaspasnalalysasnthrleu65707580tyrleuglnmetserserleulyssergluaspthralamettyrtyr859095cysalaarghisserglytyrglythrhistrpglyvalleupheala100105110tyrtrpglyglnglythrleuvalthrvalserala115120<210>11<211>124<212>prt<213>人工序列<220><223>人工序列:合成多肽的描述<400>11metgluvalglnleuvalgluserglyglyglyleuvallysprogly151015glyserleulysleusercysalaalaserglyphealapheserile202530tyraspmetsertrpvalargglnthrproglulyscysleuglutrp354045valalatyrileserserglyglyglythrthrtyrtyrproaspthr505560vallysglyargphethrileserargaspasnalalysasnthrleu65707580tyrleuglnmetserserleulyssergluaspthralamettyrtyr859095cysalaarghisserglytyrglysersertyrglyvalleupheala100105110tyrtrpglyglnglythrleuvalthrvalserala115120<210>12<211>108<212>prt<213>人工序列<220><223>人工序列:合成多肽的描述<400>12metaspileglnmetthrglnthrthrserserleuseralaserleu151015glyaspargvalthrilesercysargalaserglnaspilealaarg202530tyrleuasntrptyrglnglnlysproaspglythrvallysleuleu354045iletyrtyrthrserileleuhisserglyvalproserargpheser505560glyserglyserglythrasptyrserleuthrileserasnleuglu65707580glngluaspphealathrtyrphecysglnglnglyasnthrleupro859095trpthrpheglycysglythrlysleugluilelys100105<210>13<211>108<212>prt<213>人工序列<220><223>人工序列:合成多肽的描述<400>13metaspileglnmetthrglnthrthrserserleuseralaserleu151015glyaspargvalthrilesercysargalaserglnaspilehisgly202530tyrleuasntrptyrglnglnlysproaspglythrvallysleuleu354045iletyrtyrthrserileleuhisserglyvalproserargpheser505560glyserglyserglythrasptyrserleuthrileserasnleuglu65707580glngluaspphealathrtyrphecysglnglnglyasnthrleupro859095trpthrpheglycysglythrlysleugluilelys100105<210>14<211>108<212>prt<213>人工序列<220><223>人工序列:合成多肽的描述<400>14metaspileglnmetthrglnthrthrserserleuseralaserleu151015glyaspargvalthrilesercysargalaserglnaspileglyarg202530tyrleuasntrptyrglnglnlysproaspglythrvallysleuleu354045iletyrtyrthrserileleuhisserglyvalproserargpheser505560glyserglyserglythrasptyrserleuthrileserasnleuglu65707580glngluaspphealathrtyrphecysglnglnglyasnthrleupro859095trpthrpheglycysglythrlysleugluilelys100105<210>15<211>108<212>prt<213>人工序列<220><223>人工序列:合成多肽的描述<400>15metaspileglnmetthrglnthrthrserserleuseralaserleu151015glyaspargvalthrilesercysargalaserglnaspilearggly202530tyrleuasntrptyrglnglnlysproaspglythrvallysleuleu354045iletyrtyrthrserileleuhisserglyvalproserargpheser505560glyserglyserglythrasptyrserleuthrileserasnleuglu65707580glngluaspphealathrtyrphecysglnglnglyasnthrleupro859095trpthrpheglycysglythrlysleugluilelys100105<210>16<211>595<212>prt<213>绿脓杆菌外毒素<400>16alagluglualapheaspleutrpasnglucysalalysalacysval151015leuaspleulysaspglyvalargserserargmetservalasppro202530alailealaaspthrasnglyglnglyvalleuhistyrsermetval354045leugluglyglyasnaspalaleulysleualaileaspasnalaleu505560serilethrseraspglyleuthrileargleugluglyglyvalglu65707580proasnlysprovalargtyrsertyrthrargglnalaargglyser859095trpserleuasntrpleuvalproileglyhisglulysproserasn100105110ilelysvalpheilehisgluleuasnalaglyasnglnleuserhis115120125metserproiletyrthrileglumetglyaspgluleuleualalys130135140leualaargaspalathrphephevalargalahisgluserasnglu145150155160metglnprothrleualaileserhisalaglyvalsertrpmetala165170175glnthrglnproargargglulysargtrpserglutrpalasergly180185190lysvalleucysleuleuaspproleuaspglyvaltyrasntyrleu195200205alaglnglnargcysasnleuaspaspthrtrpgluglylysiletyr210215220argvalleualaglyasnproalalyshisaspleuaspilelyspro225230235240thrvalileserhisargleuhispheprogluglyglyserleuala245250255alaleuthralahisglnalacyshisleuproleugluthrphethr260265270arghisargglnproargglytrpgluglnleugluglncysglytyr275280285provalglnargleuvalalaleutyrleualaalaargleusertrp290295300asnglnvalaspglnvalileargasnalaleualaserproglyser305310315320glyglyaspleuglyglualailearggluglnprogluglnalaarg325330335leualaleuthrleualaalaalaglusergluargphevalarggln340345350glythrglyasnaspglualaglyalaalaasnglyproalaaspser355360365glyaspalaleuleugluargasntyrprothrglyalaglupheleu370375380glyaspglyglyaspvalserpheserthrargglythrglnasntrp385390395400thrvalgluargleuleuglnalahisargglnleuglugluarggly405410415tyrvalphevalglytyrhisglythrpheleuglualaalaglnser420425430ilevalpheglyglyvalargalaargserglnaspleuaspalaile435440445trpargglyphetyrilealaglyaspproalaleualatyrglytyr450455460alaglnaspglngluproaspalaargglyargileargasnglyala465470475480leuleuargvaltyrvalproargserserleuproglyphetyrarg485490495thrserleuthrleualaalaproglualaalaglygluvalgluarg500505510leuileglyhisproleuproleuargleuaspalailethrglypro515520525gluglugluglyglyargleugluthrileleuglytrpproleuala530535540gluargthrtrpileproseralaileprothraspproargasnval545550555560glyglyaspleuaspproserserileproasplysgluglnalaile565570575seralaleuproasptyralaserglnproglylysproproargglu580585590aspleulys595<210>17<211>361<212>prt<213>人工序列<220><223>人工序列:合成多肽的描述<400>17glyglyserleualaalaleuthralahisglnalacyshisleupro151015leugluthrphethrarghisargglnproargglytrpgluglnleu202530gluglncysglytyrprovalglnargleuvalalaleutyrleuala354045alaargleusertrpasnglnvalaspglnvalileargasnalaleu505560alaserproglyserglyglyaspleuglyglualaileargglugln65707580progluglnalaargleualaleuthrleualaalaalagluserglu859095argphevalargglnglythrglyasnaspglualaglyalaalaasn100105110alaaspvalvalserleuthrcysprovalalaalaglyglucysala115120125glyproalaaspserglyaspalaleuleugluargasntyrprothr130135140glyalaglupheleuglyaspglyglyaspvalserpheserthrarg145150155160glythrglnasntrpthrvalgluargleuleuglnalahisarggln165170175leuglugluargglytyrvalphevalglytyrhisglythrpheleu180185190glualaalaglnserilevalpheglyglyvalargalaargsergln195200205aspleuaspalailetrpargglyphetyrilealaglyaspproala210215220leualatyrglytyralaglnaspglngluproaspalaargglyarg225230235240ileargasnglyalaleuleuargvaltyrvalproargserserleu245250255proglyphetyrargthrserleuthrleualaalaproglualaala260265270glygluvalgluargleuileglyhisproleuproleuargleuasp275280285alailethrglyprogluglugluglyglyargleugluthrileleu290295300glytrpproleualagluargthrvalvalileproseralailepro305310315320thraspproargasnvalglyglyaspleuaspproserserilepro325330335asplysgluglnalaileseralaleuproasptyralaserglnpro340345350glylysproproarggluaspleulys355360<210>18<211>344<212>prt<213>人工序列<220><223>人工序列:合成多肽的描述<400>18glyglyserleualaalaleuthralahisglnalacyshisleupro151015leugluthrphethrarghisargglnproargglytrpgluglnleu202530gluglncysglytyrprovalglnargleuvalalaleutyrleuala354045alaargleusertrpasnglnvalaspglnvalileargasnalaleu505560alaserproglyserglyglyaspleuglyglualaileargglugln65707580progluglnalaargleualaleuthrleualaalaalagluserglu859095argphevalargglnglythrglyasnaspglualaglyalaalaasn100105110glyproalaaspserglyaspalaleuleugluargasntyrprothr115120125glyalaglupheleuglyaspglyglyaspvalserpheserthrarg130135140glythrglnasntrpthrvalgluargleuleuglnalahisarggln145150155160leuglugluargglytyrvalphevalglytyrhisglythrpheleu165170175glualaalaglnserilevalpheglyglyvalargalaargsergln180185190aspleuaspalailetrpargglyphetyrilealaglyaspproala195200205leualatyrglytyralaglnaspglngluproaspalaargglyarg210215220ileargasnglyalaleuleuargvaltyrvalproargserserleu225230235240proglyphetyrargthrserleuthrleualaalaproglualaala245250255glygluvalgluargleuileglyhisproleuproleuargleuasp260265270alailethrglyprogluglugluglyglyargleugluthrileleu275280285glytrpproleualagluargthrtrpileproseralaileprothr290295300aspproargasnvalglyglyaspleuaspproserserileproasp305310315320lysgluglnalaileseralaleuproasptyralaserglnprogly325330335lysproproarggluaspleulys340<210>19<211>318<212>prt<213>人工序列<220><223>人工序列:合成多肽的描述<400>19mettrpgluglnleugluglncysglytyrprovalglnargleuval151015alaleutyrleualaalaargleusertrpasnglnvalaspglnval202530ileargasnalaleualaserproglyserglyglyaspleuglyglu354045alailearggluglnprogluglnalaargleualaleuthrleuala505560alaalaglusergluargphevalargglnglythrglyasnaspglu65707580alaglyalaalaasnglyproalaaspserglyaspalaleuleuglu859095argasntyrprothrglyalaglupheleuglyaspglyglyaspval100105110serpheserthrargglythrglnasntrpthrvalgluargleuleu115120125glnalahisargglnleuglugluargglytyrvalphevalglytyr130135140hisglythrpheleuglualaalaglnserilevalpheglyglyval145150155160argalaargserglnaspleuaspalailetrpargglyphetyrile165170175alaglyaspproalaleualatyrglytyralaglnaspglnglupro180185190aspalaargglyargileargasnglyalaleuleuargvaltyrval195200205proargserserleuproglyphetyrargthrserleuthrleuala210215220alaproglualaalaglygluvalgluargleuileglyhisproleu225230235240proleuargleuaspalailethrglyprogluglugluglyglyarg245250255leugluthrileleuglytrpproleualagluargthrvalvalile260265270proseralaileprothraspproargasnvalglyglyaspleuasp275280285proserserileproasplysgluglnalaileseralaleuproasp290295300tyralaserglnproglylysproproarggluaspleulys305310315<210>20<211>230<212>prt<213>人工序列<220><223>人工序列:合成多肽的描述<400>20arghisargglnproargglytrpgluglnleuprothrglyalaglu151015pheleuglyaspglyglyaspvalserpheserthrargglythrgln202530asntrpthrvalgluargleuleuglnalahisargglnleugluglu354045argglytyrvalphevalglytyrhisglythrpheleuglualaala505560glnserilevalpheglyglyvalargalaargserglnaspleuasp65707580alailetrpargglyphetyrilealaglyaspproalaleualatyr859095glytyralaglnaspglngluproaspalaargglyargileargasn100105110glyalaleuleuargvaltyrvalproargserserleuproglyphe115120125tyrargthrserleuthrleualaalaproglualaalaglygluval130135140gluargleuileglyhisproleuproleuargleuaspalailethr145150155160glyprogluglugluglyglyargleugluthrileleuglytrppro165170175leualagluargthrvalvalileproseralaileprothrasppro180185190argasnvalglyglyaspleuaspproserserileproasplysglu195200205glnalaileseralaleuproasptyralaserglnproglylyspro210215220proarggluaspleulys225230<210>21<211>230<212>prt<213>人工序列<220><223>人工序列:合成多肽的描述<400>21arghisargglnproargglytrpgluglnleuprothrglyalaglu151015pheleuglyaspglyglyaspvalserpheserthrargglythrgln202530asntrpthrvalgluargleuleuglnalahisargglnleugluglu354045glyglytyrvalphevalglytyrhisglythrpheleuglualaala505560glnserilevalpheglyglyvalargalaargserglnaspleuasp65707580alailetrpalaglyphetyrilealaglyaspproalaleualatyr859095glytyralaglnaspglngluproaspalaalaglyargileargasn100105110glyalaleuleuargvaltyrvalproargserserleuproglyphe115120125tyralathrserleuthrleualaalaproglualaalaglygluval130135140gluargleuileglyhisproleuproleuargleuaspalailethr145150155160glyprogluglualaglyglyargleugluthrileleuglytrppro165170175leualagluargthrvalvalileproseralaileprothrasppro180185190argasnvalglyglyaspleuaspproserserileproaspserglu195200205glnalaileseralaleuproasptyralaserglnproglylyspro210215220proarggluaspleulys225230<210>22<211>347<212>prt<213>人工序列<220><223>人工序列:合成多肽的描述<400>22progluglyglyserleualaalaleuthralahisglnalacyshis151015leuproleugluthrphethrarghisargglnproargglytrpglu202530glnleugluglncysglytyrprovalglnargleuvalalaleutyr354045leualaalaargleusertrpasnglnvalaspglnvalileargasn505560alaleualaserproglyserglyglyaspleuglyglualailearg65707580gluglnprogluglnalaargleualaleuthrleualaalaalaglu859095sergluargphevalargglnglythrglyasnaspglualaglyala100105110alaasnglyproalaaspserglyaspalaleuleugluargasntyr115120125prothrglyalaglupheleuglyaspglyglyaspvalserpheser130135140thrargglythrglnasntrpthrvalgluargleuleuglnalahis145150155160argglnleuglugluargglytyrvalphevalglytyrhisglythr165170175pheleuglualaalaglnserilevalpheglyglyvalargalaarg180185190serglnaspleuaspalailetrpargglyphetyrilealaglyasp195200205proalaleualatyrglytyralaglnaspglngluproaspalaarg210215220glyargileargasnglyalaleuleuargvaltyrvalproargser225230235240serleuproglyphetyrargthrserleuthrleualaalaproglu245250255alaalaglygluvalgluargleuileglyhisproleuproleuarg260265270leuaspalailethrglyprogluglugluglyglyargleugluthr275280285ileleuglytrpproleualagluargthrvalvalileproserala290295300ileprothraspproargasnvalglyglyaspleuaspproserser305310315320ileproasplysgluglnalaileseralaleuproasptyralaser325330335glnproglylysproproarggluaspleulys340345<210>23<211>5<212>prt<213>人工序列<220><223>人工序列:合成肽的描述<400>23lysalaserglygly15当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1