盐耐受的木糖苷酶突变体T329E及其制备方法和用途与流程
盐耐受的木糖苷酶突变体t329e及其制备方法和用途
技术领域
[0001]
本发明涉及一种木糖苷酶突变体,具体涉及一种盐耐受的木糖苷酶突变体t329e及其制备方法和用途。
背景技术:
[0002]
木聚糖主要来源于植物细胞壁,约占植物细胞干重的15%~35%,其主链由木糖聚合而成,具有多样的侧链取代基团。内切木聚糖酶(endo-1,4-β-d-xylanase,ec 3.2.1.8)可随机地切割木聚糖的主链骨架,生成低聚木糖,而木糖苷酶(β-d-xylosidase,ec 3.2.1.37)可将低聚木糖水解为木糖(collins et al.fems microbiology reviews,2005,29:3~23.)。木糖可作为原料,用于生产乙醇、乳酸、木糖醇等。除了木聚糖外,植物的糖蛋白和动物体内的蛋白聚糖中也含有木糖,其皆可被木糖苷酶降解(leszczuk et al.plant physiology and biochemistry,2019,139:681~690;takagaki et al.the journal ofbiological chemistry,1990,265:854~860.)。
[0003]
盐广泛存在于在自然界和各种生产实践中,包括污水、洗涤、制革、食品、造纸等。具有耐盐性的酶可更好地应用于高盐环境生物技术领域,例如,在皮革软化过程中,需要添加硫酸钠,在此过程中加入木聚糖酶,可达到促进皮纤维松散,提高成品革的柔软度、手感和物理机械性能的效果(如中国专利zl201710574969.3公开的一种基于木聚糖酶作用的动物皮纤维松散方法)。
[0004]
但是,由于高盐浓度下的盐析作用,大部分的酶在高盐浓度下不具有良好的催化活性。因此,为了使酶在高盐环境生物技术领域具有更好的应用性,需要提高酶在盐中的稳定性。
技术实现要素:
[0005]
本发明的目的是提供一种盐耐受的木糖苷酶突变体t329e及其制备方法和用途,该突变体解决了现有酶在高盐浓度下不具有良好的催化活性的问题,具有耐盐性,经高浓度盐处理后仍具有很好的酶活性。
[0006]
为了达到上述目的,本发明提供了一种盐耐受的木糖苷酶突变体t329e,该突变体t329e的氨基酸序列由野生木糖苷酶hj14gh43第329位的苏氨酸突变为谷氨酸获得,其序列如seq id no.1所示,该盐不为nacl。
[0007]
本发明还提供了一种编码所述的木糖苷酶突变体t329e的基因t329e,该基因t329e的核苷酸序列如seq id no.2所示。
[0008]
本发明还提供了一种含有所述的基因t329e的重组载体。
[0009]
优选地,所述重组载体采用peasy-e1。
[0010]
本发明还提供了一种含有如权利要求2所述的基因t329e的重组菌。
[0011]
优选地,所述重组菌采用的宿主细胞包含:大肠杆菌bl21。
[0012]
本发明还提供了所述的木糖苷酶突变体t329e在制革、造纸和污水处理中的应用。
[0013]
优选地,所述木糖苷酶突变体t329e用于在含盐液体中对木聚糖或/和含木糖基的物质进行降解,所述盐浓度大于3%,且该盐不为nacl。
[0014]
优选地,所述盐包含:kcl、na2so4和(nh4)2so4中任意一种或两种以上。
[0015]
本发明还提供了一种所述的木糖苷酶突变体t329e的制备方法,该方法包含:
[0016]
将所述的基因t329e与表达载体相连接,获得重组载体;将所述重组载体转化宿主细胞,获得重组菌;培养所述重组菌株,诱导木糖苷酶突变体t329e表达,回收并纯化表达的木糖苷酶突变体t329e。
[0017]
本发明的盐耐受的木糖苷酶突变体t329e及其制备方法和用途,解决了现有酶在高盐浓度下不具有良好的催化活性的问题,具有以下优点:
[0018]
与野生酶hj14gh43相比,本发明的突变酶t329e在高浓度kcl、na2so4和(nh4)2so4中的稳定性得到了增强。经15.0~30.0%(w/v)的kcl处理60min后,突变酶t329e的活性剩余59~70%,而野生酶hj14gh43的活性只剩余28~39%;经15.0~30.0%(w/v)的na2so4处理60min后,突变酶t329e的活性剩余78~87%,而野生酶hj14gh43的活性只剩余47~58%;经20.0~30.0%(w/v)的(nh4)2so4处理60min后,hj14gh43的活性从79%降至38%,t329e的活性不仅没有下降,反而提高20%左右。
[0019]
因此,本发明的盐稳定性改良的木糖苷酶突变体t329e可应用于制革、造纸、污水处理等行业。
附图说明
[0020]
图1为野生酶hj14gh43和突变酶t329e的sds-page分析结果。
[0021]
图2为纯化的野生酶hj14gh43和突变酶t329e在nacl中的稳定性结果。
[0022]
图3为纯化的野生酶hj14gh43和突变酶t329e在kcl中的稳定性结果。
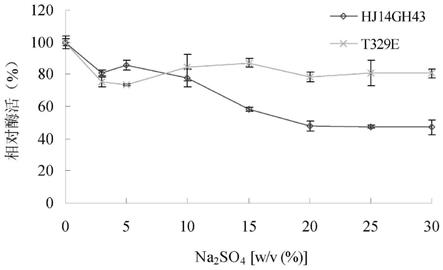
[0023]
图4为纯化的野生酶hj14gh43和突变酶t329e在na2so4中的稳定性结果。
[0024]
图5为纯化的野生酶hj14gh43和突变酶t329e在(nh4)2so4中的稳定性结果。
具体实施方式
[0025]
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0026]
本发明实验例中的实验材料和试剂如下:
[0027]
菌株及载体:大肠杆菌escherichia coli bl21(de3)和表达载体peasy-e1均购自北京全式金生物技术有限公司;
[0028]
酶类及其它生化试剂:pnp(p-nitrophenol)和pnpx(p-nitrophenyl-β-d-xylopyranoside)均购自sigma公司,其它都为国产试剂(均可从普通生化试剂公司购买得到);
[0029]
lb培养基:peptone 10g,yeast extract 5g,nacl 10g,加蒸馏水至1000ml,ph自然(约为7)。固体培养基在此基础上加2.0%(w/v)琼脂。
[0030]
以下实验例中未作具体说明的分子生物学实验方法,均参照《分子克隆实验指南》
(第三版)j.萨姆布鲁克一书中所列的具体方法进行,或者按照试剂盒和产品说明书进行。
[0031]
实验例1表达载体的构建和转化
[0032]
根据genbank记录的木糖苷酶核苷酸序列ky391885(seq id no.4),合成野生木糖苷酶hj14gh43的编码基因hj14gh43;另合成突变酶t329e的编码基因t329e(seq id no.2)。
[0033]
将合成的木糖苷酶核苷酸和突变酶t329e核苷酸序列分别和表达载体peasy-e1相连接,获得包含hj14gh43和t329e的表达载体,将连接产物分别转化大肠杆菌bl21(de3),获得分别表达野生酶hj14gh43和突变酶t329e的重组菌株。
[0034]
实验例2野生酶hj14gh43和突变酶t329e的制备
[0035]
将含hj14gh43和t329e的重组菌株以0.1%的接种量分别接种于lb(含100μg ml-1
amp)培养液中,37℃快速振荡16h。
[0036]
然后,将此活化的菌液以1%接种量接种到新鲜的lb(含100μg ml-1
amp)培养液中,快速振荡培养约2~3h(od
600
达到0.6-1.0)后,加入终浓度0.1mm的iptg进行诱导,于20℃继续振荡培养约20h。
[0037]
12000rpm离心5min,收集菌体。用适量的ph7.0 tris~hcl缓冲液悬浮菌体后,于低温水浴下超声波破碎菌体。
[0038]
以上胞内浓缩的粗酶液经12,000rpm离心10min后,吸取上清并用nickel-nta agarose和0~500mm的咪唑分别亲和和洗脱目的蛋白,获得纯化的目的蛋白。
[0039]
如图1所示,为野生酶hj14gh43和突变酶t329e的sds-page分析结果(m:蛋白质marker;w:hj14gh43),表明野生酶hj14gh43和突变酶t329e在大肠杆菌中都得到了表达,经纯化后,产物均为单一条带。
[0040]
实验例3纯化的野生酶hj14gh43和突变酶t329e的性质测定
[0041]
采用pnp法测定纯化的野生酶hj14gh43和突变酶t329e的活性,具体如下:
[0042]
将pnpx溶于缓冲液中,使其终浓度为2mm;反应体系含50μl适量酶液,450μl的2mm底物;底物在反应温度下预热5min后,加入酶液再反应适当时间,然后加2ml 1m na2co3终止反应,冷却至室温后在405nm波长下测定释放出的pnp;1个酶活单位(u)定义为每分钟分解底物产生1μmo l pnp所需的酶量。
[0043]
1、纯化的野生酶hj14gh43和突变酶t329e在nacl中的稳定性
[0044]
将纯化的酶液置于3.0~30.0%(w/v)nacl水溶液中,在20℃下处理60min,然后在ph7.0及20℃下进行酶促反应,以未处理的酶液作为对照。以pnpx为底物,反应10min,测定纯化的hj14gh43以及突变酶t329e的酶学性质。
[0045]
如图2所示,为纯化的野生酶hj14gh43和突变酶t329e在nacl中的稳定性结果,表明野生酶hj14gh43和突变酶t329e在nacl中的稳定性非常相似,两者在nacl中都不太稳定,经3.0~30.0%(w/v)的nacl处理60min后,活性剩余20~45%。
[0046]
2、纯化的野生酶hj14gh43和突变酶t329e在kcl中的稳定性
[0047]
将纯化的酶液置于3.0~30.0%(w/v)kcl水溶液中,在20℃下处理60min,然后在ph7.0及20℃下进行酶促反应,以未处理的酶液作为对照。以pnpx为底物,反应10min,测定纯化的hj14gh43以及突变酶t329e的酶学性质。
[0048]
如图3所示,为纯化的野生酶hj14gh43和突变酶t329e在kcl中的稳定性结果,表明野生酶hj14gh43和突变酶t329e在kcl中的稳定性不同,突变酶t329e在高浓度kcl中比野生
酶hj14gh43稳定,经15.0~30.0%(w/v)的kcl处理60min后,突变酶t329e的活性剩余59~70%,而野生酶hj14gh43的活性只剩余28~39%。
[0049]
3、纯化的野生酶hj14gh43和突变酶t329e在na2so4中的稳定性
[0050]
将纯化的酶液置于3.0~30.0%(w/v)na2so4水溶液中,在20℃下处理60min,然后在ph7.0及20℃下进行酶促反应,以未处理的酶液作为对照。以pnpx为底物,反应10min,测定纯化的hj14gh43以及突变酶t329e的酶学性质。
[0051]
如图4所示,为纯化的野生酶hj14gh43和突变酶t329e在na2so4中的稳定性结果,表明野生酶hj14gh43和突变酶t329e在na2so4中的稳定性不同,突变酶t329e在高浓度na2so4中比野生酶hj14gh43稳定,经15.0~30.0%(w/v)的na2so4处理60min后,突变酶t329e的活性剩余78~87%,而野生酶hj14gh43的活性只剩余47~58%。
[0052]
4、纯化的野生酶hj14gh43和突变酶t329e在(nh4)2so4中的稳定性
[0053]
将纯化的酶液置于3.0~30.0%(w/v)(nh4)2so4水溶液中,在20℃下处理60min,然后在ph7.0及20℃下进行酶促反应,以未处理的酶液作为对照。以pnpx为底物,反应10min,测定纯化的hj14gh43以及突变酶t329e的酶学性质。
[0054]
如图5所示,为纯化的野生酶hj14gh43和突变酶t329e在(nh4)2so4中的稳定性结果,表明野生酶hj14gh43和突变酶t329e在(nh4)2so4中的稳定性不同,经3.0~10.0%(w/v)的(nh4)2so4处理60min后,野生酶hj14gh43保持稳定,而突变酶t329e的酶活剩余58~82.0%,但是经20.0~30.0%(w/v)的(nh4)2so4处理60min后,hj14gh43的活性从79%降至38%,t329e的活性不仅没有下降,反而提高20%左右。
[0055]
尽管本发明的内容已经通过上述优选实施例作了详细介绍,但应当认识到上述的描述不应被认为是对本发明的限制。在本领域技术人员阅读了上述内容后,对于本发明的多种修改和替代都将是显而易见的。因此,本发明的保护范围应由所附的权利要求来限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1