Kex2酶的变体及稳定表达的方法与流程
本发明属于生物技术领域,具体涉及kex2酶的变体及稳定表达的方法。
技术背景
kex2酶,为双碱内肽酶,基因来自酿酒酵母saccharomycescerevisia,属于枯草杆菌蛋白酶家族,是一个钙离子依赖型的丝氨酸蛋白水解酶。kex2能特异性识别蛋白质或多肽中的双碱性氨基酸残基对lys-arg或arg-arg,从第二个氨基酸残基羧基端(即arg-)切断肽键,发挥作用。
在酵母体内,kex2分子在核糖体上翻译,经过信号肽和前体肽的切除,以及复杂的o-连和n-连糖基化的过程,成为有活力的蛋白酶分子。作为真核生物的前体加工酶,kex2可以在体内和体外环境下加工成熟很多哺乳动物的激素前体,不仅对于研究整个高等生物的前体加工酶家族非常重要,其在重组蛋白生产领域也非常重要。
在前人研究中发现,kex2多数使用甲醇诱导型酵母表达系统,蛋白表达诱导工艺流程操作繁琐,且表达水平相对偏低,不利于产业化生产。
技术实现要素:
本发明的目的在于提供一种kex2酶的变体及稳定表达的方法,酶的变体具有良好酶活且可以适用于不含酵母粉或蛋白胨的低盐无机盐培养基,所述变体采用所述方法进行表达可以实现kex2酶的稳定高效分泌表达、高密度发酵制备以及纯化,可以获得高产量和纯度的终产品。
本发明的第一方面,提供kex2酶稳定高效分泌表达的方法,所述方法包括:
(1)提供kex2酶的变体,在变体c端加或者不加histag标签;以seqidno.1所示的全长kex2的氨基酸序列位数计,所述变体为1-613位截短体、1-667位截短体、1-673位截短体、20-613位截短体、20-660位截短体、20-667位截短体或20-673位截短体;
(2)将包含(1)的变体的dna序列克隆到酵母表达载体上,获得重组表达质粒;
(3)将包含(2)的重组表达质粒转化进入酵母内,获得重组酵母;
(4)培养(3)的重组酵母,发酵并直接收取发酵上清;
(5)步骤(4)中的发酵上清无需特殊前处理,直接稀释进行离子交换层析纯化获得kex2酶的变体。
在本发明一种优选的实施方案中,本发明步骤(1)中所述变体:以seqidno.1所示的全长kex2的氨基酸序列位数计,其中第225位、436位、503位均由k突变为a或p。
在一种具体实施例中,本发明步骤(1)中所述变体可以是:
kex2的第1-613位截短体,且以seqidno.1所示的全长kex2酶的氨基酸序列位数计,其中第225位、436位、503位均由k突变为a或p,同时在截短体c端加或者不加histag标签;或
kex2的第1-667位截短体,且以seqidno.1所示的全长kex2酶的氨基酸序列位数计,其中第225位、436位、503位均由k突变为a或p,同时在截短体c端加或者不加histag标签;或
kex2的第1-673位截短体,且以seqidno.1所示的全长kex2酶的氨基酸序列位数计,其中第225位、436位、503位均由k突变为a或p,同时在截短体c端加或者不加histag标签;或
kex2的第20-613位截短体,且以seqidno.1所示的全长kex2酶的氨基酸序列位数计,其中第225位、436位、503位均由k突变为a或p,同时在截短体c端加或者不加histag标签;或
kex2的第20-660位截短体,且以seqidno.1所示的全长kex2酶的氨基酸序列位数计,其中第225位、436位、503位均由k突变为a或p,同时在截短体c端加或者不加histag标签;或
kex2的第20-667位截短体,且以seqidno.1所示的全长kex2酶的氨基酸序列位数计,其中第225位、436位、503位均由k突变为a或p,同时在截短体c端加或者不加histag标签;或
kex2的第20-673位截短体,且以seqidno.1所示的全长kex2酶的氨基酸序列位数计,其中第225位、436位、503位均由k突变为a或p,同时在截短体c端加或者不加histag标签。
本发明步骤(2)所述的重组表达质粒适用于毕赤酵母,其中含有kex2的变体的dna序列。
本发明步骤(2)所用酵母可以为本领域常用的酵母,优选为毕赤酵母。表达产物为组成型表达。
本发明将所述的重组表达质粒转化酵母,培养转化有所述重组表达质粒的重组酵母,从而可以表达kex2酶。所述的重组表达质粒先经过线性化,然后转化毕赤酵母。转化毕赤酵母的转化方法可以为电转化或理化法制备毕赤酵母感受态细胞等。较佳的选择电转化。
本发明所述方法表达的kex2酶的变体蛋白为可溶性分泌表达,因此可以直接收获发酵上清即可获取高表达目的蛋白。
本发明步骤(4)发酵所用的培养基为不含酵母粉或蛋白胨的低盐无机盐培养基,所述培养基采用甘油或葡萄糖作为唯一碳源;发明人发现,本发明所述的变体可以适用于不含酵母粉或蛋白胨的低盐无机盐培养基,采用该培养基可以不影响目的蛋白的表达,同时还可以有效提高下游蛋白纯化的效率。
在一种优选的实施例中,本发明步骤(4)中发酵采用的不含酵母粉或蛋白胨的低盐无机盐培养基组分为:七水硫酸镁4g-4.5/l、硫酸钾5-6g/l、二水硫酸钙0.3-0.5g/l、甘油30-40g/l、85%磷酸10-11g/l、85%氢氧化钾1-1.2g/l。发明人发现,采用该培养基可以提高蛋白表达,并进一步有效提高下游蛋白纯化的效率,且目的蛋白不易产生降解。
本发明步骤(4)获得的发酵上清,无需进行分子筛脱盐或大体积稀释等前处理步骤,仅需要纯水稀释2-3倍,电导率控制在不超过2.5ms/cm即可直接进行阴离子交换层析,得到电泳纯度大于80%纯化的产物。
本发明的第二方面,还提供kex2酶的变体,所述变体可以是:
kex2的第1-613位截短体,且以seqidno.1所示的全长kex2酶的氨基酸序列位数计,其中第225位、436位、503位均由k突变为a或p,同时在截短体c端加或者不加histag标签;或
kex2的第1-667位截短体,且以seqidno.1所示的全长kex2酶的氨基酸序列位数计,其中第225位、436位、503位均由k突变为a或p,同时在截短体c端加或者不加histag标签;或
kex2的第1-673位截短体,且以seqidno.1所示的全长kex2酶的氨基酸序列位数计,其中第225位、436位、503位均由k突变为a或p,同时在截短体c端加或者不加histag标签;或
kex2的第20-613位截短体,且以seqidno.1所示的全长kex2酶的氨基酸序列位数计,其中第225位、436位、503位均由k突变为a或p,同时在截短体c端加或者不加histag标签;或
kex2的第20-660位截短体,且以seqidno.1所示的全长kex2酶的氨基酸序列位数计,其中第225位、436位、503位均由k突变为a或p,同时在截短体c端加或者不加histag标签;或
kex2的第20-667位截短体,且以seqidno.1所示的全长kex2酶的氨基酸序列位数计,其中第225位、436位、503位均由k突变为a或p,同时在截短体c端加或者不加histag标签;或
kex2的第20-673位截短体,且以seqidno.1所示的全长kex2酶的氨基酸序列位数计,其中第225位、436位、503位均由k突变为a或p,同时在截短体c端加或者不加histag标签。
本发明还提供编码本发明所述的kex2酶的变体的多核苷酸。
本发明所述的多核苷酸可以根据毕赤酵母的偏爱型进行密码子优化。
本发明还提供包括所述多核苷酸的重组表达质粒,所述的重组表达质粒包括本发明所述的多核苷酸。
本发明还提供包括所述多苷酸或重组表达质粒的宿主细胞,所述的宿主细胞包括本发明所述的重组表达质粒,或其基因组中整合有本发明所述的多核苷酸。
本发明还提供所述的kex2酶的变体在蛋白水解中的应用。
在另一个优选例中,我们所述的重组表达质粒为组成型表达质粒。
在另一个优选例中,我们所述的宿主细胞为酵母,更优选为毕赤酵母。表达产物为组成型表达,采用甘油或葡萄糖作为唯一碳源,诱导表达产物高表达。
在另一个优选例中,我们所述的酵母采用甘油作为唯一碳源,诱导表达产物高表达。
在另一个优选例中,我们所述的酵母表达产物为可溶性分泌表达,直接收获发酵上清即可获取高表达目的蛋白。
本发明的其他方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
本发明相对于现有技术的优势:
(1)本发明通过适当截短及氨基酸位点突变获得kex2酶的变体,该变体不仅具有更高的酶活,而且可以适用于不含酵母粉或蛋白胨的低盐无机盐培养基,通过选择组成型表达质粒,将该质粒转入酵母体内,获得重组酵母,重组酵母可以利用甘油作为碳源,可以持续高效表达目的蛋白。整个高密度发酵过程中不使用甲醇诱导,使得高密度发酵的整个过程更加简单及安全;本发明整个发酵周期大约70h,相对于现有甲醇诱导的发酵工艺大大缩短。
(2)发明人发明了无蛋白胨和酵母粉的低盐基础发酵培养基,不但降低了发酵成本,同时极大地便利下游kex2酶的纯化,同时也发明了一整套针对该产品的高密度发酵和纯化技术路线,能够满足制备商业化规模kex2酶的工艺流程。
(3)本发明人通过在毕赤酵母中表达本发明所述的kex2酶的变体,选择组成型表达质粒可以实现kex2稳定高效分泌表达,且能良好的保留蛋白的生物活性。
文中定义:
如本文所用,“分离纯化”是指从kex2表达上清中分离纯化获得良好酶活,产量和纯度的kex2酶。
如本文所用,“重组的”是指借助基因工程手段获得(或大量制备)的蛋白、基因工程载体或者细胞等。
如本文所用,所述的“表达盒”是指包含有表达目的蛋白(本发明中的kex2截短体或者变体)所需的所用必要元件的基因表达系统,通常其包括以下元件:信号肽、启动子、编码目的蛋白的基因序列、终止子,这些元件的操作性相连的。当考虑目的蛋白纯化方便时,与所述kex2截短体或者变体还可以加上包括6×his的纯化标签。
附图说明
图1为kex2结构;
图2是培养24h时取样鉴定蛋白表达的结果;
图3是培养48h时取样鉴定蛋白表达的结果;
图4是培养72h时取样鉴定蛋白表达的结果;
图5是发酵罐培养不同时期的目标蛋白表达情况;
图6是纯化方法一的层析图谱;
图7是纯化方法一的sds-page蛋白鉴定分析结果;
图8是纯化方法二的层析图谱;
图9是纯化方法二的sds-page蛋白鉴定分析结果;
图10是纯化后样品的活力结果。
具体实施方式
下面结合实施例对本发明做进一步说明,应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明,凡在本发明的构思前提下对本发明制备方法的简单改进都属于本发明的保护范围之内。下面实施例未注明具体条件的实验方法,通常按照本领域的公知手段。
kex2截短体:
在利用毕赤酵母重组表达kex2的过程中,本发明人发现,不同序列长度kex2截短体,其蛋白表达量和蛋白活性存在明显的差别。因此本发明人设计了一系列kex2的截短体,研究其在毕赤酵母中的表达情况,经过反复研究实验,确定了若干个能实验在酵母中稳定高效分泌表达且保留良好酶活的kex2截短体。
基于发明人的上述发现,提供了kex2的截短体,所述截短体相对于野生型kex2去除了c端跨膜区和胞外结构域,或是相对于野生型kex2去除了部分或者全部c端ser/thr富集区、跨膜区和胞外结构域。
编码所述kex2截短体或者变体的核苷酸序列也包含在本发明中,其多核苷酸经过毕赤酵母偏爱型密码子优化。
本发明的kex2截短体或者变体的多核苷酸序列通常可以用pcr扩增法、酶切或者基因合成方法获得。然后将该序列引入表达载体和细胞中。
表达系统:
发酵培养将含酵母粉蛋白胨培养基、高盐培养基和低盐培养基均在此进行对比描述,同时表明优化的低盐培养基为最佳方式。
将冻存管保存的甘油菌1~2%接种比接入ypd培养基,进行一级种子培养20~24h;再以5~8%接种比接入ypd培养基,进行二级种子培养6~10h;经过ypd培养基两级放大后,以5~10%接种比接入罐基。发酵罐培养16~20小时左右开始补甘油,过程取样离心收集上清,跑电泳观察不同时期的目标蛋白表达情况。补料50小时左右,总时间约70小时,放罐离心去菌体,收集上清,-20℃保存。发明人通过罐基对比,基础盐培养基、低基础盐培养基、富营养培养基,对比发酵上清的目的蛋白表达情况,以及纯化处理效果,最终证明本发明所采用的不含酵母粉或蛋白胨的低盐无机盐培养基为最优培养基。
纯化工艺:
将发酵液离心去除沉淀而获得的上清液经适当的方法处理后可使用阴离子交换层析或疏水层析进行分离纯化。阴离子交换层析要求样品的离子强度低于其结合强度(可以采用g25凝胶过滤脱盐或直接稀释的方法),使用nacl线性洗脱可获得纯度符合要求的kex2蛋白酶,洗脱液中nacl的浓度较低而对酶的活力无影响。疏水层析要求在样品中添加较高浓度的(nh4)2so4以实现与填料的结合,洗脱液中仍存在相当浓度的(nh4)2so4,需再添加一步超滤脱盐才能消除其对酶的活力的影响。两种方法获得的kex2蛋白酶的纯度及活力无显著差异,本发明优选阴离子交换层析(polarmc60q)进行样品的分离纯化。
本发明涉及包含本发明的kex2截短体或者变体的编码基因的表达载体,以及用本发明的载体经过基因工程转化产生的宿主细胞。
实施例1.kex2蛋白酶截短体或者变体设计
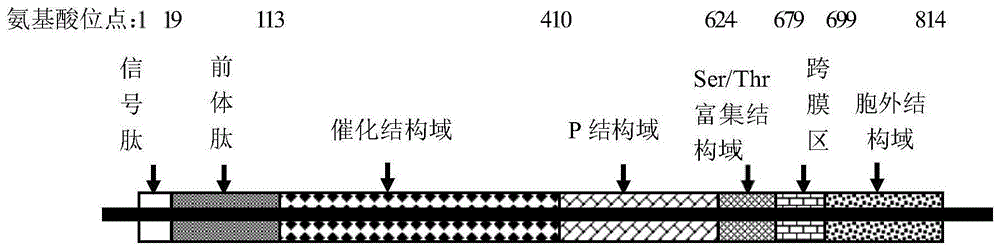
kex2由814个氨基酸残基组成(seqidno.1),整个分子包含信号肽(1-19aa),前体肽(20-113aa残基),催化结构域(114-410aa残基),p结构域(411-624aa残基),ser/thr富集结构域(625-679aa残基),跨膜区(680-699aa残基)以及胞外结构域(700-814aa残基),kex2结构如图1所示。
kex2的第1-613位截短体,以全长kex2酶的氨基酸序列数计,其中第225位、436位、503位由k突变为a或p,同时在截短体c端加或者不加histag标签。
kex2的第1-667位截短体,以全长kex2酶的氨基酸序列数计,其中第225位、436位、503位由k突变为a或p,同时在截短体c端加或者不加histag标签。
kex2的第1-673位截短体,以全长kex2酶的氨基酸序列数计,其中第225位、436位、503位由k突变为a或p,同时在截短体c端加或者不加histag标签。
kex2的第20-613位截短体,以全长kex2酶的氨基酸序列数计,其中第225位、436位、503位由k突变为a或p,同时在截短体c端加或者不加histag标签。
kex2的第20-660位截短体,以全长kex2酶的氨基酸序列数计,其中第225位、436位、503位由k突变为a或p,同时在截短体c端加或者不加histag标签。
kex2的第20-667位截短体,以全长kex2酶的氨基酸序列数计,其中第225位、436位、503位由k突变为a或p,同时在截短体c端加或者不加histag标签。
kex2的第20-673位截短体以全长kex2酶的氨基酸序列数计,其中第225位、436位、503位由k突变为a或p,同时在截短体c端加或者不加histag标签。
上述kex2截短体或者变体的多核苷酸序列按照毕赤酵母偏爱型进行密码子优化,然后克隆构建至pgapzaa载体上。
实施例2.重组毕赤酵母的构建
含有kex2截短体或者变体的重组表达质粒,经过avrll或者bsphi酶进行线性化,然后使用takaraminibestdnafragmentpurificationkitver.4.0回收线性化重组表达质粒。
采用电转化方法将构建好的线性化重组表达质粒转入毕赤酵母x33或者gs115感受态细胞中,从而获得重组毕赤酵母。
pgapzaa表达质粒含有zeocin抗生素筛选基因,使用不同浓度的zeocin抗生素可以筛选出稳定高效分泌表达kex2的重组毕赤酵母。
配制100μg/mlzeocin浓度的ypd平板(1%yeastextraction,2%peptone,2%葡萄糖)用于筛选稳定高效分泌表达的重组毕赤酵母。
实施例3.kex2蛋白酶的高效分泌表达
从含有zeocin抗生素的ypd平板上,随机挑取长势良好的单克隆,分别接种至3ml的ypd培养基中,设置培养条件28-30℃,250-300rpm,培养大约24h,然后按照0.2%体积转接至新鲜的ypd培养基中,继续培养,并且分别在培养大约24h、48h、72h时分别取样,鉴定蛋白表达结果,如图2~4所示(a:表示在宿主x33中的蛋白表达结果,图中1-18分别表示挑取的1-18个克隆蛋白表达结果;b:表示在宿主gs115中的蛋白表达结果,图中1-18分别表示挑取的1-18个克隆蛋白表达结果)。
实施例4.kex2蛋白酶的不含酵母粉或蛋白胨的低盐无机盐培养基高密度发酵
一级种子:250ml摇瓶分装ypd培养基50ml,121℃、20min灭菌,温度降至室温后,在超净工作台内无菌接入甘油管菌种,接种比1~2%。30℃,250rpm培养16~24h。od600长到4~10。
二级种子:500ml摇瓶分装ypd培养基150ml,121℃、20min灭菌,温度降至室温后,在超净工作台内无菌接入一级种子,接种比5~8%。30℃,250rpm培养6~10h。od600长到10左右。
发酵罐准备:2.0l不含酵母粉或蛋白胨的低盐无机盐培养基物料:七水硫酸镁8g、硫酸钾10g、二水硫酸钙1g、甘油80g、85%磷酸22g、85%氢氧化钾2g,使用纯化水定容至1.8l,倒入发酵罐。121℃、20min灭菌。发酵罐通冷却水降温至30℃后,使用稀氨水调ph至4.5,火圈加入过滤除菌的ptm1培养基8.7ml,接种比5~10%接入二级种子。500g甘油,定容至1.0l。121℃、20min灭菌后,降至室温,加入过滤除菌的ptm1培养基12ml,作为补料待用。通过使用不含酵母粉或蛋白胨的低盐无机盐培养基代替基础盐培养基,可以在不影响目的蛋白表达的情况下,有效提高下游蛋白纯化的效率。
发酵控制:30℃,200rpm,通气量2l/min,ph5.0。根据溶氧调节转速和通气,保持溶氧30%以上。定时取样检测菌浓。培养20h左右,培养基中的甘油消耗结束,溶氧突变上升,开始甘油补料,补料速度约为20ml/h,适当调整补料速度,保持溶氧在30%以上。过程取样离心收集上清,跑电泳观察不同时期的目标蛋白表达情况,结果见图5(发酵罐培养20小时至70小时11个取样点目标蛋白表达情况)。补料50h左右,菌浓达到450g/l左右放罐。9000rpm,30min离心,去菌体,收集上清。分装后,-20℃冷冻保存。
实施例5.kex2蛋白酶的纯化方法一
样品的处理:本发明采用不含酵母粉或蛋白胨的低盐无机盐培养基所获得的发酵上清离子强度较低,仅需加入两倍体积10mmnaac-hac(ph5.5)的缓冲液即可进行上柱纯化,相较于普通培养基需发酵上清需稀释10倍体积或凝胶过滤脱盐的处理,纯化效率大大提高。
缓冲液a的配制:20mmnaac-hac(ph5.5)。
缓冲液b的配制:20mmnaac-hac+0.5mnacl(ph5.5)。
层析介质:取polarmc60q阴离子交换填料,装填为φ25×200mm的柱床。
纯化方法:全过程取120cm/h线流速,稀释后的样品上样至预先由缓冲液a平衡好的polarmc60q层析柱,完成后用缓冲液a冲洗,之后用0-100%b线性40cv的梯度洗脱的方式,根据色谱峰形分阶段收集洗脱液。典型的层析图谱如图6所示。
检测:sds-page鉴定蛋白纯度,通过对电泳凝胶的光密度扫描分析,其纯化前后纯度分别为60%(泳道3:柱前样)、85%(泳道7:纯化后主峰)。根据电泳结果,将合格的样品置-20℃保存。分析结果如图7所示。
实施案例6.kex2蛋白酶的纯化方法二
样品的处理:发酵液离心后取上清,搅拌同时缓慢加入(nh4)2so4至2.5m,置2~8℃层析柜充分搅拌2小时后离心取上清。
缓冲液a的配制:20mmnaac-hac+2.5m(nh4)2so4(ph5.5)。
缓冲液b的配制:20mmnaac-hac(ph5.5)。
层析介质:取phenyl-ff疏水填料,装填为φ25×200mm的柱床。
纯化方法:全过程取120cm/h线流速,处理后的样品上样至预先由缓冲液a平衡好的phenyl-ff层析柱,完成后用缓冲液a冲洗,之后用0-100%b线性20cv的梯度洗脱的方式,根据色谱峰形分阶段收集洗脱液。典型的层析图谱如图8所示。
检测:sds-page鉴定蛋白纯度,其纯化前后纯度分别为60%(泳道1:柱前样)、83%(泳道3:收集2)。根据电泳结果,将合格的样品用20mmnaac-hac(ph5.5)缓冲液超滤脱盐后置-20℃保存。分析结果如9所示。
实施例7.kex2酶活检测
使用boc-gln-arg-arg-pna(boc-qrr-pna)作为测活底物,酶活力单位(u)的定义为:在25℃,ph8.0的条件下,每分钟催化1μmol的boc-qrr-pna转化为产物所需要的酶量。测活缓冲液为:50mm的tris-hcl,ph8.0,2mmca2+,100μmol/lboc-qrr-pna。3ml底物溶液中加入适量的酶,在波长405nm下,每间隔20s记录吸光值a405,连续记录3min,保证每分钟的吸光值的变化不超过0.040。通过下列公式计算酶活力。
酶活力u(μmol/l)=△a/min×f。
实施例5纯化后样品(离子交换洗脱峰和疏水层析洗脱峰)的活力为15~20u/mg,酶活高于市售kex2酶活性。酶活检测见图10。
序列表
<110>万新医药科技(苏州)有限公司
<120>kex2酶的变体及稳定表达的方法
<160>1
<170>siposequencelisting1.0
<210>1
<211>814
<212>prt
<213>酿酒酵母yjm1526(saccharomycescerevisiaeyjm1526)
<400>1
metlysvalarglystyrilethrleucysphetrptrpalapheser
151015
thrseralaleuvalserserglnglnileproleulysasphisthr
202530
serargglntyrphealavalgluserasngluthrleuserargleu
354045
gluglumethisproasntrplystyrgluhisaspvalargglyleu
505560
proasnhistyrvalpheserlysgluleuleulysleuglylysarg
65707580
serserleuglugluleuglnglyaspasnasnasphisileleuser
859095
valhisaspleupheproargasnaspleuphelysargleuproval
100105110
proalaproprometaspserserleuleuprovallysglualaglu
115120125
asplysleuserileasnaspproleuphegluargglntrphisleu
130135140
valasnproserpheproglyseraspileasnvalleuaspleutrp
145150155160
tyrasnasnilethrglyalaglyvalvalalaalailevalaspasp
165170175
glyleuasptyrgluasngluaspleulysaspasnphecysalaglu
180185190
glysertrpasppheasnaspasnthrasnleuprolysproargleu
195200205
seraspasptyrhisglythrargcysalaglygluilealaalalys
210215220
lysglyasnasnphecysglyvalglyvalglytyrasnalalysile
225230235240
serglyileargileleuserglyaspilethrthrgluaspgluala
245250255
alaserleuiletyrglyleuaspvalasnaspiletyrsercysser
260265270
trpglyproalaaspaspglyarghisleuglnglyproseraspleu
275280285
vallyslysalaleuvallysglyvalthrgluglyargaspserlys
290295300
glyalailetyrvalphealaserglyasnglyglythrargglyasp
305310315320
asncysasntyraspglytyrthrasnseriletyrserilethrile
325330335
glyalaileasphislysaspleuhisproprotyrsergluglycys
340345350
seralavalmetalavalthrtyrserserglyserglyglutyrile
355360365
hisserseraspileasnglyargcysserasnserhisglyglythr
370375380
seralaalaalaproleualaalaglyvaltyrthrleuleuleuglu
385390395400
alaasnproasnleuthrtrpargaspvalglntyrleuserileleu
405410415
seralavalglyleuglulysasnalaaspglyasptrpargaspser
420425430
alametglylyslystyrserhisargtyrglypheglylysileasp
435440445
alahislysleuileglumetserlysthrtrpgluasnvalasnala
450455460
glnthrtrpphetyrleuprothrleutyrvalserglnserthrasn
465470475480
serthrglugluthrleugluservalilethrileserglulysser
485490495
leuglnaspalaasnphelysargilegluhisvalthrvalthrval
500505510
aspileaspthrgluileargglythrthrthrvalaspleuileser
515520525
proalaglyileileserasnleuglyvalvalargproargaspval
530535540
sersergluglyphelysasptrpthrphemetservalalahistrp
545550555560
glygluasnglyvalglyasptrplysilelysvallysthrthrglu
565570575
asnglyhisargileaspphehissertrpargleulysleuphegly
580585590
gluserileaspserserlysthrgluthrphevalpheglyasnasp
595600605
lysglugluvalgluproalaalathrgluserthrvalserglntyr
610615620
seralaserserthrserileserileseralathrserthrserser
625630635640
ileserileglyvalgluthrseralaileproglnthrthrthrala
645650655
serthraspproaspseraspproasnthrprolyslysleuserser
660665670
proargglnalamethistyrpheleuthrilepheleuileglyala
675680685
thrpheleuvalleutyrphemetphephemetlysserargargarg
690695700
ileargargserargalagluthrtyrglupheaspileileaspthr
705710715720
aspserglutyraspserthrleuaspasnglythrserglyilethr
725730735
gluproglugluvalgluasppheasppheaspleuseraspgluasp
740745750
hisleualaserleusersersergluasnglyaspalagluhisthr
755760765
ileaspservalleuthrasngluasnpropheseraspproilelys
770775780
glnlyspheproasnaspalaasnalagluseralaserasnlysleu
785790795800
glngluleuglnproaspvalproproserserglyargser
805810
- 还没有人留言评论。精彩留言会获得点赞!