多特异性抗原结合蛋白及其使用方法与流程
相关申请的交叉引用
本申请要求2018年1月8日提交的国际专利申请第pct/cn2018/071729号的优先权权益,所述国际专利申请的内容通过引用整体并入本文中。
以ascii文本文件形式的序列表的提交
ascii文本文件形式的以下提交内容通过引用整体并入本文中:序列表的计算机可读形式(crf)(文件名:761422001041seqlist.txt;记录日期:2019年1月4日;大小:88kb)。
发明领域
本发明涉及特异性地结合至三种或更多种不同抗原或表位的多特异性抗原结合蛋白及其使用方法。
发明背景
单克隆抗体(mab)已广泛用作治疗剂来治疗多种人类疾病,例如癌症和自身免疫疾病。目前,存在超过30种单克隆抗体,包括鼠类、完全人源化和嵌合抗体,它们已经被fda批准用于治疗用途。利妥昔单抗(rituximab)和曲妥珠单抗(trastuzumab)是最畅销的抗癌蛋白质治疗剂。近来,已证实靶向免疫检查点分子的单克隆抗体(例如伊匹单抗(ipilimumab)和纳武单抗(nivolumab))通过诱导针对肿瘤的t细胞免疫来促进临床结果。由于许多患者对单一治疗方法反应不佳,因此经常将单克隆抗体与其它免疫调节方法(例如针对其它靶标的单克隆抗体)组合以增强其功效。例如,临床研究已证明纳武单抗与伊匹单抗的组合在黑色素瘤患者中产生提高的客观反应率。
多特异性抗体已经被设计来同时调节两个或更多个治疗靶标以便提供增强的治疗功效和加宽的潜在效用。据报道双特异性抗体可比两种单克隆抗体的简单组合更有效。已开发多种多特异性抗体形式。例如,双特异性抗体已通过将抗原结合(fab)片段或单链可变片段(scfv)融合至单克隆抗体而制得(参见例如weidle等,cancergenomics&proteomics2013;10:1-18)。不同形式的多特异性抗体在大小上不同,通常通过不同技术产生,并且在体内分布、组织渗透和药代动力学性质方面不同。
尽管在概念上的优势,但目前的多特异性抗体难以制造并开发成生物药物。作为人工构建体,多特异性抗体不能由正常b细胞产生。产生多特异性抗体的最初尝试涉及单特异性抗体的化学结合和表达mab的细胞的融合,但这些方法具有低效率并且需要从丰富的副产物进行纯化。在蛋白质工程与分子生物学中的高级方法能够实现多种新的多特异性抗体形式的重组构建。然而,一旦采用这些已知的工程化多特异性抗体形式,个别组分(例如scfv和mab)便丧失其有利的生物化学和/或生物物理学性质、血清半衰期和/或稳定性,导致不良功效、不稳定性和高免疫原性。
单域抗体(sdab)是各自具有单一单体抗体可变域的抗体片段。尽管sdab比具有两条重链和两条轻链的常见单克隆抗体的尺寸小得多,但其可以与mab相似的亲和力和特异性结合抗原。sdab用作结构单元时,其可融合至iggfc域以产生igg样抗体,包括二价和双特异性抗体(参见例如hmilai.等,mol.immunol.2008;45:3847-3856)。
本文提及的所有出版物、专利、专利申请和公开的专利申请的公开内容在此通过引用整体并入本文中。
技术实现要素:
本申请提供多特异性(例如三特异性)抗原结合蛋白或由此衍生的抗原结合片段,所述抗原结合蛋白包含两种或更多种融合至全长四链抗体的单域抗体(sdab)。
因此,本申请的一个方面提供一种多特异性(例如三特异性)抗原结合蛋白(“mabp”),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,(b)含有特异性地结合第二表位的第一单域抗体(sdab)的第二抗原结合部分,和(c)含有特异性地结合第三表位的第二单域抗体(sdab)的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。在一些实施方案中,第一表位、第二表位和第三表位来自相同抗原。在一些实施方案中,第一表位、第二表位和第三表位来自不同抗原。在一些实施方案中,第二表位和第三表位来自相同抗原,并且第一表位来自不同抗原。在一些实施方案中,第一表位和第三表位来自相同抗原,第二表位来自不同抗原。
在根据任何一种上述mabp的一些实施方案中,第一抗原结合部分是由两条重链和两条轻链组成的全长抗体。在一些实施方案中,第一抗原结合部分是包含含有vh的重链和含有vl的轻链的抗体片段。在一些实施方案中,第二抗原结合部分和/或第三抗原结合部分包含单一多肽链。在一些实施方案中,第一sdab和/或第二sdab是vhh。
在根据任何一种上述mabp的一些实施方案中,mabp包含:(1)第一多肽,其从n末端至c末端包含:第一sdab和第一抗原结合部分的重链;和(2)第二多肽,其从n末端至c末端包含:第二sdab和第一抗原结合部分的轻链。在一些实施方案中,mabp包含:(1)第一多肽,其从n末端至c末端包含:第一抗原结合部分的重链和第一sdab;和(2)第二多肽,其从n末端至c末端包含:第二sdab和第一抗原结合部分的轻链。在一些实施方案中,mabp包含:(1)第一多肽,其从n末端至c末端包含:第一sdab和第一抗原结合部分的重链;和(2)第二多肽,其从n末端至c末端包含:第一抗原结合部分的轻链和第二sdab。在一些实施方案中,mabp包含:(1)第一多肽,其从n末端至c末端包含:第一抗原结合部分的重链和第一sdab;和(2)第二多肽,其从n末端至c末端包含:第一抗原结合部分的轻链和第二sdab。在一些实施方案中,mabp包含:(1)第一多肽,其从n末端至c末端包含:第一sdab、第一抗原结合部分的重链和第二sdab;和(2)第二多肽,其从n末端至c末端包含:第一抗原结合部分的轻链。在一些实施方案中,mabp包含:(1)第一多肽,其从n末端至c末端包含:第一抗原结合部分的重链;和(2)第二多肽,其从n末端至c末端包含:第一sdab、第一抗原结合部分的轻链和第二sdab。在一些实施方案中,mabp包含:(1)第一多肽,其从n末端至c末端包含:第一sdab、第二sdab和第一抗原结合部分的重链;和(2)第二多肽,其从n末端至c末端包含:第一抗原结合部分的轻链。在一些实施方案中,mabp包含:(1)第一多肽,其从n末端至c末端包含:第一抗原结合部分的重链、第二sdab和第一sdab;和(2)第二多肽,其从n末端至c末端包含:第一抗原结合部分的轻链。在一些实施方案中,mabp包含:(1)第一多肽,其从n末端至c末端包含:第一抗原结合部分的重链;和(2)第二多肽,其从n末端至c末端包含:第一sdab、第二sdab和第一抗原结合部分的轻链。在一些实施方案中,mabp包含:(1)第一多肽,其从n末端至c末端包含:第一抗原结合部分的重链;和(2)第二多肽,其从n末端至c末端包含:第一抗原结合部分的轻链、第二sdab和第一sdab。在一些实施方案中,mabp包含第一多肽的两条链和第二多肽的两条链。
在根据任何一种上述mabp的一些实施方案中,第一表位、第二表位和/或第三表位来自免疫检查点分子。在一些实施方案中,免疫检查点分子选自由下列各物组成的组:pd-1、pd-l1、pd-l2、ctla-4、b7-h3、tigit、tim-3、lag-3、tigit、vista、icos、4-1bb、ox40、gitr和cd40。在一些实施方案中,第一抗原结合部分是抗pd-1抗体或其抗原结合片段。在一些实施方案中,抗pd-1抗体来源于派姆单抗(例如,
在根据任何一种上述mabp的一些实施方案中,第一表位、第二表位和/或第三表位来自肿瘤抗原。在一些实施方案中,肿瘤抗原选自由下列各物组成的组:her2、braf、egfr、vegfr2、cd20、rankl、cd38和cd52。在一些实施方案中,第一表位、第二表位和/或第三表位来自免疫效应细胞(例如t细胞)的细胞表面抗原。在一些实施方案中,第一抗原结合部分是抗her2抗体或其抗原结合片段。在一些实施方案中,抗her2抗体来源于曲妥珠单抗。在一些实施方案中,第二抗原结合部分包含抗cd3sdab。在一些实施方案中,第三抗原结合部分包含抗egfrsdab。
在根据任何一种上述mabp的一些实施方案中,第一表位、第二表位和/或第三表位来自促炎性分子。在一些实施方案中,促炎性分子选自由下列各物组成的组:il-1β、tnf-α、il-5、il-6、il-6r、il-17a、il-17f和伊红趋素-1。在一些实施方案中,第一抗原结合部分是抗tnf-α抗体或其抗原结合片段。在一些实施方案中,抗tnf-α抗体来源于阿达木单抗。在一些实施方案中,第二抗原结合部分包含抗il-17asdab。在一些实施方案中,第三抗原结合部分包含抗il-17fsdab。
在根据任何一种上述mabp的一些实施方案中,第一表位、第二表位和/或第三表位来自血管生成因子。在一些实施方案中,第一抗原结合部分是抗ang2抗体或其抗原结合片段。在一些实施方案中,抗ang2抗体来源于lc10。在一些实施方案中,第二抗原结合部分包含抗vegfsdab。在一些实施方案中,第三抗原结合部分包含抗dll4sdab。
在根据任何一种上述mabp的一些实施方案中,第一抗原结合部分包含人类、人源化或嵌合抗体或其抗原结合片段。
在根据任何一种上述mabp的一些实施方案中,第一抗原结合部分包含fc区。在一些实施方案中,fc区是igg1fc。在一些实施方案中,fc区是igg4fc,例如具有s228p突变的igg4fc。
在根据任何一种上述mabp的一些实施方案中,第一抗原结合部分、第二抗原结合部分和/或第三抗原结合部分经由肽键或肽接头彼此融合。在一些实施方案中,肽接头长度不超过约30个(例如不超过约25、20或15个中的任一者)氨基酸。在一些实施方案中,肽接头包含seqidno:1-7的氨基酸序列中的任一者。在一些实施方案中,第一抗原结合部分、第二抗原结合部分和/或第三抗原结合部分在化学上彼此融合。
在根据任何一种上述mabp的一些实施方案中,第一sdab和/或第二sdab是骆驼科、人源化或人类sdab。
在根据任何一种上述mabp的一些实施方案中,mabp可重组产生,例如在哺乳动物细胞(例如cho细胞)中,以至少约10mg/l,例如至少约10mg/l、50mg/l、100mg/ml或更高的表达水平。在一些实施方案中,mabp具有至少约55℃的聚集起始温度(t聚集),例如约55℃至约70℃。在一些实施方案中,mabp在约25℃下在至少约50mg/ml的浓度下稳定至少约一周。在一些实施方案中,mabp在37℃下在至少约50mg/ml的浓度下稳定至少约一周。在一些实施方案中,mabp在至少50mg/ml的浓度下在至少约5个冻融循环之后是稳定的。在一些实施方案中,mabp在人类血清中在生理温度(例如约37℃)下具有高的长期稳定性持续至少约1天、3天或7天中的任一者。
本申请的另一方面提供一种药物组合物,所述药物组合物包含任何一种上述mabp和药学上可接受的载体。在一些实施方案中,mabp在药物组合物中的浓度是至少约100mg/ml,例如至少约150mg/ml、200mg/ml或更高。
本申请的一个方面还提供了一种治疗个体的疾病的方法,所述方法包括向所述个体施用有效量的任何一种上述药物组合物。在一些实施方案中,所述疾病是癌症。在一些实施方案中,癌症选自由下列各病组成的组:乳腺癌、肾癌、黑色素瘤、肺癌、胶质母细胞瘤、头颈癌、前列腺癌、卵巢癌、膀胱癌和淋巴瘤。在一些实施方案中,所述疾病是炎症性或自身免疫疾病。在一些实施方案中,炎症性或自身免疫疾病选自由下列各病组成的组:关节炎(例如类风湿性关节炎、幼年型特发性关节炎、牛皮癣性关节炎、强直性脊柱炎和关节炎性溃疡性结肠炎)、结肠炎、牛皮癣、严重哮喘和中度至重度克罗恩病(crohn'sdisease)。
附图说明
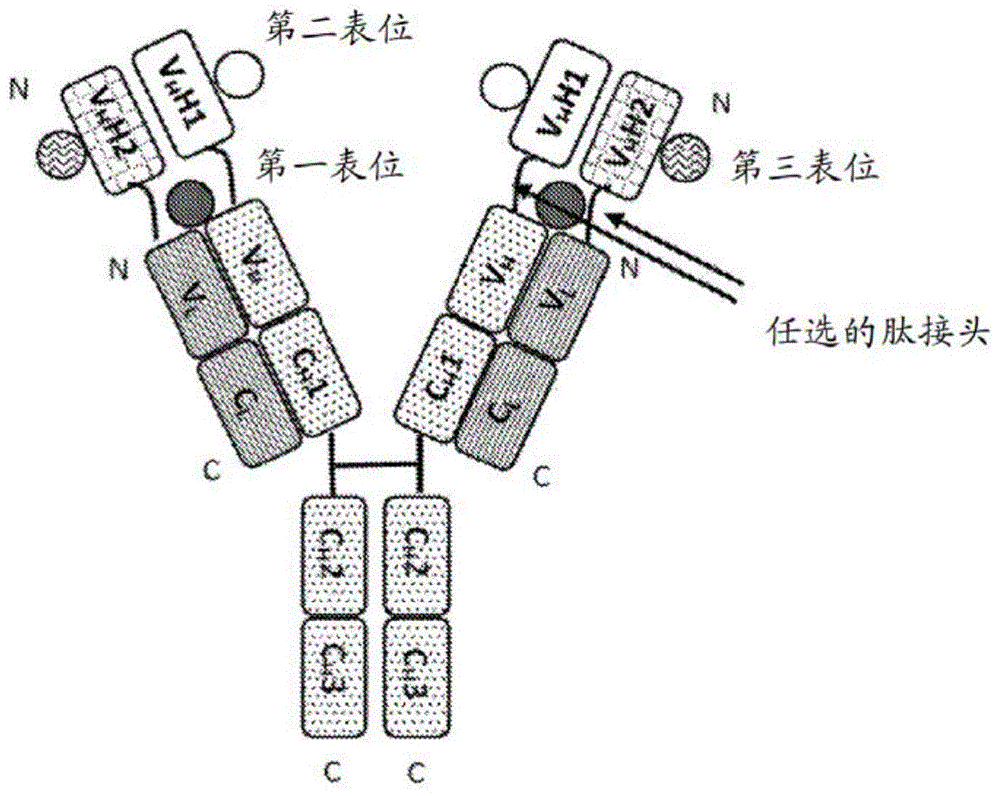
图1描绘示例性三特异性抗原结合蛋白(在本文中也称为“tabp”)的示意性结构,其包含具有两条相同重链与两条相同轻链的单特异性全长抗体、第一sdab和第二sdab,其中第一sdab的c末端经由第一任选的肽接头融合至重链的n末端并且第二sdab的c末端经由第二任选的肽接头融合至轻链的n末端。全长抗体具有特异性地结合第一表位的两个抗原结合位点。第一sdab特异性地结合第二表位。第二sdab特异性地结合至第三表位。例如,tabp可由四条多肽链组成,所述多肽链从n末端至c末端具有如下结构:(1)vhh2-vl-cl;(2)vhh1-vh-ch1-ch2-ch3;(3)vhh1-vh-ch1-ch2-ch3;和(4)vhh2-vl-cl。
图2描绘示例性三特异性抗原结合蛋白的示意性结构,其包含具有两条相同重链和两条相同轻链的单特异性全长抗体、第一sdab和第二sdab,其中第一sdab的c末端经由第一任选的肽接头融合至第二sdab的n末端,并且第二sdab的c末端经由第二任选的肽接头融合至重链的n末端。全长抗体具有特异性地结合第一表位的两个抗原结合位点。第一sdab特异性地结合第二表位。第二sdab特异性地结合至第三表位。例如,tabp可由四条多肽链组成,所述多肽链从n末端至c末端具有如下结构:(1)vl-cl;(2)vhh1-vhh2-vh-ch1-ch2-ch3;(3)vhh1-vhh2-vh-ch1-ch2-ch3;和(4)vl-cl。
图3描绘示例性三特异性抗原结合蛋白的示意性结构,其包含具有两条相同重链和两条相同轻链的单特异性全长抗体、第一sdab和第二sdab,其中第一sdab的c末端经由第一任选的肽接头融合至第二sdab的n末端,并且第二sdab的c末端经由第二任选的肽接头融合至轻链的n末端。全长抗体具有特异性地结合第一表位的两个抗原结合位点。第一sdab特异性地结合第二表位。第二sdab特异性地结合至第三表位。例如,tabp可由四条多肽链组成,所述多肽链从n末端至c末端具有如下结构:(1)vhh1-vhh2-vl-cl;(2)vh-ch1-ch2-ch3;(3)vh-ch1-ch2-ch3;和(4)vhh1-vhh2-vl-cl。
图4描绘示例性三特异性抗原结合蛋白的示意性结构,其包含具有两条相同重链和两条相同轻链的单特异性全长抗体、第一sdab和第二sdab,其中第一sdab的c末端经由第一任选的肽接头融合至轻链的n末端,并且第二sdab的n末端经由第二任选的肽接头融合至轻链的c末端。全长抗体具有特异性地结合第一表位的两个抗原结合位点。第一sdab特异性地结合第二表位。第二sdab特异性地结合至第三表位。例如,tabp可由四条多肽链组成,所述多肽链从n末端至c末端具有如下结构:(1)vhh1-vl-cl-vhh2;(2)vh-ch1-ch2-ch3;(3)vh-ch1-ch2-ch3;和(4)vhh1-vl-cl-vhh2。
图5描绘示例性三特异性抗原结合蛋白的示意性结构,其包含具有两条相同重链和两条相同轻链的单特异性全长抗体、第一sdab和第二sdab,其中第一sdab的c末端经由第一任选的肽接头融合至重链的n末端,并且第二sdab的n末端经由第二任选的肽接头融合至轻链的c末端。全长抗体具有特异性地结合第一表位的两个抗原结合位点。第一sdab特异性地结合第二表位。第二sdab特异性地结合至第三表位。例如,tabp可由四条多肽链组成,所述多肽链从n末端至c末端具有如下结构:(1)vl-cl-vhh2;(2)vhh1-vh-ch1-ch2-ch3;(3)vhh1-vh-ch1-ch2-ch3;和(4)vl-cl-vhh2。
图6描绘示例性三特异性抗原结合蛋白的示意性结构,其包含具有两条相同重链和两条相同轻链的单特异性全长抗体、第一sdab和第二sdab,其中第一sdab的c末端经由第一任选的肽接头融合至重链的n末端,并且第二sdab的n末端经由第二任选的肽接头融合至重链的c末端。全长抗体具有特异性地结合第一表位的两个抗原结合位点。第一sdab特异性地结合第二表位。第二sdab特异性地结合至第三表位。例如,tabp可由四条多肽链组成,所述多肽链从n末端至c末端具有如下结构:(1)vl-cl;(2)vhh1-vh-ch1-ch2-ch3-vhh2;(3)vhh1-vh-ch1-ch2-ch3-vhh2;和(4)vl-cl。
图7描绘示例性三特异性抗原结合蛋白的示意性结构,其包含具有两条相同重链和两条相同轻链的单特异性全长抗体、第一sdab和第二sdab,其中第一sdab的c末端经由第一任选的肽接头融合至轻链的n末端,并且第二sdab的n末端经由第二任选的肽接头融合至重链的c末端。全长抗体具有特异性地结合第一表位的两个抗原结合位点。第一sdab特异性地结合第二表位。第二sdab特异性地结合至第三表位。例如,tabp可由四条多肽链组成,所述多肽链从n末端至c末端具有如下结构:(1)vhh1-vl-cl;(2)vh-ch1-ch2-ch3-vhh2;(3)vh-ch1-ch2-ch3-vhh2;和(4)vhh1-vl-cl。
图8描绘示例性三特异性抗原结合蛋白的示意性结构,其包含具有两条相同重链和两条相同轻链的单特异性全长抗体、第一sdab和第二sdab,其中第一sdab的n末端经由第一任选的肽接头融合至重链的c末端,并且第二sdab的n末端经由第二任选的肽接头融合至轻链的c末端。全长抗体具有特异性地结合第一表位的两个抗原结合位点。第一sdab特异性地结合第二表位。第二sdab特异性地结合至第三表位。例如,tabp可由四条多肽链组成,所述多肽链从n末端至c末端具有如下结构:(1)vl-cl-vhh2;(2)vh-ch1-ch2-ch3-vhh1;(3)vh-ch1-ch2-ch3-vhh1;和(4)vl-cl-vhh2。
图9描绘示例性三特异性抗原结合蛋白的示意性结构,其包含具有两条相同重链和两条相同轻链的单特异性全长抗体、第一sdab和第二sdab,其中第一sdab的n末端经由第一任选的肽接头融合至第二sdab的c末端,并且第二sdab的n末端经由第二任选的肽接头融合至轻链的c末端。全长抗体具有特异性地结合第一表位的两个抗原结合位点。第一sdab特异性地结合第二表位。第二sdab特异性地结合至第三表位。例如,tabp可由四条多肽链组成,所述多肽链从n末端至c末端具有如下结构:(1)vl-cl-vhh2-vhh1;(2)vh-ch1-ch2-ch3;(3)vh-ch1-ch2-ch3;和(4)vl-cl-vhh2-vhh1。
图10描绘示例性三特异性抗原结合蛋白的示意性结构,其包含具有两条相同重链和两条相同轻链的单特异性全长抗体、第一sdab和第二sdab,其中第一sdab的n末端经由第一任选的肽接头融合至第二sdab的c末端,并且第二sdab的n末端经由第二任选的肽接头融合至重链的c末端。全长抗体具有特异性地结合第一表位的两个抗原结合位点。第一sdab特异性地结合第二表位。第二sdab特异性地结合至第三表位。例如,tabp可由四条多肽链组成,所述多肽链从n末端至c末端具有如下结构:(1)vl-cl;(2)vh-ch1-ch2-ch3-vhh2-vhh1;(3)vh-ch1-ch2-ch3-vhh2-vhh1;和(4)vl-cl。
图11示出概述10个示例性tabp的抗体产生数据的表格。tptl11具有图1中所示的形式。tptl12具有图2中所示的形式。tptl13具有图3中所示的形式。tptl14具有图4中所示的形式。tptl15具有图5中所示的形式。tptl16具有图6中所示的形式。tptl17具有图7中所示的形式。tptl18具有图8中所示的形式。tptl19具有图9中所示的形式。tptl20具有图10中所示的形式。
图12a-12k示出如通过
图13a-13k示出如通过
图14a-14k示出如通过
图15示出示例性tabp(tptl11-tptl20)与pd-1、tigit和lag-3的体外结合和配体竞争参数。
图16示出示例性tabp(tptl11-tptl20)借助于温度诱导的聚集产生的热稳定性。
图17示出示例性tabp(tptl11-tptl20)在5个冻融循环之后的稳定性。
图18a-18c示出示例性tabp(tptl11-tptl17)在血清共培育1天、7天和14天之后的人类血清稳定性。图18a示出示例性tabp(tptl11-tptl17)与人类tigit蛋白的结合活性。图18b示出示例性tabp(tptl11-tptl17)与人类lag-3蛋白的结合活性。图18c示出示例性tabp(tptl11-tptl17)与人类pd-1蛋白的结合活性。
具体实施方式
本申请提供了新颖的多特异性抗原结合蛋白(“mabp”),其包含融合至含有重链可变域(vh)和轻链可变域(vl)的全长抗体或其抗原结合片段上的两种或更多种单域抗体(sdab)。各sdab特异性地结合不同靶标(例如不同表位或抗原),并且sdab的靶标还不同于由全长抗体或抗原结合片段所识别的靶标。本文所述的多特异性抗原结合蛋白形式能够实现不同靶抗原的多价共接合,并且还提供新颖的同二聚变体,其促进同二聚蛋白例如抗体的折叠和纯化。
本申请的一些实施方案提供了三特异性抗原结合蛋白(“tabp”),其可用于靶向多种疾病相关表位和/或抗原组合,包括免疫检查点分子、细胞表面抗原(例如肿瘤抗原)、血管生成因子或促炎性分子的组合。本文所述的tabp提供了用于治疗多种疾病和疾患(例如癌症、炎症和自身免疫疾病)的有用试剂。
因此,本申请的一个方面提供了一种多特异性(例如,三特异性)抗原结合蛋白,其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,(b)含有特异性地结合第二表位的第一单域抗体的第二抗原结合部分,和(c)含有特异性地结合第三表位的第二单域抗体的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。
在一些实施方案中,提供一种多特异性(例如三特异性)抗原结合蛋白,其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一免疫检查点分子(例如pd-1)的抗原结合位点,(b)含有特异性地结合第二免疫检查点分子(例如tigit)的第一单域抗体的第二抗原结合部分,和(c)含有特异性地结合第三免疫检查点分子(例如lag-3)的第二单域抗体的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。
在一些实施方案中,提供一种多特异性(例如三特异性)抗原结合蛋白(tabp),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一肿瘤抗原(例如her-2)的抗原结合位点,(b)第二抗原结合部分,其含有特异性地结合第二肿瘤抗原或免疫效应细胞的细胞表面抗原(例如cd-3)的第一单域抗体,和(c)含有特异性地结合第三肿瘤抗原(例如egfr)的第二单域抗体的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。
在一些实施方案中,提供一种多特异性(例如三特异性)抗原结合蛋白(tabp),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一促炎性分子(例如tnf-α)的抗原结合位点,(b)含有特异性地结合第二促炎性分子(例如il-17a)的第一单域抗体的第二抗原结合部分,和(c)含有特异性地结合第三促炎性分子(例如il-17f)的第二单域抗体的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。
在一些实施方案中,提供一种多特异性(例如三特异性)抗原结合蛋白(tabp),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一血管生成因子(例如ang2)的抗原结合位点,(b)含有特异性地结合第二血管生成因子(例如vegf)的第一单域抗体的第二抗原结合部分,和(c)含有特异性地结合第三血管生成因子(例如dll4)的第二单域抗体的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。
还提供了包含多特异性(例如三特异性)抗原结合蛋白的药物组合物、试剂盒和制造物品,以及使用本文所述的多特异性(例如三特异性)抗原结合蛋白治疗疾病的方法。
i.定义
除非明确相反地指出,否则本发明的实践将采用本领域技能范围内的病毒学、免疫学、微生物学、分子生物学和重组dna技术的常规方法,其中许多出于说明目的在下文中描述。这类技术充分阐述于以下文献中。参见例如currentprotocolsinmolecularbiologyorcurrentprotocolsinimmunology,johnwiley&sons,newyork,n.y.(2009);ausubel等,shortprotocolsinmolecularbiology,第3版,wiley&sons,1995;sambrook和russell,molecularcloning:alaboratorymanual(第3版,2001);maniatis等,molecularcloning:alaboratorymanual(1982);dnacloning:apracticalapproach,第i和ii卷(d.glover编);oligonucleotidesynthesis(n.gait编,1984);nucleicacidhybridization(b.hames和s.higgins编,1985);transcriptionandtranslation(b.hames和s.higgins编,1984);animalcellculture(r.freshney编,1986);perbal,apracticalguidetomolecularcloning(1984)以及其它类似参考文献。
术语“多特异性抗原结合蛋白”与“mabp”在本文中可互换使用。术语“三特异性抗原结合蛋白”与“tabp”在本文中可互换使用。
如本文所用,术语“治疗”是指被设计来改变临床病理过程中所治疗的个体或细胞的天然过程的临床干预。所需治疗作用包括降低疾病进展率、改善或减轻疾病状况,以及缓解或改进预后。例如,如果与所治疗的疾病或疾患(例如癌症、炎症性或自身免疫疾病)相关的一种或多种症状得以减轻或消除,则个体成功地通过本申请的mabp治疗。
如本文所用,“有效量”是指有效治疗受试者的疾病或疾患的药剂或药物的量。在癌症的情况下,有效量的本申请的mabp可减少癌细胞数量;减小肿瘤尺寸;抑制(即在某种程度上减慢并且优选终止)癌细胞浸润至外周器官中;抑制(即在某种程度上减慢并且优选终止)肿瘤转移;在某种程度上抑制肿瘤生长;和/或在某种程度上减轻一种或多种与所述癌症相关的症状。如在临床背景中所理解,药物、化合物或药物组合物的有效量可联合或不联合另一药物、化合物或药物组合物一起实现。因此,可在施用一种或多种治疗剂的背景下考虑“有效量”,并且如果与一种或多种其它药剂联合可能或能够实现所需结果,则可考虑给予有效量的单一药剂。
如本文所用,“个体”或“受试者”是指哺乳动物,包括但不限于人类、牛、马、猫、犬、啮齿动物或灵长类动物。在一些实施方案中,个体是人类。
术语“抗体”包括单克隆抗体(包括具有免疫球蛋白fc区的全长4链抗体)、具有多表位特异性的抗体组合物、多特异性抗体(例如,双特异性或三特异性抗体)、双抗体和单链分子,以及抗体片段(例如,fab、f(ab')2和fv)。术语“免疫球蛋白”(ig)在本文中可与“抗体”互换使用。本文所涵盖的抗体包括仅重链的抗体和单域抗体。
基本4链抗体单元是由两条相同轻(l)链与两条相同重(h)链构成的异四聚体糖蛋白。igm抗体由5个基本异四聚体单元与额外的称为j链的多肽组成,并且含有10个抗原结合位点,而iga抗体包含2-5个基本4链单元,所述4链单元可与j链共同聚合以形成多价集合体。在igg的情况下,4链单元一般是约150,000道尔顿。各l链通过一个共价二硫键连接至h链,而两条h链视h链同型而定通过一个或多个二硫键彼此连接。各h链和l链还具有规则间隔的链内二硫桥。各h链在n末端处具有可变域(vh),接着是各自针对α和γ链的三个恒定域(ch)以及针对μ和ε同型的四个ch域。各l链在n末端处具有可变域(vl),接着是在其另一端处的恒定域。vl与vh对准并且cl与重链的第一恒定域(ch1)对准。认为特定的氨基酸残基在轻链与重链可变域之间形成界面。vh与vl一起配对形成单个抗原结合位点。关于不同类别抗体的结构和性质,参见例如basicandclinicalimmunology,第8版,danielp.sties,abbai.terr和tristramg.parsolw(编),appleton&lange,norwalk,conn.,1994,第71页和第6章。来自任何脊椎动物物种的l链可基于其恒定域的氨基酸序列分为两种明确不同类型中的一种,称为κ和λ。视免疫球蛋白重链的恒定域(ch)的氨基酸序列而定,免疫球蛋白可分为不同类别或同型。存在五个类别的免疫球蛋白:iga、igd、ige、igg和igm,分别具有称为α、δ、ε、γ和μ的重链。γ和α类别基于ch序列和功能中的相对较小差异进一步分成子类,例如,人类表达以下子类:igg1、igg2a、igg2b、igg3、igg4、iga1和iga2。
“经分离的”抗体是已经从其产生环境的组分(例如自然或重组的)中鉴定、分离和/或回收的抗体。优选地,经分离的多肽不与来自其产生环境的所有其它组分结合。其产生环境的污染组分(例如由重组转染细胞所产生者)是通常将干扰抗体的研究、诊断或治疗用途的材料,并且可包括酶、激素和其它蛋白质或非蛋白质溶质。在优选实施方案中,多肽将被纯化:(1)至大于95重量%的抗体,如通过例如lowry法所测定,并且在一些实施方案中,至大于99重量%;(1)至足以获得n末端或内部氨基酸序列的至少15个残基的程度,通过利用转杯式测序仪;或(3)至同质,使用考马斯蓝或优选银染色剂,在非还原或还原条件下,通过sds-page。经分离的抗体包括原位在重组细胞内的抗体,因为抗体天然环境的至少一种组分将不存在。然而,通常,经分离的多肽或抗体将通过至少一个纯化步骤来制备。
抗体的“可变区”或“可变域”是指抗体的重链或轻链的氨基末端结构域。重链与轻链的可变域可分别称为“vh”与“vl”。这些结构域一般是抗体的最可变部分(相对于相同类别的其它抗体)并且含有抗原结合位点。来自骆驼科物种的仅重链抗体具有单个重链可变区,其被称为“vhh”。vhh因此是一种特殊类型的vh。
术语“可变”是指以下事实:可变域的某些区段在抗体之间在序列上广泛不同。v结构域介导抗原结合并限定特定抗体对于其特定抗原的特异性。然而,可变性在整个可变域范围上并非均匀分布的。相反,它集中于轻链与重链可变域内三个称为高变区(hvr)的区段中。可变域的更高度保守部分被称作框架区(fr)。天然重链与轻链的可变域各自包含四个fr区,大部分采用β-折叠构型,由三个hvr连接,其形成环连接,并且在一些情况下形成β-折叠结构的一部分。每条链中的hvr通过fr区紧密保持在一起,并且与其它链的hvr一起促成抗体的抗原结合位点的形成(参见kabat等,sequencesofimmunologicalinterest,第五版,nationalinstituteofhealth,bethesda,md.(1991))。恒定域不直接牵涉于抗体与抗原的结合中,但展现出各种效应功能,例如参与抗体的抗体依赖性细胞毒性。
如本文所用的术语“单克隆抗体”是指由基本上同源的抗体群体获得的抗体,即除可以微量存在的可能天然存在的突变和/或翻译后修饰(例如异构化、酰胺化)之外与所述群体相同的个别抗体。单克隆抗体针对单个抗原位点有高度特异性。与通常包括针对不同决定基(表位)的不同抗体的多克隆抗体制剂相反,各单克隆抗体针对抗原上的单一决定基。单克隆抗体除了其特异性之外,优势还在于它们是通过杂交瘤培养而合成,无其它免疫球蛋白的污染。修饰语“单克隆”表示抗体如从基本上同源的抗体群体获得的抗体特性,并且不应理解为需要通过任何特定方法产生抗体。举例来说,根据本申请使用的单克隆抗体可通过以下多种技术制得,包括例如杂交瘤方法(例如kohler和milstein.,nature,256:495-97(1975);hongo等,hybridoma,14(3):253-260(1995);harlow等,antibodies:alaboratorymanual,(coldspringharborlaboratorypress,第2版1988);hammerling等,monoclonalantibodiesandt-cellhybridomas563-681(elsevier,n.y.,1981))、重组dna方法(参见例如美国专利第4,816,567号)、噬菌体展示技术(参见例如clackson等,nature,352:624-628(1991);marks等,j.mol.biol.222:581-597(1992);sidhu等,j.mol.biol.338(2):299-310(2004);lee等,j.mol.biol.340(5):1073-1093(2004);fellouse,proc.natl.acad.sci.usa101(34):12467-12472(2004);和lee等,j.immunol.methods284(1-2):119-132(2004),以及用于在动物中产生人类或人类样抗体的技术,所述抗体具有人类免疫球蛋白基因座或编码人类免疫球蛋白序列的基因的一部分或全部(参见例如wo1998/24893;wo1996/34096;wo1996/33735;wo1991/10741;jakobovits等,proc.natl.acad.sci.usa90:2551(1993);jakobovits等,nature362:255-258(1993);bruggemann等,yearinimmunol.7:33(1993);美国专利第5,545,807号;第5,545,806号;第5,569,825号;第5,625,126号;第5,633,425号;和第5,661,016号;marks等,bio/technology10:779-783(1992);lonberg等,nature368:856-859(1994);morrison,nature368:812-813(1994);fishwild等,naturebiotechnol.14:845-851(1996);neuberger,naturebiotechnol.14:826(1996);以及lonberg和huszar,intern.rev.immunol.13:65-93(1995)。
术语“全长抗体”、“完整抗体”或“全抗体”可互换地用于指代与抗体片段相比呈其基本上完整形式的抗体。特定来说,全长4链抗体包括具有包括fc区的重链和轻链的那些。恒定域可以是天然序列恒定域(例如,人类天然序列恒定域)或其氨基酸序列变体。在一些情况下,完整抗体可具有一种或多种效应功能。
“抗体片段”包含完整抗体的一部分,优选地,完整抗体的抗原结合和/或可变区。抗体片段的实例包括fab、fab'、f(ab')2和fv片段;双抗体;线性抗体(参见美国专利第5,641,870号,实施例2;zapata等,proteineng.8(10):1057-1062[1995]);单链抗体分子和由抗体片段形成的多特异性抗体。抗体的木瓜蛋白酶消化产生两个相同抗原结合片段,称为“fab”片段;和残余“fc”片段,名称反映其容易结晶的能力。fab片段由完整的l链以及h链的可变区结构域(vh)和一条重链的第一恒定域(ch1)组成。各fab片段对于抗原结合是单价的,即,其具有单一抗原结合位点。对抗体进行胃蛋白酶处理产生单个大的f(ab')2片段,其大致对应于具有不同抗原结合活性的两个二硫化物连接的fab片段,并且仍能够交联抗原。fab'片段不同于fab片段之处在于在ch1域的羧基末端处添加了几个额外的残基,包括来自抗体铰链区的一个或多个半胱氨酸。fab'-sh是在本文中针对其中恒定域的半胱氨酸残基带有游离硫醇基的fab'的名称。f(ab')2抗体片段最初作为在其间具有铰链半胱氨酸的fab'片段对而产生。还已知抗体片段的其它化学偶联。
fc片段包含通过二硫键保持在一起的两条h链的羧基末端部分。抗体的效应功能由fc区的序列决定,所述区也被某些种类的细胞上存在的fc受体(fcr)识别。
“fv”是含有完整抗原识别和结合位点的最小抗体片段。该片段由一个重链可变区结构域与一个轻链可变区结构域通过紧密的非共价结合形成的二聚体组成。这两个结构域的折叠产生六个高变环(3个环来自h链并且3个环来自l链),这些高变环贡献了用于抗原结合的氨基酸残基并且赋予抗体以抗原结合特异性。然而,即使单个可变域(或fv上仅包含对抗原具有特异性的三个hvr的那一半)具有识别并结合抗原的能力,但与完整结合位点相比其亲和力较低。
“单链fv”,也缩写为“sfv”或“scfv”,是包含连接至单一多肽链中的vh与vl抗体结构域的抗体片段。优选地,sfv多肽还包含介于vh与vl域之间的多肽接头,其使得sfv能够形成抗原结合所需的结构。关于sfv的综述,参见pluckthun,thepharmacologyofmonoclonalantibodies,第113卷,rosenburg和moore编,springer-verlag,newyork,第269-315页(1994)。
本文所述的抗体的“功能性片段”包含完整抗体的一部分,通常包括完整抗体的抗原结合区或可变区或者保留fcr结合能力或具有改变的fcr结合能力的抗体的fc区。抗体片段的实例包括线性抗体、单链抗体分子和由抗体片段形成的多特异性抗体。
术语“双抗体”是指通过以下操作所制备的小抗体片段:在vh与vl域之间构建具有短接头(约5-10个残基)的sfv片段(参见前述段落)以使得实现v域的链间而非链内配对,由此产生二价片段,即具有两个抗原结合位点的片段。双特异性双抗体是两个“交叉”sfv片段的异二聚体,其中两种抗体的vh和vl域存在于不同多肽链上。双抗体更详细地描述于例如ep404,097;wo93/11161;hollinger等,proc.natl.acad.sci.usa90:6444-6448(1993)中。
单克隆抗体在本文中具体地包括“嵌合”抗体(免疫球蛋白),其中重链和/或轻链的一部分与来源于特定物种或属于特定抗体类别或子类的抗体中的相应序列相同或同源,而链的其余部分与来源于另一物种或属于另一抗体类别或子类的抗体以及这类抗体片段中的相应序列相同或同源,只要它们展现所需的生物活性即可(美国专利第4,816,567号;morrison等,proc.natl.acad.sci.usa,81:6851-6855(1984))。所关注的嵌合抗体在本文中包括
“人源化”形式的非人类(例如鼠类)抗体是含有来源于非人类免疫球蛋白的最小序列的嵌合抗体。在一个实施方案中,人源化抗体是人类免疫球蛋白(受者抗体),其中来自受者的hvr(在下文中定义)的残基被来自非人类物种(供者抗体)例如小鼠、大鼠、兔或非人灵长类动物的具有所需特异性、亲和力和/或能力的hvr的残基代替。在一些情况下,人类免疫球蛋白的框架(“fr”)残基被相应的非人类残基代替。此外,人源化抗体可包含受者抗体或供者抗体中不存在的残基。可作出这些修饰以进一步改进抗体性能,例如结合亲和力。一般来说,人源化抗体将包含基本上至少一个,并且通常两个可变域,其中所有或基本上所有的高变环对应于非人类免疫球蛋白序列的那些,并且所有或基本上所有的fr区是人类免疫球蛋白序列的那些,但fr区可包括一个或多个改进抗体性能(例如结合亲和力、异构化、免疫原性等)的个别fr残基取代。fr中这些氨基酸取代的数目通常在h链中不超过6个,并且在l链中不超过3个。人源化抗体任选地还将包含免疫球蛋白恒定区(fc)的至少一部分,通常是人类免疫球蛋白的至少一部分。关于更多细节,参见例如jones等,nature321:522-525(1986);riechmann等,nature332:323-329(1988);以及presta,curr.op.struct.biol.2:593-596(1992)。也参见例如vaswani和hamilton,ann.allergy,asthma&immunol.1:105-115(1998);harris,biochem.soc.transactions23:1035-1038(1995);hurle和gross,curr.op.biotech.5:428-433(1994);以及美国专利第6,982,321号和第7,087,409号。
“人类抗体”是具有对应于由人类所产生的抗体的氨基酸序列和/或已使用如本文所公开的制备人类抗体的任何技术所制造的抗体。人类抗体的这种定义明确地排除包含非人类抗原结合残基的人源化抗体。人类抗体可使用本领域中已知的各种技术(包括噬菌体展示文库)产生。hoogenboom和winter,j.mol.biol.,227:381(1991);marks等,j.mol.biol.,222:581(1991)。还可用于制备人类单克隆抗体的方法描述于cole等,monoclonalantibodiesandcancertherapy,alanr.liss,第77页(1985);boerner等,j.immunol.,147(1):86-95(1991)中。也参见vandijk和vandewinkel,curr.opin.pharmacol.,5:368-74(2001)。人类抗体可通过向已被修饰以响应于抗原激发产生这类抗体但其内源性基因座已失效的转基因动物(例如,经免疫的异种小鼠)施用抗原来制备(关于xenomousetm技术,参见例如美国专利第6,075,181号和第6,150,584号)。关于经由人类b细胞杂交瘤技术产生的人类抗体,也参见例如li等,proc.natl.acad.sci.usa,103:3557-3562(2006)。
术语“高变区”、“hvr”或“hv”当用于本文中时是指在序列上是高变的和/或在结构上形成所定义的环的抗体可变域的区域。通常,4链抗体包含六个hvr;三个在vh中(h1、h2、h3),并且三个在vl中(l1、l2、l3)。单域抗体包含三个hvr,例如vhh中的三个(h1、h2、h3)。在天然4链抗体中,h3和l3展示六个hvr的最大多样性,并且特别认为h3在赋予抗体以良好特异性上发挥独特作用。参见例如xu等,immunity13:37-45(2000);johnson和wu,methodsinmolecularbiology248:1-25(lo编,humanpress,totowa,n.j.,2003)。实际上,仅由重链组成的天然存在的骆驼科抗体在不存在轻链的情况下是功能性和稳定的。参见例如hamers-casterman等,nature363:446-448(1993);sheriff等,naturestruct.biol.3:733-736(1996)。
术语“互补决定区”或“cdr”用于指代如kabat系统所定义的高变区。参见kabat等,sequencesofproteinsofimmunologicalinterest,第5版,publichealthservice,nationalinstitutesofhealth,bethesda,md.(1991)
许多hvr划定在本文中使用并由其涵盖。kabat互补决定区(cdr)是基于序列变异性并且最常使用(kabat等,sequencesofproteinsofimmunologicalinterest,第5版,publichealthservice,nationalinstitutesofhealth,bethesda,md.(1991))。chothia则是指结构环的位置(chothia和lesk,j.mol.biol.196:901-917(1987))。abmhvr表示kabathvr与chothia结构环之间的折衷,并且通过oxfordmolecular'sabm抗体建模软件使用。“接触”hvr是基于可获得的复杂晶体结构的分析。来自这些hvr各自的残基在下表1中示出。
表1.hvr划定
hvr可包含如下“延长的hvr”:在vl中的24-36或24-34(l1)、46-56或50-56(l2)和89-97或89-96(l3);以及在vh中的26-35(h1)、50-65或49-65(h2)和93-102、94-102或95-102(h3)。对于这些定义中的每一者,根据kabat等,同上对可变结构域残基进行编号。
表述“如kabat中所编号的可变域残基”或“如kabat中所编号的氨基酸位置”及其变型是指在kabat等,同上中用于抗体编译的重链可变域或轻链可变域的编号系统。使用这种编号系统,实际的线性氨基酸序列可含有较少或额外的氨基酸,对应于可变域的fr或hvr的缩短或其中的插入。例如,重链可变域可包括在h2的残基52之后插入的单个氨基酸(根据kabat的残基52a)和重链fr残基82之后插入的残基(例如,根据kabat的残基82a、82b和82c等)。残基的kabat编号可针对给定抗体通过比对抗体序列的同源区与“标准”kabat编号序列来确定。
“框架”或“fr”残基是除如本文所定义的hvr残基以外的那些可变域残基。
“人类共有框架”或“受体人类框架”是表示在选择免疫球蛋白vl或vh框架序列中最常出现的氨基酸残基的框架。一般来说,人类免疫球蛋白vl或vh序列的选择是来自可变域序列的亚组。一般来说,序列的亚组是如kabat等,sequencesofproteinsofimmunologicalinterest,第5版,publichealthservice,nationalinstitutesofhealth,bethesda,md.(1991)中所述的亚组。实例包括:对于vl,亚组可以是亚组κi、κii、κiii或κiv,如在kabat等,同上中。另外,对于vh,亚组可以是亚组i、亚组ii或亚组iii,如在kabat等中。或者,人类共有框架可来源于以上特定残基,例如当人类框架残基通过比对供者框架序列与各种人类框架序列的集合,基于其与供者框架的同源性来选择时。“来源于”人类免疫球蛋白框架或人类共有框架的受体人类框架可包含其相同的氨基酸序列,或者其可含有预先存在的氨基酸序列变化。在一些实施方案中,预先存在的氨基酸变化的数目是10个或更少个、9个或更少个、8个或更少个、7个或更少个、6个或更少个、5个或更少个、4个或更少个、3个或更少个、或2个或更少个。
在例如fc区的指定位置处的“氨基酸修饰”是指指定残基的取代或缺失,或与所述指定残基相邻的至少一个氨基酸残基的插入。与指定残基“相邻”的插入意指在其一至两个残基内的插入。插入可在指定残基的n末端或c末端处。本文中的优选氨基酸修饰是取代。
“亲和力成熟的”抗体在其一个或多个hvr中有一个或多个变化,从而导致所述抗体对抗原的亲和力相比于不具有那些变化的亲本抗体有所提高。在一个实施方案中,亲和力成熟的抗体对靶抗原具有纳摩尔或甚至皮摩尔亲和力。亲和力成熟的抗体是通过本领域中已知的程序产生。例如,marks等,bio/technology10:779-783(1992)描述通过vh与vl域改组实现的亲和力成熟。hvr和/或框架残基的随机诱变由例如以下文献描述:barbas等,procnat.acad.sci.usa91:3809-3813(1994);schier等,gene169:147-155(1995);yelton等,j.immunol.155:1994-2004(1995);jackson等,j.immunol.154(7):3310-9(1995);以及hawkins等,j.mol.biol.226:889-896(1992)。
如本文所用,术语“特异性地结合”或“对……具特异性”是指介于靶标与抗体之间的可测量且可再现的相互作用例如结合,其是在包括生物分子的分子的异源群体存在下靶标存在的决定因素。例如,特异性地结合靶标(其可以是表位)的抗体是这样的抗体:与结合其它靶标相比,所述抗体以较大亲和力、亲合力、更容易地和/或以更长持续时间结合该靶标。在一个实施方案中,抗体与不相关的靶标结合的程度小于所述抗体与靶标结合的约10%,如例如通过放射免疫测定(ria)所测量。在某些实施方案中,特异性地结合靶标的抗体具有≦1μm、≦100nm、≦10nm、≦1nm或≦0.1nm的解离常数(kd)。在某些实施方案中,抗体特异性地结合在来自不同物种的蛋白质中保守的蛋白质上的表位。在另一个实施方案中,特异性结合可包括但不需要排他性结合。
术语“特异性”是指抗原结合蛋白或抗体对于抗原的特定表位的选择性识别。天然抗体是例如单特异性的。如本文所用的术语“多特异性”表示抗原结合蛋白或抗体具有两个或更多个抗原结合位点,其中至少两个结合不同抗原或相同抗原的不同表位。如本文所用的“三特异性”表示抗原结合蛋白或抗体具有三种不同的抗原结合特异性。如本文所用的术语“单特异性”抗体表示具有一个或多个结合位点的抗体,所述一个或多个结合位点各自结合相同抗原的相同表位。
如本文所用的术语“价态”表示指定数目的结合位点在抗原结合蛋白或抗体分子中的存在。例如,天然抗体或全长抗体具有两个结合位点并且是二价的。因而,术语“三价”、“四价”、“五价”和“六价”表示两个结合位点、三个结合位点、四个结合位点、五个结合位点和六个结合位点分别在抗原结合蛋白或抗体分子中的存在。
“阻断”抗体或“拮抗剂”抗体是抑制或降低其所结合的抗原的生物活性的抗体。在一些实施方案中,阻断抗体或拮抗剂抗体基本上或完全抑制抗原的生物活性。
“激动剂”或活化抗体是增强或引发由其所结合的抗原进行的信号传导的抗体。在一些实施方案中,激动剂抗体在天然配体不存在下引起或激活信号传导。
“抗体效应功能”是指可归因于抗体的fc区(天然序列fc区或氨基酸序列变体fc区)的那些生物活性,并且随抗体同型而变化。抗体效应功能的实例包括:c1q结合和补体依赖性细胞毒性;fc受体结合;抗体依赖性细胞介导的细胞毒性(adcc);吞噬作用;细胞表面受体(例如b细胞受体)的下调;以及b细胞活化。“降低的或最小化的”抗体效应功能意指相比于野生型或未经修饰的抗体,抗体效应功能减小了至少50%(或者60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%)。抗体效应功能的测定可容易由本领域普通技术人员确定和测量。在一个优选的实施方案中,实现了以下抗体效应功能:补体结合、补体依赖性细胞毒性和抗体依赖性细胞毒性。在一些实施方案中,效应功能是通过恒定区中的突变消除,所述突变消除了糖基化,例如,“效应子较弱的突变”。在一个方面,效应子较弱的突变是ch2区中的n297a或dana突变(d265a+n297a)。shields等,j.biol.chem.276(9):6591-6604(2001)。或者,产生降低或消除的效应功能的额外突变包括:k322a和l234a/l235a(lala)。或者,效应功能可通过产生技术而降低或消除,例如在无糖基化(例如大肠杆菌)或其中产生改变的糖基化模式(所述模式在促进效应功能上是无效或不太有效的)的宿主细胞中的表达(例如,shinkawa等,j.biol.chem.278(5):3466-3473(2003)。
“抗体依赖性细胞介导的细胞毒性”或adcc是指一种细胞毒性形式,其中结合至存在于某些细胞毒性细胞(例如,自然杀手(nk)细胞、嗜中性白细胞和巨噬细胞)上的fc受体(fcr)上的分泌型ig使得这些细胞毒性效应细胞能够特异性地结合至带有抗原的靶细胞,随后用细胞毒素杀死靶细胞。抗体“装备(arm)”细胞毒性细胞并且是通过该机制杀灭靶细胞所需的。介导adcc的主要细胞(nk细胞)仅表达fcγriii,而单核细胞则表达fcγri、fcγrii和fcγriii。造血细胞上的fc表达概述于ravetch和kinet,annu.rev.immunol.9:457-92(1991)第464页的表3中。为了评价所关注的分子的adcc活性,可进行体外adcc测定,例如美国专利第5,500,362号或第5,821,337号中所述的测定。对于这类测定有用的效应细胞包括外周血单核细胞(pbmc)和自然杀手(nk)细胞。或者或另外,可例如在例如clynes等,pnasusa95:652-656(1998)中所公开的动物模型中在体内评价所关注的分子的adcc活性。
除非本文中另外指示,否则免疫球蛋白重链中残基的编号是如kabat等,同上中eu索引的编号。“如kabat中的eu索引”是指人类igg1eu抗体的残基编号。
术语“fc区”在本文中用于定义免疫球蛋白重链的c末端区,包括天然序列fc区和变异fc区。虽然免疫球蛋白重链的fc区的边界可变化,但人类igg重链fc区通常限定为从位置cys226或pro230处的氨基酸残基延伸至其羧基末端的一段。fc区的c末端赖氨酸(残基447,根据eu编号系统)可例如在抗体产生或纯化期间移除或通过重组工程化编码抗体重链的核酸来移除。因此,完整抗体的组成可包含所有k447残基被移除的抗体群体、k447残基未被移除的抗体群体、以及具有存在和不存在k447残基的抗体的混合物的抗体群体。适用于本文所述的抗体中的天然序列fc区包括人类igg1、igg2(igg2a、igg2b)、igg3和igg4。
“fc受体”或“fcr”描述结合抗体的fc区的受体。优选的fcr是天然序列人类fcr。此外,优选fcr是结合igg抗体的受体(γ受体)并且包括fcγri、fcγrii和fcγriii子类的受体,包括等位基因变体和替代地剪接形式的这些受体,fcγrii受体包括fcγriia(“活化受体”)与fcγriib(“抑制受体”),其具有主要区别在于其细胞质域的相似的氨基酸序列。活化受体fcγriia在其细胞质域中含有基于免疫受体酪氨酸的活化基序(itam)。抑制受体fcγriib在其细胞质域中含有基于免疫受体酪氨酸的抑制基序(itim)。(参见m.
术语“fc受体”或“fcr”还包括新生受体fcrn,其负责将母体igg转移至胎儿。guyer等,j.immunol.117:587(1976)和kim等,j.immunol.24:249(1994)。已知测量结合至fcrn的方法(参见例如ghetie和ward,immunol.today18:(12):592-8(1997);ghetie等,naturebiotechnology15(7):637-40(1997);hinton等,j.biol.chem.279(8):6213-6(2004);wo2004/92219(hinton等)。体内与fcrn的结合和人类fcrn高亲和力结合多肽的血清半衰期可例如在表达人类fcrn的转基因小鼠或经转染的人类细胞系中或在施用具有变异fc区的多肽的灵长类动物中测定。wo2004/42072(presta)描述改进或减弱与fcr的结合的抗体变体。也参见例如shields等,j.biol.chem.9(2):6591-6604(2001)。
“效应细胞”是表达一个或多个fcr并执行效应功能的白细胞。在一个方面,效应细胞至少表达fcγriii并执行adcc效应功能。介导adcc的人类白细胞的实例包括外周血单核细胞(pbmc)、自然杀手(nk)细胞、单核细胞、细胞毒性t细胞和嗜中性白细胞。效应细胞可从天然来源(例如血液)中分离。效应细胞一般是与效应期相关的淋巴细胞,并且用于产生细胞因子(辅助t细胞)、杀灭感染病原体的细胞(细胞毒性t细胞)或分泌抗体(分化的b细胞)。
“补体依赖性细胞毒性”或“cdc”是指在补体存在下靶细胞的溶解。经典补体途径的激活是通过补体系统的第一组分(c1q)与结合至其同源抗原上的(适当子类的)抗体的结合来引发。为了评价补体激活,可进行cdc测定,例如,如gazzano-santoro等,j.immunol.methods202:163(1996)中所述。具有经改变的fc区氨基酸序列和提高或降低的c1q结合能力的抗体变体描述于美国专利第6,194,551b1号和wo99/51642中。那些专利出版物的内容明确地通过引用并入本文中。也参见idusogie等,j.immunol.164:4178-4184(2000)。
术语“仅重链的抗体”或“hcab”是指功能性抗体,其包含重链但缺少通常见于抗体中的轻链。已知骆驼科动物(例如骆驼、美洲驼或羊驼)产生hcab。
术语“单域抗体”或“sdab”是指具有三个互补决定区(cdr)的单一抗原结合多肽。单独的sdab能够在不与相应的含cdr的多肽配对下与抗原结合。在一些情况下,sdab是从骆驼科hcab工程化,并且其重链可变域在本文中称为“vhh”。骆驼科sdab是最小的已知抗原结合抗体片段之一(参见例如hamers-casterman等,nature363:446-8(1993);greenberg等,nature374:168-73(1995);hassanzadeh-ghassabeh等,nanomedicine(lond),8:1013-26(2013))。
“结合亲和力”一般是指介于分子(例如抗体)的单个结合位点与其结合搭配物(例如抗原)之间的非共价相互作用的总强度。除非另外指示,否则如本文所用的“结合亲和力”是指反映结合对的成员(例如,抗体与抗原)之间的1:1相互作用的固有结合亲和力。分子x对其搭配物y的亲和力一般可由解离常数(kd)表示。亲和力可通过本领域中已知的常用方法测量,包括本文所述的那些。低亲和力抗体通常缓慢结合抗原并且倾向于容易解离,而高亲和力抗体通常更快地结合抗原并且倾向于保持结合更久。测量结合亲和力的多种方法是本领域中已知的,其中任一种可出于本申请的目的使用。用于测量结合亲和力的具体的说明性和示例性实施方案在下文中描述。
如本文所用的“kd”或“kd值”在一个实施方案中通过放射性标记的抗原结合测定(ria)来测量,所述ria如由以下测定所述用fab形式的抗体和抗原分子进行,所述测定通过下列操作来测量fab对于抗原的溶液结合亲和力:在一系列滴定的未标记抗原存在下使fab与最小浓度的(125i)-标记的抗原平衡,然后用抗fab抗体包被的板捕获结合抗原(chen等,(1999)j.mol.biol293:865-881)。为了确定用于测定的条件,在50mm碳酸钠(ph9.6)中用5μg/ml捕获抗fab抗体(cappellabs)包被微量滴定板(dynex)过夜,并且随后在室温(大约23℃)下在pbs中用2%(w/v)牛血清白蛋白阻断2至5小时。在非吸附板(nunc#269620)中,将100pm或26pm[125i]-抗原与所关注的fab的连续稀释液(与抗vegf抗体的评估一致,fab-12,在presta等,(1997)cancerres.57:4593-4599中)混合。然后将所关注的fab培育过夜;然而,培育可持续更长时间(例如65小时)以确保达到平衡。其后,将混合物转移至捕获板以便在室温下培育1小时。随后移除溶液并且用在pbs中的0.1%tween-20洗涤所述板8次。当所述板已经干燥时,添加150μl/孔的闪烁体(microscint-20;packard),并且在topcountγ计数器(packard)上计数所述板十分钟。选择给出小于或等于20%最大结合的各fab的浓度以用于竞争性结合测定中。
根据另一个实施方案,在25℃下,在约10个响应单位(ru)下,用经固定的抗原cm5芯片,使用
相对于肽、多肽或抗体序列的“氨基酸序列同一性百分比(%)”与“同源性”被定义为在比对序列并引入空位(如果需要)以获得最大序列同一性百分比并且不将任何保守取代视为序列同一性的一部分后的候选序列的氨基酸残基与特定的肽或多肽序列的氨基酸残基相同的百分比。为了测定氨基酸序列同一性百分比所进行的比对可用本领域技能范围内的各种方法实现,例如,使用公众可获得的计算机软件,例如blast、blast-2、align或megaligntm(dnastar)软件。本领域技术人员可确定用于测量比对的适当参数,包括在所比较的序列全长上实现最大比对所需的任何算法。
编码本文的mabp的“经分离的”核酸分子是被鉴定并与至少一个污染物核酸分子分离的核酸分子,所述核酸分子通常在其产生的环境中与污染物核酸分子缔合。优选地,经分离的核酸免于与其产生环境相关的所有组分缔合。编码本文的多肽与抗体的经分离的核酸分子处于与其在自然界中所见的形式或环境不同的形式。因此,经分离的核酸分子不同于天然存在于细胞中的编码本文的多肽和抗体的核酸。
术语“控制序列”是指在特定的宿主生物体中表达可操作连接的编码序列所必需的dna序列。适用于原核生物的控制序列例如包括启动子、任选地操纵子序列和核糖体结合位点。已知真核细胞利用启动子、多腺苷酸化信号和增强子。
核酸当置于与另一核酸序列的功能关系中时是“可操作地连接”。例如,前序列或分泌型前导序列的dna如果被表达为参与多肽分泌的前蛋白则与多肽的dna可操作地连接;启动子或增强子如果影响序列的转录则与编码序列可操作地连接;或核糖体结合位点如果被定位以便促进翻译则与编码序列可操作地连接。一般来说,“可操作地连接”意指所连接的dna序列是邻接的,并且在分泌型前导序列的情况下是邻接的并且处于阅读相中。然而,增强子不必是邻接的。连接是通过在适宜的限制性位点处的连接实现。如果不存在这类位点,则按照常规操作使用合成的寡核苷酸衔接子或接头。
如本文所用的“载体”包括当其以所用剂量和浓度暴露于细胞或哺乳动物时无毒的药学上可接受的载体、赋形剂或稳定剂。通常,生理上可接受的载体是ph缓冲水溶液。生理上可接受的载体的实例包括缓冲剂,例如磷酸盐、柠檬酸盐和其它有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(例如十八烷基二甲苄基氯化铵;氯化六烃季铵;苯扎氯铵;苄索氯铵;苯酚、丁醇或苄醇;对羟基苯甲酸烷酯,例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)多肽;蛋白质,例如血清白蛋白、明胶或免疫球蛋白;亲水聚合物,例如聚乙烯吡咯烷酮;氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸;单糖、二糖和其它碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,例如edta;糖类,例如蔗糖、甘露糖醇、海藻糖或山梨糖醇;成盐相对离子,例如钠;金属复合物(例如,zn-蛋白质复合物);和/或非离子性界面活性剂,例如tweentm、聚乙二醇(peg)和pluronicstm或聚乙二醇(peg)。
所关注的“稀释剂”在此是药学上可接受的(对于向人类施用是安全和无毒的)并且对于制备液体制剂有用的试剂,例如在冻干之后重构的制剂。示例性稀释剂包括无菌水、抑菌注射用水(bwfi)、ph值缓冲溶液(例如,磷酸盐缓冲盐水)、无菌盐水溶液、林格氏溶液或右旋糖溶液。在一个替代实施方案中,稀释剂可包括盐和/或缓冲液的水溶液。
“防腐剂”是可添加至本文制剂中以降低细菌活性的化合物。防腐剂的添加可例如便于多次使用(多剂量)制剂的产生。可能的防腐剂的实例包括十八烷基二甲苄基氯化铵、氯化六烃季铵、苯扎氯铵(烷基苄基二甲基氯化铵的混合物,其中烷基是长链化合物)和苄索氯铵。其它类型的防腐剂包括芳族醇,例如苯酚、丁醇和苯甲醇;对羟基苯甲酸烷酯,例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚。最优选的防腐剂在此是苄醇。
术语“药物制剂”是指其剂型容许有效发挥活性成分的生物活性,并且不含对于施用制剂的受试者有不可接受的毒性的额外组分的制剂。这类制剂是无菌的。“无菌”制剂是无菌的或不含所有活的微生物及其芽孢。
“稳定”制剂是这样的制剂,在储存时,其中的蛋白质基本上保持其物理与化学稳定性和完整性。用于测量蛋白质稳定性的各种分析技术可在本领域中获得并且综述于peptideandproteindrugdelivery,247-301,vincentlee编,marceldekker,inc.,newyork,n.y.,pubs.(1991)和jones,a.adv.drugdeliveryrev.10:29-90(1993)中。可在选定温度下在选定时期内测量稳定性。对于快速筛选,制剂可保持在40℃下持续2周至1个月,在此期间测量稳定性。当制剂将要在2-8℃下储存时,一般地制剂应在30℃或40℃下稳定至少1个月和/或在2-8℃下稳定至少2年。当制剂将要在30℃下储存时,一般地制剂应在30℃下稳定至少2年和/或在40℃下稳定至少6个月。例如,在储存期间的聚集程度可用作蛋白质稳定性的指标。因此,“稳定”制剂可以是这样的制剂:其中小于约10%并且优选小于约5%的蛋白质在制剂中以聚集体存在。在其它实施方案中,可确定在制剂储存期间聚集体形成的任何增加。
“重构”制剂是已通过将冻干的蛋白质或抗体制剂溶解在稀释剂中以使得蛋白质分散遍及其中而制备的制剂。重构制剂适用于向有待用所关注的蛋白质治疗的患者施用(例如皮下施用)并且在某些实施方案中,可以是适用于非经肠或静脉内施用的制剂。
“等渗”制剂是基本上具有与人类血液相同的渗透压的制剂。等渗制剂一般将具有约250至350mosm的渗透压。术语“低渗”描述具有低于人类血液的渗透压的制剂。相应地,术语“高渗”用于描述具有高于人类血液的渗透压的制剂。等渗性可例如使用蒸汽压或冰冻型渗压计来测量。本申请的制剂可由于添加盐和/或缓冲液而是高渗的。
“免疫检查点分子”是指上调信号或下调信号的免疫系统中的分子。“刺激性免疫检查点分子”或“共刺激性分子”是上调免疫系统中的信号的免疫检查点分子。“抑制性免疫检查点分子”是下调免疫系统中的信号的免疫检查点分子。
应理解,本文所述的实施方案包括“由实施方案组成”和/或“基本上由实施方案组成”。
在本文中提及“约”某个值或参数包括(并描述)涉及所述值或参数本身的变化。举例来说,提及“约x”的说明包括“x”的说明。
如本文所用,提及“并非”某个值或参数一般意指并描述“除所述值或参数以外”。举例来说,所述方法不用于治疗x型癌症意味着所述方法用于治疗除x以外的类型的癌症。
在本文中使用的术语“约x-y”具有与“约x至约y”相同的含义。
除非上下文另外清楚指示,否则如本文和所附权利要求中所用,单数形式“一”、“或”和“所述”包括复数个指示物。
ii.多特异性抗原结合蛋白(mabp)
本申请的一个方面提供一种多特异性(例如三特异性)抗原结合蛋白(mabp),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,(b)含有特异性地结合第二表位的第一sdab的第二抗原结合部分,和(c)含有特异性地结合第三表位的第二sdab的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。在一些实施方案中,第一表位来自第一免疫检查点分子(例如pd-1,seqidno:12),第二表位来自第二免疫检查点分子(例如tigit,seqidno:13),并且第三表位来自第三免疫检查点分子(例如lag-3,seqidno:14)。在一些实施方案中,第一表位来自第一肿瘤抗原,第二表位来自第二肿瘤抗原,并且第三表位来自第三肿瘤抗原。在一些实施方案中,第一表位来自第一肿瘤抗原(例如her-2),第二表位来自免疫效应细胞上的细胞表面分子(例如cd3),并且第三表位来自第二肿瘤抗原(例如egfr)。在一些实施方案中,第一表位来自第一促炎性分子(例如tnf-α),第二表位来自第二促炎性分子(例如il-17a),并且第三表位来自第三促炎性分子(例如il-17f)。在一些实施方案中,第一表位来自第一血管生成因子(例如ang2),第二表位来自第二血管生成因子(例如vegf),并且第三表位来自第三血管生成因子(例如dll4)。在一些实施方案中,第一sdab和/或第二sdab是vhh。在一些实施方案中,第一抗原结合部分包含含有vh的重链和含有vl的轻链。在一些实施方案中,第一抗原结合区是由两条重链和两条轻链组成的全长抗体。在一些实施方案中,抗原结合部分经由肽接头融合在一起。在一些实施方案中,肽接头长度不超过约30个(例如不超过约25、20或15个中的任一者)氨基酸。在一些实施方案中,第一抗原结合部分包含fc区,例如igg1fc或igg4fc。
本申请的mabp具有可特异性地结合至少三个不同表位的至少三个抗原结合部分。mabp可以是对称或不对称的。例如,mabp可包含第一抗原结合部分的一个或两个拷贝、第二抗原结合部分的一至八个拷贝、以及第三抗原结合部分的一至八个拷贝。在一些实施方案中,第一抗原结合部分可以是双特异性抗体。在一些实施方案中,第一抗原结合部分是单特异性全长抗体或其抗原结合片段,例如fab。
在一些实施方案中,mabp包含2个、3个、4个、5个、6个、7个、8个或更多个不同抗原结合部分中的任一者,其各自包含sdab。各sdab可直接融合至第一抗原结合部分或融合至另一sdab,其中所融合的sdab进一步融合至第一抗原结合部分。
mabp可对每个表位具有任何合适数目的价态和任何合适数目的特异性。在一些实施方案中,mabp对第一表位呈二价、三价、四价、五价、六价或更高价态。在一些实施方案中,mabp对第二表位呈单价、二价、三价、四价、五价、六价或更高价态。在一些实施方案中,mabp对第三表位呈单价、二价、三价、四价、五价、六价或更高价态。在一些实施方案中,mabp是三特异性的。在一些实施方案中,mabp是四特异性的。在一些实施方案中,mabp具有超过四种特异性。示例性三特异性抗原结合蛋白(“tabp”)描绘于图1-10中。
在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分的一个或多个(例如,1个或2个)拷贝,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,(b)含有特异性地结合第二表位的sdab的第二抗原结合部分的一个或多个(例如2个)拷贝,和(c)含有特异性地结合第三表位的sdab的第三抗原结合部分的一个或多个(例如2个)拷贝,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。
第一抗原结合部分、第二抗原结合部分和第三抗原结合部分可以任何合适的形式彼此融合。在一些实施方案中,第二抗原结合部分和第三抗原结合部分各自包含单一多肽链。在一些实施方案中,第一抗原结合部分包含一条或多条(例如2条)重链和一条或多条(例如2条)轻链。在一些实施方案中,第二抗原结合部分的c末端融合至第一抗原结合部分的至少一条重链的n末端,并且第三抗原结合部分的c末端融合至第一抗原结合部分的至少一条轻链的n末端。在一些实施方案中,第二抗原结合部分的c末端融合至第三抗原结合部分的n末端,并且第三抗原结合部分的c末端融合至第一抗原结合部分的至少一条重链的n末端。在一些实施方案中,第二抗原结合部分的c末端融合至第三抗原结合部分的n末端,并且第三抗原结合部分的c末端融合至第一抗原结合部分的至少一条轻链的n末端。在一些实施方案中,第二抗原结合部分的c末端融合至第一抗原结合部分的至少一条轻链的n末端,并且第三抗原结合部分的n末端融合至第一抗原结合部分的至少一条轻链的c末端。在一些实施方案中,第二抗原结合部分的c末端融合至第一抗原结合部分的至少一条重链的n末端,并且第三抗原结合部分的n末端融合至第一抗原结合部分的至少一条轻链的c末端。在一些实施方案中,第二抗原结合部分的c末端融合至第一抗原结合部分的至少一条重链的n末端,并且第三抗原结合部分的n末端融合至第一抗原结合部分的至少一条重链的c末端。在一些实施方案中,第二抗原结合部分的c末端融合至第一抗原结合部分的至少一条轻链的n末端,并且第三抗原结合部分的n末端融合至第一抗原结合部分的至少一条重链的c末端。在一些实施方案中,第二抗原结合部分的c末端融合至第一抗原结合部分的至少一条重链的c末端,并且第三抗原结合部分的n末端融合至第一抗原结合部分的至少一条轻链的c末端。在一些实施方案中,第三抗原结合部分的c末端融合至第二抗原结合部分的n末端,并且第三抗原结合部分的n末端融合至第一抗原结合部分的至少一条轻链的c末端。在一些实施方案中,第三抗原结合部分的c末端融合至第二抗原结合部分的n末端,并且第三抗原结合部分的n末端融合至第一抗原结合部分的至少一条重链的c末端。
在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,(b)含有特异性地结合第二表位的第一sdab的第二抗原结合部分,其中第一sdab的c末端融合至第一抗原结合部分的vh的n末端,和(c)含有特异性地结合第三表位的第二sdab的第三抗原结合部分,其中第二sdab的c末端融合至第一抗原结合部分的vl的n末端。在一些实施方案中,tabp包含:(a)第一多肽的两条链,每条链从n末端至c末端包含:vhh1-vh-ch1-ch2-ch3,和(b)第二多肽的两条链,每条链从n末端至c末端包含:vhh2-vl-cl,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,vhh1是特异性地结合第二表位的第一sdab,并且vhh2是特异性地结合第三表位的第二sdab。一个实例示于图1中。
在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,(b)含有特异性地结合第二表位的第一sdab的第二抗原结合部分,和(c)含有特异性地结合第三表位的第二sdab的第三抗原结合部分,其中第一sdab的c末端融合至第二sdab的n末端,并且第二sdab的c末端融合至第一抗原结合部分的vh的n末端。在一些实施方案中,tabp包含:(a)第一多肽的两条链,每条链从n末端至c末端包含:vhh1-vhh2-vh-ch1-ch2-ch3,和(b)第二多肽的两条链,每条链从n末端至c末端包含:vl-cl,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,vhh1是特异性地结合第二表位的第一sdab,并且vhh2是特异性地结合第三表位的第二sdab。一个实例示于图2中。
在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,(b)含有特异性地结合第二表位的第一sdab的第二抗原结合部分,和(c)含有特异性地结合第三表位的第二sdab的第三抗原结合部分,其中第一sdab的c末端融合至第二sdab的n末端,并且第二sdab的c末端融合至第一抗原结合部分的vl的n末端。在一些实施方案中,tabp包含:(a)第一多肽的两条链,每条链从n末端至c末端包含:vh-ch1-ch2-ch3,和(b)第二多肽的两条链,每条链从n末端至c末端包含:vhh1-vhh2-vl-cl,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,vhh1是特异性地结合第二表位的第一sdab,并且vhh2是特异性地结合第三表位的第二sdab。一个实例示于图3中。
在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)第一抗原结合部分,其含有包含重链可变区(vh)与重链恒定区(ch1)的重链和包含轻链可变区(vl)与轻链恒定区(cl)的轻链,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,(b)含有特异性地结合第二表位的第一sdab的第二抗原结合部分,和(c)含有特异性地结合第三表位的第二sdab的第三抗原结合部分,其中第一sdab的c末端融合至第一抗原结合部分的vl的n末端并且cl的c末端融合至第二sdab的n末端。在一些实施方案中,tabp包含:(a)第一多肽的两条链,每条链从n末端至c末端包含:vh-ch1-ch2-ch3,和(b)第二多肽的两条链,每条链从n末端至c末端包含:vhh1-vl-cl-vhh2,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,vhh1是特异性地结合第二表位的第一sdab,并且vhh2是特异性地结合第三表位的第二sdab。一个实例示于图4中。
在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)第一抗原结合部分,其含有包含重链可变区(vh)与重链恒定区(ch1)的重链和包含轻链可变区(vl)与轻链恒定区(cl)的轻链,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,(b)含有特异性地结合第二表位的第一sdab的第二抗原结合部分,和(c)含有特异性地结合第三表位的第二sdab的第三抗原结合部分,其中第一sdab的c末端融合至第一抗原结合部分的vh的n末端并且第一抗原结合部分的cl的c末端融合至第二sdab的n末端。在一些实施方案中,tabp包含:(a)第一多肽的两条链,每条链从n末端至c末端包含:vhh1-vh-ch1-ch2-ch3,和(b)第二多肽的两条链,每条链从n末端至c末端包含:vl-cl-vhh2,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,vhh1是特异性地结合第二表位的第一sdab,并且vhh2是特异性地结合第三表位的第二sdab。一个实例示于图5中。
在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)第一抗原结合部分,其含有包含重链可变区(vh)与重链恒定区ch1、ch2和ch3的重链以及包含轻链可变区(vl)与轻链恒定区(cl)的轻链,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,(b)含有特异性地结合第二表位的第一sdab的第二抗原结合部分,和(c)含有特异性地结合第三表位的第二sdab的第三抗原结合部分,其中第一sdab的c末端融合至第一抗原结合部分的vh的n末端并且第一抗原结合部分的ch3的c末端融合至第二sdab的n末端。在一些实施方案中,tabp包含:(a)第一多肽的两条链,每条链从n末端至c末端包含:vhh1-vh-ch1-ch2-ch3-vhh2,和(b)第二多肽的两条链,每条链从n末端至c末端包含:vl-cl,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,vhh1是特异性地结合第二表位的第一sdab,并且vhh2是特异性地结合第三表位的第二sdab。一个实例示于图6中。
在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)第一抗原结合部分,其含有包含重链可变区(vh)与重链恒定区ch1、ch2和ch3的重链以及包含轻链可变区(vl)与轻链恒定区(cl)的轻链,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,(b)含有特异性地结合第二表位的第一sdab的第二抗原结合部分,和(c)含有特异性地结合第三表位的第二sdab的第三抗原结合部分,其中第一sdab的c末端融合至第一抗原结合部分的vl的n末端并且第一抗原结合部分的ch3的c末端融合至第二sdab的n末端。在一些实施方案中,tabp包含:(a)第一多肽的两条链,每条链从n末端至c末端包含:vh-ch1-ch2-ch3-vhh2,和(b)第二多肽的两条链,每条链从n末端至c末端包含:vhh1-vl-cl,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,vhh1是特异性地结合第二表位的第一sdab,并且vhh2是特异性地结合第三表位的第二sdab。一个实例示于图7中。
在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)第一抗原结合部分,其含有包含重链可变区(vh)与重链恒定区ch1、ch2和ch3的重链以及包含轻链可变区(vl)与轻链恒定区(cl)的轻链,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,(b)含有特异性地结合第二表位的第一sdab的第二抗原结合部分,和(c)含有特异性地结合第三表位的第二sdab的第三抗原结合部分,其中第一sdab的n末端融合至第一抗原结合部分的ch3的c末端并且第一抗原结合部分的cl的c末端融合至第二sdab的n末端。在一些实施方案中,tabp包含:(a)第一多肽的两条链,每条链从n末端至c末端包含:vh-ch1-ch2-ch3-vhh1,和(b)第二多肽的两条链,每条链从n末端至c末端包含:vl-cl-vhh2,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,vhh1是特异性地结合第二表位的第一sdab,并且vhh2是特异性地结合第三表位的第二sdab。一个实例示于图8中。
在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)第一抗原结合部分,其含有包含重链可变区(vh)与重链恒定区(ch1)的重链和包含轻链可变区(vl)与轻链恒定区(cl)的轻链,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,(b)含有特异性地结合第二表位的第一sdab的第二抗原结合部分,和(c)含有特异性地结合第三表位的第二sdab的第三抗原结合部分,其中第二sdab的n末端融合至第一抗原结合部分的cl的c末端并且第二sdab的c末端融合至第一sdab的n末端。在一些实施方案中,tabp包含:(a)第一多肽的两条链,每条链从n末端至c末端包含:vh-ch1-ch2-ch3,和(b)第二多肽的两条链,每条链从n末端至c末端包含:vl-cl-vhh2-vhh1,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,vhh1是特异性地结合第二表位的第一sdab,并且vhh2是特异性地结合第三表位的第二sdab。一个实例示于图9中。
在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)第一抗原结合部分,其含有包含重链可变区(vh)与重链恒定区ch1、ch2和ch3的重链以及包含轻链可变区(vl)与轻链恒定区(cl)的轻链,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,(b)含有特异性地结合第二表位的第一sdab的第二抗原结合部分,和(c)含有特异性地结合第三表位的第二sdab的第三抗原结合部分,其中第二sdab的n末端融合至第一抗原结合部分的ch3的c末端并且第二sdab的c末端融合至第一sdab的n末端。在一些实施方案中,tabp包含:(a)第一多肽的两条链,每条链从n末端至c末端包含:vh-ch1-ch2-ch3-vhh2-vhh1,和(b)第二多肽的两条链,每条链从n末端至c末端包含:vl-cl,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,vhh1是特异性地结合第二表位的第一sdab,并且vhh2是特异性地结合第三表位的第二sdab。一个实例示于图10中。
表位和抗原
本文所述的mabp中的任一者可特异性地结合至少三个不同表位。所识别的至少三个不同表位可位于相同抗原或不同抗原上。在一些实施方案中,抗原是细胞表面分子。在一些实施方案中,抗原是细胞外分子。
在一些实施方案中,第一表位、第二表位和/或第三表位是免疫检查点分子。在一些实施方案中,免疫检查点分子是刺激性免疫检查点分子。示例性刺激性免疫检查点分子包括但不限于cd28、ox40、icos、gitr、4-1bb、cd27、cd40、cd3、hvem和tcr(例如,mhci类或ii类分子)。在一些实施方案中,免疫检查点分子是抑制性免疫检查点分子。示例性抑制性免疫检查点分子包括但不限于ctla-4、tim-3、a2a受体、lag-3、tigit、btla、kir、pd-1、ido、cd47和其配体,例如b7.1、b7.2、pd-l1、pd-l2、hvem、b7-h4、nktr-218和sirp-α受体。
因此,在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一免疫检查点分子的抗原结合位点,(b)含有特异性地结合第二免疫检查点分子的sdab的第二抗原结合部分,和(c)含有特异性地结合第三免疫检查点分子的第二sdab的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。在一些实施方案中,第一免疫检查点分子、第二免疫检查点分子和/或第三免疫检查点分子选自由下列各物组成的组:pd-1、pd-l1、pd-l2、ctla-4、b7-h3、tim-3、lag-3、tigit、vista、icos、4-1bb、ox40、gitr和cd40。在一些实施方案中,第一sdab和/或第二sdab是vhh。在一些实施方案中,第一抗原结合部分包含含有vh的重链和含有vl的轻链。在一些实施方案中,第一抗原结合区是由两条重链和两条轻链组成的全长抗体。在一些实施方案中,抗原结合部分经由肽接头融合在一起。在一些实施方案中,肽接头长度不超过约30个(例如不超过约25、20或15个中的任一者)氨基酸。在一些实施方案中,第一抗原结合部分包含fc区,例如igg4fc。
在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合pd-1的抗原结合位点,(b)含有特异性地结合tigit的第一sdab的第二抗原结合部分,和(c)含有特异性地结合lag-3的第二sdab的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。在一些实施方案中,第一sdab和/或第二sdab是vhh。在一些实施方案中,第一抗原结合部分包含含有vh的重链和含有vl的轻链。在一些实施方案中,第一抗原结合区是由两条重链和两条轻链组成的全长抗体,例如派姆单抗。在一些实施方案中,抗原结合部分经由肽接头融合在一起。在一些实施方案中,肽接头长度不超过约30个(例如不超过约25、20或15个中的任一者)氨基酸。在一些实施方案中,第一抗原结合部分包含fc区,例如igg4fc。
在一些实施方案中,第一表位、第二表位和/或第三表位是细胞表面抗原。在一些实施方案中,细胞表面抗原是免疫效应细胞上的抗原,例如t细胞(例如,辅助t细胞、细胞毒性t细胞、记忆t细胞等)、b细胞、巨噬细胞和自然杀手(nk)细胞。在一些实施方案中,细胞表面抗原是t细胞表面抗原,例如cd3。
在一些实施方案中,细胞表面抗原是肿瘤抗原。肿瘤抗原是由引发免疫应答(特别是t细胞介导的免疫应答)的肿瘤细胞产生的蛋白质。本文所述的靶抗原的选择将视有待治疗的具体癌症类型而定。示例性肿瘤抗原包括例如神经胶质瘤相关抗原、癌胚抗原(cea)、β-人绒毛膜促性腺激素、甲胎蛋白(afp)、凝集素反应性afp、甲状腺球蛋白、rage-1、mn-caix、人类端粒酶反转录酶、ru1、ru2(as)、肠羧基酯酶、muthsp70-2、m-csf、前列腺酶(prostase)、前列腺特异性抗原(psa)、pap、ny-eso-1、lage-la、p53、prostein、psma、her2/neu、存活素和端粒酶、前列腺癌肿瘤抗原-1(pcta-1)、mage、elf2m、嗜中性弹性蛋白酶、ephrinb2、cd22、胰岛素生长因子(igf)-i、igf-ii、igf-i受体和间皮素。
在一些实施方案中,肿瘤抗原包含与恶性肿瘤相关的一个或多个抗原性癌症表位。恶性肿瘤表达许多可充当免疫攻击的靶抗原的蛋白质。这些分子包括但不限于组织特异性抗原,例如在黑色素瘤中的mart-1、酪氨酸酶和gp100以及在前列腺癌中的前列腺酸性磷酸酶(pap)和前列腺特异性抗原(psa)。其它靶分子属于转化相关分子的组,例如致癌基因her2/neu/erbb-2。另一组靶抗原是肿瘤-胚胎性抗原,例如癌胚抗原(cea)。在b细胞淋巴瘤中,肿瘤特异性独特型免疫球蛋白构成真正的肿瘤特异性免疫球蛋白抗原,其为个别肿瘤所特有的。b细胞分化抗原例如cd19、cd20和cd37是b细胞淋巴瘤中的靶抗原的其它候选物。
在一些实施方案中,肿瘤抗原是肿瘤特异性抗原(tsa)或肿瘤相关抗原(taa)。tsa是肿瘤细胞所特有的并且未在体内的其它细胞上出现。taa相关抗原并非肿瘤细胞所特有,并且相反,还在未能诱导针对抗原的免疫耐受状态的条件下在正常细胞上表达。抗原在肿瘤上的表达可在免疫系统能够实现对抗原应答的条件下发生。taa可以是在胎儿发育期间当免疫系统未成熟并且不能响应时在正常细胞上表达的抗原,或者其可以是通常在正常细胞上以极低水平存在但在肿瘤细胞上以高得多的水平表达的抗原。
tsa或taa抗原的非限制性实例包括以下:分化抗原例如mart-1/melana(mart-i)、gp100(pmel17)、酪氨酸酶、trp-1、trp-2和肿瘤特异性多谱系抗原例如mage-1、mage-3、bage、gage-1、gage-2、pl5;过表达的胚胎抗原例如cea;过表达的致癌基因和突变的肿瘤抑制基因例如p53、ras、her2/neu;由染色体易位产生的独特肿瘤抗原;例如bcr-abl、e2a-prl、h4-ret、igh-igk、myl-rar;以及病毒抗原,例如eb病毒抗原ebva和人类乳头状瘤病毒(hpv)抗原e6和e7。其它大的基于蛋白质的抗原包括:tsp-180、mage-4、mage-5、mage-6、rage、ny-eso、pl85erbb2、pl80erbb-3、c-met、nm-23hi、psa、tag-72、ca19-9、ca72-4、cam17.1、numa、k-ras、β-链蛋白、cdk4、mum-1、p15、p16、43-9f、5t4、791tgp72、甲胎蛋白、β-hcg、bca225、btaa、ca125、ca15-3\ca27.29\bcaa、ca195、ca242、ca-50、cam43、cd68\p1、co-029、fgf-5、g250、ga733\epcam、htgp-175、m344、ma-50、mg7-ag、mov18、nb/70k、ny-co-1、rcas1、sdccag16、ta-90\mac-2结合蛋白\亲环蛋白c相关蛋白、taal6、tag72、tlp和tps。
因此,在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一肿瘤抗原的抗原结合位点,(b)含有特异性地结合第二肿瘤抗原的第一sdab的第二抗原结合部分,和(c)含有特异性地结合第三肿瘤抗原的第二sdab的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。在一些实施方案中,第一肿瘤抗原、第二肿瘤抗原和/或第三肿瘤抗原选自由下列各物组成的组:her2、braf、egfr、vegfr2、cd20、rankl、cd38和cd52。在一些实施方案中,第一sdab和/或第二sdab是vhh。在一些实施方案中,第一抗原结合部分包含含有vh的重链和含有vl的轻链。在一些实施方案中,第一抗原结合区是由两条重链和两条轻链组成的全长抗体。在一些实施方案中,抗原结合部分经由肽接头融合在一起。在一些实施方案中,肽接头长度不超过约30个(例如不超过约25、20或15个中的任一者)氨基酸。在一些实施方案中,第一抗原结合部分包含fc区,例如igg1fc。
在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一肿瘤抗原的抗原结合位点,(b)第二抗原结合部分,其含有特异性地结合免疫效应细胞(例如t细胞)上的细胞表面抗原的第一sdab,和(c)含有特异性地结合第二肿瘤抗原的第二sdab的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。在一些实施方案中,第一肿瘤抗原和/或第二肿瘤抗原选自由下列各物组成的组:her2、braf、egfr、vegfr2、cd20、rankl、cd38和cd52。在一些实施方案中,第一sdab和/或第二sdab是vhh。在一些实施方案中,第一抗原结合部分包含含有vh的重链和含有vl的轻链。在一些实施方案中,第一抗原结合区是由两条重链和两条轻链组成的全长抗体。在一些实施方案中,抗原结合部分经由肽接头融合在一起。在一些实施方案中,肽接头长度不超过约30个(例如不超过约25、20或15个中的任一者)氨基酸。在一些实施方案中,第一抗原结合部分包含fc区,例如igg1fc或igg4fc。
在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合her-2的抗原结合位点,(b)含有特异性地结合cd3的第一sdab的第二抗原结合部分,和(c)含有特异性地结合egfr的第二sdab的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。在一些实施方案中,第一sdab和/或第二sdab是vhh。在一些实施方案中,第一抗原结合部分包含含有vh的重链和含有vl的轻链。在一些实施方案中,第一抗原结合区是由两条重链和两条轻链组成的全长抗体,例如曲妥珠单抗。在一些实施方案中,抗原结合部分经由肽接头融合在一起。在一些实施方案中,肽接头长度不超过约30个(例如不超过约25、20或15个中的任一者)氨基酸。在一些实施方案中,第一抗原结合部分包含fc区,例如igg1fc或igg4fc。
在一些实施方案中,第一表位、第二表位和/或第三表位是促炎性分子。“促炎性分子”是指由上调炎性反应的免疫细胞(例如单核细胞、巨噬细胞、淋巴细胞和白细胞)产生或表达的任何分子。在一些实施方案中,促炎性分子是促炎性细胞因子,例如淋巴因子、单核因子、趋化因子或白介素。示例性促炎性分子包括但不限于il-1β、tnf-α、il-6、il-6r、il-5、il-17a、il-17f、il-23、il-22、il-21、il-12和伊红趋素-1(即ccl11)。
因此,在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一促炎性分子的抗原结合位点,(b)含有特异性地结合第二促炎性分子的第一sdab的第二抗原结合部分,和(c)含有特异性地结合第三促炎性分子的第二sdab的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。在一些实施方案中,第一促炎性分子、第二促炎性分子和/或第三促炎性分子选自由下列各物组成的组:il-1β、tnf-α、il-6、il-6r、il-5、il-17a、il-17f、il-23、il-22、il-21、il-12和伊红趋素-1。在一些实施方案中,第一sdab和/或第二sdab是vhh。在一些实施方案中,第一抗原结合部分包含含有vh的重链和含有vl的轻链。在一些实施方案中,第一抗原结合区是由两条重链和两条轻链组成的全长抗体。在一些实施方案中,抗原结合部分经由肽接头融合在一起。在一些实施方案中,肽接头长度不超过约30个(例如不超过约25、20或15个中的任一者)氨基酸。在一些实施方案中,第一抗原结合部分包含fc区,例如igg1fc。
在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合tnf-α的抗原结合位点,(b)含有特异性地结合il-17a的第一sdab的第二抗原结合部分,和(c)含有特异性地结合il-17f的第二sdab的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。在一些实施方案中,第一sdab和/或第二sdab是vhh。在一些实施方案中,第一抗原结合部分包含含有vh的重链和含有vl的轻链。在一些实施方案中,第一抗原结合区是由两条重链和两条轻链组成的全长抗体,例如阿达木单抗。在一些实施方案中,抗原结合部分经由肽接头融合在一起。在一些实施方案中,肽接头长度不超过约30个(例如不超过约25、20或15个中的任一者)氨基酸。在一些实施方案中,第一抗原结合部分包含fc区,例如igg1fc。
在一些实施方案中,第一表位、第二表位和/或第三表位是血管生成因子,例如ang2、vegf和dll4。
因此,在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一血管生成因子的抗原结合位点,(b)含有特异性地结合第二血管生成因子的第一sdab的第二抗原结合部分,和(c)含有特异性地结合第三血管生成因子的第二sdab的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。在一些实施方案中,第一sdab和/或第二sdab是vhh。在一些实施方案中,第一抗原结合部分包含含有vh的重链和含有vl的轻链。在一些实施方案中,第一抗原结合区是由两条重链和两条轻链组成的全长抗体。在一些实施方案中,抗原结合部分经由肽接头融合在一起。在一些实施方案中,肽接头长度不超过约30个(例如不超过约25、20或15个中的任一者)氨基酸。在一些实施方案中,第一抗原结合部分包含fc区,例如igg1fc。
在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合ang-2的抗原结合位点,(b)含有特异性地结合vegf的第一sdab的第二抗原结合部分,和(c)含有特异性地结合dll4的第二sdab的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。在一些实施方案中,第一sdab和/或第二sdab是vhh。在一些实施方案中,第一抗原结合部分包含含有vh的重链和含有vl的轻链。在一些实施方案中,第一抗原结合区是由两条重链和两条轻链组成的全长抗体,例如lc10。在一些实施方案中,抗原结合部分经由肽接头融合在一起。在一些实施方案中,肽接头长度不超过约30个(例如不超过约25、20或15个中的任一者)氨基酸。在一些实施方案中,第一抗原结合部分包含fc区,例如igg1fc。
融合多肽
mabp的第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此直接或间接地融合(即共价连接)。因此,本申请的mabp包含一种或多种融合多肽。各融合多肽可包含第二抗原结合部分和/或第三抗原结合部分和来自第一抗原结合部分的多肽。
各个抗原结合部分可通过单一化学键(例如肽键)或经由肽接头化学融合。第二抗原结合部分与第三抗原结合部分可各自在第一抗原结合部分的任一个(包括每个)多肽的n末端或c末端处融合。第二抗原结合部分与第三抗原结合部分还可彼此直接融合,并且经融合的sdab可在第一抗原结合部分的任一个(包括每个)多肽的n末端或c末端处融合。融合多肽可以重组或化学方式获得。
因此,在一些实施方案中,提供一种mabp(例如tabp),其包含:(a)由两条重链和两条轻链组成的全长抗体,其中全长抗体特异性地识别第一表位;(b)特异性地识别第二表位的第一sdab;和(c)特异性地识别第三表位的第二sdab,其中全长抗体、第一sdab和第二sdab彼此融合。在一些实施方案中,全长抗体是由两条相同重链和两条相同轻链组成的全长单克隆抗体。在一些实施方案中,第一sdab和/或第二sdab是vhh。在一些实施方案中,抗原结合部分经由肽接头融合在一起。在一些实施方案中,肽接头长度不超过约30个(例如不超过约25、20或15个中的任一者)氨基酸。在一些实施方案中,第一抗原结合部分包含fc区,例如igg4fc或igg1fc。
在一些实施方案中,mabp(例如tabp)包含:(1)第一多肽,其从n末端至c末端包含:第一sdab、任选的肽接头和第一抗原结合部分的重链;和(2)第二多肽,其从n末端至c末端包含:第二sdab、任选的肽接头和第一抗原结合部分的轻链。参见例如图1。
在一些实施方案中,mabp(例如tabp)包含:(1)第一多肽,其从n末端至c末端包含:第一sdab、任选的肽接头、第二sdab、任选的肽接头和第一抗原结合部分的重链,和(2)第二多肽,其从n末端至c末端包含:第一抗原结合部分的轻链。参见例如图2。
在一些实施方案中,mabp(例如tabp)包含:(1)第一多肽,其从n末端至c末端包含:第一抗原结合部分的重链;和(2)第二多肽,其从n末端至c末端包含:第一sdab、任选的肽接头、第二sdab、任选的肽接头和第一抗原结合部分的轻链。参见例如图3。
在一些实施方案中,mabp(例如tabp)包含:(1)第一多肽,其从n末端至c末端包含:第一抗原结合部分的重链、任选的肽接头和第一sdab;和(2)第二多肽,其从n末端至c末端包含:第一抗原结合部分的轻链、任选的肽接头和第二sdab。参见例如图4。
在一些实施方案中,mabp(例如tabp)包含:(1)第一多肽,其从n末端至c末端包含:第一sdab、任选的肽接头和第一抗原结合部分的重链;和(2)第二多肽,其从n末端至c末端包含:第一抗原结合部分的轻链、任选的肽接头和第二sdab。参见例如图5。
在一些实施方案中,mabp(例如tabp)包含:(1)第一多肽,其从n末端至c末端包含:第一sdab、任选的肽接头、第一抗原结合部分的重链、任选的肽接头、第二sdab;和(2)第二多肽,其从n末端至c末端包含:第一抗原结合部分的轻链。参见例如图6。
在一些实施方案中,mabp(例如tabp)包含:(1)第一多肽,其从n末端至c末端包含:第一抗原结合部分的重链、任选的肽接头、第一sdab;和(2)第二多肽,其从n末端至c末端包含:第二sdab、任选的肽接头、第一抗原结合部分的轻链。参见例如图7。
在一些实施方案中,mabp(例如tabp)包含:(1)第一多肽,其从n末端至c末端包含:第一抗原结合部分的重链、任选的肽接头、第一sdab,和(2)第二多肽,其从n末端至c末端包含:第一抗原结合部分的轻链、任选的肽接头和第二sdab。参见例如图8。
在一些实施方案中,mabp(例如tabp)包含:(1)第一多肽,其从n末端至c末端包含:第一抗原结合部分的重链;和(2)第二多肽,其从n末端至c末端包含:第一抗原结合部分的轻链、任选的肽接头、第二sdab、任选的肽接头和第一sdab。参见例如图9。
在一些实施方案中,mabp(例如tabp)包含:(1)第一多肽,其从n末端至c末端包含:第一抗原结合部分的重链、任选的肽接头、第二sdab、任选的肽接头和第一sdab;和(2)第二多肽,其从n末端至c末端包含:第一抗原结合部分的轻链。参见例如图10。
在一些实施方案中,第一抗原结合部分是由两条重链和两条轻链组成的全长抗体。在一些实施方案中,mabp包含第一多肽的两条链和第二多肽的两条链。
本文所述的mabp可包含位于各个抗原结合部分之间的一个或多个肽接头。在一些实施方案中,各个抗原结合部分在无肽接头安置于其间的情况下彼此直接融合。
连接不同抗原结合部分的肽接头可以是相同或不同的。每个肽接头可被单独优化。肽接头可具有任何合适的长度。在一些实施方案中,肽接头的长度为至少约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、50个或更多个氨基酸中的任一者。在一些实施方案中,肽接头的长度不超过约50、40、35、30、25、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5或更少个氨基酸中的任一者。在一些实施方案中,肽接头的长度为以下任一者:约1个氨基酸至约10个氨基酸、约1个氨基酸至约20个氨基酸、约1个氨基酸至约30个氨基酸、约5个氨基酸至约15个氨基酸、约10个氨基酸至约25个氨基酸、约5个氨基酸至约30个氨基酸、约10个氨基酸至约30个氨基酸、约30个氨基酸至约50个氨基酸、或约1个氨基酸至约50个氨基酸。
肽接头可具有天然存在的序列或非天然存在的序列。例如,来源于仅重链抗体的铰链区的序列可用作接头。参见例如wo1996/34103。在一些实施方案中,肽接头是柔性接头。示例性柔性接头包括甘氨酸聚合物(g)n、甘氨酸-丝氨酸聚合物(包括例如(gs)n(seqidno:4)、(gsggs)n(seqidno:5)和(gggs)n(seqidno:6),其中n是至少一的整数)、甘氨酸-丙氨酸聚合物、丙氨酸-丝氨酸聚合物和本领域中已知的其它柔性接头。在一些实施方案中,肽接头包含氨基酸序列ggggsgggs(seqidno:1)。在一些实施方案中,肽接头包含氨基酸序列ggggsggggsggggs(seqidno:2)。在一些实施方案中,肽接头包含igg的铰链区,例如人类igg1的铰链区。在一些实施方案中,肽接头包含氨基酸序列epkscdkthtcppcp(seqidno:7)。在一些实施方案中,肽接头包含经修饰的序列,其来源于igg的铰链区,例如人类igg1的铰链区。例如,igg的铰链区中的一个或多个半胱氨酸可被丝氨酸代替。在一些实施方案中,肽接头包含氨基酸序列epkssdkthtsppsp(seqidno:3)。
在一些实施方案中,各个抗原结合部分在化学上彼此融合。例如,抗原结合部分可使用一个或多个反应性位点经由连接基团而结合。适用于化学结合的多肽中的反应性位点是本领域中熟知的,包括但不限于在氨基酸残基上存在的伯氨基,例如赖氨酸的ε氨基和n末端氨基酸的α氨基、半胱氨酸残基中的硫醇基、c末端氨基酸的羧基、以及糖基化抗体中的碳水化合物基团。在一些实施方案中,反应性位点是通过定点诱变、硒代半胱氨酸或非天然氨基酸的并入、双官能接头(例如双烷基化试剂)的并入和/或糖工程化而引入第二抗原结合部分或第一抗原结合部分中。在一些实施方案中,多肽的一个或多个伯氨基可转化成含硫醇的基团(例如,来自半胱氨酸或高半胱氨酸残基)、亲电子不饱和基团例如顺丁烯二酰亚胺基团或卤化基团例如溴乙酰基,以便于结合至硫醇反应性多肽。本领域中已知的任何连接基团和结合方法可用于将第二抗原结合部分化学融合至第一抗原结合部分。在一些实施方案中,可例如通过使用下列各物实现结合:琥珀酰亚胺酯(例如琥珀酰亚胺基4-[n-马来酰亚胺基甲基]环己烷-1-甲酸酯(smcc)或n-马来酰亚胺基苯甲酰基-n-羟基琥珀酰亚胺酯(mbs))、戊二醛、碳化二亚胺(例如1-乙基-3-(3-二甲氨基丙基)碳化二亚胺(edci))、联苯胺(bdb)、过碘酸或异硫氰酸酯(例如n-乙酰基高半胱氨酸硫内酯(naht))。
示例性三特异性抗原结合蛋白(tabp)
在一些实施方案中,提供一种三特异性抗原结合蛋白(tabp),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合pd-1的抗原结合位点,(b)含有特异性地结合tigit的第一sdab的第二抗原结合部分,和(c)含有特异性地结合lag-3的第二sdab的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。在一些实施方案中,第一抗原结合部分包含含有seqidno:10的氨基酸序列的vh域和含有seqidno:11的氨基酸序列的vl域。在一些实施方案中,第一抗原结合部分包含含有seqidno:8的氨基酸序列的重链。在一些实施方案中,第一抗原结合部分包含含有seqidno:9的氨基酸序列的轻链。在一些实施方案中,第一sdab包含vhh,其含有seqidno:31的氨基酸序列的cdr1、cdr2和cdr3,或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体。在一些实施方案中,第二sdab包含vhh,其含有seqidno:32的氨基酸序列的cdr1、cdr2和cdr3,或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体。在一些实施方案中,第一sdab包含具有seqidno:31的氨基酸序列的vhh,或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体。在一些实施方案中,第二sdab包含具有seqidno:32的氨基酸序列的vhh,或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体。在一些实施方案中,第一sdab包含具有seqidno:31的氨基酸序列的vhh。在一些实施方案中,第二sdab包含具有seqidno:32的氨基酸序列的vhh。
在一些实施方案中,提供一种三特异性抗原结合蛋白(tabp),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合pd-1的抗原结合位点,(b)含有特异性地结合tigit的第一sdab的第二抗原结合部分,和(c)含有特异性地结合lag-3的第二sdab的第三抗原结合部分,其中第一抗原结合部分包含含有seqidno:10的氨基酸序列的vh域和含有seqidno:11的氨基酸序列的vl域,第一sdab包含具有seqidno:31的氨基酸序列的vhh,或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体,第二sdab包含具有seqidno:32的氨基酸序列的vhh,或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体;其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。
在一些实施方案中,提供一种三特异性抗原结合蛋白(tabp),其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合pd-1的抗原结合位点,(b)含有特异性地结合tigit的第一sdab的第二抗原结合部分,和(c)含有特异性地结合lag-3的第二sdab的第三抗原结合部分,其中第一抗原结合部分包含含有seqidno:10的氨基酸序列的vh域和含有seqidno:11的氨基酸序列的vl域,第一sdab包含具有seqidno:31的氨基酸序列的vhh,第二sdab包含具有seqidno:32的氨基酸序列的vhh;其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。
在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其包含seqidno:16、18、20、23、25、26、28中任一者的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体;和(2)第二多肽,其包含seqidno:15、17、19、21、22、24、27中任一者的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其包含seqidno:16、18、20、23、25、26或28中任一者的氨基酸序列;和(2)第二多肽,其包含seqidno:15、17、19、21、22、24或27中任一者的氨基酸序列。
在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:包含seqidno:31的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体的抗tigitvhh、包含seqidno:1-7中任一者的氨基酸序列的肽接头和包含seqidno:8的氨基酸序列的抗pd-1抗体的重链;和(2)第二多肽,其从n末端至c末端包含:包含seqidno:32的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体的抗lag-3vhh、包含seqidno:1-7中任一者的氨基酸序列的肽接头和包含seqidno:9的氨基酸序列的抗pd-1抗体的轻链。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:包含seqidno:31的氨基酸序列的抗tigitvhh、包含seqidno:1-3或7中任一者的氨基酸序列的肽接头和包含seqidno:8的氨基酸序列的抗pd-1抗体的重链;和(2)第二多肽,其从n末端至c末端包含:包含seqidno:32的氨基酸序列的抗lag-3vhh、包含seqidno:1-3或7中任一者的氨基酸序列的肽接头和包含seqidno:9的氨基酸序列的抗pd-1抗体的轻链。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:抗tigitvhh、肽接头和抗pd-1抗体的重链,以及包含seqidno:16的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体的第一多肽;(2)第二多肽,其从n末端至c末端包含:抗lag-3vhh、肽接头和抗pd-1抗体的轻链,以及包含seqidno:15的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体的第二多肽。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:抗tigitvhh、肽接头和抗pd-1抗体的重链,以及包含seqidno:16的氨基酸序列的第一多肽;(2)第二多肽,其从n末端至c末端包含:抗lag-3vhh、肽接头和抗pd-1抗体的轻链,以及包含seqidno:15的氨基酸序列的第二多肽(在下文中表示为“tptl-11”)。
在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:包含seqidno:31的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体的抗tigitvhh,包含seqidno:1-7中任一者的氨基酸序列的肽接头,包含seqidno:32的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体的抗lag-3vhh,包含seqidno:1-7中任一者的氨基酸序列的肽接头和包含seqidno:8的氨基酸序列的抗pd-1抗体的重链;和(2)第二多肽,其从n末端至c末端包含:包含seqidno:9的氨基酸序列的抗pd-1抗体的轻链。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:包含seqidno:31的氨基酸序列的抗tigitvhh、包含seqidno:1-3或7中任一者的氨基酸序列的肽接头、包含seqidno:32的氨基酸序列的抗lag-3vhh、包含seqidno:1-3或7中任一者的氨基酸序列的肽接头和包含seqidno:8的氨基酸序列的抗pd-1抗体的重链;和(2)第二多肽,其从n末端至c末端包含:包含seqidno:9的氨基酸序列的抗pd-1抗体的轻链。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:抗tigitvhh、肽接头、抗lag-3vhh、肽接头和抗pd-1抗体的重链,以及包含seqidno:18的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体的第一多肽;(2)第二多肽,其从n末端至c末端包含:抗pd-1抗体的轻链和包含seqidno:17的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体的第二多肽。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:抗tigitvhh、肽接头、抗lag-3vhh、肽接头和抗pd-1抗体的重链,以及包含seqidno:18的氨基酸序列的第一多肽;(2)第二多肽,其从n末端至c末端包含:抗pd-1抗体的轻链和包含seqidno:17的氨基酸序列的第二多肽(在下文中表示为“tptl-12”)。
在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:包含seqidno:8的氨基酸序列的抗pd-1抗体的重链;和(2)第二多肽,其从n末端至c末端包含:包含seqidno:31的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体的抗tigitvhh、包含seqidno:1-7中任一者的氨基酸序列的肽接头、包含seqidno:32的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体的抗lag-3vhh、包含seqidno:1-7中任一者的氨基酸序列的肽接头和包含seqidno:9的氨基酸序列的抗pd-1抗体的轻链。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:包含seqidno:8的氨基酸序列的抗pd-1抗体的重链;和(2)第二多肽,其从n末端至c末端包含:包含seqidno:31的氨基酸序列的抗tigitvhh、包含seqidno:1-3或7中任一者的氨基酸序列的肽接头、包含seqidno:32的氨基酸序列的抗lag-3vhh、包含seqidno:1-3或7中任一者的氨基酸序列的肽接头和包含seqidno:9的氨基酸序列的抗pd-1抗体的轻链。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:抗pd-1抗体的重链,以及包含seqidno:20的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体的第一多肽;(2)第二多肽,其从n末端至c末端包含:抗tigitvhh、肽接头、抗lag-3vhh、肽接头和抗pd-1抗体的轻链,以及包含seqidno:19的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体的第二多肽。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:抗pd-1抗体的重链和包含seqidno:20的氨基酸序列的第一多肽;(2)第二多肽,其从n末端至c末端包含:抗tigitvhh、肽接头、抗lag-3vhh、肽接头和抗pd-1抗体的轻链,以及包含seqidno:19的氨基酸序列的第二多肽(在下文中表示为“tptl-13”)。
在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:包含seqidno:8的氨基酸序列的抗pd-1抗体的重链;和(2)第二多肽,其从n末端至c末端包含:包含seqidno:31的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体的抗tigitvhh、包含seqidno:1-7中任一者的氨基酸序列的肽接头、包含seqidno:9的氨基酸序列的抗pd-1抗体的轻链、包含seqidno:1-7中任一者的氨基酸序列的肽接头和包含seqidno:32的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体的抗lag-3vhh。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:包含seqidno:8的氨基酸序列的抗pd-1抗体的重链;和(2)第二多肽,其从n末端至c末端包含:包含seqidno:31的氨基酸序列的抗tigitvhh、包含seqidno:1-3或7中任一者的氨基酸序列的肽接头、包含seqidno:9的氨基酸序列的抗pd-1抗体的轻链、包含seqidno:1-3或7中任一者的氨基酸序列的肽接头和包含seqidno:32的氨基酸序列的抗lag-3vhh。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:抗pd-1抗体的重链,和包含seqidno:20的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体的第一多肽;(2)第二多肽,其从n末端至c末端包含:抗tigitvhh、肽接头、抗pd-1抗体的轻链、肽接头和抗lag-3vhh,以及包含seqidno:21的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体的第二多肽。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:抗pd-1抗体的重链和包含seqidno:20的氨基酸序列的第一多肽;(2)第二多肽,其从n末端至c末端包含:抗tigitvhh、肽接头、抗pd-1抗体的轻链、肽接头和抗lag-3vhh,以及包含seqidno:21的氨基酸序列的第二多肽(在下文中表示为“tptl-14”)。
在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:包含seqidno:31的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体的抗tigitvhh、包含seqidno:1-7中任一者的氨基酸序列的肽接头和包含seqidno:8的氨基酸序列的抗pd-1抗体的重链;和(2)第二多肽,其从n末端至c末端包含:包含seqidno:9的氨基酸序列的抗pd-1抗体的轻链、包含seqidno:1-7中任一者的氨基酸序列的肽接头和包含seqidno:32的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体的抗lag-3vhh。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:包含seqidno:31的氨基酸序列的抗tigitvhh、包含seqidno:1-3或7中任一者的氨基酸序列的肽接头和包含seqidno:8的氨基酸序列的抗pd-1抗体的重链;和(2)第二多肽,其从n末端至c末端包含:包含seqidno:9的氨基酸序列的抗pd-1抗体的轻链、包含seqidno:1-3或7中任一者的氨基酸序列的肽接头和包含seqidno:32的氨基酸序列的抗lag-3vhh。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:抗tigitvhh、肽接头和抗pd-1抗体的重链,和包含seqidno:16的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体的第一多肽;(2)第二多肽,其从n末端至c末端包含:抗pd-1抗体的轻链、肽接头和抗lag-3vhh,以及包含seqidno:22的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体的第二多肽。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:抗tigitvhh、肽接头和抗pd-1抗体的重链,和包含seqidno:16的氨基酸序列的第一多肽;(2)第二多肽,其从n末端至c末端包含:抗pd-1抗体的轻链、肽接头和抗lag-3vhh,以及包含seqidno:22的氨基酸序列的第二多肽(在下文中表示为“tptl-15”)。
在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:包含seqidno:31的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体的抗tigitvhh、包含seqidno:1-7中任一者的氨基酸序列的肽接头、包含seqidno:8的氨基酸序列的抗pd-1抗体的重链、包含seqidno:1-7中任一者的氨基酸序列的肽接头、包含seqidno:32的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体的抗lag-3vhh;和(2)第二多肽,其从n末端至c末端包含:包含seqidno:9的氨基酸序列的抗pd-1抗体的轻链。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:包含seqidno:31的氨基酸序列的抗tigitvhh、包含seqidno:1-3或7中任一者的氨基酸序列的肽接头、包含seqidno:8的氨基酸序列的抗pd-1抗体的重链、包含seqidno:1-3或7中任一者的氨基酸序列的肽接头、包含seqidno:32的氨基酸序列的抗lag-3vhh;和(2)第二多肽,其从n末端至c末端包含:包含seqidno:9的氨基酸序列的抗pd-1抗体的轻链。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:抗tigitvhh、肽接头、抗pd-1抗体的重链、肽接头和抗lag-3vhh,以及包含seqidno:23的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体的第一多肽;(2)第二多肽,其从n末端至c末端包含:抗pd-1抗体的轻链和包含seqidno:17的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体的第二多肽。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:抗tigitvhh、肽接头、抗pd-1抗体的重链、肽接头和抗lag-3vhh,以及包含seqidno:23的氨基酸序列的第一多肽;(2)第二多肽,其从n末端至c末端包含:抗pd-1抗体的轻链和包含seqidno:17的氨基酸序列的第二多肽(在下文中表示为“tptl-16”)。
在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:包含seqidno:8的氨基酸序列的抗pd-1抗体的重链、包含seqidno:1-7中任一者的氨基酸序列的肽接头和包含seqidno:32的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体的抗lag-3vhh;和(2)第二多肽,其从n末端至c末端包含:包含seqidno:31的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体的抗tigitvhh、包含seqidno:1-7中任一者的氨基酸序列的肽接头和包含seqidno:9的氨基酸序列的抗pd-1抗体的轻链。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:包含seqidno:8的氨基酸序列的抗pd-1抗体的重链、包含seqidno:1-3或7中任一者的氨基酸序列的肽接头和包含seqidno:32的氨基酸序列的抗lag-3vhh;和(2)第二多肽,其从n末端至c末端包含:包含seqidno:31的氨基酸序列的抗tigitvhh、包含seqidno:1-3或7中任一者的氨基酸序列的肽接头和包含seqidno:9的氨基酸序列的抗pd-1抗体的轻链。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:抗pd-1抗体的重链、肽接头和抗lag-3vhh,以及包含seqidno:25的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体的第一多肽;(2)第二多肽,其从n末端至c末端包含:抗tigitvhh、肽接头和抗pd-1抗体的轻链,以及包含seqidno:24的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体的第二多肽。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:抗pd-1抗体的重链、肽接头和抗lag-3vhh,以及包含seqidno:25的氨基酸序列的第一多肽;(2)第二多肽,其从n末端至c末端包含:抗tigitvhh、肽接头和抗pd-1抗体的轻链,以及包含seqidno:24的氨基酸序列的第二多肽(在下文中表示为“tptl-17”)。
在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:包含seqidno:8的氨基酸序列的抗pd-1抗体的重链、包含seqidno:1-7中任一者的氨基酸序列的肽接头和包含seqidno:31的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体的抗tigitvhh;和(2)第二多肽,其从n末端至c末端包含:包含seqidno:9的氨基酸序列的抗pd-1抗体的轻链、包含seqidno:1-7中任一者的氨基酸序列的肽接头和包含seqidno:32的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体的抗lag-3vhh。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:包含seqidno:8的氨基酸序列的抗pd-1抗体的重链、包含seqidno:1-3或7中任一者的氨基酸序列的肽接头和包含seqidno:31的氨基酸序列的抗tigitvhh;和(2)第二多肽,其从n末端至c末端包含:包含seqidno:9的氨基酸序列的抗pd-1抗体的轻链、包含seqidno:1-3或7中任一者的氨基酸序列的肽接头和包含seqidno:32的氨基酸序列的抗lag-3vhh。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:抗pd-1抗体的重链、肽接头和抗tigitvhh,以及包含seqidno:26的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体的第一多肽;(2)第二多肽,其从n末端至c末端包含:抗pd-1抗体的轻链、肽接头和抗lag-3vhh,以及包含seqidno:22的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体的第二多肽。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:抗pd-1抗体的重链、肽接头和抗tigitvhh,以及包含seqidno:26的氨基酸序列的第一多肽;(2)第二多肽,其从n末端至c末端包含:抗pd-1抗体的轻链、肽接头和抗lag-3vhh,以及包含seqidno:22的氨基酸序列的第二多肽(在下文中表示为“tptl-18”)。
在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:包含seqidno:8的氨基酸序列的抗pd-1抗体的重链;和(2)第二多肽,其从n末端至c末端包含:包含seqidno:9的氨基酸序列的抗pd-1抗体的轻链、包含seqidno:1-7中任一者的氨基酸序列的肽接头、包含seqidno:32的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体的抗lag-3vhh、包含seqidno:1-7中任一者的氨基酸序列的肽接头和包含seqidno:31的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体的抗tigitvhh。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:包含seqidno:8的氨基酸序列的抗pd-1抗体的重链;和(2)第二多肽,其从n末端至c末端包含:包含seqidno:9的氨基酸序列的抗pd-1抗体的轻链、包含seqidno:1-3或7中任一者的氨基酸序列的肽接头、包含seqidno:32的氨基酸序列的抗lag-3vhh、包含seqidno:1-3或7中任一者的氨基酸序列的肽接头和包含seqidno:31的氨基酸序列的抗tigitvhh。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:抗pd-1抗体的重链和包含seqidno:20的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体的第一多肽;(2)第二多肽,其从n末端至c末端包含:抗pd-1抗体的轻链、肽接头、抗lag-3vhh、肽接头和抗tigitvhh,以及包含seqidno:27的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体的第二多肽。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:抗pd-1抗体的重链和包含seqidno:20的氨基酸序列的第一多肽;(2)第二多肽,其从n末端至c末端包含:抗pd-1抗体的轻链、肽接头、抗lag-3vhh、肽接头和抗tigitvhh,以及包含seqidno:27的氨基酸序列的第二多肽(在下文中表示为“tptl-19”)。
在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:包含seqidno:8的氨基酸序列的抗pd-1抗体的重链、包含seqidno:1-7中任一者的氨基酸序列的肽接头、包含seqidno:32的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体的抗lag-3vhh、包含seqidno:1-7中任一者的氨基酸序列的肽接头和包含seqidno:31的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体的抗tigitvhh;和(2)第二多肽,其从n末端至c末端包含:包含seqidno:9的氨基酸序列的抗pd-1抗体的轻链。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:包含seqidno:8的氨基酸序列的抗pd-1抗体的重链、包含seqidno:1-3或7中任一者的氨基酸序列的肽接头、包含seqidno:32的氨基酸序列的抗lag-3vhh、包含seqidno:1-3或7中任一者的氨基酸序列的肽接头和包含seqidno:31的氨基酸序列的抗tigitvhh;和(2)第二多肽,其从n末端至c末端包含:包含seqidno:9的氨基酸序列的抗pd-1抗体的轻链。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:抗pd-1抗体的重链、肽接头、抗lag-3vhh、肽接头和抗tigitvhh,以及包含seqidno:28的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体的第一多肽;(2)第二多肽,其从n末端至c末端包含:抗pd-1抗体的轻链和包含seqidno:17的氨基酸序列或其包含至多约5个(例如约1个、2个、3个、4个或5个中的任一者)氨基酸取代的变体的第二多肽。在一些实施方案中,三特异性抗原结合蛋白(tabp)包含:(1)第一多肽,其从n末端至c末端包含:抗pd-1抗体的重链、肽接头、抗lag-3vhh、肽接头和抗tigitvhh,以及包含seqidno:28的氨基酸序列的第一多肽;(2)第二多肽,其从n末端至c末端包含:抗pd-1抗体的轻链和包含seqidno:17的氨基酸序列的第二多肽(在下文中表示为“tptl-20”)。
包含单域抗体的抗原结合部分
本申请的mabp包含至少两个抗原结合部分,其各自包含sdab。示例性sdab包括但不限于来自仅重链的抗体的重链可变域(例如vhh或vnar)、天然地不含轻链的结合分子、来源于常规4链抗体的单域(例如vh或vl)、人源化的仅重链抗体、由表达人类重链区段的转基因小鼠或大鼠产生的人类sdab,以及工程化结构域和除那些来源于抗体以外的单域支架。本领域中已知或由本发明者开发的任何sdab可用于构建本申请的mabp。sdab可来源于任何物种,包括但不限于小鼠、大鼠、人类、骆驼、美洲驼、七鳃鳗、鱼、鲨鱼、山羊、兔和牛。本文所涵盖的单域抗体还包括来自除骆驼科和鲨鱼以外的物种的天然存在的sdab分子。
在一些实施方案中,第一sdab和/或第二sdab来源于天然存在的单域抗原结合分子,称为不含轻链的重链抗体(在本文中也称为“仅重链抗体”)。这类单域分子公开于例如wo94/04678和hamers-casterman,c.等,(1993)nature363:446-448中。为清楚起见,来源于天然地不含轻链的重链分子的可变域在本文中被称为vhh以便将其与四链免疫球蛋白的常规vh区分。这类vhh分子可来源于在骆驼科物种例如骆驼、美洲驼、小羊驼、单峰驼、羊驼和原驼中生成的抗体。除骆驼科之外的其它物种可产生天然地不含轻链的重链分子,并且这类vhh在本申请的范围内。
来自骆驼科的vhh分子比igg分子小约10倍。它们是单一多肽并且可以非常稳定,抗极端ph与温度条件。此外,它们可对蛋白酶的作用有抗性,而常规抗体则不能。此外,vhh的体外表达产生高产量、适当折叠的功能性vhh。另外,在骆驼科中生成的抗体可识别与由通过使用抗体文库体外产生或经由除骆驼科以外的哺乳动物的免疫作用而产生的抗体所识别的那些表位不同的表位(参见例如wo9749805)。因而,包含vhh域的mabp可比常规抗体与靶标更有效地相互作用。由于已知vhh结合至‘不寻常的’表位例如空腔或凹槽中,因此包含这类vhh的mabp的亲和力可比常规多特异性多肽更适用于治疗性治疗。
在一些实施方案中,提供一种三特异性抗原结合蛋白,其包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,(b)含有特异性地结合第二表位的第一vhh域的第二抗原结合部分,和(c)含有特异性地结合第三表位的第二vhh域的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。在一些实施方案中,第一抗原结合部分包含含有vh的重链和含有vl的轻链。在一些实施方案中,第一抗原结合区是由两条重链和两条轻链组成的全长抗体。在一些实施方案中,抗原结合部分经由肽接头融合在一起。在一些实施方案中,肽接头长度不超过约30个(例如不超过约25、20或15个中的任一者)氨基酸。在一些实施方案中,第一抗原结合部分包含fc区,例如igg1fc或igg4fc。
在一些实施方案中,第一sdab和/或第二sdab来源于软骨鱼中所见的免疫球蛋白的可变区。例如,sdab可来源于鲨鱼血清中所见的称为新颖抗原受体(nar)的免疫球蛋白同型。产生来源于nar的可变区的单域分子(“ignar”)的方法描述于wo03/014161和streltsov(2005)proteinsci.14:2901-2909中。
在一些实施方案中,第一sdab和/或第二sdab是重组的、cdr移植的、人源化的、骆驼源化的、去免疫化的和/或体外生成的(例如,通过噬菌体展示所选择)。在一些实施方案中,第一sdab和/或第二sdab是由表达人类重链区段的转基因小鼠或大鼠产生的人类sdab。参见例如us20090307787a1、美国专利第8,754,287号、us20150289489a1、us20100122358a1和wo2004049794。在一些实施方案中,第一sdab和/或第二sdab是亲和力成熟的。
包含vhh域的sdab可被人源化以具有人类样序列。在一些实施方案中,本文所用的vhh域的fr区包含与人类vh框架区具有至少约50%、60%、70%、80%、90%、95%或更大的氨基酸序列同源性中的任一者。人源化vhh域的一个示例性类别的特征在于:vhh带有来自由下列各物组成的组的氨基酸:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、酪氨酸、色氨酸、甲硫氨酸、丝氨酸、苏氨酸、天冬酰胺或谷胺酰胺,根据kabat编号在位置45处,例如l45和在位置103处的色氨酸。因而,属于这类的多肽示出与人类vh框架区的高氨基酸序列同源性并且所述多肽可直接向人类施用,而不希望由此产生不希望的免疫反应并且无进一步人源化的负担。
人源化骆驼科sdab的另一示例性类别已描述于wo03/035694中并且含有通常见于人类来源或来自其它物种的常规抗体中的疏水性fr2残基,但由在位置103处的带电精氨酸残基弥补在亲水性上的损失,所述带电精氨酸残基取代存在于来自双链抗体的vh中的保守色氨酸残基。因而,属于这两种类别的肽示出与人类vh框架区的高氨基酸序列同源性并且所述肽可直接向人类施用,而不希望由此产生不希望的免疫反应并且无进一步人源化的负担。
在一些实施方案中,mabp包含天然产生的sdab或其衍生物,例如骆驼科sdab或来源于骆驼科sdab的人源化sdab。在一些实施方案中,第一sdab和/或第二sdab获自美洲驼。在一些实施方案中,第一sdab和/或第二sdab进一步被工程化以移除通常未见于人类抗体中的序列(例如cdr区或cdr-fr接合点)。
mabp的第一sdab和第二sdab对其表位具有合适的亲和力。例如,各sdab的亲和力可影响mabp对靶细胞或组织的总亲和力和亲合力,这可进一步影响mabp的功效。在一些实施方案中,第一sdab和/或第二sdab以高亲和力结合其表位。高亲和力sdab以在低纳摩尔(10-9m)范围内的解离常数(kd)结合其表位,例如不超过以下中的任一者:约5nm、4nm、3nm、2nm、1nm、0.5nm、0.2nm、0.1nm、0.05nm、0.02nm、0.01nm、5pm、2pm、1pm或更小。在一些实施方案中,第一sdab和/或第二sdab以低亲和力结合其表位。低亲和力sdab以在低微摩尔(10-6m)范围内或更高的kd结合其表位,例如大于以下中的任一者:约1μm、2μm、3μm、4μm、5μm、6μm、7μm、8μm、9μm、10μm或更高。在一些实施方案中,第一sdab和/或第二sdab以中等亲和力结合其表位。中等亲和力sdab以比低亲和力sdab低但比高亲和力sdab高的kd结合其表位。在一些实施方案中,中等亲和力sdab以如下任一者的kd结合其表位:约1nm至约10nm、约10nm至约100nm、约100nm至约500nm、约500nm至约1μm、约1nm至约100nm、约10nm至约500nm、或约1nm至约1μm。
在一些实施方案中,第一sdab和/或第二sdab对其表位具有比包含vh和vl的抗原结合部分更强的亲和力。在一些实施方案中,第一sdab和/或第二sdab对其表位具有比包含vh和vl的抗原结合部分较弱的亲和力。在一些实施方案中,第一sdab和/或第二sdab对其表位的亲和力与包含vh和vl的抗原结合部分对其表位的亲和力之间的差异是以下中的至少一者:约2x、5x、10x、100x、1000x或更大。在一些实施方案中,第一sdab和/或第二sdab对其表位的亲和力可与包含vh和vl的抗原结合部分对其表位的亲和力相当。
在一些实施方案中,第一sdab和/或第二sdab特异性地结合免疫检查点分子。在一些实施方案中,第一sdab和/或第二sdab特异性地结合刺激性免疫检查点分子。在一些实施方案中,第一sdab和/或第二sdab特异性地结合抑制性免疫检查点分子。在一些实施方案中,第一sdab和/或第二sdab特异性地结合选自由下列各物组成的组的免疫检查点分子:pd-1、pd-l1、pd-l2、ctla-4、b7-h3、tim-3、lag-3、tigit、vista、icos、4-1bb、ox40、gitr和cd40。在一些实施方案中,第一sdab和/或第二sdab是针对免疫检查点分子的激动剂。在一些实施方案中,第一sdab和/或第二sdab是针对免疫检查点分子的拮抗剂。
在一些实施方案中,第一sdab特异性地结合tigit。在一些实施方案中,第一sdab以高亲和力结合tigit。在一些实施方案中,第一sdab以中等亲和力结合tigit。在一些实施方案中,第一sdab以低亲和力结合tigit。在一些实施方案中,第二sdab特异性地结合lag-3。在一些实施方案中,第二sdab以高亲和力结合lag-3。在一些实施方案中,第二sdab以中等亲和力结合lag-3。在一些实施方案中,第二sdab以低亲和力结合lag-3。
在一些实施方案中,第一sdab特异性地结合tigit,所述tigit包含seqidno:31的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体。在一些实施方案中,第一sdab特异性地结合包含seqidno:31的氨基酸序列的tigit。在一些实施方案中,第二sdab特异性地结合lag-3,所述lag-3包含seqidno:32的氨基酸序列或其包含至多约3个(例如约1个、2个或3个中的任一者)氨基酸取代的变体。在一些实施方案中,第二sdab特异性地结合包含seqidno:32的氨基酸序列的lag-3。
在一些实施方案中,第一sdab和/或第二sdab特异性地结合细胞表面抗原。在一些实施方案中,细胞表面抗原是肿瘤抗原。在一些实施方案中,肿瘤抗原选自由下列各物组成的组:her2、braf、egfr、vegfr2、cd20、rankl、cd38和cd52。在一些实施方案中,第一sdab和/或第二sdab特异性地结合免疫效应细胞(例如t细胞或自然杀手细胞)上的细胞表面抗原。
在一些实施方案中,第一sdab特异性地结合cd3。在一些实施方案中,第一sdab以高亲和力结合cd3。在一些实施方案中,第一sdab以中等亲和力结合cd3。在一些实施方案中,第一sdab以低亲和力结合cd3。在一些实施方案中,第二sdab结合egfr。在一些实施方案中,第二sdab以高亲和力结合egfr抗原。在一些实施方案中,第二sdab以中等亲和力结合egfr。在一些实施方案中,第二sdab以低亲和力结合egfr。
在一些实施方案中,第一sdab和/或第二sdab特异性地结合细胞外蛋白,例如分泌型蛋白。在一些实施方案中,第一sdab和/或第二sdab特异性地结合促炎性分子,例如tnf-α、il-17a、il-17f、il-1β、tnf-α、il-5、il-6、il-6r或伊红趋素-1。
在一些实施方案中,第一sdab和/或第二sdab特异性地结合血管生成因子,例如vegf、ang2或dll4。
包含vh和vl的抗原结合部分
本申请的mabp包含至少一个抗原结合部分,所述抗原结合部分含有重链可变域(vh)与轻链可变域(vl)。这类抗原结合部分可以是由两条重链和两条轻链组成的全长常规抗体或来源于此的抗原结合片段。
在一些实施方案中,第一抗原结合部分是抗原结合片段,其包含含有vh域的重链和含有vl域的轻链。本文所涵盖的示例性抗原结合片段包括但不限于fab、fab'、f(ab')2和fv片段;双抗体;线性抗体;单链抗体分子(例如scfv);和由抗体片段形成的多特异性抗体。
在一些实施方案中,第一抗原结合部分包含fc区,例如人类fc区。在一些实施方案中,fc区来源于igg分子,例如igg1、igg2、igg3或igg4子类中的任一者。在一些实施方案中,fc区能够介导抗体效应功能,例如adcc(抗体依赖性细胞介导的细胞毒性)和/或cdc(补体依赖性细胞毒性)。例如,具有野生型fc序列的子类igg1、igg2和igg3抗体通常显示补体激活,包括ciq和c3结合,而igg4不激活补体系统并且不结合ciq和/或c3。在一些实施方案中,fc区包含降低fc区与fc受体的结合亲和力的修饰。在一些实施方案中,fc区是igg1fc。在一些实施方案中,igg1fc包含在位置233-236处的一个或多个突变,例如l234a和/或l235a。在一些实施方案中,fc区是igg4fc。在一些实施方案中,igg4fc包含在位置327、330和/或331处的突变。参见例如armourkl等,eurj.immunol.1999;29:2613;和shieldsrl等,j.biol.chem.2001;276:6591。在一些实施方案中,fc区包含p329g突变。
在一些实施方案中,fc区包含促进两条不同重链的异二聚化的修饰。这类经修饰的fc区可以是本文所述的具有不对称设计的mabp所特别关注的。在一些实施方案中,所述修饰是隆凸入孔洞(knob-into-hole)修饰,包含在一条重链或重链融合多肽中的隆凸修饰和在两条重链或重链融合多肽的另一条中的孔洞修饰。在一个实施方案中,fc区包含在ch3域中介于两条重链之间的界面内的修饰,其中i)在一条重链的ch3域中,氨基酸残基被具有较大侧链体积的氨基酸残基代替,从而在一条重链的ch3域中的界面内产生凸起(“隆凸”),所述凸起(“隆凸”)可定位于另一条重链的ch3域中的界面内的空腔(“孔洞”)中,以及ii)在另一条重链的ch3域中,氨基酸残基被具有较小侧链体积的氨基酸残基代替,由此在第二ch3域中的界面内产生空腔(“孔洞”),第一ch3域中的界面内的凸起(“隆凸”)可定位于所述空腔(“孔洞”)中。隆凸入孔洞修饰的实例已描述于例如us2011/0287009、us2007/0178552、wo96/027011、wo98/050431和zhu等,1997,proteinscience6:781-788中。本文还涵盖促进异二聚化的fc区的其它修饰。例如,静电转向效应可被工程化到fc区中以提供fc-异二聚分子(参见例如us4676980和brennan等,science,229:81(1985))。
在一些实施方案中,fc区包含抑制fab臂交换的修饰。例如,igg4fc中的s228p突变防止fab臂交换。
在一些实施方案中,第一抗原结合部分包含κ轻链恒定区。在一些实施方案中,第一抗原结合部分包含λ轻链恒定区。在一些实施方案中,第一抗原结合部分包含含有seqidno:9的氨基酸序列的轻链恒定区。在一些实施方案中,第一抗原结合部分包含含有seqidno:8的氨基酸序列的重链恒定区。
在一些实施方案中,第一抗原结合部分是由两条重链和两条轻链组成的全长抗体。在一些实施方案中,第一抗原结合部分包含由两条重链和两条轻链组成的单克隆抗体(在本文中也称为“4链抗体”)。在一些实施方案中,第一抗原结合部分包含由两条重链和两条轻链组成的多特异性(例如三特异性)全长抗体。在一些实施方案中,第一抗原结合部分包含人类iggl子类或具有突变l234a和l235a的人类iggl子类的全长抗体。在一些实施方案中,第一抗原结合部分包含人类igg2子类的全长抗体。在一些实施方案中,第一抗原结合部分包含人类igg3子类的全长抗体。在一些实施方案中,第一抗原结合部分包含人类igg4子类或具有额外突变s228p的人类igg4子类的全长抗体。
本领域中已知的任何全长4链抗体或来源于此的抗原结合片段可用作本申请的mabp中的第一抗原结合部分。具有经证实的临床功效、安全性和药代动力学概况的抗体或抗体片段尤其受关注。在一些实施方案中,本领域中已知的抗体或抗体片段进一步被工程化,例如人源化或诱变以选择具有合适的亲和力的变体,之后与第二抗原结合部分融合以提供mabp。在一些实施方案中,第一抗原结合部分包含本领域中已知的单克隆抗体或抗体片段的vh和vl域,以及经修饰的重链恒定区和/或轻链恒定区。在一些实施方案中,第一抗原结合部分包含本领域中已知的单克隆抗体和经修饰的fc区,例如具有s228p突变的igg4fc。在一些实施方案中,第一抗原结合部分包含人类、人源化或嵌合全长抗体或抗体片段。
在一些实施方案中,第一抗原结合部分来源于获批准(例如获fda和/或ema批准)或研究性单克隆抗体或抗体片段(例如fab)。在一些实施方案中,第一抗原结合部分是获批准(例如获fda和/或ema批准)或研究性单克隆抗体或抗体片段(例如fab)。
在一些实施方案中,第一抗原结合部分特异性地结合免疫检查点分子。在一些实施方案中,第一抗原结合部分包含全长抗体(例如拮抗剂抗体)或来源于此的抗原结合片段,其特异性地结合抑制性免疫检查点蛋白。在一些实施方案中,第一抗原结合部分包含全长抗体(例如激动剂抗体)或来源于此的抗原结合片段,其特异性地结合刺激性检查点分子。在一些实施方案中,免疫检查点分子选自由下列各物组成的组:pd-1、pd-l1、pd-l2、ctla-4、b7-h3、tim-3、lag-3、tigit、vista、icos、4-1bb、ox40、gitr和cd40。在一些实施方案中,第一抗原结合部分是抗pd-1抗体或其抗原结合片段。在一些实施方案中,抗pd-1抗体选自由派姆单抗和纳武单抗组成的组。在一些实施方案中,第一抗原结合部分是抗pd-l1抗体或其抗原结合片段。在一些实施方案中,第一抗原结合部分是抗tigit抗体或其抗原结合片段。在一些实施方案中,第一抗原结合部分是抗lag-3抗体或其抗原结合片段。
在一些实施方案中,第一抗原结合部分来源于派姆单抗。在一些实施方案中,第一抗原结合部分包含派姆单抗或其抗原结合片段。在一些实施方案中,第一抗原结合部分包含含有seqidno:10的氨基酸序列的vh域和含有seqidno:11的氨基酸序列的vl域。在一些实施方案中,第一抗原结合部分包含含有seqidno:8的氨基酸序列的重链。在一些实施方案中,第一抗原结合部分包含含有seqidno:9的氨基酸序列的轻链。在一些实施方案中,第一抗原结合部分包含igg4fc。
派姆单抗(例如
在一些实施方案中,第一抗原结合部分特异性地结合肿瘤抗原。在一些实施方案中,肿瘤抗原选自由下列各物组成的组:her2、braf、egfr、vegfr2、cd20、rankl、cd38和cd52。在一些实施方案中,第一抗原结合部分是抗her2抗体或其抗原结合片段。在一些实施方案中,第一抗原结合部分来源于曲妥珠单抗。
曲妥珠单抗
在一些实施方案中,第一抗原结合部分特异性地结合血管生成因子。在一些实施方案中,第一抗原结合部分是抗ang2抗体或其抗原结合片段。在一些实施方案中,第一抗原结合部分来源于lc10。
在一些实施方案中,第一抗原结合部分特异性地结合促炎性分子。在一些实施方案中,促炎性分子选自由下列各物组成的组:vegf、il-1β、tnf-α、il-5、il-6、il-6r和伊红趋素-1。在一些实施方案中,第一抗原结合部分是抗tnf-α抗体或其抗原结合片段。在一些实施方案中,第一抗原结合部分来源于阿达木单抗。
mabp的性质
本文所述的mabp适于制造并开发为生物药物。在一些实施方案中,mabp可在高表达水平下重组产生。在一些实施方案中,mabp可在足以工业生产的水平下重组产生。在一些实施方案中,mabp可在哺乳动物细胞中瞬时表达。在一些实施方案中,通过重组表达产生的mabp可被纯化至同质或基本上同质,通过尺寸排阻色谱法确定。在一些实施方案中,在经纯化的mabp中单分散分子(例如,作为单体mabp分子,例如由4条多肽链组成的二聚体蛋白)的百分比(例如通过色谱法所测定)为至少约以下任一者:90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%或更高。mabp在组合物中的同质可使用本领域中已知的方法来测定,例如通过sds-page分析、动态光散射(dls)或使用hplc或fplc的分析。在一些实施方案中,纯化获得的mabp的产率是至少约以下任一者:50%、60%、70%、80%、90%或更高。在一些实施方案中,纯化获得的mabp的产率为约70%至约95%。
本文所述的mabp进一步具有适用作生物药物的各种生物物理学性质,包括例如高溶解性、高的长期稳定性和热稳定性。mabp的稳定性可使用本领域中已知的方法测定,包括动态光散射(dsl),其概述了基于其粒度可溶的分子的不同群体。在一些实施方案中,在组合物中至少约90%、91%、92%、93%、94%、95%或更高的mabp呈非聚集构象,即作为单一、单体mabp分子,例如由4条多肽链组成的二聚体蛋白。在一些实施方案中,在组合物中聚集(即,多个mabp分子缔合成复合体)的水平不超过约以下任一者:1%、2%、3%、4%、5%、6%、7%、8%、9%、10%或更高。在一些实施方案中,在组合物中形成mabp的至少约5%聚集的时间在约4℃下是至少约以下任一者:1天、3天、7天、2周、3周、4周或更长时间。在一些实施方案中,在组合物中形成mabp的至少约5%聚集的时间在约室温(例如25℃)下是至少约以下任一者:1天、3天、7天、2周、3周、4周或更长时间。在一些实施方案中,在组合物中形成mabp的至少约10%聚集的时间在生理温度(例如约37℃)下是至少约以下任一者:1天、2天、3天、4天、6天、7天、10天、2周或更长时间。
在一些实施方案中,mabp具有与亲本4链抗体或其抗原结合片段相当的热稳定性。在一些实施方案中,mabp具有比亲本4链抗体或其抗原结合片段更高的热稳定性。热稳定性可使用本领域中已知的方法测量,包括毛细管差示扫描量热法(dsc)和dls与逐渐加热相结合。在一些实施方案中,mabp具有至少约55℃的聚集起始温度(t聚集),例如至少约以下任一者:56℃、57℃、58℃、59℃、60℃、61℃、62℃、63℃、64℃、65℃、66℃、67℃、68℃、69℃、70℃或更高。在一些实施方案中,mabp具有至少约55℃至约70℃的聚集起始温度(t聚集)。
在一些实施方案中,mabp具有高的长期稳定性。在一些实施方案中,mabp在约4℃下稳定持续至少约以下任一者:1天、3天、7天、2周、3周、4周或更长时间。在一些实施方案中,mabp在高温下具有高的长期稳定性。在一些实施方案中,mabp在室温(例如约25℃或更高)下稳定持续至少约以下任一者:1天、3天、7天、2周、3周、4周或更长时间。在一些实施方案中,mabp在生理温度(例如约37℃或更高)下稳定持续至少约以下任一者:1天、2天、3天、4天、6天、7天、10天、2周或更长时间。在一些实施方案中,mabp的稳定性是在加速稳定性评估程序中测试,例如在约40℃、50℃、60℃、70℃或更高温度中的任一者下,由此得出mabp在较低温度下的稳定性。在一些实施方案中,mabp在高浓度下具有高的长期稳定性,例如至少约以下任一者:50mg/ml、100mg/ml、150mg/ml、200mg/ml或更高。如本文所用,“稳定的”组合物基本上不含(例如小于约以下任一者:10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更少)沉淀和/或聚集。在一些实施方案中,mabp在约4℃下在人类血清中具有高的长期稳定性,持续至少约以下任一者:1天、3天、7天、2周、3周、4周或更长时间。在一些实施方案中,mabp在生理温度(例如约37℃)下在人类血清中具有高的长期稳定性,持续至少约以下任一者:1天、3天、7天、10天、2周、3周、4周或更长时间。沉淀可通过光谱学来检测。聚集可通过例如dls来检测。
在一些实施方案中,mabp经冻融循环具有高稳定性。在一些实施方案中,包含mabp的组合物可冻融至少约以下中的任一者:3、4、5、6、7、8、9、10次或更多次,而不会丧失mabp的结构完整性(例如形成聚集体)和/或活性。在一些实施方案中,包含mabp的组合物可在高浓度下冻融,例如至少约以下中的任一者:50mg/ml、100mg/ml、150mg/ml、200mg/ml或更高。
iii.药物组合物
本申请还提供了药物组合物,所述药物组合物包含mabp中的任一种和药学上可接受的载体。药物组合物可通过将具有所需纯度的mabp与任选的药学上可接受的载体、赋形剂或稳定剂(remington'spharmaceuticalsciences第16版,osol,a.编(1980))混合以冻干制剂或水溶液形式来制备。
用于体内施用的药物组合物必须是无菌的。所述药物组合物可通过经由无菌过滤膜过滤而变成无菌的。一般将本文的药物组合物置于具有无菌输液港的容器中,例如,具有可由皮下注射针头刺穿的塞子的静脉内溶液袋或小瓶。
施用途径是根据已知和公认的方法,例如通过单次或多次推注,或以合适的方式在长时间内输注,例如,通过皮下、静脉内、腹膜内、肌内、动脉内、病灶内或关节内途径的注射或输注、局部施用、吸入或通过持续释放或延时释放装置。
本文的药物组合物还可含有为所治疗的特定适应症所必需的一种以上活性化合物,优选具有互补活性而不会不利地彼此影响的那些物质。或者或另外,组合物可包含细胞毒性剂、化疗剂、细胞因子、免疫抑制剂或生长抑制剂。这类分子适当地以对预期目标有效的量组合存在。
活性成分还可分别装入例如通过团聚技术或通过界面聚合制备的微胶囊(例如,羟甲基纤维素或明胶微胶囊和聚-(甲基丙烯酸甲酯)微胶囊)中、胶质药物递送系统(例如,脂质体、白蛋白微球体、微乳液、纳米颗粒和纳米胶囊)中或粗滴乳液中。这些技术公开于remington'spharmaceuticalsciences第18版中。
iv.使用方法
本文所述的mabp(例如tabp)及其组合物(例如药物组合物)适用于多种应用,例如在诊断、分子测定和疗法中。
在一些实施方案中,存在一种治疗有需要的个体的疾病或疾患的方法,所述方法包括施用有效量的包含多特异性(例如三特异性)抗原结合蛋白和药学上可接受的载体的药物组合物,其中所述mabp包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,(b)含有特异性地结合第二表位的第一sdab的第二抗原结合部分,和(c)含有特异性地结合第三表位的第二sdab的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。在一些实施方案中,第一表位来自第一免疫检查点分子(例如pd-1,seqidno:12),第二表位来自第二免疫检查点分子(例如tigit,seqidno:13),并且第三表位来自第三免疫检查点分子(例如lag-3,seqidno:14)。在一些实施方案中,第一表位来自第一肿瘤抗原,第二表位来自第二肿瘤抗原,并且第三表位来自第三肿瘤抗原。在一些实施方案中,第一表位来自第一肿瘤抗原(例如her-2),第二表位来自免疫效应细胞上的细胞表面分子(例如cd3),并且第三表位来自第二肿瘤抗原(例如egfr)。在一些实施方案中,第一表位来自第一促炎性分子(例如tnf-α),第二表位来自第二促炎性分子(例如il-17a),并且第三表位来自第三促炎性分子(例如il-17f)。在一些实施方案中,第一表位来自第一血管生成因子(例如ang2),第二表位来自第二血管生成因子(例如vegf),并且第三表位来自第三血管生成因子(例如dll4)。在一些实施方案中,第一sdab和/或第二sdab是vhh。在一些实施方案中,第一抗原结合部分包含含有vh的重链和含有vl的轻链。在一些实施方案中,第一抗原结合区是由两条重链和两条轻链组成的全长抗体。在一些实施方案中,抗原结合部分经由肽接头融合在一起。在一些实施方案中,肽接头长度不超过约30个(例如不超过约25、20或15个中的任一者)氨基酸。在一些实施方案中,第一抗原结合部分包含fc区,例如igg1fc或igg4fc。
治疗癌症的方法
在一些实施方案中,提供一种治疗有需要的个体的癌症的方法,所述方法包括施用有效量的包含多特异性(例如三特异性)抗原结合蛋白和药学上可接受的载体的药物组合物,其中所述mabp包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,(b)含有特异性地结合第二表位的第一sdab的第二抗原结合部分,和(c)含有特异性地结合第三表位的第二sdab的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。在一些实施方案中,癌症选自由下列各病组成的组:乳腺癌、肾癌、黑色素瘤、肺癌、胶质母细胞瘤、头颈癌、前列腺癌、卵巢癌、膀胱癌和淋巴瘤。在一些实施方案中,第一sdab和/或第二sdab是vhh。在一些实施方案中,第一抗原结合部分包含含有vh的重链和含有vl的轻链。在一些实施方案中,第一抗原结合区是由两条重链和两条轻链组成的全长抗体。在一些实施方案中,抗原结合部分经由肽接头融合在一起。在一些实施方案中,肽接头长度不超过约30个(例如不超过约25、20或15个中的任一者)氨基酸。在一些实施方案中,第一抗原结合部分包含fc区,例如igg1fc或igg4fc。
在一些实施方案中,提供一种治疗有需要的个体的癌症的方法,所述方法包括施用有效量的包含多特异性(例如三特异性)抗原结合蛋白和药学上可接受的载体的药物组合物,其中所述mabp包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一免疫检查点分子(例如pd-1)的抗原结合位点,(b)第二抗原结合部分,其含有特异性地结合第二免疫检查点分子(例如tigit)的第一sdab(例如vhh),和(c)第三抗原结合部分,其含有特异性地结合第三免疫检查点抑制剂(例如lag-3)的第二sdab(例如vhh),其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。在一些实施方案中,癌症选自由下列各病组成的组:乳腺癌、肾癌、黑色素瘤、肺癌、胶质母细胞瘤、头颈癌、前列腺癌、卵巢癌、膀胱癌和淋巴瘤。在一些实施方案中,第一sdab和/或第二sdab是vhh。在一些实施方案中,第一抗原结合部分包含含有vh的重链和含有vl的轻链。在一些实施方案中,第一抗原结合区是由两条重链和两条轻链组成的全长抗体。在一些实施方案中,第一抗原结合区来源于派姆单抗。在一些实施方案中,抗原结合部分经由肽接头融合在一起。在一些实施方案中,肽接头长度不超过约30个(例如不超过约25、20或15个中的任一者)氨基酸。在一些实施方案中,第一抗原结合部分包含fc区,例如igg4fc。
在一些实施方案中,提供一种治疗有需要的个体的癌症的方法,所述方法包括施用有效量的包含多特异性(例如三特异性)抗原结合蛋白和药学上可接受的载体的药物组合物,其中所述mabp包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一肿瘤抗原(例如her-2)的抗原结合位点,(b)第二抗原结合部分,其含有特异性地结合免疫效应细胞的细胞表面抗原(例如cd3)的第一sdab(例如vhh),和(c)第三抗原结合部分,其含有特异性地结合第二肿瘤抗原(例如egfr)的第二sdab(例如vhh),其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。在一些实施方案中,癌症选自由下列各病组成的组:乳腺癌、肾癌、黑色素瘤、肺癌、胶质母细胞瘤、头颈癌、前列腺癌、卵巢癌、膀胱癌和淋巴瘤。在一些实施方案中,第一sdab和/或第二sdab是vhh。在一些实施方案中,第一抗原结合部分包含含有vh的重链和含有vl的轻链。在一些实施方案中,第一抗原结合区是由两条重链和两条轻链组成的全长抗体。在一些实施方案中,第一抗原结合区来源于曲妥珠单抗。在一些实施方案中,抗原结合部分经由肽接头融合在一起。在一些实施方案中,肽接头长度不超过约30个(例如不超过约25、20或15个中的任一者)氨基酸。在一些实施方案中,第一抗原结合部分包含fc区,例如igg1fc。
在一些实施方案中,提供一种治疗有需要的个体的癌症的方法,所述方法包括施用有效量的包含多特异性(例如三特异性)抗原结合蛋白和药学上可接受的载体的药物组合物,其中所述mabp包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一血管生成因子(例如ang2)的抗原结合位点,(b)第二抗原结合部分,其含有特异性地结合第二血管生成因子(例如vegf)的第一sdab(例如vhh),和(c)第三抗原结合部分,其含有特异性地结合第三血管生成因子(例如dll4)的第二sdab(例如vhh),其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。在一些实施方案中,癌症选自由下列各病组成的组:乳腺癌、肾癌、黑色素瘤、肺癌、胶质母细胞瘤、头颈癌、前列腺癌、卵巢癌、膀胱癌和淋巴瘤。在一些实施方案中,第一sdab和/或第二sdab是vhh。在一些实施方案中,第一抗原结合部分包含含有vh的重链和含有vl的轻链。在一些实施方案中,第一抗原结合区是由两条重链和两条轻链组成的全长抗体。在一些实施方案中,第一抗原结合区来源于lc10。在一些实施方案中,抗原结合部分经由肽接头融合在一起。在一些实施方案中,肽接头长度不超过约30个(例如不超过约25、20或15个中的任一者)氨基酸。在一些实施方案中,第一抗原结合部分包含fc区,例如igg1fc。
本文所述的方法适用于治疗各种癌症,包括实体癌和液体癌。所述方法适用于所有阶段的癌症,包括早期、晚期和转移性癌症。本文所述的方法可用作第一疗法、第二疗法、第三疗法或与本领域中已知的其它类型的癌症疗法的组合疗法,例如化学疗法、手术、放射线、基因疗法、免疫疗法、骨髓移植、干细胞移植、靶向疗法、冷冻疗法、超声疗法、光动力疗法、射频切除等,在辅助背景或新辅助背景下。
治疗炎症性或自身免疫疾病的方法
在一些实施方案中,提供一种治疗有需要的个体的炎症性或自身免疫疾病的方法,所述方法包括施用有效量的包含多特异性(例如三特异性)抗原结合蛋白和药学上可接受的载体的药物组合物,其中所述mabp包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一表位的抗原结合位点,(b)含有特异性地结合第二表位的第一sdab的第二抗原结合部分,和(c)含有特异性地结合第三表位的第二sdab的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。在一些实施方案中,炎症性或自身免疫疾病选自由下列各病组成的组:关节炎(例如类风湿性关节炎、幼年型特发性关节炎、牛皮癣性关节炎、强直性脊柱炎和关节炎性溃疡性结肠炎)、结肠炎、牛皮癣、严重哮喘,以及中度至重度克罗恩病。在一些实施方案中,第一sdab和/或第二sdab是vhh。在一些实施方案中,第一抗原结合部分包含含有vh的重链和含有vl的轻链。在一些实施方案中,第一抗原结合区是由两条重链和两条轻链组成的全长抗体。在一些实施方案中,抗原结合部分经由肽接头融合在一起。在一些实施方案中,肽接头长度不超过约30个(例如不超过约25、20或15个中的任一者)氨基酸。在一些实施方案中,第一抗原结合部分包含fc区,例如igg1fc或igg4fc。
在一些实施方案中,提供一种治疗有需要的个体的炎症性或自身免疫疾病的方法,所述方法包括施用有效量的包含多特异性(例如三特异性)抗原结合蛋白和药学上可接受的载体的药物组合物,其中所述mabp包含:(a)含有重链可变域(vh)和轻链可变域(vl)的第一抗原结合部分,其中vh与vl一起形成特异性地结合第一促炎性分子(例如tnf-α)的抗原结合位点,(b)含有特异性地结合第二促炎性分子(例如il-17a)的第一sdab的第二抗原结合部分,和(c)含有特异性地结合第三促炎性分子(例如il-17f)的第二sdab的第三抗原结合部分,其中第一抗原结合部分、第二抗原结合部分和第三抗原结合部分彼此融合。在一些实施方案中,炎症性或自身免疫疾病选自由下列各病组成的组:关节炎(例如类风湿性关节炎、幼年型特发性关节炎、牛皮癣性关节炎、强直性脊柱炎和关节炎性溃疡性结肠炎)、结肠炎、牛皮癣、严重哮喘,以及中度至重度克罗恩病。在一些实施方案中,第一sdab和/或第二sdab是vhh。在一些实施方案中,第一抗原结合部分包含含有vh的重链和含有vl的轻链。在一些实施方案中,第一抗原结合区是由两条重链和两条轻链组成的全长抗体。在一些实施方案中,第一抗原结合区来源于阿达木单抗。在一些实施方案中,抗原结合部分经由肽接头融合在一起。在一些实施方案中,肽接头长度不超过约30个(例如不超过约25、20或15个中的任一者)氨基酸。在一些实施方案中,第一抗原结合部分包含fc区,例如igg1fc。
剂量和施用途径
本申请的药物组合物的剂量和所需药物浓度可根据所设想的特定用途而变化。适当剂量或施用途径的确定在普通技术人员的技能范围内。动物实验提供关于确定人类疗法的有效剂量的可靠指导。可根据mordenti,j.和chappell,w.“theuseofinterspeciesscalingintoxicokinetics,”toxicokineticsandnewdrugdevelopment,yacobi等编,pergamonpress,newyork1989,第42-46页中提出的原则进行有效剂量的物种间换算。
当使用本文所述的mabp的体内施用时,正常剂量的量可根据施用途径而在每天约10ng/kg至约100mg/kg哺乳动物体重或更大量之间变化,优选约1mg/kg/天至10mg/kg/天。在本申请的范围内的是:不同制剂将对不同治疗和不同病症有效,并且旨在治疗特定器官或组织的施用可能需要以不同于向另一器官或组织施用的方式来递送。此外,剂量可通过一次或多次单独施用或通过连续输注来施用。对于经若干天或更长时间的重复施用,视疾患而定,应维持治疗直至出现所希望的抑制疾病症状的效果。然而,其它剂量方案可以是有用的。这种疗法的进程容易通过常规技术和测定来监测。
在一些实施方案中,药物组合物是单次施用的。在一些实施方案中,药物组合物是多次(例如以下任一者:2次、3次、4次、5次、6次或更多次)施用的。在一些实施方案中,药物组合物是每周一次、2周一次、3周一次、4周一次、每月一次、每2月一次、每3月一次、每4月一次、每5月一次、每6月一次、每7月一次、每8月一次、每9月一次或每年一次施用的。在一些实施方案中,施用之间的间隔时间是约以下任一者:1周至2周、2周至1个月、2周至2个月、1个月至2个月、1个月至3个月、3个月至6个月或6个月至一年。用于具体患者的最佳剂量和治疗方案可容易由医药领域的技术人员通过监测患者的疾病体征并相应地调整治疗来确定。
本申请的药物组合物,包括但不限于重构和液体制剂,是根据已知方法,例如以推注形式静脉内施用,或通过肌内、腹膜内、脑脊髓内、皮下、关节内、滑膜内、鞘内、经口、局部或吸入途径经一段时间连续输注,来向需要用mabp治疗的个体施用,所述个体优选是人类。
在一些实施方案中,通过皮下(即皮肤下面)施用向个体施用药物组合物。出于这些目的,药物组合物可使用注射器来注射。然而,可利用用于施用药物组合物的其它装置,例如注射装置;注射笔;自动注射器装置;无针装置;和皮下贴剂递送系统。
在一些实施方案中,向个体静脉内施用药物组合物。在一些实施方案中,通过输注(例如静脉内输注)向个体施用药物组合物。用于免疫疗法的输注技术是本领域中已知的(参见例如rosenberg等,neweng.j.ofmed.319:1676(1988))。
v.制备方法
本申请还提供了编码mabp的经分离的核酸、包含所述经分离的核酸的载体和宿主细胞,和产生所述mabp的重组方法。
关于mabp的重组产生,将编码第一抗原结合部分、第一sdab和第二sdab的全长抗体或抗原结合片段的核酸分离并插入可复制的载体中以用于进一步克隆(dna的扩增)或用于表达。在一些实施方案中,将编码第一抗原结合部分的全长抗体或抗原结合片段的核酸任选地经由编码肽接头的核酸重组融合至编码第一或第二sdab的核酸中,全部都相对于彼此同框翻译以提供编码mabp的核酸。编码mabp或其组分的dna易于使用常规程序(例如,通过使用能够特异性地结合至编码所述抗体的重链和轻链的基因的寡核苷酸探针)分离并测序。可利用许多载体。载体的选择部分地根据有待使用的宿主细胞而定。一般来说,优选宿主细胞具有原核或真核(一般是哺乳动物)来源。
或者,第一抗原结合部分、第二抗原结合部分和第三抗原结合部分各自使用包含分别编码第一抗原结合部分、第二抗原结合部分和第三抗原结合部分的原核或真核宿主细胞来重组制备。然后将所表达的第一抗原结合部分、第二抗原结合部分和第三抗原结合部分在化学上结合,并且纯化以提供mabp。
1.在原核细胞中的蛋白质产生
a)载体构建
编码本申请的mabp的多肽组分的多核苷酸序列可使用标准重组技术获得。所需多核苷酸序列可由抗体产生细胞例如杂交瘤细胞分离并测序。或者,多核苷酸可使用核苷酸合成器或pcr技术来合成。一旦获得,便将编码多肽的序列插入能够在原核宿主中复制并表达异源多核苷酸的重组载体中。在本领域中已知并可获得的许多载体可用于本申请的目的。适当载体的选择主要将取决于有待插入载体中的核酸的尺寸和有待用载体转化的具体宿主细胞。各载体根据其功能(异源多核苷酸的扩增或表达或这两者)和其与驻留其中的具体宿主细胞的相容性而含有不同组分。载体组分一般包括但不限于:复制起点、选择标记基因、启动子、核糖体结合位点(rbs)、信号序列、异源核酸插入物和转录终止序列。
一般来说,将含有来源于与宿主细胞相容的物种的复制子和控制序列的质粒载体结合这些宿主使用。载体通常带有复制位点以及能够提供在转化细胞中的表型选择的标记序列。例如,大肠杆菌通常使用pbr322(即来源于大肠杆菌物种的质粒)来转化。pbr322含有编码氨苄青霉素(amp)和四环素(tet)抗性的基因并且由此提供用于鉴定经转化的细胞的简单手段。pbr322、其衍生物或其它微生物质粒或噬菌体还可含有或被修饰以含有可由微生物用于表达内源性蛋白质的启动子。用于表达特定抗体的pbr322衍生物的实例详细描述于carter等,美国专利第5,648,237号中。
另外,含有与宿主微生物相容的复制子和控制序列的噬菌体载体可用作与这些宿主有关的转化载体。例如,噬菌体例如gemtm-11可在制备重组载体中使用,所述重组载体可用于转化易感宿主细胞例如大肠杆菌le392。
本文所述的表达载体可包含两个或更多个启动子-顺反子对,其编码每种多肽组分。启动子是位于调节其表达的顺反子上游(5')的非翻译调控序列。原核启动子通常分成两种类型:诱导型和组成型。诱导型启动子是响应于培养条件的变化(例如,营养素的存在或不存在或温度的变化)引发在其控制下顺反子的转录水平增加的启动子。
由多种潜在宿主细胞识别的大量启动子是众所周知的。经由限制性酶消化从源dna移除启动子并将经分离的启动子序列插入载体中,可以将选定的启动子可操作地连接至编码轻链或重链的顺反子dna。天然启动子序列和许多异源启动子都可用于靶基因的直接扩增和/或表达。在一些实施方案中,利用异源启动子,因为它们一般允许所表达的靶基因与天然靶多肽启动子相比的更大量转录和更高产量。
适于与原核宿主一起使用的启动子包括phoa启动子、-半乳糖酶和乳糖启动子系统、色氨酸(trp)启动子系统和杂合启动子例如tac或trc启动子。然而,在细菌(例如其它已知细菌或噬菌体启动子)中具功能性的其它启动子也是合适的。已公开它们的核苷酸序列,从而使得熟练工作人员能够使用接头或衔接子将其可操作地连接至编码靶轻链和重链的顺反子(siebenlist等,(1980)cell20:269)以便提供任何所需限制位点。
在一个方面,重组载体内的各顺反子包含分泌信号序列组分,其指导所表达的多肽的跨膜易位。一般来说,信号序列可以是载体的组分,或者它可以是插入载体中的靶多肽dna的一部分。出于本申请的目的选择的信号序列应该是由宿主细胞识别并加工(即由信号肽酶裂解)的序列。对于不会识别并加工异源多肽的天然信号序列的原核宿主细胞,信号序列被例如选自由下列各物组成的组的原核信号序列取代:碱性磷酸酶、青霉素酶、ipp或热稳定性肠毒素ii(stii)前导序列、lamb、phoe、pelb、ompa和mbp。在一些实施方案中,用于所述表达系统的两个顺反子中的信号序列是stii信号序列或其变体。
在一些实施方案中,mabp的产生可在宿主细胞的细胞质中进行,并且因此无需在各顺反子内存在分泌信号序列。在一些实施方案中,多肽组分被表达、折叠和装配以便在细胞质内形成功能性mabp。某些宿主菌株(例如大肠杆菌trxb-菌株)提供有利于二硫键形成的细胞质条件,从而允许所表达的蛋白质亚基的适当折叠和装配。proba和pluckthungene,159:203(1995)。
本申请提供了一种表达系统,其中可调节所表达的多肽组分的定量比率以便最大化分泌并适当装配本申请的mabp的产量。这种调节至少部分地通过同时调节多肽组分的翻译强度来实现。用于调节翻译强度的一项技术公开于simmons等,美国专利第5,840,523号中。其利用顺反子内的翻译起始区(tir)的变体。对于给定tir,可以一定范围内的翻译强度生成一系列氨基酸或核酸序列变体,由此提供调节这种因子以便于特定链的所需表达水平的适宜手段。tir变体可通过常规诱变技术产生,所述技术产生可改变氨基酸序列的密码子变化,但核苷酸序列中的沉默变化是优选的。tir中的改变可包括例如shine-dalgarno序列的数量或间隔的改变以及信号序列的改变。产生突变型信号序列的一种方法是在编码序列的开始处生成不改变所述信号序列的氨基酸序列(即变化是沉默的)的“密码子库”。这可通过改变各密码子的第三核苷酸位置来实现;另外,一些氨基酸例如亮氨酸、丝氨酸和精氨酸具有多个可在生成所述库时增加复杂性的第一位置和第二位置。这种诱变方法详细描述于yansura等,(1992)methods:acompaniontomethodsinenzymol.4:151-158中。
优选地,生成一组载体,其对于其中各顺反子具有一系列tir强度。这种有限组提供在各种tir强度组合下,每条链的表达水平以及所需mabp产物的产率的比较。tir强度可通过如simmons等的美国专利第5,840,523号中详细描述来定量报告基因的表达水平来测定。基于翻译强度的比较,选择所需个别tir以便在本申请的表达载体构建体中组合。
b)原核宿主细胞
适用于表达本申请的mabp的原核宿主细胞包括古细菌(archaebacteria)和真细菌(eubacteria),例如革兰氏(gram)阴性或革兰氏阳性生物体。可用细菌的实例包括大肠杆菌属(escherichia)(例如,大肠杆菌)、杆菌属(bacilli)(例如,枯草杆菌(b.subtilis))、肠细菌(enterobacteria)、假单胞菌属(pseudomonas)物种(例如,铜绿假单胞菌(p.aeruginosa))、鼠伤寒沙门杆菌(salmonellatyphimurium)、粘质沙雷氏菌(serratiamarcescans)、克雷伯氏菌属(klebsiella)、变形杆菌属(proteus)、志贺杆菌属(shigella)、根瘤菌属(rhizobia)、透明颤菌属(vitreoscilla)或副球菌属(paracoccus)。在一个实施方案中,使用革兰氏阴性细胞。在一个实施方案中,大肠杆菌细胞被用作宿主。大肠杆菌菌株的实例包括菌株w3110(bachmann,cellularandmolecularbiology,第2卷(washington,d.c.:americansocietyformicrobiology,1987),第1190-1219页;atcc保藏号27,325)及其衍生物,包括具有基因型w3110afhua(atona)ptr3laciqlacl8aompta(nmpc-fepe)degp41kanr的菌株33d3(美国专利第5,639,635号)。其它菌株及其衍生物,例如大肠杆菌294(atcc31,446)、大肠杆菌b、大肠杆菌1776(atcc31,537)和大肠杆菌rv308(atcc31,608)也是合适的。这些实例是说明性而非限制性的。用于构建具有限定基因型的以上提及的任何细菌的衍生物的方法是本领域中已知的并且描述于例如bass等,proteins,8:309-314(1990)中。一般来说,选择适当的细菌时必须考虑细菌细胞中复制子的复制能力。例如,当使用众所周知的质粒例如pbr322、pbr325、pacyc177或pkn410提供复制子时,大肠杆菌、沙雷氏菌属(serratia)或沙门杆菌属(salmonella)物种可适宜用作宿主。
通常,宿主细胞应分泌最少量的蛋白分解酶,并且理想地可在细胞培养物中掺入额外的蛋白酶抑制剂。
c)蛋白质产生
用上述表达载体转化宿主细胞并且在适当时被改性以用于诱导启动子、选择转化株或扩增编码所需序列的基因的常规营养培养基中培养。转化意味着将dna引入原核宿主中以便dna可作为染色体外元件或通过染色体整合体来复制。取决于所用的宿主细胞,使用适于这类细胞的标准技术进行转化。采用氯化钙的钙处理通常用于含有坚固的细胞壁屏障的细菌细胞。用于转化的另一方法采用聚乙二醇/dmso。所用的又一项技术是电穿孔。
用于产生本申请的mabp的原核细胞在本领域中已知并且适于培养所选宿主细胞的培养基中生长。合适的培养基的实例包括luria肉汤(lb)加上必需的营养补充剂。在一些实施方案中,培养基还含有基于表达载体的构建而选择的选择剂,以便选择性地允许含有表达载体的原核细胞的生长。例如,将氨苄青霉素添加至培养基中以用于表达氨苄青霉素抗性基因的细胞的生长。
除碳源、氮源和无机磷酸盐源以外,还可包括适当浓度的任何必需补充剂,其可单独引入或者与另一种补充剂或培养基组合成混合物引入,例如复合氮源。任选地,培养基可含有一种或多种选自由下列各物组成的组的还原剂:谷胱甘肽、半胱氨酸、胱胺、巯乙酸盐、二硫赤藓糖醇和二硫苏糖醇。
在适当温度下培养原核宿主细胞。对于大肠杆菌生长,例如,优选温度范围为约20℃至约39℃、更优选约25℃至约37℃,甚至更优选在约30℃下。培养基的ph可为在约5至约9范围内的任何ph,这主要取决于宿主生物体。对于大肠杆菌,ph优选为约6.8至约7.4,并且更优选为约7.0。
如果诱导型启动子用于表达载体中,则在适于激活启动子的条件下诱导蛋白质表达。在一些实施方案中,将phoa启动子用于控制多肽的转录。因此,将被转化的宿主细胞在磷酸盐限制培养基中培养以用于诱导。优选地,磷酸盐限制培养基是c.r.a.p培养基(参见例如simmons等,j.immunol.methods(2002),263:133-147)。如本领域中已知,根据所采用的载体构建体,可使用多种其它诱导物。
所表达的本申请的mabp分泌至宿主细胞周质中并且从宿主细胞周质回收。蛋白质回收通常涉及微生物的破坏,通常通过例如渗透压休克、声波处理或溶解等手段实现。一旦细胞被破坏,就可通过离心或过滤去除细胞碎片或完整细胞。蛋白质可例如通过亲和树脂色谱法进一步纯化。或者,可将蛋白质转运至培养基中并在其中分离。细胞可从培养物中去除并且过滤并浓缩培养上清液以进一步纯化所产生的蛋白质。可使用通常已知的方法例如聚丙烯酰胺凝胶电泳(page)和免疫印迹测定进一步分离并鉴定所表达的多肽。
或者,通过发酵过程大批量地进行蛋白质生产。各种大规模补料分批发酵程序可用于产生重组蛋白质。大规模发酵具有至少1000公升的容量,优选约1,000至100,000公升的容量。这些发酵罐使用搅拌器叶轮来分配氧气和营养素,尤其是葡萄糖(优选的碳源/能源)。小规模发酵通常是指在体积容量不超过大约100公升并且可在约1公升至约100公升范围内的发酵罐中的发酵。
在发酵过程期间,诱导蛋白质表达通常是在细胞已在合适条件下生长至期望密度(例如,od550为约180-220)后起始,在该阶段细胞处于早期稳定期。如本领域已知和上文所述,根据所采用的载体构建体,可使用多种诱导物。细胞可在诱导之前生长较短时期。通常将细胞诱导约12-50小时,但可使用更长或更短的诱导时间。
为了改进本申请的mabp的产量和质量,可对各种发酵条件进行修改。例如,为了改进所分泌的多肽的适当装配和折叠,可使用过表达例如dsb蛋白(dsba、dsbb、dsbc、dsbd和或dsbg)或fkpa(具有伴侣蛋白活性的肽基脯氨酰基顺,反-异构酶)的伴侣蛋白的其它载体来共转化宿主原核细胞。已证实所述伴侣蛋白促进细菌宿主细胞中所产生的异源蛋白的适当折叠和溶解性。chen等,(1999)jbiochem274:19601-19605;georgiou等,美国专利第6,083,715号;georgiou等,美国专利第6,027,888号;bothmann和pluckthun(2000)j.biol.chem.275:17100-17105;ramm和pluckthun(2000)j.biol.chem.275:17106-17113;arie等,(2001)mol.microbiol.39:199-210。
为了最小化所表达的异源蛋白(尤其是具有蛋白水解敏感性的那些蛋白)的蛋白质水解,可将某些缺乏蛋白水解酶的宿主菌株用于本申请。例如,可修饰宿主细胞菌株,以便在编码已知细菌蛋白酶的基因中实现一个或多个基因突变,所述细菌蛋白酶是例如蛋白酶iii、ompt、degp、tsp、蛋白酶i、蛋白酶mi、蛋白酶v、蛋白酶vi及其组合。一些大肠杆菌蛋白酶缺陷型菌株可获得并且描述于例如joly等,(1998),同上;georgiou等,美国专利第5,264,365号;georgiou等,美国专利第5,508,192号;hara等,microbialdrugresistance,2:63-72(1996)中。
缺乏蛋白水解酶并且被过表达一种或多种伴侣蛋白的质粒转化的大肠杆菌菌株可用作编码本申请的mabp的表达系统中的宿主细胞。
d)蛋白质纯化
本文产生的mabp可被进一步纯化,以获得基本上均质的制剂,以供进一步的测定和应用。可采用本领域中已知的标准蛋白质纯化方法。以下程序是合适的纯化程序的示例:免疫亲和柱或离子交换柱上的分级分离、乙醇沉淀、反相hplc、二氧化硅上或阳离子交换树脂(例如deae)上的色谱法、色谱聚焦、sds-page、硫酸铵沉淀和使用例如sephadexg-75的凝胶过滤。
在一些实施方案中,将固相上固定的蛋白a用于包含本文所述的fc区的mabp的免疫亲和纯化。蛋白a是来自金黄色葡萄球菌(staphylococcusaureas)的411(d细胞壁蛋白,其以高亲和力结合至抗体的fc区。lindmark等,(1983)j.immunol.meth.62:1-13。固定有蛋白a的固相优选是包含玻璃或二氧化硅表面的柱,更优选是受控孔径玻璃柱或硅酸柱。在一些应用中,柱已涂覆有试剂,例如甘油,以试图防止污染物的非特异性粘附。然后洗涤固相以去除非特异性地结合至固相的污染物。最终,所关注的mabp通过溶析从固相中回收。
2.在真核细胞中的蛋白质产生
对于真核表达,载体组件一般包括但不限于以下中的一者或多者:信号序列、复制起点、一个或多个标记基因和增强子组件、启动子和转录终止序列。
a)信号序列组件
用于真核宿主中的载体也可以是编码信号序列或在成熟蛋白质或多肽的n末端处具有特异性裂解位点的其它多肽的插入物。所选异源信号序列优选是由宿主细胞识别并加工(即由信号肽酶裂解)的序列。在哺乳动物细胞表达中,可利用哺乳动物信号序列以及病毒分泌型前导序列,例如单纯性疱疹gd信号。
将这种前体区的dna在阅读框内连接至编码本申请的mabp的dna上。
b)复制起点
一般来说,哺乳动物表达载体无需复制起点组件(sv40起点通常仅因为其含有早期启动子而使用)。
c)选择基因组件
表达和克隆载体可含有选择基因,也称为可选标记。典型的选择基因编码以下蛋白质:(a)赋予对抗生素或其它毒素的抗性,例如对氨苄青霉素、新霉素、甲氨蝶呤或四环素的抗性,(b)补足营养缺陷型不足,或(c)提供不能从复合培养基中得到的关键营养素,例如,对杆菌属来说,编码d-丙氨酸消旋酶的基因。
选择方案的一个实例利用药物来阻止宿主细胞的生长。成功地用异源基因转化的那些细胞产生赋予耐药性的蛋白质,并且由此能够在选择方案中存活。这类显性选择的实例使用药物新霉素、霉酚酸和潮霉素。
适用于哺乳动物细胞的可选标记的另一实例是能够鉴定有能力吸收编码本申请mabp的核酸的细胞的那些可选标记,例如dhfr、胸苷激酶、金属硫蛋白-i和金属硫蛋白-ii(优选是灵长类动物金属硫蛋白基因)、腺苷脱氨酶、鸟氨酸脱羧酶等。
例如,首先通过在含有甲氨蝶呤(mtx)(即dhfr的竞争性拮抗剂)的培养基中培养所有转化株来鉴定用dhfr选择基因转化的细胞。当采用野生型dhfr时,适当的宿主细胞是缺乏dhfr活性的中国仓鼠卵巢(cho)细胞系(例如atcccrl-9096)。
或者,用编码多肽的dna序列、野生型dhfr蛋白和另一可选标记例如氨基糖苷3'-磷酸转移酶(aph)转化或共转化的宿主细胞(特别是含有内源性dhfr的野生型宿主)可通过在含有针对可选标记的选择剂例如氨基糖苷抗生素,例如卡那霉素、新霉素或g418的培养基中进行细胞生长来选择。参见美国专利第4,965,199号。
d)启动子组件
表达和克隆载体通常含有由宿主生物体识别并与编码所需多肽序列的核酸可操作连接的启动子。实际上所有真核基因均具有富含at的区域,位于转录起始位点上游约25至30个碱基处。在许多基因的转录起始点上游的70至80个碱基处发现的另一序列是cncaat区,其中n可以是任何核苷酸。大多数真核基因的3'端是aataaa序列,所述序列可以是向编码序列的3'端中添加polya尾的信号。所有这些序列均可插入真核表达载体中。
适合与原核宿主一起使用的其它启动子包括phoa启动子、-内酰胺酶和乳糖启动子系统、碱性磷酸酶启动子、色氨酸(trp)启动子系统和杂合启动子例如tac启动子。然而,其它已知的细菌启动子也是合适的。用于细菌系统中的启动子也将含有与编码mabp的dna可操作连接的shine-dalgarno(s.d.)序列。
由哺乳动物宿主细胞中的载体进行的多肽转录可受到例如下列启动子的控制:从病毒(例如多瘤病毒、禽痘病毒、腺病毒(例如腺病毒2)、牛乳头状瘤病毒、禽肉瘤病毒、巨细胞病毒、反转录病毒、乙型肝炎病毒和最优选猿猴病毒40(sv40))的基因组获得的启动子、从异源哺乳动物启动子(例如,肌动蛋白启动子或免疫球蛋白启动子)获得的启动子、从热休克启动子获得的启动子,条件是这些启动子与宿主细胞系统相容。
sv40病毒的早期和晚期启动子宜作为sv40限制性片段获得,所述片段还含有sv40病毒复制起点。人类巨细胞病毒的立即早期启动子宜作为hindiiie限制性片段获得。使用牛乳头状瘤病毒作为载体在哺乳动物宿主中表达dna的系统公开于美国专利第4,419,446号中。这种系统的变型描述于美国专利第4,601,978号中。关于在来自单纯疱疹病毒的胸苷激酶启动子控制下在小鼠细胞中进行的人类-干扰素cdna的表达,也参见reyes等,nature297:598-601(1982)。或者,劳斯肉瘤病毒(roussarcomavirus)长末端重复序列可用作启动子。
e)增强子元件组件
在载体中插入增强子序列经常能增加高等真核生物对编码本申请mabp的dna的转录。现已知多种增强子序列是来自哺乳动物基因(球蛋白、弹性蛋白酶、白蛋白、甲胎蛋白和胰岛素)。然而,通常将使用来自真核细胞病毒的增强子。实例包括复制起点后侧的sv40增强子(bp100-270)、巨细胞病毒早期启动子增强子、复制起点后侧的多瘤病毒增强子,和腺病毒增强子。关于用于激活真核启动子的增强元件,也参见yaniv,nature297:17-18(1982)。增强子可在多肽编码序列的5'或3'位置处剪接至载体中,但优选位于启动子的位点5'处。
f)转录终止组件
用于真核宿主细胞(酵母、真菌、昆虫、植物、动物、人类细胞或来自其它多细胞生物体的有核细胞)中的表达载体还将含有转录终止和使mrna稳定所必需的序列。这些序列通常可获自真核生物或病毒dna或cdna的5'和有时3'非翻译区。这些区域含有转录为编码多肽的mrna的非翻译部分中多腺苷酸化片段的核苷酸区段。一种有用的转录终止组件是牛生长激素多腺苷酸化区。参见wo94/11026和其中所公开的表达载体。
g)宿主细胞的选择与转化
适用于在本文的载体中克隆或表达dna的宿主细胞包括本文所述的高等真核生物细胞,包括脊椎动物宿主细胞。脊椎动物细胞在培养(组织培养)中的增殖已成为常规程序。有用的哺乳动物宿主细胞系的实例是由sv40转化的猴肾cv1系(cos-7,atcccrl1651);人类胚肾系(被亚克隆以便在悬浮培养中生长的293或293细胞,graham等,j.genvirol.36:59(1977));幼仓鼠肾细胞(bhk,atccccl10);中国仓鼠卵巢细胞/-dhfr(cho,urlaub等,proc.natl.acad.sci.usa77:4216(1980));小鼠塞托利细胞(sertolicell)(tm4,mather,biol.reprod.23:243-251(1980));猴肾细胞(cv1atccccl70);非洲绿猴肾细胞(vero-76,atcccrl-1587);人类宫颈癌细胞(hela,atccccl2);犬肾细胞(mdck,atccccl34);布法罗(buffalo)大鼠肝细胞(brl3a,atcccrl1442);人类肺细胞(w138,atccccl75);人类肝细胞(hepg2,hb8065);小鼠乳腺肿瘤(mmt060562,atccccl51);tr1细胞(mather等,annalsn.y.acad.sci.383:44-68(1982));mrc5细胞;fs4细胞;和人类肝细胞瘤系(hepg2)。
用上述用于mabp产生的表达或克隆载体转化宿主细胞并且在适当时被修饰用于诱导启动子、选择转化株或扩增编码所需序列的基因的常规营养培养基中培养。
h)培养宿主细胞
用于产生本申请的mabp的宿主细胞可在多种培养基中培养。市售的培养基例如ham'sf10(sigma)、最低必需培养基((mem),(sigma))、rpmi-1640(sigma)和杜尔贝科改良伊格尔培养基((dulbecco'smodifiedeagle'smedium,dmem),sigma)适于培养宿主细胞。另外,ham等,meth.enz.58:44(1979),barnes等,anal.biochem.102:255(1980),美国专利第4,767,704号;第4,657,866号;第4,927,762号;第4,560,655号;或第5,122,469号;wo90/03430;wo87/00195;或美国专利re.30,985中所述的任何培养基都可用作宿主细胞的培养基。这些培养基中的任一种可视需要补充有激素和/或其它生长因子(例如胰岛素、转铁蛋白或表皮生长因子)、盐(例如氯化钠、钙、镁和磷酸盐)、缓冲液(例如hepes)、核苷酸(例如腺苷和胸苷)、抗生素(例如gentamycintm药物)、微量元素(定义为通常以在微摩尔范围内的最终浓度存在的无机化合物)和葡萄糖或等效能量来源。也可包括本领域技术人员已知的适当浓度的任何其它所需补充剂。例如温度、ph等的培养条件是先前与被选择用于表达的宿主细胞一起使用的那些培养条件,并且将为普通技术人员所显而易见。
i)蛋白质纯化
当使用重组技术时,mabp可在细胞内、在周质空间中产生或直接分泌至培养基中。如果mabp是在细胞内产生,则作为第一步骤,例如通过离心或超滤去除微粒碎片(即宿主细胞或溶解片段)。carter等,bio/technology10:163-167(1992)描述一种用于分离分泌至大肠杆菌周质空间中的抗体的程序。简言之,将细胞糊在乙酸钠(ph3.5)、edta和苯基甲基磺酰氟(pmsf)存在下经约30分钟解冻。可通过离心去除细胞碎片。当mabp分泌至培养基中时,通常首先使用市售蛋白质浓缩过滤器(例如amicon或milliporepellicon超滤装置)来浓缩来自这些表达系统的上清液。可在前述任何步骤中纳入蛋白酶抑制剂(例如pmsf)以抑制蛋白水解并且可纳入抗生素以防止外来污染物生长。
从细胞制备的蛋白质组合物可例如使用羟磷灰石色谱法、凝胶电泳、透析和亲和色谱法来纯化,其中亲和色谱法是优选的纯化技术。蛋白a作为亲和配体的适用性取决于存在于mabp中的任何免疫球蛋白fc域的种类和同型。蛋白a可用于纯化基于含有1、2或4条重链的人类免疫球蛋白的mabp(lindmark等,j.immunol.meth.62:1-13(1983))。蛋白g被推荐用于所有小鼠同型和人类3(guss等,emboj.5:15671575(1986))。亲和配体所附接的基质最经常为琼脂糖,但可利用其它基质。机械稳定的基质,例如受控孔径玻璃或聚(苯乙烯-二乙烯基)苯允许比琼脂糖可实现的更快的流速和较短的加工时间。当mabp包含ch3域时,bakerbondabxtm树脂(j.t.baker,phillipsburg,n.j.)适用于纯化。取决于待回收的mabp,也可使用其它蛋白质纯化技术,例如在离子交换柱上分级分离、乙醇沉淀、反相hplc、二氧化硅色谱法、肝素sepharosetm色谱法、阴离子或阳离子交换树脂(例如聚天冬氨酸柱)色谱法、色谱聚焦、sds-page和硫酸铵沉淀。
在任何初步纯化步骤之后,可使用ph介于约2.5-4.5之间的溶析缓冲液使包含所关注mabp和污染物的混合物经受低ph疏水相互作用色谱法,其优选在低盐浓度(例如,约0-0.25m盐)下实施。
3.抗体产生
mabp的组分例如常规的4链抗体、抗原结合片段和sdab可使用本领域中任何已知的方法(包括如下所述的方法)产生。
sdab(例如vhh)可使用本领域中已知的方法获得,例如通过免疫骆驼科物种(例如骆驼或美洲驼)和由此获得杂交瘤,或通过使用本领域中已知的分子生物学技术克隆sdab文库并且随后通过elisa用未经选择的文库的个别克隆或通过使用噬菌体展示进行选择。
1)单克隆抗体
单克隆抗体是从基本上同源的抗体群体获得,即除可以微量存在的可能天然存在的突变和/或翻译后修饰(例如异构化、酰胺化)之外与所述群体相同的个别抗体。因此,修饰语“单克隆”表示抗体的特性并非不同抗体的混合物。
例如,单克隆抗体可使用由kohler等,nature,256:495(1975)首次描述的杂交瘤方法制得,或者可通过重组dna方法(美国专利第4,816,567号)制得。
在杂交瘤方法中,如上所述对小鼠或其它适当宿主动物(例如仓鼠)进行免疫以引发产生或能够产生抗体的淋巴细胞,所述抗体将特异性地结合用于免疫的蛋白。或者,可在体外免疫淋巴细胞。接着使用合适的融合剂(例如聚乙二醇)将淋巴细胞与骨髓瘤细胞融合以形成杂交瘤细胞(goding,monoclonalantibodies:principlesandpractice,第59-103页(academicpress,1986)。
免疫剂通常将包括抗原性蛋白或其融合变体。一般来说,如果需要人类来源的细胞,则使用外周血淋巴细胞(“pbl”),或者如果需要非人类哺乳动物来源,则使用脾细胞或淋巴结细胞。然后使用合适的融合剂(例如聚乙二醇)将淋巴细胞与永生化细胞系融合以形成杂交瘤细胞。goding,monoclonalantibodies:principlesandpractice,academicpress(1986),第59-103页。
永生化细胞系通常是被转化的哺乳动物细胞,特别是啮齿动物、牛和人类来源的骨髓瘤细胞。通常,采用大鼠或小鼠骨髓瘤细胞系。将由此制备的杂交瘤细胞接种并生长于合适的培养基中,所述培养基优选含有一种或多种抑制未融合的亲本骨髓瘤细胞生长或存活的物质。例如,如果亲本骨髓瘤细胞缺乏酶次黄嘌呤鸟嘌呤磷酸核糖转移酶(hgprt或hprt),则用于杂交瘤的培养基通常将包括次黄嘌呤、氨基蝶呤和胸苷(hat培养基),它们是可防止hgprt缺陷型细胞生长的物质。
优选的永生化骨髓瘤细胞是有效融合、支持所选抗体产生细胞稳定大量产生抗体并且对培养基(例如hat培养基)敏感的那些细胞。在这些细胞中,优选的是鼠类骨髓瘤系,例如源自mopc-21和mpc-11小鼠肿瘤的那些骨髓瘤系(可从沙克研究院细胞分配中心(salkinstitutecelldistributioncenter),sandiego,calif.usa获得),以及sp-2细胞(及其衍生物,例如x63-ag8-653)(可从美国典型培养物保藏所(americantypeculturecollection),manassas,va.usa获得)。也已关于人类单克隆抗体的产生对人类骨髓瘤和小鼠-人类异源骨髓瘤细胞系进行描述(kozbor,j.immunol.,133:3001(1984);brodeur等,monoclonalantibodyproductiontechniquesandapplications,第51-63页(marceldekker,inc.,newyork,1987))。
对其中生长杂交瘤细胞的培养基测定针对抗原的单克隆抗体的产生。优选地,杂交瘤细胞所产生的单克隆抗体的结合特异性是通过免疫沉淀或通过体外结合测定(例如放射性免疫测定(ria)或酶联免疫吸附测定(elisa))来确定。
可对其中培养杂交瘤细胞的培养基测定针对所需抗原的单克隆抗体的存在。优选地,单克隆抗体的结合亲和力和特异性可通过免疫沉淀或通过体外结合测定例如放射免疫测定(ria)或酶联测定(elisa)来测定。这些技术和测定是本领域中已知的。例如,结合亲和力可通过munson等,anal.biochem.,107:220(1980)的scatchard分析来测定。
在鉴定产生具有所需特异性、亲和力和/或活性的抗体的杂交瘤细胞之后,可通过限制性稀释程序对克隆进行亚克隆并且通过标准方法(goding,同上)使其生长。用于此目的的合适的培养基包括例如d-mem或rpmi-1640培养基。另外,杂交瘤细胞可在哺乳动物中在体内作为肿瘤生长。
将由亚克隆分泌的单克隆抗体通过以下常规免疫球蛋白纯化程序适当地从培养基、腹水或血清中分离:例如蛋白a-sepharose、羟磷灰石色谱法、凝胶电泳、透析或亲和色谱法。
单克隆抗体也可通过重组dna方法制得,例如美国专利第4,816,567号中所述和如上所述的那些方法。编码单克隆抗体的dna易于使用常规程序(例如,通过使用能够特异性地结合至编码鼠类抗体的重链和轻链的基因的寡核苷酸探针)分离并测序。杂交瘤细胞充当这种dna的优选来源。一旦分离,就可将dna置于表达载体中,然后将所述表达载体转染至原本不产生免疫球蛋白的宿主细胞(例如大肠杆菌细胞、猿猴cos细胞、中国仓鼠卵巢(cho)细胞或骨髓瘤细胞)中,以在这些重组宿主细胞中合成单克隆抗体。关于编码抗体的dna在细菌中重组表达的综述文章包括skerra等,curr.opinioninimmunol.,5:256-262(1993)和pliickthun,immunol.revs.130:151-188(1992)。
在又一个实施方案中,抗体可从使用mccafferty等,nature,348:552-554(1990)中所述的技术产生的抗体噬菌体文库中分离。clackson等,nature,352:624-628(1991)和marks等,j.mol.biol.,222:581-597(1991)描述使用噬菌体文库分别分离鼠类和人类抗体。后续出版物描述通过链改组产生高亲和力(nm范围)人类抗体(marks等,bio/technology,10:779-783(1992))以及组合感染和体内重组作为用于构建极大噬菌体文库的策略(waterhouse等,nucl.acidsres.,21:2265-2266(1993))。因此,这些技术是用于分离单克隆抗体的传统单克隆抗体杂交瘤技术的可行替代方案。
dna也可被修饰,例如通过用人类重链和轻链恒定域的编码序列取代同源鼠类序列(美国专利第4,816,567号;morrison等,proc.natlacad.sci.usa,81:6851(1984)),或通过将非免疫球蛋白多肽的所有或一部分编码序列共价接合至免疫球蛋白编码序列上。通常,这些非免疫球蛋白多肽取代抗体的恒定域,或者它们可取代抗体的一个抗原结合位点的可变域以生成嵌合二价抗体,所述嵌合二价抗体包含一个对抗原具有特异性的抗原组合位点和另一个对不同抗原具有特异性的抗原组合位点。
本文所述的单克隆抗体可以是单价的,其制备是本领域中熟知的。例如,一种方法涉及免疫球蛋白轻链和经修饰重链的重组表达。重链通常在fc区内的任何点处截短以防止重链交联。或者,相关半胱氨酸残基可被另一氨基酸残基取代或缺失以防止交联。体外方法也适于制备单价抗体。可使用本领域中已知的常规技术实现抗体的消化以产生其片段,特别是fab片段。
嵌合或杂合抗体也可使用合成蛋白质化学中已知的方法(包括涉及交联剂的那些)体外制备。例如,可使用二硫键交换反应或通过形成硫醚键来构建免疫毒素。用于这个目的的合适试剂的实例包括亚氨基硫醇酯和4-巯基丁酰亚氨酸甲基酯。
2)人源化抗体
抗体还可包括人源化或人类抗体。人源化形式的非人类(例如鼠类)抗体是嵌合免疫球蛋白、其免疫球蛋白链或片段(例如fv、fab、fab'、f(ab')2或抗体的其它抗原结合子序列),其含有来源于非人类免疫球蛋白的最小序列。人源化抗体包括人类免疫球蛋白(受者抗体),其中来自受者的互补决定区(cdr)的残基被来自具有所需特异性、亲和力和容量的非人类物种(供者抗体)例如小鼠、大鼠或兔的cdr的残基代替。在一些情况下,人类免疫球蛋白的fv框架残基被相应的非人类残基代替。人源化抗体也可包含在受者抗体和输入cdr或框架序列中均未发现的残基。一般来说,人源化抗体将包含基本上全部的至少一个、并且通常两个可变域,其中全部或基本上全部的cdr区对应于非人类免疫球蛋白的那些cdr区,并且全部或基本上全部的fr区是人类免疫球蛋白共有序列的那些fr区。人源化抗体最佳还将包含免疫球蛋白恒定区(fc)的至少一部分,通常是人类免疫球蛋白的至少一部分。jones等,nature321:522-525(1986);riechmann等,nature332:323-329(1988)和presta,curr.opin.struct.biol.2:593-596(1992)。
用于使非人类抗体人源化的方法是本领域中熟知的。一般来说,人源化抗体具有从非人类来源引入至其中的一个或多个氨基酸残基。这些非人类氨基酸残基经常称为“输入”残基,其通常取自“输入”可变域。人源化可基本上遵循winter和其同事的方法(jones等,nature321:522-525(1986);riechmann等,nature332:323-327(1988);verhoeyen等,science239:1534-1536(1988)),或经由用啮齿类动物cdr或cdr序列取代人类抗体的相应序列来实施。因此,这些“人源化”抗体是嵌合抗体(美国专利第4,816,567号),其中基本上少于一个完整的人类可变域已被来自非人类物种的相应序列取代。实际上,人源化抗体通常是其中一些cdr残基和可能一些fr残基被来自啮齿动物抗体中的类似位点的残基取代的人类抗体。
有待用于制备人源化抗体的人类可变域(轻链和重链)的选择对于降低抗原性极其重要。根据所谓的“最佳拟合”方法,针对已知人类可变域序列的整个文库筛选啮齿动物抗体的可变域序列。然后将与啮齿动物序列最接近的人类序列视作人源化抗体的人类框架(fr)。sims等,j.immunol.,151:2296(1993);chothia等,j.mol.biol.,196:901(1987)。另一方法使用来源于具有特定亚组的轻链或重链的所有人类抗体的共有序列作为特定框架。相同框架可用于若干种不同人源化抗体。carter等,proc.natl.acad.sci.usa,89:4285(1992);presta等,j.immunol.,151:2623(1993)。
此外重要的是,抗体在人源化后保留对抗原的高亲和力以及其它有利的生物学特性。为实现这个目的,根据优选方法,通过用亲本和人源化序列的三维模型分析亲本序列和各种概念性人源化产物的过程来制备人源化抗体。三维免疫球蛋白模型通常可获得并且是本领域技术人员所熟悉的。可使用计算机程序,这些计算机程序说明并展示所选候选免疫球蛋白序列的可能的三维构象结构。观察这些展示内容容许分析残基在候选免疫球蛋白序列功能行使中的可能作用,即分析影响候选免疫球蛋白与其抗原结合的能力的残基。以这种方式,可从受者和输入序列中选择并组合fr残基,以便实现所需抗体特征,例如对一种或多种靶抗原的亲和力增加。一般来说,cdr残基直接并且最实质性地涉及对抗原结合的影响。
涵盖人源化抗体的各种形式。例如,人源化抗体可以是抗体片段,例如fab,其任选地与一种或多种细胞毒性剂结合以产生免疫结合物。或者,人源化抗体可以是完整抗体,例如完整的igg1抗体。
在一些实施方案中,第一sdab和/或第二sdab被修饰,例如人源化,而不会减小结构域对抗原的天然亲和力并且同时降低其对异源物种的免疫原性。例如,可确定美洲驼抗体的抗体可变域(vhh)的氨基酸残基,并且例如在框架区中的一个或多个骆驼科氨基酸被人类共有序列中所见的其人类对应体代替,而所述多肽不会丧失其典型特性,即人源化不会显著影响所得多肽的抗原结合能力。骆驼科sdab的人源化需要有限量的氨基酸在单一多肽链中的引入和诱变。这与scfv、fab'、(fab')2和igg的人源化相反,后者需要在两条链(即轻链和重链)中引入氨基酸变化并且维持两条链的装配。
3)人类抗体
作为人源化的替代,可产生人类抗体。例如,目前可产生转基因动物(例如小鼠),所述转基因动物在免疫后能够在不产生内源性免疫球蛋白的情况下产生完整人类抗体谱。例如,已描述嵌合和种系突变小鼠中抗体重链接合区(jh)基因的同型缺失使内源性抗体产生受到完全抑制。将人类种系免疫球蛋白基因阵列转移至这些种系突变小鼠中,由此将会导致在抗原激发时产生人类抗体。参见例如jakobovits等,proc.natl.acad.sci.usa,90:2551(1993);jakobovits等,nature,362:255-258(1993);bruggermann等,yearinimmuno.,7:33(1993);美国专利第5,591,669号和wo97/17852。能够产生完全人类sdab的转基因小鼠或大鼠是本领域中已知的。参见例如us20090307787a1、美国专利第8,754,287号、us20150289489a1、us20100122358a1和wo2004049794。
或者,噬菌体展示技术可用于从来自未经免疫的供者的免疫球蛋白可变(v)域基因谱体外产生人类抗体和抗体片段。mccafferty等,nature348:552-553(1990);hoogenboom和winter,j.mol.biol.227:381(1991)。根据这种技术,将抗体v结构域基因框内克隆至丝状噬菌体的主要或次要外壳蛋白基因例如m13或fd中,并且在噬菌体颗粒表面上展示为功能性抗体片段。因为丝状颗粒含有噬菌体基因组的单链dna拷贝,所以基于抗体功能特性的选择也导致编码展现那些特性的抗体的基因的选择。因此,噬菌体模拟b细胞的一些特性。噬菌体展示可以多种形式进行,综述于例如johnson,kevins和chiswell,davidj.,curr.opinstruct.biol.3:564-571(1993)中。可使用v-基因区段的若干来源进行噬菌体展示。clackson等,nature352:624-628(1991)从来源于免疫小鼠的脾脏的v基因的小型随机组合文库中分离一系列不同的抗噁唑啉酮抗体。可构建来自未经免疫的人类供者的v基因谱并且可基本上遵循marks等,j.mol.biol.222:581-597(1991)或griffith等,emboj.12:725-734(1993)所述的技术分离针对一系列不同抗原(包括自身抗原)的抗体。也参见美国专利第5,565,332号和第5,573,905号。
cole等和boerner等的技术也可用于制备人类单克隆抗体(cole等,monoclonalantibodiesandcancertherapy,alanr.liss,第77页(1985)和boerner等,j.immunol.147(1):86-95(1991)。类似地,可通过将人类免疫球蛋白基因座引入转基因动物(例如小鼠)中来制造人类抗体,在所述转基因动物中内源性免疫球蛋白基因已部分或完全失活。激发后,观察到人类抗体产生,其在所有方面(包括基因重排、装配和抗体谱)都非常类似于在人类中可见的情形。这种方法描述于例如美国专利第5,545,807号、第5,545,806号、第5,569,825号、第5,625,126号、第5,633,425号、第5,661,016号和以下科学出版物中:marks等,bio/technology10:779-783(1992);lonberg等,nature368:856-859(1994);morrison,nature368:812-13(1994);fishwild等,naturebiotechnology14:845-51(1996),neuberger,naturebiotechnology14:826(1996)以及lonberg和huszar,intern.rev.immunol.13:65-93(1995)。
最终,人类抗体还可由活化的b细胞体外产生(参见美国专利第5,567,610号和第5,229,275号)。
4)抗体片段
在某些情形下,使用抗体片段例如抗原结合片段比使用全抗体有优势。较小片段尺寸允许快速清除,并且可改进与实体肿瘤的接触。
已开发用于产生抗体片段的各种技术。传统上,这些片段经由完整抗体的蛋白水解消化来衍生(参见例如morimoto等,jbiochembiophys.method.24:107-117(1992);和brennan等,science229:81(1985))。然而,这些片段现在可由重组宿主细胞直接产生。fab、fv和scfv抗体片段都可在大肠杆菌中表达并从其中分泌,由此容许轻易产生大量的这些片段。抗体片段可从以上论述的抗体噬菌体文库中分离。或者,fab'-sh片段可从大肠杆菌中直接回收并化学偶联以形成f(ab')2片段(carter等,bio/technology10:163-167(1992))。根据另一方法,f(ab')2片段可从重组宿主细胞培养物中直接分离。具有增加的体内半衰期的fab和f(ab')2描述于美国专利第5,869,046号中。在其它实施方案中,所选抗体是单链fv片段(scfv)。参见wo93/16185;美国专利第5,571,894号和美国专利第5,587,458号。抗体片段也可以是“线性抗体”,例如如美国专利第5,641,870号中所述。这些线性抗体片段可以是单特异性或双特异性的。
5)多特异性抗体
第一抗原结合部分可包含多特异性抗体,例如双特异性抗体。双特异性抗体(bsab)是对至少两个不同表位(包括在相同或另一蛋白质上的那些表位)具有结合特异性的抗体。或者,一条臂可结合靶抗原,并且另一条臂可与结合白细胞上的触发分子例如t细胞受体分子(例如cd3)或igg的fc受体(fcγr)例如fcγr1(cd64)、fcγrii(cd32)和fcγriii(cd16)的臂组合,以使得细胞防御机制集中并定位于表达靶抗原的细胞。这些抗体可来源于全长抗体或抗体片段(例如f(ab')2双特异性抗体)。
双特异性抗体也可用于将细胞毒性剂定位于表达靶抗原的细胞。这些抗体具有结合所需抗原的一条臂和结合细胞毒性剂(例如,皂草素、抗干扰素-α、长春花生物碱、蓖麻毒蛋白a链、甲氨蝶呤或放射性同位素半抗原)的另一条臂。已知的双特异性抗体的实例包括抗erbb2/抗fcgriii(wo96/16673)、抗erbb2/抗fcgri(美国专利第5,837,234号)、抗erbb2/抗cd3(美国专利第5,821,337号)。
用于制备双特异性抗体的方法是本领域中已知的。全长双特异性抗体的传统生产是基于两个免疫球蛋白重链/轻链对的共表达,其中两条链具有不同特异性。millstein等,nature,305:537-539(1983)。由于免疫球蛋白重链与轻链的随机分配,因此这些杂交瘤(四体瘤)产生10种不同抗体分子的潜在混合物,其中仅一种具有正确的双特异性结构。对正确分子的纯化(通常通过亲和色谱法步骤来进行)相当繁琐,并且产量较低。相似程序公开于wo93/08829和traunecker等,emboj.,10:3655-3659(1991)中。
根据一种不同方法,将具有所需结合特异性的抗体可变域(抗体-抗原结合位点)融合至免疫球蛋白恒定域序列。所述融合优选用包含铰链、ch2和ch3区的至少一部分的免疫球蛋白重链恒定域进行。优选的是含有为轻链结合所必需的位点的第一重链恒定区(ch1),存在于至少一种融合体中。将编码免疫球蛋白重链融合体和(如果需要)免疫球蛋白轻链的dna插入单独的表达载体中,并且共转染至合适的宿主生物体中。这在当不等比率的三条用于构建中的多肽链提供最佳产率时的实施方案中调节三个多肽片段的相互比例上提供了极大灵活性。然而,可能当相等比率的至少两条多肽链的表达造成高产率时或者当比率并非特别重要时将两条或所有三条多肽链的编码序列插入一个表达载体中。
在这种方法的一个优选实施方案中,双特异性抗体包含杂合免疫球蛋白重链,其中在一条臂上具有第一结合特异性,并且在另一条臂上具有杂合免疫球蛋白重链-轻链对(提供第二结合特异性)。发现这种不对称结构促进所需双特异性化合物从不希望的免疫球蛋白链组合中的分离,因为免疫球蛋白轻链在仅一半双特异性分子中的存在提供一种便利的分离方式。这种方法公开于wo94/04690中。关于产生双特异性抗体的进一步细节,参见例如suresh等,methodsinenzymology121:210(1986)。
根据wo96/27011或美国专利第5,731,168号中所述的另一种方法,一对抗体分子之间的界面可被工程化,以使得从重组细胞培养中回收的异二聚体的百分比最大。优选的界面包含抗体恒定域的ch3区的至少一部分。在这种方法中,来自第一抗体分子的界面的一条或多条小氨基酸侧链被较大侧链(例如酪氨酸或色氨酸)代替。与大侧链尺寸相同或相似的互补“腔”可通过将氨基酸大侧链用较小侧链(例如丙氨酸或苏氨酸)代替而在第二抗体分子的界面上产生。这提供一种增加异二聚体的产量使其超过其它不希望的终产物例如同二聚体产量的机制。
已经在文献中描述了从抗体片段生成双特异性抗体的技术。例如,可使用化学键制备双特异性抗体。brennan等,science229:81(1985)描述一种程序,其中完整抗体被蛋白水解裂解以生成f(ab')2片段。这些片段在二硫醇复合剂亚砷酸钠存在下还原,以使邻位二硫醇稳定并防止分子间二硫化物形成。然后使生成的fab'片段转化成硫硝基苯甲酸酯(tnb)衍生物。fab'-tnb衍生物之一随后恢复成fab'-tnb衍生物以形成双特异性抗体。所产生的双特异性抗体可用作选择性固定酶的试剂。
fab'片段可直接从大肠杆菌中回收并化学偶联以形成双特异性抗体。shalaby等,j.exp.med.175:217-225(1992)描述完全人源化的双特异性抗体f(ab')2分子的产生。各fab'片段分别从大肠杆菌中分泌并且经历体外直接化学偶联以形成双特异性抗体。由此形成的双特异性抗体能够结合过表达erbb2受体的细胞和正常的人类t细胞,并且还触发人类细胞毒性淋巴细胞针对人类乳腺肿瘤靶标的溶解活性。
还已描述了用于制备并从重组细胞培养物直接分离二价抗体片段的各种技术。例如,已使用亮氨酸拉链产生二价异二聚体。kostelny等,j.immunol.,148(5):1547-1553(1992)。将来自fos和jun蛋白的亮氨酸拉链肽通过基因融合连接至两种不同抗体的fab'部分。抗体同二聚体在铰链区处还原以形成单体,然后再次氧化以形成抗体异二聚体。由hollinger等,proc.natl.acad.sci.usa,90:6444-6448(1993)所述的“双抗体”技术已提供用于制备双特异性/二价抗体片段的替代机制。所述片段包含通过接头连接至轻链可变域(vl)上的重链可变域(vh),所述接头因太短以致于不能使同一条链上的两个结构域配对。因此,迫使一个片段的vh和vl域与另一片段的互补vl和vh域配对,从而形成两个抗原结合位点。还已报道通过使用单链fv(scfv)二聚体制备双特异性/二价抗体片段的另一策略。参见gruber等,j.immunol.,152:5368(1994)。
涵盖超过二价的抗体。例如,可制备三特异性抗体。tutt等,j.immunol.147:60(1991)。
示例性双特异性抗体可结合给定分子上的两个不同表位。或者,抗蛋白质臂可与结合白细胞上的触发分子例如t细胞受体分子(例如cd2、cd3、cd28或b7)或igg的fc受体(fcγr)例如fcγri(cd64)、fcγrii(cd32)和fcγriii(cd16)的臂组合,以使得细胞防御机制集中于表达特定蛋白质的细胞。双特异性抗体也可用于将细胞毒性剂定位于表达特定蛋白质的细胞。这些抗体具有蛋白结合臂和结合细胞毒性剂或放射性核素螯合剂例如eotube、dpta、dota或teta的臂。所关注的另一种双特异性抗体结合所关注的蛋白质并且进一步结合组织因子(tf)。
6)多价抗体
第一抗原结合部分可包含多价抗体。多价抗体可通过表达抗体所结合的抗原的细胞而比二价抗体更快地内化(和/或异化)。用作本申请的mabp中的第一抗原结合部分的抗体可以是具有三个或更多个抗原结合位点(例如四价抗体)的多价抗体(其不同于igm类别),其可容易通过重组表达编码抗体的多肽链的核酸产生。多价抗体可包含二聚化结构域和三个或更多个抗原结合位点。优选的二聚化结构域包含(或由以下组成)fc区或铰链区。在这种情形下,抗体将包含fc区和在fc区的氨基末端处的三个或更多个抗原结合位点。本文中的优选多价抗体包含(或由以下组成)三至约八个但优选四个抗原结合位点。多价抗体包含至少一条多肽链(并且优选两条多肽链),其中所述一条或多条多肽链包含两个或更多个可变域。例如,多肽链可包含vd1-(x1)n-vd2-(x2)n-fc,其中vd1是第一可变域,vd2是第二可变域,fc是fc区的一条多肽链,x1和x2表示氨基酸或多肽,并且n是0或1。例如,多肽链可包含:vh-ch1-柔性接头-vh-ch1-fc区链;或vh-ch1-vh-ch1-fc区链。本文中的多价抗体优选还包含至少两个(和优选四个)轻链可变域多肽。本文中的多价抗体可例如包含约二至约八个轻链可变域多肽。在此所涵盖的轻链可变域多肽包含轻链可变域并且任选地还包含cl结构域。
7)异结合物抗体
异结合物抗体也可用作本申请的mabp的第一抗原结合部分。异结合物抗体由两个共价接合的抗体构成。例如,异结合物中的一个抗体可偶联至抗生物素蛋白,另一者偶联至生物素。例如,美国专利第4,676,980号中已提出这些抗体用于将免疫系统细胞靶向不希望的细胞,并用于治疗hiv感染。wo91/00360、wo92/200373和ep0308936。预期可使用合成蛋白质化学中已知的方法(包括涉及交联剂的那些方法)在体外制备抗体。例如,使用二硫键交换反应或通过形成硫醚键构建免疫毒素。用于该目的的合适试剂的实例包括亚氨基硫醇酯和4-巯基丁酰亚氨酸甲基酯以及在例如美国专利第4,676,980号中所公开的那些。异结合物抗体可使用任何适宜的交联方法制得。合适的交联剂是本领域中熟知的,并且连同许多交联技术一起公开于美国专利第4,676,980号中。
8)效应功能工程化
可能需要修饰本申请的mabp的fc效应功能,例如以便修改(例如增强或消除)所述抗体的抗原依赖性细胞介导的细胞毒性(adcc)和/或补体依赖性细胞毒性(cdc)。在一个优选的实施方案中,mabp的fc效应功能得以降低或消除。这可通过在抗体的fc区中引入一个或多个氨基酸取代来实现。或者或另外,一个或多个半胱氨酸残基可引入fc区中,从而容许在该区域中形成链间二硫键。由此产生的同二聚mabp可具有改进的内化能力和/或提高的补体介导的细胞杀灭和抗体依赖性细胞毒性(adcc)。参见caron等,j.expmed.176:1191-1195(1992)和shopes,b.j.immunol.148:2918-2922(1992)。还可如wolff等,cancerresearch53:2560-2565(1993)中所述使用异双功能交联剂制备具有提高的抗肿瘤活性的同二聚抗体。或者,抗体可被工程化以具有双重fc区并且可由此具有提高的补体溶解和adcc能力。参见stevenson等,anti-cancerdrugdesign3:219-230(1989)。
为了延长抗体的血清半衰期,可如例如美国专利第5,739,277号中所述将补救受体结合表位并入mabp中。如本文所用,术语“补救受体结合表位”是指负责延长igg分子的体内血清半衰期的igg分子(例如,igg1、igg2、igg3或igg4)的fc区的表位。
9)其它氨基酸序列修饰
涵盖抗体(例如本文所述的mabp的单链抗体或抗体组分)的氨基酸序列修饰。例如,可能期望改进抗体的结合亲和力和/或其它生物性质。抗体的氨基酸序列变体可通过引入适当的核苷酸变化至抗体核酸中或者通过肽合成来制备。这类修饰包括例如抗体的氨基酸序列内的残基的缺失和/或插入和/或取代。可制造缺失、插入和取代的任何组合以获得最终构建体,前提条件是最终构建体具有所需特征。氨基酸变化还可改变抗体的翻译后加工,例如改变糖基化位点的数量或位置。
用于鉴定抗体中处于诱变优选位置的某些残基或区域的有效方法被称为“丙氨酸扫描诱变”,如由cunningham和wells在science,244:1081-1085(1989)中所述。在此,鉴定残基或靶残基的组(例如,带电残基,例如arg、asp、his、lys和glu)并由中性或带负电的氨基酸(最优选是丙氨酸或聚丙氨酸)代替以实现氨基酸抗原的相互作用。然后通过在取代位点或对于取代位点引入进一步或其它变体来改善经证实对取代具有功能敏感性的那些氨基酸位置。因此,尽管引入氨基酸序列变异的位点是预先确定的,但突变性质本身不一定是预先确定的。例如,为了分析在给定位点处突变的性能,在靶密码子或区域处进行ala扫描或随机诱变,并且关于所需活性对所表达的抗体变体进行筛选。
氨基酸序列插入物包括长度从一个残基至含有一百个或更多个残基的多肽的氨基和/或羧基末端融合体以及单个或多个氨基酸残基的序列内插入物。末端插入物的实例包括具有n末端甲硫氨酰基残基的抗体或融合至细胞毒性多肽的抗体。抗体分子的其它插入变体包括抗体的n末端或c末端与增加抗体的血清半衰期的酶(例如对于adept)或多肽的融合体。
另一类型的变体是氨基酸取代变体。这些变体在抗体分子中具有至少一个被不同残基代替的氨基酸残基。取代诱变最为关注的位点包括高变区,但还涵盖fr改变。保守取代在下表2中示于“优选取代”的标题下。如果这些取代引起生物学活性的改变,则可引入表2中命名为“示例性取代”的更实质性改变,或者如下文中关于氨基酸类别进一步所述引入取代,并且筛选产物。
表2.氨基酸取代
表2.氨基酸取代
在抗体的生物特性中的实质性修饰可通过选择对保持下列特征的作用显著不同的取代来实现:(a)多肽主链在取代的区域内的结构,例如作为折叠或螺旋构象,(b)在靶位点处的分子的电荷或疏水性,或(c)侧链的大小。天然存在的残基基于共同的侧链性质分成以下各组:
(1)疏水性:正亮氨酸、met、ala、val、leu、ile;
(2)中性亲水性:cys、ser、thr;
(3)酸性:asp、glu;
(4)碱性:asn、gln、his、lys、arg;
(5)影响链取向的残基:gly、pro;和
(6)芳族:trp、tyr、phe。
非保守取代将需要用另一类别更换这些类别中的一类的成员。
未参与保持抗体的适当构象的任何半胱氨酸残基一般还可被丝氨酸取代,以便改进分子的氧化稳定性并防止异常交联。相反,可添加一个或多个半胱氨酸键以改进其稳定性(特别是当抗体是抗体片段例如fv片段时)。
取代变体的特别优选的类型涉及取代亲本抗体(例如,人源化或人类抗体)的一个或多个高变区残基。一般来说,选择用于进一步开发的所得变体相对于产生其的亲本抗体应具有改进的生物学特性。用于产生这类取代变体的一种适宜方法涉及使用噬菌体展示进行亲和力成熟。简言之,使若干高变区位点(例如6-7个位点)突变,以在各个位点处产生所有可能的氨基取代。如此产生的抗体变体以单价形式展示在丝状噬菌体颗粒上,作为与各个颗粒内包装的m13的基因iii产物的融合体。然后筛选噬菌体展示变体是否具有本文所公开的生物学活性(例如结合亲和力)。为了鉴定用于修饰的候选高变区位点,可进行丙氨酸扫描诱变来鉴定对抗原结合具有重要贡献的高变区残基。或者或另外,分析抗原-抗体复合体的晶体结构以鉴定抗体与其靶标(例如pd-l1、b7.1)之间的接触点也是有利的。这些接触残基和相邻残基是根据本文中详述的技术取代的候选物。一旦产生这些变体,如本文所述对变体组进行筛选,并且可选出在一个或多个相关测定中具有优良特性的抗体以供进一步开发。
抗体的另一种类型的氨基酸变体改变抗体的原始糖基化模式。改变意味着缺失抗体中可见的一个或多个碳水化合物部分,和/或添加抗体中不存在的一个或多个糖基化位点。
抗体的糖基化通常是n-连接或o-连接的。n-连接是指碳水化合物部分与天冬酰胺残基的侧链的连接。三肽序列天冬酰胺-x-丝氨酸和天冬酰胺-x-苏氨酸(其中x是除脯氨酸之外的任何氨基酸)是用于碳水化合物部分酶促连接至天冬酰胺侧链的识别序列。因此,这些三肽序列中的任一者在多肽中的存在产生潜在的糖基化位点。o-连接的糖基化是指糖n-乙酰基半乳糖胺、半乳糖或木糖中的一者与羟氨基酸,最通常丝氨酸或苏氨酸的连接,但还可使用5-羟脯氨酸或5-羟赖氨酸。
糖基化位点向抗体中的添加宜通过改变氨基酸序列以使得其含有上述三肽序列中的一个或多个(对于n-连接的糖基化位点)来实现。所述变化还可通过添加一个或多个丝氨酸或苏氨酸残基至原始抗体的序列中或通过一个或多个丝氨酸或苏氨酸的取代来制造(对于o-连接的糖基化位点)。
编码本申请的mabp的氨基酸序列变体的核酸分子是通过本领域中已知的多种方法来制备。这些方法包括但不限于从天然来源分离(在天然存在的氨基酸序列变体的情况下),或通过对较早制备的变体或非变体形式进行寡核苷酸介导的(或定点)诱变、pcr诱变或盒式诱变来制备。
10)其它修饰
本申请的mabp可进一步被修饰以含有本领域中已知并且容易获得的额外的非蛋白质部分。优选地,适用于抗体衍生化的部分是水溶性聚合物。水溶性聚合物的非限制性实例包括但不限于聚乙二醇(peg)、乙二醇/丙二醇的共聚物、羧甲基纤维素、葡聚糖、聚乙烯醇、聚乙烯吡咯烷酮、聚-1,3-二氧戊环、聚-1,3,6-三噁烷、乙烯/顺丁烯二酸酐共聚物、聚氨基酸(均聚物或随机共聚物)和葡聚糖或聚(n-乙烯基吡咯烷酮)聚乙二醇、聚丙二醇均聚物、聚环氧丙烷/环氧乙烷共聚物、聚氧乙烯化多元醇(例如甘油)、聚乙烯醇及其混合物。聚乙二醇丙醛由于在水中的稳定性而在制造上具有优势。聚合物可具有任何分子量,并且可以是分支或未分支的。连接于抗体上的聚合物的数目可变化,并且如果连接一个以上聚合物,则它们可以是相同或不同分子。一般来说,用于衍生化的聚合物的数目和/或类型可基于以下考虑因素确定,所述因素包括但不限于:待改进的抗体的具体特性或功能,抗体衍生物是否将用于治疗特定疾患等。这些技术和其它合适的制剂公开于remington:thescienceandpracticeofpharmacy,第20版,alfonsogennaro编,philadelphiacollegeofpharmacyandscience(2000)中。
vi.试剂盒和制造物品
还提供了包含任何一种本文所述的mabp的试剂盒、单位剂量和制造物品。在一些实施方案中,提供一种试剂盒,所述试剂盒包含任何一种本文所述的药物组合物并且优选提供其使用说明书。
本申请的试剂盒是适当包装的。合适的包装包括但不限于小瓶、瓶子、广口瓶、软包装(例如密封的聚酯胶膜(mylar)或塑料袋)等。试剂盒可任选地提供额外的组分,例如缓冲液和解释信息。因此,本申请还提供制造物品,其包括小瓶(例如密封小瓶)、瓶子、广口瓶、软包装等。
所述制造物品可包括容器和在容器上或与容器相关联的标签或包装插页。合适的容器包括例如瓶子、小瓶、注射器等。容器可由多种材料例如玻璃或塑料形成。一般来说,容器装有可有效治疗本文所述的疾病或病症的组合物,并且可具有无菌输液港(例如,所述容器可以是具有皮下注射针头可刺穿的塞子的静脉内溶液袋或小瓶)。标签或包装插页指示所述组合物用于治疗个体的特定疾患。标签或包装插页还将包含用于向个体施用组合物的说明书。标签可标明重构和/或使用的指导。装有药物组合物的容器可以是多次使用的小瓶,其允许重构制剂的重复施用(例如,2-6次施用)。包装插页是指通常包括在治疗性产品的商业包装中的说明书,其包括关于适应症、用法、剂量、施用、禁忌症的信息和/或有关使用这类治疗性产品的警告。另外,所述制造物品还可包括第二容器,所述第二容器包含药学上可接受的缓冲液,例如抑菌注射用水(bwfi)、磷酸盐缓冲盐水、林格氏溶液和右旋糖溶液。其还可包括商业和用户角度期望的其它材料,包括其它缓冲液、稀释剂、滤器、针头和注射器。
所述试剂盒或制造物品可包括药物组合物的多个单位剂量和使用说明书,以足够在药房(例如医院药房和调配药房)中储存和使用的量包装。
实施例
以下实施例旨在仅是本发明的示例并且因此不应视为以任何方式限制本发明。以下实施例和详细说明是作为说明而非作为限制提供。
实施例1:pd-1/tigit/lag-3三特异性抗原结合蛋白的构建和表达
该实施例描述示例性pd-1/tigit/lag-3三特异性抗原结合蛋白(tabp)的构建和表达。设计并表达10个构建体(tptl11-tptl20),其各自包含如下两个多肽。抗pd-1抗体来源于派姆单抗。抗tigitvhh来源于as19584vh28(seqidno:31)。抗lag-3vhh来源于vhh2(seqidno:32)。
tptl11:第一多肽从n末端至c末端包含:抗tigitvhh、肽接头和抗pd-1抗体的重链;并且第二多肽从n末端至c末端包含:抗lag-3vhh、肽接头和抗pd-1抗体的轻链。参见图1。
tptl12:第一多肽从n末端至c末端包含:抗tigitvhh、肽接头、抗lag-3vhh、肽接头和抗pd-1抗体的重链;并且第二多肽包含抗pd-1抗体的轻链。参见图2。
tptl13:第一多肽包含抗pd-1抗体的重链;并且第二多肽从n末端至c末端包含:抗tigitvhh、肽接头、抗lag-3vhh、肽接头和抗pd-1抗体的轻链。参见图3。
tptl14:第一多肽包含抗pd-1抗体的重链;并且第二多肽从n末端至c末端包含:抗tigitvhh、肽接头、抗pd-1抗体的轻链、肽接头和抗lag-3vhh。参见图4。
tptl15:第一多肽从n末端至c末端包含:抗tigitvhh、肽接头和抗pd-1抗体的重链;并且第二多肽从n末端至c末端包含:抗pd-1抗体的轻链、肽接头和抗lag-3vhh。参见图5。
tptl16:第一多肽从n末端至c末端包含:抗tigitvhh、肽接头、抗pd-1抗体的重链、肽接头和抗lag-3vhh;并且第二多肽包含抗pd-1抗体的轻链。参见图6。
tptl17:第一多肽从n末端至c末端包含:抗pd-1抗体的重链、肽接头和抗lag-3vhh;并且第二多肽从n末端至c末端包含:抗tigitvhh、肽接头和抗pd-1抗体的轻链。参见图7。
tptl18:第一多肽从n末端至c末端包含:抗pd-1抗体的重链、肽接头和抗tigitvhh;并且第二多肽从n末端至c末端包含:抗pd-1抗体的轻链、肽接头和抗lag-3vhh。参见图8。
tptl19:第一多肽包含抗pd-1抗体的重链;并且第二多肽从n末端至c末端包含:抗pd-1抗体的轻链、肽接头、抗lag-3vhh、肽接头和抗tigitvhh。参见图9。
tptl20:第一多肽从n末端至c末端包含:抗pd-1抗体的重链、肽接头、抗lag-3vhh、肽接头和抗tigitvhh;并且第二多肽包含抗pd-1抗体的轻链。参见图10。
每个tabp由第一多肽的两条链和第二多肽的两条链组成。将s228p突变引入igg4fc区中以抑制fab臂交换。此外,tabp的fc区可用不同同型(例如igg1同型)的iggfc交换。igg4同型的fc区对fcγr具有低结合亲和力,并且因此在一些实施方案中在避免pd-1、tigit或lag-3阳性细胞的adcc介导的耗竭上优于igg1同型。
生成表达10个pd-1/tigit/lag-3tabp构建体中的每一者的cho-k1细胞。cho-k1细胞用于表达tabp,通过经由含蛋白a琼脂糖树脂的柱接着是尺寸排阻柱的色谱法对tabp进行纯化。与10个tabp(tptl11-tptl20)的产生有关的数据概述于图11中。示例性tabp的氨基酸序列提供于表3中。
实施例2:pd-1/tigit/lag-3tabp的结合亲和力
纯化之后,测量tabp的结合亲和力参数并且与相应的单特异性抗体(例如,抗pd-1抗体派姆单抗
简言之,为了测定与pd-1的结合亲和力,将各tabp或派姆单抗经由抗人类fc抗体捕获于
为了测定与tigit的结合亲和力,将各tabp或as19584vh28hcab经由抗人类fc抗体捕获于
为了测定与lag-3的结合亲和力,将各tabp或vhh2hcab固定至
实施例3:pd-1/tigit/lag-3tabp的基于facs的表征
在如下所述的基于facs的测定中测试实施例1中制备的pd-1/tigit/lag-3tabp以评价其针对pd-1、tigit和lag-3的靶结合能力。
靶结合
使用基于facs的测定来确定pd-1/tigit/lag-3tabp(tptl11-tptl20)与cho细胞上表达的人类pd-1的结合。使表达人类pd-1的cho细胞从粘附培养瓶上分离并与变化浓度的各tabp、派姆单抗(
使用基于facs的测定来确定pd-1/tigit/lag-3tabp(tptl11-tptl20)与cho细胞上表达的人类tigit的结合。使表达人类tigit的cho细胞从粘附培养瓶上分离并与变化浓度的各tabp、as19584vh28hcab(作为阳性对照)或人类igg(作为阴性对照)在96孔板中混合。混合物在室温下平衡30分钟,并且用facs缓冲液(含有1%bsa的pbs)洗涤三次。然后添加用作二级抗体的fitc结合的抗人类fc抗体(jacksonimmunoresearch),并且在室温下培育混合物15分钟。将细胞用facs缓冲液再次洗涤并通过流式细胞术分析。使用非线性回归,用prismtm(graphpadsoftware,sandiego,ca)分析数据,并且计算ec50值。如图15所示,facs结合测定显示,tptl11-tptl20展现出与as19584vh28hcab相当的tigit结合能力,其中ec50值在2倍之内。
使用基于facs的测定来确定pd-1/tigit/lag-3tabp(tptl11-tptl20)与cho细胞上表达的人类lag-3的结合。使表达人类lag-3的cho细胞从粘附培养瓶上分离并与变化浓度的各tabp、vhh2hcab(作为阳性对照)或人类igg(作为阴性对照)在96孔板中混合。混合物在室温下平衡30分钟,并且用facs缓冲液(含有1%bsa的pbs)洗涤三次。然后添加用作二级抗体的fitc结合的抗人类fc抗体(jacksonimmunoresearch),并且在室温下培育15分钟。将细胞用facs缓冲液再次洗涤并通过流式细胞术分析。使用非线性回归,用prismtm(graphpadsoftware,sandiego,ca)分析数据,并且计算ec50值。如图15所示,facs结合测定显示,大多数tabp(tptl11-tptl13、tptl15-tptl18和tptl20)展现出与vhh2hcab相当的lag-3结合能力,其中ec50值在4倍之内。tptl14和tptl19对lag-3的结合亲和力比vhh2hcab弱5倍。
配体结合的抑制
还通过facs测定评价tabp对配体结合的抑制。为了评价tabp(tptl11-tptl20)对pd-l1和pd-l2与pd-1的结合的抑制,将表达人类pd-1的cho细胞从粘附培养瓶上分离并与变化浓度的各tabp和恒定浓度的具有生物素标记的hpd-l1fc或pd-l2fc融合蛋白混合。各混合物在室温下平衡30分钟,并且用facs缓冲液(含有1%bsa的pbs)洗涤三次。然后将pe/cy5链霉亲和素二级抗体添加至各混合物中并在室温下培育15分钟。随后将细胞用facs缓冲液洗涤并通过流式细胞术分析。使用非线性回归,用prismtm(graphpadsoftware,sandiego,ca)分析数据,并且计算ic50值。如图15所示,竞争测定显示tabp在低浓度(1-10μg/ml)下有效抑制pd-1/pd-l1和pd-1/pd-l2相互作用的能力。所有10个tabp具有相当的配体阻断活性,其中ic50值在3倍之内。
为了评价tabp(tptl11-tptl20)对cd155与tigit的结合的抑制,将表达人类tigit细胞的cho细胞从粘附培养瓶上分离并与变化浓度的各tabp和恒定浓度的具有生物素标记的hcd155fc融合蛋白混合。各混合物在室温下平衡30分钟,并且用facs缓冲液(含有1%bsa的pbs)洗涤三次。然后将pe/cy5链霉亲和素二级抗体添加至各混合物中并在室温下培育15分钟。随后将细胞用facs缓冲液再次洗涤并通过流式细胞术分析。使用非线性回归,用prismtm(graphpadsoftware,sandiego,ca)分析数据,并且计算ic50值。如图15所示,竞争测定显示tabp在低浓度(1-10μg/ml)下有效抑制tigit-cd155相互作用的能力。所有10个tabp具有相当的配体阻断活性,其中ic50值在3倍之内。tptl11-tptl17展现出比tptl18-tptl20更强的抑制活性,其表明与抗pd-1抗体的重链的c末端的融合可抑制抗tigitsdab与其靶标的结合。
为了评价tabp(tptl11-tptl20)对lag-3配体结合的抑制,将表达人类tigit配体(mhcii类)的a375细胞从粘附培养瓶上分离并与变化浓度的各tabp和恒定浓度的具有生物素标记的lag-3fc融合蛋白混合。各混合物在室温下平衡30分钟,并且用facs缓冲液(含有1%bsa的pbs)洗涤三次。然后将pe/cy5链霉亲和素二级抗体添加至各混合物中并在室温下培育15分钟。随后将细胞用facs缓冲液再次洗涤并通过流式细胞术分析。使用非线性回归,用prismtm(graphpadsoftware,sandiego,ca)分析数据,并且计算ic50值。如图15所示,竞争测定显示tabp在低浓度(1-10μg/ml)下有效抑制lag-3-mhcii相互作用的能力。tptl12、tptl17和tptl18显示针对lag-3配体结合的降低的抑制活性。
实施例4:pd-1/tigit/lag-3tabp的可开发性
在如下所述的可开发性测定中测试实施例1中制备的pd-1/tigit/lag-3tabp以评价其稳定性。
起始聚集温度(t聚集)
使用dynapronanostar(wyatt,santabarbara,california)对5mg/ml的样品进行以约0.75℃的温度间隔从25℃至80℃的温度斜线上升。将20μl的各蛋白质样品添加至wyatt一次性试管中,接着用10μl矿物油(sigma8410)覆盖样品以防止蒸发。对各蛋白质样品的一式三份测量(5次采集/每次测量)取平均值。
在具有选定温度间隔的实验的持续期间,热扫描频率被计算为1.5℃/min。测量各样品,同时连续加热温度直至靶温度达到80℃(~40分钟)。在dynamics7.6.0.48软件(wyatt,santabarbara,california)中用起始分析法分析聚集温度(t聚集)。
如图16所示,tptl11、tptl19和tptl20的t聚集与其余tabp相比相对较低,表明这三种tabp不如其它tabp稳定。
冻融过程(5个冻融循环)
测试pd-1/tigit/lag-3tabp(tptl11-tptl20)持续5个重复冻融循环。将各样品在特殊缓冲液(ph6.0,4%蔗糖、50mm组氨酸、50mm精氨酸)中浓缩至50mg/ml,然后制备两份样品,一份在-80℃下冷冻作为对照,另一份用5个冻融循环测试;对于每轮冻融循环,在-80℃下进行冷冻至少3小时,然后在室温下解冻至少2小时,之后再次冷冻回到-80℃;
在5个冻融循环之后,用sec-hplc测定样品。针对对照来计算经历冻融循环的样品的主峰高度,获得的比率是回收率。认为超过90%的回收率通过冻融循环标准。如图17所示,tptl18、tptl19和tptl20的回收率低于90%。tptl11-tptl17的回收率超过90%。
人类血清稳定性
选择tptl11-tptl17tabp用于人类血清稳定性评估。有待测试的抗体被制备成在50%人类血清中0.5mg/ml的浓度。然后对溶液进行等分以分别在37℃下培育0天、1天、7天和14天,当培育完成时将各等分试样在-20℃下储存。
当所有样品都已准备好时,通过elisa测量各样品的结合活性(ec50值),其中第0天样品作为100%活性对照。在该实验中,测定tabp11-tabp17tabp对人类tigit、人类lag-3和人类pd-1的结合活性。在96孔板上以2μg/ml包被人类tigit、人类lag-3和人类pd-1的抗原蛋白过夜。阻断之后,将连续浓度的tptl11-tptl17tabp添加至被包被的孔中。浓度起始于5μg/ml,以3倍稀释。使用非线性回归,用prismtm(graphpadsoftware,sandiego,ca)分析数据,并且计算ec50值。在第0天将所有样品的ec50值设定为100%。通过(第1/7/14天的ec50-第0天的ec50)/第0天的ec50确定第1天、第7天和第14天的ec50值的变化。图18a示出tabp11-tabp17tabp对人类tigit的结合活性。图18b示出tabp11-tabp17tabp对人类lag-3的结合活性。图18c示出tabp11-tabp17tabp对人类pd-1的结合活性。如图中所示,tptl-12、tptl-15和tptl-16对人类tigit具有与阳性对照抗体as19584vh28hcab相当的结合。tptl-14、tptl-15和tptl-17对人类lag-3具有与阳性对照抗体vhh2hcab相当的结合。tptl-13、tptl-14、tptl-15、tptl-16和tptl-17对人类pd-1具有与阳性对照抗体keytruda生物仿制药相当的结合。
本公开内容中的所有引用文献特此通过引用明确并入。
序列表
seqidno:1ggggsgggs
seqidno:2ggggsggggsggggs
seqidno:3epkssdkthtsppsp
seqidno:4(gs)n
seqidno:5(gsggs)n
seqidno:6(gggs)n
seqidno:7epkscdkthtcppcp
seqidno:8keytruda重链
qvqlvqsgvevkkpgasvkvsckasgytftnyymywvrqapgqglewmgginpsnggtnfnekfknrvtlttdsstttaymelkslqfddtavyycarrdyrfdmgfdywgqgttvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk
seqidno:9keytruda轻链
eivltqspatlslspgeratlscraskgvstsgysylhwyqqkpgqaprlliylasylesgvparfsgsgsgtdftltisslepedfavyycqhsrdlpltfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
seqidno:10keytrudavh域
qvqlvqsgvevkkpgasvkvsckasgytftnyymywvrqapgqglewmgginpsnggtnfnekfknrvtlttdsstttaymelkslqfddtavyycarrdyrfdmgfdywgqgttvtvss
seqidno:11keytrudavl域
eivltqspatlslspgeratlscraskgvstsgysylhwyqqkpgqaprlliylasylesgvparfsgsgsgtdftltisslepedfavyycqhsrdlpltfgggtkveikr
seqidno:12人类pd-1
pgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqtlvvgvvggllgslvllvwvlavicsraargtigarrtgqplkedpsavpvfsvdygeldfqwrektpeppvpcvpeqteyativfpsgmgtssparrgsadgprsaqplrpedghcswpl
seqidno:13人类tigit
mmtgtiettgnisaekggsiilqchlssttaqvtqvnweqqdqllaicnadlgwhispsfkdrvapgpglgltlqsltvndtgeyfciyhtypdgtytgriflevlessvaehgarfqipllgamaatlvvictavivvvaltrkkkalrihsvegdlrrksagqeewspsapsppgscvqaeaapaglcgeqrgedcaelhdyfnvlsyrslgncsfftetg
seqidno:14人类lag-3
vpvvwaqegapaqlpcsptiplqdlsllrragvtwqhqpdsgppaaapghplapgphpaapsswgprprrytvlsvgpgglrsgrlplqprvqldergrqrgdfslwlrparradageyraavhlrdralscrlrlrlgqasmtasppgslrasdwvilncsfsrpdrpasvhwfrnrgqgrvpvresphhhlaesflflpqvspmdsgpwgciltyrdgfnvsimynltvlglepptpltvyagagsrvglpcrlpagvgtrsfltakwtppgggpdllvtgdngdftlrledvsqaqagtytchihlqeqqlnatvtlaiitvtpksfgspgslgkllcevtpvsgqerfvwssldtpsqrsfsgpwleaqeaqllsqpwqcqlyqgerllgaavyftelsspgaqrsgrapgalpaghlllflilgvlsllllvtgafgfhlwrrqwrprrfsaleqgihppqaqskieeleqepepepepepepepepepeql
表3pd-1/tigit/lag-3三特异性抗原结合蛋白(tabp)氨基酸序列的示例(接头序列呈粗体)
seqidno:29as19584vh28hcab
evqlvesggglvqpggslrlscaasgykygvysmgwfrqapgkglegvsaicsggrttysdsvkgrftisrdnsnqilylqmnslraedtavyycaarplwtgdcdlssswyktwgqgtlvtvsseskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk
seqidno:30vhh2hcab
evqlvesggglvqpggslrlscaasgytvssycmgwfrqapgkgregvsaidsdgsvsyadsvkgrftiskdnskntlylqmnslraedtavyfcaadlcwvdqdqgeyntwgqgtlvtvsseskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk
seqidno:31as19584vh28sdab
evqlvesggglvqpggslrlscaasgykygvysmgwfrqapgkglegvsaicsggrttysdsvkgrftisrdnsnqilylqmnslraedtavyycaarplwtgdcdlssswyktwgqgtlvtvss
seqidno:32vhh2sdab
evqlvesggglvqpggslrlscaasgytvssycmgwfrqapgkgregvsaidsdgsvsyadsvkgrftiskdnskntlylqmnslraedtavyfcaadlcwvdqdqgeyntwgqgtlvtvss
序列表
<110>南京传奇生物科技有限公司(nanjinglegendbiotechco.,ltd.)
<120>多特异性抗原结合蛋白及其使用方法
<130>2
<150>pct/cn2018/071729
<151>2018-01-08
<160>32
<170>patentinversion3.5
<210>1
<211>9
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>接头
<400>1
glyglyglyglyserglyglyglyser
15
<210>2
<211>15
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>接头
<400>2
glyglyglyglyserglyglyglyglyserglyglyglyglyser
151015
<210>3
<211>15
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>接头
<400>3
gluprolysserserasplysthrhisthrserproproserpro
151015
<210>4
<211>2
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>接头
<220>
<221>变体
<222>(1)..(2)
<223>可以一个或多个重复序列存在
<400>4
glyser
1
<210>5
<211>5
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>接头
<220>
<221>变体
<222>(1)..(5)
<223>可以一个或多个重复序列存在
<400>5
glyserglyglyser
15
<210>6
<211>4
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>接头
<220>
<221>变体
<222>(1)..(4)
<223>可以一个或多个重复序列存在
<400>6
glyglyglyser
1
<210>7
<211>15
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>接头
<400>7
gluprolyssercysasplysthrhisthrcysproprocyspro
151015
<210>8
<211>447
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>keytruda重链
<400>8
glnvalglnleuvalglnserglyvalgluvallyslysproglyala
151015
servallysvalsercyslysalaserglytyrthrphethrasntyr
202530
tyrmettyrtrpvalargglnalaproglyglnglyleuglutrpmet
354045
glyglyileasnproserasnglyglythrasnpheasnglulysphe
505560
lysasnargvalthrleuthrthraspserserthrthrthralatyr
65707580
metgluleulysserleuglnpheaspaspthralavaltyrtyrcys
859095
alaargargasptyrargpheaspmetglypheasptyrtrpglygln
100105110
glythrthrvalthrvalserseralaserthrlysglyproserval
115120125
pheproleualaprocysserargserthrsergluserthralaala
130135140
leuglycysleuvallysasptyrpheprogluprovalthrvalser
145150155160
trpasnserglyalaleuthrserglyvalhisthrpheproalaval
165170175
leuglnserserglyleutyrserleuserservalvalthrvalpro
180185190
serserserleuglythrlysthrtyrthrcysasnvalasphislys
195200205
proserasnthrlysvalasplysargvalgluserlystyrglypro
210215220
procysproprocysproalaproglupheleuglyglyproserval
225230235240
pheleupheproprolysprolysaspthrleumetileserargthr
245250255
progluvalthrcysvalvalvalaspvalserglngluaspproglu
260265270
valglnpheasntrptyrvalaspglyvalgluvalhisasnalalys
275280285
thrlysproargglugluglnpheasnserthrtyrargvalvalser
290295300
valleuthrvalleuhisglnasptrpleuasnglylysglutyrlys
305310315320
cyslysvalserasnlysglyleuproserserileglulysthrile
325330335
serlysalalysglyglnproarggluproglnvaltyrthrleupro
340345350
proserglngluglumetthrlysasnglnvalserleuthrcysleu
355360365
vallysglyphetyrproseraspilealavalglutrpgluserasn
370375380
glyglnprogluasnasntyrlysthrthrproprovalleuaspser
385390395400
aspglyserphepheleutyrserargleuthrvalasplysserarg
405410415
trpglngluglyasnvalphesercysservalmethisglualaleu
420425430
hisasnhistyrthrglnlysserleuserleuserleuglylys
435440445
<210>9
<211>218
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>keytruda轻链
<400>9
gluilevalleuthrglnserproalathrleuserleuserprogly
151015
gluargalathrleusercysargalaserlysglyvalserthrser
202530
glytyrsertyrleuhistrptyrglnglnlysproglyglnalapro
354045
argleuleuiletyrleualasertyrleugluserglyvalproala
505560
argpheserglyserglyserglythraspphethrleuthrileser
65707580
serleugluprogluaspphealavaltyrtyrcysglnhisserarg
859095
aspleuproleuthrpheglyglyglythrlysvalgluilelysarg
100105110
thrvalalaalaproservalpheilepheproproseraspglugln
115120125
leulysserglythralaservalvalcysleuleuasnasnphetyr
130135140
proargglualalysvalglntrplysvalaspasnalaleuglnser
145150155160
glyasnserglngluservalthrgluglnaspserlysaspserthr
165170175
tyrserleuserserthrleuthrleuserlysalaasptyrglulys
180185190
hislysvaltyralacysgluvalthrhisglnglyleuserserpro
195200205
valthrlysserpheasnargglyglucys
210215
<210>10
<211>120
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>keytrudavh结构域
<400>10
glnvalglnleuvalglnserglyvalgluvallyslysproglyala
151015
servallysvalsercyslysalaserglytyrthrphethrasntyr
202530
tyrmettyrtrpvalargglnalaproglyglnglyleuglutrpmet
354045
glyglyileasnproserasnglyglythrasnpheasnglulysphe
505560
lysasnargvalthrleuthrthraspserserthrthrthralatyr
65707580
metgluleulysserleuglnpheaspaspthralavaltyrtyrcys
859095
alaargargasptyrargpheaspmetglypheasptyrtrpglygln
100105110
glythrthrvalthrvalserser
115120
<210>11
<211>112
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>keytrudavl结构域
<400>11
gluilevalleuthrglnserproalathrleuserleuserprogly
151015
gluargalathrleusercysargalaserlysglyvalserthrser
202530
glytyrsertyrleuhistrptyrglnglnlysproglyglnalapro
354045
argleuleuiletyrleualasertyrleugluserglyvalproala
505560
argpheserglyserglyserglythraspphethrleuthrileser
65707580
serleugluprogluaspphealavaltyrtyrcysglnhisserarg
859095
aspleuproleuthrpheglyglyglythrlysvalgluilelysarg
100105110
<210>12
<211>268
<212>prt
<213>智人(homosapiens)
<400>12
proglytrppheleuaspserproaspargprotrpasnproprothr
151015
pheserproalaleuleuvalvalthrgluglyaspasnalathrphe
202530
thrcysserpheserasnthrsergluserphevalleuasntrptyr
354045
argmetserproserasnglnthrasplysleualaalapheproglu
505560
aspargserglnproglyglnaspcysargpheargvalthrglnleu
65707580
proasnglyargaspphehismetservalvalargalaargargasn
859095
aspserglythrtyrleucysglyalaileserleualaprolysala
100105110
glnilelysgluserleuargalagluleuargvalthrgluargarg
115120125
alagluvalprothralahisproserproserproargproalagly
130135140
glnpheglnthrleuvalvalglyvalvalglyglyleuleuglyser
145150155160
leuvalleuleuvaltrpvalleualavalilecysserargalaala
165170175
argglythrileglyalaargargthrglyglnproleulysgluasp
180185190
proseralavalprovalpheservalasptyrglygluleuaspphe
195200205
glntrpargglulysthrprogluproprovalprocysvalproglu
210215220
glnthrglutyralathrilevalpheproserglymetglythrser
225230235240
serproalaargargglyseralaaspglyproargseralaglnpro
245250255
leuargprogluaspglyhiscyssertrpproleu
260265
<210>13
<211>223
<212>prt
<213>智人(homosapiens)
<400>13
metmetthrglythrilegluthrthrglyasnileseralaglulys
151015
glyglyserileileleuglncyshisleuserserthrthralagln
202530
valthrglnvalasntrpgluglnglnaspglnleuleualailecys
354045
asnalaaspleuglytrphisileserproserphelysaspargval
505560
alaproglyproglyleuglyleuthrleuglnserleuthrvalasn
65707580
aspthrglyglutyrphecysiletyrhisthrtyrproaspglythr
859095
tyrthrglyargilepheleugluvalleugluserservalalaglu
100105110
hisglyalaargpheglnileproleuleuglyalametalaalathr
115120125
leuvalvalilecysthralavalilevalvalvalalaleuthrarg
130135140
lyslyslysalaleuargilehisservalgluglyaspleuargarg
145150155160
lysseralaglyglngluglutrpserproseralaproserpropro
165170175
glysercysvalglnalaglualaalaproalaglyleucysglyglu
180185190
glnargglygluaspcysalagluleuhisasptyrpheasnvalleu
195200205
sertyrargserleuglyasncysserphephethrgluthrgly
210215220
<210>14
<211>497
<212>prt
<213>智人(homosapiens)
<400>14
valprovalvaltrpalaglngluglyalaproalaglnleuprocys
151015
serprothrileproleuglnaspleuserleuleuargargalagly
202530
valthrtrpglnhisglnproaspserglyproproalaalaalapro
354045
glyhisproleualaproglyprohisproalaalaprosersertrp
505560
glyproargproargargtyrthrvalleuservalglyproglygly
65707580
leuargserglyargleuproleuglnproargvalglnleuaspglu
859095
argglyargglnargglyasppheserleutrpleuargproalaarg
100105110
argalaaspalaglyglutyrargalaalavalhisleuargasparg
115120125
alaleusercysargleuargleuargleuglyglnalasermetthr
130135140
alaserproproglyserleuargalaserasptrpvalileleuasn
145150155160
cysserpheserargproaspargproalaservalhistrpphearg
165170175
asnargglyglnglyargvalprovalarggluserprohishishis
180185190
leualagluserpheleupheleuproglnvalserprometaspser
195200205
glyprotrpglycysileleuthrtyrargaspglypheasnvalser
210215220
ilemettyrasnleuthrvalleuglyleugluproprothrproleu
225230235240
thrvaltyralaglyalaglyserargvalglyleuprocysargleu
245250255
proalaglyvalglythrargserpheleuthralalystrpthrpro
260265270
proglyglyglyproaspleuleuvalthrglyaspasnglyaspphe
275280285
thrleuargleugluaspvalserglnalaglnalaglythrtyrthr
290295300
cyshisilehisleuglngluglnglnleuasnalathrvalthrleu
305310315320
alaileilethrvalthrprolysserpheglyserproglyserleu
325330335
glylysleuleucysgluvalthrprovalserglyglngluargphe
340345350
valtrpserserleuaspthrproserglnargserpheserglypro
355360365
trpleuglualaglnglualaglnleuleuserglnprotrpglncys
370375380
glnleutyrglnglygluargleuleuglyalaalavaltyrphethr
385390395400
gluleuserserproglyalaglnargserglyargalaproglyala
405410415
leuproalaglyhisleuleuleupheleuileleuglyvalleuser
420425430
leuleuleuleuvalthrglyalapheglyphehisleutrpargarg
435440445
glntrpargproargargpheseralaleugluglnglyilehispro
450455460
proglnalaglnserlysileglugluleugluglngluproglupro
465470475480
gluprogluprogluprogluprogluprogluprogluproglugln
485490495
leu
<210>15
<211>355
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>tptl-11轻链
<400>15
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglytyrthrvalsersertyr
202530
cysmetglytrppheargglnalaproglylysglyarggluglyval
354045
seralaileaspseraspglyservalsertyralaaspservallys
505560
glyargphethrileserlysaspasnserlysasnthrleutyrleu
65707580
glnmetasnserleuargalagluaspthralavaltyrphecysala
859095
alaaspleucystrpvalaspglnaspglnglyglutyrasnthrtrp
100105110
glyglnglythrleuvalthrvalsersergluprolysserserasp
115120125
lysthrhisthrserproproserprogluilevalleuthrglnser
130135140
proalathrleuserleuserproglygluargalathrleusercys
145150155160
argalaserlysglyvalserthrserglytyrsertyrleuhistrp
165170175
tyrglnglnlysproglyglnalaproargleuleuiletyrleuala
180185190
sertyrleugluserglyvalproalaargpheserglyserglyser
195200205
glythraspphethrleuthrileserserleugluprogluaspphe
210215220
alavaltyrtyrcysglnhisserargaspleuproleuthrphegly
225230235240
glyglythrlysvalgluilelysargthrvalalaalaproserval
245250255
pheilepheproproseraspgluglnleulysserglythralaser
260265270
valvalcysleuleuasnasnphetyrproargglualalysvalgln
275280285
trplysvalaspasnalaleuglnserglyasnserglngluserval
290295300
thrgluglnaspserlysaspserthrtyrserleuserserthrleu
305310315320
thrleuserlysalaasptyrglulyshislysvaltyralacysglu
325330335
valthrhisglnglyleuserserprovalthrlysserpheasnarg
340345350
glyglucys
355
<210>16
<211>587
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>tptl-11重链
<400>16
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglytyrlystyrglyvaltyr
202530
sermetglytrppheargglnalaproglylysglyleugluglyval
354045
seralailecysserglyglyargthrthrtyrseraspservallys
505560
glyargphethrileserargaspasnserasnglnileleutyrleu
65707580
glnmetasnserleuargalagluaspthralavaltyrtyrcysala
859095
alaargproleutrpthrglyaspcysaspleusersersertrptyr
100105110
lysthrtrpglyglnglythrleuvalthrvalsersergluprolys
115120125
serserasplysthrhisthrserproproserproglnvalglnleu
130135140
valglnserglyvalgluvallyslysproglyalaservallysval
145150155160
sercyslysalaserglytyrthrphethrasntyrtyrmettyrtrp
165170175
valargglnalaproglyglnglyleuglutrpmetglyglyileasn
180185190
proserasnglyglythrasnpheasnglulysphelysasnargval
195200205
thrleuthrthraspserserthrthrthralatyrmetgluleulys
210215220
serleuglnpheaspaspthralavaltyrtyrcysalaargargasp
225230235240
tyrargpheaspmetglypheasptyrtrpglyglnglythrthrval
245250255
thrvalserseralaserthrlysglyproservalpheproleuala
260265270
procysserargserthrsergluserthralaalaleuglycysleu
275280285
vallysasptyrpheprogluprovalthrvalsertrpasnsergly
290295300
alaleuthrserglyvalhisthrpheproalavalleuglnserser
305310315320
glyleutyrserleuserservalvalthrvalproserserserleu
325330335
glythrlysthrtyrthrcysasnvalasphislysproserasnthr
340345350
lysvalasplysargvalgluserlystyrglyproprocyspropro
355360365
cysproalaproglupheleuglyglyproservalpheleuphepro
370375380
prolysprolysaspthrleumetileserargthrprogluvalthr
385390395400
cysvalvalvalaspvalserglngluaspprogluvalglnpheasn
405410415
trptyrvalaspglyvalgluvalhisasnalalysthrlysproarg
420425430
glugluglnpheasnserthrtyrargvalvalservalleuthrval
435440445
leuhisglnasptrpleuasnglylysglutyrlyscyslysvalser
450455460
asnlysglyleuproserserileglulysthrileserlysalalys
465470475480
glyglnproarggluproglnvaltyrthrleuproproserglnglu
485490495
glumetthrlysasnglnvalserleuthrcysleuvallysglyphe
500505510
tyrproseraspilealavalglutrpgluserasnglyglnproglu
515520525
asnasntyrlysthrthrproprovalleuaspseraspglyserphe
530535540
pheleutyrserargleuthrvalasplysserargtrpglnglugly
545550555560
asnvalphesercysservalmethisglualaleuhisasnhistyr
565570575
thrglnlysserleuserleuserleuglylys
580585
<210>17
<211>218
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>tptl-12轻链
<400>17
gluilevalleuthrglnserproalathrleuserleuserprogly
151015
gluargalathrleusercysargalaserlysglyvalserthrser
202530
glytyrsertyrleuhistrptyrglnglnlysproglyglnalapro
354045
argleuleuiletyrleualasertyrleugluserglyvalproala
505560
argpheserglyserglyserglythraspphethrleuthrileser
65707580
serleugluprogluaspphealavaltyrtyrcysglnhisserarg
859095
aspleuproleuthrpheglyglyglythrlysvalgluilelysarg
100105110
thrvalalaalaproservalpheilepheproproseraspglugln
115120125
leulysserglythralaservalvalcysleuleuasnasnphetyr
130135140
proargglualalysvalglntrplysvalaspasnalaleuglnser
145150155160
glyasnserglngluservalthrgluglnaspserlysaspserthr
165170175
tyrserleuserserthrleuthrleuserlysalaasptyrglulys
180185190
hislysvaltyralacysgluvalthrhisglnglyleuserserpro
195200205
valthrlysserpheasnargglyglucys
210215
<210>18
<211>724
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>tptl-12重链
<400>18
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglytyrlystyrglyvaltyr
202530
sermetglytrppheargglnalaproglylysglyleugluglyval
354045
seralailecysserglyglyargthrthrtyrseraspservallys
505560
glyargphethrileserargaspasnserasnglnileleutyrleu
65707580
glnmetasnserleuargalagluaspthralavaltyrtyrcysala
859095
alaargproleutrpthrglyaspcysaspleusersersertrptyr
100105110
lysthrtrpglyglnglythrleuvalthrvalsersergluprolys
115120125
serserasplysthrhisthrserproproserprogluvalglnleu
130135140
valgluserglyglyglyleuvalglnproglyglyserleuargleu
145150155160
sercysalaalaserglytyrthrvalsersertyrcysmetglytrp
165170175
pheargglnalaproglylysglyarggluglyvalseralaileasp
180185190
seraspglyservalsertyralaaspservallysglyargphethr
195200205
ileserlysaspasnserlysasnthrleutyrleuglnmetasnser
210215220
leuargalagluaspthralavaltyrphecysalaalaaspleucys
225230235240
trpvalaspglnaspglnglyglutyrasnthrtrpglyglnglythr
245250255
leuvalthrvalsersergluprolysserserasplysthrhisthr
260265270
serproproserproglnvalglnleuvalglnserglyvalgluval
275280285
lyslysproglyalaservallysvalsercyslysalaserglytyr
290295300
thrphethrasntyrtyrmettyrtrpvalargglnalaproglygln
305310315320
glyleuglutrpmetglyglyileasnproserasnglyglythrasn
325330335
pheasnglulysphelysasnargvalthrleuthrthraspserser
340345350
thrthrthralatyrmetgluleulysserleuglnpheaspaspthr
355360365
alavaltyrtyrcysalaargargasptyrargpheaspmetglyphe
370375380
asptyrtrpglyglnglythrthrvalthrvalserseralaserthr
385390395400
lysglyproservalpheproleualaprocysserargserthrser
405410415
gluserthralaalaleuglycysleuvallysasptyrpheproglu
420425430
provalthrvalsertrpasnserglyalaleuthrserglyvalhis
435440445
thrpheproalavalleuglnserserglyleutyrserleuserser
450455460
valvalthrvalproserserserleuglythrlysthrtyrthrcys
465470475480
asnvalasphislysproserasnthrlysvalasplysargvalglu
485490495
serlystyrglyproprocysproprocysproalaproglupheleu
500505510
glyglyproservalpheleupheproprolysprolysaspthrleu
515520525
metileserargthrprogluvalthrcysvalvalvalaspvalser
530535540
glngluaspprogluvalglnpheasntrptyrvalaspglyvalglu
545550555560
valhisasnalalysthrlysproargglugluglnpheasnserthr
565570575
tyrargvalvalservalleuthrvalleuhisglnasptrpleuasn
580585590
glylysglutyrlyscyslysvalserasnlysglyleuproserser
595600605
ileglulysthrileserlysalalysglyglnproarggluprogln
610615620
valtyrthrleuproproserglngluglumetthrlysasnglnval
625630635640
serleuthrcysleuvallysglyphetyrproseraspilealaval
645650655
glutrpgluserasnglyglnprogluasnasntyrlysthrthrpro
660665670
provalleuaspseraspglyserphepheleutyrserargleuthr
675680685
valasplysserargtrpglngluglyasnvalphesercysserval
690695700
methisglualaleuhisasnhistyrthrglnlysserleuserleu
705710715720
serleuglylys
<210>19
<211>495
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>tptl-13轻链
<400>19
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglytyrlystyrglyvaltyr
202530
sermetglytrppheargglnalaproglylysglyleugluglyval
354045
seralailecysserglyglyargthrthrtyrseraspservallys
505560
glyargphethrileserargaspasnserasnglnileleutyrleu
65707580
glnmetasnserleuargalagluaspthralavaltyrtyrcysala
859095
alaargproleutrpthrglyaspcysaspleusersersertrptyr
100105110
lysthrtrpglyglnglythrleuvalthrvalsersergluprolys
115120125
serserasplysthrhisthrserproproserprogluvalglnleu
130135140
valgluserglyglyglyleuvalglnproglyglyserleuargleu
145150155160
sercysalaalaserglytyrthrvalsersertyrcysmetglytrp
165170175
pheargglnalaproglylysglyarggluglyvalseralaileasp
180185190
seraspglyservalsertyralaaspservallysglyargphethr
195200205
ileserlysaspasnserlysasnthrleutyrleuglnmetasnser
210215220
leuargalagluaspthralavaltyrphecysalaalaaspleucys
225230235240
trpvalaspglnaspglnglyglutyrasnthrtrpglyglnglythr
245250255
leuvalthrvalsersergluprolysserserasplysthrhisthr
260265270
serproproserprogluilevalleuthrglnserproalathrleu
275280285
serleuserproglygluargalathrleusercysargalaserlys
290295300
glyvalserthrserglytyrsertyrleuhistrptyrglnglnlys
305310315320
proglyglnalaproargleuleuiletyrleualasertyrleuglu
325330335
serglyvalproalaargpheserglyserglyserglythraspphe
340345350
thrleuthrileserserleugluprogluaspphealavaltyrtyr
355360365
cysglnhisserargaspleuproleuthrpheglyglyglythrlys
370375380
valgluilelysargthrvalalaalaproservalpheilephepro
385390395400
proseraspgluglnleulysserglythralaservalvalcysleu
405410415
leuasnasnphetyrproargglualalysvalglntrplysvalasp
420425430
asnalaleuglnserglyasnserglngluservalthrgluglnasp
435440445
serlysaspserthrtyrserleuserserthrleuthrleuserlys
450455460
alaasptyrglulyshislysvaltyralacysgluvalthrhisgln
465470475480
glyleuserserprovalthrlysserpheasnargglyglucys
485490495
<210>20
<211>447
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>tptl-13重链
<400>20
glnvalglnleuvalglnserglyvalgluvallyslysproglyala
151015
servallysvalsercyslysalaserglytyrthrphethrasntyr
202530
tyrmettyrtrpvalargglnalaproglyglnglyleuglutrpmet
354045
glyglyileasnproserasnglyglythrasnpheasnglulysphe
505560
lysasnargvalthrleuthrthraspserserthrthrthralatyr
65707580
metgluleulysserleuglnpheaspaspthralavaltyrtyrcys
859095
alaargargasptyrargpheaspmetglypheasptyrtrpglygln
100105110
glythrthrvalthrvalserseralaserthrlysglyproserval
115120125
pheproleualaprocysserargserthrsergluserthralaala
130135140
leuglycysleuvallysasptyrpheprogluprovalthrvalser
145150155160
trpasnserglyalaleuthrserglyvalhisthrpheproalaval
165170175
leuglnserserglyleutyrserleuserservalvalthrvalpro
180185190
serserserleuglythrlysthrtyrthrcysasnvalasphislys
195200205
proserasnthrlysvalasplysargvalgluserlystyrglypro
210215220
procysproprocysproalaproglupheleuglyglyproserval
225230235240
pheleupheproprolysprolysaspthrleumetileserargthr
245250255
progluvalthrcysvalvalvalaspvalserglngluaspproglu
260265270
valglnpheasntrptyrvalaspglyvalgluvalhisasnalalys
275280285
thrlysproargglugluglnpheasnserthrtyrargvalvalser
290295300
valleuthrvalleuhisglnasptrpleuasnglylysglutyrlys
305310315320
cyslysvalserasnlysglyleuproserserileglulysthrile
325330335
serlysalalysglyglnproarggluproglnvaltyrthrleupro
340345350
proserglngluglumetthrlysasnglnvalserleuthrcysleu
355360365
vallysglyphetyrproseraspilealavalglutrpgluserasn
370375380
glyglnprogluasnasntyrlysthrthrproprovalleuaspser
385390395400
aspglyserphepheleutyrserargleuthrvalasplysserarg
405410415
trpglngluglyasnvalphesercysservalmethisglualaleu
420425430
hisasnhistyrthrglnlysserleuserleuserleuglylys
435440445
<210>21
<211>495
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>tptl-14轻链
<400>21
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglytyrlystyrglyvaltyr
202530
sermetglytrppheargglnalaproglylysglyleugluglyval
354045
seralailecysserglyglyargthrthrtyrseraspservallys
505560
glyargphethrileserargaspasnserasnglnileleutyrleu
65707580
glnmetasnserleuargalagluaspthralavaltyrtyrcysala
859095
alaargproleutrpthrglyaspcysaspleusersersertrptyr
100105110
lysthrtrpglyglnglythrleuvalthrvalsersergluprolys
115120125
serserasplysthrhisthrserproproserprogluilevalleu
130135140
thrglnserproalathrleuserleuserproglygluargalathr
145150155160
leusercysargalaserlysglyvalserthrserglytyrsertyr
165170175
leuhistrptyrglnglnlysproglyglnalaproargleuleuile
180185190
tyrleualasertyrleugluserglyvalproalaargphesergly
195200205
serglyserglythraspphethrleuthrileserserleuglupro
210215220
gluaspphealavaltyrtyrcysglnhisserargaspleuproleu
225230235240
thrpheglyglyglythrlysvalgluilelysargthrvalalaala
245250255
proservalpheilepheproproseraspgluglnleulyssergly
260265270
thralaservalvalcysleuleuasnasnphetyrproarggluala
275280285
lysvalglntrplysvalaspasnalaleuglnserglyasnsergln
290295300
gluservalthrgluglnaspserlysaspserthrtyrserleuser
305310315320
serthrleuthrleuserlysalaasptyrglulyshislysvaltyr
325330335
alacysgluvalthrhisglnglyleuserserprovalthrlysser
340345350
pheasnargglyglucysgluprolysserserasplysthrhisthr
355360365
serproproserprogluvalglnleuvalgluserglyglyglyleu
370375380
valglnproglyglyserleuargleusercysalaalaserglytyr
385390395400
thrvalsersertyrcysmetglytrppheargglnalaproglylys
405410415
glyarggluglyvalseralaileaspseraspglyservalsertyr
420425430
alaaspservallysglyargphethrileserlysaspasnserlys
435440445
asnthrleutyrleuglnmetasnserleuargalagluaspthrala
450455460
valtyrphecysalaalaaspleucystrpvalaspglnaspglngly
465470475480
glutyrasnthrtrpglyglnglythrleuvalthrvalserser
485490495
<210>22
<211>355
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>tptl-15轻链
<400>22
gluilevalleuthrglnserproalathrleuserleuserprogly
151015
gluargalathrleusercysargalaserlysglyvalserthrser
202530
glytyrsertyrleuhistrptyrglnglnlysproglyglnalapro
354045
argleuleuiletyrleualasertyrleugluserglyvalproala
505560
argpheserglyserglyserglythraspphethrleuthrileser
65707580
serleugluprogluaspphealavaltyrtyrcysglnhisserarg
859095
aspleuproleuthrpheglyglyglythrlysvalgluilelysarg
100105110
thrvalalaalaproservalpheilepheproproseraspglugln
115120125
leulysserglythralaservalvalcysleuleuasnasnphetyr
130135140
proargglualalysvalglntrplysvalaspasnalaleuglnser
145150155160
glyasnserglngluservalthrgluglnaspserlysaspserthr
165170175
tyrserleuserserthrleuthrleuserlysalaasptyrglulys
180185190
hislysvaltyralacysgluvalthrhisglnglyleuserserpro
195200205
valthrlysserpheasnargglyglucysgluprolysserserasp
210215220
lysthrhisthrserproproserprogluvalglnleuvalgluser
225230235240
glyglyglyleuvalglnproglyglyserleuargleusercysala
245250255
alaserglytyrthrvalsersertyrcysmetglytrpphearggln
260265270
alaproglylysglyarggluglyvalseralaileaspseraspgly
275280285
servalsertyralaaspservallysglyargphethrileserlys
290295300
aspasnserlysasnthrleutyrleuglnmetasnserleuargala
305310315320
gluaspthralavaltyrphecysalaalaaspleucystrpvalasp
325330335
glnaspglnglyglutyrasnthrtrpglyglnglythrleuvalthr
340345350
valserser
355
<210>23
<211>724
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>tptl-16重链
<400>23
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglytyrlystyrglyvaltyr
202530
sermetglytrppheargglnalaproglylysglyleugluglyval
354045
seralailecysserglyglyargthrthrtyrseraspservallys
505560
glyargphethrileserargaspasnserasnglnileleutyrleu
65707580
glnmetasnserleuargalagluaspthralavaltyrtyrcysala
859095
alaargproleutrpthrglyaspcysaspleusersersertrptyr
100105110
lysthrtrpglyglnglythrleuvalthrvalsersergluprolys
115120125
serserasplysthrhisthrserproproserproglnvalglnleu
130135140
valglnserglyvalgluvallyslysproglyalaservallysval
145150155160
sercyslysalaserglytyrthrphethrasntyrtyrmettyrtrp
165170175
valargglnalaproglyglnglyleuglutrpmetglyglyileasn
180185190
proserasnglyglythrasnpheasnglulysphelysasnargval
195200205
thrleuthrthraspserserthrthrthralatyrmetgluleulys
210215220
serleuglnpheaspaspthralavaltyrtyrcysalaargargasp
225230235240
tyrargpheaspmetglypheasptyrtrpglyglnglythrthrval
245250255
thrvalserseralaserthrlysglyproservalpheproleuala
260265270
procysserargserthrsergluserthralaalaleuglycysleu
275280285
vallysasptyrpheprogluprovalthrvalsertrpasnsergly
290295300
alaleuthrserglyvalhisthrpheproalavalleuglnserser
305310315320
glyleutyrserleuserservalvalthrvalproserserserleu
325330335
glythrlysthrtyrthrcysasnvalasphislysproserasnthr
340345350
lysvalasplysargvalgluserlystyrglyproprocyspropro
355360365
cysproalaproglupheleuglyglyproservalpheleuphepro
370375380
prolysprolysaspthrleumetileserargthrprogluvalthr
385390395400
cysvalvalvalaspvalserglngluaspprogluvalglnpheasn
405410415
trptyrvalaspglyvalgluvalhisasnalalysthrlysproarg
420425430
glugluglnpheasnserthrtyrargvalvalservalleuthrval
435440445
leuhisglnasptrpleuasnglylysglutyrlyscyslysvalser
450455460
asnlysglyleuproserserileglulysthrileserlysalalys
465470475480
glyglnproarggluproglnvaltyrthrleuproproserglnglu
485490495
glumetthrlysasnglnvalserleuthrcysleuvallysglyphe
500505510
tyrproseraspilealavalglutrpgluserasnglyglnproglu
515520525
asnasntyrlysthrthrproprovalleuaspseraspglyserphe
530535540
pheleutyrserargleuthrvalasplysserargtrpglnglugly
545550555560
asnvalphesercysservalmethisglualaleuhisasnhistyr
565570575
thrglnlysserleuserleuserleuglylysgluprolysserser
580585590
asplysthrhisthrserproproserprogluvalglnleuvalglu
595600605
serglyglyglyleuvalglnproglyglyserleuargleusercys
610615620
alaalaserglytyrthrvalsersertyrcysmetglytrpphearg
625630635640
glnalaproglylysglyarggluglyvalseralaileaspserasp
645650655
glyservalsertyralaaspservallysglyargphethrileser
660665670
lysaspasnserlysasnthrleutyrleuglnmetasnserleuarg
675680685
alagluaspthralavaltyrphecysalaalaaspleucystrpval
690695700
aspglnaspglnglyglutyrasnthrtrpglyglnglythrleuval
705710715720
thrvalserser
<210>24
<211>358
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>tptl-17轻链
<400>24
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglytyrlystyrglyvaltyr
202530
sermetglytrppheargglnalaproglylysglyleugluglyval
354045
seralailecysserglyglyargthrthrtyrseraspservallys
505560
glyargphethrileserargaspasnserasnglnileleutyrleu
65707580
glnmetasnserleuargalagluaspthralavaltyrtyrcysala
859095
alaargproleutrpthrglyaspcysaspleusersersertrptyr
100105110
lysthrtrpglyglnglythrleuvalthrvalsersergluprolys
115120125
serserasplysthrhisthrserproproserprogluilevalleu
130135140
thrglnserproalathrleuserleuserproglygluargalathr
145150155160
leusercysargalaserlysglyvalserthrserglytyrsertyr
165170175
leuhistrptyrglnglnlysproglyglnalaproargleuleuile
180185190
tyrleualasertyrleugluserglyvalproalaargphesergly
195200205
serglyserglythraspphethrleuthrileserserleuglupro
210215220
gluaspphealavaltyrtyrcysglnhisserargaspleuproleu
225230235240
thrpheglyglyglythrlysvalgluilelysargthrvalalaala
245250255
proservalpheilepheproproseraspgluglnleulyssergly
260265270
thralaservalvalcysleuleuasnasnphetyrproarggluala
275280285
lysvalglntrplysvalaspasnalaleuglnserglyasnsergln
290295300
gluservalthrgluglnaspserlysaspserthrtyrserleuser
305310315320
serthrleuthrleuserlysalaasptyrglulyshislysvaltyr
325330335
alacysgluvalthrhisglnglyleuserserprovalthrlysser
340345350
pheasnargglyglucys
355
<210>25
<211>584
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>tptl-17重链
<400>25
glnvalglnleuvalglnserglyvalgluvallyslysproglyala
151015
servallysvalsercyslysalaserglytyrthrphethrasntyr
202530
tyrmettyrtrpvalargglnalaproglyglnglyleuglutrpmet
354045
glyglyileasnproserasnglyglythrasnpheasnglulysphe
505560
lysasnargvalthrleuthrthraspserserthrthrthralatyr
65707580
metgluleulysserleuglnpheaspaspthralavaltyrtyrcys
859095
alaargargasptyrargpheaspmetglypheasptyrtrpglygln
100105110
glythrthrvalthrvalserseralaserthrlysglyproserval
115120125
pheproleualaprocysserargserthrsergluserthralaala
130135140
leuglycysleuvallysasptyrpheprogluprovalthrvalser
145150155160
trpasnserglyalaleuthrserglyvalhisthrpheproalaval
165170175
leuglnserserglyleutyrserleuserservalvalthrvalpro
180185190
serserserleuglythrlysthrtyrthrcysasnvalasphislys
195200205
proserasnthrlysvalasplysargvalgluserlystyrglypro
210215220
procysproprocysproalaproglupheleuglyglyproserval
225230235240
pheleupheproprolysprolysaspthrleumetileserargthr
245250255
progluvalthrcysvalvalvalaspvalserglngluaspproglu
260265270
valglnpheasntrptyrvalaspglyvalgluvalhisasnalalys
275280285
thrlysproargglugluglnpheasnserthrtyrargvalvalser
290295300
valleuthrvalleuhisglnasptrpleuasnglylysglutyrlys
305310315320
cyslysvalserasnlysglyleuproserserileglulysthrile
325330335
serlysalalysglyglnproarggluproglnvaltyrthrleupro
340345350
proserglngluglumetthrlysasnglnvalserleuthrcysleu
355360365
vallysglyphetyrproseraspilealavalglutrpgluserasn
370375380
glyglnprogluasnasntyrlysthrthrproprovalleuaspser
385390395400
aspglyserphepheleutyrserargleuthrvalasplysserarg
405410415
trpglngluglyasnvalphesercysservalmethisglualaleu
420425430
hisasnhistyrthrglnlysserleuserleuserleuglylysglu
435440445
prolysserserasplysthrhisthrserproproserprogluval
450455460
glnleuvalgluserglyglyglyleuvalglnproglyglyserleu
465470475480
argleusercysalaalaserglytyrthrvalsersertyrcysmet
485490495
glytrppheargglnalaproglylysglyarggluglyvalserala
500505510
ileaspseraspglyservalsertyralaaspservallysglyarg
515520525
phethrileserlysaspasnserlysasnthrleutyrleuglnmet
530535540
asnserleuargalagluaspthralavaltyrphecysalaalaasp
545550555560
leucystrpvalaspglnaspglnglyglutyrasnthrtrpglygln
565570575
glythrleuvalthrvalserser
580
<210>26
<211>587
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>tptl-18重链
<400>26
glnvalglnleuvalglnserglyvalgluvallyslysproglyala
151015
servallysvalsercyslysalaserglytyrthrphethrasntyr
202530
tyrmettyrtrpvalargglnalaproglyglnglyleuglutrpmet
354045
glyglyileasnproserasnglyglythrasnpheasnglulysphe
505560
lysasnargvalthrleuthrthraspserserthrthrthralatyr
65707580
metgluleulysserleuglnpheaspaspthralavaltyrtyrcys
859095
alaargargasptyrargpheaspmetglypheasptyrtrpglygln
100105110
glythrthrvalthrvalserseralaserthrlysglyproserval
115120125
pheproleualaprocysserargserthrsergluserthralaala
130135140
leuglycysleuvallysasptyrpheprogluprovalthrvalser
145150155160
trpasnserglyalaleuthrserglyvalhisthrpheproalaval
165170175
leuglnserserglyleutyrserleuserservalvalthrvalpro
180185190
serserserleuglythrlysthrtyrthrcysasnvalasphislys
195200205
proserasnthrlysvalasplysargvalgluserlystyrglypro
210215220
procysproprocysproalaproglupheleuglyglyproserval
225230235240
pheleupheproprolysprolysaspthrleumetileserargthr
245250255
progluvalthrcysvalvalvalaspvalserglngluaspproglu
260265270
valglnpheasntrptyrvalaspglyvalgluvalhisasnalalys
275280285
thrlysproargglugluglnpheasnserthrtyrargvalvalser
290295300
valleuthrvalleuhisglnasptrpleuasnglylysglutyrlys
305310315320
cyslysvalserasnlysglyleuproserserileglulysthrile
325330335
serlysalalysglyglnproarggluproglnvaltyrthrleupro
340345350
proserglngluglumetthrlysasnglnvalserleuthrcysleu
355360365
vallysglyphetyrproseraspilealavalglutrpgluserasn
370375380
glyglnprogluasnasntyrlysthrthrproprovalleuaspser
385390395400
aspglyserphepheleutyrserargleuthrvalasplysserarg
405410415
trpglngluglyasnvalphesercysservalmethisglualaleu
420425430
hisasnhistyrthrglnlysserleuserleuserleuglylysglu
435440445
prolysserserasplysthrhisthrserproproserprogluval
450455460
glnleuvalgluserglyglyglyleuvalglnproglyglyserleu
465470475480
argleusercysalaalaserglytyrlystyrglyvaltyrsermet
485490495
glytrppheargglnalaproglylysglyleugluglyvalserala
500505510
ilecysserglyglyargthrthrtyrseraspservallysglyarg
515520525
phethrileserargaspasnserasnglnileleutyrleuglnmet
530535540
asnserleuargalagluaspthralavaltyrtyrcysalaalaarg
545550555560
proleutrpthrglyaspcysaspleusersersertrptyrlysthr
565570575
trpglyglnglythrleuvalthrvalserser
580585
<210>27
<211>495
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>tptl-19轻链
<400>27
gluilevalleuthrglnserproalathrleuserleuserprogly
151015
gluargalathrleusercysargalaserlysglyvalserthrser
202530
glytyrsertyrleuhistrptyrglnglnlysproglyglnalapro
354045
argleuleuiletyrleualasertyrleugluserglyvalproala
505560
argpheserglyserglyserglythraspphethrleuthrileser
65707580
serleugluprogluaspphealavaltyrtyrcysglnhisserarg
859095
aspleuproleuthrpheglyglyglythrlysvalgluilelysarg
100105110
thrvalalaalaproservalpheilepheproproseraspglugln
115120125
leulysserglythralaservalvalcysleuleuasnasnphetyr
130135140
proargglualalysvalglntrplysvalaspasnalaleuglnser
145150155160
glyasnserglngluservalthrgluglnaspserlysaspserthr
165170175
tyrserleuserserthrleuthrleuserlysalaasptyrglulys
180185190
hislysvaltyralacysgluvalthrhisglnglyleuserserpro
195200205
valthrlysserpheasnargglyglucysgluprolysserserasp
210215220
lysthrhisthrserproproserprogluvalglnleuvalgluser
225230235240
glyglyglyleuvalglnproglyglyserleuargleusercysala
245250255
alaserglytyrthrvalsersertyrcysmetglytrpphearggln
260265270
alaproglylysglyarggluglyvalseralaileaspseraspgly
275280285
servalsertyralaaspservallysglyargphethrileserlys
290295300
aspasnserlysasnthrleutyrleuglnmetasnserleuargala
305310315320
gluaspthralavaltyrphecysalaalaaspleucystrpvalasp
325330335
glnaspglnglyglutyrasnthrtrpglyglnglythrleuvalthr
340345350
valsersergluprolysserserasplysthrhisthrserpropro
355360365
serprogluvalglnleuvalgluserglyglyglyleuvalglnpro
370375380
glyglyserleuargleusercysalaalaserglytyrlystyrgly
385390395400
valtyrsermetglytrppheargglnalaproglylysglyleuglu
405410415
glyvalseralailecysserglyglyargthrthrtyrseraspser
420425430
vallysglyargphethrileserargaspasnserasnglnileleu
435440445
tyrleuglnmetasnserleuargalagluaspthralavaltyrtyr
450455460
cysalaalaargproleutrpthrglyaspcysaspleuserserser
465470475480
trptyrlysthrtrpglyglnglythrleuvalthrvalserser
485490495
<210>28
<211>724
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>tptl-20重链
<400>28
glnvalglnleuvalglnserglyvalgluvallyslysproglyala
151015
servallysvalsercyslysalaserglytyrthrphethrasntyr
202530
tyrmettyrtrpvalargglnalaproglyglnglyleuglutrpmet
354045
glyglyileasnproserasnglyglythrasnpheasnglulysphe
505560
lysasnargvalthrleuthrthraspserserthrthrthralatyr
65707580
metgluleulysserleuglnpheaspaspthralavaltyrtyrcys
859095
alaargargasptyrargpheaspmetglypheasptyrtrpglygln
100105110
glythrthrvalthrvalserseralaserthrlysglyproserval
115120125
pheproleualaprocysserargserthrsergluserthralaala
130135140
leuglycysleuvallysasptyrpheprogluprovalthrvalser
145150155160
trpasnserglyalaleuthrserglyvalhisthrpheproalaval
165170175
leuglnserserglyleutyrserleuserservalvalthrvalpro
180185190
serserserleuglythrlysthrtyrthrcysasnvalasphislys
195200205
proserasnthrlysvalasplysargvalgluserlystyrglypro
210215220
procysproprocysproalaproglupheleuglyglyproserval
225230235240
pheleupheproprolysprolysaspthrleumetileserargthr
245250255
progluvalthrcysvalvalvalaspvalserglngluaspproglu
260265270
valglnpheasntrptyrvalaspglyvalgluvalhisasnalalys
275280285
thrlysproargglugluglnpheasnserthrtyrargvalvalser
290295300
valleuthrvalleuhisglnasptrpleuasnglylysglutyrlys
305310315320
cyslysvalserasnlysglyleuproserserileglulysthrile
325330335
serlysalalysglyglnproarggluproglnvaltyrthrleupro
340345350
proserglngluglumetthrlysasnglnvalserleuthrcysleu
355360365
vallysglyphetyrproseraspilealavalglutrpgluserasn
370375380
glyglnprogluasnasntyrlysthrthrproprovalleuaspser
385390395400
aspglyserphepheleutyrserargleuthrvalasplysserarg
405410415
trpglngluglyasnvalphesercysservalmethisglualaleu
420425430
hisasnhistyrthrglnlysserleuserleuserleuglylysglu
435440445
prolysserserasplysthrhisthrserproproserprogluval
450455460
glnleuvalgluserglyglyglyleuvalglnproglyglyserleu
465470475480
argleusercysalaalaserglytyrthrvalsersertyrcysmet
485490495
glytrppheargglnalaproglylysglyarggluglyvalserala
500505510
ileaspseraspglyservalsertyralaaspservallysglyarg
515520525
phethrileserlysaspasnserlysasnthrleutyrleuglnmet
530535540
asnserleuargalagluaspthralavaltyrphecysalaalaasp
545550555560
leucystrpvalaspglnaspglnglyglutyrasnthrtrpglygln
565570575
glythrleuvalthrvalsersergluprolysserserasplysthr
580585590
histhrserproproserprogluvalglnleuvalgluserglygly
595600605
glyleuvalglnproglyglyserleuargleusercysalaalaser
610615620
glytyrlystyrglyvaltyrsermetglytrppheargglnalapro
625630635640
glylysglyleugluglyvalseralailecysserglyglyargthr
645650655
thrtyrseraspservallysglyargphethrileserargaspasn
660665670
serasnglnileleutyrleuglnmetasnserleuargalagluasp
675680685
thralavaltyrtyrcysalaalaargproleutrpthrglyaspcys
690695700
aspleusersersertrptyrlysthrtrpglyglnglythrleuval
705710715720
thrvalserser
<210>29
<211>354
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>as19584vh28hcab
<400>29
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglytyrlystyrglyvaltyr
202530
sermetglytrppheargglnalaproglylysglyleugluglyval
354045
seralailecysserglyglyargthrthrtyrseraspservallys
505560
glyargphethrileserargaspasnserasnglnileleutyrleu
65707580
glnmetasnserleuargalagluaspthralavaltyrtyrcysala
859095
alaargproleutrpthrglyaspcysaspleusersersertrptyr
100105110
lysthrtrpglyglnglythrleuvalthrvalsersergluserlys
115120125
tyrglyproprocysproprocysproalaproglupheleuglygly
130135140
proservalpheleupheproprolysprolysaspthrleumetile
145150155160
serargthrprogluvalthrcysvalvalvalaspvalserglnglu
165170175
aspprogluvalglnpheasntrptyrvalaspglyvalgluvalhis
180185190
asnalalysthrlysproargglugluglnpheasnserthrtyrarg
195200205
valvalservalleuthrvalleuhisglnasptrpleuasnglylys
210215220
glutyrlyscyslysvalserasnlysglyleuproserserileglu
225230235240
lysthrileserlysalalysglyglnproarggluproglnvaltyr
245250255
thrleuproproserglngluglumetthrlysasnglnvalserleu
260265270
thrcysleuvallysglyphetyrproseraspilealavalglutrp
275280285
gluserasnglyglnprogluasnasntyrlysthrthrproproval
290295300
leuaspseraspglyserphepheleutyrserargleuthrvalasp
305310315320
lysserargtrpglngluglyasnvalphesercysservalmethis
325330335
glualaleuhisasnhistyrthrglnlysserleuserleuserleu
340345350
glylys
<210>30
<211>351
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>vhh2hcab
<400>30
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglytyrthrvalsersertyr
202530
cysmetglytrppheargglnalaproglylysglyarggluglyval
354045
seralaileaspseraspglyservalsertyralaaspservallys
505560
glyargphethrileserlysaspasnserlysasnthrleutyrleu
65707580
glnmetasnserleuargalagluaspthralavaltyrphecysala
859095
alaaspleucystrpvalaspglnaspglnglyglutyrasnthrtrp
100105110
glyglnglythrleuvalthrvalsersergluserlystyrglypro
115120125
procysproprocysproalaproglupheleuglyglyproserval
130135140
pheleupheproprolysprolysaspthrleumetileserargthr
145150155160
progluvalthrcysvalvalvalaspvalserglngluaspproglu
165170175
valglnpheasntrptyrvalaspglyvalgluvalhisasnalalys
180185190
thrlysproargglugluglnpheasnserthrtyrargvalvalser
195200205
valleuthrvalleuhisglnasptrpleuasnglylysglutyrlys
210215220
cyslysvalserasnlysglyleuproserserileglulysthrile
225230235240
serlysalalysglyglnproarggluproglnvaltyrthrleupro
245250255
proserglngluglumetthrlysasnglnvalserleuthrcysleu
260265270
vallysglyphetyrproseraspilealavalglutrpgluserasn
275280285
glyglnprogluasnasntyrlysthrthrproprovalleuaspser
290295300
aspglyserphepheleutyrserargleuthrvalasplysserarg
305310315320
trpglngluglyasnvalphesercysservalmethisglualaleu
325330335
hisasnhistyrthrglnlysserleuserleuserleuglylys
340345350
<210>31
<211>125
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>as19584vh28sdab
<400>31
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglytyrlystyrglyvaltyr
202530
sermetglytrppheargglnalaproglylysglyleugluglyval
354045
seralailecysserglyglyargthrthrtyrseraspservallys
505560
glyargphethrileserargaspasnserasnglnileleutyrleu
65707580
glnmetasnserleuargalagluaspthralavaltyrtyrcysala
859095
alaargproleutrpthrglyaspcysaspleusersersertrptyr
100105110
lysthrtrpglyglnglythrleuvalthrvalserser
115120125
<210>32
<211>122
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>vhh2sdab
<400>32
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglytyrthrvalsersertyr
202530
cysmetglytrppheargglnalaproglylysglyarggluglyval
354045
seralaileaspseraspglyservalsertyralaaspservallys
505560
glyargphethrileserlysaspasnserlysasnthrleutyrleu
65707580
glnmetasnserleuargalagluaspthralavaltyrphecysala
859095
alaaspleucystrpvalaspglnaspglnglyglutyrasnthrtrp
100105110
glyglnglythrleuvalthrvalserser
115120
- 还没有人留言评论。精彩留言会获得点赞!