化合物的盐及其晶体的制作方法
本发明涉及化合物的盐及其晶体。
背景技术:
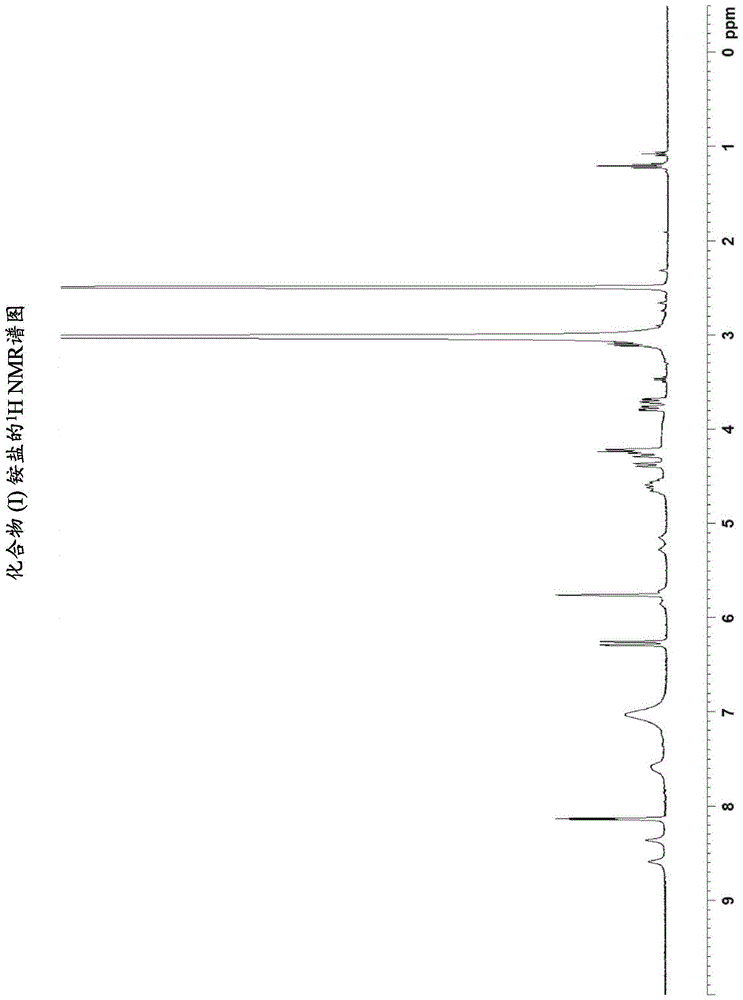
:sting(干扰素基因的刺激因子)是细胞质中对dsdna的先天反应中的信号转导分子。已报道在多种人类癌症中的sting缺失。此外,在黑素瘤(xiat等人,"recurrentlossofstingsignalinginmelanomacorrelateswithsusceptibilitytoviraloncolysis[在与对病毒溶瘤的易感性有关的黑素瘤中的sting]信号转导的复发性损失"cancerres.[癌症研究]2016)和结肠癌.(xiat等人,"deregulationofstingsignalingincolorectalcarcinomaconstrainsdnadamageresponsesandcorrelateswithtumorigenesis[在结直肠癌中sting信号转导的失调限制dna损伤应答并且与肿瘤发生有关]"cellrep.[细胞报道]2016;14:282-97)中已经报道了在人类癌症中sting信号转导的失调。有趣的是,在这些研究中,基因组分析结果表明sting的丢失表达不是由于基因缺失或突变,而是通过表观遗传变化(xia,cancerres.[癌症研究]2016;xia,cellrep.[细胞报道]2016)。从小鼠模型研究中获得的证据也支持sting的癌症保护活性。sting敲除小鼠已经显示出有缺陷的肿瘤控制。(woosr等人."sting-dependentcytosolicdnasensingmediatesinnateimmunerecognitionofimmunogenictumors[sting依赖性细胞质dna传感介导免疫原性肿瘤的先天免疫识别]"immunity[免疫力]2014;41:830-42)。此外,已经在若干种小鼠自发性模型中证明了sting在保护个体发育中的作用,这些模型包括胶质瘤(ohkurit等人,"protectiveroleofstingagainstgliomagenesis:rationaluseofstingagonistinanti-gliomaimmunotherapy[针对胶质瘤发生的sting的保护作用:在抗胶质瘤免疫疗法中sting激动剂的合理使用]"oncoimmunology[肿瘤免疫学].2015;4:e999523)和结肠癌(zhuq等人,"cuttingedge:stingmediatesprotectionagainstcolorectaltumorigenesisbygoverningthemagnitudeofintestinalinflammation[最前沿:sting通过管理肠道炎症的大小介导针对结直肠肿瘤发生的保护作用]"j.immunol.[免疫学杂志]2014;193:4779-82)。这种抗肿瘤效果可能归因于其抵抗nf-kb和stat3过度激活的能力(ohkuri2015)。sting途径的激活在临床前小鼠肿瘤模型中也显示出有效活性(woo2014;chandrad等人."stingligandc-di-gmpimprovescancervaccinationagainstmetastaticbreastcancer[sting配体c-di-gmp针对转移性乳腺癌改善了癌症疫苗接种]"cancerimmunolres.[癌症免疫学研究]2014;2:901-10;corralesl等人,"directactivationofstinginthetumormicroenvironmentleadstopotentandsystemictumorregressionandimmunity[在肿瘤微环境中sting的直接激活导致有效并且全身性的肿瘤消退和免疫力]"cellrep.[细胞报道]2015;11:1018-30;currane等人,"stingpathwayactivationstimulatespotentimmunityagainstacutemyeloidleukemia[sting途径激活刺激针对急性髓性白血病的有效免疫力]"cellrep.[细胞报道]2016;15:2357-66;tangch等人,"agonist-mediatedactivationofstinginducesapoptosisinmalignantbcells[sting的激动剂介导的激活诱导恶性b细胞中的凋亡]"cancerres.[癌症研究]2016;76:2137-52).这种抗肿瘤活性可能是由于肿瘤脉管系统的破坏,然后诱导适应性免疫应答(corralesl等人,"thehoststingpathwayattheinterfaceofcancerandimmunity[在癌症与免疫力界面处的宿主sting途径]"j.clin.invest.[临床研究杂志]2016;126:2404-11)。因此,在肿瘤环境中通过激动剂直接刺激sting可能成为一种治疗多种癌症类型的新方法。发明概述技术问题由化学式(i)表示的化合物,即,(1r,3r,15e,28r,29r,30r,31r,34r,36r,39s,41r)-29,41-二氟-34,39-双(巯基)-2,33,35,38,40,42-六氧-4,6,9,11,13,18,20,22,25,27-十氮杂-34λ5,39λ5-二磷八环[28.6.4.13,36.128,31.04,8.07,12.019,24.023,27]四十二烷-5,7,9,11,15,19,21,23,25-壬烯-34,39-二酮(在下文被称为化合物(i)),抑制肿瘤的生长。[化学式1]一般地,用作药品的化合物、其盐及其晶体的物理特性极大地影响药物的生物利用度、活性药物成分的纯度、制剂的配方等。因此本发明的目的是提供一种具有用作药品中药用物质的潜力的化合物(i)的盐或其晶体。问题的解决方案诸位发明人已经发现了化合物(i)的盐或其晶体具有用作药品中药用物质的潜力,由此完成了本发明。具体地,本发明涉及以下<1>至<50>。<1>一种(1r,3r,15e,28r,29r,30r,31r,34r,36r,39s,41r)-29,41-二氟-34,39-双(巯基)-2,33,35,38,40,42-六氧-4,6,9,11,13,18,20,22,25,27-十氮杂-34λ5,39λ5-二磷八环[28.6.4.13,36.128,31.04,8.07,12.019,24.023,27]四十二烷-5,7,9,11,15,19,21,23,25-壬烯-34,39-二酮(化合物(i))铵盐、化合物(i)钠盐或化合物(i)的晶体。[化学式2]<2>根据<1>所述的晶体,其为(1r,3r,15e,28r,29r,30r,31r,34r,36r,39s,41r)-29,41-二氟-34,39-双(巯基)-2,33,35,38,40,42-六氧-4,6,9,11,13,18,20,22,25,27-十氮杂-34λ5,39λ5-二磷八环[28.6.4.13,36.128,31.04,8.07,12.019,24.023,27]四十二烷-5,7,9,11,15,19,21,23,25-壬烯-34,39-二酮(化合物(i))铵盐的晶体。<3>根据<2>所述的晶体,其为(1r,3r,15e,28r,29r,30r,31r,34r,36r,39s,41r)-29,41-二氟-34,39-双(巯基)-2,33,35,38,40,42-六氧-4,6,9,11,13,18,20,22,25,27-十氮杂-34λ5,39λ5-二磷八环[28.6.4.13,36.128,31.04,8.07,12.019,24.023,27]四十二烷-5,7,9,11,15,19,21,23,25-壬烯-34,39-二酮(化合物(i))二铵盐的晶体。<4>根据<3>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为8.3°处具有衍射峰的晶体(晶型1)。<5>根据<4>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.4°、8.3°和16.6°处具有衍射峰的晶体(晶型1)。<6>根据<4>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.4°、8.3°、12.7°、16.6°和25.4°处具有衍射峰的晶体(晶型1)。<7>根据<4>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.4°、8.3°、12.7°、14.6°、16.6°、18.1°、22.1°、22.8°、24.4°和25.4°处具有衍射峰的晶体(晶型1)。<8>根据<7>所述的具有与图3所示的粉末x射线衍射图基本上相同的粉末x射线衍射图的晶体(晶型1)。<9>根据<4>至<8>中任一项所述的晶体(晶型1),其为水合物。<10>根据<3>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为9.0°处具有衍射峰的晶体(晶型2)。<11>根据<10>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为9.0°、15.4°和20.8°处具有衍射峰的晶体(晶型2)。<12>根据<10>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为9.0°、15.4°、20.8°、24.0°和30.0°处具有衍射峰的晶体(晶型2)。<13>根据<10>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为7.0°、9.0°、11.8°、13.2°、15.4°、19.7°、20.8°、24.0°、30.0°和31.1°处具有衍射峰的晶体(晶型2)。<14>根据<13>所述的具有与图4所示的粉末x射线衍射图基本上相同的粉末x射线衍射图的晶体(晶型2)。<15>根据<10>至<14>中任一项所述的晶体(晶型2),其为水合物。<16>根据<3>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为7.4°处具有衍射峰的晶体(晶型3)。<17>根据<16>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为7.4°、16.0°和21.4°处具有衍射峰的晶体(晶型3)。<18>根据<16>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.0°、7.4°、9.3°、16.0°和21.4°处具有衍射峰的晶体(晶型3)。<19>根据<16>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.0°、7.4°、9.3°、12.6°、16.0°、16.6°、18.1°、21.4°、22.0°和22.8°处具有衍射峰的晶体(晶型3)。<20>根据<19>所述的具有与图5所示的粉末x射线衍射图基本上相同的粉末x射线衍射图的晶体(晶型3)。<21>根据<16>至<20>中任一项所述的晶体(晶型3),其为水合物。<22>根据<3>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为9.7°处具有衍射峰的晶体(晶型4)。<23>根据<22>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为9.7°、14.0°和26.9°处具有衍射峰的晶体(晶型4)。<24>根据<22>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为9.7°、14.0°、17.4°、22.3°和26.9°处具有衍射峰的晶体(晶型4)。<25>根据<22>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为5.9°、7.6°、9.7°、11.6°、14.0°、16.0°、17.4°、22.3°、24.6°和26.9°处具有衍射峰的晶体(晶型4)。<26>根据<25>所述的具有与图6所示的粉末x射线衍射图基本上相同的粉末x射线衍射图的晶体(晶型4)。<27>根据<3>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为20.0°处具有衍射峰的晶体(晶型5)。<28>根据<27>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为10.9°、20.0°和23.6°处具有衍射峰的晶体(晶型5)。<29>根据<27>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为10.9°、17.7°、18.9°、20.0°和23.6°处具有衍射峰的晶体(晶型5)。<30>根据<27>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为9.0°、9.6°、10.9°、13.0°、15.3°、17.7°、18.9°、20.0°、21.5°和23.6°处具有衍射峰的晶体(晶型5)。<31>根据<30>所述的具有与图7所示的粉末x射线衍射图基本上相同的粉末x射线衍射图的晶体(晶型5)。<32>根据<2>所述的晶体,其为(1r,3r,15e,28r,29r,30r,31r,34r,36r,39s,41r)-29,41-二氟-34,39-双(巯基)-2,33,35,38,40,42-六氧-4,6,9,11,13,18,20,22,25,27-十氮杂-34λ5,39λ5-二磷八环[28.6.4.13,36.128,31.04,8.07,12.019,24.023,27]四十二烷-5,7,9,11,15,19,21,23,25-壬烯-34,39-二酮(化合物(i))单铵盐的晶体。<33>根据<32>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为17.0°处具有衍射峰的晶体(晶型6)。<34>根据<33>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为17.0°、21.6°和25.9°处具有衍射峰的晶体(晶型6)。<35>根据<33>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为15.1°、16.4°、17.0°、21.6°和25.9°处具有衍射峰的晶体(晶型6)。<36>根据<33>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.9°、8.5°、12.0°、15.1°、16.4°、17.0°、21.0°、21.6°、22.8°和25.9°处具有衍射峰的晶体(晶型6)。<37>根据<36>所述的具有与图8所示的粉末x射线衍射图基本上相同的粉末x射线衍射图的晶体(晶型6)。<38>根据<1>所述的晶体,其为(1r,3r,15e,28r,29r,30r,31r,34r,36r,39s,41r)-29,41-二氟-34,39-双(巯基)-2,33,35,38,40,42-六氧-4,6,9,11,13,18,20,22,25,27-十氮杂-34λ5,39λ5-二磷八环[28.6.4.13,36.128,31.04,8.07,12.019,24.023,27]四十二烷-5,7,9,11,15,19,21,23,25-壬烯-34,39-二酮(化合物(i))钠盐的晶体。<39>根据<38>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.1°处具有衍射峰的晶体。<40>根据<39>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.1°、9.3°和16.6°处具有衍射峰的晶体。<41>根据<39>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.1°、9.3°、15.9°、16.6°和22.3°处具有衍射峰的晶体。<42>根据<39>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.1°、9.3°、13.4°、14.8°、15.9°、16.6°、20.6°、22.3°、23.5°和24.4°处具有衍射峰的晶体。<43>根据<42>所述的具有与图9所示的粉末x射线衍射图基本上相同的粉末x射线衍射图的晶体。<44>根据<1>所述的晶体,其为(1r,3r,15e,28r,29r,30r,31r,34r,36r,39s,41r)-29,41-二氟-34,39-双(巯基)-2,33,35,38,40,42-六氧-4,6,9,11,13,18,20,22,25,27-十氮杂-34λ5,39λ5-二磷八环[28.6.4.13,36.128,31.04,8.07,12.019,24.023,27]四十二烷-5,7,9,11,15,19,21,23,25-壬烯-34,39-二酮(化合物(i))的晶体。<45>根据<44>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为5.6°处具有衍射峰的晶体。<46>根据<45>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为5.6°、13.9°和16.8°处具有衍射峰的晶体。<47>根据<45>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为5.6°、8.9°、11.4°、13.9°和16.8°处具有衍射峰的晶体。<48>根据<45>所述的在粉末x射线衍射中在衍射角(2θ±0.2°)为5.6°、7.9°、8.9°、11.4°、13.9°、16.8°、22.1°和23.1°处具有衍射峰的晶体。<49>根据<48>所述的具有与图10所示的粉末x射线衍射图基本上相同的粉末x射线衍射图的晶体。<50>一种包含根据<1>至<49>中任一项所述的晶体的药物组合物。本发明的有益效果本发明提供的化合物(i)的盐及其晶体具有如下文实例中所示的特性,例如吸湿性,并且具有用作药品中药用物质的潜力。附图简要说明[图1]图1示出了化合物(i)铵盐的1hnmr谱图。[图2a]图2a示出了化合物(i)铵盐的晶体的x射线晶体学结果(ortep图),其中不对称晶体单元中存在两个分子。[图2b]图2b示出了不对称晶体单元中的第一分子的x射线晶体学结果(ortep图)。[图2c]图2c示出了不对称晶体单元中的第二分子的x射线晶体学结果(ortep图)。[图3]图3示出了在实例1中获得的化合物(i)二铵盐的晶体(晶型1)粉末x射线衍射图。横坐标示出了衍射角(2θ),并且纵坐标示出了峰强度。[图4]图4示出了在实例2中获得的化合物(i)二铵盐的晶体(晶型2)的粉末x射线衍射图。横坐标示出了衍射角(2θ),并且纵坐标示出了峰强度。[图5]图5示出了在实例3中获得的化合物(i)二铵盐的晶体(晶型3)粉末x射线衍射图。横坐标示出了衍射角(2θ),并且纵坐标示出了峰强度。[图6]图6示出了在实例4中获得的化合物(i)二铵盐的晶体(晶型4)粉末x射线衍射图。横坐标示出了衍射角(2θ),并且纵坐标示出了峰强度。[图7]图7示出了在实例5中获得的化合物(i)二铵盐的晶体(晶型5)粉末x射线衍射图。横坐标示出了衍射角(2θ),并且纵坐标示出了峰强度。[图8]图8示出了在实例6中获得的化合物(i)的单铵盐的晶体(晶型6)的粉末x射线衍射图。横坐标示出了衍射角(2θ),并且纵坐标示出了峰强度。[图9]图9示出了在实例7中获得的化合物(i)钠盐的晶体的粉末x射线衍射图。横坐标示出了衍射角(2θ),并且纵坐标示出了峰强度。[图10]图10示出了在实例8中获得的化合物(i)的盐酸盐的晶体的粉末x射线衍射图。横坐标示出了衍射角(2θ),并且纵坐标示出了峰强度。[图11]图11为示出了在实例1中获得的化合物(i)二铵盐的晶体(晶型1)的吸湿性的图。横坐标示出了相对湿度,并且纵坐标示出了重量变化。[图12]图12为示出了在实例2中获得的化合物(i)二铵盐的晶体(晶型2)的吸湿性的图。横坐标示出了相对湿度,并且纵坐标示出了重量变化。[图13]图13为示出了在实例5中获得的化合物(i)二铵盐的晶体(晶型5)的吸湿性的图。横坐标示出了相对湿度,并且纵坐标示出了重量变化。[图14]图14为示出了在实例6中获得的化合物(i)单铵盐的晶体(晶型6)的吸湿性的图。横坐标示出了相对湿度,并且纵坐标示出了重量变化。[图15]图15为示出了在实例7中获得的化合物(i)钠盐的晶体的吸湿性的图。横坐标示出了相对湿度,并且纵坐标示出了重量变化。[图16]图16示出了wysting的表达载体图(plenti-wt人sting-puro)。[图17]图17伴随药理学测试实例6,并且示出了化合物(i)二铵盐在ct26双肿瘤模型中的治愈活性。[图18]图18伴随药理学测试实例6,并且示出了化合物(i)二铵盐在ct26双肿瘤模型中的治愈活性。[图19]图19伴随药理学测试实例7,并且示出了经治疗的肿瘤的肿瘤体积图和存活曲线。[图20]图20伴随药理学测试实例8,并且示出了经治疗的肿瘤的肿瘤体积图和存活曲线。[图21]图21示出了晶体(晶型1)的tg-dta热分析图。[图22]图22示出了在室温(下边的图)和高于60℃(上边的图)下晶体(晶型1)的粉末x射线衍射图。[图23]图23示出了以下粉末x射线衍射图的比较:1)通过透射法分析出的晶体(晶型1)图(下边),2)通过反射方法分析出的加热至高于60℃的晶体(晶型1)样品的图(中间),3)通过透射法分析出的晶体(晶型2)图(上边)。[图24]图24示出了在不同温度下的晶体(晶型1)的粉末x射线衍射图:1)室温(下边的图),2)61℃至71℃(中间的图),3)125℃至134℃(上边的图)。[图25]图25示出了在25℃下晶型1的吸附和脱附等温线。[图26]图26示出了在于25℃、94%rh下储存4天之前(下边的图)和之后(上边的图)的晶型1的pxrd图的比较。实施方式说明将具体描述本发明的化合物(i)的盐、其晶体及其生产方法。如本文所使用的,“盐”是指由作为酸性组分的化合物(i)和与特定当量数量的化合物(i)的碱组成的化学实体。在此,术语“由式(i)表示的(1r,3r,15e,28r,29r,30r,31r,34r,36r,39s,41r)-29,41-二氟-34,39-双(巯基)-2,33,35,38,40,42-六氧-4,6,9,11,13,18,20,22,25,27-十氮杂-34λ5,39λ5-二磷八环[28.6.4.13,36.128,31.04,8.07,12.019,24.023,27]四十二烷-5,7,9,11,15,19,21,23,25-壬烯-34,39-二酮(化合物(i))和选自下组的碱的盐,该组由以下各项组成:氢氧化钠、碳酸钠、乙醇中的氨和氢氧化铵等”用于与“由式(i)表示的(1r,3r,15e,28r,29r,30r,31r,34r,36r,39s,41r)-29,41-二氟-34,39-双(巯基)-2,33,35,38,40,42-六氧-4,6,9,11,13,18,20,22,25,27-十氮杂-34λ5,39λ5-二磷八环[28.6.4.13,36.128,31.04,8.07,12.019,24.023,27]四十二烷-5,7,9,11,15,19,21,23,25-壬烯-34,39-二酮(化合物(i))与选自下组的碱形成的盐,该组由以下各项组成:氢氧化钠、碳酸钠、乙醇中的氨和氢氧化铵等”相同的含义。在此使用的“盐”的实例包括具有无机碱的盐,并且特别地,优选药学上可接受的盐。化合物(i)的盐也可以是溶剂合物或水合物。如本文所使用的,化合物(i)的盐的溶剂合物或水合物意指化合物(i)的盐与溶剂分子或水分子形成的固体。溶剂合物中的溶剂的实例包括:酮溶剂,例如丙酮、甲基乙基酮或环己酮;酯溶剂,例如乙酸乙酯或乙酸甲酯;醚溶剂,例如1,2-二甲氧基乙烷或甲基叔丁基醚;醇类溶剂,如甲醇、乙醇、1-丙醇或异丙醇;极性溶剂,例如n-甲基-2-吡咯烷酮、n,n-二甲基甲酰胺或二甲基亚砜。如本文所使用的,“晶体”是指化合物(i)的盐的晶体或化合物(i)的晶体。因此,例如,化合物(i)铵盐的晶体意指化合物(i)和氨(或氢氧化铵)之间形成的盐的晶体。此外,例如,化合物(i)二铵盐的晶体意指一分子的化合物(i)和两分子的氨(或氢氧化铵)之间形成的盐的晶体。在此优选的晶体实例包括:(a1)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为8.3°处具有衍射峰的晶体(晶型1);(a2)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为8.3°和16.6°处具有衍射峰的晶体(晶型1);(a3)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.4°、8.3°和16.6°处具有衍射峰的晶体(晶型1);(a4)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.4°、8.3°、12.7°、16.6°和25.4°处具有衍射峰的晶体(晶型1);(a5)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.4°、8.3°、12.7°、16.6°、22.1°、22.8°和25.4°处具有衍射峰的晶体(晶型1);(a6)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.4°、8.3°、12.7°、14.6°、16.6°、18.1°、22.1°、22.8°、24.4°和25.4°处具有衍射峰的晶体(晶型1);(b1)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为9.0°处具有衍射峰的晶体(晶型2);(b2)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为9.0°和15.4°处具有衍射峰的晶体(晶型2);(b3)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为9.0°、15.4°和20.8°处具有衍射峰的晶体(晶型2);(b4)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为9.0°、15.4°、20.8°、24.0°和30.0°处具有衍射峰的晶体(晶型2);(b5)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为9.0°、11.8°、15.4°、20.8°、24.0°、30.0°和31.1°处具有衍射峰的晶体(晶型2);(b6)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为7.0°、9.0°、11.8°、13.2°、15.4°、19.7°、20.8°、24.0°、30.0°和31.1°处具有衍射峰的晶体(晶型2);(c1)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为7.4°处具有衍射峰的晶体(晶型3);(c2)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为7.4°和16.0°处具有衍射峰的晶体(晶型3);(c3)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为7.4°、16.0°和21.4°处具有衍射峰的晶体(晶型3);(c4)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.0°、7.4°、9.3°、16.0°和21.4°处具有衍射峰的晶体(晶型3);(c5)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.0°、7.4°、9.3°、12.6°、16.0°、16.6°和21.4°处具有衍射峰的晶体(晶型3);(c6)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.0°、7.4°、9.3°、12.6°、16.0°、16.6°、18.1°、21.4°、22.0°和22.8°处具有衍射峰的晶体(晶型3);(d1)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为9.7°处具有衍射峰的晶体(晶型4);(d2)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为9.7°和14.0°处具有衍射峰的晶体(晶型4);(d3)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为9.7°、14.0°和26.9°处具有衍射峰的晶体(晶型4);(d4)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为9.7°、14.0°、17.4°、22.3°和26.9°处具有衍射峰的晶体(晶型4);(d5)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为7.6°、9.7°、14.0°、17.4°、22.3°、24.6°和26.9°处具有衍射峰的晶体(晶型4);(d6)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为5.9°、7.6°、9.7°、11.6°、14.0°、16.0°、17.4°、22.3°、24.6°和26.9°处具有衍射峰的晶体(晶型4);(e1)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为20.0°处具有衍射峰的晶体(晶型5);(e2)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为20.0°和23.6°处具有衍射峰的晶体(晶型5);(e3)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为10.9°、20.0°和23.6°处具有衍射峰的晶体(晶型5);(e4)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为10.9°、17.7°、18.9°、20.0°和23.6°处具有衍射峰的晶体(晶型5);(e5)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为10.9°、13.0°、17.7°、18.9°、20.0°、21.5°和23.6°处具有衍射峰的晶体(晶型5);(e6)化合物(i)二铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为9.0°、9.6°、10.9°、13.0°、15.3°、17.7°、18.9°、20.0°、21.5°和23.6°处具有衍射峰的晶体(晶型5);(f1)化合物(i)单铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为17.0°处具有衍射峰的晶体(晶型6);(f2)化合物(i)单铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为17.0°和25.9°处具有衍射峰的晶体(晶型6);(f3)化合物(i)单铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为17.0°、21.6°和25.9°处具有衍射峰的晶体(晶型6);(f4)化合物(i)单铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为15.1°、16.4°、17.0°、21.6°和25.9°处具有衍射峰的晶体(晶型6);(f5)化合物(i)单铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为12.0°、15.1°、16.4°、17.0°、21.6°、22.8°和25.9°处具有衍射峰的晶体(晶型6);(f6)化合物(i)单铵盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.9°、8.5°、12.0°、15.1°、16.4°、17.0°、21.0°、21.6°、22.8°和25.9°处具有衍射峰的晶体(晶型6);(g1)化合物(i)钠盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.1°处具有衍射峰的晶体;(g2)化合物(i)钠盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.1°和16.6°处具有衍射峰的晶体;(g3)化合物(i)钠盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.1°、9.3°和16.6°处具有衍射峰的晶体;(g4)化合物(i)钠盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.1°、9.3°、15.9°、16.6°和22.3°处具有衍射峰的晶体;(g5)化合物(i)钠盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.1°、9.3°、13.4°、15.9°、16.6°、20.6°和22.3°处具有衍射峰的晶体;(g6)化合物(i)钠盐的在粉末x射线衍射中在衍射角(2θ±0.2°)为6.1°、9.3°、13.4°、14.8°、15.9°、16.6°、20.6°、22.3°、23.5°和24.4°处具有衍射峰的晶体;(h1)化合物(i)的在粉末x射线衍射中在衍射角(2θ±0.2°)为5.6°处具有衍射峰的晶体;(h2)化合物(i)的在粉末x射线衍射中在衍射角(2θ±0.2°)为5.6°和13.9°处具有衍射峰的晶体;(h3)化合物(i)的在粉末x射线衍射中在衍射角(2θ±0.2°)为5.6°、13.9°和16.8°处具有衍射峰的晶体;(h4)化合物(i)的在粉末x射线衍射中在衍射角(2θ±0.2°)为5.6°、8.9°、11.4°、13.9°和16.8°处具有衍射峰的晶体;(h5)化合物(i)的在粉末x射线衍射中在衍射角(2θ±0.2°)为5.6°、7.9°、8.9°、11.4°、13.9°、16.8°、22.1°和23.1°处具有衍射峰的晶体。上文描述的在粉末x射线衍射中的峰是化合物(i)二铵盐的晶体(晶型1)、化合物(i)二铵盐的晶体(晶型2)、化合物(i)二铵盐的晶体(晶型3)、化合物(i)二铵盐的晶体(晶型4)、化合物(i)二铵盐的晶体(晶型5)、化合物(i)单铵盐的晶体(晶型6)、化合物(i)钠盐的晶体和化合物(i)的晶体各自的特征。通常,在粉末x射线衍射中可能出现在±0.2°范围内的衍射角(2θ)误差,并且因此需要考虑上述衍射角值包括在约±0.2°范围内的值。因此,包括在本发明中的不仅是在粉末x射线衍射中具有完全相同衍射角的峰的晶体,而且还包括在衍射角的约±0.2°的误差范围内具有峰的晶体。因此,如本文所使用的,“在衍射角(2θ±0.2°)为8.3°处具有衍射峰,例如,意指“在衍射角(2θ)为8.1°至8.5°处具有衍射峰。这同样适用于其他衍射角。通常,对于每次测量,粉末x射线衍射中衍射角(2θ)的峰强度和半值宽度是不同的,因为测量条件、粉末晶体的每个颗粒的尺寸和形状分散的差异、以及即使晶体晶型相同但不总是稳定的。因此,在比较粉末x射线衍射图的情况下,当衍射角(2θ)相同但峰强度、相对峰强度和半值宽度不同时,这些差异并不意味着测量出的晶型彼此不同。因此,具有粉末x射线衍射图的盐的晶体,其对于根据本发明所述的盐的某种晶体的特征衍射峰具有上述差异,意味着该晶体具有与根据本发明所述的盐的晶体相同的晶型。如本文所使用的,“具有与图3中所示的粉末x射线衍射图基本相同的粉末x射线衍射图”意味着它不仅包括具有与如图3中所示的完全相同的粉末x射线衍射图的情况,还包括峰强度、相对峰强度和半值宽度不同的情况,或者在衍射角的约±0.2°的误差范围内具有特征峰的情况。因此,具有这种粉末x射线衍射图的每种晶体都意味着该晶体与根据本发明所述的晶体相同。将详细描述用于生产化合物(i)的盐及其晶体的方法。(化合物(i)的生产)如下文生产实例1或生产实例2中具体描述可以合成化合物(i)。(用于生产化合物(i)的盐的方法)可以通过用于生产盐的常规方法获得化合物(i)的盐。具体地,例如可以通过以下方法来生产化合物(i)的盐:将化合物(i)悬浮或溶解于溶剂中,如果需要的话在加热条件下;然后向所得悬浮液或溶液中添加碱(例如,对于钠盐,氢氧化钠、碳酸钠;对于单铵盐或二铵盐,乙醇中的氨和氢氧化铵);以及在室温下或冰浴冷却下将所得悬浮液或溶液搅拌或静置若干分钟至若干天。根据上述生产方法可以获得化合物(i)的盐,为晶体或无定型物质。这些方法中使用的溶剂的实例包括醇类溶剂,例如乙醇、1-丙醇和异丙醇;乙腈;酮溶剂,例如丙酮和2-丁酮;酯溶剂,如乙酸乙酯;饱和烃溶剂,例如己烷和庚烷;醚溶剂,例如叔-丁基甲基醚;或者水。这些溶剂中每一种可以单独使用,或者可以两种或更多种混合并且使用。(用于生产化合物(i)的盐的晶体的方法)可以通过上述用于生产化合物(i)的盐的方法,或者通过将化合物(i)的盐加热溶解于溶剂中并通过搅拌冷却使其结晶来生产化合物(i)的盐的晶体。要在结晶中使用的化合物(i)的盐可以是任何形式的:其可以为溶剂合物、水合物、无水物、无定型物质、结晶物质(包括由多种结晶多晶型物组成的那些)或其组合。在结晶中使用的溶剂的实例包括醇类溶剂,例如甲醇、乙醇、异丙醇和1-丙醇;乙腈;酰胺溶剂,例如n,n-二甲基甲酰胺;酯溶剂,如乙酸乙酯;饱和烃溶剂,例如己烷和庚烷;酮溶剂,例如丙酮和2-丁酮;醚溶剂,例如叔-丁基甲基醚;或者水。此外,这些溶剂中每一种可以单独使用,或者可以两种或更多种混合并且使用。要使用的溶剂的量可以适当选择,条件是下限是通过加热溶解游离形式的化合物(i)或其盐或者可以搅拌悬浮液的量,并且上限是晶体产率没有显著降低的量。可以在结晶过程中添加或不添加晶种(例如,希望的化合物(i)的盐的晶体)。添加晶种的温度不受具体限制,但优选地是0℃至80℃。作为加热溶解化合物(i)的盐时采用的温度,可以取决于溶剂适当选择溶解化合物(i)的温度,但优选地在重结晶溶剂开始回流的温度至50℃的范围内,更优选地65℃至55℃。在快速冷却的情况下,结晶期间的冷却可以给出含有不同形式晶体(多晶型)的物质。因此,基于冷却对晶体的质量、晶粒尺寸等的影响的考虑,希望在适当地控制冷却速率的同时进行冷却。优选地,例如,在40℃/小时至5℃/小时的冷却速率下冷却。更优选地,在例如25℃/小时至5℃/小时的冷却速率下冷却。此外,最终结晶温度可以根据晶体的产率、质量等适当选择,但优选地是30℃至-25℃。可以通过以下方法获得目标晶体:通过常规过滤程序分离所形成的晶体,如果需要的话,用溶剂洗涤滤出的晶体,并将其进一步干燥。作为用于洗涤晶体的溶剂,可以使用与结晶中相同的溶剂。此外,这些溶剂中每一种可以单独使用,或者可以两种或更多种混合并且使用。优选地,溶剂为,例如,丙酮、2-丁酮、乙酸乙酯、叔-丁基甲基醚、己烷或己烷/2-丁酮的混合溶剂。通过过滤程序分离出的晶体可以通过在空气或氮气流中静置或者通过加热适当地干燥。作为干燥时间,可以取决于生产的量、干燥设备、干燥温度等适当选择直至残留溶剂量变得小于预定量的时间。此外,干燥可以在气流或减压下进行。可以取决于生产的量、干燥设备、干燥温度等适当选择减压程度。干燥后,可以根据需要将所得晶体留在空气中。(用于生产化合物(i)的晶体的方法)可以通过上文所示的用于生产晶体的常规方法获得化合物(i)的晶体。本发明的药物组合物可以通过将药学上可接受的添加剂与化合物(i)的盐或其晶体混合来制备。本发明的药物组合物可以根据已知的方法来制备,例如日本药典第17版的generalrulesforpreparations[制剂通则]中描述的方法。本发明的药物组合物可以取决于剂型适当地给予至患者。本发明的药物组合物具有作为用于治疗癌症的治疗剂的实用性,因为化合物(i)的盐或其晶体可以有效激活sting途径并显示出有效的抗肿瘤活性。癌症的实例包括胶质瘤、黑素瘤和结肠癌。化合物(i)的盐或其晶体的剂量取决于症状的程度、年龄、性别、体重、剂型、盐的类型、疾病的具体类型等而变化。在成人的情况下,典型地每天口服给予约30μg至10g,优选100μg至5g,并且更优选100μg至1g,或者在各种情况下,以单剂量或分开的剂量每天注射给予约30μg至1g,优选100μg至500mg,并且更优选100μg至300mg。实例在下文中,将通过生产实例和实例详细描述本发明。然而,本发明不旨在受这些实例的限制。在整个实例中可以使用以下缩写。dmt:4,4'-二甲氧基三苯甲基(dmto-:[化学式3]bz:苯甲酰ce:氰乙基[化学式4]dead:偶氮二甲酸二乙酯diad:偶氮二甲酸二异丙酯dcm:二氯甲烷ddtt:n,n-二甲基-n'-(3-硫代-3h-1,2,4-二噻唑-5-基)甲酰胺[化学式5]dmocp:2-氯-5,5-二甲基-1,3,2-二氧杂膦-2-氧化物[化学式6]tbs:叔丁基二甲基3h苯并[c][1,2]二硫酚-3-酮:[化学式7]mtbe:甲基叔丁基醚粉末x射线衍射将每个结晶样品置于粉末x射线衍射仪的样品台上,并在以下条件之一下进行分析。传输方法条件设备:x’pertprompd或empyrean(spectris)x射线源:cukα(45kv,40ma)光学系统:聚焦镜soller狭缝:0.02弧度或0.04弧度检测器:x’celerator或pixcel1d检测器(半导体检测系统)模式:传输扫描范围:3°或5°至35°或40°步长:0.013°、0.017°或0.033°步进扫描时间:9秒、19秒、305秒、1976秒或2000秒样品架:kapton(注册商标)膜反射方法条件设备:rintttr-iii(rigaku)x射线源:cukα(50kv,300ma)检测器:闪烁计数器模式:反射狭缝:0.5mm(发散狭缝)、开口(散射狭缝)、开口(光接收狭缝)扫描速率:5°/分钟或10°/分钟加样间隔:0.02°扫描范围:3°或5°至35°样品架:铝架1hnmr:质子核磁共振耦合常数以赫兹(hz)记录。裂分形式的缩写如下:s:单重峰、d:双重峰、t:三重峰、q:四重峰、m:多重峰、bs:宽单峰、brs:宽单峰、dd:双重峰的双重峰、dt:三重峰的双重峰、brd:宽双峰、brt:宽三峰除非另有说明,1hnmr谱是在bruker300mhz或400mhznmr上获得的。吸湿性将所得固体称入取样杯中,并将取样杯置于25℃的等温室内。使用重量蒸汽吸附系统将相对湿度(rh)控制在0%至95%,并且在预定的时间间隔(例如,每2分钟)内测量每个rh阶段的样品重量。每个rh阶段的重量变化以逐步的方式评估,并且然后最后在以下标准下确定。每次测量的最大重量变化在5分钟内小于0.01%(w/w)或在1分钟内小于0.002%(w/w)。生产实例1化合物(i)的合成步骤a[化学式8]在环境温度下,向在thf(1.1l)中的(2r,3r,4r,5r)-5-(6-苯甲酰-9h-嘌呤-9-基)-2-((双(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-氟四氢呋喃-3-基(2-氰基乙基)二异丙基亚磷酰胺(化合物(1))(磷非对映异构体的混合物;80.0g,91.332mmol,1当量,chemgenescorporation公司目录号#anp-9151)、烯丙醇(9.63ml,142mmol,1.55当量)和三苯基膦(38.3g,146mmol,1.60当量)的混合物中添加dead(40重量%甲苯溶液;54.2ml,137mmol,1.5当量)。在环境温度下持续搅拌,通过lc/ms监测反应。完成后(19h),将混合物真空浓缩(35℃),并将所得混合物通过硅胶柱色谱法(800g×2柱,在用0.5%三乙胺缓冲的正庚烷中的40%至60%etoac)纯化给出到化合物(2),为白色泡沫(84.2g,定量产率,磷非对映异构体的混合物)。1hnmr(磷非对映异构体的3:2混合物,400mhz,cdcl3)δ1.14-1.21(m,12h),2.40(t,j=6.2hz,1.2h),2.59(t,j=6.2hz,0.8h),3.27(d,j=8.6hz,1h),3.52-3.66(m,5h),3.78(s2.4h),3.79(s3.6h),4.28-4.34(m,1h),4.84-4.96(m,0.4h),4.99(d,j=5.5hz,2h),4.95-5.10(m,0.6h),5.05(d,j=10.9hz,1h),5.22(brd,j=17.6hz,1h),5.64(brd,j=53.2hz,0.6h),5.70(brd,j=51.6hz,0.4h),5.96-6.75(m,1h),6.20(d,j=16.0hz,0.6h),6.24(d,j=17.2hz,0.4h),6.74-6.79(m,4h),7.02-7.06(m,2h),7.17-7.24(m,8h),7.32-7.34(m,2h),7.41-7.44(m,2h),8.11(s,1h),8.52(s,0.4h),8.54(s,0.6h)。步骤b[化学式9]向在乙腈(30ml)中的化合物(2)(3.00g,3.28mmol,1当量)的溶液中添加水(0.118当量ml,6.55mmol,2.0当量)和吡啶三氟乙酸盐(0.759g,3.93mmol,1.2当量)。在环境温度下搅拌1分钟后,添加叔丁胺(14.5g,21.0ml,0.20mol,60当量)。在完全裂解氰乙基(通过lc/ms监测)后,将反应混合物真空浓缩并与乙腈共沸两次。将粗混合物溶解于dcm(45.0ml)中,并在环境温度下用水(0.118ml,6.55mmol,2.0eq.)和nahso4-sio2(1.18g,6.55mmol,2当量)处理。在完全裂解dmt基团(通过lc/ms监测,约1小时)后,过滤反应混合物并用dcm/meoh(9/1,20ml)冲洗两次。将合并的滤液真空浓缩,并用1:1的正庚烷/甲苯(约30ml)混合物处理。通过倾析除去顶层。用正庚烷/甲苯(1/1,30ml)再次重复相同的操作,并将底层与乙腈共沸两次,以给出化合物(3)(假设理论产率为100%)。该产物不经进一步纯化用于下一步骤中。步骤c[化学式10]向在乙腈(30ml)中的化合物(3)(1.56g,3.27mmol,1eq.)和化合物(1)(3.00g,3.28mmol,1eq.)的混合物中添加吡啶三氟乙酸盐(用吡啶共沸干燥;0.760g,3.94mmol,1.25当量)。5分钟后,添加ddtt(0.840g,4.09mmol,1.30当量,chemgenescorporation公司目录号#rn-1588),在完全硫化(通过lc/ms监测)后,将反应混合物真空浓缩。将残余物溶解于dcm(30ml)中,用水(0.57ml,32mmol,10eq.)和在dcm(30ml)中的6%二氯乙酸(1.56ml,18.9mmol,6.0eq.)处理。20分钟后,用吡啶(20ml)淬灭反应并真空浓缩。将残余物与吡啶共沸,以给出化合物(4)(3.22g,假设理论产率为100%)。该产物不经进一步纯化用于下一步骤中。步骤d[化学式11]在环境温度下向在吡啶(100ml)中的化合物(4)(3.22g,3.15mmol,1当量)溶液中添加dmocp(1.45g,7.88mmol,2.50当量)。完成大环化后(通过lc/ms监测),添加水(1.7ml,94.5mmol,相对于dmocpx10倍),然后添加3h-苯并[c][1,2]二硫醇-3-酮(0.795g,4.73mmol,1.5当量)。完成硫化(约40分钟)后,将反应混合物在真空中部分浓缩至约15ml,倒入水性饱和nahco3(50ml)和水(30ml)的混合物中。在环境温度下搅拌10min后,用1:1的etoac/mtbe(60ml×3次)混合物萃取该混合物。合并有机层,用盐水(25ml)洗涤,经mgso4干燥并真空浓缩。通过硅胶柱色谱法(在dcm中的0%至20%meoh)纯化残余物,以给出化合物(5)(3.31g,3.20mmol,假设理论产率为100%),为棕色油状物。该产物不经进一步纯化用于下一步骤中。步骤e[化学式12]向在乙腈(66.2ml)中的化合物(5)(3.31g,3.20mmol,1eq.)的溶液中添加2-硝基苄基溴(2.42g,11.2mmol,3.50当量)和三乙胺(1.78ml,12.8mmol,4.00当量)。在完成反应(通过lc/ms监测,在环境温度下约20小时)后,将反应混合物真空浓缩并通过硅胶柱色谱法(60%乙酸乙酯/正庚烷至100%乙酸乙酯)纯化,以给出0.568g产物,为磷非对映异构体的混合物。非对映异构体的制备型hplc分离给出化合物(6)(sr异构体;0.225g,0.180mmol,从化合物(2)的总产率5.6%)和化合物(7)(rr异构体;0.187g,0.149mmol,从化合物(2)的总产率4.7%)。化合物(6)(sprp)1hnmr(400mhz,cdcl3)δ(ppm):8.63(s,1h),8.61(s,1h),8.04-8.00(m,2h),7.99(s,1h),7.90(s,1h),7.65-7.44(m,8h),7.40-7.31(m,4h),7.25-7.21(m,4h),6.15-5.89(m,5h),5.61(dd,j=52.0,5.1hz,1h),5.55(ddd,j=51.2,4.7,2.7hz,1h),5.51-5.42(m,1h),5.31-5.22(m,2h),5.11(dd,j=3.9,9.8hz,2h),5.04-4.95(m,4h),4.55-4.37(m,7h),4.29-4.12(m,3h)。化合物(7)(rprp)1hnmr(400mhz,cdcl3)δ(ppm):8.65(s,2h),8.06(dd,j=1.4,8.0hz,2h),7.98(s,2h),7.57-7.52(m,6h),7.47-7.32(m,6h),7.25-7.21(m,4h),6.15(d,j=18.7hz,2h),6.09-5.99(m,2h),5.82-5.76(m,2h),5.60(dd,j=51.8,4.9hz,2h),5.27(dd,j=1.2,17.2hz,2h),5.12(dd,j=1.0,10.4hz,2h),5.06-4.96(m,4h),4.55-4.40(m,4h),4.36-4.24(m,4h),4.21-4.02(m,2h)。[表1]制备型hplc条件:步骤f[化学式13]向在甲苯(519ml)中的化合物(6)(519mg,0.414mmol,1eq.)的加热溶液(90℃)中添加hoveyda-grubbscatalysttm第2代((1,3-双-(2,4,6)-三甲基苯基)-2-咪唑烷亚基)二氯(邻-异丙氧基苯基亚甲基)钌(可以从西格玛奥德里奇公司(sigma-aldritch)(注册商标)目录号569755获得;cas301224-40-8;91mg,0.15mmol,0.35当量)和醌(0.102ml,1.243mmol,3.0当量)。将混合物加热至回流并通过lc/ms监测反应进展。3小时后,添加另外的催化剂(91mg,0.15mmol,0.35当量),并且继续再反应3小时。冷却后,在环境温度下将混合物用dmso(0.59ml,8.3mmol,20当量)处理15小时,真空浓缩并通过硅胶柱色谱法(sio225g,66%乙酸乙酯的正庚烷溶液至100%的乙酸乙酯)纯化,以给出化合物(8)(200mg,0.163mmol,产率39%),为棕色干燥泡沫。1hnmr(400mhz,cdcl3)δ(ppm):8.19(s,1h),8.12(dd,j=7.8hz,1.9hz,1h),8.10(s,1h),8.02(d,j=8.2hz,1h),7.89(s,1h),7.63(brd,j=7.0hz,1h),7.53-7.41(m,10h),7.35-7.30(m,2h),7.25-7.20(m,4h),6.23(d,j=17.6hz,1h),6.14(d,j=18.8hz,1h),5.86-5.75(m,1h),5.75(dt,j=15.3,5.0hz,1h),5.67(dt,j=15.3,4.7hz,1h),5.60(dd,j=52.0,3.9hz.1h),5.48(dd,j=50.4,3.9hz.1h),5.50-5.39(m,1h),4.91-4.64(m,4h),4.57-4.25(m,9h),4.15(d,j=7.03hz,1h),4.11(d,j=7.03hz,1h)。步骤g[化学式14]向在1,4-二噁烷(1.76ml)中的化合物(8)(88mg,0.072mmol,1当量)的溶液中添加苯硫酚(0.88ml,8.55mmol,119当量)和三乙胺(0.88ml,6.31mmol,88当量)。在环境温度下将所得混合物搅拌。在完成反应(通过lc/ms监测,13小时)后,添加甲醇(5.28ml)和28%氢氧化铵(3.52ml),将所得混合物加热至50℃。在完成反应(通过lc/ms监测,5小时)后,将混合物冷却至环境温度,过滤所得褐色浆料并用水(15ml)冲洗。再次过滤滤液以除去另外的固体。最终滤液用甲苯和正庚烷的1:1混合物(30ml)萃取两次。将水层真空浓缩,并且然后重悬于水(6ml)中。滤出所得固体,使滤液进行制备型hplc,以给出化合物(i)的二铵盐(也被称为化合物(1a))(39mg,0.050mmol,产率70%),为白色固体。化合物(1a)(sprp,反式)1hnmr(400mhz,cd3od)δ(ppm):9.05(s,1h),8.33(s,1h),8.25(s,1h),8.12(s,1h),6.34(brs,2h),5.88(brs,2h),5.66(brd,j=51.6hz,1h),5.59(brd,j=52.2hz,1h),5.01(brs,2h),4.68-4.34(m,6h),4.07-3.82(m,2h),3.79-3.55(m,2h);31pnmr(162mhz,cd3od)δ(ppm):55.48(s,1p),55.16(s,1p)。[表2]化合物(1a)制备型hplc条件:仪器agilent1200/1260as/fchplc柱watersxbridgec18,10x100mm,#1413流速3.0ml/min柱温35℃流动相a:水中0.1%nh4oh,b:乙腈中的0.1%nh4oh梯度(b%)0→50运行时间20min注射体积50ul(水中4mg/ml)检测uv260nm停留时间6.5min生产实例2(化合物(1a)的替代合成)阶段1[化学式15]将化合物(201)(570g,1.53mol,1重量,1体积,1当量)溶解于吡啶(2.85l,35.2mol,4.89重量,5.0体积,23当量)中。将混合物冷却至2.6℃并用4,4’-二甲氧基三苯甲基氯(dmtcl;543g,1.60mol,0.953重量,1.05当量)处理。在0至5℃下将混合物搅拌2h,并且然后允许温热至环境温度。通过lc/ms监测反应,并且在搅拌过夜后确认完全转化。将反应混合物冷却至低于5℃,并通过用meoh(124ml,3.05mol,0.172重量,0.217体积,2.0当量)处理15分钟来猝灭。将混合物在真空下与甲苯(2.00l,3.04重量,3.51体积)共蒸发,并且然后用etoac(2.850l,4.5重量,5.0体积)和正庚烷(2.85l,3.42重量,5.0体积)的混合物稀释。用饱和nahco3(9重量%水溶液;2.0l,3.5体积)洗涤有机层。添加另外的etoac(2.85l,4.5重量,5.0体积)以完全溶解粗产物。在搅拌5分钟后,分离两层。用水(2.0l,3.5重量,3.5体积)洗涤有机层。固体开始从有机层中缓慢沉淀出来。分离水层。然后将有机层浓缩至约1体积。将粗产物用正庚烷(2.00l,2.40重量,3.51体积)和甲苯(0.50l,0.76重量,0.88体积)的混合物浆化。搅拌15分钟后,通过真空过滤收集浅黄色固体。将滤饼依次用以下冲洗:(1)正庚烷(0.60l,0.72重量,1.05体积)和甲苯(0.30l,0.46重量,0.53体积)的混合物,和然后(2)正庚烷(3.00l,3.6重量,5.26体积)。在不加热的情况下将固体干燥30分钟,并且然后转移到托盘中用以在50℃下在真空烘箱中干燥过夜,以给出化合物(202),为浅黄色固体(996.7g,1.47mol,1.75重量,产率97%)。1hnmr(400mhz,chloroform-d)δ(ppm):8.99(s,1h),8.76(s,1h),8.21(s,1h),8.04-8.00(m,2h),7.64-7.59(m,1h),7.57-7.50(m,2h),7.41-7.36(m,2h),7.32-7.15(m,7h),6.83-6.76(m,4h),6.31(dd,j=2.5,17.0hz,1h),5.68(ddd,j=2.3,4.7,52.7hz,1h),4.88-4.77(m,1h),4.26-4.21(m,1h),3.77(s,6h),3.57(dd,j=3.1,10.9hz,1h),3.43(dd,j=4.1,10.7hz,1h),2.60(brs,1h)。阶段1’[化学式16]将化合物(201)(430g,1.15mol,1重量,1体积,1当量)和咪唑(118g,1.73mol,0.274重量,1.50当量)溶解于dmf(1.72l,3.78重量,4.0体积)中,将所得混合物冷却至5℃。添加tbs-cl(191g,1.27mol,0.444重量,1.10当量)。在0℃至11℃下将混合物搅拌2h,允许其缓慢温热至环境温度(通过lcms监测进展)。添加tbs-cl后6h反应完成,仍允许在环境温度下再搅拌20h。将混合物冷却至2℃并用甲醇(93ml,74g,2.3mol,0.17重量,0.22体积,2.0当量)处理10分钟。将反应混合物用mtbe(1.72l,1.23kg,2.96重量,4.0体积)和etoac(1.72l,1.55kg,3.60重量,4.0体积)的混合物稀释,然后用饱和nh4cl(28重量%水溶液;2.15l,5.0体积)稀释。固体开缓慢脱离溶液。允许将混合物温热至24℃,并向其(t-内部=22℃)中添加水(1.08l,1.08kg,2.5重量,2.5体积)。更多的固体开始从混合物中沉淀出来。向该混合物中添加另外的水(1.08l,1.08kg,2.5重量,2.5体积)和mtbe(1.40l,1.04kg,2.4重量,3.3体积)。通过真空过滤收集灰白色固体。用水(320ml,0.74体积)冲洗反应器,并且然后用mtbe(1.80l,1.33kg,3.10重量,4.19体积)冲洗,以将任何剩余的固体转移到过滤器中。将滤饼依次用以下冲洗:(1)水(1.80l,1.80kg,4.2重量,4.2体积),(2)水(1.80l,1.80kg,4.2重量,4.2体积),(3)mtbe(0.90l,0.67kg,1.5重量,2.1体积)和正庚烷(0.90l,0.62kg,1.4重量,2.1体积)的混合物,(4)mtbe(0.90l,0.67kg,1.5重量,2.1体积)和正庚烷(0.90l,0.62kg,1.4重量,2.1体积)的混合物。将回收的固体在40℃下真空干燥2天,以给出化合物(203),为白色固体(483g,0.991mol,1.12重量,产率86%)。1hnmr(400mhz,chloroform-d)δ(ppm):8.97(s,1h),8.82(s,1h),8.36(s,1h),8.04-8.00(m,2h),7.64-7.58(m,1h),7.56-7.51(m,2h),6.40(dd,j=2.3,16.0hz,1h),5.45(ddd,j=2.7,4.3,53.1hz,1h),4.75-4.66(m,1h),4.22-4.17(m,1h),4.07(dd,j=2.3,11.7hz,1h),3.91(dd,j=2.7,11.7hz,1h),2.38(dd,j=2.7,7.0hz,1h),0.92(s,9h),0.11(s,3h),0.11(s,3h)。阶段2[化学式17]将化合物(202)(993g,1.47mol,1重量,1体积,1当量)和咪唑(150g,2.20mol,0.151重量,1.5当量)溶解于dmf(3.48l,3.28kg,3.3重量,3.5体积)中,将该混合物冷却至5℃。添加tbs-cl(244g,1.62mol,0.245重量,1.10当量)。在0℃至5℃下将混合物搅拌2h,允许其缓慢温热至环境温度并通过lcms监测。17h后,添加另外的咪唑(100g,1.47mol,0.10重量,1.0当量)和tbs-cl(111g,735mmol,0.112重量,0.50当量),并在环境温度下继续搅拌2h,并且在35℃下搅拌2h。将所得混合物冷却至13.6℃并用meoh(119ml,2.94mol,2当量)处理10分钟。在单独的反应器中添加冰(5kg,5重量)和饱和nh4cl(28重量%水溶液;5.0l,5体积)。将反应混合物添加至冰/nh4cl混合物中。灰白色固体立即开始从溶液中沉淀出来。向该混合物中添加另外的2kg冰(2kg,2wt)和水(3.0l,3体积)。将反应烧瓶用水(0.50l,0.5体积)冲洗,并将冲洗液添加至混合物中。向混合物中添加正庚烷(2.00l,2体积)并继续搅拌10分钟。通过真空过滤收集灰白色固体。将滤饼用以下冲洗:(1)水(4.0l,4.0体积),(2)水(4.0l,4.0体积),(3)正庚烷(4.0l,4.0体积),(4)正庚烷(4.0l,4.0体积)。将回收的固体在45℃下真空干燥4天,以给出化合物(204),为白色固体(1.095kg,1.39mol,1.10重量,产率94%)。1hnmr(400mhz,chloroform-d)δ(ppm):9.09(s,1h),8.78(s,1h),8.28(s,1h),8.02(d,j=7.4hz,2h),7.63-7.59(m,1h),7.55-7.50(m,2h),7.37(d,j=7.1hz,2h),7.29-7.17(m,7h),6.79(d,j=7.9hz,4h),6.29(dd,j=2.9,16.2hz,1h),5.60(ddd,j=2.7,3.9,53.1hz,1h),4.78(ddd,j=4.7,6.4,15.8hz,1h),4.26-4.22(m,1h),3.77(s,6h),3.58(dd,j=3.1,10.9hz,1h),3.26(dd,j=3.7,10.7hz,1h),0.85(s,9h),0.10(s,3h),0.02(s,3h)。阶段3[化学式18]将化合物(204)(1000g,1.27mol,1重量,1体积,1当量)和反式-2-丁烯-1,4-二醇(通过1h-nmr确认的烯烃几何结构;335g,3.80mol,0.335重量,3.0当量)与thf(3.0l,3.0体积)共沸两次。将残余物溶解于thf(10l,10体积)和甲苯(15l,15体积)的混合物中。添加三苯基膦(432g,1.65mol,0.432重量,1.3当量),并且然后将反应混合物冷却至-5℃。在20分钟内缓慢添加diad(0.320l,1.65mol,333g,0.333重量,0.320体积,1.3当量),同时保持t-内部低于5℃。在0℃至5℃下将反应搅拌1h并通过lcms监测。移去冰浴,允许将混合物温热至室温。搅拌过夜(17h)后,添加三苯基膦(83g,0.32mol,0.083重量,0.25当量)和diad(62ml,0.32mol,64g,0.064重量,0.062体积,0.25当量)。在室温下再过1h后,将反应混合物用mtbe(10l,10体积)稀释,用半饱和的nacl(18重量%的水溶液;2×4l)洗涤两次,并真空浓缩成稠油状物。将混合物重新溶解于mtbe(4.00l,4体积)和正庚烷(0.50l,0.5体积)的混合物中,并且然后冷却至0℃。向溶液中添加三苯基氧化膦晶种。固体缓慢地开始从溶液中沉淀出来,并搅拌过夜。通过真空过滤收集白色固体,并用mtbe(2l,2体积)冲洗以分离540g三苯基氧化膦。将滤液浓缩并经由biotage150lkp-sil(sio25kg;用在庚烷/etoac中的1%tea预处理;洗脱液:正庚烷/etoac(48l的33%etoac和1%tea,24l的50%etoac和1%tea,24l的66%etoac和1%tea)→100%etoac和1%tea)纯化。通过tlc(2:1etoac/正庚烷)监测柱。合并清洁产物级分并真空浓缩,以给出化合物(205),为浅白色泡沫固体(634g,含有14重量%diad衍生的副产物,净545g,0.63mol,调节的产率50%)。合并混合物级分并真空浓缩,以给出浅黄色泡沫固体(750g),将其经由biotage150mhp-sphere(2.5kgsio2;用正庚烷/etoac中的1%tea预处理;用以下加载样品:甲苯洗脱液:正庚烷/etoac/1%tea(12l的50%etoac和1%tea,16l的66%etoac和1%tea)→etoac和1%tea)进行再纯化处理。通过tlc(2/1/0.03etoac/正庚烷/tea)监测柱。合并清洁产物级分并真空浓缩,以给出另外的化合物(205),为浅白色泡沫状固体(206g,0.24mol,产率18%)。1hnmr(400mhz,chloroform-d)δ(ppm):8.58(s,1h),8.10(s,1h),7.43-7.37(m,2h),7.32-7.28(m,2h),7.24-7.15(m,8h),7.03-6.98(m,2h),6.78-6.73(m,4h),6.18(dd,j=2.7,17.2hz,1h),5.88(td,j=5.5,15.6hz,1h),5.77(td,j=5.1,15.6hz,1h),5.60(ddd,j=2.7,4.3,53.1hz,1h),5.03-4.96(m,2h),4.91(ddd,j=4.5,6.6,16.6hz,1h),4.18-4.14(m,1h),3.88-3.82(m,2h),3.78(s,6h),3.52(dd,j=2.7,10.9hz,1h),3.14(dd,j=3.5,10.9hz,1h),0.85(s,9h),0.10(s,3h),0.01(s,3h)。阶段4[化学式19]将化合物(205)(800g,0.930mol,1重量,1体积,1当量)和化合物(203)(522g,1.07mol,0.652重量,1.15当量)与thf(2×3l,2×3.8体积)共沸干燥,并在室温下重新溶解于thf(9.60l,8.45kg,12.0体积)中。添加三苯基膦(317g,1.21mol,0.396重量,1.30当量),将混合物冷却至-5℃以下。在t-内部低于7℃下添加diad(226ml,1.16mol,235g,0.294重量,0.283体积,1.25当量)。允许反应缓慢温热至室温。通过lcms监测反应。21h后,将反应混合物真空浓缩成稠油状物,与正庚烷(2.00,1.37kg,1.71重量,2.50体积)共沸,并且然后再溶解于mtbe(2.40l,1.78kg,2.2重量,3.0体积)和正庚烷(800ml,547g,0.68重量,1.0体积)的混合物中。将溶液用三苯基氧化膦接种并冷却至5℃,用正庚烷(400ml,274g,0.34重量,0.50体积)稀释,并在5℃下搅拌30分钟。通过真空过滤收集白色固体沉淀物,并用mtbe和正庚烷的2:1(v/v)混合物(1.8l)冲洗,以给出三苯基氧化膦(455g)。将滤液真空浓缩,并经由biotage150lkp-sil(sio25kg;用1%tea预处理;通过溶解于甲苯洗脱液中加载样品:9:1正庚烷/etoac(16l)和15tea,3.6:1(46l),2:1(20l)和1%tea,1:1(30l)和1%tea,及100%etoac(16l)和1%tea)。将合并的清洁产物级分真空浓缩,以给出化合物(206),为浅白色泡沫状固体(662.2g)。合并混合物级分并真空浓缩(480g)。在加载到biotage150l上之前通过真空过滤除去用甲苯(300ml)稀释形成的白色不溶性固体。经由biotage150mhp-sphere(sio22.5kg(用1%tea预处理);用甲苯装载样品;洗脱液:2:1正庚烷/etoac(26l)w/1%tea,1:1(25l)w/1%tea,1:4(34l)w/1%tea)纯化可溶于甲苯的物质。通过tlc(1:1正庚烷/etoac)监测柱。将合并的清洁产物级分真空浓缩,以给出另外的化合物(206),为浅白色泡沫状固体(165.5g,总计662.2+165,5g=827.7g,930mmol,1.03重量,产率67%)。1hnmr(400mhz,chloroform-d)δ(ppm):8.47(s,1h),8.39(s,1h),8.20(s,1h),8.01(s,1h),7.38-7.31(m,5h),7.27-7.19(m,6h),7.14-7.06(m,3h),6.93-6.87(m,2h),6.76(d,j=8.6hz,4h),6.26(dd,j=2.0,16.0hz,1h),6.15(dd,j=2.7,17.2hz,1h),5.86(dd,j=4.7,15.2hz,1h),5.80(dd,j=4.7,15.2hz,1h),5.51(ddd,j=2.7,4.3,52.8hz,1h),5.31(ddd,j=2.0,4.3,52.8hz,1h),4.87(d,j=4.7hz,2h),4.85-4.81(m,1h),4.79(d,j=4.3hz,2h),4.71-4.59(m,1h),4.20-4.13(m,2h),4.06(dd,j=2.7,11.3hz,1h),3.90(dd,j=2.7,11.7hz,1h),3.77(s,6h),3.52(dd,j=3.1,10.9hz,1h),3.18(dd,j=3.9,10.9hz,1h),0.92(s,9h),0.84(s,9h),0.10(s,3h),0.09(s,6h),0.07(s,3h)。阶段5-6[化学式20]向在吡啶(1.23l,1.21kg,15.2mol,2.9重量,3.0体积,49当量)中的化合物(206)(410.7g,309mmol,1重量,1体积,1当量)的溶液中添加亚磷酸二苯酯(90ml,109g,0.46mol,0.26重量,0.22体积,1.5当量)。在室温下搅拌反应并通过lcms监测。2h后(80%转化率),添加另外的亚磷酸二苯酯(29.9ml,36.2g,155mmol,0.088重量,0.073体积,0.50当量)。再过1h后,添加额外的亚磷酸二苯酯(6.0ml,7.2g,31mmol,0.018重量,0.015体积,0.10当量)并继续再反应0.5h(98%转化率)。将反应混合物添加到饱和nahco3(9重量%水溶液;2.1l,5体积)和水(1.0ml,2.5体积)的混合物中,同时保持t-内部为4.7℃至12℃。用少量体积的etoac冲洗反应器。在室温下继续搅拌30分钟并通过lcms监测反应(100%转化率)。将反应混合物用etoac和mtbe的1:1混合物(2×8.2l,2×20体积)萃取两次。将合并的有机层用水(4.1l,10体积)洗涤,真空浓缩,并且与甲苯(3×4.1l,3×10体积;连续进料)共沸用以除去吡啶,以给出化合物(207)(0.55当量,剩余的吡啶)。阶段6在环境温度下将粗化合物(207)溶解于二氯甲烷(3.08l,4.07kg,9.9重量,7.5体积)中。添加水(55.7ml,0.136体积,10当量),然后添加在dcm(3.08l,7.5体积)中的二氯乙酸(77ml,120g,0.93mol,0.29重量,0.19体积,3.0当量)的溶液,同时保持内部t低于25℃(变成橙色溶液)。30min后,添加三乙基硅烷(et3sih;494ml,359g,3.09mol,0.875重量,1.20体积,10.0当量)(t-内部从18.2℃降至17℃)并继续搅拌20min。添加三乙胺(431ml,313g,3.09mol,0.762重量,1.05体积,10.0当量)(t-内部从17.8℃升至22℃)。将混合物浓缩至1.55kg(3.8重量),再溶于etoac(6.2l,5.5kg,14重量,15体积)中,依次用以下洗涤:(1)水(1.0l,2.5体积)和饱和nahco3(9重量%水溶液,0.82l,2.0体积)。将粗产物etoac溶液在-20℃下储存过夜;0.82l,2.0体积),并且第二天将溶液在25℃下真空浓缩。将由此获得的粗混合物(654g)与以下物质一起研磨:(1)正庚烷(3.01l,7.5体积),(2)正庚烷(2.46l,6.0体积)和甲苯(0.82l,2.0体积)的混合物。倾析出溶液部分(上清液),并且将残留在底部的固体溶解于乙腈(4.1l,10体积)中。将混合物在25℃下真空浓缩,并与乙腈共沸两次,以给出化合物(208)。该产物无需纯化即可用于后续阶段(假设理论产率为100%)。阶段7[化学式21]阶段7a在室温下将化合物(208)(337g,309mmol,1重量,1体积,1当量)溶解于无水吡啶(13.5l,13.2kg,39重量,40体积)中。添加三乙胺(129ml,927mmol,94g,0.28重量,0.38体积,3.0当量),然后添加2-氯-5,5-二甲基-1,3,2-二氧杂膦-2-氧化物(dmocp;103g,556mmol,0.31重量,1.80当量)。将所得混合物在环境温度下搅拌30分钟,并通过lcms(100%转化率)监测,以产生化合物(209)。阶段7b向上述化合物(209)的混合物中添加tea(129ml,927mmol,94g,0.28重量,0.38体积,3.0当量)、水(100ml,5.56mol,0.30重量,0.30重量,18当量)和硫(34.7g,1.08mol,0.10重量,3.5当量)。在90分钟(100%转化率)后,添加nahco3(9重量%水溶液;3.37l,10体积),同时保持t-内部低于30℃(16.6℃至27℃)。过滤所得混合物以除去盐。将滤液浓缩,混合物在真空中,用mtbe(5.1l,15体积)稀释,并用nacl(30重量%水溶液;2x1.35l,2x4体积)洗涤两次。滤出不溶性固体,并且将滤液真空浓缩,并与甲苯(4.0l,12体积)共沸。通过过滤除去所得固体,并且将粗混合物溶解在甲苯中,并经由biotage150lkp-sil(sio25kg;用正庚烷/etoac/tea(1.5/1.5/0.03cv)预处理;用以下物质洗脱:etoac/tea(3/0.03cv)、etoac/meoh/tea(4/0.2/0.04cv)、etoac/meoh/tea(2/0.2/0.02cv)纯化。通过tlc(etoac/meoh/tea=9/1/0.1)监测柱。合并含有sp异构体的级分并真空浓缩,以给出化合物(210),为浅粉色泡沫状固体(sp异构体;154g,128mmol,0.46重量,产率41.3%)。合并含有rp异构体的级分并真空浓缩,以给出化合物(212),为浅粉色泡沫状固体(rp异构体;64g,53mmol,0.19重量,产率17%)。化合物(210)(sp异构体):1hnmr(400mhz,chloroform-d)δ(ppm):8.51(s,1h),8.50(s,1h),8.22(s,1h),8.14(s,1h),7.49-7.44(m,2h),7.38-7.27(m,4h),7.25-7.21(m,2h),7.14(t,j=7.1hz,2h),6.44(dd,j=2.5,13.9hz,1h),6.18(d,j=15.2hz,1h),5.78(td,j=6.3,15.6hz,1h),5.69(td,j=4.7,15.6hz,1h),5.56(dd,j=3.9,50.8hz,1h),5.20-5.06(m,1h),4.95-4.79(m,4h),4.69(dd,j=4.3,16.0hz,1h),4.54-4.38(m,3h),4.35(d,j=5.5hz,1h),4.32-4.29(m,1h),4.05(dd,j=1.6,11.7hz,1h),3.91(dd,j=3.1,11.7hz,1h),3.14-3.06(m,6h),1.30(t,j=7.4hz,9h),0.91(s,9h),0.90(s,9h),0.12(s,3h),0.08(s,3h),0.06(s,3h),0.05(s,3h)。化合物(212)(sp异构体):1hnmr(400mhz,chloroform-d)δ(ppm):8.54(s,1h),8.38(s,1h),8.33(s,1h),8.01(s,1h),7.39-7.09(m,10h),6.39(dd,j=2.3,14.1hz,1h),6.13(d,j=17.2hz,1h),5.72(d,j=3.1hz,2h),5.68(dd,j=4.3,51.2hz,1h),5.43-5.29(m,1h),5.10-4.96(m,3h),4.90-4.83(m,2h),4.78-4.72(m,1h),4.52(ddd,j=3.9,6.6,17.2hz,1h),4.44-4.35(m,2h),4.31-4.26(m,1h),4.20-4.12(m,2h),3.87(dd,j=3.5,11.7hz,1h),3.79-3.77(m,1h),3.15-3.09(m,6h),1.33(t,j=7.4hz,9h),0.94(s,9h),0.89(s,9h),0.13(s,3h),0.12(s,3h),0.10(s,3h),0.09(s,3h)。阶段8[化学式22]将化合物(210)(221g,183mmol,1重量,1体积,1当量)溶解于吡啶(530ml,6.56mol,519g,2.3重量,2.4体积)和tea(2.65l,19.0mol,1.93kg,8.7重量,12体积,104当量)的混合物中。添加三乙胺三氢氟酸盐(264ml,1.62mol,262g,1.2重量,1.2体积,8.9当量作为络合物,27当量hf),并在室温下将混合物搅拌,同时通过lcms监测转化率。3h(97%转化率)后,添加甲氧基三甲基硅烷(tmsome;1.40l,10.2mol,1.06kg,4.8重量,6.3体积,55当量)并继续搅拌30分钟。将粘性固体涂覆在反应器上。倾析出溶液部分(上清液)。将固体用甲苯研磨两次(2×2.2l,2×10体积;倾析出的上清液)。将残留在反应器中的粗固体溶解于二氯甲烷(2.2l,10体积)中并用nh4cl(28重量%水溶液;2.2l,10体积)洗涤。用二氯甲烷(2.2l,10体积)反萃取水层。将合并的有机层用nacl(36重量%水溶液;1.1l,5体积)和水(1.1l,5体积)的混合物洗涤,并且然后真空浓缩,以给出化合物(211),为棕褐色干燥泡沫(152g,155mmol,0.70重量,产率85%)。该粗产物无需纯化即可用于下一步骤。阶段9[化学式23]将化合物(211)(150g,153mmol,1重量,1体积,1当量)与乙腈(4l,27体积)共沸,并且然后在室温下再溶解于乙腈(1.05l,0.83kg,5.5重量,7.0体积)中。在室温下添加2-硝基苄基溴(44.4g,205mmol,0.30重量,1.34当量)并通过lcms监测反应。23h(100%转化率)后,添加etoac(1.50l,10体积)、nh4cl(28重量%水溶液;300ml,2体积)和水(300ml,2体积)(ph=6),并在25℃、真空下将所得混合物部分浓缩至重量为1.11kg。添加etoac(2.25l,15体积)并将混合物搅拌5分钟。将两层分离。用乙酸乙酯萃取水层(750ml,5体积)。将合并的有机层依次用以下洗涤:(1)nacl(36重量%水溶液;300ml,2体积)和水(300ml,2体积)的混合物和(2)水(600ml,4体积)。然后将有机层真空浓缩并与正庚烷(1.50l,10体积)共沸。将mtbe(0.95l,6.3体积)添加至粗固体中,并将混合物在40℃下加热。将混合物用etoac(300ml,2体积)稀释并缓慢冷却至0℃。允许致密固体沉降,并通过过滤器玻璃管泵出上清液。用mtbe(2×300ml,2×2体积;每次从过滤器玻璃管泵出的上清液)冲洗固体两次,并在40℃下真空干燥过夜,以给出化合物(212),为浅黄色固体(156g)。将滤液真空浓缩,从而产生棕色油状物(17.8g),将其经由biotagesnap-ultra340g(洗脱液:在etoac中的0%至5%meoh)进行纯化,以给出另外的化合物(212),为浅黄色固体(5.8g)。总计156g+5.8g=161.8g(净152mmol,纯度95%,产率99%)1hnmr(400mhz,chloroform-d)δ(ppm);8.46(s,1h),8.15(s,1h),8.10(s,1h),8.09-8.06(m,1h),7.89(s,1h),7.54-7.51(m,1h),7.49-7.45(m,4h),7.37-7.28(m,3h),7.24-7.19(m,3h),7.16-7.11(m,2h),6.22(d,j=16.8hz,1h),6.14(dd,j=2.7,17.2hz,1h),5.83-5.61(m,3h),5.60-5.48(m,1h),5.07(dd,j=3.5,51.6hz,1h),5.06-4.96(m,1h),4.79(dd,j=4.9,15.8hz,1h),4.69(d,j=5.9hz,2h),4.67-4.56(m,1h),4.48-4.40(m,3h),4.37-4.30(m,1h),4.27(d,j=5.9hz,2h),4.19-4.13(m,1h),3.93-3.85(m,1h),3.85-3.78(m,1h)。阶段10-11[化学式24]阶段10将化合物(212)(纯度95%,净73.2g,72.3mmol,1重量,1体积,1当量)和2-氰基乙基n,n,n’,n’-四异丙基磷酰二亚胺(25.3ml,79.5mmol,0.33重量,0.35体积,1.10当量)与无水乙腈共沸三次(3×2l),重新溶解于二氯甲烷(0.73l,10体积)中并冷却至0℃至5℃。添加二异丙基铵四唑(6.19g,36.1mmol,0.085重量,0.50当量)。在0℃下将所得反应混合物搅拌10h,在2h内温热至10℃,在10℃下保持10h并在2h内温热至室温。通过lcms和tlc监测反应(etoac和0.5%tea)。18h后,添加无水乙腈(0.73l,10体积),并且将混合物在-20℃下储存3天。阶段11a将来自阶段10的混合物温热至环境温度并经由滴液漏斗分批(每30分钟100ml,在9h内)添加到吡啶三氟乙酸盐(预先与吡啶共沸两次;41.9g,217mmol,0.57重量,3.0当量)和乙腈(5.85l,80体积)的混合物中。通过lcms监测反应。13h后,在4h内添加2-氰基乙基n,n,n’,n’-四异丙基磷酰二亚胺(5.8ml,18mmol,0.25当量)的乙腈溶液(24ml)。基于剩余的化合物(212)(基于lcms的约30%)确定另外的试剂的量。6h后观察到更多的二醇转化。阶段11b添加((二甲基氨基亚甲基)氨基)-3h-1,2,4-二噻唑啉-3-硫酮(ddtt;20.8g,101mmol,0.28重量,1.4当量)并继续搅拌1h。将反应混合物部分浓缩至约800ml,并用mtbe(1.46l,20体积)、nahco3(9重量%水溶液;1.1l,15体积)和水(0.37l,5体积)稀释。ph=8。将各层分离,并且用mtbe(1.46l,20体积)和etoac(1.10l,15体积)的混合物萃取水层。将合并的有机层用30%nacl水溶液洗涤两次(2×0.73l,2×10体积),在35℃下真空浓缩并与甲苯(1.46l,20体积)共沸。lcms和tlc(etoac)表明化合物(215)(sprp,希望的):化合物(217)(spsp)=5:1经由biotage150mkp-sil(sio22.5kg;洗脱液:etoac/正庚烷:2:1(4cv),3:1(2.5cv),4:1(2.5cv),100%ea(3cv),ea中的5%至10%meoh4cv)纯化粗产物以给出化合物(215)(36g,31.5mmol,产率44%)。化合物(215)(sprp):1hnmr(400mhz,chloroform-d)δ(ppm):8.59(s,1h),8.10(s,1h),8.03-7.99(m,1h),7.91(s,1h),7.56-7.53(m,2h),7.49-7.40(m,5h),7.35-7.28(m,2h),7.24-7.16(m,4h),6.92(s,1h),6.29(d,j=14.9hz,1h),6.08(d,j=20.7hz,1h),5.97-5.83(m,1h),5.76(td,j=4.7,15.6hz,1h),5.61-5.51(m,2h),5.40(d,j=4.3hz,1h),5.29-5.17(m,1h),4.91(dd,j=7.4,14.9hz,1h),4.86-4.75(m,3h),4.63(dd,j=3.7,9.2hz,1h),4.58-4.43(m,5h),4.34-4.19(m,4h),2.79(td,j=5.9,16.8hz,1h),2.66(td,j=6.3,16.8hz,1h)。化合物(217)(spsp)1hnmr(400mhz,chloroform-d)δ(ppm):8.11(s,1h),8.03(d,j=8.2hz,1h),7.94(s,1h),7.90(s,1h),7.61(s,1h),7.56-7.40(m,7h),7.33-7.28(m,2h),7.23-7.17(m,4h),6.22(d,j=17.6hz,1h),6.15(d,j=18.8hz,1h),5.85(dd,j=3.5,51.2hz,1h),5.75-5.45(m,5h),4.95-4.23(m,14h),2.82(t,j=6.1hz,2h)。阶段12[化学式25]将化合物(215)(71.6g,62.6mmol,1重量,1体积,1当量)溶解于1,4-二噁烷(0.43l,6体积)中。添加苯硫酚(215ml,2.09mol,230g,3.2重量,3体积,>30当量),然后添加三乙胺(215ml,1.54mol,156g,2.2重量,3体积)。观察到一些放热(t-内部增加约7℃),因此,使用水/冰浴来冷却并控制t-内部低于27℃。通过lcms监测反应。2h后,添加meoh(0.57l,8体积)和nh4oh(28重量%;15mol,0.57l,8体积,>200当量)。将所得混合物在50℃下加热5h,冷却至室温并搅拌过夜。14h后,添加水(0.72l,10体积)(未观察到固体),并且用1:1(v/v)正庚烷和甲苯(3×0.86l,3×12体积)的混合物萃取该混合物三次,然后用甲苯(0.57l,8体积)萃取。在40℃至50℃下将水层真空浓缩,并用水(1.07l,15体积)稀释。将所得浆料在室温下保持过夜。滤出所得固体,用水(0.36l,5体积)冲洗。滤液仍然是浑浊的,并且通过硅藻土和kuno过滤器过滤。浑浊度仍然存在。在1h内添加hcl(1.0m水溶液;132ml,132mmol,2.1当量)并检查ph(ph<2)。在室温下继续搅拌1h,并且过滤混合物。将滤饼用水(8×0.20l)冲洗,在35℃下在真空烘箱中干燥2天并不加热的情况下干燥1天,以给出化合物(i),为浅橙色固体(44.88g,60.1mmol,0.63重量,产率96%)。阶段13[化学式26]向游离酸化合物(i)(22.42g,30.03mmol,1重量,1体积,1当量)中添加氨(2.0mmeoh溶液;220ml,440mmol,10体积,15当量)。添加etoh(55ml,2.5体积),并将所得溶液通过kuno过滤器(0.45微米;ptfe)过滤,用meoh和etoh(90ml,4体积)的1:1(v/v)混合物冲洗。在30℃下将滤液真空浓缩,从而产生灰白色固体,将其在室温下干燥过夜,用刮刀研磨(易于破碎)并在室温下进一步真空干燥。然后将分离出的固体悬浮于甲苯(250ml)中并在室温下搅拌30分钟。然后通过真空过滤收集固体并用甲苯冲洗两次(2×50ml)。然后将固体在真空烘箱中真空干燥,以给出22.4g化合物(1a)(化合物(i)二铵盐)。重结晶:将化合物(1a)(化合物(i)二铵盐)(22.14g,28.36mmol,1重量,1体积,1当量)溶解于水(664ml,30体积)和氢氧化铵(28重量%;2.5ml,18mmol,0.63当量)的混合物(ph=9至10)中,并用甲苯萃取三次(3×300ml,3×14体积),用etoac萃取三次(3×200ml,3×9体积),并且用甲苯萃取三次(3×300ml,3×14体积)。在3.5小时期间内将所得水层用hcl(1.0m水溶液;90ml,90mmol,3.2当量)处理(ph2或更低)。将混合物搅拌30分钟,并且然后通过真空过滤收集固体沉淀物。将滤饼用水洗涤三次(3×200ml,3×9体积)并真空干燥过夜。将氨(2.0mmeoh溶液;250ml,500mmol,17.6当量)和乙醇(100ml)添加到固体中,并且将所得混合物真空浓缩直至出现晶体(约100ml),此时停止浓缩,并且将混合物搅拌20分钟。添加乙醇(45ml),并且将混合物部分浓缩(除去45ml)。再重复相同操作两次,并且然后将混合物冷却至0℃并搅拌3.5h。通过真空过滤收集白色固体,并用冷乙醇(20ml)洗涤,然后用乙酸乙酯(2×50ml)洗涤。将白色固体室温下真空干燥3天,以给出化合物(1a)(化合物(i)二铵盐),为白色固体(16.6g,21.3mmol,0.75重量,产率75%)。将滤液真空浓缩并在室温下真空干燥3天,以给出化合物(1a)(化合物(i)二铵盐),为灰白色固体(4.16g,5.3mmol,产率18%)。分析实例1.2-化合物(i)铵盐的1hnmr分析化合物(i)铵盐的1hnmr谱图显示在图1中。所得谱为:1h-nmr谱(400mhz,dmso-d6,δh2.49ppm,80℃)δ(ppm):8.59(1h,brs),8.36(1h,brs),8.14(1h,s),8.13(1h,s),6.29(1h,m),6.26(1h,m),5.78(1h,m),5.76(2h,s),5.22(1h,m),4.53-4.68(2h,m),4.38(1h,m),4.28(1h,m),4.21-4.24(2h,m),3.78(1h,dd,j=12,4hz),3.70(1h,dd,j=13,5hz),3.05-3.13(4h,m)。分析实例1.3-化合物(i)铵盐的x射线分析将约2mg化合物(i)铵盐溶解于600μl水中。将120μl该溶液放入另一个玻璃小瓶中,并且然后将该小瓶在室温下与3mlmecn一起储存在固定容器中1周。这是样品制备的h2o/mecn蒸汽扩散法。将在结晶溶液中发现的无色块状单晶(0.1×0.1×0.1mm)分散在液体parabar10312中,并固定在dual-thicknessmicromountstm(mitegen)上。采用ω轴振荡法使用多层镜面单色cu-kα辐射在xtalabprop200mm007hf(日本理学株式会社(rigaku))上在-160℃下收集衍射数据。图2a示出了化合物(i)铵盐晶体的ortep图,其中不对称单元存在两个分子以及许多无序水分子。图2b示出了来自图2a的不对称单元中的两个分子中一个的ortep图。图2c示出了来自图2a的不对称单元中的两个分子中另一个的ortep图。解决了化合物(i)铵盐的晶体结构的最终r因子为0.1354。flack参数几乎为零(0.083(17)),表明化合物(i)铵盐的绝对构型是(r,s)。晶体结构分析还表明化合物(i)铵盐的大通道中存在若干个水分子,这表明水分子能够容易地从通道中滑出。该分析还证实不对称单元中两种结晶学上独立的分子的构象几乎相同。[表3]x射线分析的其他参数示于以下:实例1(1r,3r,15e,28r,29r,30r,31r,34r,36r,39s,41r)-29,41-二氟-34,39-双(巯基)-2,33,35,38,40,42-六氧-4,6,9,11,13,18,20,22,25,27-十氮杂-34λ5,39λ5-二磷八环[28.6.4.13,36.128,31.04,8.07,12.019,24.023,27]四十二烷-5,7,9,11,15,19,21,23,25-壬烯-34,39-二酮(化合物(i))二铵盐的晶体(晶型1)的制备向在乙酸异丙酯(2.769ml)中的化合物(i)(138.5mg)的悬浮液中添加28%氨水溶液(62μl)、乙酸异丙酯(0.693ml)和2-丙醇(0.138ml)的混合物,并且将所得浆料在室温下搅拌过夜。通过过滤收获沉淀物,用乙酸异丙酯(0.8ml)冲洗,并且将所得固体在室温下减压干燥2小时,以给出标题晶体(126.8mg)。标题晶体被鉴定为水合物。实例1-2(1r,3r,15e,28r,29r,30r,31r,34r,36r,39s,41r)-29,41-二氟-34,39-双(巯基)-2,33,35,38,40,42-六氧-4,6,9,11,13,18,20,22,25,27-十氮杂-34λ5,39λ5-二磷八环[28.6.4.13,36.128,31.04,8.07,12.019,24.023,27]四十二烷-5,7,9,11,15,19,21,23,25-壬烯-34,39-二酮(化合物(i))二铵盐的晶体(晶型1)的制备向在乙酸异丙酯(18.0ml)中的化合物(i)(900mg)的悬浮液中添加28%氨水溶液(400μl)、乙酸异丙酯(4.5ml)和2-丙醇(0.90ml)的混合物,将所得浆料在室温下搅拌过夜。通过过滤收获沉淀物,用乙酸异丙酯(4.5ml)冲洗,并且将所得固体在室温下减压干燥5小时,并通过在室温下在50%相对湿度下保持过夜连续吸收湿气,以给出标题晶体(942mg)。标题晶体被鉴定为水合物。实例2(1r,3r,15e,28r,29r,30r,31r,34r,36r,39s,41r)-29,41-二氟-34,39-双(巯基)-2,33,35,38,40,42-六氧-4,6,9,11,13,18,20,22,25,27-十氮杂-34λ5,39λ5-二磷八环[28.6.4.13,36.228,31.04,8.07,12.019,24.023,27]四十二烷-5,7,9,11,15,19,21,23,25-壬烯-34,39-二酮(化合物(i))二铵盐的晶体(晶型2)的制备向化合物(i)(143.6mg)中添加28%氨水溶液(1.724ml)和乙醇(1.718ml),并且将所得溶液在40℃下减压浓缩至约0.86ml。向残余物中添加乙醇(1ml),并将溶液在40℃下减压浓缩至约0.86ml。向残余物中添加乙醇(1ml),并将所得溶液在40℃下减压浓缩至0.89g。将残余溶液在室温下搅拌0.5小时,沉淀物从溶液中析出。向浆料中逐滴逐渐添加乙酸异丙酯(1.2ml)10分钟,并将所得浆料在室温下搅拌过夜。通过过滤收获沉淀物,并将所得固体在室温下减压干燥3.3小时,以给出标题晶体(144mg)。标题晶体被鉴定为水合物。实例3(1r,3r,15e,28r,29r,30r,31r,34r,36r,39s,41r)-29,41-二氟-34,39-双(巯基)-2,33,35,38,40,42-六氧-4,6,9,11,13,18,20,22,25,27-十氮杂-34λ5,39λ5-二磷八环[28.6.4.13,36.328,31.04,8.07,12.019,24.023,27]四十二烷-5,7,9,11,15,19,21,23,25-壬烯-34,39-二酮(化合物(i))二铵盐的晶体(晶型3)的制备将约10mg化合物(i)二铵盐的晶体(晶型1)置于25℃培养箱内的干燥器中,其中使用饱和硝酸钾溶液将湿度条件控制在94%rh。将固体样品储存4天,以给出标题晶体(约10mg)。标题晶体被鉴定为水合物。实例4(1r,3r,15e,28r,29r,30r,31r,34r,36r,39s,41r)-29,41-二氟-34,39-双(巯基)-2,33,35,38,40,42-六氧-4,6,9,11,13,18,20,22,25,27-十氮杂-34λ5,39λ5-二磷八环[28.6.4.13,36.428,31.04,8.07,12.019,24.023,27]四十二烷-5,7,9,11,15,19,21,23,25-壬烯-34,39-二酮(化合物(i))二铵盐的晶体(晶型4)的制备向在2mol/l氨的甲醇中的化合物(i)(217.22mg)的溶液(2.152ml)中添加乙醇(0.869ml),并将溶液在50℃下减压浓缩至约1.1g。将残余物在室温下搅拌0.8小时,并且沉淀物从溶液中析出。向该浆料中添加乙醇(0.434ml),并将混合物在50℃下减压浓缩至约0.8g。向残余物中添加乙醇(0.434ml),并将混合物在50℃下减压浓缩至约1.2g。向所得浆料中添加水(40μl),并将混合物在室温下搅拌1小时,并且在冰冷却下搅拌1.8小时。通过过滤收获沉淀物,依次用乙醇(0.2ml)和乙酸乙酯(0.2ml)冲洗,将所得固体在室温下减压干燥1小时,以给出标题晶体(21.22mg)。实例5(1r,3r,15e,28r,29r,30r,31r,34r,36r,39s,41r)-29,41-二氟-34,39-双(巯基)-2,33,35,38,40,42-六氧-4,6,9,11,13,18,20,22,25,27-十氮杂-34λ5,39λ5-二磷八环[28.6.4.13,36.528,31.04,8.07,12.019,24.023,27]四十二烷-5,7,9,11,15,19,21,23,25-壬烯-34,39-二酮(化合物(i))二铵盐的晶体(晶型5)的制备向化合物(i)(201.62mg)的2-丙醇(5ml)悬浮液中添加28%氨水溶液(36μl),并将所得溶液在60℃下搅拌。向该溶液中添加28%氨水溶液(108μl),并且沉淀物从溶液中析出。在温度自然降至室温后,通过过滤收获沉淀物,以给出标题晶体(160mg)。实例6(1r,3r,15e,28r,29r,30r,31r,34r,36r,39s,41r)-29,41-二氟-34,39-双(巯基)-2,33,35,38,40,42-六氧-4,6,9,11,13,18,20,22,25,27-十氮杂-34λ5,39λ5-二磷八环[28.6.4.13,36.628,31.04,8.07,12.019,24.023,27]四十二烷-5,7,9,11,15,19,21,23,25-壬烯-34,39-二酮(化合物(i))单铵盐的晶体(晶型6)的制备向在实例5中获得的化合物(i)二铵盐(85.24mg)中添加乙醇(4ml),将所得浆料在室温下搅拌过夜。然后,通过过滤收获沉淀物,给出标题晶体(40.93mg)。实例7(1r,3r,15e,28r,29r,30r,31r,34r,36r,39s,41r)-29,41-二氟-34,39-双(巯基)-2,33,35,38,40,42-六氧-4,6,9,11,13,18,20,22,25,27-十氮杂-34λ5,39λ5-二磷八环[28.6.4.13,36.128,31.04,8.07,12.019,24.023,27]四十二烷-5,7,9,11,15,19,21,23,25-壬烯-34,39-二酮(化合物(i))钠盐的晶体的制备向化合物(i)(201.58mg)中添加甲醇(5ml),并将所得浆料在室温下搅拌。向该浆料中添加1mol/l氢氧化钠水溶液(0.54ml),并将所得溶液在60℃下搅拌约1小时。在温度自然降至室温后,将溶液在氮气流下搅拌浓缩。随着溶剂逐渐被除去,开始结晶。将所得固体在室温下减压干燥,以给出标题晶体(227mg)。实例8(1r,3r,15e,28r,29r,30r,31r,34r,36r,39s,41r)-29,41-二氟-34,39-双(巯基)-2,33,35,38,40,42-六氧-4,6,9,11,13,18,20,22,25,27-十氮杂-34λ5,39λ5-二磷八环[28.6.4.13,36.128,31.04,8.07,12.019,24.023,27]四十二烷-5,7,9,11,15,19,21,23,25-壬烯-34,39-二酮的晶体的制备向在乙醇(2.5ml)、2mol/l氨的乙醇(2.5ml)和水(2.5ml)的混合物中的化合物(i)(500mg)的溶液中逐滴添加乙酸(0.572ml),并且将溶液在室温下搅拌。向该溶液中添加以与下列实例8-2类似的方式获得的化合物(i)的晶种。然后将混合物在室温下搅拌10分钟,并且沉淀物从溶液中析出。向浆料中逐滴逐渐添加乙酸(1.144ml)45分钟,并将所得浆料在室温下搅拌过夜。通过过滤收获沉淀物,并依次用冷的67%乙醇水溶液(3.0ml)和叔丁基甲基醚(2.0ml)冲洗。将所得固体在室温下减压干燥5小时,以给出标题晶体(417mg),产率83.4%。实例8-2(1r,3r,15e,28r,29r,30r,31r,34r,36r,39s,41r)-29,41-二氟-34,39-双(巯基)-2,33,35,38,40,42-六氧-4,6,9,11,13,18,20,22,25,27-十氮杂-34λ5,39λ5-二磷八环[28.6.4.13,36.128,31.04,8.07,12.019,24.023,27]四十二烷-5,7,9,11,15,19,21,23,25-壬烯-34,39-二酮的晶体的制备向化合物(i)(497.5mg)中添加乙醇(1.0ml)和2mol/l氨的乙醇(2.0ml),并且将混合物在室温下搅拌并溶解。将所得溶液通过棉垫过滤,并且将垫用2mol/l氨的乙醇(0.5ml)和乙醇(1.5ml)冲洗,并向溶液中添加水(2.5ml)。在室温下向所得溶液中逐滴逐渐添加乙酸(0.57ml)30分钟,并且沉淀物从溶液中析出,并将浆料在室温下搅拌37分钟。向浆料中逐滴逐渐添加乙酸(0.85ml)32分钟,并将所得浆料在室温下搅拌过夜。通过过滤收获沉淀物,并依次用冷的67%乙醇水溶液(4.0ml)和水(4.0ml)冲洗。将所得固体在室温下减压干燥过夜,并且在30℃下干燥3小时,以给出标题晶体(432.4mg),产率86.9%。实例9晶体(晶型1)的热重分析和差热分析(tg-dta)将约5mg晶体(晶型1)样品精确称量到铝盘中,并且然后在以下条件下进行分析。在tg热分析图中,在室温至130℃的范围内观察到由于脱水引起的重量损失。测量条件气氛:氮气流量为100ml/分钟参考盘:空铝盘加热速度:10℃/分钟加样间隔:1秒温度范围:室温至300℃实例10不同温度下的粉末x射线衍射将晶体(晶型1)样品置于粉末x射线衍射仪的样品台上,并在室温和高于60℃下进行分析,其中在晶体(晶型1)的tg-dta热分析图中观察到由于脱水引起的显著重量损失。测量条件如下:反射方法条件设备:rintttr-iii(rigaku)x射线源:cukα(50kv,300ma)检测器:闪烁计数器模式:反射狭缝:0.5mm(发散狭缝)、开口(散射狭缝)、开口(光接收狭缝)扫描速率:10°/分钟加样间隔:0.02°扫描范围:5°至35°样品架:铝架在晶体(晶型1)的tg-dta热分析图(图21)中,在高达130℃的温度范围内观察到由于脱水引起的显著重量损失,伴随着吸热峰。当晶体(晶型1)被加热时,在高于60℃的粉末x射线衍射(pxrd)图中发现显著变化(图22)。如图23所示,改变的pxrd图与晶体(晶型2)的相当。然后,晶体(晶型2)的pxrd图在125℃或更高温度下进一步变成另一种图(图24)。这些发现表明晶体(晶型1)和晶体(晶型2)将为水合物。实例11在于25℃下在30%至95%的rh范围内的晶体(晶型1)的吸湿性测量中,观察到吸附和解吸过程之间的磁滞回线,如图25所示。在吸附过程中,直至80%rh,重量变化水平逐渐增加至1.7%,并且然后在95%rh下,最终达到约19%。在吸湿性测量之前和之后,没有观察到pxrd图的变化。相反,在25℃、94%rh下储存4天的晶体(晶型1)样品的pxrd图与图26中描述的初始图不同。改变的pxrd图的晶型被定义为晶型3。这些发现证明晶体(晶型3)为水合物。药理学测试实例进行以下测试实例以检查化合物(1a)的药理学作用。药理学测试实例1:haqsting激动剂活性报告基因测定使用thp1-dualtm细胞(invivogen公司,目录#thpd-nfis)用于ec50测定。根据供应商invivogen公司(insight201402-1),thp1-dualtm细胞已被表征为携带haqsting基因型。细胞在制造商推荐的条件下和维持。遵循制造商手册中描述的干扰素调节因子(irf)途径诱导以进行ec50测定。简而言之,接种细胞并用不同浓度的化合物处理20hr,同时在37℃、5%co2下孵育。将细胞重悬浮,并添加quanti-luctm溶液(目录#:rep-q1c1)。通过发光计(envision,perkinelmer)测量所得的光发射。将所得信号制图,并用graphpadprism7软件计算ec50。ec50值报告于下表1中。[表4]表1化合物编号人stinghaqec50(μm)1a4.1在表1中测量化合物(1a)的人stingec50(μm)。药理学测试实例2:sting变体特异性报告基因测定人sting具有4种主要的变体,包括wt、haq、ref和aq变体。例如,ref-sting也被称为r232h,出现在约14%的人群中。与野生型等位基因相比,r232h对细菌和后生动物环状二核苷酸的反应降低。yig等人报道了这4种主要变体以及其他罕见变体的具体内容,“singlenucleotidepolymorphismsofhumanstingcanaffectinnateimmuneresponsetocyclicdinucleotide[人sting的单核苷酸多态性可以影响对环状二核苷酸的先天免疫应答]”plosone[公共科学图书馆·综合]2013;8:e77846。通过使用thp1-dualtmko-sting细胞(invivogen公司,目录#thpd-kostg)和三种sting变体蛋白表达载体建立sting变体特异性报告基因细胞系。wtsting的表达载体图显示在图16中。对于其他两种表达载体,在该载体中使用不同的sting变体序列,其中wtsting被适当的核苷酸序列取代。制备用于wt-sting、ref-sting和aq-sting的sting变体表达载体,并稳定转染到thp1-dualtmko-sting细胞中以分别制备用于wt-sting、ref-sting和aq-的sting变体特异性报告基因测定。如以上在haqsting激动剂活性报告基因测定的药理学测试实例1中所述的,测定ec50值。结果示于下表2中。用于这些sting变体的dna序列示于seqidno:1(wt人sting的核苷酸序列);seqidno:2(ref人sting的核苷酸序列);seqidno:3(aq人sting的核苷酸序列)。wt人sting:atgccccactccagcctgcatccatccatcccgtgtcccaggggtcacggggcccagaaggcagccttggttctgctgagtgcctgcctggtgaccctttgggggctaggagagccaccagagcacactctccggtacctggtgctccacctagcctccctgcagctgggactgctgttaaacggggtctgcagcctggctgaggagctgcgccacatccactccaggtaccggggcagctactggaggactgtgcgggcctgcctgggctgccccctccgccgtggggccctgttgctgctgtccatctatttctactactccctcccaaatgcggtcggcccgcccttcacttggatgcttgccctcctgggcctctcgcaggcactgaacatcctcctgggcctcaagggcctggccccagctgagatctctgcagtgtgtgaaaaagggaatttcaacgtggcccatgggctggcatggtcatattacatcggatatctgcggctgatcctgccagagctccaggcccggattcgaacttacaatcagcattacaacaacctgctacggggtgcagtgagccagcggctgtatattctcctcccattggactgtggggtgcctgataacctgagtatggctgaccccaacattcgcttcctggataaactgccccagcagaccggtgaccgggctggcatcaaggatcgggtttacagcaacagcatctatgagcttctggagaacgggcagcgggcgggcacctgtgtcctggagtacgccacccccttgcagactttgtttgccatgtcacaatacagtcaagctggctttagccgggaggataggcttgagcaggccaaactcttctgccggacacttgaggacatcctggcagatgcccctgagtctcagaacaactgccgcctcattgcctaccaggaacctgcagatgacagcagcttctcgctgtcccaggaggttctccggcacctgcggcaggaggaaaaggaagaggttactgtgggcagcttgaagacctcagcggtgcccagtacctccacgatgtcccaagagcctgagctcctcatcagtggaatggaaaagcccctccctctccgcacggatttctcttga(seqidno:1)。ref人sting:atgccccactccagcctgcatccatccatcccgtgtcccaggggtcacggggcccagaaggcagccttggttctgctgagtgcctgcctggtgaccctttgggggctaggagagccaccagagcacactctccggtacctggtgctccacctagcctccctgcagctgggactgctgttaaacggggtctgcagcctggctgaggagctgcgccacatccactccaggtaccggggcagctactggaggactgtgcgggcctgcctgggctgccccctccgccgtggggccctgttgctgctgtccatctatttctactactccctcccaaatgcggtcggcccgcccttcacttggatgcttgccctcctgggcctctcgcaggcactgaacatcctcctgggcctcaagggcctggccccagctgagatctctgcagtgtgtgaaaaagggaatttcaacgtggcccatgggctggcatggtcatattacatcggatatctgcggctgatcctgccagagctccaggcccggattcgaacttacaatcagcattacaacaacctgctacggggtgcagtgagccagcggctgtatattctcctcccattggactgtggggtgcctgataacctgagtatggctgaccccaacattcgcttcctggataaactgccccagcagaccggtgaccatgctggcatcaaggatcgggtttacagcaacagcatctatgagcttctggagaacgggcagcgggcgggcacctgtgtcctggagtacgccacccccttgcagactttgtttgccatgtcacaatacagtcaagctggctttagccgggaggataggcttgagcaggccaaactcttctgccggacacttgaggacatcctggcagatgcccctgagtctcagaacaactgccgcctcattgcctaccaggaacctgcagatgacagcagcttctcgctgtcccaggaggttctccggcacctgcggcaggaggaaaaggaagaggttactgtgggcagcttgaagacctcagcggtgcccagtacctccacgatgtcccaagagcctgagctcctcatcagtggaatggaaaagcccctccctctccgcacggatttctcttga(seqidno:2)。aq人sting:atgccccactccagcctgcatccatccatcccgtgtcccaggggtcacggggcccagaaggcagccttggttctgctgagtgcctgcctggtgaccctttgggggctaggagagccaccagagcacactctccggtacctggtgctccacctagcctccctgcagctgggactgctgttaaacggggtctgcagcctggctgaggagctgcgccacatccactccaggtaccggggcagctactggaggactgtgcgggcctgcctgggctgccccctccgccgtggggccctgttgctgctgtccatctatttctactactccctcccaaatgcggtcggcccgcccttcacttggatgcttgccctcctgggcctctcgcaggcactgaacatcctcctgggcctcaagggcctggccccagctgagatctctgcagtgtgtgaaaaagggaatttcaacgtggcccatgggctggcatggtcatattacatcggatatctgcggctgatcctgccagagctccaggcccggattcgaacttacaatcagcattacaacaacctgctacggggtgcagtgagccagcggctgtatattctcctcccattggactgtggggtgcctgataacctgagtatggctgaccccaacattcgcttcctggataaactgccccagcagaccgctgaccgagctggcatcaaggatcgggtttacagcaacagcatctatgagcttctggagaacgggcagcgggcgggcacctgtgtcctggagtacgccacccccttgcagactttgtttgccatgtcacaatacagtcaagctggctttagccgggaggataggcttgagcaggccaaactcttctgccagacacttgaggacatcctggcagatgcccctgagtctcagaacaactgccgcctcattgcctaccaggaacctgcagatgacagcagcttctcgctgtcccaggaggttctccggcacctgcggcaggaggaaaaggaagaggttactgtgggcagcttgaagacctcagcggtgcccagtacctccacgatgtcccaagagcctgagctcctcatcagtggaatggaaaagcccctccctctccgcacggatttctcttga(seqidno:3)。药理学测试实例3:小鼠sting激动剂活性报告基因测定使用raw-luciatmisg细胞(invivogen公司,目录#rawl-isg)用于小鼠sting激动剂报告基因测定。如以上在haqsting激动剂活性报告基因测定中的药理学测试实例1中所述的,测定ec50值。结果示于下表2中。[表5]表2化合物(1a)体外表征药理学测试实例4:差示扫描荧光(dsf)测定采用dsf测定以测量化合物与重组sting蛋白之间的物理相互作用。在大肠杆菌中表达截短的重组sting蛋白(a.a.155-341)(seqidno:4),并将其分离用于测定,如下所述。在384孔板中制备测定基质至每孔10μl的最终体积,最终体积由1μm重组sting蛋白(a.a.155-341)(seqidno:4)、100mmpbsph7.4(补充有100mmkcl、5xsypro橙色染料)和50μm化合物组成(最终dmso浓度0%至1%)。在quantstudio12kflex实时pcr系统上进行测定,其中使用25℃至95℃的温度梯度,速率为0.05℃/min,并且激发和发射滤光器分别为470nm和586nm。根据appliedbiosystems(注册商标)proteinthermalshift软件(算法版本1.3)分配的荧光衍生曲线,计算未结合和与配体结合的重组sting蛋白的热熔(tm)和热熔差(dtmd)。通常,δtm值大于0的化合物被认为与测试的蛋白质具有物理相互作用,并且δtm的值与化合物结合亲和力正相关。此处,化合物(1a)示出的δtm为17.6(上表2所示),表明与sting蛋白的物理相互作用。药理学测试实例5:离体人pbmc刺激测定使用10.0mlbdvacutainer肝素钠管(目录#367874)收集来自5个健康供体的人血液。使用sigmaaccuspin50ml管(目录#a2055)和sigmaaccuspin系统-histopaque-1077(目录#a7054),使用制造商提供的方案进行外周血单核细胞(pbmc)分离。收获pbmc层,并如sigma公司所建议的用1x磷酸盐缓冲盐水(pbs)洗涤。计数pbmc并最终以1×10e6/ml悬浮于补充有10%胎牛血清(fbs)(gibco公司目录#20140.79)的rpmi(康宁公司(corning)目录#10-041-cv)中。将1ml细胞(1×10e6)转移到falcon5ml圆底聚丙烯试管(目录#352063)中,并用不同浓度(0μm,0.1μm,1μm,10μm)在5%co2培养箱中于37℃下刺激24小时。在孵育24小时后,将管以1400rpm离心5分钟,并且收获上清液。将上清液储存在-80℃下用于后续的ifnβ测量。使用人ifn-β碱基试剂盒(mesoscalediagnostics目录#k151ada)进行ifnβ测量,并使用制造商提供的方案。通过在mesosector成像仪2400上读取测定板并使用msddiscoveryworkbench4.0程序进行ifn-β估计。在24小时后,分析ifnβ蛋白。结果示出化合物(1a)可以以剂量依赖性方式诱导原代人pbmcifnβ蛋白的生产。表3中示出的结果反映了使用五个不同供体进行的测量的平均值。[表6]表3离体人pbmc刺激测定对于ifnβmrna定量,使用rneasy迷你试剂盒(凯杰公司(qiagen),德国)根据制造商的方案分离总rna。通过qpcr测定定量ifnβmrna。简而言之,使用superscriptvilomastermix(生命技术公司(lifetechnologies),美国)将总rna(400ng至1000ng)以60μl反应体积转化为cdna。随后使用appliedbiosystemstaqman表达测定法使用针对ifnb1(hs01077958_s1)和gapdh(hs99999905_m1)的rna特异性引物扩增所得cdna(10ng)。使用taqmanfastadvancedmastermix(生命技术公司(lifetechnologies),美国)在appliedbiosystemsquantstudio12kflex实时pcr系统上进行qpcr分析,在50℃下进行初始2min步骤,然后在95℃下进行2s,并且在95℃下40个循环1s,在60℃下进行20s。在使用2-δδct方法针对参考基因gapdh归一化后,计算相对基因表达。使用appliedbiosystemsquantstudio12kflex软件v1.2.2进行计算。ifnβmrna倍数变化相对于载体处理的样品总结于表4中。结果示出化合物(1a)可以以剂量和时间依赖性方式诱导原代pbmc中的ifnβmrna。表4示出了从五个不同供体计算出的平均值。[表7]表4离体人pbmc3hr和24hr刺激测定(mrna)药理学测试实例6:化合物(1a)对ct26双肿瘤模型的抗癌作用在ct26双肿瘤模型中测试化合物(1a)的抗癌活性,该模型为小鼠结肠癌模型。5-6周龄雌性balb/cj小鼠(杰克逊实验室(jacksonlabs),巴尔港,缅因州),在每只动物两侧皮下植入ct26肿瘤细胞,每侧105个细胞。对于研究a,在肿瘤植入后5天开始治疗(1.25mg/kg,2.5mg/kg和5mg/kg),此时平均肿瘤达到约100mm3。对于研究b,在肿瘤植入后8天开始治疗(0.6mg/kg和10mg/kg),此时平均肿瘤达到约120mm3。治疗方案描述于表5和表6中。[表8]表5研究a的给药方案组动物编号治疗途径和方案a6载体(1xpbs)i.t.*;单一剂量b65mg/kg化合物(1a)i.t.;单一剂量c62.5mg/kg化合物(1a)i.t.;单一剂量d61.25mg/kg化合物(1a)i.t.;单一剂量*i.t.为肿瘤内[表9]表6研究b的给药方案组动物编号治疗途径和方案a5载体(1xpbs)i.t.*;单一剂量b510mg/kg化合物(1a)i.t.;单一剂量c50.6mg/kg化合物(1a)i.t.;单一剂量*i.t.为肿瘤内研究中的所有小鼠都有两种皮下ct26肿瘤。“经治疗的肿瘤”表明经化合物直接给予的肿瘤,而“未经治疗的肿瘤”表明没有直接给予化合物的肿瘤。在整个实验中跟踪肿瘤体积。在治疗开始后每周测量肿瘤体积两次。通过扁长椭球状体积(lxw2)/2的公式从卡尺测量计算肿瘤负荷,其中l和w为相应的正交长度和宽度测量值(mm)。化合物(1a)在ct26双肿瘤模型中显示出有效并且治愈的活性(图17和图18)。对于经治疗的肿瘤,即使在研究中测试的最低剂量下也检测到20%的治愈率(图18,0.6mg/kg剂量)。同时,在研究结束时最高剂量(10mg/kg)治愈了动物的100%该肿瘤。对于未经治疗的肿瘤,剂量依赖性抗肿瘤作用也是明显的。最高剂量组(10mg/kg)显示80%的治愈作用;所有更低剂量也显示出肿瘤生长抑制活性。因此,观察到化合物(1a)的治疗窗口为0.6mg/kg至10mg/kg,基于未注射的远端肿瘤部位的效果,不仅局部而且全身地观察到抗肿瘤活性。总之,这些结果表明化合物(1a)的局部给予可以诱导局部和全身(远位)抗癌活性。药理学测试实例7:化合物(1a)对ct26肝转移模型的抗癌作用在ct26肝转移模型中测试化合物(1a)的抗癌活性。对麻醉的5-6周龄雌性balb/cj小鼠(杰克逊实验室(jacksonlabs),巴尔港,缅因州)在脾内植入表达萤光素酶的ct26肿瘤细胞(每只小鼠5x105个细胞)。在随后的十分钟等待期允许肿瘤细胞循环进入动物的肝脏中。然后取出脾脏,并且缝合动物并允许其恢复。三天后,再次植入ct26肿瘤细胞(每只小鼠105个细胞),这次皮下(sc)在右前肢区域下,以便使得用于化合物给予的肿瘤块能够发育。脾内注射后9天,将化合物(10mg/kg)一次肿瘤内给予到sc肿瘤中。通过其对sc肿瘤的作用测量化合物的局部抗癌作用,同时基于在每只小鼠肝脏中生长肿瘤块的不利影响,通过与载体治疗的对照小鼠比较的经治疗的小鼠的总体存活来评估化合物的远位效应。化合物(1a)显示出对局部sc肿瘤的有效活性以及还有10只经治疗的动物中的9只的治愈性全身活性(图19)。这些结果表明局部给予化合物(1a)可以诱导局部和全身(远位)抗癌活性,包括深部病变,例如在肝脏中。药理学测试实例8:化合物(1a)对gl261脑原位模型的抗癌作用在gl261脑原位模型中测试化合物(1a)的抗癌活性。gl261是鼠胶质瘤细胞系。将表达萤光素酶的gl261小鼠胶质瘤细胞(2x104个细胞/小鼠)颅内植入雌性5-6周龄b6白化小鼠(杰克逊实验室(jacksonlabs),巴尔港,缅因州)中。3至4天后,将gl261细胞皮下植入(106细胞/小鼠)右前肢区域下,以允许用于化合物给予的肿瘤块发育。在颅内肿瘤细胞植入后10天,将化合物(10mg/kg)一次肿瘤内给予到sc肿瘤中。通过化合物对sc肿瘤的作用测量该化合物的局部抗癌作用,同时基于在每只小鼠脑中生长肿瘤块的不利影响,通过与载体治疗的对照小鼠比较的经治疗的小鼠的总体存活来评估化合物的远位效应。化合物(1a)在局部sc肿瘤中均显示出有效活性,并且在8只经治疗的动物中的5只中显示出治愈性全身活性(图20)。这些结果表明局部给予化合物(1a)可以诱导局部和全身(远位)抗癌活性,包括深部病变,例如在脑中。序列表seqidno:1(wt人sting):atgccccactccagcctgcatccatccatcccgtgtcccaggggtcacggggcccagaaggcagccttggttctgctgagtgcctgcctggtgaccctttgggggctaggagagccaccagagcacactctccggtacctggtgctccacctagcctccctgcagctgggactgctgttaaacggggtctgcagcctggctgaggagctgcgccacatccactccaggtaccggggcagctactggaggactgtgcgggcctgcctgggctgccccctccgccgtggggccctgttgctgctgtccatctatttctactactccctcccaaatgcggtcggcccgcccttcacttggatgcttgccctcctgggcctctcgcaggcactgaacatcctcctgggcctcaagggcctggccccagctgagatctctgcagtgtgtgaaaaagggaatttcaacgtggcccatgggctggcatggtcatattacatcggatatctgcggctgatcctgccagagctccaggcccggattcgaacttacaatcagcattacaacaacctgctacggggtgcagtgagccagcggctgtatattctcctcccattggactgtggggtgcctgataacctgagtatggctgaccccaacattcgcttcctggataaactgccccagcagaccggtgaccgggctggcatcaaggatcgggtttacagcaacagcatctatgagcttctggagaacgggcagcgggcgggcacctgtgtcctggagtacgccacccccttgcagactttgtttgccatgtcacaatacagtcaagctggctttagccgggaggataggcttgagcaggccaaactcttctgccggacacttgaggacatcctggcagatgcccctgagtctcagaacaactgccgcctcattgcctaccaggaacctgcagatgacagcagcttctcgctgtcccaggaggttctccggcacctgcggcaggaggaaaaggaagaggttactgtgggcagcttgaagacctcagcggtgcccagtacctccacgatgtcccaagagcctgagctcctcatcagtggaatggaaaagcccctccctctccgcacggatttctcttgaseqidno:2(ref人sting):atgccccactccagcctgcatccatccatcccgtgtcccaggggtcacggggcccagaaggcagccttggttctgctgagtgcctgcctggtgaccctttgggggctaggagagccaccagagcacactctccggtacctggtgctccacctagcctccctgcagctgggactgctgttaaacggggtctgcagcctggctgaggagctgcgccacatccactccaggtaccggggcagctactggaggactgtgcgggcctgcctgggctgccccctccgccgtggggccctgttgctgctgtccatctatttctactactccctcccaaatgcggtcggcccgcccttcacttggatgcttgccctcctgggcctctcgcaggcactgaacatcctcctgggcctcaagggcctggccccagctgagatctctgcagtgtgtgaaaaagggaatttcaacgtggcccatgggctggcatggtcatattacatcggatatctgcggctgatcctgccagagctccaggcccggattcgaacttacaatcagcattacaacaacctgctacggggtgcagtgagccagcggctgtatattctcctcccattggactgtggggtgcctgataacctgagtatggctgaccccaacattcgcttcctggataaactgccccagcagaccggtgaccatgctggcatcaaggatcgggtttacagcaacagcatctatgagcttctggagaacgggcagcgggcgggcacctgtgtcctggagtacgccacccccttgcagactttgtttgccatgtcacaatacagtcaagctggctttagccgggaggataggcttgagcaggccaaactcttctgccggacacttgaggacatcctggcagatgcccctgagtctcagaacaactgccgcctcattgcctaccaggaacctgcagatgacagcagcttctcgctgtcccaggaggttctccggcacctgcggcaggaggaaaaggaagaggttactgtgggcagcttgaagacctcagcggtgcccagtacctccacgatgtcccaagagcctgagctcctcatcagtggaatggaaaagcccctccctctccgcacggatttctcttgaseqidno:3(aq人sting):atgccccactccagcctgcatccatccatcccgtgtcccaggggtcacggggcccagaaggcagccttggttctgctgagtgcctgcctggtgaccctttgggggctaggagagccaccagagcacactctccggtacctggtgctccacctagcctccctgcagctgggactgctgttaaacggggtctgcagcctggctgaggagctgcgccacatccactccaggtaccggggcagctactggaggactgtgcgggcctgcctgggctgccccctccgccgtggggccctgttgctgctgtccatctatttctactactccctcccaaatgcggtcggcccgcccttcacttggatgcttgccctcctgggcctctcgcaggcactgaacatcctcctgggcctcaagggcctggccccagctgagatctctgcagtgtgtgaaaaagggaatttcaacgtggcccatgggctggcatggtcatattacatcggatatctgcggctgatcctgccagagctccaggcccggattcgaacttacaatcagcattacaacaacctgctacggggtgcagtgagccagcggctgtatattctcctcccattggactgtggggtgcctgataacctgagtatggctgaccccaacattcgcttcctggataaactgccccagcagaccgctgaccgagctggcatcaaggatcgggtttacagcaacagcatctatgagcttctggagaacgggcagcgggcgggcacctgtgtcctggagtacgccacccccttgcagactttgtttgccatgtcacaatacagtcaagctggctttagccgggaggataggcttgagcaggccaaactcttctgccagacacttgaggacatcctggcagatgcccctgagtctcagaacaactgccgcctcattgcctaccaggaacctgcagatgacagcagcttctcgctgtcccaggaggttctccggcacctgcggcaggaggaaaaggaagaggttactgtgggcagcttgaagacctcagcggtgcccagtacctccacgatgtcccaagagcctgagctcctcatcagtggaatggaaaagcccctccctctccgcacggatttctcttgaseqidno:4(wtsting残基155-341):vahglawsyyigylrlilpelqarirtynqhynnllrgavsqrlyillpldcgvpdnlsmadpnirfldklpqqtgdragikdrvysnsiyellengqragtcvleyatplqtlfamsqysqagfsredrleqaklfcrtlediladapesqnncrliayqepaddssfslsqevlrhlrqeekeev当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1