用于增加来自细菌细胞的蛋白质产物产率的系统和方法与流程
用于增加来自细菌细胞的蛋白质产物产率的系统和方法
[0001]
相关申请的交叉引用本申请主张2018年5月21日提交的美国临时专利申请序列号62/674,604和2019年5月17日提交的美国非临时专利申请序列号16/416,127的权益,上述引用的所有申请在此通过引用并入。
[0002]
发明背景微生物发酵当向微生物提供碳底物时发生,微生物可以利用和处理碳底物以生成各种可被回收、分离和纯化的产物。所选择的碳底物取决于所使用的微生物的类型和它们的代谢途径,并且所使用的微生物的类型基于具有产生所需产物类型的能力的微生物菌株的识别和选择。碳底物可以包括一氧化碳(co)、二氧化碳(co2)、甲醇、甲基、乙醇、正烷烃、葡萄糖、纤维素、甘蔗渣、糖蜜和亚硫酸盐废料。由细菌发酵产生的有用的产物和物质包括乙醇、乳酸、乙酸盐及其它可用作能量来源和各种附加应用的生物燃料和化学品。
[0003]
作为实例,厌氧微生物包括产乙酸微生物的细菌发酵可通过对气态底物诸如一氧化碳(co)、氢气(h2)和/或二氧化碳(co2)的发酵产生发酵产物(例如,乙醇、丁醇、乙酸盐、丁酸盐、丁酸、2,3-丁二醇和其它相关产物)。乙醇和丁醇通常用作与运输有关的液体燃料,而乙酸盐和2,3-丁二醇用于化学工业。用于微生物发酵的生产生物乙醇的产乙酸细菌的实例包括梭菌属和醋酸杆菌属的那些。例如,美国专利第5173429号描述了从合成气产生乙醇和乙酸盐的厌氧微生物俊达氏梭菌(clostridium ljungdahlii) atcc编号49587。美国专利第5807722号描述了使用俊达氏梭菌atcc编号55380将废气转化为有机酸和醇的方法和装置。美国专利第6136577号描述了使用俊达氏梭菌atcc编号55988和55989将废气转化为乙醇的方法和装置。
[0004]
除了发酵产物之外,大规模的微生物发酵还产生大量的微生物发酵培养肉汤并且可能需要排出大部分的死的或无活性的细胞。将过量的细菌细胞从过量的或排出的培养肉汤中回收到微生物生物质中可导致产生单细胞蛋白(scp)和其他组分,重复用作蛋白质、氨基酸和碳水化合物来源,所述蛋白质、氨基酸和碳水化合物用作动物饲料的原料和/或动物饲料的营养物或补充物。所有动物都需要氨基酸,氨基酸是最佳生长、繁殖、哺育以及维持所需的蛋白质的构建块。牛的小肠中吸收的氨基酸来自瘤胃中消化的蛋白质,一般情况下,其消化系统必须提供10种不可由牛自身产生的必需氨基酸,包括精氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯丙氨酸、苏氨酸、色氨酸和缬氨酸。理想情况下,吸收的每一种必需氨基酸的相对比例将完全匹配牛所需的氨基酸的供应,因为任一种的短缺可能会限制其它氨基酸的利用。
[0005]
然而,目前针对单细胞蛋白的方法常常是直接将微生物细胞作为完全细胞生物质加入来用于动物饲料或水产养殖。在微生物发酵过程中,发酵肉汤包括细菌细胞以及细胞碎片。这些方法并不区分两者,并且通常包含可能对动物或水产养殖(例如鱼或虾等)有害的生物质含量。例如,微生物完全细胞生物质可能含有不适合于摄入的高核酸含量或不能适当消化的其他含量。大多数这些现有方法在将完全细胞生物质加入动物饲料前并不通过额外的细胞破裂或细胞破碎技术对完全细胞生物质进行处理。此外,目前从细菌发酵中回
收细菌蛋白的方法不能产出适合营养相关目的的足够高的蛋白质含量。存在对于获得来自细菌发酵过程的富含蛋白质的补充物以及任何这种营养补充物的组合物和动物饲料的方法和系统的需求。
[0006]
发明概述本发明的实施方案提供使用多种细胞破裂和蛋白质分级和纯化技术用于生产和获得富含蛋白质的营养补充物和/或动物饲料的方法、系统和组合物,所述营养补充物和/或动物饲料源自厌氧细菌发酵过程后的微生物细胞生物质。富含蛋白质的营养补充物可以直接用作原料,或与其他营养物一起用作人类或动物的补充物。
[0007]
在一个实施方案中,提供了由发酵过程产生含蛋白质部分的细菌发酵系统,其包括一个或多个发酵容器、一个或多个细胞分离器、一个或多个处理室、一个或多个细胞破裂装置以及一个或多个分级器。在另一个实施方案中,本发明进一步提供了由使用厌氧细菌的发酵过程产生的富含蛋白质的营养补充物的组合物,其对于各种不同的动物和人类的摄入具有有用的应用。
[0008]
在又一个实施方案中,提供了用于获得从厌氧细菌细胞纯化的含蛋白质产物的高回收率的方法。在一个方面,该方法包括在发酵容器内用厌氧细菌细胞将气态底物发酵成发酵液肉汤,其中所述发酵液肉汤处于第一ph值;将起始细胞浓度的从发酵容器输送的一定量的发酵液肉汤分离成无细胞渗透溶液和含有厌氧细菌细胞的含细胞悬浮液;以及供应一种或多种ph调节剂以调节所述含细胞悬浮液的ph,其中所述含细胞悬浮液的ph调节至高于所述第一ph值的第二ph值。
[0009]
该方法进一步包括将含细胞悬浮液中所含的厌氧细菌细胞的细胞膜破裂成具有第一蛋白质回收率的含蛋白质产物的匀浆,其中所述第一蛋白质回收率为含蛋白质产物的蛋白质浓度(克/升)除以起始细胞浓度(克/升)的百分比;以及将匀浆分级成第二蛋白质回收率的第一含蛋白质部分,和第三蛋白质回收率的含蛋白质的细胞碎片部分。
[0010]
本发明的另一个实施方案提供了用于增加从厌氧细菌细胞纯化的含蛋白质产物的回收率的系统。所述系统包括发酵容器,其连接至气体入口管线以使气态底物流入含有厌氧细菌细胞的发酵容器中,以通过厌氧细菌细胞将气态底物发酵成第一ph值的发酵液肉汤;和细胞分离器,其连接至发酵容器以从发酵容器接收发酵液肉汤并将发酵液肉汤分离成含有厌氧细菌细胞的含细胞悬浮液。
[0011]
该系统进一步包括一个或多个破裂装置,其连接至第一分离器的一个或多个第一出口,以将包含于含细胞悬浮液中的厌氧细菌细胞的细胞膜破裂成第二ph值的匀浆,其中第二ph值高于第一ph值;和一个或多个分级器,其连接至所述一个或多个破裂装置以接收来自所述一个或多个破裂装置的匀浆并将该匀浆分级成具有含蛋白质产物的一个或多个含蛋白质部分和一个或多个含蛋白质的细胞碎片部分。
[0012]
附图的简要说明以为了可以详细地理解本发明的上述特征的方式,可以通过参考实施方案来对上面简要概述的本发明进行更具体的描述,其中一些实施方案在附图中示出。然而,应注意,附图仅示出了本发明的典型实施方案,因此不应视为对本发明范围的限制,因为本发明可以允许其他等效实施方案。
[0013]
图1a示出了根据本发明的一个或多个实施方案的方法的流程图,该方法处理来自
发酵过程的含细胞悬浮液,其中具有厌氧细菌培养物,并获得第一含蛋白质部分和/或含蛋白质细胞碎片部分作为富含蛋白质的营养补充物。
[0014]
图1b示出了根据本发明的一个或多个实施方案的另一种方法的流程图,该方法处理来自发酵过程的含细胞悬浮液,其中具有厌氧细菌培养物,并获得第一含蛋白质部分和/或含蛋白质细胞碎片部分作为富含蛋白质的营养补充物。
[0015]
图2a示出了根据本发明的一个或多个实施方案的方法的流程图,该方法处理来自发酵过程的含细胞悬浮液,其中具有厌氧细菌培养物,并获得第二含蛋白质部分作为富含蛋白质的营养补充物。
[0016]
图2b示出了根据本发明的一个或多个实施方案的另一种方法的流程图,该方法处理来自发酵过程的含细胞悬浮液,其中具有厌氧细菌培养物,并获得第三含蛋白质部分作为富含蛋白质的营养补充物。
[0017]
图3a示出了根据本发明的一个或多个实施方案的细菌发酵系统300a的示意图,用于由使用厌氧细菌培养物的发酵过程来生产含细胞悬浮液和一种或多种含氧烃化合物,其中细菌发酵系统300a包括一个或多个细胞分离器、一个或多个处理室以及任选的一个或多个脱水室。
[0018]
图3b示出了根据本发明的一个或多个实施方案的细菌发酵系统300b的示意图,用于由使用厌氧细菌培养物的发酵过程来生产一种或多种含细胞悬浮液和一种或多种含氧烃化合物,其中细菌发酵系统300b包括两个细胞分离器、无细胞保存槽、处理室和任选的脱水室。
[0019]
图4a示出了根据本发明的一个或多个实施方案的细菌发酵系统400a的示意图,其具有一个或多个细胞分离器、一个或多个处理室、一个或多个破裂装置、一个或多个分级器、一个或多个脱水室以及一个或多个用于将ph调节剂输送至系统中的入口管线,用于使用厌氧细菌培养物的发酵过程。
[0020]
图4b示出了根据本发明的一个或多个实施方案的细菌发酵系统400b的示意图,其具有一个或多个用于将ph调节剂输送至系统中的入口管线、两个细胞分离器、一个处理室、一个破裂装置、两个分级器和三个脱水室,用于使用厌氧细菌培养物的发酵过程。
[0021]
图4c示出了根据本发明的一个或多个实施方案的细菌发酵系统400c的示意图,其具有一个或多个用于将ph调节剂输送至系统中的入口管线、一个细胞分离器、一个无细胞保存槽、一个处理室、一个破裂装置、一个分级器以及两个或更多个脱水室,用于使用厌氧细菌培养物的发酵过程。
[0022]
图4d示出了根据本发明的一个或多个实施方案的细菌发酵系统400d的示意图,其具有一个或多个用于将ph调节剂输送至系统中的入口管线、一个细胞分离器、一个无细胞的保存槽、一个处理室、一个破裂装置、两个分级器以及任选的另外的脱水室,用于使用厌氧细菌培养物的发酵过程。
[0023]
图4e示出了根据本发明的一个或多个实施方案的细菌发酵系统400e的示意图,其具有一个或多个用于将ph调节剂输送至系统中的入口管线、两个细胞分离器、一个无细胞保存槽、一个处理室、一个破裂装置、两个分级器以及任选的三个脱水室,用于使用厌氧细菌培养物的发酵过程。
[0024]
图4f示出了根据本发明的一个或多个实施方案的细菌发酵系统400f的示意图,其
具有一个或多个用于将ph调节剂输送至系统中的入口管线、一个细胞分离器、一个无细胞的保存槽、一个处理室、一个含细胞保存槽、一个破裂装置、两个分级器以及任选的三个脱水室,用于使用厌氧细菌培养物的发酵过程。
[0025]
图4g示出了根据本发明的一个或多个实施方案的细菌发酵系统400g的示意图,其具有一个或多个用于将ph调节剂输送至系统中的入口管线、两个细胞分离器、一个无细胞的保存槽、一个处理室、一个含细胞保存槽、一个破裂装置、两个分级器以及任选的三个脱水室,用于使用厌氧细菌培养物的发酵过程。
[0026]
图4h示出了根据本发明的一个或多个实施方案的细菌发酵系统400h的示意图,其具有一个或多个用于将ph调节剂输送至系统中的入口管线、两个细胞分离器、一个无细胞保存槽、一个处理室、一个破裂装置、两个分级器以及任选的三个脱水室,用于使用厌氧细菌培养物的发酵过程。
[0027]
图5a是根据本发明的一个或多个实施方案的示例性细菌发酵系统的示意图,该系统用于使从厌氧细菌发酵过程中收集的细胞破裂并从匀浆获得一个或多个含蛋白质部分。
[0028]
图5b是根据本发明的一个或多个实施方案的另一个示例性细菌发酵系统的示意图,该系统用于使从厌氧细菌发酵过程中收集的细胞破裂并从匀浆获得一个或多个含蛋白质部分。
[0029]
图5c是根据本发明的一个或多个实施方案的细菌发酵系统另一个实例的示意图,该系统用于使从厌氧细菌发酵过程中收集的细胞破裂并从匀浆获得一个或多个含蛋白质部分。
[0030]
图5d是根据本发明的一个或多个实施方案的细菌发酵系统另一个实例的示意图,该系统用于使从厌氧细菌发酵过程中收集的细胞破裂并从匀浆获得一个或多个含蛋白质部分。
[0031]
图5e是根据本发明的一个或多个实施方案的另一个示例性细菌发酵系统的示意图,该系统用于使从厌氧细菌发酵过程中收集的细胞破裂并从匀浆获得一个或多个含蛋白质部分。
[0032]
图6是根据本发明的一个或多个实施方案的细菌发酵系统另一个实例的示意图,该系统用于使从厌氧细菌发酵过程中收集的细胞破裂并从匀浆获得一个或多个含蛋白质部分。
[0033]
图7a示出了根据本发明的一个或多个实施方案的在将含细胞悬浮液内的厌氧细菌细胞破裂成匀浆之前的含细胞悬浮液的一个实例的电子显微照片。
[0034]
图7b示出了根据本发明的一个或多个实施方案的在使细菌发酵液肉汤的含细胞悬浮液内的厌氧细菌细胞破裂之后从破裂装置获得的匀浆的一个实例的电子显微照片。
[0035]
图7c是显示根据本发明的一个或多个实施方案的在破裂装置内破裂后的含细胞悬浮液内厌氧细菌细胞的电子显微照片的另一个实例。
[0036]
图7d是显示根据本发明的一个或多个实施方案的在高压下通过破裂装置破裂后在含细胞悬浮液中的厌氧细菌细胞的破裂的细胞膜的匀浆的电子显微照片的另一实例。
[0037]
图7e是显示根据本发明的一个或多个实施方案的在很高压下通过破裂装置破裂后在含细胞悬浮液中的厌氧细菌细胞的破裂的细胞膜的匀浆的电子显微照片的另一实例。
[0038]
图8a示出了根据本发明的一个或多个实施方案的使在含细胞悬浮液的实例中的
厌氧细菌细胞破裂之后,从破裂装置获得的匀浆中的可溶性蛋白浓度的实例的图。
[0039]
图8b示出了根据本发明的一个或多个实施方案的使在含细胞悬浮液的另一实例中的厌氧细菌细胞的细胞膜破裂之后,从破裂装置获得的可溶性蛋白浓度的另一实例的另一图。
[0040]
发明详细说明本发明的实施方案提供了使用多种细胞破裂和蛋白质分级和纯化技术用于增加富含蛋白质的营养补充物和/或动物饲料生产的方法、系统和组合物,所述营养补充物和/或动物饲料源自厌氧细菌发酵过程后的微生物细胞生物质。更具体地,本发明涉及从发酵过程中分离出微生物生物质,将微生物生物质的细胞破裂成匀浆并从匀浆中分级和纯化一个或多个含蛋白质部分从而使所述一个或多个含蛋白质部分可以进一步处理成作为动物和人类均可摄入的营养补充物的组合物的方法。富含蛋白质的营养补充物可以直接用作原料,或与其他营养物一起用作人类或动物的补充物。
[0041]
富含蛋白质的营养补充物和动物饲料补充物可以被处理和得自在使用一种或多种气态底物例如合成气、碳源底物、含一氧化碳(co)气体、二氧化碳(co2)、氢气(h2)、合成气及其组合的细菌发酵系统中的发酵过程后的一个或多个含蛋白质部分。本发明进一步提供了富含蛋白质的营养补充物的组合物,其对于动物和人类的摄入具有有用的应用。
[0042]
在一方面,提供了用于增加从厌氧细菌细胞纯化的含蛋白质产物的回收率的方法。该方法包括在发酵容器内用厌氧细菌细胞将气态底物发酵成发酵液肉汤,其中发酵液肉汤处于第一ph值,并将从发酵容器中输送的发酵液肉汤分离成无细胞渗透溶液和含有厌氧细菌细胞的含细胞悬浮液。该方法进一步包括提供一种或多种ph调节剂以调节含细胞悬浮液的ph,其中将含细胞悬浮液的ph调节至高于第一ph值的第二ph值,并将含细胞悬浮液中所含的厌氧细菌细胞的细胞膜破裂成具有第一蛋白质回收率的含蛋白质产物的匀浆,其中第一蛋白质回收率是含蛋白质产物的蛋白质浓度(克/升)除以起始细胞浓度(克/升)的百分比。
[0043]
在另一方面,使用第一分级器将匀浆分级成第二蛋白质回收率的第一含蛋白质部分,和第三蛋白质回收率的含蛋白质的细胞碎片部分,然后输送第一含蛋白质部分至第二分级器。在另一方面,使用第二分级器将第一含蛋白质部分分级成第二含蛋白质部分,然后收集第二含蛋白质部分。
[0044]
在一个实施方案中,第一蛋白质回收率在10%至95%之间,例如30%至85%之间,或50%至80%之间。一方面,第二蛋白质回收率在10%至85%之间,例如在30%至80%之间。在另一方面,第三蛋白质回收率在10%至75%之间,例如在45%至65%之间。在一个方面,第一含蛋白质部分和/或含蛋白质的细胞碎片部分可以作为富含蛋白质的营养补充物进行处理和生产。在另一方面,所述第一含蛋白质部分被作为富含蛋白质的营养补充物生产,其蛋白质含量为约10%或更大,例如40%或更大,50%或更大,60%或更大,70%或更大,或80%或更大,90%或更大,例如约10%至约80%的蛋白质含量,或约10%至约95%的蛋白质含量,例如约10%至约98%的蛋白质含量。
[0045]
在一方面,第二ph值在5至12的范围内。在另一方面,第二ph值在7至12的范围内。在一个实施方案中,所述一种或多种ph调节剂选自氢氧化钠、氢氧化钾、氢氧化铵、碳酸氢盐、盐酸、硝酸、磷酸、氯化氢以及可用于升高或降低溶液ph值的任何试剂及其组合。
[0046]
在一方面,在使厌氧细菌细胞的细胞膜破裂之前,将一种或多种ph调节剂添加到含细胞悬浮液中。在另一方面,在使厌氧细菌细胞的细胞膜破裂之后,将一种或多种ph调节剂添加到含细胞悬浮液中。
[0047]
在另一方面,该方法还可包括将包含厌氧细菌细胞的含细胞悬浮液保存在含细胞保存槽中,并将含细胞悬浮液从含细胞保存槽以输送速率输送至破裂装置。含细胞保存槽可以用作含细胞悬浮液的储存容器或预处理室。在一个实例中,含细胞保存槽用于进行预处理步骤,该预处理步骤用一种或多种通过连接到含细胞保存槽的入口管线供应的添加剂(包括ph调节剂)在第二ph值处理包含厌氧细菌细胞的含细胞悬浮液。添加剂的实例包括但不限于表面活性剂、去污剂、edta、tween-20、triton x-100、十二烷基硫酸钠、chaps、酶、蛋白酶、溶菌酶、全能核酸酶、核酸酶、ph调节剂及其组合。
[0048]
在另一方面,该方法进一步包括在使厌氧细菌细胞的细胞膜破裂之前,用一种或多种添加剂处理含有厌氧细菌细胞的含细胞悬浮液。或者,该方法包括在破裂过程之后并在从包含细胞的细胞碎片部分中分离出第一包含蛋白质部分之前,用一种或多种添加剂处理包含厌氧细菌细胞的含细胞悬浮液。
[0049]
在又一方面,本发明的系统和方法可以进一步包括将含有厌氧细菌细胞的含细胞悬浮液浓缩成第二含细胞悬浮液。在一个实例中,将第二含细胞悬浮液输送到含细胞保存槽中以进行浓缩和/或储存在其中。在另一个实例中,对保存槽中的第二含细胞悬浮液进行预处理步骤,该预处理步骤是用一种或多种通过连接到含细胞保存槽的入口提供的添加剂处理含有厌氧细菌细胞的第二含细胞悬浮液。然后,将第二含细胞悬浮液从保存槽送出到破裂装置中。破裂装置使第二含细胞悬浮液中的厌氧细菌细胞的细胞膜破裂并产生匀浆。然后将另外含蛋白质部分与匀浆中含细胞的细胞碎片部分分离。
[0050]
在又一方面,该方法可以进一步包括将第一含蛋白质部分输送至一个或多个分级器,使用该一个或多个分级器将第一含蛋白质部分分级为第二含蛋白质部分和/或第三或更多含蛋白质部分,并收集第二和第三或更多含蛋白质部分。分级器的实例包括但不限于固液分级器、离心装置、连续离心机、倾析器离心机、圆盘堆叠式离心机、过滤装置、中空纤维过滤装置、螺旋缠绕式过滤装置、陶瓷过滤器装置、错流过滤装置、尺寸排阻装置、一个或一系列尺寸排阻柱、一个或一系列离子交换柱、一个或一系列碳聚合物柱、流通式磁性分级器、超滤装置、一个或一系列亲和色谱柱、一个或一系列凝胶过滤柱及其组合。
[0051]
在一个实施方案中,可以将第一包含蛋白质部分输送至过滤装置,以通过过滤装置进行过滤,并分级成截留物部分和滤液部分,从而将滤液部分制成富含蛋白质的营养补充物。在另一个实施方案中,截留部分被生产为富含蛋白质的营养补充物。在又一个实施方案中,可将第一含蛋白质部分输送至离心机中,并通过离心分级成上清含蛋白质部分和沉淀含蛋白质部分,从而使上清含蛋白质部分和/或沉淀含蛋白质部分被制成富含蛋白质的营养补充物。
[0052]
本发明的另一个实施方案提供了用于增加从厌氧细菌细胞纯化的含蛋白质产物的回收率的系统。该系统包括:发酵容器,其连接至气体入口管线以使气态底物流入含有厌氧细菌细胞的发酵容器中,以通过厌氧细菌细胞将气态底物发酵成第一ph值的发酵液肉汤,以及细胞分离器,其连接至发酵容器以从发酵容器接收发酵液肉汤并将发酵液肉汤分离成含有厌氧细菌细胞的含细胞悬浮液。
[0053]
该系统进一步包括一个或多个破裂装置,其连接至第一分离器的一个或多个第一出口,以将包含于含细胞悬浮液中的厌氧细菌细胞的细胞膜破裂成第二ph值的匀浆,其中第二ph值高于第一ph值,以及一个或多个分级器,其连接至一个或多个破裂装置以接收来自一个或多个破裂装置的匀浆并将该匀浆分级成具有含蛋白质产物的一个或多个含蛋白质部分和一个或多个含蛋白质的细胞碎片部分。
[0054]
在本发明的又一个实施方案中,通过将一种或多种ph调节剂供应到第一分离器的一个或多个第一出口中以调节含细胞悬浮液的ph,使第二ph值高于第一ph值。在另一个实施方案中,通过将一种或多种ph调节剂供应到一个或多个破裂装置中以调节含细胞悬浮液的ph,使第二ph值高于第一ph值。
[0055]
在本发明的一个实施方案中,该系统还包括保存槽,该保存槽连接到一个或多个破裂装置和细胞分离器,以在破裂该厌氧细菌细胞的细胞膜之前接收从细胞分离器流出的含细胞悬浮液。在一个实施方案中,通过将一种或多种ph调节剂供应到保存槽中并调节保存槽中的含细胞悬浮液的ph,使第二ph值高于第一ph值。在替代实施方案中,通过向连接至所述一个或多个破裂装置的保存槽的一个或多个第二出口中供应一种或多种ph调节剂,以调节所述一个或多个破裂装置内含细胞悬浮液的ph,使第二ph值高于第一ph值。在本发明的一个实施方案中,第二ph值在5至12的范围内。
[0056]
在本发明的一个实施方案中,系统的细胞分离器选自过滤装置、中空纤维过滤装置、螺旋缠绕式过滤装置、超滤装置、陶瓷过滤器装置、错流过滤装置、尺寸排阻柱过滤装置、具有错流过滤器的过滤装置、离心装置及其组合。
[0057]
在本发明的一个实施方案中,系统的所述一个或多个分级器选自固液分级器、离心装置、连续离心机、倾析器离心机、圆盘堆叠式离心机、过滤装置、中空纤维过滤装置、螺旋缠绕式过滤装置、陶瓷过滤器装置、错流过滤装置、尺寸排阻装置、一个或一系列尺寸排阻柱、一个或一系列离子交换柱、一个或一系列碳聚合物柱、流通式磁性分级器及其组合。
[0058]
在本发明的一个实施方案中,该系统进一步包括一个或多个脱水室,以接收从所述一个或多个分级器获得的一个或多个部分并将该一个或多个部分脱水以产生富含蛋白质的营养补充物,其中所述一个或多个部分选自第一含蛋白质部分、含蛋白质的细胞碎片部分及其组合,其中所述一个或多个脱水室选自喷雾干燥装置、鼓式干燥机和冷冻干燥机、冻干装置及其组合。
[0059]
在一个实施方案中,通过微流化器完成细胞破裂。在另一个实施方案中,使用超声仪完成细胞破裂。在又一个实施方案中,使用微流化器以5,000至25,000磅/平方英寸(psi)的处理压力完成细胞破裂。在又一个实施方案中,使用微流化器以15,000至20,000磅/平方英寸(psi)的处理压力完成细胞破裂。在又一个实施方案中,使用微流化器以15,000磅/平方英寸(psi)的处理压力完成细胞破裂。
[0060]
一方面,细菌发酵系统包括连接至发酵容器的第一细胞分离器和破裂装置。第一细胞分离器从发酵容器以第一细胞浓度接收发酵液,并将发酵液分离为无细胞渗透溶液和第二细胞浓度的含细胞悬浮液。在另一方面,细菌发酵系统还包括连接至第一细胞分离器的含细胞保存槽,以接收一定量的第一含细胞悬浮液。在又一方面,细菌发酵系统还包括第二细胞分离器,该第二细胞分离器连接至发酵容器的第四出口管线,以从发酵容器接收发酵液肉汤的第二流并将发酵液肉汤的第二流分离成第二含细胞悬浮液和第二无细胞渗透
溶液。
[0061]
i.微生物生物质的处理以产生源自发酵的蛋白质细菌发酵过程通常包括通过细菌(例如厌氧细菌或产乙酸细菌等)发酵气态底物,例如合成气或含一氧化碳(co)的气态底物,以及产生包括二氧化碳(co2)、乙醇、丁醇、丁酸、乙酸等的发酵产物。更重要的是,在厌氧细菌发酵过程之后,获得了大量的微生物生物质。在细菌发酵过程中或之后,可以清除大量微生物生物质。在完成细胞清除后或在细菌发酵过程中,如此大量的微生物生物质可用于其他应用。然而,需要进一步的复杂处理以将大量源自发酵的蛋白质提取至高质量(即,没有有害物质或污染物),以使其可用作例如营养补充物或动物原料。具体地,本发明包括从来自细菌发酵过程的细胞生物质中提取出这种源自发酵的蛋白质的过程。更具体地,本发明包括用于细菌发酵过程的系统,其从细胞团或微生物生物质中提取出一个或多个含源自发酵的蛋白质的部分,以处理成营养补充物和动物饲料。
[0062]
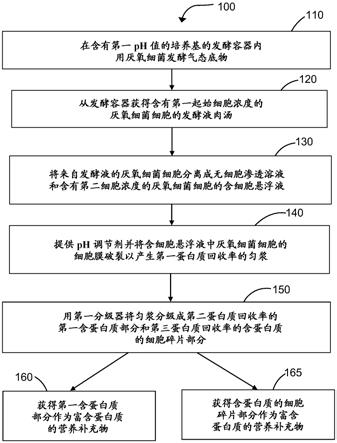
图1a是从细菌发酵系统生产富含蛋白质的营养补充物的方法100的一个实例的流程图。气态底物的细菌发酵的方法100可以在有利于形成烃化合物、碳水化合物、特定蛋白质、特定氨基酸和/或其他所需组分的条件下操作,同时保持所需的发酵产物水平,例如醇生产率水平。
[0063]
步骤110包括在含有第一ph值的培养基的发酵容器中用厌氧细菌发酵气态底物。在步骤110,将发酵培养基添加到发酵容器中以进行细菌发酵过程。另外,将一种或多种气态底物输送到发酵容器中,并通过细菌培养物例如含有厌氧细菌的培养物进行发酵。最初,包含在发酵容器中的液体发酵培养基可以包括各种类型的合适的细菌培养基、发酵培养基或液体营养培养基。营养培养基包含有效量的一种或多种维生素和几种矿物质,以允许所用微生物的生长和/或有利于所产生的特定产物。
[0064]
可以使用适合厌氧细菌生长的培养基,其适合用于发酵过程,该发酵过程用合成气如一氧化碳和氢气或另一种其他合适的底物生产一种或多种含氧烃化合物,例如各种类型的乙醇、丁醇、乙酸等。合适的发酵培养基的一个实例在美国专利号7,285,402中描述,其通过引用并入本文。合适培养基的其他实例在美国序列号61/650,098和61/650,093中描述,二者均通过引用并入本文。
[0065]
另外,方法100的细菌发酵过程中使用的一种或多种气态底物可包括各种合成气体(即合成气),钢生产过程中的废气,铁生产过程中的废气,煤生产过程中的废气,或工业生产工厂产生的任何其他合适的气体源。在一个实施方案中,在细菌发酵过程中使用的气态底物包括含一氧化碳(co)的气态底物和/或其他气体,例如氢气、二氧化碳(co2)、氮气(n2)及其组合。
[0066]
在一个实例中,含一氧化碳的气态底物可以是高体积的含一氧化碳的工业烟气。在一些方面,包括一氧化碳的气体源自含碳废气。含碳废气包括工业废气或其他市政固体或液体废物的气化。因此,这些工业过程代表了捕获原本将被排放到周围的环境中的碳的有效过程。工业烟气的实例包括在黑色金属产品制造、有色产品制造、石油精炼过程、煤的气化、生物质的气化、电力生产、炭黑生产、氨气生产、甲醇生产和焦炭生产过程中产生的气体。
[0067]
在一个实例中,取决于所使用的发酵容器的尺寸和类型,将含一氧化碳的合成气
7827)、clostridium coskatii (atcc pta-10522)、德雷克氏梭菌(clostridium drakei)、俊达氏梭菌(clostridium ljungdahlii) petc (atcc 49587)、俊达氏梭菌(clostridium ljungdahlii) eri2 (atcc 55380)、俊达氏梭菌(clostridium ljungdahlii) c-01 (atcc 55988)、俊达氏梭菌(clostridium ljungdahlii) o-52 (atcc 55889)、大梭菌(clostridium magnum)、巴氏梭菌(clostridium pasteurianum) (dsm 525, dsmz germany)、拉氏梭菌(clostridium ragsdali) p11 (atcc baa-622)、粪味梭菌(clostridium scatologenes)、热乙酸梭菌(clostridium thermoaceticum)、clostridium ultunense、desulfotomaculum kuznetsovii、粘液真杆菌(eubacterium limosum)、geobacter sulfurreducens、乙酸甲烷八叠球菌(methanosarcina acetivorans)、巴氏甲烷八叠球菌(methanosarcina barkeri)、morrella thermoacetica、morrella thermoautotrophica、oxobacter pfennigii、产生消化链球菌(peptostreptococcus productus)、ruminococcus productus、thermoanaerobacter kivui及其组合。还可以选择其他产乙酸或厌氧细菌用于本文所述的方法100。
[0071]
在一实例中,所使用的细菌包括具有约50%或更少的基因组dna g+c含量的产乙酸细菌细胞。产乙酸细菌可以是有活性的、无活性的或两者的组合。在这方面,g+c含量可以通过本领域已知的任何方法确定。例如,可以使用诸如sambrook et al. (1989) molecular cloning: a laboratory manual (cold spring harbor laboratory press, cold spring harbor) (也称为"maniatis", 其通过引用并入本文)中描述的方法对基因组进行测序。然后可以手动或通过使用许多程序(例如bohlin et al.
ꢀ“
analysis of intragenomic gc content homogenicity within prokaryotes”, bmc genomics 2010, 11:464, 其通过引用并入本文)确定g+c含量。确定g+c含量的其他方法包括美国专利号8,143,037、mesbah et al. (1989)
ꢀ“
measurement of deoxyguanosine/thymidine ratios in complex mixtures by high-performance liquid chromatorgraphy for determination of the mole percentage guanine + cytosine of dna. j. chromatogr. 479: 297-306和tanner et al.,
ꢀ“
costridium ljungdahlii sp. nov., an acetogenic species in clostridial rrna homology group i”, international journal of systematic bacteriology, apr. 1993, p. 232-236,其全部通过引用并入本文。
[0072]
在步骤110中,在将细菌培养物接种到发酵容器中之后,建立初始进料气供应速率,以有效生长初始微生物(例如厌氧细菌)种群并随后发酵。发酵容器提供了培养厌氧细菌的环境。合适的发酵容器可包括但不限于以下一种或多种:连续搅拌釜反应器(cstr)、固定化细胞反应器(icr)、滴流床反应器(tbr)、移动床生物膜反应器(mbbr)、鼓泡柱、气体提升发酵罐、膜反应器(例如中空纤维膜生物反应器(hfmbr))、静态混合器、容器、管道布置、塔、环管反应器及其组合。在方法100中,可以利用任何已知的发酵容器或发酵生物反应器。生物反应器的一些实例描述于在2011年6月30日提交的美国序列号61/571,654和61/571,565、在2011年9月13日提交的美国序列号61/573,845、在2012年5月15日提交的美国序列号13/471,827和13/471,858、以及在2012年5月16日提交的美国序列号13/473,167,通过引用将其全部并入本文。
[0073]
在一个实施方案中,发酵容器包括连接至第二生物反应器的第一生物反应器,其
中第一生物反应器将发酵液进料到第二生物反应器中,其中在第二生物反应器中产生乙醇。例如,发酵容器可以是用于改善培养物稳定性的两阶段cstr系统。例如,发酵容器可任选地包括具有第一cstr室的第一生长阶段和具有第二cstr室的第二生产阶段。
[0074]
在一个实例中,向生长阶段cstr供给液体培养基,并且将来自生产阶段cstr的未转化的底物气体供给至生长阶段cstr。通常,向生产阶段cstr供入新鲜气体进料,和新鲜培养基进料以及来自生长阶段cstr的细菌培养物进料。任选地,细胞循环用于将细菌细胞从生产阶段cstr中取出来,从发酵产物中分离出来,和送回生产阶段cstr,以获得高细菌发酵效率。通常,细菌细胞不被循环到生长阶段cstr。美国申请号10/311,655描述了连续发酵过程,其通过引用并入本文。术语“发酵”、“发酵过程”、“细菌发酵过程”、“发酵反应”、“细菌发酵反应”等旨在涵盖该过程的生长阶段和产物生物合成阶段。一方面,发酵是指一氧化碳向醇的转化。一方面,细菌发酵过程开始于向其中包含细菌的发酵容器中添加合适的发酵培养基和一种或多种气态底物。
[0075]
通常,一旦细菌发酵过程开始,发酵液肉汤就在发酵容器内产生。发酵液肉汤除了包含在发酵容器内的培养基、一种或多种气态底物和细菌之外,还可以包括一种或多种发酵产物。包含在发酵液肉汤中的和通过发酵容器内部的细菌发酵过程产生的发酵产物可以包括一种或多种含氧烃化合物,例如醇等,包括但不限于乙醇、2-丁醇、2-丁酮、2,3-丁二醇、丙酮、丁二烯、丁烷、丁醇、丁酸盐、丁酸、乙烯和脂肪酸、乙酸及其组合。
[0076]
一方面,可以产生乙醇和乙酸的混合物。在另一方面,产生了乙醇和丁醇的混合物。在一个实例中,在发酵容器中以每天大于10g/l的比生产率生产乙醇,而游离乙酸的浓度保持在小于5g/l的游离乙酸。在发酵液肉汤中发现的乙醇和乙酸盐的乙醇与乙酸盐之比可以为1:1至20:1。
[0077]
容纳在发酵容器内的发酵液肉汤可包含稀释浓度的乙醇,并且可能需要按质量和/或其浓度进行进一步处理。例如,包含在发酵液肉汤中的发酵产物可以从发酵容器中送出并进入蒸馏室或其他类型的反应器中,以蒸馏成更高浓度的最终的蒸馏产物,并进一步处理和回收。
[0078]
发酵液肉汤还可以包括死亡或无活性的细菌细胞。这些细菌细胞另外被称为细菌细胞或厌氧细菌的细胞。来自细菌发酵过程的大量细胞积累被称为细胞团或废生物质。术语“无活性的产乙酸细菌”或“无活性的细菌细胞”是指在经过细菌发酵过程后丧失其复制能力的死细胞。术语“细胞团”是指形成微生物生物质的细菌细胞整体。微生物生物质可以在细菌发酵过程中积累,并且可用于通过本文所述的方法和系统处理成源自发酵的蛋白质。发酵液肉汤还可以包括各种蛋白质、氨基酸、碳水化合物、核酸和其他部分。核酸的实例包括核苷酸,例如dna、rna及其任何衍生物和类似物。由于发酵肉汤中细胞团或微生物生物质的积累,因此发酵肉汤本身可以提供显著的热量值。发酵液肉汤可具有约0.5%、1%、5%、10%、20%、25%、30%、35%、40%、45%和约50%的干物质含量。
[0079]
如图1a所示,在方法100的步骤120处,将一定量的包含第一浓度的厌氧细菌细胞的发酵液肉汤和发酵产物从细菌发酵容器中输送出。通常,当细胞在发酵容器内达到稳态生长时,可以将含有细菌细胞的发酵液肉汤送出发酵容器。对于稳态细菌生长阶段之后的发酵过程,发酵液肉汤中包含的第一批细菌细胞的第一起始细胞浓度可以为0.5g/l(干细胞质量)或更高,例如1.0g/l或更高,或2.0g/l或更高,或5.0g/l或更高,或15.0g/l或更高,
或30.0g/l或更高。
[0080]
在步骤130,使用例如一个或多个细胞分离器,将来自发酵液肉汤的厌氧细菌的细胞分离成无细胞渗透溶液和含细胞悬浮液。在该步骤中,目标是从发酵液肉汤中分离并除去细菌细胞,并分别获得无细胞渗透溶液和含细胞悬浮液。无细胞渗透溶液主要包含发酵过程中产生的发酵产物,便于通过蒸馏和其他过程进行进一步处理。发酵过程后,含细胞悬浮液主要包含细菌细胞。可以在第二浓度(或第二细胞密度)下测量含细胞悬浮液中的细菌细胞,并且在一个实施方案中,含细胞悬浮液中的细菌细胞的第二浓度等于或高于发酵液肉汤中所含细菌细胞的第一浓度。
[0081]
为了维持发酵容器中微生物培养物的期望细胞浓度,细菌发酵过程包括清除一部分发酵液肉汤。增加的细胞浓度在发酵过程中引起与操作相关的问题,例如,游离乙酸浓度的不希望的增加,使得乙酸盐的产生优先于乙醇的产生。因此,重要的是监测细胞密度并进行发酵液肉汤的定期或连续细胞清除。术语“细胞密度”是指每单位发酵培养基体积的微生物细胞质量,例如,克/升。
[0082]
细菌发酵容器中细胞浓度的稳定是通过将细菌细胞从发酵容器中清除到低于利用生物反应器中所有还原性气体或营养底物的稳定稳态浓度的细胞浓度,并在发酵生物反应器肉汤中存在的乙酸盐的游离乙酸部分超过高浓度(例如,游离乙酸浓度为1g/l或更高,或2g/l或更高)时增加水性进料速率来实现的。通过在发酵容器内维持恒定的细胞浓度而无需额外的培养物补充,可以长时间(例如,数月)维持大规模的连续细菌发酵。在此期间,向发酵容器内的细菌培养物供给一种或多种气体(例如,co、co2、h2和其他碳源底物)以及含有维生素和其他必需营养物的液体营养培养基。
[0083]
可用于将无细胞渗透溶液与发酵液肉汤中的含细胞悬浮液分离的合适细胞分离器包括但不限于任何过滤装置、中空纤维过滤装置、螺旋缠绕式过滤装置、超滤装置、陶瓷过滤器装置、错流过滤装置、尺寸排阻柱过滤装置或其组合。可用于本发明的过滤型细胞分离器的合适的过滤器包括但不限于螺旋缠绕膜/过滤器、错流过滤器。另外,从无细胞的渗透物中分离细胞的另一种合适的方式是通过使用一个或多个离心装置。
[0084]
在一个实施方案中,在步骤130使用的细胞分离器的功能是将细菌细胞分离成含细胞悬浮液和无细胞渗透溶液,和/或浓缩含细胞悬浮液使其浓度高于在通过细胞分离器分离细胞之前发酵液肉汤内的细胞浓度。在另一个实施方案中,发酵液肉汤中的细胞可以通过使其通过细胞分离器数次(例如,通过一个或多个过滤器型过滤装置数次,或通过一个或多个离心机以相同或不同的离心速率离心数次)而被分离和浓缩。
[0085]
在优选的实施方案中,在细胞分离后,含细胞悬浮液中的细胞浓度(或细胞密度)高于发酵液肉汤的细胞浓度。在本发明的一方面,一个或多个具有螺旋缠绕过滤器的过滤装置用于通过使发酵液肉汤通过螺旋缠绕过滤器数次而浓缩细胞。
[0086]
在另一方面,进行细胞循环,通常是指从无细胞液体渗透溶液中分离出含有细菌细胞的悬浮液,并将所有或部分那些分离的细菌细胞返回到发酵容器中。在一个实施方案中,通过细胞分离器如过滤装置的超滤用于完成细胞分离和/或细胞循环。
[0087]
在又一方面,在发酵容器内培养的细菌的稳态细菌生长期间,进行从发酵容器的细胞清除以将细菌细胞收集到较高浓度的含细胞悬浮液或半干微生物生物质中。在一个实施方案中,细胞清除需要一定量的发酵液肉汤,其包含细菌细胞和在发酵培养基中发现的
其他物质。例如,细胞清除可以是在细菌发酵过程中从发酵容器中移出的发酵液或发酵液肉汤。在另一个实施方案中,细胞清除可能需要通过从发酵容器中除去第一细胞浓度的发酵液并进一步浓缩细胞以具有第二细胞浓度的含细胞悬浮液来获得浓缩的含细胞悬浮液。含细胞悬浮液的细胞密度比从发酵容器中取出的发酵液的细胞密度高。这些步骤提供了某些颗粒的有效去除,并允许从方法100产生的最终富含蛋白质的营养补充物中蛋白质含量的高收率。
[0088]
一方面,在连续细菌发酵期间发生细胞清除。在另一方面,细胞清除在细菌发酵之后发生,其中细菌发酵过程被暂停或停止以允许从发酵容器中去除微生物生物质。
[0089]
接下来,方法100的步骤140包括提供ph调节剂并使含细胞悬浮液中的厌氧细菌细胞的细胞膜破裂,产生第一蛋白质回收率的匀浆。ph调节剂可以选自氢氧化钠、氢氧化钾、氢氧化铵、碳酸氢盐、盐酸、硝酸、磷酸、氯化氢、可用于升高或降低溶液ph值的任何试剂及其组合。
[0090]
在方法100的步骤140,将包含在含细胞悬浮液中的细菌细胞破裂成匀浆。破裂装置可用于破裂和/或裂解含细胞悬浮液中细菌细胞的细胞膜。用于使细菌细胞破裂的破裂装置的实例包括但不限于各种类型的微流体装置、声处理装置、超声装置、机械破碎装置、弗氏压碎器、冷冻机、加热器、热交换器、蒸馏柱、施加热以造成温度变化的任何装置、高温反应器、均化器及其组合等。
[0091]
如图1a所示,在含细胞悬浮液中的细菌细胞破开和/或破裂后,所得的破裂的细胞混合物,例如匀浆,可以在步骤150通过从微生物生物质匀浆中的细胞碎片部分分离出含蛋白质部分并进一步纯化和提取另外的含蛋白质部分以生成富含蛋白质的营养补充物来进一步处理。预期通过使用一个或多个分级器来进行这种分离。一方面,获得一个或多个含蛋白质部分,并且该一个或多个含蛋白质部分还可以包括游离氨基酸、总氨基酸和肽。
[0092]
在步骤150,用于分级匀浆的一个或多个分级器的合适实例包括但不限于各种类型的固液分级器、离心装置、连续离心机、倾析器离心机、圆盘堆叠式离心机、过滤装置、中空纤维过滤装置、螺旋缠绕式过滤装置、陶瓷过滤器装置、错流过滤装置、尺寸排阻装置、一个或一系列尺寸排阻柱、一个或一系列离子交换柱、一个或一系列碳聚合物柱、流通式磁性分级器、超滤装置、一个或一系列亲和色谱柱、一个或一系列凝胶过滤柱及其组合等等。
[0093]
在一个实施方案中,在步骤150,将通过一个或多个破裂装置破裂细菌细胞后获得的匀浆输送至第一分级器,并获得第一含蛋白质部分和第一含蛋白质细胞碎片部分。在一个方面,第一含蛋白质部分的蛋白质含量为至少1%或更多,3%或更多,5%或更多,10%或更多,20%或更多,30%或更多,40%或更多,50%或更多,60%或更多,70%或更多,80%或更多或95%或更多。
[0094]
在一个实施方案中,在步骤160,可以将源自匀浆的第一含蛋白质部分直接掺入富含蛋白质的营养补充物组合物、细胞生长培养基补充物/组合物、药物组合物和/或动物饲料(例如,鱼饲料、虾饲料、鸡饲料等)中。这种掺入可能需要将第一含蛋白质部分干燥至低水分含量(例如,糊状或粉末状),并将该第一含蛋白质部分与其他成分(例如,其他动物饲料营养物、药物填充剂、共混剂、增塑剂等)直接共混,用于制成一种或多种类型的营养补充物。本文所述的步骤160可包括以下另外的处理步骤:调节第一含蛋白质部分的ph,添加一种或多种溶解度增加剂,从第一含蛋白质部分中去除有害蛋白质和/或其组合,以增加和提
高第一含蛋白质部分的质量和浓度。另外,可以通过进行源自细菌发酵的蛋白质的提取和纯化并将其重新用作富含蛋白质的营养补充物来对第一含蛋白质部分进行进一步的下游处理。这样的实例在图2a和2b中示出。
[0095]
或者,在步骤165,可以将源自匀浆的第一含蛋白质的细胞碎片部分直接掺入富含蛋白质的营养补充物组合物、药物组合物、细胞生长培养基补充物/组合物和/或动物饲料(例如,鱼饲料、虾饲料、鸡饲料等)。类似地,可能需要调节第一含蛋白质的细胞碎片部分的ph,向含蛋白质的细胞碎片部分添加一种或多种溶解度增加剂,从第一含蛋白质的细胞碎片部分中去除有害蛋白质和/或其组合的其他处理步骤以增加和提高第一含蛋白质的细胞碎片部分的质量和浓度。在一方面,如果仅回收第一含蛋白质的细胞碎片部分的可溶性蛋白质,则可以获得回收的蛋白质并将其直接掺入作为动物摄入或人类摄入的富含营养的补充物。但是,为了将第一含蛋白质的细胞碎片部分掺入高质量的富含营养的补充物中以供人类摄入,可能需要进一步的下游处理以纯化和回收营养和蛋白质内容物。在另一方面,在该方法中回收的不溶蛋白质可以进行进一步的下游处理,然后与第一含蛋白质部分结合并被生产为富含蛋白质的营养补充物。
[0096]
图1b是从细菌发酵系统生产富含蛋白质的营养补充物的方法100的另一个实例的流程图。气态底物的细菌发酵的方法100可以在有利于形成烃化合物、碳水化合物、特定蛋白质、特定氨基酸和/或其他所需组分的条件下操作,同时保持所需的发酵产物水平,例如醇生产率水平。
[0097]
方法100的步骤130包括将厌氧细菌的细胞从发酵液中分离成无细胞渗透溶液和含细胞悬浮液,该悬浮液含有第二细胞浓度的厌氧细菌细胞。任选地,方法100的步骤135包括将第二ph值的含细胞悬浮液保存在第一保存槽中。
[0098]
方法100的步骤140包括通过破裂装置使第二ph值的含细胞悬浮液中的厌氧细菌细胞的细胞膜破裂以产生匀浆。任选地,方法100的步骤145包括在破裂后将第二ph值的含细胞悬浮液保存在第一保存槽中。
[0099]
方法100的步骤150包括使用第一分级器将匀浆分级成第一含蛋白质部分和含蛋白质细胞碎片部分。方法100的步骤160包括获得第一含蛋白质部分作为富含蛋白质的营养补充物。方法100的步骤165包括获得含蛋白质的细胞碎片部分作为富含蛋白质的营养补充物。
[0100]
图2a是处理来自发酵过程的包含厌氧细菌细胞的含细胞悬浮液(例如,来自方法100的步骤130的第二浓度的含细胞悬浮液)以获得第二含蛋白质部分作为富含蛋白质的营养补充物的方法200a的一个实例。在该方法中,存在在使含细胞悬浮液内的需氧细胞的细胞膜破裂并产生匀浆之前在步骤202用一种或多种添加剂处理含细胞悬浮液的任选的处理步骤。
[0101]
在步骤202的细胞预处理过程中,可以在预处理室或用于预处理的保存槽中对含细胞悬浮液进行处理,并用一种或多种添加剂处理以辅助并提高细胞破裂效率以在步骤204分解厌氧细菌细胞的细胞壁和细胞膜。一方面,浓缩的细菌细胞进入保存槽,在其中容纳它们,直到破裂装置准备好将更大体积的细胞一起处理。在另一方面,当细菌细胞被容纳在保存槽中时,可以进行预处理以准备产生具有高蛋白质含量并适合消费的富含蛋白质的补充物。在另一方面,在步骤202的预处理过程中添加的一种或多种添加剂还可以帮助优化
在步骤204用于使细菌细胞破裂的条件并以高质量产生匀浆。
[0102]
在步骤202使用的合适的添加剂包括但不限于去污剂、ph调节剂、酶、核酸酶、蛋白酶、水解酶、碱性缓冲剂、酸性缓冲剂或其组合。在一实施方案中,方法200a的步骤202包括降低源自发酵的细菌细胞的含细胞悬浮液的核酸含量。通过用核酸酶处理细菌细胞来完成这种预处理过程。所使用的核酸酶的实例包括但不限于脱氧核糖核酸酶、核糖核酸酶、全能核酸酶和核酸酶。含细胞悬浮液的核酸酶处理可以进一步通过碱性水解和化学提取(例如硫酸铵沉淀、乙醇沉淀、聚乙烯亚胺沉淀)来辅助。一方面,含细胞悬浮液的核酸含量降低至约1.5%至5%,或约2%至18%。
[0103]
在步骤206,在细胞破裂之后,可以对匀浆进行另外的提取和纯化过程,例如使用第一分级器将其分级成第一含蛋白质部分和含蛋白质的细胞碎片部分。用于分级匀浆的第一分级器的实例包括但不限于各种类型的固液分级器、离心装置、连续离心机、倾析器离心机、圆盘堆叠式离心机、过滤装置、中空纤维过滤装置、螺旋缠绕式过滤装置、陶瓷过滤器装置、错流过滤装置、尺寸排阻装置、一个或一系列尺寸排阻柱、一个或一系列离子交换柱、一个或一系列碳聚合物柱、流通式磁性分级器、超滤装置、一个或一系列亲和色谱柱、一个或一系列凝胶过滤柱及其组合等。
[0104]
或者,浓缩的细菌细胞的含细胞悬浮液可以在步骤204直接进入破裂装置,然后进行如步骤202所述的预处理过程以帮助优化在步骤206用于分离和分级匀浆的条件。在另一方面,可以将从方法200a中回收的蛋白质进行进一步的下游处理,然后与第一含蛋白质部分结合并制成富含蛋白质的营养补充物。
[0105]
在步骤208,将第一含蛋白质部分输送至第二分级器并在步骤210使用第二分级器分级为第二含蛋白质部分。用于分级含蛋白质部分的第二分级器的实例包括但不限于各种类型的固液分级器、离心装置、连续离心机、倾析器离心机、圆盘堆叠式离心机、过滤装置、中空纤维过滤装置、螺旋缠绕式过滤装置、陶瓷过滤器装置、错流过滤装置、尺寸排阻装置、一个或一系列尺寸排阻柱、一个或一系列离子交换柱、一个或一系列碳聚合物柱、流通式磁性分级器、超滤装置、一个或一系列亲和色谱柱、一个或一系列凝胶过滤柱及其组合等。
[0106]
在步骤212,可以将获得的第二含蛋白质部分配制成富含蛋白质的营养补充物、药物组合物、细胞生长培养基/组合物和/或动物饲料(例如鱼饲料、虾饲料、鸡饲料等)。这种掺入可能需要将第二含蛋白质部分干燥至低水分含量(例如,糊状或粉末状),并将该第二含蛋白质部分与其他成分(例如,其他动物饲料营养物、药物填充剂、共混剂、增塑剂等)直接共混,用于制成一种或多种类型的营养补充物。
[0107]
例如,来自步骤204的匀浆可以进入过滤装置以产生第一含蛋白质部分(例如,在由过滤装置过滤后的滤液含蛋白质部分)。过滤的含蛋白质部分是部分纯化的蛋白质产物。在一个实施方案中,然后将过滤的含蛋白质部分离心(例如,通过第二分级器/离心机)以产生另外的可溶性蛋白质部分和细胞固体部分。这样的第二含蛋白质部分可以单独或组合用作富含蛋白质的营养补充物。
[0108]
作为另一个实例,可以对来自步骤204的匀浆进行离心,之后,收集上清含蛋白质部分。上清含蛋白质部分进入过滤装置,其中收集第二滤液含蛋白质部分。作为又一个实例,第一含蛋白质部分仅进入过滤装置,之后收集滤液含蛋白质部分并用作富含蛋白质的补充物。作为又一个实例,仅对第一含蛋白质部分进行离心,之后收集分级的蛋白质或上清
液作为含蛋白质部分。一个或多个含蛋白质部分与细胞碎片蛋白质的分离通过一个或多个分级器完成。
[0109]
一方面,使用具有两个分级器的发酵系统。在另一个实施方案中,使用具有三个分级器的发酵系统。图2b是根据本发明的一个或多个实施方案的处理来自发酵过程的含细胞悬浮液的方法200b的一个实例,其中使用三个分级器,以获得第三含蛋白质部分作为富含蛋白质的营养补充物。
[0110]
如图2b所示,方法200b包括在步骤214处将第二含蛋白质部分输送至第三分级器,并且在步骤216从第二含蛋白质部分中分级出并提取出第三含蛋白质部分。在步骤218收集第三含蛋白质部分,且第三含蛋白质部分在步骤220收集并作为富含蛋白质的补充物获得。
[0111]
例如,可以输送来自步骤210的第二含蛋白质部分至第三分级器(例如,过滤装置),以产生收集的滤液含蛋白质部分,并用作富含蛋白质的补充物。作为另一个实例,对第二含蛋白质部分进行离心,之后收集上清含蛋白质部分和沉淀细胞碎片部分。从过滤装置中收集滤液含蛋白质部分,并制成富含蛋白质的营养补充物,其蛋白质含量为约1%至3%,3%至7%,7%至10%,约10%至14%,约11%至20%,约21%至35%以及约35%或更多。
[0112]
在一个实施方案中,将从步骤160、165、212、220获得的一个或多个含蛋白质部分输送至脱水室,之后收集脱水的含蛋白质部分并将其生产为富含蛋白质的营养补充物。或者,存在两个或更多个脱水室,其中来自每个步骤的每个含蛋白质部分被输送至分开的、单独的脱水室。脱水室接收含蛋白质部分,并将其干燥成低水分糊状或干粉形式,准备将其混入富含蛋白质的营养补充物中,以供人类摄入和/或动物饲料使用。脱水室的合适实例包括但不限于烘箱干燥机、喷雾干燥室、鼓式干燥机和冷冻干燥机、冻干装置、真空干燥机及其组合。
[0113]
在一个实施方案中,本发明是使用厌氧细菌从发酵过程生产富含蛋白质的营养补充物的方法。该方法包括在发酵容器中用厌氧细菌发酵气态底物,从发酵容器中获得一定量的包含第一浓度的厌氧细菌细胞的发酵液,将厌氧细菌的细胞从发酵液分离成无细胞渗透溶液和含有第二浓度的厌氧细菌细胞的含细胞悬浮液,将含细胞悬浮液中的厌氧细菌细胞的细胞膜破裂成匀浆,并从匀浆中的细胞碎片部分分离第一含蛋白质部分。
[0114]
一方面,该方法包括在发酵容器中用厌氧细菌发酵气态底物。气态底物是流入发酵容器的一种或多种气体的含co的气态底物。所使用的一种或多种气体选自碳源底物、一氧化碳(co)、二氧化碳(co2)、氢气(h2)、合成气及其组合。厌氧细菌包括但不限于一种或多种产乙酸细菌菌株,例如来自梭菌属、醋酸杆菌属及其类似变体。发酵容器提供了用于培养梭菌细菌的有利环境,其中存在发酵培养基,其流入发酵容器中以向细菌提供营养、维生素和其他必需矿物质。
[0115]
所述方法还包括从发酵容器中获得一定量的包含第一细胞浓度的厌氧细菌细胞的发酵液。发酵液的收集物可以被送到细菌发酵系统内的一个或多个设备。一方面,后续受控量的发酵液处于第二、第三和第四细胞浓度。在大多数方面,受控发酵液的第二细胞浓度大于第一发酵液的第一细胞浓度。
[0116]
该方法还包括第一细胞分离器,其接收一定量的包含厌氧细菌细胞的发酵液。第一细胞分离器将发酵液分离成包含厌氧细菌细胞的第一含细胞悬浮液和第一无细胞渗透溶液。输送至第一细胞分离器的发酵液具有第一细胞浓度。由第一细胞分离器产生的第一
含细胞悬浮液具有第二细胞浓度。第一含细胞悬浮液的第二细胞浓度高于发酵液的第一细胞浓度。第一无细胞渗透溶液被送至与第一细胞分离器相连的处理室。在一些方面,一些第一含细胞悬浮液被送回发酵容器。
[0117]
在另一方面,将第一发酵液的第一流送至第一细胞分离器以进一步处理以便乙醇生产。将第二发酵液的第二流送至第二细胞分离器以进一步处理以便生产含蛋白质产物,该产物可用作富含蛋白质的营养补充物。
[0118]
本发明的方法提供了产生高生产率乙醇生产同时重新利用了在发酵过程中使用的细菌细胞中发现的有用部分的同时方法。收集的发酵液处于厌氧细菌细胞的第一浓度。细胞分离器产生第二浓度的厌氧细胞的含细胞悬浮液。在一个实施方案中,细胞分离器将第二浓度的含细胞悬浮液送至破裂装置。在另一个实施方案中,细胞分离器将含细胞悬浮液送至保存槽。
[0119]
一旦完成收集,就可以进一步处理收集物以将厌氧细菌的细胞从发酵液分离成无细胞渗透溶液和含有第二浓度的厌氧细菌细胞的含细胞悬浮液。含细胞悬浮液的第二浓度高于含有厌氧细菌细胞的发酵液的第一浓度。无细胞渗透溶液被送回处理室,该处理室蒸馏乙醇以生产乙醇。这提供了有效的系统,该系统不会丢弃仍然有用的含乙醇的无细胞渗透溶液。
[0120]
该方法还包括将含细胞悬浮液中的厌氧细菌细胞的细胞膜破裂成匀浆。一方面,这发生在破裂装置中。含有厌氧细菌细胞的含细胞悬浮液进入破裂装置,其中含细胞悬浮液受到很高的力(例如,机械、声音或压力)。高剪切力使细胞的细胞膜破裂,导致细胞破开,并使细胞中的内容物在它们进入含细胞悬浮液时自由漂浮。破裂装置产生匀浆,该匀浆可以被进一步处理以获得第一含蛋白质部分。匀浆包含通常在源自发酵的细菌细胞中发现的几个部分,包括蛋白质、金属(例如,ca、cl、co、k、mg、ni、p、s、se、w、zn、na、fe)、脂质、核酸和糖。
[0121]
为了获得第一含蛋白质部分,该方法还包括从匀浆内的细胞碎片部分分离第一含蛋白质部分。在一方面,将匀浆离心,然后过滤,以产生第一含蛋白质部分。所述第一含蛋白质部分被输送至第一分级器,其将第二含蛋白质部分与所述第一含蛋白质部分分离,并允许从所述第一分级器收集第二含蛋白质部分。
[0122]
在一方面,该方法包括使与匀浆的细胞碎片部分分离的第一含蛋白质部分脱水。在这个方面,系统具有连接到第一分级器的脱水室。第一分级器将第一含蛋白质部分输送到脱水室中,其中脱水室产生干燥的含蛋白质部分,其被生产为富含蛋白质的营养补充物。
[0123]
在另一方面,该方法包括使匀浆的细胞碎片部分脱水。在这方面,破裂装置将细胞碎片部分输送到脱水室中,以准备用于进一步的下游处理。细胞碎片部分是含有高水平蛋白质含量的不溶部分。通常,这包括不溶的细胞壁或细胞膜组分。它还可能包含小浓度的核酸或蛋白质聚集体。在大多数方面,大多数核酸被释放到第一含蛋白质部分中。有时,这些蛋白质聚集体难溶解,会保留在细胞碎片部分中。确定第一含蛋白质部分和细胞碎片部分中的蛋白质含量是基于围绕总细胞质量和可溶和不溶蛋白质量的质量平衡的假设。举例来说,不溶蛋白质回收率的计算包括从总细胞质量中减去可溶蛋白质的质量以得到不溶质量的近似值。
[0124]
ii.用于处理产乙酸的生物质以产生源自发酵的蛋白质的细菌发酵系统
细菌发酵系统包括但不限于将ph调节剂输送到发酵系统中的一个或多个入口管线、细菌发酵容器、一个或多个破裂装置、一个或多个细胞分离器以及一个或多个分级器。另外,一个或多个脱水室连接至所述一个或多个破裂装置和/或所述一个或多个分级器以增加获得的含蛋白质部分的蛋白质浓度并降低其水分含量。任选地,细菌发酵系统进一步包括一个或多个用于保存细菌细胞或含细胞悬浮液的保存槽、储存室和/或预处理室。
[0125]
图3a-3b,4a-4h,5a-5e和6示出了这种示例性细菌发酵系统,其用于从使用厌氧细菌培养物的发酵过程来生产含细胞悬浮液和一种或多种含氧烃化合物。图3a是用于产生含细胞悬浮液和一种或多种含氧烃化合物的细菌发酵系统300a的示意图,其中使用了两个细胞分离器和一个脱水室。
[0126]
在图3a中,细菌发酵系统300a包括发酵容器310、细胞分离器320、细胞分离器330、处理室350和任选的脱水室375。在一个实施方案中,细菌发酵系统300a可以是连续的细菌发酵系统。或者,细菌发酵系统300a可以是分批细菌发酵系统。
[0127]
两条或更多条入口管线,例如入口管线302和入口管线304,连接到发酵容器310。入口管线302可用于将气态底物、附加补充物和/或其他固体或液体底物输送到发酵容器310中。入口管线304可用于将发酵培养基或其他培养基输送到发酵容器310中。气态底物和发酵培养基的转化在发酵容器310中进行。本文所用的发酵培养基包括常规的细菌生长培养基,其含有足以允许所选厌氧细菌生长的维生素、盐和矿物质。将维生素混合物形式的维生素添加到发酵培养基中。维生素包括b族维生素中的几种,包括但不限于硫胺素(b1)、泛酸(b5)、生物素(b7)、其他氨基酸及其组合。
[0128]
在发酵容器310内,气态底物和发酵培养基被包含在发酵容器310内的厌氧细菌发酵成发酵液肉汤,所述发酵液肉汤包含第一浓度的厌氧细菌的细胞。然后通过出口管线314从细菌发酵系统300a释放反应器气体。发酵容器310提供了用厌氧细菌发酵气态底物的环境。一方面,气态底物是由碳源底物、一氧化碳(co)、二氧化碳(co2)、氢气(h2)和合成气组成的一种或多种气体,而厌氧细菌是选自梭菌属、醋酸杆菌属及其变体的一种或多种厌氧细菌。
[0129]
发酵容器310可以包括三个或更多个出口管线,例如,出口管线314、出口管线316和出口管线312。出口管线314可用于输送气体、排放气体、要从发酵容器310中排出的多余气体。出口管线312可用于将一部分发酵液肉汤从细菌发酵系统300a输出到细胞分离器320。出口管线316可用于将一部分发酵液肉汤从细菌发酵系统300a输出到细胞分离器330。来自发酵容器310的发酵液肉汤的部分分别通过出口管线312和出口管线316输送并供应到细胞分离器320和细胞分离器330。在细胞分离器320和细胞分离器330的每一个内部,发酵液肉汤(包含第一浓度的细菌细胞)中包含的厌氧细菌的细胞被分离成无细胞渗透溶液和截留溶液(例如,含有第二浓度的厌氧细菌细胞的含细胞悬浮液)。
[0130]
出口管线322和出口332用于将无细胞渗透溶液分别从细胞分离器320和细胞分离器330输出到处理室350中。在处理室350内部,无细胞渗透溶液被处理成含氧烃化合物。处理室350还可以将蒸馏水内容物(包括水)通过出口管线354再循环回到发酵容器310。在一实例中,馏出物可主要包含水,并且还可包含其他内容物。例如,普通蒸馏水流包含95%的水,约5%的乙酸和一些其他内容物。然后,处理室350通过出口管线352送出含氧烃化合物的最终产物,用于进一步的下游处理。在一个实施方案中,处理室350是蒸馏室,其中将无细
胞渗透溶液处理并蒸馏成高质量的含氧烃化合物(例如,高浓度和/或无水形式的乙醇、丁醇,例如95%w/w或更高浓度的乙醇等)。
[0131]
通过细胞分离器320后获得的含细胞悬浮液可以通过出口管线324输送回到发酵容器310中以进行细胞再循环,使得含细胞悬浮液中的细胞可以进行进一步的发酵过程。另一方面,通过细胞分离器330后得到的含细胞悬浮液可以通过细胞分离器330浓缩,并经由出口管线336输送至脱水室375,从而破裂成混合物并干燥。脱水室375可以是烘箱干燥机、桨式干燥机、喷雾干燥装置、鼓式干燥机、冻干装置及其组合。然后将细胞分离器330中的一部分含有厌氧细菌细胞的含细胞悬浮液通过出口管线334输送回发酵容器310,以进行进一步的发酵过程。
[0132]
将含细胞悬浮液处理成富含蛋白质的补充物的一个实例是使含细胞悬浮液经历在高温处理室,例如喷雾干燥脱水室中约100摄氏度或更高的高温(例如250摄氏度或更高),以使细胞破裂并减少含细胞悬浮液的水分含量以形成糊状或粉末状。处理含细胞悬浮液的另一个实例是使含细胞悬浮液经历在低温处理室中约0摄氏度或更低的温度。
[0133]
出口管线376连接到脱水室375,以将破裂和脱水形式的含细胞悬浮液从脱水室375中输出,以准备混入富含蛋白质的补充物的组合物中。在脱水室375中进行脱水过程之后,获得富含蛋白质的营养补充物并通过出口管线376从细菌发酵系统300a中收集。
[0134]
图3b是用于产生含细胞悬浮液和一种或多种含氧烃化合物的细菌发酵系统300b的示意图,其中使用了两个细胞分离器、一个保存槽和一个脱水室。在图3b中,细菌发酵系统300b包括连接到入口管线302、入口管线304和几个出口管线的发酵容器310,连接到出口管线312、出口管线322和出口管线324的细胞分离器320,连接到出口管线316和出口管线336的细胞分离器330,以及连接到出口管线336和出口管线376的脱水室375,如上所述。
[0135]
另外,细菌发酵系统300b还包括用于保存和储存无细胞渗透溶液部分的保存槽或储存槽。例如,保存槽340(例如,无细胞渗透溶液保存槽)分别经由出口管线322和出口管线332连接至细胞分离器320和细胞分离器330。通过细胞分离器320和细胞分离器330进行细胞分离后获得的无细胞渗透溶液可以进行预处理或大量储存,以准备将保存在保存槽340中的无细胞渗透溶液处理成高质量形式的含氧烃化合物的最终产物。在一个实施方案中,无细胞渗透溶液被进一步处理以在处理室350内产生乙醇,通过出口管线342从保存槽340输送。之后,经处理的含氧烃化合物的最终产物经由出口管线352被输出处理室350,并且可以将从处理室350产生的水、乙酸、营养物和其他材料通过出口管线354再循环回到发酵容器310。
[0136]
图4a示出了细菌发酵系统400a的示意图,该系统具有将ph调节剂输送到发酵系统中的一个或多个入口管线、一个发酵容器、一个细胞分离器、一个处理室、一个破裂装置、一个分级器和两个脱水室,用于使用根据本发明的一个或多个实施方案的厌氧细菌的培养物的发酵过程并从细菌发酵获得富含蛋白质的营养补充物。细菌发酵系统400a包括入口管线402,入口管线404,入口管线406a,入口管线406b,入口管线406c,发酵容器410,出口管线412,出口管线414,细胞分离器420,出口管线422,出口管线424,处理室450,出口管线452,出口管线454,破裂装置460,出口管线462,分级器470,出口管线472,出口管线474,脱水室475a,脱水室475b,出口管线476a和出口管线476b。
[0137]
在一个实施方案中,细菌发酵系统400a可以是连续细菌发酵系统。首先,发酵培养
基流通过入口管线402被供应到细菌发酵系统400a。接下来,气态底物流通过入口管线404被供应到细菌发酵系统400a。气态底物和发酵培养基的流然后进入培养厌氧细菌的发酵容器410。发酵容器410提供了用厌氧细菌发酵气态底物的环境。气态底物和发酵培养基的转化在发酵容器410中进行。在发酵容器410内,通过包含在发酵容器内的厌氧细菌促进气态底物和发酵培养基发酵成发酵液肉汤,该发酵液肉汤含有第一浓度的厌氧细菌的细胞。然后,未反应的反应物气体释放并通过出口管线414从细菌容器410中排出。
[0138]
此外,发酵液肉汤通过出口管线412输送并供应至细胞分离器420。在细胞分离器420内,发酵液肉汤中所包含的厌氧细菌的细胞被分离成无细胞渗透溶液和第二浓度的含细胞的厌氧细菌细胞。然后,细胞分离器420中的无细胞渗透溶液通过出口管线422输送到处理室450。然后将细胞分离器420中的一定量的含有厌氧细菌细胞的含细胞悬浮液通过出口管线424输送回发酵容器410,以进行进一步的发酵过程。细胞分离器420中的另一量的含有厌氧细菌细胞的含细胞悬浮液通过出口管线426输送至破裂装置460。
[0139]
在一个实施方案中,发酵系统400a还包括连接至出口管线426的入口管线406a,用于将ph调节剂输送至发酵系统中并调节包含从细胞分离器420输出的厌氧细菌细胞的含细胞悬浮液的ph值。用ph调节剂处理细胞使细胞膜对于细菌细胞的机械破坏更具有延展性。可以在含细胞悬浮液进入破裂装置460之前进行该ph调节。或者,可以当含细胞悬浮液进入破裂装置460中时进行ph调节。或者,可以在通过破裂装置460使含细胞悬浮液破裂后进行ph调节,并用一种或多种ph调节剂处理含有厌氧细菌细胞的匀浆。
[0140]
在一个实施方案中,可以将含细胞悬浮液的ph值调节到高于含细胞悬浮液进入破裂装置460之前的发酵肉汤液体的ph值的值。在一个实施方案中,在含细胞悬浮液进入破裂装置460之前,可以将含细胞悬浮液的ph值调节至5。在另一个实施方案中,在含细胞悬浮液进入破裂装置460之前,可以将含细胞悬浮液的ph值调节至6。在另一个实施方案中,在含细胞悬浮液进入破裂装置460之前,可以将含细胞悬浮液的ph值调节至7。在另一个实施方案中,在含细胞悬浮液进入破裂装置460之前,可以将含细胞悬浮液的ph值调节至8。在另一个实施方案中,在含细胞悬浮液进入破裂装置460之前,可以将含细胞悬浮液的ph值调节至9。在另一个实施方案中,在含细胞悬浮液进入破裂装置460之前,可以将含细胞悬浮液的ph值调节至10。在另一个实施方案中,在含细胞悬浮液进入破裂装置460之前,可以将含细胞悬浮液的ph值调节至11。在另一个实施方案中,在含细胞悬浮液进入破裂装置460之前,可以将含细胞悬浮液的ph值调节至12。在另一个实施方案中,在含细胞悬浮液进入破裂装置460之前,可以将含细胞悬浮液的ph值调节至5至12之间的任何值。
[0141]
在处理室450内,无细胞渗透溶液被处理成含氧烃化合物。处理室450还将水通过出口管线454再循环回到发酵容器410。总之,处理室450通过出口管线452送出95%的乙醇用于进一步的下游处理。
[0142]
在破裂装置460内,包含在含细胞悬浮液中的厌氧细菌细胞的细胞膜破裂以产生匀浆。匀浆通过出口管线462送至分级器470。在一个方面,出口管线474连接至分级器470,分级器470输送第一含蛋白质部分以被生产为富含蛋白质的营养补充物。出口管线472连接至分级器470,分级器470允许细胞碎片部分流入另一设备以进行进一步的下游处理。在另一方面,在一个或多个分级器去除不想要的污染物和碎片后的一个或多个含蛋白质的级分一起加回并制成富含蛋白质的营养补充物。
[0143]
可在本文中使用的示例性破裂装置包括但不限于微流体装置、声处理装置、超声装置、机械破碎装置、弗氏压碎器、冷冻机、加热器、巴氏灭菌装置、热交换器、蒸馏柱、提高工艺物流和保存槽温度的装置、紫外线灭菌装置、伽马射线灭菌装置、反应器、均化器及其组合。
[0144]
破裂装置460的一个实例是引起细菌微生物的细胞膜和细胞壁的结构的不可逆改变以允许进一步操纵细菌细胞的内容物的装置。细菌细胞的内容物包括核酸、氨基酸、蛋白质、糖原、色素、脂质滴、晶体和其他营养物,例如不同形式的碳、氮、硫、钙等。
[0145]
一方面,破裂装置460通过利用高力破裂厌氧细菌细胞的细胞膜来破开细胞。高剪切力例如通过声音、压力或机械方式施加到含细胞悬浮液中的厌氧细菌细胞。在本发明中,该方法包括将包含第二浓度的厌氧细菌细胞的含细胞悬浮液送至破裂装置460。破裂装置460通过用强力(例如,机械、声音、压力)破裂细胞的细胞膜来破开细胞并产生匀浆,其中由于细菌细胞的破裂状态,更好地接近细菌细胞内的有用部分,例如蛋白质。或者,该方法包括在将匀浆输送到第一分级器之前,将匀浆输送到第二破裂装置。第二破裂装置进一步破裂匀浆的细胞,之后产生富含蛋白质的营养补充物。
[0146]
作为实例,破裂装置460是微流体装置。微流体装置包括但不限于反应室、管、泵、法兰管、环、垫圈、高压止回阀。微流体装置的反应室可以是单槽、多槽并具有微通道的陶瓷反应室、耐磨室、线轴反应室。
[0147]
作为另一个实例,破裂装置460是酶处理装置。作为又一个实例,破裂装置是超声装置。超声装置是超声探头或超声浴。超声装置通过使用高频声波来剪切细胞,以搅动和破裂细胞。作为又一个实例,破裂装置是冷冻装置。冷冻装置具有冷冻和解冻循环,其中细菌细胞进入多轮的冷冻和解冻循环,其中细胞被冷冻然后在缓冲液中解冻。作为又一个实例,破裂装置是机械破裂装置。机械破裂装置包括机械叶片或珠,以分解细菌细胞的细胞壁和/或细胞膜。
[0148]
在另一个替代实施方案中,发酵系统400a还包括连接到破裂装置460的入口管线406b,用于将ph调节剂输送到发酵系统中并调节破裂装置460内厌氧细菌细胞的ph值。在一个实施方案中,可以将含细胞悬浮液的ph值调节至高于含细胞悬浮液进入破裂装置460之前的发酵肉汤液体的ph值的值。在另一个实施方案中,在破裂装置460内,可将含细胞悬浮液的ph值调节至5至12之间的任何值。
[0149]
在另一个替代实施方案中,发酵系统400a还包括连接至出口管线462的入口管线406c,用于将ph调节剂输送至发酵系统中,并调节从含有厌氧细菌细胞的含细胞溶液破裂的匀浆的ph值。在另一个实施方案中,可以将从含有厌氧细菌细胞的含细胞溶液破裂后的匀浆的ph值调节为高于匀浆进入分级器470之前发酵肉汤液体的ph值的值。在另一个实施方案中,从含有厌氧细菌细胞的含细胞溶液破裂后的匀浆的ph值可以在匀浆进入分级器470之前调节至5。在另一个实施方案中,从含有厌氧细菌细胞的含细胞溶液破裂后的匀浆的ph值可以在匀浆进入分级器470之前调节至6。在另一个实施方案中,从含有厌氧细菌细胞的含细胞溶液破裂后的匀浆的ph值可以在匀浆进入分级器470之前调节至7。在另一个实施方案中,从含有厌氧细菌细胞的含细胞溶液破裂后的匀浆的ph值可以在匀浆进入分级器470之前调节至8。在另一个实施方案中,从含有厌氧细菌细胞的含细胞溶液破裂后的匀浆的ph值可以在匀浆进入分级器470之前调节至9。在另一个实施方案中,从含有厌氧细菌细
胞的含细胞溶液破裂后的匀浆的ph值可以在匀浆进入分级器470之前调节至10。在另一个实施方案中,从含有厌氧细菌细胞的含细胞溶液破裂后的匀浆的ph值可以在匀浆进入分级器470之前调节至11。在另一个实施方案中,从含有厌氧细菌细胞的含细胞溶液破裂后的匀浆的ph值可以在匀浆进入分级器470之前调节至12。在另一个实施方案中,从含有厌氧细菌细胞的含细胞溶液破裂后的匀浆的ph值可以在匀浆进入分级器470之前调节至5至12之间的任何值。
[0150]
可通过入口管线406a、406b和406c输送至系统中的ph调节剂包括氢氧化钠、氢氧化钾、氢氧化铵、碳酸氢盐、盐酸、硝酸、磷酸、氯化氢和可以用来提高或降低溶液的ph值的任何试剂。
[0151]
然后在分级器470内,将匀浆分级成第一含蛋白质部分和含蛋白质的细胞碎片部分。接下来,第一含蛋白质的细胞碎片部分通过出口管线472输送到脱水室475a。然后,第一含蛋白质部分通过出口管线474输送至脱水室475b。示例性的分级器包括但不限于各种类型的固液分级器、离心装置、连续离心机、倾析器离心机、圆盘堆叠式离心机、过滤装置、中空纤维过滤装置、螺旋缠绕式过滤装置、陶瓷过滤器装置、错流过滤装置、尺寸排阻装置、一个或一系列尺寸排阻柱、一个或一系列离子交换柱、一个或一系列碳聚合物柱、流通式磁性分级器、超滤装置、一个或一系列亲和色谱柱、一个或一系列凝胶过滤柱及其组合。
[0152]
在脱水室475a和脱水室475b中进行脱水过程之后,可以分别各自由脱水室475a和脱水室475b经由出口管线476a和476b获得并收集富含蛋白质的营养补充物。
[0153]
图4b示出了细菌发酵系统400b的示意图,该系统具有将ph调节剂输送到发酵系统中的一个或多个入口管线、一个发酵容器、两个细胞分离器、一个处理室、一个破裂装置、两个分级器和三个脱水室,以从细菌发酵过程中获得富含蛋白质的营养补充物。细菌发酵系统400b包括入口管线402、入口管线404、入口管线406a、入口管线406b、入口管线406c、发酵容器410、出口管线412、出口管线414、出口管线416、细胞分离器420、出口管线422、出口管线424、出口管线426、细胞分离器430、出口管线432、出口管线434、出口管线436、处理室450、出口管线452、出口管线454、破裂装置460、出口管线462、分级器470、出口管线472、出口管线474、脱水室475、出口管线476、分级器480、出口管线482、出口管线484、脱水室485a、出口管线486a、脱水室485b和出口管线486b。
[0154]
一方面,细胞分离器430是细胞浓缩器。对于本发明,该方法包括从发酵容器中收集一定量的包含第一浓度的厌氧细菌细胞的发酵液肉汤。该收集物通过将发酵容器410连接到细胞分离器430的出口管线416输送。在细胞分离器430中,将发酵液肉汤分离成无细胞渗透溶液和包含第一浓度的厌氧细菌细胞的含细胞悬浮液,并浓缩至第二浓度(例如,具有高浓度的细胞,高于发酵液肉汤的第一浓度)。无细胞渗透溶液通过连接处理室450和细胞分离器430的出口管线432被送至处理室450。包含第二浓度的细胞的含细胞悬浮液通过将破裂装置460连接至细胞分离器430的出口管线436送至破裂装置460。
[0155]
在一个实施方案中,发酵系统400b还包括连接至出口管线436的入口管线406a,用于将ph调节剂输送至发酵系统中并调节含有从细胞分离器430输出的厌氧细菌细胞的含细胞悬浮液的ph值。用ph调节剂处理细胞使细胞膜对于细菌细胞的机械破坏更具有延展性。可以在含细胞悬浮液进入破裂装置460之前进行ph调节。或者,可以在含细胞悬浮液进入破裂装置460期间进行ph调节。或者,可以在通过破裂装置460使含细胞悬浮液破裂之后进行
ph调节,并用一种或多种ph调节剂处理含有厌氧细菌细胞的匀浆。
[0156]
在一个实施方案中,可以将含细胞悬浮液的ph值调节至高于含细胞悬浮液进入破裂装置460之前的发酵肉汤液体的ph值的值。在另一实施方案中,可以在含细胞悬浮液进入破裂装置460之前将含细胞悬浮液的ph值调节至诸如5、6、7、8、9、10、11和12的值。在另一个实施方案中,可以在含细胞悬浮液进入破裂装置460之前将含细胞悬浮液的ph值调节至5至12之间的任何值。
[0157]
在另一个替代实施方案中,发酵系统400b还包括连接至破裂装置460的入口管线406b,用于将ph调节剂输送到发酵系统中并调节破裂装置460内的厌氧细菌细胞的ph值。在一个实施方案中,可以将含细胞悬浮液的ph值调节至高于含细胞悬浮液进入破裂装置460之前的发酵肉汤液体的ph值的值。在另一实施方案中,可以在破裂装置460内将含细胞悬浮液的ph值调节至诸如5、6、7、8、9、10、11和12的值。在另一个实施方案中,可以在破裂装置460内将含细胞悬浮液的ph值调节至5至12之间的任何值。
[0158]
一方面,在通过破裂装置460处理之后,将匀浆输送至分级器470以分离成含蛋白质部分和细胞碎片部分。分级器470经由出口管线462连接至破裂装置460。分级器470具有至少两个出口管线,其中出口管线472用于输送细胞碎片部分,且第二出口管线474用于输送含蛋白质部分。
[0159]
在另一个替代实施方案中,发酵系统400b还包括连接至出口管线462的入口管线406c,用于将ph调节剂输送至发酵系统中,并调节从含有厌氧细菌细胞的含细胞溶液破裂的匀浆的ph值。在一个实施方案中,可以将匀浆的ph值调节至高于匀浆进入分级器470之前发酵肉汤液体的ph值的值。在另一实施方案中,可以在匀浆进入分级器470之前将匀浆的ph值调节至诸如5、6、7、8、9、10、11和12的值。在另一实施方案中,可以在匀浆进入分级器470之前将从含有厌氧细菌细胞的含细胞溶液破裂后的匀浆的ph值调节至5至12之间的任何值。
[0160]
可通过入口管线406a、406b和406c输送到系统中的ph调节剂包括氢氧化钠、氢氧化钾、氢氧化铵、碳酸氢盐、盐酸、硝酸、磷酸、氯化氢和可以设置为升高或降低溶液的ph值的任何试剂。
[0161]
在一个方面,将第一含蛋白质部分输送至分级器480,以进一步从第一含蛋白质部分中分离出第二含蛋白质部分。分级器480经由出口474连接至分级器470。分级器480具有至少两个出口,其中细胞碎片从第一出口482流出,第二含蛋白质部分从第二出口484流出。该方法还包括从第二分级器收集第二含蛋白质部分。在另一方面,存在两个或更多个分级器。在另一方面,在用于本发明的细菌发酵系统内仅存在一个分级器,从中收集第一含蛋白质部分。示例性的分级器包括但不限于各种类型的固液分级器、离心装置、连续离心机、倾析器离心机、圆盘堆叠式离心机、过滤装置、中空纤维过滤装置、螺旋缠绕式过滤装置、陶瓷过滤器装置、错流过滤装置、尺寸排阻装置、一个或一系列尺寸排阻柱、一个或一系列离子交换柱、一个或一系列碳聚合物柱、流通式磁性分级器、超滤装置、一个或一系列亲和色谱柱、一个或一系列凝胶过滤柱及其组合。
[0162]
图4c示出了细菌发酵系统400c的示意图,其具有将ph调节剂输送到发酵系统中的一个或多个入口管线、一个发酵容器、一个细胞分离器、一个无细胞保存槽、一个处理室、一个破裂装置、一个分级器和两个脱水室,以从细菌发酵过程中获得富含蛋白质的营养补充
物。细菌发酵系统400c包括入口管线402、入口管线404、入口管线406a、入口管线406b、入口管线406c、发酵容器410、出口管线412、出口管线414、细胞分离器420、出口管线422、出口管线424、出口管线426、无细胞的保存槽440、出口管线442、出口管线444、处理室450、出口管线452、出口管线454、破裂装置460、出口管线462、分级器470、出口管线472、出口管线474、脱水室475a、出口管线476a、脱水室475b和出口管线476b。
[0163]
图4d示出了细菌发酵系统400d的示意图,其具有将ph调节剂输送到发酵系统中的一个或多个入口管线、一个发酵容器、一个细胞分离器、一个无细胞保存槽、一个处理室、一个破裂装置、两个分级器和三个脱水室,以从细菌发酵过程中获得富含蛋白质的营养补充物。细菌发酵系统400d包括入口管线402、入口管线404、入口管线406a、入口管线406b、入口管线406c、发酵容器410、出口管线412、出口管线414、细胞分离器420、出口管线422、出口管线424、出口管线426、无细胞保存槽440、出口管线442、出口管线444、处理室450、出口管线452、出口管线454、破裂装置460、出口管线462、分级器470、出口管线472、出口管线474、脱水室475、出口管线476、分级器480、出口管线482、出口管线484、脱水室485a、出口管线486a、脱水室485b和出口管线486b。
[0164]
图4e示出了细菌发酵系统400e的示意图,其具有将ph调节剂输送到发酵系统中的一个或多个入口管线、一个发酵容器、两个细胞分离器、一个无细胞保存槽、一个处理室、一个破裂装置、两个分级器和三个脱水室,以从细菌发酵过程中获得富含蛋白质的营养补充物。细菌发酵系统400e包括入口管线402、入口管线404、入口管线406a、入口管线406b、入口管线406c、发酵容器410、出口管线412、出口管线414、细胞分离器420、出口管线422、出口管线424、细胞分离器430、出口管线432、出口管线436、无细胞保存槽440、出口管线442、出口管线444、处理室450、出口管线452、出口管线454、破裂装置460、出口管线462、分级器470、出口管线472、出口管线474、脱水室475、出口管线476、分级器480、出口管线482、出口管线484、脱水室485a、出口管线486a、脱水室485b和出口管线486b。
[0165]
图4f示出了细菌发酵系统400f的示意图,其具有将ph调节剂输送到发酵系统中的一个或多个入口管线、一个发酵容器、一个细胞分离器、一个无细胞保存槽、一个处理室、一个含细胞保存槽、一个破裂装置、两个分级器和三个脱水室,以从细菌发酵过程中获得富含蛋白质的营养补充物。细菌发酵系统400f包括入口管线402、入口管线404、入口管线406a、入口管线406b、入口管线406c、入口管线406d、入口管线406e、发酵容器410、出口管线412、出口管线414、细胞分离器420、出口管线422、出口管线424、出口管线426、无细胞保存槽440、出口管线442、出口管线444、含细胞保存槽445、出口管线446、处理室450、出口管线452、出口管线454、破裂装置460、出口管线462、分级器470、出口管线472、出口管线474、脱水室475、出口管线476、分级器480、出口管线482、出口管线484、脱水室485a、出口管线486a、脱水室485b和出口管线486b。
[0166]
在一个实施方案中,发酵系统400f包括连接至出口管线426的入口管线406d,用于将ph调节剂输送至发酵系统中并调节含有从细胞分离器420输出的厌氧细菌细胞的含细胞悬浮液的ph值。用ph调节剂处理细胞使细胞膜对于细菌细胞的机械破坏更具有延展性。可以在含细胞悬浮液进入含细胞保存槽445之前进行ph调节。或者,可以在含细胞悬浮液进入含细胞保存槽445期间进行ph调节。或者,可以在含细胞悬浮液进入破裂装置460之前,在含细胞悬浮液进入破裂装置460期间,或者在含细胞悬浮液被破裂装置460破裂之后进行该ph
调节,和用一种或多种ph调节剂处理含有厌氧细菌细胞的匀浆。
[0167]
在一个实施方案中,可以将含细胞悬浮液的ph值调节到高于含细胞悬浮液进入含细胞保存槽445之前的发酵肉汤液体的ph值的值。在另一个实施方案中,可以在含细胞悬浮液进入破裂装置460之前将含细胞悬浮液的ph值调节至诸如5、6、7、8、9、10、11和12的值。在另一个实施方案中,可以在含细胞悬浮液进入破裂装置460之前将含细胞悬浮液的ph值调节至5至12之间的任何值。
[0168]
一方面,细菌发酵系统400f包括保存槽(例如,含细胞保存槽445),以容纳从细菌发酵容器送来的细菌细胞。在一个实施方案中,保存槽是储存容器,其储存从发酵容器收集的微生物生物质的厌氧细菌细胞。这缓解了对当细菌细胞从发酵容器410行进到破裂装置460中时的瓶颈问题的担忧,其中细菌细胞连续地从细菌发酵容器410收集并输送到破裂装置460而不会使破裂装置460过载。浓缩细菌细胞到破裂装置460中的输送速率可以比发酵液肉汤从细胞分离器/浓缩器的输出速率低。
[0169]
在另一个实施方案中,保存槽(例如,含细胞保存槽445)用作预处理装置,其中细菌细胞经受一种或多种添加剂以增加破裂效率。用添加剂处理细胞使细胞膜对于细菌细胞的机械破坏更有延展性。该预处理可以在含细胞悬浮液进入破裂装置460之前进行。备选地,可以在通过破裂装置460使含细胞悬浮液破裂并且用一种或多种添加剂处理含有厌氧细菌细胞的匀浆之后进行预处理。含细胞保存槽445)的实例包括但不限于处理室、槽、不锈钢槽、塑料槽等。
[0170]
在细菌发酵系统400f中,可以在含细胞保存槽445内用一种或多种添加剂对包含细胞的含细胞悬浮液进行预处理。可以通过入口管线406e将一种或多种添加剂添加到含细胞保存槽445中,添加剂例如,表面活性剂、去污剂、edta、triton x-100、tween-20、十二烷基硫酸钠、chaps、酶、蛋白酶、溶菌酶、全能核酸酶、核酸酶、核糖核酸酶(rnase)、脱氧核糖核酸酶(dnase)、水解诱导剂、ph调节剂及其组合。作为ph调节剂的添加剂的一个实例是氢氧化钠。作为ph调节剂的添加剂的另一个实例是氯化氢。
[0171]
在一个实施方案中,可以将含细胞悬浮液的ph值调节至高于含细胞悬浮液在含细胞保存槽445中之前发酵肉汤液体的ph值的值。在另一个实施方案中,可以在含细胞保存槽445内将含细胞悬浮液的ph值调节至诸如5、6、7、8、9、10、11和12的值。在另一个实施方案中,可以在含细胞保存槽445内将含细胞悬浮液的ph值调节至5至12之间的任何值。
[0172]
可通过入口管线406a、406b、406c、406d和406e输送到系统中的ph调节剂包括氢氧化钠、氢氧化钾、氢氧化铵、碳酸氢盐、盐酸、硝酸、磷酸、氯化氢和可用于提高或降低溶液ph值的任何试剂。
[0173]
一方面,预处理装置连接至细胞分离器/浓缩器(例如,细胞分离器420和/或细胞分离器430),其连接至发酵容器410。在另一方面,预处理装置直接连接到发酵容器410,其中预处理装置的部件是细胞分离器和浓缩器。预处理装置包括预处理室和入口(例如,入口管线406),以引入特定的添加剂以使细菌细胞的细胞膜对于其他破裂技术更有延展性。所使用的一种或多种添加剂的类型和所使用的破裂装置的类型可以是任何数量的组合,以增加细胞的破裂效率。
[0174]
图4g示出了细菌发酵系统400g的示意图,其具有将ph调节剂输送到发酵系统中的一个或多个入口管线、一个发酵容器、两个细胞分离器、一个无细胞保存槽、一个处理室、一
个含细胞保存槽、一个破裂装置、两个分级器和三个脱水室,以从细菌发酵过程中获得富含蛋白质的营养补充物。细菌发酵系统400g包括入口管线402、入口管线404、入口管线406a、入口管线406b、入口管线406c、入口管线406d、入口管线406e、发酵容器410、出口管线412、出口管线414、出口管线416、细胞分离器420、出口管线422、出口管线424、细胞分离器430、出口管线432、出口管线436、无细胞保存槽440、出口管线442、出口管线444、含细胞保存槽445、出口管线446、处理室450、出口管线452、出口管线454、破裂装置460、出口管线462、分级器470、出口管线472、出口管线474、脱水室475、出口管线476、分级器480、出口管线482、出口管线484、脱水室485a、出口管线486a、脱水室485b和出口管线486b。
[0175]
图4h示出了细菌发酵系统400h的示意图,其具有将ph调节剂输送到发酵系统中的一个或多个入口管线、一个发酵容器、两个细胞分离器、一个无细胞保存槽、一个处理室、一个含细胞保存槽、一个破裂装置、两个分级器和三个脱水室,以从细菌发酵过程中获得富含蛋白质的营养补充物。细菌发酵系统400h包括入口管线402、入口管线404、入口管线406a、入口管线406b、入口管线406c、入口管线406d、入口管线406e、发酵容器410、出口管线412、出口管线414、出口管线416、细胞分离器420、出口管线422、出口管线424、细胞分离器430、出口管线432、出口管线436、无细胞保存槽440、出口管线442、出口管线444、含细胞保存槽445、出口管线446、处理室450、出口管线452、出口管线454、破裂装置460、出口管线462、返回管线464、分级器470、出口管线472、出口管线474、脱水室475、出口管线476、分级器480、出口管线482、出口管线484、脱水室485a、出口管线486a、脱水室485b和出口管线486b。
[0176]
在某些实施方案中,细菌发酵系统400h还包括一个或多个循环管线。在一个实施方案中,循环管线是连接至破裂装置460的返回管线464。返回管线464从破裂装置中取出一部分产物混合物,并重新进入破裂装置460。这允许多次通过破裂装置460,其继而增加了厌氧细菌细胞的含蛋白质匀浆的破裂量和蛋白质浓度,并确保了细菌细胞内蛋白质化合物的充分可及性以进行进一步处理。
[0177]
图5a示出了细菌发酵系统500a的示意图,其具有将ph调节剂输送到发酵系统中的一个或多个入口管线、一个发酵容器、一个细胞分离器、一个处理室、一个含细胞保存槽、一个破裂装置、一个分级器和两个脱水室,以从细菌发酵过程中获得富含蛋白质的营养补充物。细菌发酵系统500a包括入口管线502、入口管线504、入口管线506a、入口管线506b、入口管线506c、入口管线506d、入口管线506e、发酵容器510、出口管线512、出口管线514、细胞分离器520、出口管线522、出口管线524、出口管线526、处理室550、出口管线552、出口管线554、含细胞保存槽545、入口管线506、出口管线542、混合器548、破裂装置560、出口管线562、出口管线564、分级器570、出口管线572、出口管线574、脱水室575a、出口管线576a、脱水室575b和出口管线576b。
[0178]
在细胞分离器520中,来自发酵容器510的发酵液肉汤被分离成无细胞渗透溶液和含有第二浓度的厌氧细菌细胞的含细胞悬浮液。无细胞渗透溶液通过连接处理室550和细胞分离器520的出口管线522被送至处理室550。包含第二浓度的厌氧细菌细胞的含细胞悬浮液通过将含细胞保存槽545与细胞分离器520连接的出口526被送至含细胞保存槽545。
[0179]
输送匀浆的破裂装置560连接至分级器570。在分级器570中,方法500a包括将含细胞悬浮液分离成第一含蛋白质部分和细胞碎片部分。分级器570经由出口562连接至破裂装置560。分级器570具有至少两个出口,其中细胞碎片从第一出口574流出,而第一含蛋白质
部分从第二出口572流出。所使用的分级器的类型包括但不限于各种类型的固液分级器、离心装置、连续离心机、倾析器离心机、圆盘堆叠式离心机、过滤装置、中空纤维过滤装置、螺旋缠绕式过滤装置、陶瓷过滤器装置、错流过滤装置、尺寸排阻装置、一个或一系列尺寸排阻柱、一个或一系列离子交换柱、一个或一系列碳聚合物柱、流通式磁性分级器、超滤装置、一个或一系列亲和色谱柱、一个或一系列凝胶过滤柱及其组合。
[0180]
在一个实例中,细菌发酵系统500a还包括用作预处理室的含细胞保存槽545。含有厌氧细菌细胞的含细胞悬浮液在含细胞保存槽545中用一种或多种添加剂处理。含细胞保存槽545连接到入口管线506e,该入口管线506e供应一种或多种添加剂(例如,去污剂、酶、缓冲剂、ph调节剂等)。入口506e通常是关闭的,并且可以在需要时打开。含细胞保存槽545保存含有厌氧细菌细胞的含细胞悬浮液,直到细胞达到高细胞密度(高浓度),并且可以用于将特定量的含细胞悬浮液定时输送至破裂装置560。
[0181]
含细胞保存槽545内的混合器548是搅拌装置,例如内部具有螺旋桨的搅拌装置。破裂装置560经由出口管线542连接至含细胞保存槽545。破裂装置560产生厌氧细菌细胞的匀浆。在含细胞保存槽545内的特定持续时间之后,将含细胞悬浮液输送至破裂装置560。
[0182]
一方面,分级器570连接到一个或多个脱水室(例如,脱水室575a,575b),该脱水室接收一个或多个含蛋白质部分并干燥它们。使用的干燥技术包括干燥、喷雾干燥、冻干等。然后将含蛋白质部分进一步处理并混入富含蛋白质的营养补充物中。含蛋白质部分的蛋白质含量可以为富含蛋白质的营养补充物的10%或更高(例如在10%至80%之间或在50%至95%之间)。
[0183]
在一个实施方案中,发酵系统500a包括连接到出口管线526的入口管线506d,用于将ph调节剂输送到发酵系统中并调节包含从细胞分离器520输出的厌氧细菌细胞的含细胞悬浮液的ph值。用ph调节剂处理细胞使细胞膜对于细菌细胞的机械破坏更具有延展性。可以在含细胞悬浮液进入含细胞保存槽545之前进行ph调节。或者,可以在含细胞悬浮液通过入口管线506e进入含细胞保存槽545期间进行ph调节。或者,可以在含细胞悬浮液通过入口管线506a进入破裂装置560之前,在含细胞悬浮液通过入口管线506b进入破裂装置560期间,或在含细胞悬浮液经由入口管线506c由破裂装置560破裂之后进行ph调节,并且用一种或多种ph调节剂处理含有厌氧细菌细胞的匀浆。
[0184]
可通过入口管线506a、506b、506c、506d和506e输送到系统中的ph调节剂包括氢氧化钠、氢氧化钾、氢氧化铵、碳酸氢盐、盐酸、硝酸、磷酸、氯化氢以及可用于提高或降低溶液ph值的任何试剂。
[0185]
图5b示出了细菌发酵系统500b的示意图,其具有将ph调节剂输送到发酵系统中的一个或多个入口管线、一个发酵容器、一个细胞分离器、一个处理室、一个破裂装置、一个含细胞保存槽、一个分级器和两个脱水室,以从细菌发酵过程中获得富含蛋白质的营养补充物。细菌发酵系统500b包括入口管线502、入口管线504、入口管线506a、入口管线506b、入口管线506c、入口管线506d、入口管线506e、发酵容器510、出口管线512、出口管线514、细胞分离器520、出口管线522、出口管线524、出口管线526、处理室550、出口管线552、出口管线554、含细胞保存槽545、入口管线506、出口管线542、混合器548、破裂装置560、出口管线562、出口管线564、分级器580、出口管线582、出口管线584、脱水室585a、出口管线586a、脱水室585b和出口管线586b。
[0186]
图5c示出了细菌发酵系统500c的示意图,其具有将ph调节剂输送到发酵系统中的一个或多个入口管线、一个发酵容器、一个细胞分离器、一个处理室、一个含细胞保存槽、一个破裂装置、两个分级器和三个脱水室,以从细菌发酵过程中获得富含蛋白质的营养补充物。细菌发酵系统500c包括入口管线502、入口管线504、入口管线506a、入口管线506b、入口管线506c、入口管线506d、入口管线506e、发酵容器510、出口管线512、出口管线514、细胞分离器520、出口管线522、出口管线524、出口管线526、处理室550、出口管线552、出口管线554、含细胞保存槽545、入口管线506、混合器548、出口管线542、破裂装置560、出口管线562、出口管线564、分级器570、出口管线572、出口管线574、脱水室575、出口管线576、分级器590、出口管线592、出口管线594、脱水室595a、出口管线596a、脱水室595b和出口管线596b。
[0187]
图5d示出了细菌发酵系统500d的示意图,其具有将ph调节剂输送到发酵系统中的一个或多个入口管线、一个发酵容器、一个细胞分离器、一个处理室、一个破裂装置、两个分级器和四个脱水室,以从细菌发酵过程中获得富含蛋白质的营养补充物。细菌发酵系统500d包括入口管线502、入口管线504、入口管线506a、入口管线506b、入口管线506c、发酵容器510、出口管线512、出口管线514、细胞分离器520、出口管线522、出口管线524、出口管线526、处理室550、出口管线552、出口管线554、破裂装置560、出口管线562、出口管线564、分级器570、出口管线572、出口管线574、分级器570、出口管线592a、出口管线594a、分级器590、出口管线592b、出口管线594b、脱水室595a、出口管线596a、脱水室595b、出口管线596b、脱水室595c、出口管线596c、脱水室595d和出口管线596d。一方面,破裂装置560具有允许多次通过破裂装置560的再循环流管线(例如,出口管线564)。
[0188]
图5e示出了细菌发酵系统500e的示意图,其具有将ph调节剂输送到发酵系统中的一个或多个入口管线、一个发酵容器、两个细胞分离器、一个处理室、一个含细胞保存槽、一个破裂装置、两个分级器和三个脱水室,以从细菌发酵过程中获得富含蛋白质的营养补充物。细菌发酵系统500e包括入口管线502、入口管线504、入口管线506a、入口管线506b、入口管线506c、入口管线506d、入口管线506e、发酵容器510、出口管线512、出口管线514、出口管线516、细胞分离器520、出口管线522、出口管线524、处理室550、出口管线552、出口管线544、细胞分离器530、出口管线532、出口管线534、出口管线536、含细胞保存槽545、入口管线506、出口管线542、混合器548、破裂装置560、出口管线562、分级器570、出口管线572、出口管线574、脱水室575、出口管线576、分级器580、出口管线582、出口管线584、脱水室585a、出口管线586a、脱水室585b和出口管线586b。
[0189]
图6示出了细菌发酵系统600的示意图,其具有将ph调节剂输送到发酵系统中的一个或多个入口管线、一个发酵容器、两个细胞分离器、一个无细胞保存槽、一个处理室、一个含细胞保存槽、一个破裂装置、两个分级器和两个脱水室,以从细菌发酵过程中获得富含蛋白质的营养补充物。细菌发酵系统600包括入口管线602、入口管线604、入口管线606a、入口管线606b、入口管线606c、入口管线606d、入口管线606e、发酵容器610、出口管线612、出口管线614、出口管线616、细胞分离器620、出口管线622、出口管线624、无细胞保存槽640、出口管线642、出口管线644、处理室650、出口管线652、出口管线654、细胞分离器630、出口管线632、出口管线636、含细胞保存槽645、入口管线606、出口管线646、破裂装置660、出口管线662、分级器670、出口管线672、出口管线674、脱水室675、出口管线676、分级器690、入口
管线692、出口管线694、脱水室695和出口管线696。
[0190]
在一个实施方案中,发酵系统600包括连接至出口管线636的入口管线606d,用于将ph调节剂输送至发酵系统中并调节包含从细胞分离器620输出的厌氧细菌细胞的含细胞悬浮液的ph值。用ph调节剂处理细胞使细胞膜对于细菌细胞的机械破坏更具有延展性。可以在含细胞悬浮液进入含细胞保存槽645之前进行ph调节。或者,可以在含细胞悬浮液通过入口管线606e进入含细胞保存槽645期间进行ph调节。或者,可以在含细胞悬浮液通过入口管线606a进入破裂装置660之前,在含细胞悬浮液通过入口管线606b进入破裂装置660期间,或在含细胞悬浮液经由入口管线606c由破裂装置660破裂之后进行ph调节,并且用一种或多种ph调节剂处理含有厌氧细菌细胞的匀浆。
[0191]
可通过入口管线606a、606b、606c、606d和606e输送到系统中的ph调节剂包括氢氧化钠、氢氧化钾、氢氧化铵、碳酸氢盐、盐酸、硝酸、磷酸、氯化氢以及可用于提高或降低溶液ph值的任何试剂。
[0192]
在一个实施方案中,存在一个破裂装置,其是微流体装置,其中细胞进入破裂装置并在反应室中经受高剪切力以分解厌氧细菌的细胞壁和细胞膜。然后,通过离心、过滤、将厌氧细菌细胞脱水的各种方法(例如、干燥、冷冻干燥、冻干等)、共混、去除重金属离子、作为营养补充物掺入可摄入的物质或其组合,进一步处理破裂的细菌细胞。
[0193]
在另一个实施方案中,细菌发酵系统具有两个或更多个破裂装置。第一破裂装置也可以是将细菌细胞保存在已从发酵液中分离的含细胞悬浮液中的保存槽或储存容器。存在第一破裂装置,其为预处理装置,其中含细胞悬浮液进入第一破裂装置并用添加剂处理以提高破裂效率。所使用的添加剂包括但不限于一种或多种去污剂、酶、化学物质或其组合。存在第二破裂装置,其是微流体装置,其中细胞进入第二破裂装置并在反应室中经受高剪切力。迫使含细胞悬浮液通过微通道,该通道导致细菌细胞的细胞壁和细胞膜破裂并破开,其中细菌细胞的内容物在整个发酵液中变为自由漂浮。这允许收集第一蛋白质回收物,可以通过离心、过滤、脱水等对其进行进一步操作。
[0194]
iii.包含源自发酵的蛋白质的营养补充物的组成从本文所述的细菌发酵系统中回收的一个或多个含蛋白质部分可以经历与原料组合物直接混合、干燥、沉降、过滤、超滤、微滤、真空过滤、离心、顺序离心、冷冻干燥、冷冻、水解以及它们的组合,以产生并获得更纯形式的蛋白质和更高的蛋白质浓度。在微生物生物质被水解的方面,可通过热处理、酸水解、酶水解、碱水解及其组合来进行水解。
[0195]
在该方法的一个实施方案中,第一含蛋白质部分被生产为富含蛋白质的营养补充物。所述第一含蛋白质部分的蛋白质含量为60%至80%。在另一方面,第一含蛋白质部分的蛋白质含量为40%至60%。在另一方面,第一含蛋白质部分的蛋白质含量在10%至40%之间。
[0196]
在一个实施方案中,本发明提供了组合物,其是富含蛋白质的营养补充物。该组合物是通过使用产乙酸细菌培养物的发酵过程产生的。该组合物包含与匀浆的细胞碎片部分分离的含蛋白质部分,其中匀浆通过破裂含产乙酸细菌培养物细胞的含细胞悬浮液而获得,其中含细胞悬浮液是从在使用产乙酸的细菌培养物的气态底物发酵过程中从发酵容器中输出的发酵液获得的。
[0197]
一方面,产乙酸细菌培养物选自梭菌、醋酸杆菌及其组合。发酵的气态底物包括一
种或多种选自碳源底物、一氧化碳(co)、二氧化碳(co2)、氢气(h2)、合成气及其组合的气体。
[0198]
在另一方面,组合物的含蛋白质部分包含占组合物的约10%至约80%的蛋白质含量,占组合物的约5%至约35%的碳水化合物含量和占组合物的约5%至约15%的核酸含量。含蛋白质部分中的蛋白质含量大于含蛋白质部分中的碳水化合物含量。在另一方面,核酸含量不超过组合物的2%。这是人类和动物均可摄入的组合物。
[0199]
在另一个实施方案中,富含蛋白质的营养补充物的组合物包含纯化的蛋白质产物,其与匀浆的第一量的含蛋白质部分和第二量的细胞碎片部分分离,其中匀浆是通过破裂包含产乙酸细菌培养物细胞的含细胞悬浮液获得的,且其中所述含细胞悬浮液得自使用产乙酸细菌培养物的气态底物发酵过程中从发酵容器中输出的发酵液。细胞碎片部分包括厌氧细菌细胞的细胞壁微粒、细胞膜微粒、蛋白质聚集体、包涵体、核酸和其他成分。从发酵容器中输出的发酵液肉汤被分离成无细胞渗透溶液和含有产乙酸细菌培养物细胞的含细胞悬浮液。一方面,部分纯化的蛋白质产物的核酸含量不超过2%。在另一方面,核酸含量不超过8%至12%。
[0200]
一方面,所述组合物包括的蛋白质含量为所述组合物的约10%至约80%,碳水化合物含量为所述组合物的约5%至约35%,且核酸含量为所述组合物的约5%至约15%。含蛋白质部分中的蛋白质含量大于含蛋白质部分中的碳水化合物含量。
[0201]
在另一方面,所述组合物包括的蛋白质含量为所述组合物的约10%至约80%,碳水化合物含量为所述组合物的约5%至约35%,且核酸含量不超过所述组合物的2%。
[0202]
在又一个实施方案中,当从细菌发酵容器中移出时,按干重计,原料组合物提供约220kcal或更多每100克产乙酸生物质,并且可包含约15克或更多碳水化合物每100克产乙酸生物质。在这方面,原料具有的碳水化合物与蛋白质的重量比为约1.0或更小。在另一方面,以干重计,原料包括约18mg或更多的钙每100克产乙酸生物质,约150mg或更多的铁每100克细胞团,约25mg或更多的钠每100克产乙酸生物质,约1200mg或更多的钾每100克生物质或它们的组合。原料组合物包括必需和非必需氨基酸。原料组合物还可包含核苷酸。
[0203]
一方面,原料组合物提供的蛋白质含量为约60克或更多每100克产乙酸生物质,另一方面,为约60至约90克每100克产乙酸生物质,在另一方面,为约65至约85克每100克产乙酸生物质,在另一方面,为约70至约80克每100克产乙酸生物质,均以干重计。
[0204]
在另一方面,原料组合物提供约220kcal或更多每100克干燥的产乙酸生物质,在另一方面,约220kcal至约400kcal,在另一方面,约250kcal至约350kcal,在另一方面,约300kcal至约325kcal,在另一方面,约220kcal至约300kcal。
[0205]
在另一方面,原料组合物提供约15克或更多的碳水化合物每100克干燥的产乙酸生物质,在另一方面,约15克至约60克,在另一方面,约20至约40克,在另一方面,约25至约35克,在另一方面,约30至约35克。在这个方面,原料包括的碳水化合物与蛋白质的重量比为约1.0或更小,在另一方面,为约0.75或更小,在另一方面,为0.5或更小,在另一方面,为约0.25或更小,并且另一方面,为0.1或更小。一方面,原料没有可检测的碳水化合物,仅包含蛋白质。在另一方面,碳水化合物可包括乙醇和/或水溶性糖。
[0206]
原料组合物还可包含纤维。纤维可以包括酸性去污剂纤维、中性去污剂纤维、可消化纤维和/或难消化纤维。原料组合物还可包含淀粉。在又一方面,原料组合物包含以下量的钙、铁、钠和钾(均以每100克产乙酸生物质的mg表示,以干重计):钙:约18mg或更多,在另
一方面,约20mg或更多,在另一方面,约25mg或更多,并且在另一方面,约30mg或更多;铁:约150mg或更多,在另一方面,约175mg或更多,在另一方面,约200mg或更多,并且在另一方面,约225mg或更多;钠:约25mg或更多,在另一方面,约30mg或更多,在另一方面,约35mg或更多,在另一方面,约40mg或更多;钾:约1200mg或更多,在另一方面,约1300mg或更多,在另一方面,约1400mg或更多,并且在另一方面,约1500mg或更多。
[0207]
一方面,原料组合物可包含微量的金属。在替代方面,原料可包括一定水平的某些所需金属。原料中可能存在或可能不存在的金属的实例包括锌、钼、镉、钪、钛、钒、铬、锰、铁、钴、镍、铜、钨和硒。
[0208]
另一方面,产乙酸生物质可以包括以下任何一种氨基酸,无论是单独还是以任何组合形式(以干重计,以每100克产乙酸生物质的克数表示):必需氨基酸含量:精氨酸:一方面,约2.5克或更多,另一方面,约3.0克或更多,另一方面,约3.5克或更多,另一方面,约4.0克或更多,另一方面,约4.5克或更多,另一方面,约5.0克或更多,另一方面,约6.0克或更多,并且另一方面,约7.0克或更多;组氨酸:一方面,约1.5克或更多,另一方面,约2.0克或更多,另一方面,约2.5克或更多,另一方面,约3.0克或更多,另一方面,约3.5克或更多,另一方面,约4.0克或更多,另一方面,约5.0克或更多,并且另一方面,约6.0克或更多;异亮氨酸:一方面,约4.0克或更多,另一方面,约4.5克或更多,另一方面,约5.0克或更多,另一方面,约5.5克或更多,另一方面,约6.0克或更多,另一方面,约7.0克或更多;另一方面,约8.0克或更多;和另一方面,约9.0克或更多;亮氨酸:一方面,约4.5克或更多,另一方面,约5.0克或更多,另一方面,约5.5克或更多,另一方面,约6.0克或更多,另一方面,约6.5克或更多,另一方面,约7.0克或更多,另一方面,约8.0克或更多,和另一方面,约9.0克或更多;赖氨酸:一方面,约6.0克或更多,另一方面,约6.5克或更多,另一方面,约7.0克或更多,另一方面,约7.5克或更多,另一方面,约8.0克或更多,另一方面,约9.0克或更多,另一方面,约10.0克或更多,另一方面,约12.0克或更多;蛋氨酸:一方面,约1.5克或更多,另一方面,约2.0克或更多,另一方面,约2.5克或更多,另一方面,约3.0克或更多,另一方面,约3.5克或更多,另一方面,约4.0克或更多,另一方面,约5.0克或更多,并且另一方面,约6.0克或更多;苯丙氨酸:一方面,约2.5克或更多,另一方面,约3.0克或更多,另一方面,约3.5克或更多,另一方面,约4.0克或更多,另一方面,约4.5克或更多,另一方面,约5.0克或更多,另一方面,约5.5克或更多,以及另一方面,约6.0克或更多;苏氨酸:一方面,约3.0克或更多,另一方面,约3.5克或更多,另一方面,约4.0克或更多,另一方面,约4.5克或更多,另一方面,约5.0克或更多,另一方面,约6.0克或更多,另一方面,约7.0克或更多,以及另一方面,约8.0克或更多;色氨酸:一方面,约0.4克或更多,另一方面,约0.5克或更多,另一方面,约0.6克或更多,另一方面,约0.7克或更多,另一方面,约0.8克或更多,另一方面,约0.9克或更多,另一方面,约1.0克或更多,另一方面,约1.5克或更多;缬氨酸:一方面,约4.0克或更多,另一方面,约4.5克或更多,另一方面,约5.0克或更多,另一方面,约5.5克或更多,另一方面,约6.0克或更多,另一方面,约7.0克或更多,另一方面,约8.0克或更多,并且另一方面,约9.0克或更多。
[0209]
其他氨基酸含量:丙氨酸:一方面,约5.0克或更多,另一方面,约5.5克或更多,另一方面,约6.0克或更多,另一方面,约7.0克或更多,另一方面,约8.0克或更多,另一方面,约9.0克或更多,另一方面,约10.0克或更多,另一方面,约11.0克或更多;天冬氨酸:一方
面,约7.0克或更多,另一方面,约7.5克或更多,另一方面,约8.0克或更多,另一方面,约9.0克或更多,另一方面,约10.0克或更多,另一方面,约11.0克或更多,另一方面,约12.0克或更多,并且另一方面,约14.0克或更多;半胱氨酸:一方面,约1.0克或更多,另一方面,约1.5克或更多,另一方面,约2.0克或更多,另一方面,约2.5克或更多,另一方面,约3.0克或更多,另一方面,约3.5克或更多,另一方面,约4.0克或更多,另一方面,约5.0克或更多;谷氨酸:一方面,约9.0克或更多,另一方面,约9.5克或更多,另一方面,约10.0克或更多,另一方面,约12.0克或更多,另一方面,约14.0克或更多,另一方面,约16.0克或更多,另一方面,约18.0克或更多,另一方面,约20.0克或更多;甘氨酸:一方面,约3.0克或更多,另一方面,约3.5克或更多,另一方面,约4.0克或更多,另一方面,约4.5克或更多,另一方面,约5.0克或更多,另一方面,约5.5克或更多,另一方面,约6.0克或更多,另一方面,约7.0克或更多;蛋氨酸:一方面,约1.5克或更多,另一方面,约2.0克或更多,另一方面,约2.5克或更多,另一方面,约3.0克或更多,另一方面,约3.5克或更多,另一方面,约4.0克或更多,另一方面,约5.0克或更多,以及另一方面,约6.0克或更多;脯氨酸:一方面,约2.0克或更多,另一方面,约2.5克或更多,另一方面,约3.0克或更多,另一方面,约3.5克或更多,另一方面,约4.0克或更多,另一方面,约4.5克或更多,另一方面,约6.0克或更多,另一方面,约7.0克或更多;丝氨酸:一方面,约2.5克或更多,另一方面,约3.0克或更多,另一方面,约3.5克或更多,另一方面,约4.0克或更多,另一方面,约4.5克或更多,另一方面,约5.0克或更多,另一方面,约5.5克或更多,另一方面,约6.0克或更多;酪氨酸:一方面,约2.5克或更多,另一方面,约3.0克或更多,另一方面,约3.5克或更多,另一方面,约4.0克或更多,另一方面,约4.5克或更多,另一方面,约5.0克或更多,另一方面,约5.5克或更多,另一方面,约6.0克或更多。
[0210]
在一实施方案中,原料组合物可用作动物饲料中的原料。在又一个实施方案中,原料组合物可以用作水产养殖中的原料。在又一个实施方案中,原料组合物可以被进一步处理并用作动物和人类均可摄入的营养补充物。
[0211]
一方面,本发明的组合物为细菌发酵过程提供了有效量的营养物。在这方面,“有效量”描述了用于促进健康的发酵过程的用途,所述发酵过程可以包括以下中的至少一种:以约1g或更多的总醇/(l
·
天)的sty生产总醇;提供约2.0克/升或更高的细胞密度;并保持培养物处于稳态。细菌发酵过程可以是含co的气态底物的发酵,并且可以是原料最初源自的相同的细菌发酵过程。
[0212]
在另一方面,本发明的组合物为动物提供有效量的营养。“有效量”描述了用于促进动物健康生长的用途,其量足以促进以下中的至少一种:抑制动物中的细菌负荷;预防或减少家禽坏死性肠炎的发生;刺激动物的免疫反应;提高以饲料或其他方式向动物施用的抗生素和疫苗的有效性;每单位施用的饲料量增加的生长率;乳产量增加;死亡率的降低;等。在确定有效量时,可以考虑几个因素,包括但不限于诸如动物的年龄、活动水平、激素平衡和总体健康状况等因素,所述有效量是根据动物调节的,例如,通过从低剂量开始,逐渐增加剂量以确定有效量。
[0213]
可以通过摄入本发明的组合物而受益的动物包括,例如,禽类,例如鸡,鸭,鹅,火鸡,鹌鹑,野母鸡(game hen)等;牛和奶牛,猪,山羊等;家养动物,例如狗和猫;水生动物,例如鲑鱼,鲑科,鳟鱼,罗非鱼,虾,龙虾等;还有人类。富含蛋白质的营养补充物的用途包括给牛、猪、家禽和鱼增肥。本组合物的其他用途包括用作乳化助剂,以提高多种消费品的营养
价值,这些消费品包括烘焙品、汤、预包装膳食、智能食品和减肥食品。其他用途还包括纸张处理、皮革处理和泡沫稳定化。
[0214]
实施例:实施例1:连续的细菌发酵过程将含有co和/或co2/h2的合成气或废气连续引入到搅拌釜式生物反应器中,该生物反应器中含有俊达氏梭菌菌株以及含有维生素、微量金属和盐的发酵培养基。下表1报道了所使用的合适的发酵培养基。
[0215]
在使用10%或更少的培养接种物的方法启动期间,反应器以间歇液相运行,其中发酵培养基不是连续供入反应器中。因此,反应器中的液相由具有标称浓度的一种或多种限制性营养物例如泛酸钙、钴的发酵培养基批次组成。或者,也可以使用含有酵母提取物、胰蛋白酶解酪蛋白或其他复杂营养物的丰富培养基。
[0216]
理想地,启动时的气相不含co2且包含过量的h2。将气体速率和搅拌速率保持在低水平(在new brunswick scientific bioflo
®
发酵生物反应器中小于500rpm),以产生稍微过量的co和h2,但同时避免co底物抑制。在一升的实验室new brunswick scientific bioflo
®
发酵生物反应器中,作为实例,其中进料气体组成为63%h2、32%co和5%ch4,开启
启动的搅拌速率为400rpm,气体速率为20毫升/分钟。为了在启动过程中产生乙醇,h2和液体营养物都过量。对发酵培养基中某些营养物的限制在以后发生。因此,在启动过程中实际上存在过量的液体营养物(例如泛酸钙、钴),以避免不想要的对于低营养物的培养适应。
[0217]
随着细菌发酵在接种后数小时内进行,co的转化产生了co2,h2与co2一起被消耗,这是名义上提高搅拌速率以避免气体传质限制的信号。在new brunswick scientific bioflo
®ꢀ
cstr中,出口气体为25%co、67%h2、2%co2和6%ch4。如果搅拌速率过快地增加,则会发生co底物抑制,如增加搅拌后甲烷浓度的降低所证明的。因此,搅拌速率通常可在24小时内增加200rpm。
[0218]
在名义上增加搅拌速率的同时监测co2产生(或h2转化)的过程以相对较快的速率发生,直到达到目标搅拌速率。new brunswick scientific bioflo
®
发酵生物反应器的典型目标搅拌速率为900rpm。在分批液体培养中增加搅拌速率的这段时间内,监测细胞产量优先于促使产物形成。因此,获得约1.5g/l的细胞浓度,而典型的产物浓度是来自分批培养的10g/l乙醇和2g/l乙酸盐。
[0219]
一旦达到目标搅拌速率,系统就被允许增长到最大的h2吸收量。期望具有非常高的h2出口浓度(通常>60%)以确保乙醇生产同时限制乙酸的生产。然后打开液体发酵培养基的进料(对于具有来自原种培养的批量接种的系统)以启动连续的液体进料,并且气体进料速率朝目标流速增加。在实验室new brunswick scientific bioflo
®
发酵生物反应器中,液体进料速率通常为0.5ml/min,而气体流速朝向125ml/min的目标速率每24小时增加10%至15%。
[0220]
随着气体流速的增加,细胞产量增加,直到反应器最终受限于液相营养物(例如泛酸钙、钴),如通过目标生产率下h2转化率的小幅下降证明的。在new brunswick scientific bioflo
®ꢀ
cstr中,在20g/l
·
天的目标生产率下,h2转化率降低了10%,认同了这一点。
[0221]
然后将生产方法和细菌发酵反应器系统保持在稳态,以产生15至35g/l的乙醇和0至5g/l的乙酸盐为产物,仅偶尔少量调整限制营养物、液体速率和气体速率。在不进行细胞再循环的实验室new brunswick scientific bioflo
®
发酵生物反应器中,典型的稳态条件是气体保留时间(气体流速/反应器液体体积)为20分钟,液体保留时间(液体流速/反应器液体体积)为30小时,搅拌速率为900rpm,产生92%的co转化率和60%的h2转化率,具有泛酸盐限制。
[0222]
在一个实施方案中,此时将细胞再循环与气体速率(增加)和第一营养物浓度(减少)的调节一起添加至反应器系统。在new brunswick scientific bioflo
®ꢀ
cstr中进行细胞再循环的情况下,气体保留时间通常为8分钟,液体保留时间为12小时,细胞保留时间为40小时,搅拌速率为900rpm。这些条件通常产生92%的co转化率和50%的h2转化率,具有泛酸盐限制。这种连续发酵的方法允许在稳定的操作条件下以低的副产物乙酸盐浓度连续生产和维持高乙醇浓度,从而在工业规模上促进主题细菌用于乙醇生产。
[0223]
实施例2:从发酵容器中清除细菌细胞以控制发酵产物的比率气态底物(30% co, 15% h2, 10% co2, 45% n2)发酵发生在cstr(ph=5.0, 温度=38℃, 压力=20 psig)中,其利用俊达氏梭菌菌株c-01,具有细胞再循环(细胞保留时间=40小时,液体保留时间=6小时),并且培养物的生长不受钴、泛酸钙或任何其他营养物限制。随着培
养物的生长,达到细胞密度,使得比摄入(每克干燥细胞每分钟的mmol co)低于0.5,且乙酸优先于乙醇产生。为防止这种情况的发生,提高细胞清除速率以防止细胞密度增加,以使细胞的稳定浓度保持足够低,以保持比摄入高于0.5mmol co每克干燥细胞每分钟。这样,细胞保留时间减少到6至25小时。关于监测俊达氏梭菌菌株细菌发酵过程中的细胞浓度,参见表2。
[0224]
实施例3:产乙酸细菌细胞的细胞生物质分析在生物反应器中用合成气生长俊达氏梭菌c-01。根据以下表3中的程序分析了来自生物反应器的发酵物和生物质细胞的浓缩干物质的样品。
[0225]
表4中显示了细胞生物质的浓缩干物质的分析结果。
[0226]
下表5中显示了细胞生物质浓缩干物质的氨基酸分析结果。
[0227]
实施例4:产乙酸细菌细胞的蛋白质、碳水化合物和核酸含量的分析在生物反应器中用合成气生长俊达氏梭菌c-01。将细胞培养物以4,000 rpm离心以除去培养基。收集沉淀并使其在100℃的烘箱中干燥过夜。使用与实施例3中所述相同的碳水化合物和蛋白质测试,将100克粉碎的干燥沉淀物送去分析。表6指出,细胞质量的多达80%是蛋白质。
[0228]
实施例5:通过一个或多个微流化破裂装置对细菌细胞进行的破裂,以及通过该微流化破裂装置对细菌细胞进行破裂的蛋白质回收率microfluidics的微流化器被确定为破裂装置,使发酵过程的厌氧细菌细胞破裂并产生含蛋白质部分。从发酵容器中获得一定体积的发酵液。通过离心将样品浓缩1.5倍,或达到例如约20g/l或更大的细胞浓度。例如,从发酵容器获得约15g/l的发酵液,并且通过离心浓缩样品以获得22.4g/l或更高的细胞密度。
[0229]
将所得的细胞重悬于溶液中(例如,悬浮于可能包含约44g细胞的2l溶液中),并送至microfluidics。微流化过程涉及用通过在高压下迫使细胞通过microfluidics反应室内的微通道而产生的高剪切力使细胞破裂。
[0230]
每个样品在不同的时间量和不同的压力下运行。一次或多次通过的测试压力范围为10,000到30,000磅/平方英寸(psi)。每次通过都构成了通过微流化器的运行。通过破裂装置以恒定的速率提供压力。微流化器产生了六个均质的样品。可以用一种或多种添加剂(例如去污剂、酶等)处理含细胞悬浮液,并使其通过微流化器(例如在高剪切或3,000psi或更高的压力下)。
[0231]
进行了几次实验。每个样品在不同的时间量和不同的压力下运行。其中,示出了六个示例性样品处理实验的条件:(1)在18,000psi下单次通过;(2)在18,000psi下2次通过;(3)在23,000psi下单次通过;(4)在23,000psi下2次通过;(5)在28,000psi下单次通过;(6)在28,000psi下2次通过。每次通过均构成通过微流化器的实验。通过破裂装置以恒定的速率提供压力。用微流化器处理后,生成了所得的六个均质的含蛋白质级分的样品。使用bradford测定法分析每个含蛋白质级分的样品的蛋白质含量。
[0232]
在一个实验中,仅通过微流化器一次,处理了一些样品。一次通过之后,从匀浆中分离出第一含蛋白质部分。然后,可以将第一含蛋白质部分喷雾干燥以获得含蛋白质的粉末。
[0233]
在第二个实验中,样品通过微流化器两次而进行处理,其中经过预处理的含细胞悬浮液流过再循环流,以第二次再次进入微流化器。两次通过之后,获得了含蛋白质部分。然后,可以获得含蛋白质部分的粉末形式。例如,在获得含蛋白质部分之后,测试了三种不同的干燥技术(高温干燥、喷雾干燥和冻干)。
[0234]
实施例6:通过一个或多个过滤型分级器装置分级破裂的细菌细胞的匀浆。
[0235]
通过尼龙过滤器过滤实施例5的处理过程之后的含蛋白质部分的匀浆。匀浆的过滤允许将原始微生物生物质的5-15%作为可溶性蛋白质回收,如表7所示。
[0236]
实施例7:通过一个或多个离心型分级器装置分级破裂的细菌细胞的匀浆将实施例4的匀浆以2,000至10,000rpm之间的速率离心6分钟,并使用bradford蛋白质测定法分析蛋白质含量。使用起始生物质浓度作为基础计算可溶性蛋白质回收百分比。结果表明,微流化后回收最多25%的蛋白质,这表明微流化然后离心是裂解细胞并回收可溶性蛋白质的可行方法。
[0237]
作为另一个实例,将细胞密度为22.4g/l(发酵液肉汤中的细胞)的细胞悬浮液送至microfluidics。一个样品在18,000psi下通过微流化器,另一样品在28,000psi压力下两次通过相同类型的微流化器。比较并获得结果,如表8所示。
[0238]
对于在18,000psi下通过一次的样品,匀浆中的蛋白质浓度为9.5mg/ml。然后将样品过滤或离心并进一步分析。通过0.45微米过滤器过滤后,富含蛋白质的级分包含2.4mg/ml的蛋白质。以2,000rpm离心8分钟后,富含蛋白质的级分的蛋白质浓度为约3.2mg/ml蛋白质。较高的离心速率会产生较少的蛋白质(在5,000rpm下,回收级分的蛋白质浓度为约1.0mg/ml或更高,或约1.9mg/ml或更高。在10,000rpm的高得多的离心速率下,旋转后所得的上清级分的蛋白质浓度为约1.4mg/ml)。
[0239]
另一组样品在28,000psi下两次通过微流化器进行处理,其中先前裂解的含细胞悬浮液流过再循环流,以第二次再次进入微流化器。测得的匀浆中含蛋白质部分的所得蛋白质浓度为约8.5mg/ml。然后将样品过滤和/或离心。通过0.45微米的过滤器过滤后,得到的蛋白质浓度为约1.8mg/ml。以2000rpm离心8分钟后,所得蛋白质浓度为约3.0mg/ml。较高的离心速率产生较少的蛋白质(在5000rpm时为2.0mg/ml;在10000rpm时为1.3mg/ml)。
[0240]
实施例8:来自通过一个或多个微流化破裂装置对细菌细胞进行的破裂的细胞裂解
被选择进行破裂过程的破裂装置可以是微流化器和其他可商购的装置。在图7b-7e中,被选择进行破裂过程的破裂装置是微流化器。破裂装置内部的破裂过程可以在不同的变量下进行,所述变量包括压力和通过次数。
[0241]
图7a示出了未进行裂解的含细胞悬浮液的电子显微照片。用显微镜并以瞄准匀浆的100x放大倍率拍摄电子显微照片。
[0242]
选择用于在破裂装置内经历破裂过程的含细胞悬浮液可以具有不同的密度。在图7a中,未经历破裂过程的含细胞悬浮液的密度为约10g/l或更高,例如约16g/l或更高。
[0243]
图7b说明了根据本发明的一个或多个实施方案在破裂装置460、560或660内获得的匀浆的另一张电子显微照片,所述匀浆是破裂装置460、560或660内含细胞悬浮液中厌氧细菌细胞的细胞膜破裂的产物。
[0244]
用显微镜并以瞄准匀浆的100x放大倍率拍摄电子显微照片。在图7b中,被选择进行破裂过程的破裂装置是微流化器。在该图7b中,破裂过程在相对于含细胞悬浮液的1,000psi或更高压力下(例如,在1,000磅/平方英寸(psi)至9,000psi或更高)以一次通过来进行。同样,在图7b中,在破裂装置内为此破裂过程选择的含细胞悬浮液的细胞密度为约10g/l或更高,例如约16g/l或更高。在视觉上,由于微流化过程所致对细胞膜造成了明显的损害。
[0245]
图7c示出了根据本发明的一个或多个实施方案的在破裂装置460、560或660内破裂之前含细胞悬浮液中的厌氧细菌细胞的细胞膜的电子显微照片。
[0246]
用显微镜并以瞄准匀浆的100x放大倍率拍摄电子显微照片。在该图7c中,为破裂装置内的该破裂过程选择的含细胞悬浮液的细胞密度为约10g/l或更高,例如约16g/l或更高。破裂过程在相对于含细胞悬浮液的约1,000psi或更高压力下(例如,在1,000磅/平方英寸(psi)至20,000psi或更高)以一次通过来进行。与图7a中的结果相比,图7c中所示的结果表明在该处理压力下发生了细胞膜的显著破裂。
[0247]
图7d说明了根据本发明的一个或多个实施方案在破裂装置460、560或660内获得的匀浆的另一张电子显微照片,所述匀浆是破裂装置460、560或660内含细胞悬浮液中厌氧细菌细胞的细胞膜破裂的产物。
[0248]
用显微镜并以瞄准匀浆的800x放大倍率拍摄电子显微照片。在该图7d中,被选择进行破裂过程的破裂装置是微流化器。在该图7d中,破裂过程在相对于含细胞悬浮液的1,000psi压力下(例如,在1,000磅/平方英寸(psi)至22,000psi或更高)以一次通过来进行。同样,在该图7d中,在破裂装置内为此破裂过程选择的含细胞悬浮液的密度为约15g/l或更高,例如约20g/l或更高,或约22.4g/l或更高。
[0249]
图7e说明了根据本发明的一个或多个实施方案在破裂装置460、560或660内获得的匀浆的另一张电子显微照片,所述匀浆是破裂装置460、560或660内含细胞悬浮液中厌氧细菌细胞的细胞膜破裂的产物。
[0250]
用显微镜并以瞄准匀浆的800x放大倍率拍摄电子显微照片。在该图7e中,被选择进行破裂过程的破裂装置是微流化器。在该图7e中,破裂过程在相对于含细胞悬浮液的1,000psi压力下(例如,在25,000磅/平方英寸(psi)至30,000psi或更高)以2次通过来进行。同样,在该图7e中,在破裂装置内为此破裂过程选择的含细胞悬浮液的细胞密度为约15g/l或更高,例如约20g/l或更高,或约23g/l或更高。
[0251]
实施例9:在含细胞保存槽中对细菌细胞进行预处理的情况下,通过一个或多个微流化破裂装置对细菌细胞进行破裂使用微流化器破裂装置(例如,microfluidics装置)来破裂发酵过程的厌氧细菌细胞并产生含蛋白质部分。从发酵容器的高细胞密度实验室反应器获得发酵液肉汤(例如,细胞密度为15g/l)。离心浓缩样品,得到45g/l的细胞密度。将所得的细胞悬浮液(含有90g细胞的2l)送至含细胞保存槽中进行预处理。
[0252]
微流化过程涉及用通过在高压下迫使细胞通过1微米反应室而产生的高剪切力使细胞破裂。将含有细菌细胞的含细胞悬浮液分成六个样品。用一种或多种添加剂(例如去污剂、酶等)处理含细胞悬浮液,并使其在15,000psi下通过微流化器。仅通过微流化器破裂装置一次。一次通过之后,从匀浆中分离出第一含蛋白质部分并喷雾干燥。
[0253]
实施例10:通过一个或多个声处理破裂装置对细菌细胞进行破裂超声仪被确定为使发酵过程的厌氧细菌细胞破裂并产生含蛋白质部分的破裂装置。从发酵容器的高细胞密度实验室反应器获得15g/l发酵液。通过离心浓缩样品以获得22.4g/l的细胞密度。将所得的细胞重悬浮液(2l,含44g细胞)进行声处理。声处理过程涉及在搅动细胞并破开细胞膜的超声频率下通过声能以高力使细胞破裂。将含有细菌细胞的含细胞悬浮液分成六个样品。对每个样品进行声处理。
[0254]
实施例11:在含细胞保存槽中对细菌细胞进行预处理的情况下,通过一个或多个声处理破裂装置对细菌细胞进行破裂超声仪被确定为使发酵过程的厌氧细菌细胞破裂并产生含蛋白质部分的破裂装置。从三个高细胞密度发酵容器中获得发酵液肉汤。通过离心浓缩样品以获得4至10mg/ml的细胞密度。
[0255]
例如,将从含有约4.2mg/ml细菌细胞的发酵容器(在本实施例中为示例性容器a)获得的发酵液肉汤在多种缓冲液中进行声处理。将来自另一个发酵容器(示例性容器b)的包含约9.2mg/ml厌氧细菌细胞的含细胞悬浮液在多种缓冲液中进行声处理。来自另一个发酵容器(示例性容器c)的含有约7.1mg/ml的细胞的含细胞悬浮液也在多种缓冲液中进行声处理。
[0256]
从发酵容器中收集发酵肉汤后,将来自发酵肉汤的细菌细胞通过离心旋转沉淀(例如,以4,000rpm或更高的离心速率旋转沉淀细菌细胞),并重悬在它们各自的缓冲液中。
[0257]
将细胞重悬于含有去污剂的缓冲液(trishcl ph 8,含有十二烷基硫酸钠(sds), chaps, triton x-100, 或tween 20)或含有酶的缓冲液(trishcl ph 8,含有溶菌酶)中。将trishcl ph8用作对照缓冲液。将所得的细胞悬浮液进行声处理。
[0258]
细胞以5秒脉冲进行声处理,然后在其间置于冰上。该循环重复三次。声处理后,将细胞以20k rpm旋转沉淀10分钟,并除去上清液。使用基于lowry的蛋白质测定法分析可溶性蛋白质级分的蛋白质含量。基于进行声处理的细胞浓度计算可溶性蛋白质回收率百分比。
[0259]
还对几个样品进行冷冻/解冻循环,其中将细胞在trishcl缓冲液中完全冷冻。在-80摄氏度冷冻后,细胞完全解冻,然后重新冷冻。该循环完成了5次。完成后,将含细胞悬浮液以20,000rpm旋转沉淀10分钟,除去上清液。表9示出了按含细胞悬浮液样品所经受的缓冲液类型的蛋白质回收量。根据起始材料计算可溶性蛋白质回收率百分比。起始材料包括
包含液体营养培养基、其他必需矿物质和产乙酸生物质积累的发酵液。
[0260]
从三个高细胞密度发酵容器获得发酵液。通过以4,000rpm离心浓缩样品,以获得4至10mg/ml的细胞密度。将细胞重悬于含有去污剂的缓冲液(trishcl ph 8,含有十二烷基硫酸钠(sds), chaps, triton x-100, 或tween 20)或含有酶的缓冲液(trishcl ph 8,含有溶菌酶)中。将trishcl ph8用作对照缓冲液。将所得的细胞悬浮液进行声处理。声处理过程涉及在搅动细胞并破开细胞膜的超声频率下通过声能以高力使细胞破裂。
[0261]
细胞以5秒脉冲进行声处理,然后在其间置于冰上。该循环重复三次。声处理后,将细胞以20,000 rpm旋转沉淀10分钟,并除去上清液。使用基于lowry的蛋白质测定法分析可溶性蛋白质级分的蛋白质含量。基于进行声处理的细胞浓度计算可溶性蛋白质回收率百分比。
[0262]
表9所示结果表明,当细胞进行声处理时,去污剂添加剂可以增加蛋白质的溶解度。具体而言,添加sds或溶菌酶大大提高了膜蛋白质的溶解度。
[0263]
实施例12:通过一个或多个过滤型分级器装置分级破裂的细菌细胞的匀浆通过尼龙过滤器过滤实施例4的匀浆。过滤匀浆使得原始微生物生物质的10.7%被回收为可溶性蛋白质。
[0264]
实施例13:通过一个或多个离心型分级器装置分级破裂的细菌细胞的匀浆实施例4的匀浆以2000rpm离心,其将3.2mg蛋白质分级到上清液中。匀浆的离心使得从发酵容器收集的初始微生物生物质的总细胞团中分离出的可溶性蛋白质的回收率为14.3%。
[0265]
实施例14:测定含细胞悬浮液中ph对通过一个或多个破裂装置破裂后回收的蛋白质的影响从含有俊达氏梭菌细胞的高细胞密度发酵容器中收集样品。收集时的细胞浓度为约22g/l,且ph值为约4.5。在4,000rpm下旋转沉淀一定体积的细胞培养物10分钟。将细胞沉淀重悬于与离心后去除的培养基体积相同体积的trishcl中(这样就不会浓缩或稀释样品)。通过添加0.5m naoh对多种体积的细胞培养物进行ph调节,使培养肉汤的最终ph值在3.5和10之间。将样品在10,000到20,000psi之间进行一次通过或多次通过的处理。每个样品以13,300rpm旋转沉淀6分钟。收集上清液,并使用基于lowry的蛋白质测定法确定可溶性级分中的蛋白质浓度。
[0266]
表10中显示的数据表明,在微流化之前细胞匀浆的ph增加会增加蛋白质溶解度。
具体地,当ph高时(高于7.6),可溶性蛋白质的回收率提高。
[0267]
实施例15. 含细胞悬浮液的ph对通过一个或多个破裂装置破裂后回收的蛋白质的影响的测定从含有acetobacterium woodii细胞的高细胞密度发酵容器中收集样品。收集时的细胞浓度的干燥细胞重量为约3g/l,且ph值为约6.1。在4,100 rpm下旋转沉淀一定体积的细胞培养物10分钟。将细胞沉淀重悬于与离心后去除的培养基体积相同体积的trishcl中(这样就不会浓缩或稀释样品)。通过添加0.5m naoh对多种体积的细胞培养物进行ph调节,使培养肉汤的最终ph值在6和10之间。将样品在10,000到20,000 psi之间进行一次通过的处理。每个样品以9,800 rpm旋转沉淀30分钟。收集上清液,并使用基于lowry的蛋白质测定法确定可溶性级分中的蛋白质浓度。
[0268]
表11中显示的数据表明,在微流化之前细胞样品的ph值的增加提高了蛋白质的溶解性。具体而言,当ph增加时,可溶性蛋白质的回收率提高。
[0269]
实施例16. 确定溶菌酶对可溶性蛋白质回收率的影响从高细胞密度发酵容器收集样品。将一定体积的细胞培养物旋转沉淀并以与前述相同的方式将其重悬于trishcl缓冲液中。使用0.5m氢氧化钠将培养肉汤的ph增加至ph8。为了确定酶预处理的影响,使用了0.5mg/ml溶菌酶。对于培养肉汤样品,与溶菌酶的孵育在室温下持续约30分钟。对于trishcl样品,与溶菌酶的孵育在室温下持续约45分钟(由于用作为瓶颈的微流化器处理的延迟造成的差异)。
[0270]
将样品在10,000到20,000 psi之间进行一次通过或多次通过的处理。还进行了不通过微流化器处理样品的对照。每个样品以13,300 rpm旋转沉淀6分钟。收集上清液,并使用基于lowry和基于bradford的蛋白质测定法确定可溶性级分中的蛋白质浓度,结果示于表12中。
[0271]
实施例17. 确定降低溶菌酶浓度和延长孵育时间的影响。
[0272]
从高细胞密度发酵容器收集样品,并通过以4,000 rpm离心10分钟浓缩。将培养肉汤的ph调节至7-10。一些样品在37℃与100ng/ml溶菌酶一起孵育一个小时。每10分钟取样以监测溶菌酶的活性。取在30分钟和1小时的大样品,并通过微流化器以10,000到20,000psi进行一次通过或多次通过的处理。每个样品以13,300rpm旋转沉淀6分钟。收集上清液,并使用基于lowry的蛋白质测定法确定可溶性级分中的蛋白质浓度,结果显示在表13中。
[0273]
实施例18. ph和细胞浓度对蛋白质提取的影响通过离心和重悬于培养基中,将来自高细胞密度发酵容器的样品稀释至1至10g/l的浓度。使用0.5m氢氧化钠将培养肉汤的ph调节至6至10。通过微流化器在10,000到20,000psi之间以一次或多次通过来处理样品(包括在发酵ph值下未改变的培养肉汤)。类似地,在一个酸性ph值和一个碱性ph值下处理来自高细胞密度发酵容器的未稀释培养清除物。每个样品以13,300 rpm旋转沉淀6分钟。
[0274]
收集上清液,并使用基于lowry的蛋白质测定法确定可溶性级分中的蛋白质浓度。表14表明随着在微流化之前培养肉汤的ph增加,可溶性级分中回收的蛋白质量增加。
[0275]
图8a示出了根据本发明的一个或多个实施方案的从破裂装置460、560或660以及从含细胞悬浮液内的厌氧细菌细胞的细胞膜获得的可溶性蛋白质的图。
[0276]
选择进行破裂过程的破裂装置可以是微流化器和其他可商购的装置。在该图8a中,选择进行破裂过程的破裂装置是微流化器。
[0277]
破裂装置460、560或660内的破裂过程可以在不同的变量下进行,所述变量包括压力和通过次数。在该图8a中,在针对含细胞悬浮液15,000磅/平方英寸(psi)的压力下,在仅一次通过的情况下,进行破裂过程。
[0278]
选择用于在破裂装置460、560或660内进行破裂过程的含细胞悬浮液可以具有不同的密度。在该图8a中,选择了四个含细胞悬浮液流,用于破裂装置460、560或660内的该破裂过程。含细胞悬浮液的密度各自为1g/l、5g/l、10g/l和18.5g/l。
[0279]
线802的y轴表示根据本发明的一个或多个实施方案自破裂装置460、560或660破裂并获得的细胞匀浆的蛋白质的产率,所述细胞匀浆在不同ph条件(x轴)下从密度为18.5g/l的含细胞悬浮液中的厌氧细菌细胞制备。
[0280]
线804的y轴表示根据本发明的一个或多个实施方案自破裂装置460、560或660破裂并获得的细胞匀浆的蛋白质的产率,所述细胞匀浆在不同ph条件(x轴)下从密度为10g/l的含细胞悬浮液中的厌氧细菌细胞制备。
[0281]
线806的y轴表示根据本发明的一个或多个实施方案,针对不同的ph条件绘制的自破裂装置460、560或660破裂并获得的细胞匀浆的蛋白质的产率,所述细胞匀浆在不同ph条件(x轴)下从密度为5g/l的含细胞悬浮液中的厌氧细菌细胞制备。
[0282]
线808的y轴表示根据本发明的一个或多个实施方案自破裂装置460、560或660破裂并获得的细胞匀浆的蛋白质的产率,所述细胞匀浆在不同ph条件(x轴)下从密度为1g/l的含细胞悬浮液中的厌氧细菌细胞制备。
[0283]
选择用于在破裂装置460、560或660内进行破裂过程的含细胞悬浮液可以具有1至14范围内的不同ph值。含细胞悬浮液的ph值可以通过各种方法调节,包括酸、碱或盐的添加或其组合。在本文在图8a中,使用0.5m氢氧化钠将含细胞悬浮液的ph值调节至约6或8。可以
在破裂装置460、560或660内破裂含细胞悬浮液之前调节含细胞悬浮液的ph值。例如,可以在含细胞保存槽445、545或645内调节含细胞悬浮液的ph值。
[0284]
实施例19. ph对高浓度含蛋白质悬浮液的影响从高细胞密度发酵容器收集样品,并通过以4,000 rpm将细胞离心10分钟浓缩至1/3。将细胞沉淀重悬在培养基中。使用浓氢氧化钠将培养基的ph调节至5至10。例如,通过将细胞以4,000 rpm离心10分钟将样品浓缩至45g/l。将细胞沉淀重悬于培养基中。用0.5m氢氧化钠将所得的细胞混合物的ph调节至5、6、7或8。通过微流化器将样品以15,000 psi以一次通过进行处理。每个样品以13,300rpm旋转沉淀6分钟。收集上清液,并使用基于lowry的蛋白质测定法确定可溶性级分中的蛋白质浓度。
[0285]
图8b示出了根据本发明的一个或多个实施方案的从破裂装置460、560或660以及从含细胞悬浮液内的厌氧细菌细胞的细胞膜获得的可溶性蛋白质的产率的图。
[0286]
在图8b中,选择进行破裂过程的破裂装置是微流化器。在图8b中,以对于含细胞悬浮液10,000至20,000psi之间的压力以一次或多次通过进行破裂过程。通过以13,300rpm离心收集上清液,并使用基于lowry的蛋白质测定法分析蛋白质。表15表明,将培养肉汤的ph从4-5增加到6-10显著增加了在可溶性级分中回收的蛋白质的百分比。
[0287]
线812的y轴代表根据本发明的一个或多个实施方案,根据含细胞悬浮液的ph值的变化,ph对来自自破裂装置460、560或660破裂并获得的细胞匀浆的蛋白质的产率的影响,所述细胞匀浆在不同ph条件(x轴)下从密度为45g/l的含细胞悬浮液中的厌氧细菌细胞制备。
[0288]
实施例20. 匀浆的ph对通过一个或多个破裂装置破裂后回收的蛋白质的影响的测定从含有俊达氏梭菌细胞的高细胞密度发酵容器中收集样品。收集时的细胞浓度为约18g/l,且ph值为约4.5。在4,000 rpm下旋转沉淀一定体积的细胞培养物10分钟。将样品在15,000 psi之间以0或一次通过进行处理。然后通过添加0.5m naoh或nh4oh对多种体积的细胞培养物进行ph调节,使培养肉汤的最终ph在约8之间。每个样品以13,3000 rpm旋转沉淀6分钟。收集上清液,并使用基于lowry的蛋白质测定法确定可溶性级分中的蛋白质浓度。
[0289]
表16中显示的数据表明,在微流化之后细胞匀浆的ph增加提高了蛋白质的溶解性。具体而言,当ph增加时,可溶性蛋白质的回收率提高。
[0290]
实施例21. 细胞样品的ph对没有破裂而回收的蛋白质的影响的测定从含有俊达氏梭菌细胞的高细胞密度发酵容器中收集样品。收集时的细胞浓度为约18g/l,且ph值为约4.5。在4,000 rpm下旋转沉淀一定体积的细胞培养物10分钟。然后通过添加0.5m naoh或nh4oh对多种体积的细胞培养物进行ph调节,使培养肉汤的最终ph值为约8。接着,不将样品在15,000 psi之间处理。每个样品以13,300 rpm旋转沉淀6分钟。收集上清液,并使用基于lowry的蛋白质测定法确定可溶性级分中的蛋白质浓度。表17中显示的数据表明,在微流化之前细胞样品的ph增加提高了蛋白质的溶解性。具体而言,当ph高时,可溶性蛋白质的回收率提高。
[0291]
实施例22. 细胞样品的ph对通过一个或多个破裂装置破裂后回收的蛋白质的影响的测定从含有俊达氏梭菌细胞的高细胞密度发酵容器中收集样品。收集时的细胞浓度为约18g/l,且ph值为约4.5。在4,000 rpm下旋转沉淀一定体积的细胞培养物10分钟。然后通过添加0.5m naoh或nh4oh对多种体积的细胞培养物进行ph调节,使培养肉汤的最终ph值为约8。接着,将样品在15,000 psi之间以一次通过进行处理。每个样品以13,300 rpm旋转沉淀6分钟。收集上清液,并使用基于lowry的蛋白质测定法确定可溶性级分中的蛋白质浓度。
[0292]
表18中显示的数据表明,在微流化之前细胞样品的ph增加提高了蛋白质的溶解性。具体而言,当ph高时,可溶性蛋白质的回收率提高。
[0293]
尽管前述内容涉及本发明的实施方案,但是在不脱离本发明的基本范围的情况下,可以设计本发明的其他和进一步的实施方案,并且本发明的范围由所附权利要求书确定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1