用于生产有机酸的微生物细胞系的分离的制作方法
优先权声明
本发明要求于2018年6月18日提交的美国专利申请号62/686,463的优先权,其全部内容通过引用并入本文。
本公开整体上涉及过量生产有机酸的微生物细胞系及其制造方法。
背景技术:
有机酸是指具有酸性的含碳化合物。有机酸的实例包括乙酸、柠檬酸、葡糖酸、乳酸、丙酸等。由于它们是可完全降解的,有机酸可以被用在可生物降解聚合物的生产中。它们也具有其他重要的工业应用,包括作为食品添加剂。
技术实现要素:
本公开提供了适合用于有机酸的工业规模生产的微生物细胞系以及制造和分离这种细胞系的方法。
在一个方面,提供了制造和分离微生物细胞系的方法,其中与亲代微生物细胞系相比,所分离的微生物细胞系过量生产有机酸。所述方法使用了在增补有有机酸的ph受控的培养基中,优选在非固定培养中亲代菌株的连续传代,其中ph值被控制在高于所述有机酸的pka值。在一些实施方式中,所述ph优选在约5.5和约7.5之间的范围内,更优选为中性或接近中性,在约6.0和约7.0之间,并且最优选为约7.0。在一些实施方式中,所述培养基是固化的。在一些实施方式中,所述培养基增补有足以抑制正常微生物细胞生长的量的有机酸,例如以降低倍增速率或生长速率,例如,将倍增速率或生长速率降低至少5%、10%、20%、30%、40%、50%或更多。在一些实施方式中,在连续传代的连续迭代中以逐渐增加的量增补所述有机酸。在一些实施方式中,在连续传代的连续迭代中以相同的量增补所述有机酸。在一些实施方式中,所述有机酸是丙酸、乳酸、乙酸或丁酸。在一些实施方式中,所述有机酸是丙酸,例如,所述培养基增补有约1.0%-3.0%的丙酸,例如,约3.0%的丙酸。在一些实施方式中,所述亲代细胞系是野生型生物。在一些实施方式中,所述亲代细胞系是来源于单细胞微生物的微生物细胞系。
在另一方面,提供了过量生产有机酸的微生物细胞系,其中在增补有有机酸的ph受控的培养基中使用连续传代来制造和分离所述微生物细胞系,其中ph值被控制在高于所述有机酸的pka值,优选在约5.5和约7.5之间的范围内,更优选为中性或接近中性,在约6.0和约7.0之间,并且最优选为约7.0。
在另一方面,提供了过量生产有机酸的微生物细胞系,其中所述微生物细胞系具有直接或间接地主要改变细胞包膜的结构、组成和/或功能的突变。优选地,所述微生物细胞系包含表3中鉴定的至少2种基因组突变或类似突变。更优选地,所述微生物细胞系包含表3中鉴定的所有基因组突变或同源突变。在一个实施方式中,所述微生物细胞系在表3中鉴定的至少2个基因中包含突变或与其类似的突变。在另一个实施方式中,所述微生物细胞系在表3中鉴定的所有基因或其同源物(例如,在本文所述的另一菌种中的同源基因)中包含突变。在另一个实施方式中,所述微生物细胞系在含o抗原连接酶结构域蛋白中包含突变。在另一个实施方式中,所述微生物细胞系在m18家族氨肽酶中包含突变。在另一个实施方式中,所述微生物细胞系在氨基酸通透酶中包含突变。在另一个实施方式中,所述微生物细胞系在腺嘌呤糖基化酶中包含突变。
所述微生物可以是任何生产有机酸的微生物。在一个实施方式中,所述微生物来自丙酸杆菌属(propionibacterium)(acidipropionibacterium),并且更优选为产丙酸丙酸杆菌(p.acidipropionici)菌种。在另一个实施方式中,所述微生物来自乳酸杆菌属(lactobacillus),并且更优选为嗜酸性乳酸杆菌(l.acidophilus)菌种。在另一个实施方式中,所述微生物来自醋杆菌属(acetobacter)。在另一个实施方式中,所述微生物来自葡糖杆菌属(gluconobacter)。在另一个实施方式中,所述微生物来自梭菌属(clostridium),并且更优选为丁酸梭菌(c.butyricum)菌种。在一些实施方式中,所述有机酸是丙酸。在一些实施方式中,所述有机酸是乳酸。在一些实施方式中,所述有机酸是乙酸。在一些实施方式中,所述有机酸是丁酸。
本文还提供了使用本文所述的方法和微生物生产有机酸的方法。
附图说明
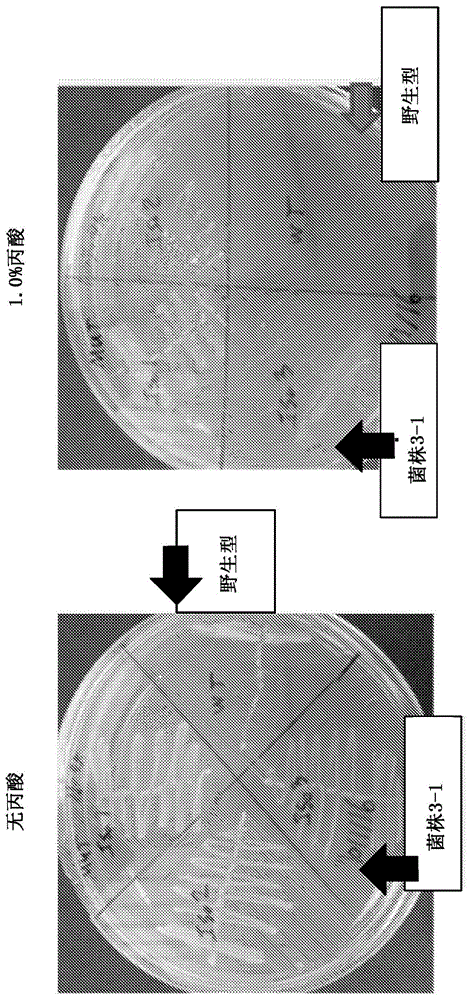
图1显示了在添加或不添加1.0%pa的固体缓冲培养基上野生型和突变体产丙酸丙酸杆菌的生长,显示了菌株3-1的表型。
图2显示了与野生型相比,产丙酸丙酸杆菌的突变体菌株(菌株3-1)在生物反应器中利用漂白的americanbeauty蛋糕面粉(wfm作为丸剂)的pa生产。1:200接种,1l工作培养物,5%(w/v)葡萄糖当量wfm,30℃,ph7(naoh,5m)。
具体实施方式
最常见的有机酸是羧酸,其酸度与羧基(-cooh)有关。它们通常是pka值在约4-5之间的弱酸。例如,丙酸(“pa”)是化学式为c2h5cooh或c3h6o2的羧酸。它是无色、油状和刺激性(想象瑞士乳酪和汗液)液体并且其物理性质介于较小的羧酸(甲酸和乙酸)和较大的脂肪酸之间。它的分子量为约74.1g/mol,并且其pka为约4.9,这意味着在ph为约4.9的溶液中,pa的一半处于质子化(或未解离)、不带电的状态(c2h5cooh),而另一半处于去质子化(或解离)、带负电的状态(c2h5coo-),后者称为丙酸化物或丙酸化物离子,其可以形成盐或酯化合物。随着ph降低(变得更加酸性),更多pa处于质子化、不带电的状态;当ph增加(变得更加碱性)时,更多pa处于去质子化、带负电的状态。
由于pa在0.1和1%(w/v)之间的水平下抑制霉菌和一些细菌的生长,pa及其盐在动物饲料和人类食品(例如烘焙物)中都被用作防腐剂。在美国,pa在用作食品添加剂时被食品药品监督管理局“一般公认为安全”或gras。在澳大利亚、新西兰和欧盟,它也被批准用作食品添加剂。此外,pa是其他化学品合成中的重要中间体,所述其他化学品例如纤维素来源的塑料、杀虫剂、水果调味剂、香水原料和药品。
尽管它们在自然界中广泛分布,但有机酸的商业生产通常依赖于化学合成,因为这在经济上更具竞争力。例如,目前,pa几乎完全是通过石化过程商业生产的。随着原油和石化产品价格的上涨,以及生物技术领域的快速发展,通过化学合成和通过微生物发酵制造pa的成本之间的经济差距正在缩小。伴随着对能源短缺和环境污染的日益关注,人们对从可再生资源以商业规模生物合成有机酸(如pa)越来越感兴趣。
通过发酵进行有机酸的微生物生产是已知的并且已经使用了几个世纪。例如,黑曲霉(aspergillusniger)和解脂耶氏酵母(yarrowialipolytica)已用于生产柠檬酸;乳酸杆菌已用于生产乳酸;梭菌已用于生产乙酸;黑曲霉和葡糖杆菌已用于生产葡糖酸。
丙酸杆菌是最常用于生产pa(以及维生素b12和瑞士奶酪)的微生物。丙酸杆菌是一种革兰氏阳性、无运动性、无孢子形成的杆状厌氧细菌属,其包括以下菌种:费氏丙酸杆菌(p.freudenreichii)、产酸丙酸杆菌(p.acidifaciens)、环己酸丙酸杆菌(p.cyclohexanicum)、澳大利亚丙酸杆菌(p.australiense)、产丙酸丙酸杆菌(p.acidipropionici)、詹氏丙酸杆菌(p.jensenii)、特氏丙酸杆菌(p.thoenii)、微嗜氧丙酸杆菌(p.microaerophilum)、p.olivae、p.damnosum、丙酸丙酸杆菌(p.propionicum)、痤疮丙酸杆菌(p.acnes)、贪婪丙酸杆菌(p.avidum)、颗粒丙酸杆菌(p.granulosum)、p.humerusii和嗜淋巴丙酸杆菌(p.lymphophilum)。对于工业pa生产,最常用的菌株是产丙酸丙酸杆菌(已有提议将丙酸杆菌属中的菌种重新分类为三个新属:acidipropionibacterium、cutibacterium和pseudopropionibacterium(scholz&kilian2016)。但是,产丙酸丙酸杆菌(propionibacteriumacidipropionci)和acidipropionibacteriumacidipropionici仍在某种程度上互换使用)。丙酸杆菌细胞生长的最佳ph和温度分别为约6.0-7.0和约30-37℃(ahmadi等,2017)。在低于约5.0的ph下细胞生长受到抑制,尽管在中性ph下开始的发酵罐可以达到ph4.4(rehberger和glatz1998)。ahmadi等提供了丙酸杆菌属各种菌种在几种碳源上生产pa的概述,如文献中所报道的(ahmadi等,2017),并通过引用并入本文。
pa也可以由其他厌氧细菌生产,例如厌氧弧菌(anaerovibrio)、拟杆菌(bacteroides)、梭菌、梭杆菌(fusobacterium)、巨球型菌(megasphaera)、丙酸螺菌(propionispira)、月形单胞菌(selenomonas)和韦荣氏球菌(veillonella)的某些菌种。
有许多发酵途径通过一系列酶促反应将碳源转化为pa。参与pa生产(尤其是在丙酸杆菌中)的主要发酵途径被称为伍德-沃克曼(wood-werkman)循环,该循环从来自糖酵解的终产物丙酮酸生产丙酸,并涉及许多中间体,包括草酰乙酸、苹果酸、延胡索酸、琥珀酸、琥珀酰coa、甲基丙二酰coa和丙酰coa,以及许多酶,包括草酰乙酸转羧酶、生物素依赖性羧基转移酶、coa转移酶、延胡索酸水解酶、乳酸脱氢酶、辅酶b12依赖性甲基丙二酰辅酶a变异酶、苹果酸脱氢酶和琥珀酸脱氢酶。
尽管大多数丙酮酸在发酵过程中转化为pa/丙酸,但有些丙酮酸转化为乙酸。该乙酸形成途径涉及中间体乙酰coa和乙酰磷酸,以及酶丙酮酸脱氢酶复合物、磷酸转乙酰酶和乙酸激酶。
许多碳源已被用于微生物pa生产,包括葡萄糖、果糖、麦芽糖、蔗糖、木糖、乳糖、甘油、乳酸、面粉水解物、糖蜜、乳清及其组合。已经使用了许多培养系统,例如分批、补料分批和连续发酵。
但是,为了使有机酸的商业规模微生物生产在经济上可行,发酵过程必须能够以高收率(从碳源生产的有机酸量,通常以g/g为单位测量)和高产率(有机酸生产速率,通常以g/l.h为单位测量)转化碳源。
已探索了各种发酵技术,包括补料分批、连续培养、多阶段、细胞固定和提取发酵系统,以提高有机酸生产的收率。然而,收率和产率的适度提高通常被生产成本的显著提高所抵消。
例如,已用共培养方法使用乳清作为原料来生产pa(wo85/04901;ep0141642a1)。wo85/04901描述了在veillonellacricetid存在下使用干酪乳酸杆菌(lactobacilluscasei)亚种鼠李糖乳酸杆菌(rhamnosus)通过两阶段发酵过程将乳酸相互转化为丙酸。在第一阶段,干酪乳酸杆菌将碳水化合物转化为乳酸;在第二阶段,乳酸被v.cricetid发酵成pa。(乳酸杆菌属和韦荣氏球菌属均属于厚壁菌门,而丙酸杆菌属属于放线菌门。)ep0141642还描述了使用乳酸生产细菌(l.casei)和pa生产细菌(费氏丙酸杆菌谢氏亚种(p.shermanii))的混合培养以使发酵收率最大化。据报道,在从乳糖生产pa方面,wo85/04901和ep0141642的共培养系统非常高产,最终收率在20–100g/l的范围内。然而,这样的共培养系统对过程参数具有相当大的影响。例如,它们缺乏对系统每个成员的生长和代谢活性的控制,这可能导致任一个成员无法生长或无法继续形成所需产物。共培养系统普遍缺乏再现性。
与有机酸的微生物生产相关的一个主要问题是终产物对细胞生长和发酵过程的强烈抑制作用,导致低生产收率和产率。据推测,耐酸性对于改善pa生产菌株的收率和产率至关重要(rehberger和glatz1998)。在ph4.5-5.0下,pa的抑制作用比乳酸强,这是由于以下事实:在该ph范围内,约一半的pa(pka为约4.9)会以未解离、质子化和不带电的形式存在,而乳酸(pka为约3.1)大多会以解离、去质子化和带电的形式存在。据推测,由于未解离的酸可以更容易地穿透细胞壁和膜,因此相比于乳酸,更多的pa可以进入细胞并发挥其抑制作用。因此,增强耐酸性被认为是减轻终产物抑制并改善pa生产的有效策略。因此,已经尝试在高pa和不受控或低ph的条件下创建丙酸杆菌的“耐酸”突变体。
例如,通过连续传代进行的适应性进化已用于获得具有改善的耐酸性的突变体产丙酸丙酸杆菌(woskow和glatz1991;zhu等,2010)。连续传代是一种在人工环境(通常在实验室场景中创建)中以两次或更多次迭代生长微生物(例如细菌)的方法,使微生物随着它们在实验过程中的进化生成自发突变,以适应一种或多种为实验设计的新环境条件。例如,反复使微生物经受极端酸性条件会导致自发突变,所述突变使微生物能够适应或耐受这种条件。
在先前工作中,为了创建赋予耐酸性的突变,通过在一年或更长的时间段内在含有增加量的pa(从0.5%至5%(woskow和glatz1991)或1.5g/l至20g/l(zhu等,2010))的选择培养基中重复和连续转移,使突变体产丙酸丙酸杆菌菌株适应于增加pa的浓度。重要的是,在这些实验中,未控制具有增加量的pa的选择培养基中的ph,这可能是因为,据推测,对细胞生长和pa生产的抑制作用是由pa的酸度引起的。
通过在纤维床生物反应器中固定和适应,也获得了具有增强的pa生产的产丙酸丙酸杆菌突变体(suwannakham和yang2005;suwannakham2005)。在纤维床生物反应器中获得耐酸突变体的能力归因于生物反应器中维持的高细胞密度和活力,以及固定的细胞由于彼此直接接触以及与固体表面的直接接触而形成的独特的生理学和生存能力。较高的pa生产部分归因于突变体中较高的草酰乙酸转羧酶和coa转移酶活性水平。尽管pa收率较高,但在具有高细胞密度的纤维床生物反应器中,细胞生长受到限制。此外,纤维床生物反应器是昂贵且不可扩展的,并且其用途限于中小型规模生产。
最近,随机诱变策略(例如基因组改组)已用于加速定向微生物进化。例如,guan等报道了使用基因组改组来生成耐酸的突变体产丙酸丙酸杆菌菌株(guan等,2012)。为了获得该菌株,通过原生质体融合进行了四轮连续的基因组改组,并且使用增补有增加量的pa(从5至20g/l)的培养基选择耐酸菌株。同样,没有控制具有增加量的pa的选择培养基中的ph,这可能是因为,据推测,对细胞生长和pa生产的抑制作用是由pa的酸度引起的。
随后的分析鉴定了24种在亲代和改组菌株之间有显著差异的蛋白(guan等,2014)。据报道,检测到的蛋白质落入四大功能类别:细胞代谢和能量生成;dna复制、rna合成和翻译;翻译后修饰、蛋白折叠和分子伴侣;以及功能未知的假设蛋白。
在另一研究中,基因组改组被用于生成产丙酸丙酸杆菌、中间丙酸杆菌(p.intermedium)和詹氏丙酸杆菌菌株的耐酸突变体(wo2017/055932a2)。对每组菌株进行三轮连续的基因组改组,随后各自从ph/pa梯度板的酸性(ph3)侧选择菌落,所述梯度板使用在ph3或ph6.5下增补有5g/lpa的琼脂培养基制备。在培养基板中连续稀释后,随机选择最终的独立重组体,并在含有100μlph5的培养基和25g/lpa的96孔板中进行筛选。据报道,相比于天然丙酸杆菌和其他已知的衍生菌株,突变体菌株具有增强的pa收率。对突变体产丙酸丙酸杆菌菌株中的一种的基因组分析鉴定了许多修饰的基因,包括那些编码abc极性氨基酸转运蛋白、细胞色素c生物合成蛋白、abc多种糖转运蛋白、核糖体rna大亚基、长链酰基coa合成酶和阳离子扩散促进子的基因。此外,在突变体菌株中发现了全核糖体rna基因的额外拷贝和具有点突变的精氨酸脱亚氨酶调节子(argr)的额外拷贝。
丙酸杆菌的靶向代谢工程也已用于增加pa生产。这些研究通常靶向丙酮酸代谢途径中涉及的酶,以例如抑制乙酸形成途径或增强pa形成途径。例如,yang和suwannakham创建了工程改造的产丙酸丙酸杆菌菌株,其中编码乙酸激酶(其催化乙酰磷酸转化为乙酸)和/或磷酸转乙酰酶(其催化乙酰coa转化为乙酰磷酸)的基因被敲除,目的是消除或减少乙酸的形成,并从而增强pa生产(us2011/0151529a1;suwannakham2005)。
yang等创建了工程改造的产丙酸丙酸杆菌和费氏丙酸杆菌谢氏亚种,其转化有丙酰基coa:琥珀酸coa转移酶基因,以通过过表达催化丙酰基coa转化为丙酸的丙酰基coa:琥珀酸coa转移酶来增加pa生产(wo2012/064883a2)。据报道,所得菌株具有增加的pa生产和对pa的抗性,以及整体上对酸性ph的抗性。据信,增加的coa转移酶活性增加了通过pa形成途径的碳通量,超过了乙酸形成途径。
下表描述了已使用重组dna操纵的基因列表。这些基因构成了常规的遗传靶标,其中调控突变预期可以增加pa收率。
表1
然而,丙酸杆菌中的靶向基因工程具有挑战性。首先,酸改变和应力对细菌生理的影响是复杂且并未完全理解的,这使得难以通过操纵特定基因来改善对有机酸的耐受性。事实上,尽管了解在丙酸杆菌中形成pa的伍德-沃克曼途径中中间体和酶的身份,对该途径中基因的遗传操纵并未显著增加pa的收率。
此外,丙酸杆菌中gc含量高,使得难以鉴定基因组中独立的基因以及所有编码区的位置,这使遗传操纵变得复杂。另外,仅有少数克隆载体可用于将重组dna引入丙酸杆菌细胞,已知丙酸杆菌细胞的转化效率低。丙酸杆菌快速产生对抗生素标记的自发抗性的能力也使转化体的选择复杂化。
除了这些挑战之外,使用重组dna生产微生物细胞系与开发有机食品成分(例如pa)不兼容。至少在美国,基因工程改造的微生物产生的pa或其他有机酸不能被标记为“有机”或“天然防腐剂”,这在食品工业中尤为重要。因此,仍然需要适合用于有机酸的工业规模生产的新微生物菌株以及制造和分离这种菌株的方法。
有机酸对微生物的毒性尚不清楚,尽管它与使用发酵来生产有机酸的食品和化学工业有关。尽管了解在丙酸杆菌中形成pa的伍德-沃克曼途径中中间体和酶的身份,但对该途径中基因的遗传操纵并未显著提高pa的收率。一个原因可能是这些基因不限制pa的形成。因此,改变它们的序列或表达不会改变pa水平。相反,本文认为其他细胞靶标控制pa收率,但是无法根据现有知识预测其身份。是未知过程限制了pa的形成。由于该过程未知,因此不可能预测参与该过程的基因。
通过连续传代或基因组改组创建pa抗性细菌的先前努力通常使用具有增加的pa量但没有ph控制或ph显著低于pa的pka的培养基。这是基于这样的观念,即有机酸的浓度会产生毒性,并因此产生抗性。但是,该方法未考虑涉及转运蛋白系统的细胞摄取有机酸的机理,其取决于转运蛋白及其所在的膜或包膜的性质。
有机酸是pka值通常在约4-5之间的弱酸。ph和pka之间的关系由henderson-hasselbalch方程描述:
ph=pka+log10([a-]/[ha])
其中[ha]是质子化、未解离且不带电的弱酸的浓度,而[a-]是去质子化、解离且带负电的共轭碱的浓度。在典型的发酵过程中,在不使用缓冲剂的情况下,当有机酸达到最大浓度时,微生物培养物的ph大约为有机酸的pka。与已知的生产有机酸的细菌的ph耐受性相比,具有约4-5的ph的溶液不那么酸性。尽管细胞生长的最佳ph通常为约6-7,大多数这些细菌的确在此范围内的ph值下生长。
取决于有机酸是带电的还是不带电的,可以通过扩散或通过膜转运蛋白系统的作用来实现有机酸的细胞内转运。当有机酸未去质子化或解离时,它们不带电。在这种状态下,它们可以扩散通过细胞膜而不依赖于转运系统。然而,带电分子总是需要转运系统来进行跨膜转运。
在等于其pka值的ph值下,有机酸的一半呈质子化(或未解离)、不带电的形式,而另一半则呈去质子化(或解离)、带负电的形式。在低于其pka值的ph值下,有机酸大多不会带电,因为它们的羧基会被质子化。在高于其pka值的ph值下,有机酸大多未质子化或解离,并因此带负电。
在高浓度的有机酸下,ph相对较低,并且有机酸大多处于不带电状态,并可以以其酸的形式扩散进入细胞。这是在不控制ph或在显著低于有机酸pka的ph下分离有机酸抗性微生物的先前努力的基础。理论上,由于基于扩散的有机酸细胞进入,该方法将生成具有产生抗性的突变的细胞系。据推测,由于细胞内相对碱性的ph,不带电的有机酸会通过细胞膜扩散进入细胞质并释放质子;细胞内酸度的增加会抑制细胞的生长和有机酸的形成。换言之,据推测,处于不带电状态的有机酸限制其自身的生产。尽管有公开的文献和专利,但根据我们的经验,这种方法不能有效地生成抗性微生物,并且可能需要多年的传代以起作用。
我们假设有毒性的不是如其他人先前所推测的有机酸的酸度。相反,有毒性的是有机酸(丙酸)的去质子化、带负电的形式或中性盐,并且其用作选择剂来恢复自发的抗性突变会更有效。
与先前努力不同,我们假设使用将ph值控制在高于待生产的有机酸的pka值、且优选高至少1个单位会确保大多数有机酸保持带电和去质子化形式。在这种形式下,它们会保持依赖于蛋白质转运系统进行细胞内摄取。这会避免由于基于扩散的有机酸细胞进入而具有产生抗性的突变的细胞系的恢复,如果可以发现这样的突变的话。
具体而言,所使用的过程是在持续将ph控制在高于有机酸的pka值的特定ph值的条件下,在增补有足以抑制正常微生物生长的量(以逐渐增加的量或所有传代相同的量)的感兴趣的有机酸的细菌培养基中,在自由(即非固定的或浮游的)细胞培养中,将起始微生物细胞系(通常但不一定是野生型)连续传代。所述ph值被控制在高于所述有机酸的pka值,优选在约5.5至约7.5之间的范围内,更优选为中性或接近中性,在约6.0至约7.0之间,并且最优选为约7.0。尽管本发明的实施例描述了丙酸杆菌的使用,其他可以使用的微生物是分泌有机酸的发酵生物,例如乳酸杆菌、醋杆菌、葡糖杆菌或梭菌。所使用的有机酸可以是例如pa、乳酸、乙酸或丁酸。在一些实施方式中,所述微生物来自丙酸杆菌属,并且更优选为产丙酸丙酸杆菌菌种,并且所述有机酸是pa。在一些实施方式中,所述微生物来自乳酸杆菌属,并且更优选为嗜酸性乳酸杆菌菌种,并且所述有机酸是乳酸。在一些实施方式中,所述微生物来自醋杆菌属或葡糖杆菌属,并且所述有机酸是乙酸。在一些实施方式中,所述微生物来自梭菌属,并且更优选为丁酸梭菌菌种,并且所述有机酸是丁酸。
使用我们的有ph控制的连续传代方法,我们能够在不到两周的时间内创建并分离出与亲代菌株相比具有增加的有机酸生产的新微生物菌株,比使用通常要至少一年的描述于woskow和glatz1991中的常规连续传代方法快得多。我们的方法也比其他随机诱变方法(例如,纤维床生物反应器中的基因组改组和细胞固定或靶向基因工程)简单得多,并且更容易扩展。使用有ph控制的连续传代创建和分离的突变体细胞系生产的有机酸可以标记为“有机”或“天然防腐剂”,这在食品工业中尤为重要。
相同的有ph控制的连续传代方法可用于制造和分离多种微生物,包括但不限于丙酸杆菌、乳酸杆菌、乙酸细菌和梭菌,其过量产生许多有机酸,包括但不限于pa、乳酸、乙酸和丁酸。所有带电分子都依赖于转运系统及其相关的膜/包膜来起作用。对于其他有机酸,这些细胞成分的改变会实现与本文所述的丙酸相同的结果。
在由基因组改组或其他随机诱变方法生成的微生物文库中筛选表现出增加的有机酸耐受性和生产的分离株中,可以使用相同的选择方法(即,在将ph持续控制在高于有机酸的pka值的ph的条件下,使用增补有足以抑制正常微生物生长的量的感兴趣的有机酸的细菌培养基)。
使用这种ph控制方法,我们能够靶向抗性的独特机制,其依赖于转运和/或不可预测的细胞内靶标,包括那些参与调节和代谢的靶标。然后,使用基因组重测序来鉴定关键基因,所述关键基因的突变变化引起对高浓度有机酸的遗传抗性。
所得突变通常影响细胞包膜功能,如表2所示。
表2.包膜及相关分类
这些突变主要改变了细胞包膜的结构和组成和功能,所述细胞包膜由细胞壁和膜(包括细胞质膜)组成。表3中提供了所鉴定的突变的完整列表。我们没有发现之前报道的已经被靶向用于代谢工程改造以及使用重组dna进行操纵的基因(见表1)中的任何突变。产生突变体表型(例如,与起始微生物细胞系相比,在增补有有机酸的培养基中的生长增加和/或有机酸的过量生产)似乎需要多个基因的突变。这与现有知识中操纵单个基因以试图改变pa收率形成直接对比。
根据本发明,可以使用其他常规微生物学、分子生物学、重组dna和生化技术。此类技术在文献中和本领域技术范围内有充分解释。在以下实施例中将进一步描述本发明,这些实施例不限制权利要求中记载的方法和物质组成的范围。
实施例
实施例1
菌株3-1的分离
在10mlm24+2.0%葡萄糖培养基中,将产丙酸丙酸杆菌(atcc25562)生长至高细胞密度。随后将该培养物的连续稀释液(100至10-3)铺板在固体m24+2.0%葡萄糖培养基上,所述培养基用琼脂固化,增补有1.0%、2.0%和3.0%(w/v)的pa,全部用氢氧化钠中和至ph7.0。细胞也铺板在没有额外pa的固体m24+2.0%葡萄糖培养基上。
在30℃下进行5天厌氧培养后,评估了在不同pa浓度下的菌落生长。在铺有未稀释细胞的3%pa平板上有三个菌落生长;在铺有稀释细胞的3%pa平板上没有菌落生长。分离出所述三个菌落,并将其与新鲜生长的野生型产丙酸丙酸杆菌细胞一起重新涂在无pa、2.0%pa和3.0%pa平板上(全部用氢氧化钠中和至ph7.0)。
在30℃下进行第二次5天厌氧培养后,再次评估了在不同pa浓度下的菌落生长。三个分离株均能在1.0%pa平板上生长,而野生型不能(图1)。只有分离株#1能够在2.0%pa和3.0%pa平板上生长。该分离株被命名为菌株3-1(“3”表示3.0%pa,并且“1”表示分离株#1)。将分离株#1接种到5ml液体m24+2.0%葡萄糖培养基中并生长至高细胞密度,并制造了这些细胞的冷冻永久物。
在确认菌株3-1对固体培养基上的3.0%pa的抗性表型后,在宽范围的培养基和培养条件下,通过hplc将该菌株在10ml分批培养物和1l生物反应器培养物中的pa生产与其亲代产丙酸丙酸杆菌(atcc25562)细胞进行比较。
实施例2
菌株3-1和野生型产丙酸丙酸杆菌的pa生产
在30℃厌氧条件下,在增补有2%葡萄糖的m24培养基中,从冷冻永久物培养野生型产丙酸丙酸杆菌(atcc255562)和菌株3-1。每48小时将细胞传代培养到新鲜的m24培养基中,从10ml开始,然后50ml,以用作1l生物反应器容器的种子。
为了制备小麦面粉培养基,在混合的同时将75g美国蛋糕面粉加入2l无菌烧瓶中的1lddh2o中。将1ml的enzencoα-淀粉酶和500ml的50ppmcacl2添加到混合物中,以水解蛋糕面粉。通过添加5ml的5mnaoh将ph调节至6.0,并将温度在90℃下保持1小时。使混合物冷却,随后在37℃下温育过夜。过夜温育后,将温度升至60℃,并通过添加2ml5mnaoh将ph调节至7.0。为了释放葡萄糖,在搅拌的同时向混合物中添加1mlenzenco葡糖淀粉酶、0.05g蛋白酶、0.4gmgso4和10gohlykat酵母提取物。将该混合物在60℃下保持2小时。使混合物冷却,随后添加至玻璃夹套的生物反应器容器中,随后密封。高压灭菌前,校准ph。
在3l生物反应器容器中以1l体积进行发酵。将温度保持在30℃,使用5mnaoh将ph保持在7.0,并且以200rpm搅拌培养物。在接种前,将3ml过滤的无菌微量元素溶液添加到生物反应器中。使用ysi2900分析仪测定葡萄糖浓度。向1l小麦面粉培养基中接种5%接种物。每24小时取出样品,用于hplc上的pa分析。结果如图2所示。
菌株3-1和亲代野生型菌株均在约120小时达到最大pa浓度。相比于亲代野生型菌株的约30g/l,由菌株3-1生产的pa的最大浓度为约36g/l。
在5-6种不同条件下进行了其他实验,各自3-4次,以比较菌株3-1和野生型产丙酸丙酸杆菌的pa生产。获得类似于图2所示的结果。培养60小时后,与野生型相比,菌株3-1的pa生产至少增加了15%。
实施例3
菌株3-1的基因组分析
用菌株3-1的基因组重测序来鉴定关键基因,所述关键基因的突变变化引起对高浓度有机酸的遗传抗性。
鉴定了在29个基因中的65个功能丧失突变。所述突变通常影响细胞包膜功能,如表2所示。这些突变主要改变细胞包膜的结构和组成和功能,所述细胞包膜由细胞壁和膜(包括细胞质膜)组成。表3提供了菌株3-1中鉴定的突变的完整列表。
表3.菌株3-1的基因组突变
这些基因(或其在本文所述的其他菌种中的同源物)中的突变可能通过改变参与调节和/或代谢的膜转运蛋白系统和/或先前未知的细胞内靶标而赋予对高浓度有机酸的遗传抗性。
同一基因中的多个突变暗示该基因对于性状非常重要,并且需要多次改变才能对性状作出贡献。值得注意的是,几个基因具有三个或更多个突变,这可能表明它们在限制有机酸形成中的关键作用。它们包括编码以下的基因:o抗原连接酶结构域蛋白(asq49_rs02520中的15个突变;asq49_rs02535中的3个突变;asq49_rs02475中的3个突变(对o抗原连接酶和膜蛋白有强blast匹配的假设蛋白);m18家族氨肽酶(asq49_rs15965中的6个突变);氨基酸通透酶(asq49_rs05840中的4个突变);和腺嘌呤糖基化酶(asq49_rs07985中的4个突变)。
参考文献
1.woskows.a.,b.a.glatz.1991.产丙酸丙酸杆菌的耐丙酸菌株在分批和半连续发酵中的丙酸生产(propionicacidproductionbyapropionicacid-tolerantstrainofpropionibacteriumacidipropioniciinbatchandsemicontinuousfermentation.)appliedandenvironmentalmicrobiology57:2821-2828.
2.zhuy.,j.li,m.tan,l.liu,l.jiang,j.sun,p.lee,g.du,j.chen.2010.以甘油为碳源的耐丙酸产丙酸丙酸杆菌的丙酸生产的优化和扩展(optimizationandscale-upofpropionicacidproductionbypropionicacid-tolerantpropionibacteriumacidipropioniciwithglycerolasthecarbonsource.)bioresourcetechnology101:8902-8906.
3.wangz.,s.-t.yang.2013.费氏丙酸杆菌谢氏亚种在甘油/葡萄糖共发酵中的丙酸生产(propionicacidproductioninglycerol/glucoseco-fermentationbypropionibacteriumfreudenreichiisubsp.shermanii.)bioresourcetechnology137:116-123.
4.zhugex.,l.liu,h.-d.shin,j.li,g.du,j.chen.2014.通过整合补料分批培养与ph偏移控制策略改善代谢工程改造的詹氏丙酸杆菌从甘油生产丙酸(improvedpropionicacidproductionfromglycerolwithmetabolicallyengineeredpropionibacteriumjenseniibyintegratingfed-batchculturewithaph-shiftcontrolstrategy.)bioresourcetechnology152:519-525.
5.zhugex.,j.li,h.-d.shin,l.liu,g.du,j.chen.2015.通过氧化还原电位转移控制策略改善代谢工程改造的詹氏丙酸杆菌的丙酸生产(improvedpropionicacidproductionwithmetabolicallyengineeredpropionibacteriumjenseniibyanoxidoreductionpotential-shiftcontrolstrategy.)bioresourcetechnology175:606-612.
6.coralj.2008.深层发酵中丙酸杆菌利用低成本碳源的丙酸生产(propionicacidproductionbypropionibacteriumsp.usinglow-costcarbonsourcesinsubmergedfermentation.)dissertation.federaluniversityofparana.
7.zhanga.,j.sun,z.wang,s.-t.yang,h.zhou.2015.二氧化碳对产丙酸丙酸杆菌的细胞生长和从甘油和葡萄糖生产丙酸的作用(effectsofcarbondioxideoncellgrowthandpropionicacidproductionfromglycerolandglucosebypropionibacteriumacidipropionici.)bioresourcetechnology175:374-381.
8.wangz.,m.lin,l.wang,e.m.ammar,s.-t.yang.2015.费氏丙酸杆菌谢氏亚种的代谢工程改造以增强丙酸发酵:过表达三种生物素依赖性羧化酶的作用(metabolicengineeringofpropionibacteriumfreudenreichiisubsp.shermaniiforenhancedpropionicacidfermentation:effectsofoverexpressingthreebiotin-dependentcarboxylases.)processbiochemistry50:194-204.
9.suwannakhams.,y.huang,s.-t.yang.2006.产丙酸丙酸杆菌的ack敲除突变体的构建和表征以增强丙酸发酵(constructionandcharacterizationofackknock-outmutantsofpropionibacteriumacidipropioniciforenhancedpropionicacidfermentation.)biotechnologyandbioengineering94:383-95.
10.suwannakhams.,s.-t.yang.2005.通过在纤维床生物反应器中适应而获得的产丙酸丙酸杆菌突变体的增强的丙酸发酵(enhancedpropionicacidfermentationbypropionibacteriumacidipropionicimutantobtainedbyadaptationinafibrous-bedbioreactor.)biotechnologyandbioengineering91:325-337.
11.suwannakhams.2005.代谢工程改造以增强产丙酸丙酸杆菌的丙酸发酵(metabolicengineeringforenhancedpropionicacidfermentationbypropionibacteriumacidipropionici.)dissertation.ohiostateuniversity.
12.tufvessonp.,a.ekman,r.r.r.sardari,k.engdahl,l.tufvesson.2013.使用不同的可再生原料通过发酵生产丙酸的经济和环境评估(economicandenvironmentalassessmentofpropionicacidproductionbyfermentationusingdifferentrenewablerawmaterials.)bioresourcetechnology149:556-564.
13.thierrya.,s.-m.deutsch,h.falentin,m.dalmasso,f.j.cousin,g.jan.2011.费氏丙酸杆菌的生理和代谢的新见解(newinsightsintophysiologyandmetabolismofpropionibacteriumfreudenreichii.)internationaljournaloffoodmicrobiology149:19-27.
14.scholzc.f.p.,m.kilian.2016.皮肤丙酸杆菌的自然历史,以及将丙酸杆菌属中选定的菌种重新分类为提议的acidipropionibacterium新属、cutibacterium新属和pseudopropionibacterium新属(thenaturalhistoryofcutaneouspropionibacteria,andreclassificationofselectedspecieswithinthegenuspropionibacteriumtotheproposednovelgeneragen.nov.,cutibacteriumgen.nov.andpseudopropionibacteriumgen.nov.)internationaljournalofsystematicandevolutionarymicrobiology66:4422-4432.
15.rehbergerj.l.,b.a.glatz.1998.丙酸杆菌培养物对酸和低ph的反应:耐受性和抑制(responseofculturesofpropionibacteriumtoacidandlowph:toleranceandinhibition.)journaloffoodproduction61:211-216.
16.ahmadin.,k.khosravi-darani,a.m.mortazavian.2017.丙酸的生物技术生产概述:从上游到下游过程(anoverviewofbiotechnologicalproductionofpropionicacid:fromupstreamtodownstreamprocesses.)electronicjournalofbiotechnology28:67-75.
17.guann.,l.liu,x.zhug,q.xu,j.li,g.du,j.chen.2012.基因组改组改善了产丙酸丙酸杆菌的耐酸性和丙酸生产(genome-shufflingimprovesacidtoleranceofpropionibacteriumacidipropioniciandpropionicacidproduction.)advancesinchemistryresearch15:143-152.
18.guann.,h.shin,r.r.chen,j.li,l.liu,g.du,j.chen.2014.了解产丙酸丙酸杆菌如何在蛋白质组学水平上应对丙酸胁迫(understandingofhowpropionibacteriumacidipropionicirespondtopropionicacidstressatthelevelofproteomics.)scientificreports4:6951.
19.guann.,h.d.shin,g.du,j.chen,l.liu.2016.酸抗性元素的代谢工程改造以提高詹氏丙酸杆菌的酸抗性和丙酸生产(metabolicengineeringofacidresistanceelementstoimproveacidresistanceandpropionicacidproductionofpropionibacteriumjensenii.)biotechnologyandbioengineering113:1294-304.
20.jiangl.,h.cui,l.zhu,y.hu,x.xu,s.li,h.huang.2015.用固定的产丙酸丙酸杆菌增强从乳清乳糖生产丙酸以及海藻糖合成在耐酸性中的作用(enhancedpropionicacidproductionfromwheylactosewithimmobilizedpropionibacteriumacidipropioniciandtheroleoftrehalosesynthesisinacidtolerance.)greenchemistry15:250-259.
21.ep0141642
22.wo85/04901
23.us2011/0151529a1
24.wo2012/064883a2
25.wo2017/055932a2
- 还没有人留言评论。精彩留言会获得点赞!