用于增加蛋白质表达和/或治疗单倍剂量不足症的方法及组合物
优先权声明
本申请要求2018年9月26日提交的、序列号为62/736,847的美国临时专利申请的优先权,并通过引用将其全部内容合并与此。
本公开内容总体上涉及在受试者中增加由包含非最佳密码子的基因所编码的基因产物的表达和/或治疗受试者单倍剂量不足症的方法及组合物。
背景技术:
当一个等位基因失活,并且由剩余的活性等位基因表达的基因产物量不足以维持正常的基因功能时,就发生单倍剂量不足(haploinsufficiency)。许多疾病与单倍体不足相关,或由单倍剂量不足引起。
单倍剂量不足症的一个例子是dravet综合征。dravet综合征是一种罕见的灾难性顽固性癫痫,始于婴儿期。最初,患者会经历长时间的癫痫发作。第二年,其他类型的癫痫发作开始发生,这通常与发育衰退同时发生,可能是由于反复的大脑缺氧所致。这导致语言和运动机能发育不良。dravet综合征与scn1a(编码电压门控钠通道α亚基)、scn1b(编码电压门控钠通道β1亚基)、scn2a、scn3a、scn9a、gabrg2(编码γ-氨基丁酸受体γ2亚基)、gabrd(编码γ-氨基丁酸受体δ亚基)和/或pcdh19基因的突变相关。
例如,dravet综合征可能由scn1a基因突变引起,该scn1a基因突变导致一个scn1a基因等位基因失活以及功能性scn1a基因产物缺乏或数量减少。scn1a基因通常编码神经元电压门控钠离子通道α亚基na(v)1.1。在小鼠模型中,已观察到scn1a的功能丧失型突变导致钠电流减少和海马gaba能中间神经元兴奋性受损。
因此,本领域需要一种增加蛋白质表达和治疗单倍剂量不足症的改进的组合物及方法,所述单倍剂量不足症包括dravet综合征。
技术实现要素:
本公开总体上涉及增加受试者基因产物的表达和/或治疗受试者单倍剂量不足症的方法及组合物,所述基因产物由包含非最佳密码子的基因进行编码。目的基因中非最佳密码子的存在会导致从该基因转录的mrna的不稳定,从而影响该基因所编码的功能蛋白的产生。在这种情况下,例如,当与非最佳密码子杂交的特定氨酰化trna分子的丰度低于细胞中用相同氨基酸氨酰化的其他不同trna时,就会发生mrna转录物的不稳定。令人惊讶的是,已经发现,相对于其他天然丰度更高的trna,增加细胞中这种trna的丰度可以促进细胞产生的功能蛋白的表达和/或数量。通过将解码基因中非最佳密码子的极少数(如1、2或3个)trna导入细胞,可增加和/或选择性增加基因产物(如蛋白质)的表达(即,该基因产物的表达可以比另一种基因产物或其他任何基因产物增加更多)。
类似地,对于具有包含非最佳密码子基因的受试者,向受试者施用有效量的解码非最佳密码子的trna可以增加受试者中来自该基因的基因产物的表达。因此,向受试者施用trna可以治疗受试者中由基因产物表达不足引起的疾病,例如,单倍剂量不足症。此外,本文描述的方法及组合物的特征使得它们适合治疗人类受试者的疾病,如单倍剂量不足症。例如,trna的大小相对较小,并且可以重组产生,并且本文所述的方法及组合物可以治疗单倍剂量不足症,而无论是突变或是等位基因失活的机制。
因此,一方面,本公开提供了一种增加哺乳动物细胞中由含有第一非最佳密码子的基因所编码的基因产物的表达的方法。所述方法包括向细胞中导入有效量的第一外源性trna,所述第一外源性trna:(i)包含与第一非最佳密码子杂交的反密码子,(ii)能够被氨基酸氨酰化,其中,相对于缺乏第一外源性trna的类似细胞,将第一外源性trna导入细胞增加了基因产物的表达。
在某些实施方案中,所述基因包含第二非最佳密码子,并且所述方法还包括将有效量的第二外源性trna导入细胞,所述第二外源性trna:(i)包含与第二非最佳密码子杂交的反密码子,(ii)能够被氨基酸氨酰化,其中,相对于缺乏第二外源性trna的类似细胞,将第二外源性trna导入细胞增加了基因产物的表达。在某些实施方案中,所述基因包含第三非最佳密码子,并且所述方法还包括将有效量的第三外源性trna导入细胞,所述第三外源性trna:(i)包含与第三非最佳密码子杂交的反密码子,(ii)能够用氨基酸氨酰化,其中,相对于缺乏第三外源性trna的类似细胞,将第三外源性trna导入细胞增加了基因产物的表达。
另一方面,本公开提供了一种增加哺乳动物细胞中由含有第一非最佳密码子的基因所编码的基因产物的表达的方法。所述方法包括向细胞中导入有效量的能够表达第一外源性trna的第一表达载体,所述第一外源性trna:(i)包含与第一非最佳密码子杂交的反密码子,(ii)能够被氨基酸氨酰化,其中,相对于缺乏第一外源性trna的类似细胞,第一外源性trna在细胞中的表达增加了基因产物的表达。
在某些实施方案中,所述基因包含第二非最佳密码子,并且所述方法还包括将有效量的能够表达第二外源性trna的第二表达载体导入细胞,所述第二外源性trna:(i)包含与第二非最佳密码子杂交的反密码子,(ii)能够被氨基酸氨酰化,其中,相对于缺乏第二外源性trna的类似细胞,第二外源性trna在细胞中的表达增加了基因产物的表达。在某些实施方案中,所述基因包含第三非最佳密码子,并且所述方法还包括将有效量的能够表达第三外源性trna的第三表达载体导入细胞,所述第三外源性trna:(i)包含与第三非最佳密码子杂交的反密码子,(ii)能够被氨基酸氨酰化,其中,相对于缺乏第三外源性trna的类似细胞,第三外源性trna在细胞中的表达增加了基因产物的表达。
在某些实施方案中,第一表达载体、第二表达载体和/或第三表达载体是相同的。在某些实施方案中,第一表达载体、第二表达载体和/或第三表达载体是病毒载体,例如,腺相关病毒(aav)载体。
在前述增加表达的任何方法的实施方案中,所述细胞是人类细胞。在某些实施方案中,所述细胞是中枢神经系统细胞,例如,神经元。
在某些实施方案中,所述基因选自aggf1、arhgap31、bmpr2、chd7、col2a1、col3a1、ctla4、ctnnb1、dll4、ehmt1、eln、eng、fas、fbn1、foxg1、gata3、gli3、grn、irf6、jag1、kcnq4、lmx1b、mbd5、med13l、mitf、mnx1、mycn、nfia、nfix、notch1、nsd1、pax3、phip、prkar1a、rai1、rbpj、rps14、runx2、sall4、scn1a、setbp1、shank3、shh、shox、slc2a1/glut1、sox10、syngap1、tbx1、tbx3、tbx5、tcf4、tcof1、tgif1、tnxb、trps1、wt1和zic2。在某些实施方案中,所述基因是scn1a。
另一方面,本公开提供了一种治疗有需要的受试者的单倍剂量不足症的方法,其中所述受试者具有包含第一非最佳密码子的单倍剂量不足基因。所述方法包括向受试者施用有效量的第一trna,所述第一trna:(i)包含与第一非最佳密码子杂交的反密码子,(ii)能够被氨基酸氨酰化,从而治疗受试者的单倍剂量不足症。
在某些实施方案中,单倍剂量不足基因包含第二非最佳密码子,并且所述方法还包括向受试者施用有效量的第二trna,所述第二trna:(i)包含与第二非最佳密码子杂交的反密码子,(ii)能够被氨基酸氨酰化。在某些实施方案中,单倍剂量不足基因包含第三非最佳密码子,并且所述方法还包括向受试者施用有效量的第三trna,所述第三trna:(i)包含与第三非最佳密码子杂交的反密码子,(ii)能够被氨基酸氨酰化。
另一方面,本公开提供了一种治疗有需要的受试者的单倍剂量不足症的方法,其中所述受试者具有包含第一非最佳密码子的单倍剂量不足基因。所述方法包括向受试者施用有效量的能够表达第一trna的第一表达载体,所述第一trna:(i)包含与第一非最佳密码子杂交的反密码子,(ii)能够被氨基酸氨酰化,从而治疗受试者的单倍剂量不足症。
在某些实施方案中,单倍剂量不足基因包含第二非最佳密码子,并且所述方法还包括向受试者施用有效量的能够表达第二trna的第二表达载体,所述第二trna:(i)包含与第二非最佳密码子杂交的反密码子,(ii)能够被氨基酸氨酰化。在某些实施方案中,单倍剂量不足基因包含第三非最佳密码子,并且所述方法还包括向受试者施用有效量的能够表达第三trna的第三表达载体,所述第三trna:(i)包含与第三非最佳密码子杂交的反密码子,(ii)能够被氨基酸氨酰化。
在某些实施方案中,第一表达载体、第二表达载体和/或第三表达载体是相同的。在某些实施方案中,第一表达载体、第二表达载体和/或第三表达载体是病毒载体,例如,腺相关病毒(aav)载体。
在任何前述治疗方法的实施方案中,所述受试者是人。
在某些实施方案中,单倍剂量不足症选自5q综合征、adams-oliver综合征1、adams-oliver综合征3、adams-oliver综合征5、adams-oliver综合征6、alagille综合征1、自身免疫性淋巴增生综合征ia型、自身免疫性淋巴增生综合征v型、常染色体显性耳聋-2a、伴或不伴输尿管缺陷的脑畸形(brmutd)、卡尼氏复合症1型、charge综合征、锁骨颅骨发育不全综合征、currarino综合征、丹尼斯-德拉什综合征/弗雷泽综合征、发育迟缓、智力障碍、肥胖和畸形综合征(didod)、digeorge综合征(tbx1相关)、dravet综合征、duane-radialray综合征、ehlers-danlos综合征(经典型)、ehlers-danlos综合征(血管型)、feingold综合征1、grn相关的tdp43包裹体(ftld-tdp)额颞叶变性、glut1缺乏综合征、greig头-指综合征、遗传性出血性毛细血管扩张1型、全前脑畸形3、全前脑畸形4、全前脑畸形5、holt-oram综合征、甲状旁腺功能减退、感音神经性耳聋和肾病(hdr)、kleefstra综合征1、klippel-trenaunay综合征(aagf相关)、leri-weil软骨骨病、马方综合征、伴或不伴心脏缺陷的精神发育迟缓症状体征(mrfacd)、常染色体显性智力低下1型、常染色体显性智力低下19型、常染色体显性智力低下29型、nail-patella综合征(nps)、phelan–mcdermid综合征、pitt-hopkins综合征、原发性肺动脉高压1、rett综合征(先天性变异)、smith-magenis综合征(rai1相关)、sotos综合征1、sotos综合征2、stickler综合症i型、主动脉瓣上狭窄、syngap1相关智力障碍、treachercollins综合征、trichorhinophalangeal综合征i型、ulnar-mammary综合征、vanderwoude综合征1、waardenburg综合征1型、waardenburg综合征2a型和waardenburg综合征4c型。在某些实施例中,单倍剂量不足症是dravet综合征。
在某些实施方案中,单倍剂量不足基因选自aggf1、arhgap31、bmpr2、chd7、col2a1、col3a1、ctla4、ctnnb1、dll4、ehmt1、eln、eng、fas、fbn1、foxg1、gata3、gli3、grn、irf6、jag1、kcnq4、lmx1b、mbd5、med13l、mitf、mnx1、mycn、nfia、nfix、notch1、nsd1、pax3、phip、prkar1a、rai1、rbpj、rps14、runx2、sall4、scn1a、setbp1、shank3、shh、shox、slc2a1/glut1、sox10、syngap1、tbx1、tbx3、tbx5、tcf4、tcof1、tgif1、tnxb、trps1、wt1和zic2。在某些实施方案中,单倍剂量不足基因是scn1a。
在某些实施方案中,单倍剂量不足症是下文表1或表2中列出的疾病,单倍剂量不足基因是列于下文表1或表2的相应行中列出的基因。
在某些实施方案中,所述方法还包括向受试者施用
在前述任何方法的实施方案中,所述基因是列于下文表1或表2中的基因,第一、第二和/或第三非最佳密码子是列于下文表1或表2的相应行中的密码子。在某些实施方案中,单倍剂量不足症是下文表1或表2中列出的疾病,并且第一、第二和/或第三非最佳密码子是下文表1或表2的相应行中列出的密码子。
在前述任何方法的实施方案中,第一、第二和/或第三非最佳密码子选自ata、gta和aga。
在任何前述方法的实施方案中,第一、第二和/或第三trna选自包含seqidno:1、seqidno:2和seqidno:3的核苷酸序列的trna。在某些实施方案中,第一、第二和/或第三表达载体包含选自seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10和seqidno:11的核苷酸序列。
另一方面,本公开提供了包含编码第一、第二和/或第三trna的核酸的表达载体,所述第一、第二和/或第三trna:(i)包含与第三非最佳密码子杂交的反密码子,(ii)能够被氨基酸氨酰化。在某些实施方案中,表达载体包含seqidno:1、seqidno:2和/或seqidno:3的核苷酸序列。在某些实施方案中,表达载体包含seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10和/或seqidno:11的核苷酸序列。在某些实施方案中,表达载体是病毒载体,例如,dna病毒载体,如腺相关病毒(aav)载体。另一方面,本公开提供了包含任何前述表达载体和药学上可接受的赋形剂的药物组合物。
在下面的具体实施方式和权利要求中描述了本发明的这些方面以及其他方面和特征。
附图说明
参考以下附图,可以更全面地理解本发明。
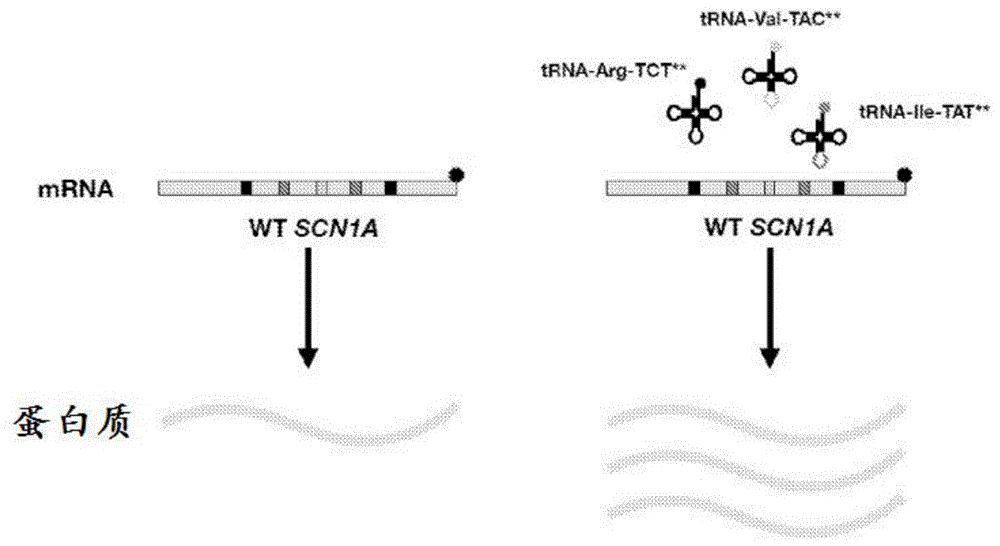
图1是含有非最佳密码子的scn1amrna转录物的示意图,所述非最佳密码子使mrna转录物不稳定。非最佳密码子在灰色转录物中显示为较暗的区域。所指示的trna的表达使mrna转录物稳定并促进了蛋白质表达的增加。
图2a为一个共有的trna二级结构。残基的编号基于steinberg等人于《核酸研究》21:3011-15(1993)中描述的trna编号系统。图2b是显示来自某些真核生物细胞质的trna序列的修饰图的表格。表中的比值表示在图2a所示的编号位置上所列核苷酸的出现频率。修饰残基的缩写为motorin等人在“transferrnamodification”(《生命科学百科全书》,johnwily&sons,inc,2005)中的定义。
图3示出了表达trnaata、trnagta和trnaaga后hek293细胞中scn1a和gapdhmrna水平的定量。通过δδct方法计算相对于表达scn1a但不表达trna的细胞的指示值。+表示每个trna的100ngdna;++表示每个trna的200ngdna;+++表示每个trna300ngdna。
具体实施方式
本公开总体上涉及在受试者增加由包含非最佳密码子的基因所编码的基因产物的表达和/或治疗受试者单倍剂量不足症的方法及组合物。目的基因中非最佳密码子的存在会导致从该基因转录的mrna的不稳定,从而影响由该基因编码的功能蛋白的产生。在这种情况下,例如,当与非最佳密码子杂交的特定氨酰化trna分子的丰度低于细胞中用相同氨基酸氨酰化的其他不同trna时,就会发生trna转录物的不稳定。在不希望被理论所束缚的情况下,据信,由于特定trna的丰度较低,在蛋白质合成过程中,那些可用的trna到达核糖体并被核糖体吸收可能比其它丰度高的trna花费更长的时间,这反过来会在该位置引入必需氨基酸的过程中造成蛋白质合成的滞后。蛋白质合成速率的滞后被认为诱导了相应的mrna转录物的不稳定,这可能导致由mrna转录物编码的蛋白质合成量的减少。已经发现,相对于其它天然的、丰度更高的trna,增加细胞中这种trna的丰度,可以促进细胞产生的功能蛋白的表达和/或数量。
通过将解码基因中非最佳密码子的极少数(如1、2或3个)trna导入细胞,可增加和/或选择性增加基因产物(即引起基因表达的产物,如该基因编码的mrna转录物、该基因编码的蛋白质等)的表达。
类似地,对于具有包含非最佳密码子的基因的受试者,向受试者施用有效量的解码非最佳密码子的trna可以增加受试者中来自该基因的基因产物的表达。因此,向受试者施用trna可以治疗受试者中由基因产物表达不足引起的疾病,例如,单倍剂量不足症。此外,本文所述的方法及组合物的特征使得它们适用于治疗人类受试者的疾病,如单倍剂量不足症。例如,trna的大小相对较小,并且可以重组产生,并且本文所述的方法及组合物可以治疗单倍剂量不足症,而无论是突变或是等位基因失活的机制。
因此,一方面,本公开提供了一种增加哺乳动物细胞中由含有第一非最佳密码子的基因所编码的基因产物的表达的方法。所述方法包括向细胞中导入有效量的第一外源性trna,所述第一外源性trna:(i)包含与第一非最佳密码子杂交的反密码子,(ii)能够被氨基酸氨酰化,其中,相对于缺乏第一外源性trna的类似细胞,将第一外源性trna导入细胞增加了基因产物的表达。
另一方面,本公开提供了一种增加哺乳动物细胞中由含有第一非最佳密码子的基因所编码的基因产物的表达的方法。所述方法包括向细胞中导入有效量的能够表达第一外源性trna的第一表达载体,所述第一外源性trna:(i)包含与第一非最佳密码子杂交的反密码子,(ii)能够被氨基酸氨酰化,其中,相对于缺乏第一外源性trna的类似细胞,第一外源性trna在细胞中的表达增加了基因产物的表达。
进一步预期,在任何前述方法中,基因可以包含额外的非最佳密码子(例如第二、第三、第四、第五、第六、第七、第八、第九或第十非最佳密码子),并且所述方法还可以包括向细胞中导入有效量的额外外源性trna或表达载体(例如,第二、第三、第四、第五、第六、第七、第八、第九或第十外源性trna或表达载体),以增加基因产物的表达。
例如,在某些实施方案中,如果基因含有第二和/或第三非最佳密码子,所述方法还包括将有效量的第二和/或第三外源性trna导入细胞,所述第二和/或第三外源性trna:(i)包含与第二和/或第三非最佳密码子杂交的反密码子,(ii)能够用氨基酸氨酰化,其中,相对于缺乏第二和/或第三外源性trna的类似细胞,将第二和/或第三外源性trna导入细胞增加了基因产物的表达。在某些实施方案中,如果基因含有第二和/或第三非最佳密码子,所述方法还包括向细胞中导入有效量的能够表达第二和/或第三外源性trna的第二和/或第三表达载体,所述第二和/或第三外源性trna:(i)包含与第二和/或第三非最佳密码子杂交的反密码子,(ii)能够用氨基酸氨酰化,其中,相对于缺乏第二和/或第三外源性trna的类似细胞,第二和/或第三外源性trna在细胞中的表达增加了基因产物的表达。
在某些实施方案中,相对于缺乏外源性trna的细胞、组织或受试者,所述方法将细胞、组织或受试者中基因产物的表达增加了至少约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约100%、约110%、约120%、约130%、约140%、约150%、约160%、约170%、约180%、约190%、约200%、约250%、约300%、约350%、约400%、约450%、约500%、约600%、约700%、约800%、约900%、约1000%或更多。在某些实施方案中,相对于缺乏外源性trna的细胞、组织或受试者,所述方法将细胞、组织或受试者中基因产物的表达增加约20%至约200%、约20%至约180%、约20%至约160%、约20%至约140%、约20%至约120%、约20%至约100%、约20%至约80%、约20%至约60%、约20%至约40%、约40%至约200%、约40%至约180%、约40%至约160%、约40%至约140%、约40%至约120%、约40%至约100%、约40%至约80%、约40%至约60%、约60%至约200%、约60%至约180%、约60%至约160%、约60%至约140%、约60%至约120%、约60%至约100%、约60%至约80%、约80%至约200%、约80%至约180%、约80%至约160%、约80%至约140%、约80%至约120%、约80%至约100%、约100%至约200%、约100%至约180%、约100%至约160%、约100%至约140%、约100%至约120%、约120%至约200%、约120%至约180%、约120%至约160%、约120%至约140%、约140%至约200%、约140%至约180%、约140%至约160%、约160%至约200%、约160%至约180%、或约180%至约200%。在某些实施方案中,相对于缺乏外源性trna的细胞、组织或受试者,所述方法将细胞、组织或受试者中基因产物的表达增加约100%至约1000%、约100%至约900%、约100%至约800%、约100%至约700%、约100%至约600%、约100%至约500%、约100%至约400%、约100%至约300%、约100%至约200%、约200%至约1000%、约200%至约900%、约200%至约800%、约200%至约700%、约200%至约600%、约200%至约500%、约200%至约400%、约200%至约300%、约300%至约1000%、约300%至约900%、约300%至约800%、约300%至约700%、约300%至约600%、约300%至约500%、约300%至约400%、约400%至约1000%、约400%至约900%、约400%至约800%、约400%至约700%、约400%至约600%、约400%至约500%、约500%至约1000%、约500%至约900%、约500%至约800%、约500%至约700%、约500%至约600%、约600%至约1000%、约600%至约900%、约600%至约800%、约600%至约700%、约700%至约1000%、约700%至约900%、约700%至约800%、约800%至约1000%、约800%至约900%、或约900%至约1000%。基因产物或蛋白质表达可以通过本领域已知的任何方法来测量,例如蛋白印迹(westernblot)或酶联免疫吸附试验(elisa)。
在某些实施方案中,相对于缺乏外源性trna的类似细胞、组织或受试者,所述方法增加了由所述基因编码的基因转录物(mrna)在细胞、组织或受试者中的稳定性。例如,在某些实施方案中,相对于缺乏外源性trna的类似细胞、组织或受试者,所述方法使细胞、组织或受试者中的mrna稳定性增加至少约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约100%、约110%、约120%、约130%、约140%、约150%、约160%、约170%、约180%、约190%、约200%、约250%、约300%、约350%、约400%、约450%、约500%、约600%、约700%、约800%、约900%、约1000%或更多。在某些实施方案中,相对于缺乏外源性trna的类似细胞、组织或受试者,所述方法将细胞、组织或受试者中的mrna稳定性增加约20%至约200%、约20%至约180%、约20%至约160%、约20%至约140%、约20%至约120%、约20%至约100%、约20%至约80%、约20%至约60%、约20%至约40%、约40%至约200%、约40%至约180%、约40%至约160%、约40%至约140%、约40%至约120%、约40%至约100%、约40%至约80%、约40%至约60%、约60%至约200%、约60%至约180%、约60%至约160%、约60%至约140%、约60%至约120%、约60%至约100%、约60%至约80%、约80%至约200%、约80%至约180%、约80%至约160%、约80%至约140%、约80%至约120%、约80%至约100%、约100%至约200%、约100%至约180%、约100%至约160%、约100%至约140%、约100%至约120%、约120%至约200%、约120%至约180%、约120%至约160%、约120%至约140%、约140%至约200%、约140%至约180%、约140%至约160%、约160%至约200%、约160%至约180%、或约180%至约200%。在某些实施方案中,相对于缺乏外源性trna的类似细胞、组织或受试者,所述方法将细胞、组织或受试者中的mrna稳定性提高了约100%至约1000%、约100%至约900%、约100%至约800%、约100%至约700%、约100%至约600%、约100%至约500%、约100%至约400%、约100%至约300%、约100%至约200%、约200%至约1000%、约200%至约900%、约200%至约800%、约200%至约700%、约200%至约600%、约200%至约500%、约200%至约400%、约200%至约300%、约300%至约1000%、约300%至约900%、约300%至约800%、约300%至约700%、约300%至约600%、约300%至约500%、约300%至约400%、约400%至约1000%、约400%至约900%、约400%至约800%、约400%至约700%、约400%至约600%、约400%至约500%、约500%至约1000%、约500%至约900%、约500%至约800%、约500%至约700%、约500%至约600%、约600%至约1000%、约600%至约900%、约600%至约800%、约600%至约700%、约700%至约1000%、约700%至约900%、约700%至约800%、约800%至约1000%、约800%至约900%、或约900%至约1000%。基因转录物或mrna稳定性可以通过本领域已知的任何方法来测量,例如northern印迹。
在某些实施方案中,细胞是人类细胞。在某些实施方案中,细胞是中枢神经系统细胞,例如,神经元。
在某些实施方案中,所述基因选自aggf1、arhgap31、bmpr2、chd7、col2a1、col3a1、ctla4、ctnnb1、dll4、ehmt1、eln、eng、fas、fbn1、foxg1、gata3、gli3、grn、irf6、jag1、kcnq4、lmx1b、mbd5、med13l、mitf、mnx1、mycn、nfia、nfix、notch1、nsd1、pax3、phip、prkar1a、rai1、rbpj、rps14、runx2、sall4、scn1a、setbp1、shank3、shh、shox、slc2a1/glut1、sox10、syngap1、tbx1、tbx3、tbx5、tcf4、tcof1、tgif1、tnxb、trps1、wt1和zic2。在某些实施方案中,所述基因是scn1a。
在某些实施方案中,所述方法基本上不增加来自内参基因的基因产物的表达。例如,在某些实施方案中,所述方法使来自内参基因的基因产物的表达增加少于约5%、约10%、约20%、约30%、约40%或约50%。在某些实施方案中,未检测到内参基因表达的增加。在某些实施方案中,内参基因选自gapdh、bad和trappc6a。在某些实施方案中,内参基因是gapdh。
在某些实施方案中,其中,所述基因是scn1a基因,相对于缺乏外源性trna的类似细胞、组织或受试者,所述方法将细胞、组织或受试者中的电压门控钠通道活性增加至少约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约100%、约110%、约120%、约130%、约140%、约150%、约160%、约170%、约180%、约190%、约200%、约250%、约300%、约350%、约400%、约450%、约500%、约600%、约700%、约800%、约900%、约1000%或更多。在某些实施方案中,相对于缺乏外源性trna的类似细胞、组织或受试者,所述方法将细胞、组织或受试者中的电压门控钠通道活性增加约20%至约200%、约20%至约180%、约20%至约160%、约20%至约140%、约20%至约120%、约20%至约100%、约20%至约80%、约20%至约60%、约20%至约40%、约40%至约200%、约40%至约180%、约40%至约160%、约40%至约140%、约40%至约120%、约40%至约100%、约40%至约80%、约40%至约60%、约60%至约200%、约60%至约180%、约60%至约160%、约60%至约140%、约60%至约120%、约60%至约100%、约60%至约80%、约80%至约200%、约80%至约180%、约80%至约160%、约80%至约140%、约80%至约120%、约80%至约100%、约100%至约200%、约100%至约180%、约100%至约160%、约100%至约140%、约100%至约120%、约120%至约200%、约120%至约180%、约120%至约160%、约120%至约140%、约140%至约200%、约140%至约180%、约140%至约160%、约160%至约200%、约160%至约180%、或约180%至约200%。电压门控钠通道活性可以通过本领域已知的任何方法来测量,例如,kalume等,(2007)j.neurosci.27(41):11065-74;yu等,(2007)nat.neurosci.9(9):1142-9;和han等(2012)nature489(7416):385-390。
在某些实施方案中,单倍剂量不足症是表1或表2中列出的疾病,单倍剂量不足基因是表1或表2的相应行中列出的基因。在某些实施方案中,所述基因是表1或表2中列出的基因,第一、第二和/或第三非最佳密码子是表1或表2的相应行中列出的密码子。在某些实施方案中,单倍剂量不足症是表1或表2中列出的疾病,第一、第二和/或第三非最佳密码子是表1或表2的相应行中列出的密码子。
表1
表2
在某些实施方案中,单倍剂量不足症是下表4、5、6或7中任一项所列的疾病,以及与每种疾病相关的单倍剂量不足基因。在某些实施方案中,所述基因是表4、5、6或7中列出的基因,第一、第二和/或第三非最佳密码子是表4、5、6或7的相应行中列出的密码子。在某些实施方案中,单倍剂量不足症是表4、5、6或7中列出的疾病,第一、第二和/或第三非最佳密码子是表4、5、6或7的相应行中列出的密码子。表4和表5分别示出了根据密码子使用百分比和trna适应性指数(tai)计算出的指定基因中三个和十个最不理想和最优的密码子。表6和表7分别示出了在指定基因中三个和十个最不理想和最优的密码子,这是基于密码子使用百分比和基于hek293细胞中trna水平的直接定量而不是基于trna基因拷贝数的trna水平估计的修正tai值计算的。
ii、解码非最佳密码子的转运rna
a、转运rna
在蛋白质合成期间,trna将氨基酸递送至核糖体,插入到正在合成的蛋白质(多肽)链中。trna的长度通常约为70至100个核苷酸。活性trna含有3'cca序列,可以在合成过程中转录到trna中,也可以在转录后处理过程中添加。在氨酰化过程中,连接到给定trna分子上的氨基酸共价连接到3'-末端核糖的2'或3'羟基上,形成氨酰化trna(aa-trna)。可以理解,氨基酸可以自发地从2'-羟基迁移到3'-羟基,反之亦然,但氨基酸从3'-羟基位置被插入到核糖体上正在合成的蛋白质链中。折叠的aa-trna分子另一端的环包含由三个碱基组成的序列,称为反密码子。当这种反密码子序列与核糖体结合的mrna转录物中互补的三碱基密码子序列杂交或碱基配对时,aa-trna与核糖体结合,其氨基酸被整合到由核糖体合成的多肽链中。由于所有与特定密码子碱基配对的trna都被特定的氨基酸氨酰化的,因此遗传密码的翻译受到trna的影响。mrna中的61个非终止密码子中的每一个均指导其同源aa-trna的结合,并向由核糖体合成的正在合成的蛋白质或多肽链添加单一特定的氨基酸。
trna通常是高度保守的,并且通常跨物种发挥功能。因此,来源于细菌trna、非哺乳动物真核trna或哺乳动物(例如,人)trna可用于本文所述的组合物及方法。编码天然存在的人trna的核苷酸序列是已知的,并且本领域技术人员通常可通过诸如基因库之类的来源获得。另请参见sprinzl等人,(2005)nucleicacidsres.33:d139-40;buckland等人,(1996)genomics35(1):164-71;schimmel等人,(eds.)(1979)“transfer-rna:structure,properties,andrecognition”,coldspringharborlaboratory;agris(1983)"themodifiednucleosidesoftransferrna,ii,”alanr.lissinc。trna通常是高度保守的,并且通常跨物种发挥功能。
在某些实施方案中,trna被氨酰化或者能够被任何天然氨基酸氨酰化。例如,trna可能能够被丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸氨酰化。在某些实施方案中,氨基酸选自丝氨酸和精氨酸。
在某些实施方案中,trna包含seqidno:1、seqidno:2或seqidno:3的核苷酸序列,或与seqidno:1、seqidno:2或seqidno:3的核苷酸序列具有80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同源性。
序列同源性可以以本领域技术人员已知的各种方式来确定,例如,使用公开的计算机软件,如blast、blast-2、align或magign(dnastar)软件。使用blastp、blastn、blastx、tblastn和tblastx程序使用的算法(karlin等人,(1990)proc.natl.acad.sci.usa87:2264-2268;altschul,(1993)j.mol.evol.36,290-300;altschul等人,(1997)nucleicacidsres.25:3389-3402,通过引用并入本文)进行blast(基本局部比对搜索工具)分析,以进行序列相似性搜索。关于搜索序列数据库中的基本问题的讨论,请参见altschul等人,(1994),naturegenetics,6:119-129,并通过引用将其并入本文。本领域技术人员可以确定用于测量比对的合适参数,包括在被比较序列的全长上实现最大比对所需的任何算法。直方图、说明、比对、期望值(即,根据数据库序列报告匹配的统计显著性阈值)、临界值、矩阵和过滤器的搜索参数为默认设置。blastp、blastx、tblastn和tblastx使用的默认评分矩阵是blosum62矩阵(henikoff等人,(1992)proc.natl.acad.sci.usa89:10915-10919,通过引用并入本文)。四个blastn参数可以调整如下:q=10(间隙产生罚分);r=10(间隙扩展罚分);wink=1(在查询的每个wink.sup.th位置生成单词命中量);和gapw=16(设置产生间隙对齐的窗口宽度)。等效的blastp参数设置可以为q=9、r=2、wink=1和gapw=32。也可以使用ncbi(国家生物技术信息中心)blast高级选项参数进行搜索(例如:-g,间隙产生成本[整数]:核苷酸默认值=5/蛋白质默认值=11;-e,间隙扩展代价[整数]:默认值=2(核苷酸)/1(蛋白质);-q,核苷酸错配罚分[整数]:默认值=-3;-r,核苷酸匹配奖励[整数]:默认值=1;-e,期望值[实数]:默认值=10;-w,字长[整数]:默认值=11(核苷酸)/28(megablast)/3(蛋白质);-y,以bit为单位的blast扩展的dropoff(x):默认值=20(blastn)/7(其他);-x,x间隙对齐的衰减值(以bit为单位):默认值=15(所有程序),不适用于blastn;-z,间隙对齐的最终x下降值(以bit为单位):blast为50,其他为25)。也可以使用用于成对蛋白质比对的clustalw(默认参数可能包括,例如blosum62矩阵、间隙产生罚分=10和间隙扩展罚分=0.1)。序列之间的最佳匹配比对,在gcg软件包10.0版中可用,应用dna参数gap=50(间隙产生罚分)和len=3(间隙扩展罚分),蛋白质比对中的等效设置是gap=8和len=2。
预期trna可以包含一个或多个修饰。修饰的trna的实例包括:酰化的trna;烷基化trna;含有一个或多个腺嘌呤、胞嘧啶、鸟嘌呤或尿嘧啶以外的碱基的trna;通过附着特异性配体或抗原、荧光、亲和力、反应性、光谱或其他探针部分而共价修饰的trna;含有一个或多个被甲基化或其他方式修饰的核糖部分的trna;用20种天然氨基酸以外的氨基酸进行氨酰化的aa-trnas,包括作为试剂、特异性配体的载体或作为抗原、荧光、反应性、亲和力、光谱或其他探针的非天然氨基酸;或者这些组合物的任意组合。修饰的trna分子的实例包括:索尔等人,(1995)“trna:structure,biosynthesis,andfunction,”asmpress;elyacoubi等人,(2012)annu.rev.genet.46:69-95;grosjean等人,(1998)“modificationandeditingofrna”asmpress;hendrickson等人,(2004)annu.rev.biochem.73:147-176,2004;ibba等人,(2000)annu.rev.biochem.69:617-650;johnson等人,(1995)coldspringharborsymp.quant.biol.60:71-82;johnson等人,(1982)j.mol.biol.156:113-140;crowley等人,(1994)cell78:61-71;beier等人,(2001)nucleicacidsres.29:4767-4782;torres等人,(2014)trendsmol.med.20:306-314和bjork等人,(1987)annu.rev.biochem.56:263-287。
在某些实施方案中,trna包含天然存在的核苷酸修饰物。天然存在的trna含有多种转录后修饰的核苷酸,例如在machnicka等人(2014)rnabiology11(12):1619-1629中进行了描述,如图2b所示包括一个或多个残基。在某些实施方案中,trna包含选自以下的一个或多个的残基:0位的2'-o-甲基鸟苷或g;1位的假尿苷或u;4位的2'-o-甲基腺苷、a、2'-o-甲基尿苷、u、2'-o-甲基胞苷、c、2'-o-甲基鸟苷或g;6位的n2-甲基鸟苷或g;7位的n2-甲基鸟苷或g;9位的1-甲基腺苷、a、1-甲基鸟苷、g或修饰的g;10位的n2-甲基鸟苷或g;12位的n4-乙酰胞苷或c;13位的假尿苷、u、2'-o-甲基胞苷或c;14位的1-甲基腺苷、a或修饰的a;16位的二氢尿苷(d)或u;17位的d或u;18位的2'-o-甲基鸟苷或g;20位的3-(3-氨基-3-羧丙基)尿苷;20a位的3-(3-氨基-3-羧丙基)尿苷、d、假尿苷、u、或修饰的u;20b位的d、假尿苷或u;25位的假尿苷或u;26位的假尿苷、u、n2,n2-二甲基鸟苷、n2-甲基鸟苷或修饰的g;27位的假尿苷、u、n2,n2-二甲基鸟苷或g;28位的假尿苷或u;30位的假尿苷或u;31位的假尿苷或u;32位的2'-o-甲基假尿苷、2'-o-甲基尿苷、假尿苷、u、2'-o-甲基胞苷、3-甲基胞苷、c、或修饰的c;34位的肌苷、a、2-硫尿苷、2'-o-甲基尿苷、5-(羧羟甲基)尿苷甲酯、5-氨基甲酰甲基尿苷、5-羧甲基氨基甲基-2'-o-甲基尿苷、5-甲氧羰基甲基-2-硫尿苷、5-甲氧羰基甲基尿苷、假尿苷、u、修饰的u、2'-o-甲基胞苷、5-甲酰基-2'-o-甲基胞苷、5-甲基胞苷、c、修饰的c、喹啉、甘露糖基-喹啉、半乳糖基-喹啉、2'-o-甲基鸟苷或g;35位的假尿苷或u;36位的假尿苷、u、或修饰的u;37位的1-甲基肌苷、2-甲硫基-n6-苏氨酰氨甲酰腺苷、n6-异戊烯基腺苷、n6-甲基-n6-苏氨酰氨甲酰腺苷、n6-苏氨酰氨甲酰腺苷、a、修饰的a、1-甲基鸟苷、过氧wybutosine、wybutosine、g或修饰的g;38位的假尿苷、u、5-甲基胞苷、c或修饰的c;39位的1-甲基假尿苷、2'-o-甲基假尿苷、2'-o-甲基尿苷、假尿苷、u、2'-o-甲基鸟苷或g;40位的假尿苷、u、5-甲基胞苷或c;44位的2'-o-甲基尿苷、u、或修饰的u;e11位假尿苷或u;e12位的假尿苷或u;e14位的假尿苷或u;e2位的3-甲基胞苷或c;第46位的7-甲基鸟苷或g;47位的d、u、或修饰u;48位的d、u、5-甲基胞苷、c、或修饰c;49位的a、修饰的a、5-甲基胞苷、c、或修饰的c;50位的假尿苷、u、5-甲基胞苷或c;54位的5,2'-o-二甲基尿苷、5-甲基尿苷、假尿苷或u;55位的假尿苷或u;58位的1-甲基腺苷、a或修饰的a;64位的2'-o-核糖基腺苷(磷酸盐)、a、2'-o-核糖基鸟苷(磷酸盐)、g、或修饰g;65位的假尿苷或u;67位的假尿苷、u、n2-甲基鸟苷或g;68位的假尿、苷或u;和72位的假尿苷、u、5-甲基胞苷、或c。残基的编号依据steinberg等人于nucleicacidsres.21:3011-15(1993)中描述的trna编号系统。
在某些实施方案中,trna包含一种或多种选自5-甲基尿苷、假尿苷、二氢尿苷和1-甲基腺苷的核苷酸修饰。
b、非最佳密码子
用于本文所述的组合物及方法中的trna包含与非最佳密码子杂交的反密码子。
蛋白质合成由遗传密码控制,遗传密码包括61个三碱基对密码子和3个终止蛋白质合成的三碱基对密码子(称为终止密码子)。遗传密码的简并性是基于编码20个氨基酸的61个三碱基对密码子组合的数学结果。同义密码子是指编码相同氨基酸的三碱基对密码子。通常认为同义密码子替换是沉默的,对基因表达或产生的功能基因产物的数量没有影响。然而,似乎同义密码子被翻译装置差异化识别。这个概念被称为密码子优化。从概念上讲,密码子优化反映了氨酰化trna分子的供应量和参与翻译的密码子浓度需求之间的平衡。因此,由于核糖体的同源trna相对更丰富,它们很快解码一些密码子,由于其他密码子的trna浓度相对较少而读取更慢(tuller等人,(2010)cell,141(2):344-54;novoa等人,(2012)trendsgenet,28(11):574-81)。此外,密码子优化在某种程度上基于trna反密码子/密码子相互作用的准确性,这可以影响解码率(akashi(1994)genetics136(3):927-35;drummond等人,(2008)cell134(2):341-52)。
基因转录物中密码子的优化会影响mrna转录物的稳定性和核糖体翻译mrna转录物的速率已被证明(presnyak等人,(2015),cell,160(6):1111-24;radhakrishnan等人,(2016)cell,167(1):122-132)。因此,如本文所用,术语“非最佳密码子”是指mrna转录物中的密码子,所述密码子被细胞中丰度低的trna识别,而不同的trna识别相同氨基酸的另一个密码子。通常,用编码相同氨基酸的不同密码子替换非最佳密码子(即,同义密码子),但被细胞中丰度高的trna读取,增加了mrna转录物的稳定性和/或核糖体翻译mrna转录物的速率。因此,非最佳密码子是其同源trna的过表达能增强了mrna稳定性、丰度和/或翻译延伸(translationalelongation)的任何密码子。
密码子优化性可以通过以下一种或多种方法来测量或量化,包括trna适应指数(tai)、归一化翻译效率(nte)、物种特异性trna适应指数(sti)、密码子适应指数(cai)、gcai和密码子存在与mrna稳定性相关系数(csc)。
tai是对每个密码子的密码子优化性的评估,它考虑了对trna细胞浓度(基于trna基因拷贝数)和解码效率的估计。例如,dosreis等人,(2004)nucleicacidsres.32(17):5036–5044,与mahlab等人,(2014)ploscomput.biol.10(1):e1003294对tai进行了描述。在某些实施方案中,非最佳密码子的tai值小于给定物种(例如人类)所有密码子的中间tai值。
在某些实施方案中,由tai确定的非最佳密码子的值为0.47或更低。例如,在某些实施方案中,非最佳密码子选自cta(leu)、tca(ser)、cat(his)、agt(ser)、tta(leu)、gta(val)、ata(ile)、cgc(arg)、tcg(ser)、ttt(phe)、aga(arg)、cga(arg)、aca(thr)、ccg(pro)、ggt(gly)、agg(arg)、cgg(arg)、caa(gln)、cgt(arg)、gat(asp)、tat(tyr)、acc(thr)、tcc(ser)、acg(thr)、ccc(pro)、ctc(leu)、gtc(val)、tgg(trp)、cca(pro)、gcg(ala)、ttg(leu)、agc(ser)、gga(gly)、ctg(leu)、act(thr)、cac(his)、tct(ser)、gca(ala)、cct(pro)、ctt(leu)、gtt(val)、ggg(gly)、gaa(glu)、ttc(phe)、gag(glu)、tgt(cys)、tac(tyr)、ggc(gly)、aat(asn)、gac(asp)以及它们的任意组合。
在某些实施方案中,由tai确定的非最佳密码子的值为0.25或更低。例如,在某些实施方案中,非最佳密码子选自cta(leu)、tca(ser)、cat(his)、agt(ser)、tta(leu)、gta(val)、ata(ile)、cgc(arg)、tcg(ser)、ttt(phe)、aga(arg)、cga(arg)、aca(thr)、ccg(pro)、ggt(gly)、agg(arg)、cgg(arg)、caa(gln)、cgt(arg)、gat(asp)、tat(tyr)、acc(thr)、tcc(ser)、acg(thr)、ccc(pro)、ctc(leu)、gtc(val)、tgg(trp)、cca(pro)、gcg(ala)、ttg(leu)、agc(ser)以及它们的任意组合。
在某些实施方案中,非最佳密码子选自cta(leu)、tca(ser)、cat(his)、agt(ser)、tta(leu)、gta(val)、ata(ile)、cgc(arg)、tcg(ser)、ttt(phe)、aga(arg)、cga(arg)、aca(thr)、ccg(pro)、ggt(gly)、agg(arg)、cgg(arg)、caa(gln)、cgt(arg)、gat(asp)及其任意组合。在某些实施方案中,非最佳密码子选自cta(leu)、tca(ser)、cat(his)、agt(ser)、tta(leu)、gta(val)、ata(ile)、cgc(arg)、tcg(ser)、ttt(phe)及其任意组合。在某些实施方案中,非最佳密码子选自cta(leu)、tca(ser)、cat(his)、agt(ser)、tta(leu)及其任意组合。
密码子优化也可以通过tai的修改版本来衡量,该版本基于给定细胞中trna水平的直接量化,而不是基于trna基因拷贝数的评估。trna水平可以通过本领域已知的任何方法测定,例如,zheng等人,(2015)nat.methods.12(9):835-837中所述。例如,在某些实施例中,非最佳密码子选自aga(arg)、ctc(leu)、ata(ile)、ccc(pro)、cta(leu)、ctt(leu)、tat(tyr)、cct(pro)、tgt(cys)、cgc(arg)、gca(ala)、tcc(ser)、tac(tyr)、gcg(ala)、agg(arg)、cgt(arg)、ccg(pro)、gga(gly)、cca(pro)、tgc(cys)、tct(ser)、tcg(ser)、ttg(leu)、agt(ser)、ttt(phe)、acg(thr)、aat(asn)、aca(thr)、gaa(glu)、atc(ile)、tgg(trp)及其任意组合。在某些实施方案中,非最佳密码子选自aga(arg)、ctc(leu)、ata(ile)、ccc(pro)、cta(leu)、ctt(leu)、tat(tyr)、cct(pro)、tgt(cys)、cgc(arg)、gca(ala)、tcc(ser)、tac(tyr)、gcg(ala)、agg(arg)、cgt(arg)、ccg(pro)、gga(gly)、cca(pro)、tgc(cys)及其任意组合。在某些实施方案中,非最佳密码子选自aga(arg)、ctc(leu)、ata(ile)、ccc(pro)、cta(leu)、ctt(leu)、tat(tyr)、cct(pro)、tgt(cys)、cgc(arg)及其任意组合。在某些实施方案中,非最佳密码子选自aga(arg)、ctc(leu)、ata(ile)、ccc(pro)、cta(leu)及其任意组合。
在某些实施方案中,基因中密码子的平均tai值在约0.15和约0.5之间、约0.15和约0.45之间、约0.15和约0.4之间、约0.15和约0.35之间、约0.15和约0.3之间、约0.15和约0.25之间、约0.15和约0.2之间、约0.2和约0.5之间、约0.2和约0.45之间、约0.2和约0.4之间、约0.2和约0.35之间、约0.2和约0.3之间、约0.2和约0.25之间、约0.25和约0.5之间、约0.25和约0.45之间、约0.25和约0.4之间、约0.25和约0.35之间、约0.25和约0.3之间、约0.3和约0.5之间、约0.3和约0.45之间、约0.3和约0.4之间、约0.3和约0.35之间、约0.35和约0.5之间和约0.35和约0.45之间、约0.35和约0.4之间、约0.4和约0.5之间、约0.4和约0.45之间、约0.45和约0.5之间。在某些实施方案中,基因中密码子的平均tai值小于约0.15、约0.2、约0.25、约0.3、约0.35、约0.4、约0.45或约0.5。
stai是对每个密码子的密码子优化性的评估,它考虑了对trna细胞浓度和解码效率的估计,并以物种特异性的方式加权解码效率。例如,sabi等人于(2014)dnares.21(5):511-525中描述的stai。在某些实施方案中,非最佳密码子的stai值小于给定物种(如人类)所有密码子的stai值的平均值。
nte是对每个密码子的密码子优化性的评估,它考虑了对trna细胞浓度、解码效率和细胞基因库中密码子使用情况的估计。例如,pechman等人于(2013)nat.struct.mol.biol.20(2):237-43中描述了nte。在某些实施方案中,非最佳密码子的nte值小于给定物种(如人类)所有密码子的nte值的平均值。
计算机辅助教学(cai)通过对高表达基因的密码子频率进行评分来评估密码子的最佳性。因此,由cai评估的密码子优化性可以根据被指定为高表达的基因组而改变。例如,在sharp等人于(1987)nucleicacidsres.15(3):1281-95中描述了cai。gcai类似于cai,但其使用给定细胞的整个表达转录组。在某些实施方案中,非最佳密码子的cai值小于给定物种(如人类)所有密码子的cai值的平均值。
csc通过将密码子出现与mrna半衰期测量值相关联来评估密码子的最佳性。例如,presnyak等人于(2015)cell160(6):1111-24中描述了csc。在某些实施方案中,非最佳密码子的csc值小于给定物种(如人类)所有密码子的csc值的平均值。在某些实施例中,由csc确定的非最佳密码子的值为0或更低。
在某些实施方案中,非最佳密码子选自ata、gta和aga及其任意组合。在某些实施例中,非最佳密码子是ata。在某些实施方案中,非最佳密码子是gta。在某些实施方案中,非最佳密码子是aga。在某些实施方案中,非最佳密码子是ata和gta。在某些实施方案中,非最佳密码子是ata和aga。在某些实施方案中,非最佳密码子是gta和aga。在某些实施方案中,非最佳密码子是ata、gta和aga。
在某些实施方案中,基因中约20%至约70%、约20%至约60%、约20%至约50%、约20%至约40%、约20%至约30%、约30%至约70%、约30%至约60%、约30%至约50%、约30%至约40%、约40%至约70%、约40%至约60%、约40%至约50%、约50%至约70%、约50%至约60%或约60%至约70%的密码子是非最佳密码子。在某些实施方案中,基因中大于约20%、约30%、约40%、约50%、约60%或约70%的密码子是非最佳密码子。在某些实施方案中,基因中大于约40%或约50%的密码子是非最佳密码子。
iii、制备转运rna的方法
预期可通过本领域已知的方法制备用于本文所述组合物及方法的trna分子,包括通过化学合成方法在细胞外制备、通过重组dna方法在细胞内制备或从天然来源纯化。
例如,编码trna的dna分子可以通过化学方法或重组dna方法合成。例如,可以通过常规杂交技术或聚合酶链反应(pcr)技术,使用合适的合成核酸引物,从文库中合成或克隆trna的序列。所得的编码trna的dna分子可以连接至其它合适的核苷酸序列,包括例如表达控制序列,以产生编码trna的常规基因表达构建体(即,表达载体)。制备确定的基因构建体是本领域的常规技术。编码所需trna的核酸可以插入(连接)到表达载体中,例如下一节所述的表达载体,可以通过常规转染或转化技术将其引入宿主细胞。宿主细胞的实例有大肠杆菌细胞、中国仓鼠卵巢(cho)细胞、人胚肾293(hek293)细胞、hela细胞、幼仓鼠肾(bhk)细胞、猴肾细胞(cos)、人肝癌细胞(例如,hepg2)和骨髓瘤细胞。转化的宿主细胞可以在允许宿主细胞表达编码trna的基因的条件下生长。具体的表达和纯化条件将根据所应用的表达系统而改变。
可选地,可以通过本领域已知的方法从天然来源来化学合成或纯化trna。在将trna导入细胞或给予受试者之前被氨酰化时,可以通过本领域已知的任何方法,包括化学或酶促氨酰化,使trna被所需的氨基酸氨酰化。
iv、表达载体
可以通过将编码目的trna的基因整合到表达载体中而在目的细胞中表达目的trna。如本文所用,“表达载体”是指包含重组多核苷酸的载体,所述重组多核苷酸包含与待表达的核苷酸序列有效连接的表达控制序列。表达载体包含足够的用于表达的顺式作用元件;其它表达元件可以由宿主细胞或体外表达系统提供。表达载体包括本领域已知的所有载体,例如粘性质粒、质粒(例如,裸露或包含在脂质体中)、逆转座子(例如,piggyback、sleepingbeauty)和插入重组多核苷酸的病毒(例如,慢病毒、逆转录病毒、腺病毒和腺相关病毒)。
在某些实施方案中,表达载体是病毒载体。本文所用术语“病毒”是指任何不具有蛋白质合成或能量产生机制的专性细胞内寄生虫。病毒载体的实例包括逆转录病毒载体(例如,慢病毒载体)、腺病毒载体、腺相关病毒载体、疱疹病毒载体、eb病毒(ebv)载体、多瘤病毒载体(例如,猿猴空泡病毒40(sv40)载体、痘病毒载体和假型病毒载体。
病毒可以是rna病毒(具有rna组成的基因组)或dna病毒(具有dna组成的基因组)。在某些实施方案中,病毒载体是dna病毒载体。示例性的dna病毒包括细小病毒(例如,腺相关病毒)、腺病毒、asfar病毒、疱疹病毒(例如,单纯疱疹病毒1和2(hsv-1和hsv-2)、eb病毒(ebv)、巨细胞病毒(cmv)、乳头瘤病毒(例如,人乳头瘤病毒)、多瘤病毒(例如,猿猴空泡病毒40(sv40)和痘病毒(例如,痘苗病毒、牛痘病毒、天花病毒、鸡痘病毒、羊痘病毒、粘液瘤病毒)。在某些实施方案中,病毒载体是rna病毒载体。rna病毒的实例包括布尼亚病毒(例如,汉坦病毒)、冠状病毒、埃博拉病毒、黄病毒(例如,黄热病病毒、西尼罗病毒、登革热病毒)、肝炎病毒(例如,甲型肝炎病毒、丙型肝炎病毒、戊型肝炎病毒)、流感病毒(例如,甲型流感病毒、乙型流感病毒、丙型流感病毒)、麻疹病毒、腮腺炎病毒、诺如病毒(例如,诺沃克病毒)、脊髓灰质炎病毒、呼吸道合胞病毒、逆转录病毒(例如,人类免疫缺陷病毒-1(hiv-1))和凸隆病毒(toroviruses)。
在某些实施方案中,表达载体包含与编码trna的核苷酸序列可操作连接的调节序列或启动子。术语“可操作连接”是指多核苷酸元件以功能关系连接。当一个核酸序列与另一个核酸序列处于功能关系时,它是“可操作连接”。例如,如果启动子或增强子影响基因的转录,则启动子或增强子与基因可操作连接。可操作连接的核苷酸序列通常是连续的。然而,由于增强子通常在与启动子分开几千个碱基时起作用,并且内含子序列可能是可变的,某些多核苷酸元件可以可操作连接,但不直接位于侧翼,甚至可以从不同的等位基因或染色体中起反式作用。
trna基因优选具有在多种细胞类型中有活性的强启动子。真核trna基因的启动子通常存在于编码trna分子本身的结构序列中。虽然在5'上游区域有调节转录活性的元件,但活性转录单位的长度可能远小于500个碱基对。
可以使用的启动子的其他实例包括但不限于逆转录病毒ltr、sv40启动子、人巨细胞病毒启动子、u6启动子或其他任何启动子(例如,细胞启动子中的真核细胞启动子,包括但不限于组蛋白、poliii和β-肌动蛋白启动子)。可以使用的其他病毒启动子包括但不限于腺病毒启动子、tk启动子和b19细小病毒启动子。根据本文中的教导,启动子的选择对本领域技术人员来说是显而易见的。
在某些实施方案中,表达载体包含seqidno:1、seqidno:2和/或seqidno:3的核苷酸序列的trna编码序列,或与seqidno:1、seqidno:2和/或seqidno:3核苷酸序列具有80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同源性的核苷酸序列。
在某些实施方案中,除了trna编码序列之外,表达载体还包含与相应的野生型trna基因侧翼的基因组dna序列相对应的核苷酸序列。例如,在某些实施方案中,表达载体包含seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10或seqidno:11的核苷酸序列,或与seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10或seqidno:11的核苷酸序列具有80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同源性的核苷酸序列。
腺相关病毒(aav)载体
在某些实施方案中,表达载体是腺相关病毒(aav)载体。aav病毒是一种细小的、无包膜的二十面体病毒,属于微小病毒科依赖病毒属。aav具有大约4.7kb的单链线性dna基因组。aav能够感染几种组织类型的分裂细胞和静止细胞,不同的aav血清型表现出不同的组织亲和性。
aav包括许多血清学上可区分的类型,包括血清型aav-1至aav-12,以及来自非人灵长类的100多种血清型(参见,例如srivastava(2008)j.cellbiochem.,105(1):17-24,和gao等人,(2004)j.virol.,78(12),6381-6388)。本领域技术人员可以基于递送效率、组织趋向性和免疫原性来选择用于本文所述组合物及方法的aav载体的血清型。例如,aav-1、aav-2、aav-4、aav-5、aav-8和aav-9可用于递送至中枢神经系统;aav-1、aav-8和aav-9可用于递送至心脏;aav-2可用于递送至肾脏;aav-7、aav-8和aav-9可用于递送至肝脏;aav-4、aav-5、aav-6、aav-9可用于递送至肺,aav-8可用于递送至胰腺,aav-2、aav-5和aav-8可用于递送至感光细胞;aav-1、aav-2、aav-4、aav-5和aav-8可用于递送至视网膜色素上皮细胞;aav-1、aav-6、aav-7、aav-8和aav-9可用于递送至骨骼肌。在某些实施方案中,aav衣壳蛋白包含专利号为7,198,951的美国专利中的序列,例如,但不限于,aav-9(美国专利7,198,951中的seqidnos:1-3),aav-2(美国专利7,198,951中的seqidno:4),aav-1(美国专利7,198,951中的seqidno:5),aav-3(美国专利7,198,951中的seqidno:6),和aav-8(美国专利7,198,951中的seqidno:7)。还考虑了从恒河猴中鉴定的aav血清型,例如,rh.8、rh.10、rh.39、rh.43和rh.74。除了天然的aav血清型,改良的aav衣壳已被开发用于提高递送效率、组织趋向性和免疫原性。美国专利号7,906,111、9,493,788和7,198,951以及pct公开号wo2017189964a2公开了天然和改性的aav衣壳的实例。
野生型aav基因组包含两个145个核苷酸的反向末端重复序列(itr),其中包含指导aav复制、基因组封装和整合的信号序列。除了itrs,三个aav启动子p5、p19和p40驱动编码rep和cap基因的两个开放阅读框的表达。两个rep启动子,加上单个aav内含子的差异剪接,导致rep基因产生四个rep蛋白(rep78,rep68,rep52和rep40)。rep蛋白负责基因组复制。cap基因由p40启动子表达,并编码三种衣壳蛋白(vp1、vp2和vp3),是cap基因的剪接变体。这些蛋白质构成了aav颗粒的衣壳。
因为复制、封装和整合的顺式作用信号包含在itr中,所以4.3kb内部基因组的部分或全部可以被外源dna替代,例如,外源目的基因的表达盒。因此,在某些实施方案中,aav载体包含基因组,所述基因组包含侧翼为5'itr和3'itr的外源基因的表达盒。itr可以来源于与衣壳或其衍生物相同的血清型。或者,itr可能与衣壳具有不同的血清型,从而产生假型aav。在某些实施方案中,itr源自aav-2。在某些实施方案中,itr源自aav-5。至少一个itr可以被修饰以突变或删除末端解析位点,从而允许产生自互补的aav载体。
rep和cap蛋白可以以反式的方法提供在例如质粒上,以产生aav载体。允许aav复制的宿主细胞系必须表达rep和cap基因、itr侧翼表达盒以及辅助病毒提供的辅助功能,例如腺病毒基因e1a、e1b55k、e2a、e4orf6和va(weitzman等人,adeno-associatedvirusbiology.adeno-associatedvirus:methodsandprotocols,1-23页,2011)。已经详细描述了生产和纯化aav载体的方法(例如,mueller等人,(2012)currentprotocolsinmicrobiology,14d.1.1-14d.1.21,productionanddiscoveryofnovelrecombinantadeno-associatedviralvectors)。许多细胞类型适于产生aav载体,包括hek293细胞、cos细胞、hela细胞、bhk细胞、vero细胞以及昆虫细胞(参见例如专利号为6,156,303、5,387,484、5,741,683、5,691,176、5,688,676和8,163,543的美国专利、公开号为20020081721的美国专利和pct公开号为wo00/47757、wo00/24916和wo96/17947的专利)。在这些细胞类型中,aav载体通常由一个含有itr侧翼表达盒的质粒和一个或多个提供其他aav病毒和辅助病毒基因的其他质粒产生。
任何血清型的aav均可用于本文所述的组合物及方法。类似地,预期可以使用任何腺病毒类型,并且本领域技术人员将能够鉴定aav和适于生产所需重组aav载体(raav)的腺病毒类型。可以通过例如亲和色谱法、碘离子梯度或cscl梯度来纯化aav颗粒。
aav载体可能具有大小为4.7kb或大于或小于4.7kb的单链基因组,包括大至5.2kb或小至3.0kb的超大基因组。因此,当从aav载体表达的外源目的基因很小时,aav基因组可以包含填充序列。此外,载体基因组可以是基本上自互补的,从而允许在细胞中快速表达。在某些实施方案中,自互补aav载体的基因组包含5'至3':5'itr;第一核酸序列,包含与目的基因的编码序列可操作连接的启动子和/或增强子;修改后的itr,不具有功能性的终端解析站点;第二核酸序列,与第一核酸序列互补或基本互补;和3'itr。包含所有类型基因组的aav载体均适于本文所述的方法。
aav载体的非限制性实例包括paav-mcs(安捷伦科技公司)、paavk-ef1α-mcs(系统生物目录#aav502a-1)、paavk-ef1α-mcs1-cmv-mcs2(系统生物目录#aav503a-1)、paav-zsgreen1(clontech目录#6231)、paav-mcs2(addgene质粒#46954)、aav-stuffer(addgene质粒#106248)、paavsccbpigpluc(addgene质粒#35645)、aavs1_puro_pgk1_3xflag_twin_strep(addgene质粒#68375)、paav-ram-d2tta::tre-mcs-wpre-pa(addgene质粒#63931)、paav-ubc(addgene质粒#62806)、paavs1-p-mcs(addgene质粒#80488)、paav-gateway(addgene质粒#32671)、paav-puro_sikd(addgene质粒#86695)、paavs1-nst-mcs(addgene质粒#80487)、paavs1-nst-cag-dest(addgene质粒#80489)、paavs1-p-cag-dest(addgene质粒#80490)、paavf-enhcb-lacznls(addgene质粒#35642)和paavs1-shrna(addgene质粒#82697)。这些载体可以被修饰以适于治疗用途。例如,外源目的基因可以插入多重克隆位点,选择标记(例如,puro或编码荧光蛋白的基因)可以被缺失或被另一个(相同或不同的)外源目的基因取代。aav载体的其他实例公开在专利号为5,871,982、6,270,996、7,238,526、6,943,019、6,953,690、9,150,882和8,298,818的美国专利、公开号为2009/0087413的美国专利和公开号为wo2017075335a1、wo2017075338a2和wo2017201258a1的pct专利中。
在某些实施方案中,表达载体是能够在受试者(例如人类受试者)中靶向神经系统(如中枢神经系统)的aav载体。可以靶向神经系统的典型aav载体包括aav9变体aav-php.(参见,例如,deverman等人,(2016)nat.biotechnol.34(2):204-209)、aav-as(参见,例如、choudhury等人,(2016)mol.ther.24:726-35)。用于靶向神经系统的其他示例性的aav在bedrook等人(2018)annurevneurosci.41:323-348中进行了描述。
慢病毒载体
在某些实施方案中,病毒载体可以是逆转录病毒载体。逆转录病毒载体的实例包括莫洛尼鼠白血病病毒载体、脾坏死病毒载体和衍生自逆转录病毒的载体,如劳斯肉瘤病毒、哈维肉瘤病毒、禽白血病病毒、人类免疫缺陷病毒、骨髓增生性肉瘤病毒和乳腺癌病毒。逆转录病毒载体可用作介导逆转录病毒介导的基因转移至真核细胞的试剂。
在某些实施方案中,逆转录病毒载体是慢病毒载体。慢病毒载体的实例包括来源于人类免疫缺陷病毒-1(hiv-1)、人类免疫缺陷病毒-2(hiv-2)、猿猴免疫缺陷病毒(siv)、猫免疫缺陷病毒(fiv)、牛免疫缺陷病毒(biv)、jembrana病毒(jdv)、马传染性贫血病毒(eiav)和山羊关节炎脑炎病毒(caev)的载体。
通常构建逆转录病毒载体,使得编码病毒结构基因的大部分序列缺失并被目的基因取代。更常见的是,使用本领域已知的遗传工程技术将结构基因(即,gag、pol和env)从逆转录病毒骨架中除去。这可能包括用适当的限制性内切酶消化,或者在某些情况下,用bal31核酸外切酶消化,以产生含有包装信号的适当部分的片段。因此,最小逆转录病毒载体包含5'至3':5'长末端重复序列(ltr)、包装信号、任选的外源启动子和/或增强子、目的外源基因和3'ltr。如果未提供外源启动子,基因表达由5'ltr驱动,5'ltr是弱启动子,需要tat的存在来激活表达。结构基因可以在单独载体中提供以制备慢病毒,使得产生的病毒粒子有复制缺陷。具体而言,对于慢病毒,包装系统可以包含编码gag、pol、rev和tat基因的独立包装载体,以及编码包膜蛋白env(由于其广泛的传染性,通常为vsv-g)的第三独立载体。为了提高包装系统的安全性,包装载体可以被拆分,一个载体表达rev,另一个载体表达gag和pol。也可以通过使用包含嵌合5'ltr的逆转录病毒载体将tat从包装系统中去除,其中5'ltr的u3区被异源调节元件取代。
这些新基因可以通过几种常见的方式整合到前病毒骨架中。最直接的结构是逆转录病毒的结构基因被单个基因取代,然后单个基因在ltr内病毒调节序列的控制下被转录。逆转录病毒载体同样被构建,其可以将多个基因导入靶细胞。通常,在此类载体中,一个基因受病毒ltr的调控,而另一个基因要么通过剪接信息表达,要么受其自身内部启动子的调控。
因此,新基因的侧翼是5'ltr和3'ltr,分别用于促进病毒体rna的转录和聚腺苷酸化。术语“长末端重复”或“ltr”是指位于逆转录病毒dna末端的碱基对结构域,它们在其天然序列中直接重复,并包含u3、r和u5区域。ltr通常提供逆转录病毒基因表达(例如,基因转录物的促进、启动和聚腺苷酸化)和病毒复制的基本功能。ltr包含许多调节信号,包括转录控制元件、聚腺苷酸化信号以及病毒基因组复制和整合所需的序列。u3区域包含增强子和启动子元件。u5区域是引物结合位点和r区域之间的序列,包含聚腺苷酸化序列。r(重复)区域的两侧是u3和u5区域。在某些实施方案中,r区域包含反式激活反应(tar)遗传元件,其与反式激活剂(tat)遗传元件相互作用以增强病毒复制。在5'ltr的u3区被异源启动子取代的实施方案中,所述元件不是必需的。
在某些实施方案中,逆转录病毒载体包含修饰的5'ltr和/或3'ltr。3'ltr的修饰通常是通过使病毒具有复制缺陷,从而提高慢病毒或逆转录病毒系统的安全性。在特定的实施方案中,逆转录病毒载体是自失活(sin)载体。如本文所用,sin逆转录病毒载体是指复制缺陷型逆转录病毒载体,其中3'ltru3区域被修饰(例如,通过缺失或取代)以防止病毒转录超过第一轮病毒复制。这是因为在病毒复制过程中,3'ltru3区域被用作5'ltru3区域的模板,因此,如果没有u3增强子-启动子,则无法制备病毒转录物。在另一个实施方案中,3'ltr被修饰,使得u5区域被例如理想的聚腺苷酸化序列取代。应当注意的是,本文还描述了对ltr的修饰,例如对3'ltr的修饰、5'ltr的修饰或3'ltr与5'ltr的同时修饰。
在某些实施方案中,5'ltr的u3区域被异源启动子取代,以在病毒颗粒的生产期间驱动病毒基因组的转录。可以使用的异源启动子的实例包括,例如,猿猴病毒40(sv40)(例如,早期或晚期)、巨细胞病毒(cmv)(例如,早期)、莫洛尼鼠白血病病毒(momlv)、劳斯肉瘤病毒(rsv)和单纯疱疹病毒(hsv)(胸苷激酶)启动子。典型的启动子能够以tat非依赖的方式驱动高水平的转录。由于在病毒生产系统中没有完整的u3序列,因而这种取代降低了重组产生具有复制能力的病毒的可能性。
与5'ltr相邻的是基因组逆转录(trna引物结合位点)及将病毒rna有效包装成颗粒(psi位点)所必需的序列。如本文所用,术语“包装信号”或“包装序列”是指位于逆转录病毒基因组内的序列,其在病毒颗粒形成过程中被逆转录病毒rna链包裹(例如,clever等人,1995j.virology,69(4):2101-09)。包装信号可以是包封病毒基因组所需的最小包装信号(也称为psi[ψ]序列)。
在某些实施方案中,逆转录病毒载体(例如,慢病毒载体)还包含flap。如本文所用,术语“flap”是指序列包含逆转录病毒(例如hiv-1或hiv-2)的中央多嘌呤区和中央终止序列(cppt和cts)的核酸。flap元件的实例在专利号为6,682,907的美国专利和zennou等人,(2000)cell101:173中记载。在逆转录过程中,正链dna在cppt中心处起始并在cts的中心处终止从而形成三链dna结构:中央dna瓣。而不希望受任何理论束缚的情况下,dna瓣可以作为慢病毒基因组核导入的顺式活性决定簇和/或可以增加病毒的滴度。在特定的实施方案中,逆转录病毒载体骨架包含载体中目的异源基因上游或下游的一个或多个flap元件。例如,在特定的实施方案中,转移质粒包括flap元件。在一个实施方案中,本文描述的载体包含分离自hiv-1的flap元件。
在某些实施方案中,逆转录病毒载体(例如,慢病毒载体)还包含输出元件。在一个实施方案中,逆转录病毒载体包含一个或多个输出元件。术语“输出元件”是指顺式作用的转录后调节元件,其调节rna转录物从细胞核到细胞质的运输。rna输出元件的实例包括但不限于人体免疫缺陷病毒(hiv)中的rre(例如,参见cullen等人,(1991)j.virol.65:1053;和cullen等人,(1991)cell58:423)和乙型肝炎病毒转录后调节元件(hpre)。通常,rna输出元件位于基因的3'utr内,并且可以作为一个或多个拷贝插入。
在某些实施方案中,逆转录病毒载体(例如,慢病毒载体)还包含转录后调控元件。多种转录后调控元件可以增加异源核酸的表达,例如土拨鼠肝炎病毒转录后调控元件(wpre,参见zufferey等人,(1999)j.virol.,73:2886)、乙型肝炎病毒中存在转录后调控元件(hpre)(黄等,mol.cell.biol.,5:3864)等等(刘等人,(1995),genesdev.,9:1766)。转录后调控元件通常位于异源核酸序列的3'端。这种构型导致了一种mrna转录物的合成,该mrna转录物的5'部分包含异源核酸编码序列,3'部分包含转录后调节元件序列。在某些实施方案中,本文描述的载体缺乏或不包含转录后调控元件,例如wpre或hpre,因为在某些情况下,这些元件增加了细胞转化的风险和/或不会可观地或显著地增加mrna转录物的量或增加mrna的稳定性。因此,在某些实施方案中,作为附加的安全措施,本文所述的载体缺少或不包含wpre或hpre。
指导异源核酸转录物有效终止和聚腺苷酸化的元件增加了异源基因表达。通常在多聚腺苷酸化信号的下游发现转录终止信号。因此,在某些实施方案中,逆转录病毒载体(例如,慢病毒载体)还包含聚腺苷酸化信号。如本文所用,术语“多聚腺苷酸化信号”或“多聚腺苷酸化序列”表示dna序列,其通过rna聚合酶h指导新生rna转录物的终止和多聚腺苷酸化。重组转录物的有效多聚腺苷酸化是理想的,因为缺乏多聚腺苷酸化信号的转录物是不稳定的,并且被快速降解。可用于本文所述载体的聚腺苷酸化信号的说明性实例包括理想的聚腺苷酸化序列(例如,aataaa、attaaa、agtaaa)、牛生长激素多聚腺苷酸化序列(bghpa)、兔β-珠蛋白多聚腺苷酸化序列(rβgpa)或本领域已知的其他合适的异源或内源多聚腺苷酸化序列。
在某些实施方案中,逆转录病毒载体还包含隔绝元件。隔绝元件可以有助于保护逆转录病毒表达的序列,例如治疗基因,免受整合位点效应的影响,整合位点效应可由基因组dna中存在的顺式作用元件介导,并导致转移序列的表达失控(即,位置效应;参见,例如burgess-beusse等人,(2002)proc.natl.acad.sci.,usa,99:16433和zhan等人,2001,hum.genet.,109:471)。在某些实施方案中,逆转录病毒载体在整合到细胞基因组的载体区域的一个或两个ltr或其他地方包含隔绝元件。用于本文所述的组合物及方法中的隔绝元件的剖的例包括但不限于鸡β-珠蛋白绝缘体(参见chung等人,(1993).cell74:505;chung等人,(1997)proc.natl.acad.sci.,usa94:575和bell等人,1999.cell98:387)。隔绝元件的实例包括但不限于来自β-珠蛋白基因座的绝缘体,例如鸡hs4。
慢病毒载体的非限制性实例包括plvx-ef1alpha-acgfp1-c1(clontech目录#631984)、plvx-ef1alpha-ires-mcherry(clontech目录#631987)、plvx-puro(clontech目录#632159)、plvx-ires-puro(clontech目录#632186)、plenti6/v5-desttm(thermofisher)、plenti6.2/v5-desttm(thermofisher)、plko.1(addgene公司,质粒#10878)、plko.3g(addgene公司,质粒#14748)、psico(addgene公司,质粒#11578)、pljm1-egfp(addgene公司,质粒#19319)、fugw(addgene公司,质粒#14883)、plvthm(addgene公司,质粒#12247)、plvut-ttr-krab(addgene公司,质粒#11651)、pll3.7(addgene公司,质粒#11795)、plb(addgene公司,质粒#11619)、pwpxl(addgene公司,质粒#12257)、pwpi(addgene公司,质粒#12254)、ef.cmv.rfp(addgene公司,质粒#17619)、plenticmvpurodest(addgene公司,质粒#17452)、plenti-puro(addgene公司,质粒#39481)、pultra(addgene公司,质粒#24129)、plx301(addgene公司,质粒#25895)、phiv-egfp(addgene公司,质粒#21373)、plv-mcherry(addgene公司,质粒#36084)、plionii(addgene公司,质粒#1730)、pinducer10-mir-rup-phes(addgene公司,质粒#44011)这些载体可以被修饰以适合治疗用途。例如,选择标记(例如puro、egfp或mcherry)可以被去除或被第二个外源目的基因取代。慢病毒载体的进一步实例在美国专利7,629,153、7,198,950、8,329,462、6,863,884、6,682,907、7,745,179、7,250,299、5,994,136、6,287,814、6,013,516、6,797,512、6,544,771、5,834,256、6,958,226、6,207,455、6,531,123和6,352,694以及公开号为wo2017/091786的pct专利中记载。
腺病毒载体
在某些实施方案中,病毒载体可以是腺病毒载体。腺病毒是中等大小(90~100纳米)的无包膜(裸露的)二十面体病毒,由核衣壳和双链线性dna基因组组成。术语“腺病毒”是指腺病毒属的任何病毒,包括但不限于人、牛、羊、马、犬、猪、鼠和猿猴腺病毒亚属。通常,通过向腺病毒的腺病毒基因组中引入一个或多个突变(例如,缺失、插入或取代)来产生腺病毒载体,以适应非天然核酸序列插入(例如用于基因转移)到腺病毒中。
人腺病毒可以用作腺病毒载体的腺病毒基因组的来源。例如,腺病毒可以是a亚群(例如,血清型12、18和31)、b亚群(例如,血清型3、7、11、14、16、21、34、35和50)、c亚群(例如,血清型1、2、5和6)、d亚群(例如,血清型8、9、10、13、15、17、19、20、22-30、32、33、36-39和42-48)、e亚群(例如,血清型4)、f亚群(例如,血清型40和41)、未分类的亚群(例如,血清型49和51),或任何其他腺病毒亚群或血清型。腺病毒血清型1至51可从美国典型培养物保藏中心(atcc,马纳萨斯,弗吉尼亚州)获得。非c亚群腺病毒载体、生产非c亚群腺病毒载体的方法和使用非c亚群腺病毒载体的方法在例如美国专利第5,801,030、5,837,511和5,849,561,以及公开号为wo1997/012986和wo1998/053087的pct专利中公开。
非人源腺病毒(例如类人猿、猿、禽、犬、羊或牛腺病毒)可用于生产腺病毒载体(即,作为腺病毒载体的腺病毒基因组来源)。例如,腺病毒载体可以基于猿猴腺病毒,包括新世界猴和旧世界猴(参见,例如,virustaxonomy:vhithreportoftheinternationalcommitteeontaxonomyofviruses(2005))。感染灵长类动物的腺病毒的系统发育分析在,例如,roy等人,(2009)plospathog.5(7):e1000503中记载。大猩猩腺病毒可作为腺病毒载体的腺病毒基因组来源。大猩猩腺病毒和腺病毒载体在,例如,公开号为wo2013/052799、wo2013/052811和wo2013/052832的pct专利申请中记载。腺病毒载体也可以包含亚群的组合,因此是“嵌合”腺病毒载体。
腺病毒载体可以具有复制能力、附条件复制能力或复制缺陷。具有复制能力的腺病毒载体可以在典型的宿主细胞中复制,即,能够被腺病毒感染的典型细胞。附条件复制型腺病毒载体是经工程改造以在预定条件下复制的腺病毒载体。例如,复制必需基因功能,例如,由腺病毒早期区域编码的基因功能可以可操作地连接到诱导型、抑制型或组织特异性的转录控制序列,如启动子。附条件复制型腺病毒载体在专利号为5,998,205的美国专利中描述。复制缺陷型腺病毒载体是需要复制所需的腺病毒基因组的一种或多种基因功能或区域互补的腺病毒载体,这是因为,例如一种或多种复制必需基因功能或区域的缺陷,使得腺病毒载体不能在典型的宿主细胞中复制,特别是在将被腺病毒载体感染的人体细胞中不复制。
在一些实施方案中,腺病毒载体是复制缺陷型腺病毒载体,使得复制缺陷型腺病毒载体需要腺病毒基因组的一个或多个区域中的至少一个复制必需基因功能的互补来繁殖(例如,以形成腺病毒载体颗粒)。腺病毒载体可能仅在腺病毒基因组的早期区域(即,e1~e4区域)、仅在腺病毒基因组的晚期区域(即,l1~l5区域)、腺病毒基因组的早期和晚期区域或所有腺病毒基因(即,一种高容量腺病毒载体(hc-ad))的一个或多个复制必需基因功能上存在缺陷。参见,例如,morsy等人,(1998)proc.natl.acad.sci.usa95:965-976,chen等人,.(1997)proc.natl.acad.sci.usa94:1645-1650和kochanek等人,(1999)hum.genether.10(15):2451-9。复制缺陷型腺病毒载体的实例在公开号为5,837,511、5,851,806、5,994,106、6,127,175、6,482,616和7,195,896的美国专利以及公开号为wo1994/028152、wo1995/002697、wo1995/016772、wo1995/034671、wo1996/022378、wo1997/012986、wo1997/021826和wo2003/022311的pct专利中记载。
本文所述的复制缺陷型腺病毒载体可以在互补细胞系中产生,所述互补细胞系以适当的水平提供复制缺陷型腺病毒载体中不存在但病毒繁殖所需的基因功能,以产生高滴度的病毒载体储备。这种互补细胞系是已知的,包括但不限于293细胞(例如,graham等人,(1977)j.gen.virol.36:59-72中记载)、per.c6细胞(例如,公开号为wo1997/000326的pct专利和专利号为5,994,128和6,033,908的美国专利中记载)和293-orf6细胞(如,公开号为wo1995/034671和brough等人,(1997)j.virol.71:9206-9213中记载)。产生复制缺陷型腺病毒载体的互补细胞系的其它实例包括互补细胞,所述互补细胞产生用于繁殖的编码转基因的腺病毒载体,所述转基因的表达抑制宿主细胞中的病毒生长(参见,例如,公开号为2008/0233650的美国专利)。互补细胞的其它实例在专利号为6,677,156和6,682,929的美国专利及公开号为wo2003/020879的pct专利中记载。包含腺病毒载体的组合物的制剂在例如专利号为6,225,289和6,514,943的美国专利以及公开号为wo2000/034444的pct专利中进一步描述。
腺病毒载体和/或制备或繁殖腺病毒载体的方法的其它实例于专利号为,559,099、5,837,511、5,846,782、5,851,806、5,994,106、5,994,128、5,965,541、5,981,225、6,040,174、6,020,191、6,083,716、6,113,913、6,303,362、7,067,310和9,073,980的美国专利中记载。
市售的腺病毒载体系统包括可从thermofisherscientific获得的virapowertm腺病毒表达系统,可从安捷伦科技公司获得的adeasytm腺病毒载体系统以及可从takarabiousa公司获得的adeno-xtm表达系统3。
其他病毒载体
在某些实施方案中,病毒载体可以是单纯疱疹病毒质粒载体。单纯疱疹病毒1型(hsv-1)已被证明是一个潜在的基因治疗有效的基因传递载体系统。hsv-1载体已被用于将基因转移至肌肉,并已被用于鼠脑瘤治疗。辅助病毒依赖的小型病毒载体已经被开发出来,以简化操作,并具有更大的插入能力(高达140kb)。现有技术中已经构建了复制能力不足的hsv扩增子。这些hsv扩增子含有大量的hsv基因组缺失,为外源dna的插入提供空间。通常,它们包括hsv-1包装位点、hsv-1“oris”复制位点和ie4/5启动子序列。这些病毒颗粒依赖辅助病毒进行繁殖。
病毒载体的制备
制备病毒载体的方法是本领域已知的。通常,使用常规技术在合适的宿主细胞系中制备已知的病毒,包括在合适的条件下培养转染或感染的宿主细胞,以便产生感染性病毒颗粒。编码病毒基因和/或trna的核酸可以通过常规转染或转化技术整合到质粒中并导入宿主细胞。用于制备已知的病毒的宿主细胞的实例包括人类细胞系,如hela、hela-s3、hek293、911、a549、her96或per-c6细胞。具体的制备和纯化条件将根据所使用的病毒和生产系统而有所不同。
在某些实施方案中,生产细胞可以直接给予受试者,然而,在其它实施方案中,在生产后,从培养物中回收感染性病毒颗粒并任选纯化。典型的纯化步骤可以包括病毒空斑纯化、离心(如氯化铯梯度离心)、澄清、酶处理(如苯并酶或蛋白酶处理)、色谱步骤(例如,离子交换色谱)或过滤步骤。
iv、药物组合物
可以将trna和/或表达载体与药学上可接受的载体结合以用于治疗。本文使用的术语“药学上可接受的”是指在合理的医学判断范围内,适用于与人和动物的组织接触而没有过度毒性、刺激、过敏反应或其他问题或并发症,并具有合理的获益/风险比的那些化合物、材料、组合物和/或剂型。
如本文所用,术语“药学上可接受的载体”是指适用于与人和动物的组织接触使用,而没有过度的毒性、刺激、过敏反应或其他问题或并发症,并具有合理的获益/风险比的缓冲剂、载体和赋形剂。药学上可接受的载体包括任何标准药物载体,例如磷酸盐缓冲液、水、乳剂(例如,油/水或水/油乳液)和各种类型的润湿剂。所述组合物还可以包括稳定剂和防腐剂。关于载体、稳定剂和佐剂的实例,参见,例如,martin,remington’spharmaceuticalsciences,15thed.,mackpubl.co.,easton,pa[1975]。药学上可接受的载体包括与药物施用相容的缓冲剂、溶剂、分散介质、包衣、等渗剂和吸收延迟剂等。这种介质和药剂用于药物活性物质是本领域已知的。
在某些实施方案中,药物组合物可包含用于修饰、维持或保存例如组合物的酸碱度、渗透压、粘度、澄清度、颜色、等渗性、气味、无菌性、稳定性、溶解或释放速率、吸附或渗透的制剂材料。在这样的实施方案中,制剂材料包括但不限于氨基酸(如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸)、抗菌剂、抗氧化剂(如抗坏血酸、亚硫酸钠或亚硫酸氢钠)、缓冲剂(如硼酸盐、碳酸氢盐、tris-hcl、柠檬酸盐、磷酸盐或其他有机酸)、填充剂(如甘露醇或甘氨酸);螯合剂(如乙二胺四乙酸(edta))、络合剂(如咖啡因、聚乙烯吡咯烷酮、β-环糊精或羟丙基-β-环糊精)、填充剂、单糖、二糖、和其他碳水化合物(如葡萄糖、甘露糖或糊精)、蛋白质(如血清白蛋白、明胶或免疫球蛋白)、着色剂、调味剂和稀释剂、乳化剂、亲水聚合物(如聚乙烯吡咯烷酮)、低分子量多肽、成盐抗衡离子(如钠)、防腐剂(如苯扎氯铵、苯甲酸、水杨酸、硫柳汞、苯乙醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、氯己定、山梨酸或过氧化氢)、溶剂(如甘油、丙二醇或聚乙二醇)、糖醇(如甘露醇或山梨醇)、悬浮剂、表面活性剂或湿润剂(如普朗尼克、聚乙二醇、脱水山梨醇酯、聚山梨醇酯如聚山梨醇酯20、聚山梨醇酯、曲拉通(triton)、三乙醇胺、卵磷脂、胆固醇、四丁酚醛(tyloxapal))、稳定性增强剂(如蔗糖或山梨醇)、渗透压增强剂(如碱金属卤化物,优选氯化钠或氯化钾,甘露醇山梨醇)、给药赋形剂、稀释剂、赋形剂和/或药用辅料(参见remington’spharmaceuticalsciences,18thed.(mackpublishingcompany,1990)。
在某些实施方案中,药物组合物可以包含纳米颗粒,例如聚合纳米颗粒、脂质体或胶束(参见anselmo等人,(2016)bioeng.transl.med.1:10-29)。在某些实施方案中,所述组合物不包含纳米颗粒或氨基脂质递送化合物,例如,公开号为2017/0354672的美国专利。在某些实施方案中,导入细胞或给予受试者的trna或表达载体不与另一部分例如载体颗粒(如氨基脂质颗粒)缀合或结合。如本文所用,术语“共轭的”,当用于两个或多个部分时,是指这些部分直接或通过一个或多个用作连接剂的附加部分彼此物理结合或连接,以形成足够稳定的结构,使得这些部分在使用该结构的条件(例如,生理状况)下保持物理结合。通常,这些部分通过一个或多个共价键或者通过涉及特异性结合的机制连接。或者,足够数量的较弱相互作用可以为保持物理结合的部分提供足够的稳定性。
在某些实施方案中,药物组合物可以包含持续或控制递送制剂。用于配制持续或控制递送方式的技术,例如脂质体载体、生物可侵蚀微粒或多孔珠和储库注射,也是本领域技术人员已知的。缓释制剂可包括,例如,多孔聚合物微粒或成形制品(例如薄膜或微胶囊)形式的半透性聚合物基质。缓释基质可包括聚酯、水凝胶、聚丙交酯、l-谷氨酸和γ-乙基-l-谷氨酸的共聚物、聚(2-羟乙基-丙烯酸乙酯)、乙烯乙酸乙烯酯或聚-d-(3-羟基丁酸)。缓释组合物还可以包括脂质体,其可以通过本领域已知的多种方法中的任何一种来制备。
包含本文公开的trna和/或表达载体的药物组合物可以以剂量单位的形式存在,并且可以通过任何合适的方法制备。药物组合物可以配制成适于预期的给药方式。给药方式的实例有静脉内、皮内、吸入、经皮、局部、经粘膜、鞘内和直肠给药。在某些实施方案中,通过鞘内给予trna和/或表达载体。在某些实施方案中,通过注射给予trna和/或表达载体。制剂可以通过制药领域已知的方法制备。例如,见remington’spharmaceuticalsciences,18thed(mackpublishingcompany,1990)。肠胃外给药的制剂组分包括无菌稀释剂,如注射用水、盐溶液、不挥发油、聚乙二醇、甘油、丙二醇或其他合成溶剂;抗菌剂,如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂,如抗坏血酸或亚硫酸氢钠;螯合剂,如edta;缓冲剂,如醋酸盐、柠檬酸盐或磷酸盐;以及渗透压调节剂,如氯化钠或葡萄糖。
对于静脉给药,载体包括生理盐水、抑菌水、聚氧乙烯蓖麻油衍生物(cremophoreltm)(basf,parsippany,nj)或磷酸盐缓冲液(pbs)。所述载体在制造和储存条件下可以是稳定的,并应无菌保存。所述载体可以是含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇)及其合适混合物的溶剂或分散介质。
通常,任何递送核酸分子的方法都可以适用于trna(参见,例如akhtar等人,(1992)trendscell.biol.2(5):139-144和公开号为wo94/02595的pct专利)。trna可以被修饰,或者使用药物递送系统递送,以防止trna在体内被核酸内切酶和核酸外切酶快速降解。trna分子可以通过与亲脂性基团如胆固醇的化学结合来修饰,以增强细胞摄取并防止降解。trna分子也可以与适配体共轭或以其他方式结合。trna也可以使用药物递送系统来递送,例如纳米颗粒、树枝状聚合物、聚合物、脂质体或阳离子递送系统。带正电荷的阳离子递送系统促进了trna分子(带负电荷)的结合,并增强了带负电荷细胞膜上的相互作用,从而使得细胞能够有效地吸收trna。阳离子脂质体、树枝状聚合物或聚合物可以与rna结合,如trna,或被诱导形成囊泡或胶束(参见例如kim等人,(2008)journalofcontrolledrelease129(2):107-116)将rna包裹。制备和施用阳离子-rna复合物的方法完全在本领域技术人员的能力范围内(参见,例如,sorensen等人,(2003)j.mol.biol327:761-766;verma等人,(2003)clin.cancerres.9:1291-1300;arnold等人,(2007)j.hypertens.25:197-205)。用于rna的全身递送的药物递送系统的一些非限制性实例,例如,trna包括dotap(sorensen等人,(2003)同上;verma等人,(2003)同上)、脂质体转染试剂盒(oligofectamine),固体核酸脂质颗粒(zimmermann等人,(2006)nature441:111-114),心磷脂(cardiolipin)(chien等人,(2005)cancergenether.12:321-328;pal等人,(2005)intj.oncol.26:1087-1091),聚乙烯亚胺(bonnet等人,(2008)pharm.res.25(12):2972-82;aigner(2006)j.biomed.biotechnol.71659),精氨酸-甘氨酸-天冬氨酸(rgd)肽(arg-gly-asp(rgd)peptides)(liu(2006)mol.pharm.3:472-487)和树枝状聚酰胺-胺(tomalia等人,(2007)biochem.soc.trans.35:61-67;yoo等人,(1999)pharm.res.16:1799-1804)。在某些实施方案中,trna与环糊精形成用于全身给药的复合物。rna和环糊精的给药方式和药物组合物可见于专利号为7,427,605的美国专利。
药物制剂优选是无菌的。可以通过任何合适的方法灭菌,例如,通过无菌过滤膜过滤。如果组合物是冻干的,可以在冻干和重构之前或之后进行过滤灭菌。
本文所述的组合物可以局部或全身施用。通常通过肠胃外给药。在一些实施方案中,药物组合物通过皮下给药,并且在更优选的实施方案中静脉内给药。胃肠外给药制剂包括无菌水溶液或非水溶液、悬浮液和乳剂。
通常,活性成分的有效治疗量,例如trna和/或表达载体,在0.1mg/kg至100mg/kg的范围内,如1mg/kg至100mg/kg、1mg/kg至10mg/kg。在某些实施方案中,病毒表达载体的有效治疗量在102~1015噬菌斑形成单位(pfu)的范围内,例如,102~1010、102~105、105~1015、105~1010或1010~1015噬菌斑形成单位。给药的量将取决于以下变量,如疾病的类型和严重程度或待治疗的适应症、患者的整体健康状况、抗体的体内效力、药物制剂和给药途径。初始剂量可以增加到高于上限水平,以便快速达到所需的血药浓度或组织中药物浓度。或者,初始剂量可以小于最佳剂量,并可在治疗过程中逐渐增加日剂量。可以在例如设计为从0.5mg/kg到20mg/kg的常规的i期剂量递增研究中优化人体剂量。给药频率可以根据给药途径、给药剂量、血清半衰期和所治疗的疾病类型等因素而变化。给药频率的实例是每天一次、每周一次和每两周一次。给药途径的一个实例是肠胃外给药,例如静脉输注。
v、治疗用途
本文公开的组合物及方法可用于治疗受试者的单倍剂量不足症。如本文所用,术语单倍剂量不足症是指由单倍剂量不足介导、增强、以其他方式促进或与之相关的疾病,即,二倍体受试者仅具有基因的单一功能拷贝且该基因的单一功能拷贝不能产生足够的基因产物(例如,蛋白质)来实现正常的基因功能。如本文所用,单倍剂量不足基因是指需要两个等位基因才能正常发挥基因功能的基因。单倍剂量不足症的实例包括5q综合征、adams-oliver综合征1、adams-oliver综合征3、adams-oliver综合征5、adams-oliver综合征6、alagille综合征1、自身免疫性淋巴增生综合征ia型、自身免疫性淋巴增生综合征v型、常染色体显性耳聋-2a、伴或不伴输尿管缺陷的脑畸形(brmutd)、卡尼氏复合症1型、charge综合征、锁骨颅骨发育不全综合征、currarino综合征、丹尼斯-德拉什综合征/弗雷泽综合征、发育迟缓、智力障碍、肥胖和畸形综合征(didod)、digeorge综合征(tbx1相关)、dravet综合征、duane-radialray综合征、ehlers-danlos综合征(经典型)、ehlers-danlos综合征(血管型)、feingold综合征1、grn相关的tdp43包裹体(ftld-tdp)额颞叶变性、glut1缺乏综合征、greig头-指综合征、遗传性出血性毛细血管扩张1型、全前脑畸形3、全前脑畸形4、全前脑畸形5、holt-oram综合征、甲状旁腺功能减退、感音神经性耳聋和肾病(hdr)、kleefstra综合征1、klippel-trenaunay综合征(aagf相关)、leri-weil软骨骨病、马方综合征、伴或不伴心脏缺陷的精神发育迟缓症状体征(mrfacd)、常染色体显性智力低下1型、常染色体显性智力低下19型、常染色体显性智力低下29型、nail-patella综合征(nps)、phelan–mcdermid综合征、pitt-hopkins综合征、原发性肺动脉高压1、rett综合征(先天性变异)、smith-magenis综合征(rai1相关)、sotos综合征1、sotos综合征2、stickler综合症i型、主动脉瓣上狭窄、syngap1相关智力障碍、treachercollins综合征、trichorhinophalangeal综合征i型、ulnar-mammary综合征、vanderwoude综合征1、waardenburg综合征1型、waardenburg综合征2a型和waardenburg综合征4c型。表1和表2描述了单倍剂量不足症的实例,包括相关的单倍剂量不足基因。
本公开提供了一种治疗有需要的受试者的单倍剂量不足症的方法。所述方法包括向受试者单独或与另一种治疗剂组合施用有效量的trna和/或表达载体,如本文公开的trna和/或表达载体,以治疗受试者的单倍剂量不足症。
在某些实施方案中,其中所述单倍剂量不足症是dravet综合征,所述方法降低受试者的癫痫发作频率、癫痫发作严重程度和/或认知障碍。例如,在某些实施方案中,所述方法在例如一天、一周或一个月时间内将受试者的癫痫发作频率降低至少10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。在某些实施例中,所述方法在例如一天、一周或一个月时间内将受试者的癫痫发作频率降低50%。
如本文所用,术语“有效量”是指足以实现有益或期望结果的活性药剂(例如,重组多肽和/或多聚体蛋白质)的量。有效量可以以一种或多种给药方式、用法或剂量施用,并且不限于特定的制剂或给药方式。
本文所用的“治疗(treat)”、“治疗(treating)”和“治疗(treatment)”是指治疗受试者(如人类)的疾病。这包括:(a)抑制疾病,即阻止其发展;(b)缓解疾病,即消退疾病的症状。如本文所用,术语“受试者”和“患者”是指应用本文所述的方法及组合物治疗的生物。这种生物优选包括但不限于哺乳动物(例如,鼠、猿、马、牛、猪、犬、猫等),更优选包括人类。
本文所述的方法及组合物可以单独使用或与其他治疗剂和/或方式结合使用。如本文所用,术语“联合”应理解为,在受试者患病期间向受试者提供两种(或多种)不同的治疗,使得对患者的治疗效果在某个时间点重叠。在某些实施方案中,一种治疗的递送仍在进行时就开始递送第二种治疗,因此在给药方面存在重叠。在本文中有时将其称为“同步”或“协同”。在其他实施方案中,一种治疗的递送在另一种治疗的递送开始之前结束。在其他实施方案中,由于联合给药,治疗效果更佳。例如,与在没有进行第一次治疗递送的情况下进行第二次治疗的递送相比,第二种治疗更有效(例如,用较少的第二种疗法就可以看到等效的效果,或者第二种疗法可以在更大程度上减轻症状),或者第一次治疗出现了类似的情况。在某些实施例中,递送使得症状或与疾病相关的其他参数的减少程度大于在不进行另一种治疗的情况下递送一种治疗所观察到的减少程度。这两种治疗的效果可以是部分相加、全部相加或协同。递送可以使得当递送第二种治疗时,递送的第一种治疗的效果仍然是可检测的。
在某些实施方案中,本文所述的方法或组合物与一种或多种其他药物联合施用,例如,
在整个说明书中,在组合物被描述为具有、包括或包含特定组分的情况下,或者在过程和方法被描述为具有、包括或包含特定步骤的情况下,另外可以设想,本发明所述组合物主要由所述组分组成或由所述组分组成,本发明的工艺及方法主要由所述处理步骤组成或由所述处理步骤组成。
在本申请中,当元素或组分被认为包括在列举的元素或组分的列表中和/或从列举的元素或组分的列表中选择时,应当理解,元素或组分可以是所列举的元素或组分中的任何一个,或者可以从由两个或多个列举的元素或组分组成的组中选择。
此外,应当理解,本文所述的组合物或方法的素素和/或特征可以以多种方式组合,无论在本文中是明确的还是隐含的均不脱离本发明的精神和范围。例如,当提及特定化合物时,除非根据上下文另有解释,所述化合物均可用于本发明组合物的各种实施方案和/或本发明的方法。换言之,在本申请中,已经以能够写出和绘制清晰简洁的申请的方式描述和描绘了实施方案,但是预期并且将被理解的是,在不脱离本申请教导和发明的情况下,可以对实施方式进行不同地组合或拆分。例如,应当理解,本文所描述和描绘的所有特征可以适用于本文描述和描绘的本发明的所有方面。
应该理解的是,除非从上下文和使用中另外理解,否则“至少一个”的表述包括在该表述之后的每个单独的所述对象以及两个或多个所述对象的各种组合。除非从上下文中另有解释,否则与三个或更多列举的对象相关的表述“和/或”应该被理解为具有相同的含义。
术语“包括(include)”、“包括(includes)”、“包括(including)”、“具有(have)”、“具有(has)”、具有(haing)”、“包含(contain)”、“包含(contains)”或“包含(containing)”以及其语法上的等同物的使用,通常应理解为开放式和非限制性的,例如,除非从上下文中另外具体陈述或解释,否则不排除额外的未引用的元素或步骤。
在术语“约”用于定量值之前的情况下,除非另有具体说明,本发明也包括具体的定量值本身。如本文所用,除非另有说明或推断,术语“大约”是指与标称值相差±10%。。
应当理解,只要本发明具有可操作性,步骤的顺序或执行某些动作的顺序是无关紧要的。此外,两个或多个步骤或动作可以同时进行。
除非另有声明,任何和所有实例或本文中的示例性语言的使用,例如,“诸如”或“包括”,仅仅是为了更好地说明本发明,而不是对本发明的范围作出限制。说明书中的任何语言都不应被解释为表示任何未要求保护的元素对于本发明的实施是必不可少的。
实施例
以下实施例仅仅是说明性的,并不旨在以任何方式限制本发明的范围或内容。
实施例1-增强野生型scn1a转录物表达的trna表达
在本实施例中,确定了scn1a中最不理想和最过表达的密码子。这些密码子的同源trna的表达可以增强scn1a的表达并治疗dravet综合征。
首先,确定scn1a基因中每个密码子的使用百分比。随后,使用trna适应性指数(tai)确定scn1a基因中每个密码子的最优性。tai是对每个密码子翻译效率的评估,它考虑了对trna细胞浓度(基于trna基因拷贝数)和解码效率的估计,较高的tai值表示更优的密码子。例如,在dosreis等人,(2004)nucleicacidsres.32(17):5036-5044和mahlab等人,(2014)ploscomput.biol.10(1):e1003294对tai进行了描述。对于本实施例中的计算,使用了基于hek293细胞中trna水平直接定量的修正tai值(如郑等人,(2015)nat.methods12(9):835–837),而不是基于trna基因拷贝数的估计值。
密码子使用百分比值乘以tai值的倒数,得出scn1a基因中每个密码子的得分。结果汇总见表3。通常,相对于转录组而言,得分最高的密码子在scn1a中是最不理想并且最富集的,这些密码子的同源trna是增强scn1a表达的最佳候选。
表3
实施例2-增强野生型scn1a转录物表达的trna表达
在本实施例中,评估了异位递送选择转运rna(trnas)以增强培养细胞中野生型scn1a表达的能力。
选择ata(ile)、gta(val)和aga(arg)作为scn1a基因中的示例性非最佳密码子。在seqidno:1中描述了编码atatrna(trnaata)的核苷酸序列,在seqidno:2中描述了编码gtatrna(trnagta)的核苷酸序列,在seqidno:3中描述了编码agatrna(trnaaga)的核苷酸序列。
通过rt-pcr、使用包含kpni位点的上游引物、包含noti位点的下游引物从人脑rna(clontech)中扩增scn1a开放阅读框。然后用kpni和noti位点将scn1a开放阅读框克隆在启动子和ptre-tight(clontech)的sv40poly(a)位点之间。
trnaata、trnagta和trnaaga基因序列(包括trna编码序列以及侧翼基因组dna序列的200个碱基对(bp)被排序为5'端具有xhoi位点,在3'端具有pcii位点的gblock(idt)。在seqidno:6中描述了trnaata基因序列(包括trna编码序列和侧翼基因组dna序列的200个碱基对),在seqidno:7中描述了trnagta基因序列(包括trna编码序列和侧翼基因组dna序列的200个碱基对),在seqidno:8中描述了trnaaga基因序列(包括trna编码序列和侧翼基因组dna序列的200个碱基对)。
使用xhoi和pcii位点将所有trna基因序列分别克隆到ptre-tight(clontech)中,使得只有氨苄青霉素抗性基因和cole1来源在ptre-tight中保留。通过测序确认了完整的trna基因序列。
将hek293细胞以每孔300,000个细胞在dmem中用10%胎牛血清在6孔板中铺板。24小时后,对每个孔进行模拟转染(无dna),或使用1、4、7或10μl的增强子和10μl的效应子(qiagen),用100ngscn1a质粒以及0、100、200或300ng每个trna进行转染。转染的细胞孵育24小时,然后根据产品说明书直接收获到trizol(thermofisher)中以制备总rna。然后,将每种条件下的2μg总rna用4u的turbodnase(thermofisher)处理,并通过用2.5m氯化锂沉淀进行净化。根据产品说明书,使用superscriptiiifirststrandsynthesissupermix和随机引物(thermofisher),以300ngdnase处理的rna在10μl的总反应体积中制备cdna。使用sybradvantageqpcr预混物(takara)、scn1a和gapdh引物以及每个反应中二十分之一的cdna,以10μl的总反应体积在步骤一实时pcr系统(appliedbiosystems)中进行qpcr。
如图3所示,在一定剂量范围内,异位trna表达对内源性转录物gapdh的影响最小。然而,异位trna表达导致scn1a表达的大致呈线性增加,在最高剂量下测试trna高达7倍(图3)。除了最高浓度的trna外,未观察到对细胞的明显毒性。
总之,这些结果表明mrna转录物例如scn1a转录物的表达可通过在该转录物中与非最佳密码子相关的trna的异位表达而增加。
实施例3-增强单倍剂量不足基因表达的trna表达
在本实施例中,确定了一系列与单倍剂量不足症相关的基因中最不理想和最过表达的密码子。这些密码子的同源trna的表达可以增强基因表达并治疗单倍剂量不足症。
如实施例1所述,测定基因中每个密码子的密码子使用百分比。随后,使用trna适应性指数(tai)确定基因中每个密码子的最优性。tai是对每个密码子翻译效率的评估,它考虑了对trna细胞浓度(基于trna基因拷贝数)和解码效率的估计值,较高的tai值表示更优的密码子。例如,在dosreis等人,(2004)nucleicacidsres.32(17):5036–5044和mahlab等人,(2014)ploscomput.biol.10(1):e1003294中描述了tai。密码子使用百分比值乘以tai值的倒数,得出基因中每个密码子的得分。通常,相对于转录组而言,得分最高的密码子是基因中最不理想并且最过表达的,这些密码子的同源trna是增强基因表达的最佳候选。
表4示出指示基因中三个最不理想和最过表达的密码子,表5示出了指示基因中10个最不理想和最过表达的密码子。
表4
表5
此外,除了使用基于hek293细胞中trna水平的直接定量的修正tai值(如郑等人,(2015)nat.methods12(9):835-837),而不是基于trna基因拷贝数的估计值,如上所述计算了指定基因中最不理想和最过表达的密码子。
表6示出了指示基因中3个最不理想和最过表达的密码子,表7示出了指示基因中10个最不理想和最过表达的密码子。
表6
表7
通过引用并入
出于所有目的,本文提及的每个专利和科学文献的全部公开内容通过引用合并于此。
等价物
在不脱离本发明的精神或必要特征的情况下,本发明可以以其他特定形式实施。因此,前述实施例在所有方面都被认为是说明性的,而不是对本文所描述的发明的限制。因此,本发明的范围由所附权利要求而不是由前述描述来指明,并且在权利要求的等同含义和范围内的所有变化都旨在包含在其中。
sequencelisting
<110>卡斯西部储备大学
<120>用于增加蛋白质表达和/或治疗单倍剂量不足症的方法及组合物
<130>cwr-027998woord
<160>9
<170>patentinversion3.5
<210>1
<211>92
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成构建体(syntheticconstruct)
<400>1
gctccagtggcgcaatcggttagcgcgcggtacttatacagcagtacatgcagagcaatg60
ccgaggttgtgagttcgagcctcacctggagc92
<210>2
<211>73
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成构建体(syntheticconstruct)
<400>2
ggttccatagtgtagtggttatcacgtctgctttacacgcagaaggtcctgggttcgagc60
cccagtggaacca73
<210>3
<211>85
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成构建体(syntheticconstruct)
<400>3
ggctccgtggcgcaatggatagcgcattggacttctagaggctgaaggcattcaaaggtt60
ccgggttcgagtcccggcggagtcg85
<210>4
<211>493
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成构建体(syntheticconstruct)
<400>4
aggctaggcggcccctccatccccgagggcgacactcgcaggcttccccggctcgatcgg60
ctgcggaacagccgggagctcggcgcgaagtcgcagaaggctcgggcctgggctcgcgcc120
gcgaacgcgcatgctctgccgaggcccgccgcgggcgccagcgcaccctgatagagccat180
cacgaggcccattcagcagagctccagtggcgcaatcggttagcgcgcggtacttataca240
gcagtacatgcagagcaatgccgaggttgtgagttcgagcctcacctggagcaagaccct300
tttggatgttcgcaaccccttttgtgtatctcgttgccagaagtaaggagtctctcttta360
gtcttctcccttcttgtttctaactgctctgccgcacgtccccattggccgcaagcagga420
agcagctcgcagtggactctcaataccccttttccgagctacttgttgccaccgcgcgac480
atccagccgctcg493
<210>5
<211>473
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成构建体(syntheticconstruct)
<400>5
ggcctcgccctggtcccaggggccgcgactgtggcgggcagggaagacaagccgcccaaa60
cgccggagcccgagactcgaagccgccgcaaactcctcgcctcgggggcggggtcacggt120
ggagaggcggggctccggcggagggaccggaactgctgtgagtctatgaataaagtccca180
acaatattcttcctcgtagaggttccatagtgtagtggttatcacgtctgctttacacgc240
agaaggtcctgggttcgagccccagtggaaccatagccgtaaggcggctgtttttgcttt300
tatagggtttcgttgtttgggttaaaaaaaaaaaagggtttgggttaaacaaacaaaaaa360
aaccaaaaagcgacaacgaagtgtttttctttgtcctttttttctttttaattttttggc420
atgtttttctcgcagaagtgaaatgacagataccctctcctatcccacaaggt473
<210>6
<211>485
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成构建体(syntheticconstruct)
<400>6
ctcaactgggtcgccgaccttgttgaggggcgaccactgcggggagaccgagagcctgcg60
gctggcgtttgaggcggatggcagtgccctgagcgcggcggctgggtctcggtgacactg120
acgacgggaggcgcggtcggaagagcgcggggccgtcgcctctggcttaacatagcagat180
gcgctgagactccaacaggtggctccgtggcgcaatggatagcgcattggacttctagag240
gctgaaggcattcaaaggttccgggttcgagtcccggcggagtcgtaacgcttttttccc300
tcccccctacaatttattttctgcctccatcatgtctcttattttttttttttgctaaac360
ggtttaacttctctctcattccctgctctcgcagttcactgcattcggttcttgcggtcc420
tttcttaagcggctcgcagggtcccgagcccctcagctccccgggcctcggtggcccagg480
gccca485
<210>7
<211>185
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成构建体(syntheticconstruct)
<400>7
gcgccagcgcaccctgatagagccatcacgaggcccattcagcagagctccagtggcgca60
atcggttagcgcgcggtacttatacagcagtacatgcagagcaatgccgaggttgtgagt120
tcgagcctcacctggagcaagacccttttggatgttcgcaaccccttttgtgtatctcgt180
tgcca185
<210>8
<211>165
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成构建体(syntheticconstruct)
<400>8
gctgtgagtctatgaataaagtcccaacaatattcttcctcgtagaggttccatagtgta60
gtggttatcacgtctgctttacacgcagaaggtcctgggttcgagccccagtggaaccat120
agccgtaaggcggctgtttttgcttttatagggtttcgttgtttg165
<210>9
<211>177
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成构建体(syntheticconstruct)
<400>9
gtcgcctctggcttaacatagcagatgcgctgagactccaacaggtggctccgtggcgca60
atggatagcgcattggacttctagaggctgaaggcattcaaaggttccgggttcgagtcc120
cggcggagtcgtaacgcttttttccctcccccctacaatttattttctgcctccatc177
- 还没有人留言评论。精彩留言会获得点赞!