作为ANKRD22抑制剂的先导化合物及其应用的制作方法
本发明涉及化合物及其应用,具体涉及一种作为ankrd22抑制剂的先导化合物及其应用。
背景技术:
人体胃肠粘膜经常暴露在多种损伤因子中,包括内源性因子如高浓度胃酸、胃蛋白酶、十二指肠液和外源性因子如非甾体类抗炎药(nsaids)、乙醇、药物和幽门螺杆菌(hp)感染等。胃肠道粘膜具有下列防御和修复机制,包括粘液-碳酸氢盐屏障、粘膜屏障、粘膜下血流量、细胞更新、前列腺素和生长因子保护等,能够抵御损伤因子的损害作用,维持胃肠粘膜的完整性。
胃肠粘膜损害是由于攻击因子的增强和/或保护因子的减弱所致。因此,对于胃肠粘膜炎性损害性疾病的药物治疗主要是消除攻击因子如抑制胃酸分泌、根除幽门螺杆菌感染等和增强粘膜防御因子两方面。然而近十余年来,随着抑酸剂、h2受体阻滞剂、质子泵抑制剂等的应用,胃肠粘膜炎性损害的治愈率增加,但其复发率仍较高。说明即使使用最强烈的抑酸剂也不会改变胃肠粘膜损害的自然病程,分析其原因可能为粘膜保护因素减弱所致。
随着对胃肠粘膜损害发病机制研究的进一步深入,学者们提出了“细胞保护”的概念,并负之于大量动物实验与临床观察。研究表明胃肠粘膜保护剂,针对“细胞保护”这一概念,在治疗胃肠粘膜相关疾病中,近期愈合率与h2受体阻滞剂相似,但复发率明显降低许多。研究表明胃肠粘膜保护剂可增强粘膜的防御、修复作用,显著提高胃肠组织损伤愈合质量,从而减轻炎症反应,降低复发率。
因此,研发新型胃肠粘膜保护剂对根本解决胃肠粘膜损伤的发生和复发将具有重要意义。近年来,随着人们对胃肠粘膜保护机制认识的加深,越来越多的胃肠粘膜保护剂被应用于临床。现已在国内外应用的胃粘膜保护剂有胃粘膜屏障增强剂胶态枸橼酸铋钾、硫糖铝等。另外,近几年国内外相继开发出几十种新型胃粘膜保护剂,其各自的粘膜保护机制侧重点均有所不同。基于理想的促进受损胃肠粘膜修复实质是“动员”胃肠粘膜上皮干细胞(其特征性为细胞膜阳性表达lgr5抗原,即lgr5+细胞,下称lgr5+干细胞)增殖和抑制组织局部粘膜上皮的炎症反应。然而,这些胃粘膜保护剂的作用靶点不明确,对胃肠粘膜上皮干细胞“动员”能力和抗炎能力也不确定。虽然这些药物有较好的治疗效果,但有关其不良反应的报道也日益增多,例如胃黏膜保护剂均可引起便秘;胶态枸橼酸铋钾由于其铋剂的不溶性和局部作用的特点,服药期间口中可能带有氨味,并可使舌、大便变黑,牙齿短暂变色;长期服用可引起外周血铋离子积蓄;硫糖铝服后可能出现腹胀、腹泻等胃肠道反应等。因此,寻找更加安全有效的胃肠粘膜保护剂药物对于攻克这一全球性疾病具有重要意义。
我们先前的研究发现,ankrd22基因的表达是与胃肠粘膜损伤修复密切相关的,是潜在的作为胃肠粘膜修复保护剂药物靶标的理想选择。ankrd22(ankyrinrepeatdomain22)蛋白是一个具有4个锚蛋白重复基序(ank)的小分子蛋白。每个ank包含2个反向α螺旋和1个α发卡样的l形结构,大小约30-34个氨基酸残基,形成高亲和的分子连接绞手架结构。体内包含ank基序的蛋白众多,功能非常广,而ankrd22在人体胃组织及巨噬细胞中有高表达水平,是一个联系了细胞代谢重编程和核重编程的分子,提示ankrd22这一靶点与胃肠组织粘膜上皮干细胞修复功能密切相关。目前关于ankrd22这一靶点的3d结构研究较少,未发现其晶体结构或者冷冻电镜结构被解析。拓扑结构分析该靶点包含4个结构域,其氨基酸位置分别处于第n39-l68,第k72-l100,第l101-a130,第y134-i163,但未发现任何关于其结构与功能关系的文献报道。在4个位点发现存在天然突变,分别位于第73位氨基酸(e→g)、第79(y→h)、第148位氨基酸(q→p)、第177位氨基酸(r→i)。但这些突变并未对ankrd22的功能产生任何影响,这说明或许氨基酸第73位(e→g)、第79位(y→h)、第148位(q→p)、第177位(r→i)突变与否未参与ankrd22行使功能,这对小分子结合区域的选择具有一定的指导意义。
ankrd22抑制剂具有促进胃肠粘膜上皮干细胞(lgr5+干细胞)扩增,间接激活wnt经典通路的作用,有助于机体受损胃肠粘膜组织的康复。ankrd22抑制剂及其衍生物有望成为具有靶向胃肠粘膜上皮干细胞、减轻炎症反应作用的新型胃肠粘膜修复保护剂。通过搜索bindingdb、drugbank、专利数据库以及药渡等数据库,我们发现有关于ankrd22靶点的多克隆抗体的研究,然而,到目前为止,尚未有人报道具有修复胃肠粘膜损伤效应的ankrd22抑制剂。因此,鉴于ankrd22可能参与的功能,开发靶向ankrd22的小分子抑制剂具有较好应用前景。
技术实现要素:
为解决上述背景技术中提出的问题,本发明的第一个目的,在于提供作为ankrd22抑制剂的先导化合物。
所采用的技术方案为:
作为ankrd22抑制剂的先导化合物,其为与ankrd22天然底物结合位点具有高亲和力的小分子化合物;亲和力为(1~9)×10-(5-12)m。“亲和力”是指分子的单一结合位点与其结合配偶体之间非共价相互作用总和的强度。
进一步地,其以
进一步地,其包括如下:
本发明的第二个目的在于提出ankrd22抑制剂的药物或药物组合物,
药物是以上述先导化合物为活性成分作为ankrd22抑制剂,以促进胃肠粘膜损伤修复作用的药物。
药物组合物包括至少一种上述的先导化合物和制药学上可用的载体。该药物组合物可根据本领域公知的方法制备。可通过将本发明化合物与一种或多种药学上可接受的固体或液体赋形剂和/或辅剂结合,制成适于人或动物使用的任何剂型。本发明化合物在其药物组合物中的含量通常为0.1-95重量%。
本发明的第三个目的在于提出一种ankrd22抑制剂的筛选方法,其是运用分子对接筛选模型,通过高通量筛选系统从小分子化合物库中筛选出能够降解ankrd22或抑制ankrd22活性的上述先导化合物。
本发明应用虚拟药物筛选技术与高通量筛选技术,通过建立虚拟ankrd22抑制剂筛选方法,和ankrd22活性检测方法,评价了化合物样品库中1,535,478个样品对ankrd22的抑制活性,发现了一批抑制活性较高的化合物。
进一步地,本发明是通过运行分子对接程序来从小分子化合物数据库中筛选与ankrd22天然底物结合位点具有高亲和力的小分子化合物。
进一步地,本发明是将ankrd22蛋白质上结合其相互作用位点的活性口袋选定作为对接化合物的活性位点。
进一步地,本发明利用所获得的三维结构信息和活性位点信息,在计算机上构建了一个针对ankrd22的计算机辅助药物筛选系统,然后运用该系统从小分子化合物数据库中筛选与之活性位点有高亲和力的化合物分子。
第二方面,本发明应用的52种ankrd22抑制剂通过化学合成制得,且早期化合物安全性评估证明其具有较好的成药性。
进一步地,本发明提供的52种ankrd22抑制剂在体外对胃肠组织细胞ankrd22活性和细胞内ca2+浓度抑制的半数有效剂量均在微摩尔水平。
进一步地,本发明确定了候选ankrd22抑制剂的50%抑制浓度(ic50)为50~100μm。
进一步地,本发明提供的52种ankrd22抑制剂在有效剂量范围内无明显的细胞毒性。
本发明的第四个目的在于提出上述先导化合物的应用。
第一种是,以上述先导化合物为活性成分作为ankrd22抑制剂在制备胃肠粘膜修复保护剂中的应用。
进一步地,所述胃肠粘膜修复保护剂为靶向胃肠粘膜上皮干细胞,促进胃肠粘膜上皮干细胞扩增和定向迁移的药物,或者为减轻胃肠组织炎症反应的药物。
针对ankrd22天然底物结合位点筛选的小分子化合物在体外试验中确实能起到扩增胃肠组织干细胞、减轻胃肠组织炎症反应的作用,确定ankrd22抑制剂是一种合适的新型胃肠粘膜修复保护剂。
第二种是,以上述先导化合物为活性成分作为ankrd22抑制剂在制备研究胃肠粘膜修复功能和作用机制的工具药中的应用。
进一步地,所述工具药为靶向胃肠粘膜上皮干细胞,促进胃肠粘膜上皮干细胞扩增和定向迁移的药物,或者为减轻胃肠组织炎症反应的药物。
发明人在研究中发现,发现本发明的小分子化合物具有较高的ankrd22抑制活性,进一步的实验结果表明本发明的化合物具有扩增胃肠组织粘膜上皮干细胞、减轻胃肠组织炎症反应的双重效应。本发明的化合物通过抑制wnt-ca2+信号通路,降低胃肠组织细胞内ca2+浓度,间接增加经典wnt通路激活水平,增加胃肠粘膜上皮干细胞扩增,促进胃肠炎症组织修复,有效地缓解实验性小鼠轻中度胃肠粘膜损伤的症状。
需要说明的是,本发明经过研究发现,联合应用高通量表型筛选模型和分子对接筛选模型,从1,535,478多个不同来源的化合物中筛选得到的52种ankrd22抑制剂对生物个体本身生长发育没有明显影响,对于无损伤的胃组织没有明显影响,因此,可以ankrd22抑制剂及其衍生物为活性成分制备胃肠粘膜修复保护剂,或制备研究胃肠粘膜修复功能和作用机制的工具药。
在本发明的具体实验中,首先测定了ankrd22小分子抑制剂对胃肠组织炎症反应的抑制作用。ankrd22抑制剂能够有效降低小鼠胃组织巨噬细胞经脂多糖(lps)激活引起的半胱氨酸天冬氨酸蛋白酶1(caspase-1)活性升高,这说明这些小分子化合物能够有效减轻组织炎症反应。
进一步的,在体外检测细胞内ca2+浓度及wnt通路活性的实验中我们发现,ankrd22抑制剂能够降低细胞在ankrd22过表达情况下引起的ca2+浓度增高,并且引起wnt信号通路下游基因c-myc和axin2表达增高,这不仅说明这些小分子化合物确实具有ankrd22抑制活性,还说明其抑制wnt-ca2+非经典信号通路,从而间接增加经典wnt通路激活水平。
其次,本发明对ankrd22抑制剂进行了扩增胃肠粘膜上皮干细胞的功能验证。利用小鼠胃组织类器官(organoid)模型,我们发现ankrd22抑制剂的应用明显增加了小鼠胃组织organoid克隆球形成数量。动物实验中,通过腹腔注射ankrd22小分子抑制剂,可以有效缓解盐酸乙醇溶液(hcl/etoh)诱导的实验性小鼠胃肠粘膜损伤症状,并且引起lgr5+干细胞比例明显增加,说明这些小分子化合物确实能够扩增胃肠粘膜上皮干细胞,具有胃肠粘膜修复作用。
可以理解,本发明的ankrd22小分子抑制剂具有很好的修复胃肠粘膜损伤效果,能够减轻胃肠组织炎症反应,扩增胃肠粘膜上皮干细胞,因此,完全可以制备成胃肠粘膜修复保护剂,用于修复胃肠粘膜轻中度损伤。其中,药物中还可以包括其它药学上可以接受的辅助成份或活性成份,在此不做具体限定。
综合而言,本发明运用分子对接筛选模型,通过高通量筛选系统从小分子化合物库中筛选出具有抑制ankrd22活性的线索化合物。本发明提供从线索化合物1,535,478个衍生物中筛选出的具有最佳量效关系的候选小分子化合物52个。在早期安全性评估证明其具有较好的成药性基础上,佐证了其能够减轻胃肠组织炎症反应,间接激活wnt-经典信号通路,从而扩增胃肠粘膜上皮干细胞,有效修复胃肠粘膜轻中度损伤,可应用其为活性成分制备胃肠粘膜修复保护剂。
由于采用以上技术方案,本发明的有益效果在于:
本发明针对ankrd22的活性位点进行计算机辅助的药物设计,高通量筛选小分子化合物数据库。通过虚拟筛选获得更可靠的潜在抑制剂,从而避免了实验的盲目性,并能在短时间内筛选大量的化合物,节约实验成本。该方法除用于筛选目的也可用于指导先导化合物的结构改造。本发明设计的小分子抑制剂,命中率高,工作量小,省时省钱省力,筛选到的化合物确实能有效扩增胃肠组织干细胞、减轻胃肠组织炎症反应。由于是针对细胞靶点设计的药物,而细胞靶点突变速率相对较慢,因此不易形成耐药性。本发明提供的ankrd22抑制剂具有促进胃肠粘膜上皮干细胞扩增,间接激活wnt经典通路的作用,有助于机体受损粘膜组织的康复。显而易见,本发明筛选的ankrd22抑制剂可在胃肠粘膜修复保护剂的开发中应用。
附图说明
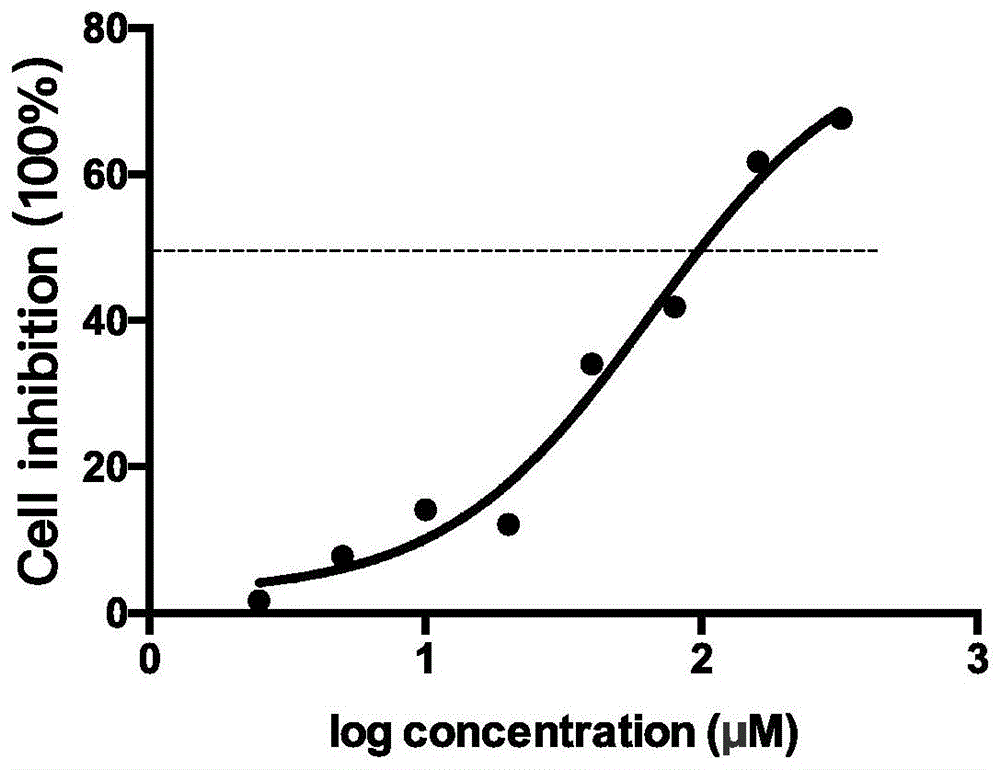
图1:mts[3-(4,5-二甲基噻唑-2-基)-5-(3-羧甲氧基苯基)-2-(4-磺苯基)-2h-四唑内盐](美国promega公司)分析法测定候选ankrd22抑制剂的50%抑制浓度(ic50)为50-100μm,ankrd22抑制剂在有效剂量范围内无明显的细胞毒性。其中,logconcentration(μm):ankrd22抑制剂浓度的对数值。cellinhibition(100%):细胞抑制率。
图2:不同浓度ankrd22抑制剂对ankrd22稳定表达细胞内ca2+水平的影响。
图3:ankrd22抑制剂对小鼠胃组织巨噬细胞caspase-1活性的影响。其中,wt,wildtype:野生型小鼠。control(ctrl):对照组。lps,脂多糖:脂多糖激活巨噬细胞的实验组。inhibitor,ankrd22抑制剂:ankrd22抑制剂处理巨噬细胞的实验组。yvad-cho:白细胞介素-1β转化酶选择性抑制剂。relativeluminescenceunit(rlu):相对荧光强度。
图4:ankrd22抑制剂对小鼠胃组织organoid克隆球形成数量的影响。其中,control(ctrl):对照组。inhibitor,ankrd22抑制剂:ankrd22抑制剂处理细胞的实验组。
图5:ankrd22抑制剂对粘膜损伤修复小鼠胃粘膜上皮lgr5+干细胞数比例的影响。其中,0:0mg/kg体重,腹腔注射生理盐水的对照组。inhibitor,ankrd22抑制剂:ankrd22抑制剂处理细胞的实验组。5:5mg/kg体重,腹腔注射5mg/kg体重ankrd22抑制剂的实验组。
具体实施方式
为使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合附图和具体实施方式,进一步阐述本发明是如何实施的。下述实施例中所述实验方法,如无特殊说明,均为常规方法;所述试剂和生物材料,如无特殊说明,均可从商业途径获得。
实施例1.建立针对ankrd22的计算机药物筛选系统。
本实施例中构建针对ankrd22的计算机药物筛选系统选用chemdiv(version2019)数据库,作为虚拟筛选的化合物库,其包含1,535,478个小分子化合物,该数据库具有骨架多样性。为了保证虚拟筛选过程中小分子全局构象,本实施例使用openeye软件中的插件omega做小分子构象生成,平均每个小分子生成大约50个构象。最终把chemdiv的分子转化为50,679,311个分子构象并保存。
实施例2.运用实施例1的计算机药物筛选系统从数据库中筛选与ankrd22活性位点有高亲和力的化合物。
分子对接是分子模拟的重要方法之一,其本质是两个或多个分子之间的识别过程,其过程涉及分子之间的空间匹配和能量匹配。分子对接方法在药物设计、材料设计等领域有广泛的应用。本实施例进行的虚拟筛选在安装ubuntukylin15.10操作系统的工作站(cpu:40;memory:64;ssd)上进行,使用虚拟筛选软件fred对ankrd22的同源建模结构进行虚拟筛选,其中运行参数如placement和scoringfunction均使用默认参数。translational
基于分子对接的虚拟筛选这一步骤是通过运行分子对接程序来从小分子化合物数据库中筛选与ankrd22天然底物结合位点(ankrd22蛋白质上结合其相互作用位点的活性口袋)具有高亲和力的小分子化合物。在本实施例中,针对ankrd22的活性中心对小分子化合物数据库的1,535,478种化合物进行筛选,得到52个与ankrd22天然底物结合位点具有高亲和力的小分子化合物。同时得到了小分子化合物与受体结合的相对构像(如图2所示)。筛选完所有的化合物库以后,通过综合亲和力打分以及人工观察小分子与靶蛋白质ankrd22天然底物结合位点的空间互补情况,最终确定候选的抑制剂(即小分子化合物)。
实施例3.ankrd22抑制剂在有效剂量范围内无明显的细胞毒性。
采用mts法测定实施例1所制得的ankrd22抑制剂对sgc7901胃腺癌细胞的毒性作用。所用sgc7901细胞来自中国科学院上海细胞库。
采用mts分析法,分别测定实施例1所制得的ankrd22抑制sgc7901剂对胃腺癌细胞的毒性作用,以52种ankrd22抑制剂作为测试样品,酶联免疫监测仪490nm测定od值,以给药浓度为横坐标,吸光值为纵坐标绘制细胞生长抑制率曲线,如图2所示。
其中,mts分析法的具体步骤为:
(1).接种细胞:用含10%胎牛血清的培养液配成单个细胞悬液,以每孔1000-10000个细胞接种到96孔板,每孔体积100μl。在5%co2细胞培养箱中培养24h后给药;
(2).药物配制:精密称取药物1mg溶于3ml二甲基亚砜(dmso)中配制成1mmol/l。设置给药梯度0、3.125、12.5、25、50、100、1000、10000nmol/l;
(3).给药后培养细胞:同一般培养条件,培养1天即24h;
(4).呈色:培养1天后,每孔加mts溶液20μl,继续孵育1小时;
(5).比色:选择490nm波长,在酶联免疫监测仪上测定各孔光吸收值,记录结果,以对数给药浓度为横坐标,细胞生长抑制率为纵坐标绘制细胞抑制曲线。
如图1可知,候选ankrd22抑制剂的50%抑制浓度(ic50)为50~100μm。作为ankrd22抑制剂的小分子化合物对于sgc7901胃癌细胞的ic50值均大于10μm,说明ankrd22抑制剂在有效剂量范围内无明显的细胞毒性。
实施例4.ankrd22抑制剂降低细胞内ca2+浓度,通过wnt-ca2+非经典信号通路,间接增强wnt经典通路激活水平。
图2显示了不同浓度ankrd22抑制剂对稳定表达ankrd22的sgc7901胃癌细胞中ca2+水平的影响。
提前一天进行细胞铺板并加入0或0.5μmankrd22抑制剂。将ankrd22稳定表达细胞与对照组细胞消化成单细胞后,加入10μmol/lfluo-4(美国invitrogen公司)和0.02%
如图2所示,ankrd22稳定表达细胞内ca2+浓度明显高于对照组野生型细胞;而0.5μm的ankrd22抑制剂处理明显降低细胞在ankrd22过表达情况下引起的ca2+浓度增高。p<0.05代表统计学差异上有显著意义。
图2说明ankrd22抑制剂可以通过抑制wnt-ca2+非经典信号通路,降低胃肠组织上皮细胞内ca2+浓度,间接增加经典wnt通路激活水平,扩增胃肠粘膜上皮干细胞。
实施例5.ankrd22抑制剂可以明显减少免疫细胞炎症小体形成,减轻胃肠道炎症反应水平。
图3显示了ankrd22抑制剂对经lps激活后的小鼠胃组织巨噬细胞caspase-1活性的影响。
提前一天提取c57bl/6j野生型雌性小鼠胃组织巨噬细胞,铺96孔板。用100ng/mllps(sigma)激活巨噬细胞4h后,用1μmankrd22抑制剂处理细胞,并以dmso刺激孔作为对照。利用caspase-1活性检测试剂盒(promega),以白细胞介素-1β转化酶选择性抑制剂ac-yvad-cho作为平行对照,通过化学发光检测仪测定发光强度。c57bl/6j野生型雌性小鼠来自浙江省中医药大学实验动物中心。
如图3所示,经过lps激活后的小鼠胃组织巨噬细胞caspase-1活性相比对照组均有明显增加;而ankrd22抑制剂处理后的野生型小鼠巨噬细胞caspase-1活性与对照组相比显著降低。p<0.05代表统计学差异上有显著意义。
图3说明ankrd22抑制剂可以明显减轻胃肠组织炎症反应,起到胃肠粘膜修复保护作用。
实施例6.ankrd22抑制剂能够扩增胃肠粘膜上皮干细胞。
图4显示了ankrd22抑制剂对小鼠胃组织organoid克隆球形成数量的影响。
用iv型胶原酶和透明质酸酶将c57bl/6j野生型雌性小鼠胃组织消化成单细胞,培养基重悬后,将matrigel基质胶(美国b&d公司)与细胞悬液等体积混合,接种到低粘附24孔板。细胞孵箱凝固2h后,加入无血清干细胞培养基,并用1μmankrd22抑制剂处理,以pbs处理作为对照。构建小鼠胃组织类器官(organoid)模型后,培养5天,镜下观察克隆球形态并计数。
如图4所示,ankrd22抑制剂的应用明显增加了小鼠胃组织organoid克隆球形成数量。p<0.05代表统计学差异上有显著意义。
图4说明ankrd22抑制剂确实能够扩增胃肠粘膜上皮干细胞,可能与胃肠粘膜修复作用有关。
实施例7.ankrd22抑制剂能够扩增胃肠粘膜上皮lgr5+干细胞,具有修复胃肠粘膜损伤的作用。
图5显示了ankrd22抑制剂对粘膜损伤小鼠的胃组织中lgr5+干细胞数量的影响。
实验性小鼠进行盐酸乙醇溶液(150mmhcl/60%absoluteethanolsolution,hcl/etoh)灌胃,造成胃肠粘膜损伤症状0h和24h后,腹腔注射ankrd22小分子抑制剂5mg/kg体重。48h后处死小鼠,将小鼠胃组织消化成单细胞后,1:50加入lgr5-pe抗体(德国miltenyi公司),置于4℃避光孵育30min,facscantoii流式细胞仪检测lgr5+干细胞比例。p<0.05代表统计学差异上有显著意义。
如图5所示,ankrd22抑制剂的应用明显增加了粘膜损伤后小鼠胃组织lgr5+干细胞比例。
图5说明ankrd22抑制剂确实增加损伤修复的胃肠组织lgr5+干细胞扩增,从而表现出靶向干细胞的胃肠粘膜保护作用。
以上内容是结合具体的实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。更确切地,本发明涉及本文所公开的抗体、器械和试剂盒等及其用途,以及控制ankrd22表达水平,并且按所述细节内容可作出各种修改方案,这些修改方案在权利要求书的范围和等同权利要求范围之内,并不偏离本发明的精神。
- 还没有人留言评论。精彩留言会获得点赞!