用于分析和鉴定桃遗传多样性的SCoT分子标记及其应用的制作方法
本发明涉及用于分析和鉴定桃遗传多样性的scot分子标记及其应用,属于桃遗传多样性研究领域。
背景技术:
随着我国桃产业的蓬勃发展,桃新品种的培育过程越来越短,市场桃品种更新换代愈加的频繁。新品种的出现易引起果农盲目的跟风,将果园老树砍掉,更换桃树新品种,其不知在桃品种更替的同时也带来一定的种植风险;如中华寿桃具有明显的裂果特点,裂果后的商品特性与经济价值极低,某些桃新品种存在中华寿桃的遗传背景,其也具有同样裂果特性,果农盲目种植极易带来种植风险和经济损失。此外,桃品种名称缺乏统一科学的命名,同一品种多个名字的现象时有发生,为科研与产业发展带了很多不便之处。不同桃品种之间的鉴别与亲缘关系的划分成为桃产业未来发展亟需解决的问题,发明高效、简洁、准确的鉴定方法是十分必要的。
技术实现要素:
本发明针对上述问题,提供了用于分析和鉴定桃遗传多样性的scot分子标记及其应用。本发明利用30条引物可快速、高效、准确对桃品种进行鉴定,且本发明简易便捷、成本低。本发明的30个scot引物如表1所示:
表1
scot分子标记分析和鉴定桃遗传多样性的方法,步骤如下:
(1)采用ctab提取法提取桃叶片dna
①采取桃幼嫩叶片,加液氮研磨成粉末状,移入2ml离心管中;
②加入800μl的ctab提取缓冲液,混匀(ctab在65℃水浴预热),每20min轻轻震荡几次,40min后12000r/min,离心10min;上下颠倒混匀100次,12000r/min,离心10min;
③小心吸取上清液,加入等体积的预冷异丙醇,混匀,4℃,20min,12000r/min,离心10min;
④弃去上清液,用75%乙醇(体积分数)洗涤沉淀2次;
⑤室温下干燥后(一般干燥5-15min),溶于30-50μl去离子水中,于-20℃或者-70℃下保存备用。
(2)基于scot引物的桃pcr扩增体系,反应总体积20μl;
桃dna模板(50~75ng/μl)1.0μl;
2×extaqmix(含mg2+、dntps、loadingbuffer)10.0μl;
scot引物(10μmol/l)1.0μl;
ddh2o8.0μl。
反应程序为:
94℃预变性5min;
94℃变性30s;
47℃退火30s;
72℃延伸3min,共35个循环;
72℃延伸5min;
4℃降温冷却。
(3)pcr产物琼脂糖凝胶电泳的电测
制作添加gelred指示剂(gelred核酸染料)的1%(质量分数)琼脂糖凝胶,将基于scot引物的桃pcr扩增产物加入琼脂糖凝胶,置于1×tae缓冲液的电泳槽中,电泳的电压为5v/cm,待溴酚兰迁移至琼脂糖凝胶的2/3处时,取出凝胶用清水漂洗,置于uvifirereader自动凝胶成像仪中观察、拍照记录结果;
(4)琼脂糖凝胶的结果分析
通过软件quantityone分析琼脂糖凝胶电泳结果。
本发明与现有技术相比具有以下优点:
本发明分析和鉴定桃遗传多样性条带多态性较高,条带清晰有序,本发明利用30条引物可快速、高效、准确对桃品种进行鉴定,且简易便捷、成本低。
附图说明
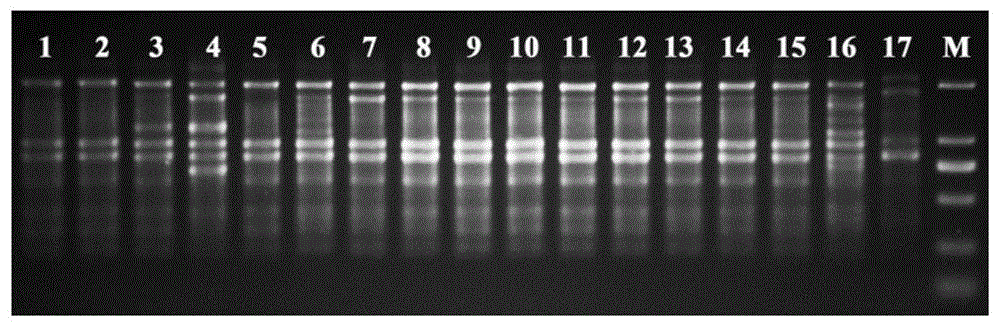
图1a为以psoct1为引物在17个桃品种pcr扩增的条带多态性;
图1b为通过软件quantityone量化psoct1引物在17个桃品种pcr扩增的条带多态性;
图2a为以soct2为引物在17个桃品种pcr扩增的条带多态性;
图2b为通过软件quantityone量化soct2引物在17个桃品种pcr扩增的条带多态性;
图3a为以soct3为引物在17个桃品种pcr扩增的条带多态性;
图3b为通过软件quantityone量化soct3引物在17个桃品种pcr扩增的条带多态性;
图4a为以soct4为引物在17个桃品种pcr扩增的条带多态性;
图4b为通过软件quantityone量化soct4引物在17个桃品种pcr扩增的条带多态性;
图5a为以soct6为引物在17个桃品种pcr扩增的条带多态性;
图5b为通过软件quantityone量化soct6引物在17个桃品种pcr扩增的条带多态性;
图6a为以soct8为引物在17个桃品种pcr扩增的条带多态性;
图6b为通过软件quantityone量化soct8引物在17个桃品种pcr扩增的条带多态性;
图7a为以soct9为引物在17个桃品种pcr扩增的条带多态性;
图7b为通过软件quantityone量化soct9引物在17个桃品种pcr扩增的条带多态性;
图8a为以soct10为引物在17个桃品种pcr扩增的条带多态性;
图8b为通过软件quantityone量化soct10引物在17个桃品种pcr扩增的条带多态性;
图9a为以soct11为引物在17个桃品种pcr扩增的条带多态性;
图9b为通过软件quantityone量化soct11引物在17个桃品种pcr扩增的条带多态性;
图10a为以soct12为引物在17个桃品种pcr扩增的条带多态性;
图10b为通过软件quantityone量化soct12引物在17个桃品种pcr扩增的条带多态性;
图11a为以psoct13为引物在17个桃品种pcr扩增的条带多态性;
图11b为通过软件quantityone量化psoct13引物在17个桃品种pcr扩增的条带多态性;
图12a为以soct14为引物在17个桃品种pcr扩增的条带多态性;
图12b为通过软件quantityone量化soct14引物在17个桃品种pcr扩增的条带多态性;
图13a为以psoct13为引物在15个桃品种pcr扩增的条带多态性;
图13b为通过软件quantityone量化psoct13引物在15个桃品种pcr扩增的条带多态性;
图14a为以psoct16为引物在17个桃品种pcr扩增的条带多态性;
图14b为通过软件quantityone量化psoct16引物在17个桃品种pcr扩增的条带多态性;
图15a为以soct19为引物在17个桃品种pcr扩增的条带多态性;
图15b为通过软件quantityone量化soct19引物在17个桃品种pcr扩增的条带多态性;
图16a为以soct20为引物在17个桃品种pcr扩增的条带多态性;
图16b为通过软件quantityone量化soct20引物在17个桃品种pcr扩增的条带多态性;
图17a为以soct21为引物在17个桃品种pcr扩增的条带多态性;
图17b为通过软件quantityone量化soct21引物在17个桃品种pcr扩增的条带多态性;
图18a为以soct22为引物在17个桃品种pcr扩增的条带多态性;
图18b为通过软件quantityone量化soct22引物在17个桃品种pcr扩增的条带多态性;
图19a为以soct24为引物在17个桃品种pcr扩增的条带多态性;
图19b为通过软件quantityone量化soct24引物在17个桃品种pcr扩增的条带多态性;
图20a为以psoct25为引物在17个桃品种pcr扩增的条带多态性;
图20b为通过软件quantityone量化psoct25引物在17个桃品种pcr扩增的条带多态性;
图21a为以soct26为引物在17个桃品种pcr扩增的条带多态性;
图21b为通过软件quantityone量化soct26引物在17个桃品种pcr扩增的条带多态性;
图22a为以soct27为引物在17个桃品种pcr扩增的条带多态性;
图22b为通过软件quantityone量化soct27引物在17个桃品种pcr扩增的条带多态性;
图23a为以soct28为引物在17个桃品种pcr扩增的条带多态性;
图23b为通过软件quantityone量化soct28引物在17个桃品种pcr扩增的条带多态性;
图24a为以soct29为引物在17个桃品种pcr扩增的条带多态性;
图24b为通过软件quantityone量化soct29引物在17个桃品种pcr扩增的条带多态性;
图25a为以soct30为引物在17个桃品种pcr扩增的条带多态性;
图25b为通过软件quantityone量化soct30引物在17个桃品种pcr扩增的条带多态性;
图26a为以soct31为引物在17个桃品种pcr扩增的条带多态性;
图26b为通过软件quantityone量化soct31引物在17个桃品种pcr扩增的条带多态性;
图27a为以soct32为引物在17个桃品种pcr扩增的条带多态性;
图27b为通过软件quantityone量化soct32引物在17个桃品种pcr扩增的条带多态性;
图28a为以soct33为引物在17个桃品种pcr扩增的条带多态性;
图28b为通过软件quantityone量化soct33引物在17个桃品种pcr扩增的条带多态性;
图29a为以soct35为引物在17个桃品种pcr扩增的条带多态性;
图29b为通过软件quantityone量化soct35引物在17个桃品种pcr扩增的条带多态性;
图30a为以soct36为引物在17个桃品种pcr扩增的条带多态性;
图30b为通过软件quantityone量化soct36引物在17个桃品种pcr扩增的条带多态性;
图31为利用软件ntsys进行17个桃品种的聚类分析图。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
实施例:用于分析和鉴定桃遗传多样性的scot分子标记及其应用
所述scot分子标记包括30个scot引物,引物如表1所示:
表1
scot分子标记分析和鉴定桃遗传多样性的方法,步骤如下:
(1)桃叶片dna的提取采用ctab提取法
①采取桃幼嫩叶片,加液氮研磨成粉末状,移入2ml离心管中;
②加入800μl的ctab提取缓冲液,混匀(ctab在65℃水浴预热),每20min轻轻震荡几次,40min后12000r/min,离心10min;上下颠倒混匀100次,12000r/min,离心10min;
③小心吸取上清液,加入等体积的预冷异丙醇,混匀,4℃,20min,12000r/min,离心10min;
④弃去上清液,用75%乙醇洗涤沉淀2次;
⑤室温下干燥后(一般干燥5-15min),溶于30-50μl去离子水中,于-20℃或者-70℃下保存备用。
(2)基于scot引物的桃pcr扩增体系,反应总体积20μl;
桃dna模板(50~75ng/μl)1.0μl;
2×extaqmix(含mg2+、dntps、loadingbuffer)10.0μl;
scot引物(10μmol/l)1.0μl
ddh2o8.0μl。
反应程序为:
94℃预变性5min;
94℃变性30s;
47℃退火30s;
72℃延伸3min,共35个循环;
72℃延伸5min;
4℃降温冷却。
(3)pcr产物琼脂糖凝胶电泳的电测
制作添加gelred指示剂(gelred核酸染料)的1%琼脂糖凝胶,将基于scot引物的桃pcr扩增产物加入琼脂糖凝胶,置于1×tae缓冲液的电泳槽中,电泳的电压为5v/cm,待溴酚兰迁移至琼脂糖凝胶的2/3处时,取出凝胶用清水漂洗,置于uvifirereader自动凝胶成像仪中观察、拍照记录结果;
(4)琼脂糖凝胶的结果分析
通过软件quantityone分析琼脂糖凝胶电泳结果,将30条scot引物扩增的pcr产物进一步分析。
实验例:
选取17桃品种:1.秋风蜜;2.金秋红蜜;3.晚熟白桃;4.红里肥桃;5.八月脆;6.寒露蜜;7.离核寒露蜜;8.鲁优-1;9.鲁优-2;10.金牛山1号;11.青州蜜-1;12.青州蜜-2;13.沂蒙霜红;14.映霜红;15.映霜红(肥城);16.中华寿桃;17.10月晚熟桃
利用实施例的方法对17桃品种进行分析、鉴定,17桃品种pcr扩增后电泳胶结果如图1a-图30a所示,从最左到最右为1-17号和marker(简写m);通过软件quantityone量化本发明30条soct引物在17个桃品种pcr扩增的条带多态性如图1b-图30b所示;并对电泳结果进行统计。
利用软件ntsys进行17个桃品种的聚类分析,结果图31所示。
结果显示,利用本发明30个scot引物结合本发明的方法,可以把外观相近不易区分的桃品种进行高效的梳理,同时可以对具体桃品种的遗传背景进行相关的了解。比如说自主选育的品种金牛山1号与青州蜜1亲缘关系非常近,金牛山1号具有晚熟,成熟着色浅的特点,这与青州蜜桃的果实性状极为相似,通过scot标记,可以快速的对金牛山1号的遗传背景和亲缘关系进行分析。
- 还没有人留言评论。精彩留言会获得点赞!