一种代谢改造酿酒酵母降低黄酒中氨基甲酸乙酯含量的方法与流程
本发明涉及发酵和生物技术领域。具体的涉及一种代谢改造酿酒酵母降低黄酒中氨基甲酸乙酯含量的方法。
技术背景
氨基甲酸乙酯(ethylcarbamate,简称ec),又名尿烷(urethane),广泛存在于发酵食品(如腐乳、酱油等)、酿造酒(如黄酒、清酒、葡萄酒、苹果酒等)和蒸馏酒(如威士忌、白兰地等)中。据文献报道,我国黄酒中ec含量普遍高于清酒和葡萄酒,最高达1210μg·l-1。黄酒中ec含量偏高的问题由来已久,不仅带来了严峻的食品安全问题,同时也使黄酒的出口受到严重限制,是我国黄酒产业的一个重要安全隐患。因此,探索适合我国黄酒企业控制ec含量的措施,降低黄酒中ec的含量,对于我国黄酒产业的发展具有重大意义。
研究表明,发酵食品和酒精饮品中的ec主要由尿素和瓜氨酸等氨甲酰化合物与乙醇反应生成。在相同的反应条件下,黄酒中的尿素与乙醇反应形成ec的速率约为相同浓度的瓜氨酸与乙醇反应形成ec速率的3倍。因此,尿素是黄酒中形成ec的主要前体物质,而黄酒中的尿素主要由酿酒酵母saccharomycescerevisiae在发酵过程中代谢精氨酸产生。精氨酸是黄酒发酵过程中含量丰富的氨基酸之一,酿酒酵母在精氨酸酶(由car1编码)的作用下降解精氨酸生成尿素和鸟氨酸。尿素会在脲基酰胺酶(由dur1,2编码)的作用下降解为nh3和co2。因此,通过代谢工程改造敲除酿酒酵母的car1基因,可以阻断酵母的尿素生成途径,从而从根源上减少黄酒发酵过程中尿素的积累和ec的形成。
本发明以来自于二倍体工业酿酒酵母的尿嘧啶缺陷型单倍体为改造对象,以尿嘧啶缺陷型的恢复为筛选标记,构建酿酒酵母car1(编码精氨酸酶)敲除组件,然后转化尿嘧啶缺陷型单倍体菌株,筛选阳性转化子,获得敲除了car1基因的单倍体黄酒酵母。将改造后的单倍体工程菌融合为二倍体后进行黄酒发酵实验,结果表明,与亲本菌株相比,工程菌发酵液中尿素和ec的含量明显降低。因此,本发明为进一步降低黄酒中ec的含量提供了新的思路。
技术实现要素:
本发明的目的在于以酿酒酵母尿嘧啶缺陷型的恢复为筛选标记,构建精氨酸酶编码基因car1的敲除组件car1l-ura3-car1r,转化尿嘧啶缺陷型单倍体,通过同源重组在酿酒酵母基因组car1的开放阅读框(openreadingframe,简称orf)插入完整的酿酒酵母ura3基因,获得敲除了car1基因的单倍体工程菌。利用该方法获得的酵母工程菌为原养型菌株,代谢工程改造不会影响其生长和发酵性能,可以减少黄酒发酵液中尿素的含量。而且本发明构建的car1敲除组件中所有的基因片段都是以酿酒酵母自身基因组为模板扩增得到,因此获得的工程菌不含外源基因,具有生物安全性。同时,本发明适用于其他酵母和基因的代谢改造。
本发明构建低产尿素工业酿酒酵母工程菌的方法由以下步骤组成:
(1)car1基因敲除组件(car1l-ura3-car1r)的构建;
(2)将上述基因敲除组件转入尿嘧啶缺陷型单倍体,并筛选阳性克隆。
上述car1基因敲除组件由酿酒酵母car1基因的上游同源臂(car1l)、下游同源臂(car1r)和完整的ura3基因组成;优选引物seqidno:1和seqidno:2扩增的片段作为ura3基因,优选引物seqidno:3和seqidno:4扩增的片段作为cr1基因;
上述筛选标记优选为尿嘧啶缺陷型,之所以选择尿嘧啶缺陷型的恢复为筛选标记是因为利用ura3可以在基本培养基(mm)和5-氟乳清酸(5-foa)培养基中进行阴性选择和阳性选择,是研究者对酿酒酵母进行代谢改造过程中最常用的遗传标记,当然,也可以利用本领域技术人员所知道的其他任何筛选标记,如色氨酸缺陷型、亮氨酸缺陷型、组氨酸缺陷型等;
上述尿嘧啶缺陷型单倍体菌株优选从工业酿酒酵母s.cerevisiaen85菌株分离得到的na-u和nα-u,之所以选择这两个单倍体是因为他们来源于绍兴黄酒厂生产过程中常用的酿酒酵母n85,是经过多次定向驯化的性状优良的野生型菌株;
上述将基因敲除组件转入尿嘧啶缺陷型单倍体的方法可以是电转化法,当然,也可以利用本领域技术人员所知道的任何将基因组件转入酵母细胞的方法,如聚乙二醇法、氯化锂法等;
上述阳性克隆的筛选包括利用mm培养基初步筛选阳性克隆子、通过提取基因组进行pcr验证以及扩增片段的测序验证。
本发明的优点是:
(1)本发明构建的敲除了car1的工程菌进行黄酒发酵实验时,能够减少发酵液中尿素的积累,并降低ec的含量;
(2)利用本方法获得的酵母工程菌为原养型菌株,代谢工程改造对其生长和发酵性能没有影响;
(3)利用本方法获得的酵母工程菌基因组不含外源基因,具有一定的生物安全性,更容易被大众所接受,具有潜在的应用可能性;
附图说明
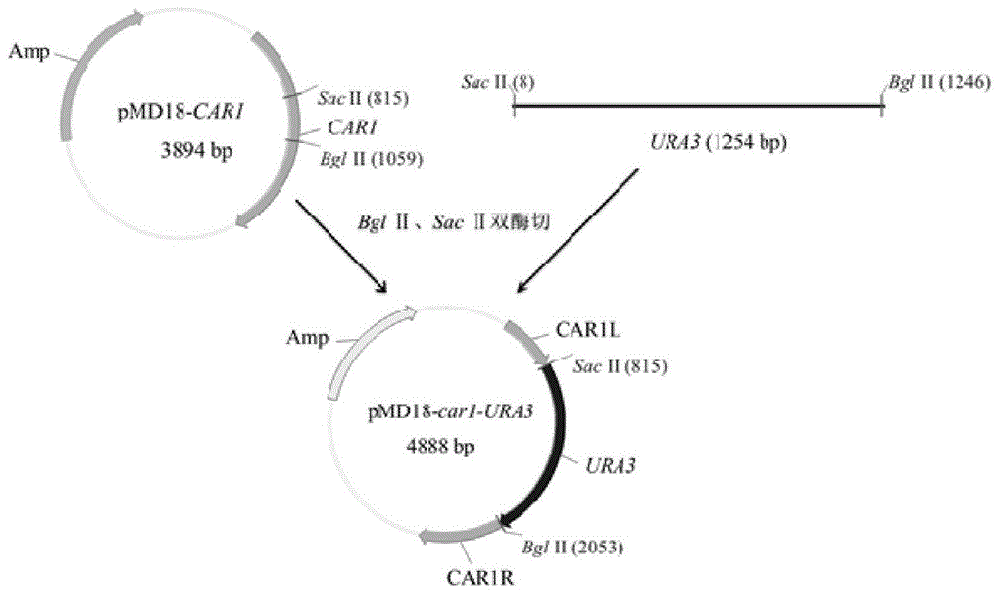
图1car1基因敲除组件的构建示意图;
图2car1基因缺失转化子的pcr鉴定电泳图;其中,泳道1:a型阳性转化子na-c(2195bp);泳道2:α型阳性转化子nα-c(2195bp);泳道3:以n85基因组为模板的阴性对照(1201bp);m:dna分子量markerdl5000
图3酵母菌株黄酒发酵过程中的co2失重曲线;
图4酿酒酵母精氨酸酶酶活的比较;
具体实施方法
以下结合附图,并通过实施例对本发明进行具体说明。这些实施例仅用于说明本发明而不用于限制本发明的范围。
以下实施例1~实施例3所涉及实验材料如下:
菌株:实施例中所用到的二倍体工业酿酒酵母s.cerevisiaen85储藏于国家黄酒工程技术研究中心,两种配型的尿嘧啶缺陷型单倍体菌株na-u和nα-u由本实验室分离获得并保藏于本实验室。
试剂与试剂盒:primestardnapolymerase(2.5u/μl)、extaq(5u/μl)、minibestuniversalgenomicdnaextractionkit、minibestagrosegeldnaextractionkit均购自宝生物工程(大连)有限公司,精氨酸酶酶活测定试剂盒quantichromarginaseassaykit购于美国bioassaysystems公司。
原料:糯米、生麦曲、熟麦曲均由国家黄酒工程技术研究中心提供。
其他试剂和原料均为市售国产或进口分析纯产品。
实施例1~实施例3实验中所使用引物序列如表1所示,由生工生物工程(上海)股份有限公司合成。
表1本发明所用到的引物序列
注:a加粗序列为sacⅱ位点;b加粗序列为bglⅱ位点。
实施例1car1基因敲除组件的构建
car1基因敲除组件的构建如图1所示。首先,提取工业酿酒酵母n85基因组dna(具体操作方法参见minibestuniversalgenomicdnaextractionkit试剂盒使用说明书),以该基因组dna为模板,利用primestardnapolymerase分别使用引物对p1/p2和p3/p4扩增ura3基因(1235bp)和car1基因(1201bp),pcr具体操作方法及反应体系配制参见primestardnapolymerase说明书。然后将扩增到的car1基因进行t克隆,获得质粒pmd18-car1。利用sacⅱ和bglⅱ两个酶对ura3扩增片段和质粒pmd18-car1进行双酶切,分别回收1230bp和3649bp大小的片段。将回收的两个片段利用t4连接酶进行连接,构建含有car1基因敲除组件(car1l-ura3-car1r)的亚克隆载体pmd18-car1-ura3,并转化大肠杆菌e.colijm109。送生工生物工程(上海)股份有限公司测序结果正确,说明car1基因敲除组件构建成功。
实施例2酿酒酵母car1基因的敲除
利用电转化的方法将上述获得的基因敲除组件car1l-ura3-car1r分别转化a型和α型的尿嘧啶缺陷型单倍体na-u和nα-u,具体步骤如下:
(1)挑取酵母单菌落接种于1mlypd液体培养基,于30℃200r/min过夜培养,得活化种子液;
(2)按照体积比10%的接种比例,将种子液转接至50ml新鲜的ypd液体培养基,于30℃200r/min继续培养至菌液od600在1.2~1.5之间;
(3)5000r/min离心5min收集菌体,用25ml无菌水离心洗涤菌体两次;
(4)用8ml10mm二硫苏糖醇溶液重悬菌体,于30℃水浴振荡30min,5000r/min离心5min收集菌体;
(5)用15ml4℃预冷的1m山梨醇溶液重悬菌体,于5000r/min4℃离心5min收集菌体;
(6)重复步骤(5)3次;
(7)用0.5ml1m山梨醇重悬菌体,取80μl菌液,加入10μl转化片段以及20μl1mg/ml鲑鱼精dna,混合后转入电击杯,冰上放置5min后,1.5kv电击;
(8)加入890μlypd培养基将电转液洗出转移到1.5ml离心管内,于30℃150r/min复苏2h,涂布于mm培养基[0.17%(w/v)ynb(yeastnitrogenbasewithoutaminoacids),2%(w/v)glucose,0.5%(w/v)ammoniumsulfate,2%(w/v)agar]平板,于30℃培养至菌落长出;
(9)挑取转化子并提取基因组作为模板,使用引物对p3/p4进行pcr扩增以鉴定car1基因被敲除的阳性转化子。
pcr鉴定结果如图2所示。
图2中,泳道1和2扩增片段大小为2195bp左右,为阳性转化子,泳道3扩增片段大小为1201bp左右,为阴性对照。分别回收条带后,送生工生物工程(上海)股份有限公司测序结果正确,说明酿酒酵母的car1基因被成功敲除。
实施例3工业酿酒酵母工程菌的黄酒发酵实验
将上述获得的敲除car1基因的两种配型的工程菌进行融合,获得二倍体工程菌,具体操作方法参考文献1(杨瑞娟.高产酒率酿酒酵母单倍体的分离与杂交育种[d].浙江大学,2007)。并将工程菌与出发菌株一起进行黄酒发酵实验以考察工程菌减少尿素和ec含量的能力,具体操作步骤如下:
黄酒发酵工艺流程:浸米→蒸饭→冷却→拌曲→接种→前酵→后酵→过滤澄清。
(1)浸米:取100g糯米,加水浸过米层10cm左右,室温浸泡2~3d;
(2)蒸煮:采用常压蒸煮的方式,待有大量蒸汽冒出后维持20min左右,至内无白心、颗粒均匀、软而不烂、熟而不黏;
(3)拌曲:将蒸熟的米放置在通风处冷却、摊凉至室温(27℃左右)后,添加13g生麦曲(13%)和4g熟麦曲(4%)与糯米摊拌均匀;
(4)前酵:将拌好的糯米和麦曲转入500ml的三角瓶,加入170ml水,按照5%的接种量接入酵母种子液,加发酵栓,摇匀,置于30℃发酵。每日称重摇瓶,当co2日失重量小于0.2g时结束前酵;
(5)后酵:将三角瓶置于15℃生化培养箱,静置发酵15d左右;
(6)过滤:使用三十二折滤纸进行过滤;
(7)指标测定:参照gb/t13662-2008中的方法进行常规理化指标的测定;发酵液中尿素和ec的测定分别参考文献2(邢江涛,等.酿酒科技,2011(3):104-106)和文献3(wupg,etal.foodcontrol.2012,23(1):286-288);参照精氨酸酶酶活测定试剂盒说明书进行操作,其中,精氨酸酶酶活单位定义为:在37℃,ph9.5的条件下,l-精氨酸每分钟生成1μmol尿素所需要的酶量。
酵母菌株在发酵过程中co2的失重曲线见图3,发酵液理化指标的测定结果见表2,尿素和ec的含量见表3。
表2黄酒发酵液中理化指标的测定
由图3和表2可知,工程菌与亲本菌株在发酵过程中co2的失重曲线基本一致,发酵液中理化指标的含量也没有明显差异,说明工程菌的生长和发酵能力与亲本菌株相似,代谢工程改造对酵母的生长和发酵性能没有影响。
表3黄酒发酵液中尿素和ec含量的比较
注:同一列中,所有数据均与n85的数值相比;*,表示对应p<0.05差异的显著性;
由表3结果可知,敲除了car1基因的工程菌黄酒发酵液中尿素含量为4.9mg/l,与亲本菌株相比,降低了86.9%,而ec含量降低了50.5%,仅为10.3μg/l。经过90d室温贮存后,亲本菌株n85发酵液中ec的含量增加了205.8%,为63.6μg/l;而工程菌发酵液中ec的含量为13.5μg/l,仅增加了30%。图4结果表明,由于car1基因的敲除,导致工程菌精氨酸酶酶活骤减(降低了91.9%),从而阻断了酿酒酵母分解精氨酸生成尿素的途径。由于发酵液中ec的含量以及生成速率与醪液中尿素的含量呈正相关,所以,尿素含量的降低,也就使得发酵液在贮存过程中ec含量的增幅减小。
综上所述,本发明以酿酒酵母自身的ura3作为遗传标记,构建了敲除精氨酸酶编码基因car1的敲除组件,通过转化获得了敲除car1的工程菌。该工程菌与亲本菌株在黄酒发酵过程中生长和发酵性能相似,而工程菌发酵液中尿素和ec的含量分别降低了86.9%和50.5%,而且还可以减缓长期储酒过程中ec的形成速率,减少了黄酒中ec的含量,提高了其饮用安全性。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!