酿酒酵母菌株YWY-1、用该菌株制备的发酵滤液、用该滤液制备的化妆水及制备方法与流程
本公开属于化妆品技术领域,具体涉及一种酿酒酵母菌株ywy-1、用该菌株制备的发酵滤液、用该滤液制备的化妆水及制备方法。
背景技术:
酵母提取物含有多种营养成分,如维生素、氨基酸、多糖、微量元素等,这些营养成分的存在使得酵母提取物具有了各种各样的功效。比如抗衰老功效,酵母提取物可以中和自由基,改善皱纹和细纹,增加皮肤弹性,让肌肤变得平顺、细致,还也可减轻和预防皮肤在早期衰老过程中产生的肤色暗沉问题。又如锁水保湿功效,酵母提取物中含有的葡萄糖等多糖类物质是天然的保湿剂,某些多糖成分(β葡聚糖)还有消炎的效果。再比如亮肤功效,酵母提取物可以促进含黑色素角质细胞的新陈代谢,加速角质脱落,促进合成表皮层蛋白质,改善肌肤质地,提亮肤色。
鉴于酵母提取物的上述功效,在化妆品和化妆品上有广阔的应用前景,市面上也有多种著名的含酵母提取物的化妆品,比如,馥蕾诗(fresh)红茶酵母精华,主要成分红茶酵母菌发酵产物滤液,具有良好的美白祛斑功能。又比如,sk-ii神仙水,核心成分pitera是半乳糖酵母样菌发酵产物滤液,具有美白祛斑、保湿、抗氧化等效果。
通常酵母提取物通过其产生方法主要有如下两种:1)酵母溶胞产物提取物,通过破坏酵母细胞壁,过滤其细胞液,从而提取到具有化妆价值的成分,其富含氨基酸,维生素,多糖,核酸和矿物质;2)酵母发酵产物滤液,即酵母发酵时产生的排泄物,可以通过选择不同的酵母种类及不同的营养及应激条件和营养,得到不同的酵母滤液提取物。
鉴于酵母提取物具有如上的功效,市场需求庞大,也驱动着研发人员不断寻找新的酵母菌种,制备更多种类的、性能优良的酵母提取物及其制品,以满足消费者的需求。
技术实现要素:
为了解决以上问题,本公开提供了一种酿酒酵母菌株ywy-1、用该菌株制备的发酵滤液、用该滤液制备的化妆水及制备方法。
为解决上述技术问题,本公开提供的技术方案是:
第一方面,本公开提供一种酿酒酵母(saccharomycescerevisiae)菌株ywy-1,其保藏编号为cgmccno.17452。本公开的酿酒酵母(saccharomycescerevisiae)菌株ywy-1由申请人从自然发酵的大米发酵液中分离纯化得来,具体做法如下:将自然发酵的大米发酵液制成菌液(取5ml发酵液与45ml无菌生理盐水混合,浓度10:1),继续用无菌生理盐水稀释至10:7;吸取50μl稀释后的菌液于孟加拉红固体平板上(孟加拉红0.033g/l,氯霉素0.1g/l,mgso40.5g/l,kh2po41g/l,蛋白5g/l,葡萄糖10g/l,琼脂15g/l),用涂布棒涂匀,28℃培养48h;挑选单个的具有典型酵母菌菌落特征且形态差异较为明显的菌落,划线纯化2~3代;将上述分离纯化得到的酵母菌接入yepd斜面培养基(酵母浸出粉5g/l,蛋白胨10g/l,琼脂14g/l,葡萄糖20g/l),4℃保藏,获得纯化菌株。
第二方面,本公开提供一种使用上述酵母新菌种制备发酵滤液的方法,包括:
菌液制备步骤:将酿酒酵母(saccharomycescerevisiae)菌株ywy-1接种于合适的培养基进行培养活化处理,然后将培养活化处理得到的单菌落接种至合适的培养基进行扩大培养得到酵母菌液;
大米发酵底物制备步骤:将大米与水按比例调配后,进行第一次灭菌处理,制得大米发酵底物;
发酵步骤:将所述酵母菌液接种至所述大米发酵底物,进行发酵处理;
尾处理步骤:将所述发酵处理后的产物依次进行分离、第二次灭菌,得到所述发酵滤液。
上述制备方法中,作为一种优选实施方式,所述菌液制备步骤中,所述培养活化处理的温度为28-35℃(比如29℃、30℃、32℃、34℃等),时间为24-48h(比如26h、30h、35h、40h、42h、45h等)。
上述制备方法中,作为一种优选实施方式,所述菌液制备步骤中,所述扩大培养的温度为28-35℃(比如29℃、30℃、32℃、34℃等),时间为20-30h(比如22h、24h、26h、28h等)。更优选地,在培养过程中进行搅拌,搅拌速度为150-200rpm(比如160rpm、170rpm、180rpm、190rpm等)。
上述制备方法中,作为一种优选实施方式,所述菌液制备步骤中,所述培养活化处理所用培养基为葡萄糖马铃薯琼脂(pda)培养基或酵母浸出粉胨葡萄糖培养基(ypd)。
上述制备方法中,作为一种优选实施方式,所述菌液制备步骤中,所述扩大培养所用培养基为酵母浸出粉胨葡萄糖培养基(ypd)。
上述制备方法中,作为一种优选实施方式,所述菌液制备步骤中,所述ypd培养基包括:葡萄糖2%,蛋白胨1%,酵母膏0.5%。当然,所述ypd培养基可以是自制,也可从市场购买;也可以是市售的其他配比的ypd培养基,比如可能的配方是:酵母粉:蛋白胨:葡萄糖=1:2:2,即所述ypd培养基包括:葡萄糖2%,蛋白胨2%,酵母粉1%。
上述制备方法中,作为一种优选实施方式,所述菌液制备步骤中,所述酵母菌液的浓度为104-1010cfu/ml(比如105cfu/ml、106cfu/ml、107cfu/ml、108cfu/ml、109cfu/ml等)。
上述制备方法中,作为一种优选实施方式,所述大米发酵底物制备步骤中,将大米与水按比例调配后、所述第一次灭菌处理前,还包括提取处理:首先对所述大米和水的混合物进行加热处理,所述加热处理结束后,加水稀释至初始体积并搅拌均匀,然后过滤取上清液,或者,所述加热处理结束后,过滤取上清液,再加水稀释至初始体积并搅拌均匀;更优选地,所述加热处理的温度为90-100℃(比如92℃、94℃、95℃、96℃、98℃等)、时间为90-150min(比如95min、100min、120min、130min、140min等)。更优选地,所述加热处理过程中进行搅拌处理。
上述制备方法中,作为一种优选实施方式,所述大米发酵底物制备步骤中,所述大米用量为大米与水总质量的0.5-3%(比如0.8%、1%、1.5%、2%、2.5%、2.8%等)。
上述制备方法中,所述大米发酵底物制备步骤中,所述水可以为蒸馏水、去离子水等,优选为温泉水,进一步优选为法国odycea公司提供的温泉水alpswarmwateron(inci:onsen-sui)。
上述制备方法中,作为一种优选实施方式,所述大米发酵底物制备步骤中,第一次灭菌处理的温度为115-130℃(比如118℃、120℃、122℃、125℃、128℃等)、时间为10-30min(比如12min、15min、20min、25min、28min等)。
上述制备方法中,作为一种优选实施方式,所述发酵步骤中,按体积百分比,接种比例为1-20%(比如2%、5%、10%、15%、18%等),即,所述酵母菌液与所述大米发酵底物的体积比为1-20:100(比如2:100、5:100、10:100、15:100、18:100等);更优选地,接种比例为1-4%。
上述制备方法中,作为一种优选实施方式,所述发酵步骤中,所述发酵处理的温度为28-35℃(比如29℃、30℃、32℃、34℃等),时间为12~120h(比如20h、35h、50h、65h、80h、90h、100h、110h等),更优选为24-48h(比如26h、30h、35h、40h、42h、45h等)。
上述制备方法中,作为一种优选实施方式,所述发酵步骤中,在培养过程中进行搅拌,搅拌可以是机械搅拌、磁力搅拌或摇晃转动搅拌等方式,搅拌速度为100-250rpm(比如110rpm、120rpm、140rpm、160rpm、180rpm、200rpm、220rpm、240rpm等),更优选为180-210rpm。
上述制备方法中,作为一种优选实施方式,所述尾处理步骤中,所述分离处理采用离心处理;更优选地,所述离心处理的转速为3000-5000rpm(比如3200rpm、3500rpm、4000rpm、4500rpm、4800rpm等),时间为20-40min(比如22min、25min、30min、35min、38min等)。
上述制备方法中,作为一种优选实施方式,所述尾处理步骤中,第二次灭菌处理的温度为115-130℃(比如118℃、120℃、122℃、125℃、128℃等)、时间为10-30min(比如12min、15min、20min、25min、28min)。
上述制备方法中,作为一种优选实施方式,所述尾处理步骤中,所述第二次灭菌处理后还包括防腐处理;更优选地,所述防腐处理所用防腐体系包括:辛甘醇0.2-0.5%,1,2-己二醇0.2-0.5%,对羟基苯乙酮0.2-0.5%,即,按质量百分比,辛甘醇加入量为发酵滤液的0.2-0.5%,1,2-己二醇加入量为发酵滤液的0.2-0.5%,对羟基苯乙酮加入量为发酵滤液的0.2-0.5%。添加方法是:首先,在发酵滤液冷却后,加入对羟基苯乙酮,搅拌均匀;然后加入预先混合好的辛甘醇和1,2-己二醇,继续搅拌均匀即可。
更优选地,所述防腐体系及其添加方法,可选自如下任一组:
a、所述防腐体系为:2~2.3wt.%1,2-己二醇,0.5wt.%戊二醇;所述添加方法为:在所述发酵滤液冷却至低于40℃,直接添加搅拌均匀;
b、所述防腐体系为:0.5wt.%对羟基苯乙酮,0.5wt.%1,2-己二醇;所述添加方法为:事先以1:1比例将两物质混合,在密封(如封上保鲜膜防止加热水分流失)和搅拌条件下加热(比如加热至70-75℃);然后按照比例添加入冷却至30~40℃的所述发酵滤液中搅拌均匀;
c、所述防腐体系为:3wt.%戊二醇,0.3~0.5wt.%symdiol68(购买于德之馨symrise公司,为己二醇和辛甘醇的混合物);所述添加方法为:在所述发酵滤液冷却至低于40℃,直接添加搅拌均匀。
第三方面,本公开还提供一种根据上述方法得到的酵母发酵滤液。
另外,本公开还提供一种将上述酵母发酵滤液进行干燥处理制得的干粉。所述干燥处理可以采用冷冻干燥、喷雾干燥等。
第四方面,本公开还提供一种使用上述酵母发酵滤液制备的化妆水。
上述化妆水中,作为一种优选实施方式,按重量百分比,所述化妆水的原料组份如下:
上述化妆水中,作为一种优选实施方式,所述浮游生物(tetraselmissuecica)提取物为交替单胞菌发酵产物提取物(alteromonasfermentextract),优选为法国codif提供的epsseafillp即时除皱精华。
上述化妆水中,作为一种优选实施方式,低分子透明质酸钠的分子量为400~1000kda(比如500kda、600kda、700kda、800kda、900kda等),高分子透明质酸钠的分子量为1800~2200kda(比如1900kda、2000kda、2100kda等)。
上述化妆水中,作为一种优选实施方式,所述水为温泉水;更优选地,所述温泉水取自法国,生产厂家为odycea,产品名称为alpswarmwater,其中含温泉水99%~99.7%,苯甲酸钠0.25%~0.35%,山梨酸钾0.10%~0.20%。
第五方面,本公开还提供一种上述化妆水的制备方法,该制备方法包括:
步骤一,将a相中的原料按照预定配比称好后混合,加热至75-85℃保温20-40min;
步骤二,将b相中的原料预先混合均匀后,加入至步骤一得到的混合物中,搅拌均匀;
步骤三,将c相中的原料预先分散溶解(即将高分子透明质酸钠和低分子透明质酸钠溶解于双丙甘醇),待步骤二得到的混合物降温至50-60℃后将c相加入其中,搅拌均匀;
步骤四,将步骤三得到的混合物降温至40-42℃后,再将d相加入其中,搅拌均匀;
步骤五,将步骤四得到的混合物降温至35-38℃后,过滤,得到所述化妆水。
上述化妆水的制备方法中,作为一种优选实施方式,所述步骤五中,所述过滤采用400目滤布过滤。
本公开的有益效果包括但不限于:
1、本公开选用保藏编号为cgmccno.17452的酿酒酵母(saccharomycescerevisiae)ywy-1,所得酵母发酵滤液具有良好的抗氧化、抗衰以及保湿功效,无致敏性,安全性高。
2、采用本公开的发酵滤液制备化妆品,具有良好的抗皱、抗衰、保湿等美肤效果。
本公开的酿酒酵母新菌株保藏日期为2019年03月27日,保藏编号为cgmccno.17452,分类命名为:酿酒酵母(saccharomycescerevisiae)ywy-1,保藏单位名称为中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc),地址为:北京市朝阳区北辰西路1号院3号,邮编为100101。
附图说明
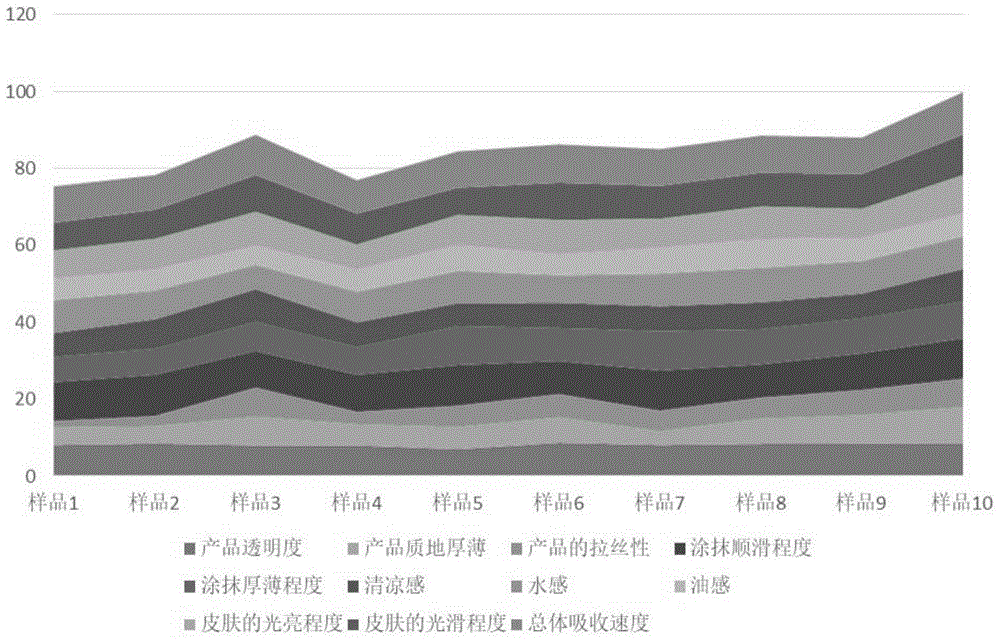
图1示出了实施例1的菌种筛选实验中使用酵母菌1~10号制得的1~10号大米发酵原浆进行肤感评价测试所得评分的堆积面积图,图中,从下往上看各堆积面积分别指如下指标的评分:产品透明度、产品质地厚薄、产品的拉丝性、涂抹顺滑程度、涂抹厚薄程度、清凉感、水感、油感、皮肤的光亮程度、皮肤的光滑程度、总体吸收速度;
图2示出了不同条件对胞外多糖浓度的影响,其中,a示出了大米发酵底物中大米浓度对发酵滤液中多糖浓度的影响,b示出了瓶容量对发酵滤液中多糖浓度的影响,c示出了发酵时间对多糖浓度的影响,d示出了接种量对发酵滤液中多糖浓度的影响,e示出了转速对发酵滤液中多糖浓度的影响;
图3为实施例2制备发酵滤液冻干粉制成的不同浓度样品溶液清除自由基的能力示意图,其中,a示出了清除dpph·的能力,b示出了清除oh·的能力,c示出了螯合fe2+的能力,d示出了还原能力;
图4示出了不同浓度的实施例2制备发酵滤液冻干粉样品溶液对hsf细胞存活率的影响;
图5示出了不同浓度的实施例2制备发酵滤液冻干粉样品溶液对hsf细胞状态的影响;
图6为示出了实施例2制备发酵滤液冻干粉样品溶液对keap1及nrf2表达量的影响;
图7为示出了实施例2制备发酵滤液冻干粉样品溶液对keap1-nrf2/are信号通路下游基因表达量的影响;
图8为实施例3-1中三种样品在不同时间下水含量和经皮水分散失的变化示意图;
图9为实施例3-1中三种样品在不同时间点不同区域的水分含量中位数变化趋势示意图;
图10为实施例3-1中三种样品在使用后不同时间点与各区域使用前水分含量的变化百分比变化趋势示意图;
图11为实施例3-1中三种样品在不同时间点不同区域的tewl中位数变化趋势示意图;
图12为实施例3-1中三种样品在使用后不同时间点与各区域使用前tewl的变化百分比变化趋势示意图。
具体实施方式
以下的实施例便于更好地理解本公开,但并不限定本公开。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
下述实施例中,实验数据利用spss19.0数据处理软件进行统计学处理,组间比较采用单因素anova分析,两两比较采用t检验,以p<0.05为差异有统计学意义,所得结果以
实施例1酿酒酵母(saccharomycescerevisiae)ywy-1的分离、鉴定和保藏
1、菌株的分离
本申请人将自然发酵的大米发酵液制成菌液(取5ml发酵液与45ml无菌生理盐水混合,浓度10:1),继续用无菌生理盐水稀释至10:7,吸取50μl稀释后的菌液于孟加拉红固体平板上(孟加拉红0.033g/l,氯霉素0.1g/l,mgso40.5g/l,kh2po41g/l,蛋白5g/l,葡萄糖10g/l,琼脂15g/l),用涂布棒涂匀,28℃培养48h。挑选单个的具有典型酵母菌菌落特征且形态差异较为明显的菌落,划线纯化2~3代,将上述分离纯化得到的酵母菌接入yepd斜面培养基(酵母浸出粉5g/l,蛋白胨10g/l,琼脂14g/l,葡萄糖20g/l),4℃保藏。
2、形态学鉴定
该菌株在孟加拉红培养基平板上的菌落为圆形,白色,表面光滑湿润,边缘整齐,不透明。革兰氏染色阳性。
3、酿酒酵母(saccharomycescerevisiae)ywy-1的菌种保藏
ywy-1已于2019年03月27日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号),保藏编号为cgmccno.17452。ywy-1的全称为酿酒酵母(saccharomycescerevisiae)ywy-1中国微生物菌种保藏管理委员会普通微生物中心(cgmcc)no.17452。
4、菌种筛选实验
本实验所采用酵母菌1~10号如下:
1号为高活性干酵母:安琪酵母股份有限公司;2号为cgmcc2.1317酿酒酵母;3号为酿酒酵母ceca(saccharomycescerevisiae):安琪酵母股份有限公司;4号为高活性黄酒酵母,安琪酵母股份有限公司;5号为葡萄酒活性干酵母mst安琪酵母股份有限公司;6号为cgmcc2.3973酿酒酵母;7号为cgmcc2.1410酿酒酵母;8号为cgmcc2.1537葡萄酒酿酒酵母;9号为cgmcc2.1313酿酒酵母;10号为本公开提供的保藏菌种cgmccno.17452。
具体实验步骤:
(1)将1~10号酵母菌种分别接种于葡萄糖马铃薯琼脂(pda)培养基,28℃培养2d;
(2)将步骤(1)获得的单菌落分别接种至100mlypd培养基(组成为:葡萄糖2%,蛋白胨1%,酵母膏0.5%),28℃、180rpm培养24h,分别得到1~10号酵母菌菌液。
(3)活化后继续传代3次,每次接种量为3%,待菌种充分活化后,4℃冷藏待用。
(4)将大米以1%的比例和蒸馏水调配(大米与蒸馏水的质量比为1:99),95℃搅拌2h进行提取,期间注意水分的保持,过滤取上清液,搅拌均匀后灭菌,灭菌条件为121℃/20min。
(5)将步骤(3)所得1~10号菌液以1%比例(体积比)接种于步骤(4)的大米上清液中,在28℃、180rpm培养24h。
(6)将步骤(5)所得发酵液5000rpm离心30min,取上清液于121℃灭菌20min,得到1~10号大米发酵原浆。
(7)对所得1~10号大米发酵原浆进行肤感评价分析,肤感测试的评价标准见表1。
对菌种1~10所得大米发酵原浆(样品1~样品10)进行肤感测试评价,依照评价标准(表1)进行评价具体分数见表2、图1,经过综合分析,样品10(即本公开的酿酒酵母ywy-1cgmccno.17452制备的大米发酵原浆)的综合分数是相对较高的,其次为样品3、样品8和样品9。
表1肤感测试评价标准
表2样品1~10的肤感测试结果
实施例2
使用酿酒酵母(saccharomycescerevisiae)ywy-1cgmccno.17452制备发酵滤液包括如下步骤。
一、ywy-1菌液的制备
ywy-1酵母菌液的制备步骤如下:
(1)将ywy-1接种于葡萄糖马铃薯琼脂(pda)培养基,28℃培养2d(目的为活化);
(2)将步骤(1)获得的单菌落接种至100mlypd培养基(组成为:葡萄糖2%,蛋白胨1%,酵母膏0.5%),28℃、180rpm培养24h,得到ywy-1菌液,浓度大致为108的cfu/ml。
二、大米发酵底物制备
将大米以1-3%的比例和蒸馏水调配,灭菌,灭菌条件为121℃/20min;制得大米发酵底物。
三、接种、发酵
将上述步骤二制备的大米发酵底物进行接种:取新鲜制备的ywy-1菌液,接种比例为1-4%,在容量为500毫升的三角瓶内发酵体系体积(即瓶容量)为100-400ml;随后置于28℃150~210rpm下培养24~120h,得到发酵产物。
四、尾处理
发酵结束后对发酵产物离心分离并灭菌,离心条件为4000rpm30min,灭菌条件为121℃20min,得到一系列酵母发酵滤液。所得酵母发酵滤液形状指标如下:ph5~6;固形物含量3~5;电导率500以下;颜色为微白色或黄色浑浊液体;气味:轻微的特殊发酵气味。然后,取部分酵母发酵滤液于-80℃条件下预冻过夜,然后置于-80℃0.03mbar48h条件下,制备成一系列冻干粉,储存。
五、制备条件优化实验及结果分析
1、单因素实验
将配好的大米培养基(即步骤二制备的大米发酵底物)进行灭菌,通过调控培养基浓度a、培养时间b、接种量c、瓶容量d、转速e(摇床转速)等单因素,探究最佳发酵条件,并按下表的条件进行单因素实验,每组重复3组,4000r/min离心30min,取上清液(即步骤四制得到酵母发酵滤液)。用苯酚-硫酸法(王倩,张佳婵,王昌涛,等.碳氮比对真菌发酵桑枝-燕麦麸皮的活性成分和抗氧化能力的影响[j].食品工业科技,2019,40(2):93-99+106.)检测上清液中多糖含量,具体的单因素实验条件见表3。
表3单因素实验条件表
培养基浓度是菌生长繁殖的前提和基础,对于优化培养基一方面可以使菌更好的生长,另一方面可以节约成本,增大经济效益。从图2中的a图可以看出当培养基的浓度为2%的时候,其胞外多糖浓度达到最高。
从图2中的b图中可知液体的容量越接近培养瓶的容量,不利于菌的生长,说明培养瓶中溶氧量的多少影响着菌的生长,根据图中分析,可选择300ml的容量作为最优培养条件。
发酵时间的长短是评价微生物产生代谢产物的重要指标。从24h、48h、72h、96h、120h几个时间段考察其多糖浓度的高低,根据图2中的c图可知,当发酵时间为72h的时候多糖浓度达到最高。
接种量即种子量,接种量越多,代谢产物越多,但当接种量足够多的时候,会产生营养物质不足,代谢产物下降的情况,根据图2中的d图可知,多糖的浓度随着接种量先增加后减小,其多糖浓度最高的时候,接种量为3%。
从图2中的e中由菌丝体的生长方式知其是依靠尖端分离来进行繁殖,调节发酵培养时的摇床转速,通过离心力产生的剪切力加快其繁殖速率,获取需要的目标产物。根据图2中的e图可知,当转速为150r/min时,多糖的浓度最高。
2、正交实验
根据单因素实验结果,设计五因素四水平正交试验见表4,通过正交试验得到最优提取条件。多糖提取条件的五因素四水平见表4,正交试验的结果见表5,正交实验方差分析见表6。由k值分析得,最佳组合为a4b4c1d3e2,五因素对多糖提取率的影响由强到弱顺序为b>e>c>d>a,即多糖提取最优工艺条件为:培养基浓度3%、发酵时间120h、接种量1%、瓶容量300ml、转速150r/min。在该条件下验证得到多糖的提取量为(16.5±0.57)mg/ml,此值与正交试验结果基本一致。
表4五因素四水平
表5正交实验结果分析表
表6正交试验方差分析表
实施例3
使用酿酒酵母(saccharomycescerevisiae)ywy-1cgmccno.17452制备发酵滤液包括如下步骤;本实施例与实施例2相比仅大米发酵底物制备方法不同。
一、ywy-1菌液的制备
ywy-1酵母菌液的制备步骤如下:
(1)将ywy-1接种于葡萄糖马铃薯琼脂(pda)培养基,28℃培养2d(目的为活化);
(2)将步骤(1)获得的单菌落接种至100mlypd培养基(组成为:葡萄糖2%,蛋白胨1%,酵母膏0.5%),28℃、180rpm培养24h,得到ywy-1菌液,浓度大致为108的cfu/ml。
二、大米发酵底物制备
将大米以1%的比例和蒸馏水调配,加热至95℃后保温搅拌2h进行提取,期间注意水分的保持,用蒸馏水补齐至初始体积,过滤取上清液,搅拌均匀后灭菌,灭菌条件为121℃/20min;最终制得大米发酵底物。
三、接种、发酵
将上述步骤二制备的大米发酵底物进行接种:取新鲜制备的ywy-1菌液,接种比例为1%;随后置于28℃200rpm下培养48h,得到发酵产物。
四、尾处理
发酵结束后离心分离并灭菌,离心条件为4000rpm30min,灭菌条件为121℃20min,得到酵母发酵滤液。所得酵母发酵滤液形状指标如下:ph5~6;固形物含量2.5~4;电导率500以下;颜色:轻微白色或轻微黄色的半透明液体;气味:轻微的特殊发酵气味。然后,取部分酵母发酵滤液于-80℃条件下预冻过夜,然后置于-80℃0.03mbar48h条件下,制备成冻干粉,储存。
五、性能测试
将步骤四制备的冻干粉配制一系列不同浓度的发酵滤液冻干粉溶液,测定其如下性能。
1、测定其清除1-二苯基-2-三硝基苦肼自由基(dpph·)的能力。
实验方法参照文献(吴迪,刘平平,李萌,王昌涛,赵丹,张佳婵.葛根水提液测定其及葛根发酵液的体外抗氧化及抗衰老功效评价[j].食品工业科技,2019,40(12):285-290+294.),具体是:用无水乙醇配制浓度为4mg/ml的dpph·溶液,向2mldpph·溶液中加入2ml样品,混匀,静置30min,3000r/min离心10min,取上清液于517nm处测吸光值。
待测物质清除dpph·的能力可以用清除率来表示,清除率越大,清除的能力越强。
其公式为:
清除率i=[i-(ai-aj)/a0]×100%
其中:ai-2mldpph·溶液+2ml样品;aj-2mldpph·溶液的溶剂+2ml样品;a0-2mldpph·溶液+2ml样品的溶剂。
测试结果如图3中的a图所示,从图中可以看出随着待测样品浓度的降低,dpph·的清除能力也在逐渐降低,样品浓度与清除dpph·的能力之间有明显的量效关系,本实施例制备的发酵产物具有一定的清除dpph·的能力。
2、测定其清除羟自由基(·oh)的能力。
实验方法参照文献并稍作修改(赵丹,许丹妮,王冬冬,张佳婵,李萌,王昌涛.灵芝发酵液的成分检测及美白与抗衰老功效评价[j].日用化学工业,2016,46(04):226-230+242.)。具体是:向1ml样品中加入6mmol/l的feso4溶液1ml,混匀后加入6mmol/l的h2o2溶液1ml,混匀后静置10min,加入6mmol/l的水杨酸溶液1ml,混匀后37℃水浴中反应30min,3000r/min离心10min,取上清于510nm处测吸光值。
·oh是氧三电子还原产物,是氧化能力很强的自由基,反应性极强,寿命很短,是自由基中已知的最强的氧化剂,对生物机体的危害性极大。几乎可以与任何大分子物质如蛋白质、核酸、脂质等发生作用,导致机体受损和基因突变,引起机体衰老和癌变。测试结果如图3的b图所示,从图中可以看出在探讨的实验浓度范围内,·oh清除能率均在40~50%左右,本实施例制备的发酵产物具有良好的·oh清除能力。
3、测定其螯合fe2+的能力。
具体方法为:取不同浓度样品溶液5ml,依次加入2mmol/l的fecl2溶液0.1ml、5mmol/l的菲啰嗪溶液0.2ml,摇匀,室温反应10min后于562nm处测吸光值。以5ml去离子水代替菲啰嗪溶液,按照上述操作做空白实验。以5ml去离子水代替多糖样品液,按照上述操作做对照实验。以β-葡聚糖作阳性对照。螯合率(fumioy,toshiakia,yoshihiroy,etal.antiaxidativeandantiglycationactivityofgarcinolfromgarcibiaindicafruitrind[j].agriculturalfoodchemistry,2000,48:180-185.)按下列公式计算。过渡金属离子可以通过fenton反应促进脂类的氧化反应,还可以使脂类氧化后的氢过氧化物降解产生各种自由基来传递氧化反应链。过渡金属离子鳌合剂可以降低其氧化能力,从而起到抗氧化剂的作用。螯合率越高表示抗氧化能力越强。
螯合率=[1-(样品吸光值-空白吸光值)/对照吸光值]×100%
测试结果如图3的c图所示,从图中可以看出随着待测样品浓度的降低,鳌合率也在逐渐降低,样品浓度与鳌合率的能力之间有明显的量效关系,本实施例制备的发酵产物铁螯合能力较好,在1mg/ml时能达到60%以上。
4、测定其还原能力。
实验方法参考文献(黄闪闪.绿色工艺制取茶籽油及茶籽多糖的研究[d].长沙理工大学,2014.)。具体为:向2.5mlph=6.6的磷酸盐缓冲液中加入样品1ml、1%的铁氰化钾溶液2.5ml,混匀后50℃恒温20min,再加入10%的三氯乙酸溶液2.5ml,3000r/min离心10min,取2.5ml上清液,加入去离子水2.5ml和0.1%的fecl3溶液0.5ml。在700nm处测吸光值,吸光值越高,说明这种反应混合物的还原性越强。
测试结果如图3的d图所示,从图中可以看出随着待测样品浓度的降低,还原能力od值呈下降趋势,表明样品还原性也在逐渐降低,本实施例制备的发酵产物还原性能良好。
5、测定样品对氧化损伤细胞的影响。
根据文献(张佳婵,邵卿,王倩,王昌涛,赵丹,李萌,孙宝国,刘继涛.灵芝菌丝体多糖对hsf细胞氧化应激损伤的防护机制[j/ol].食品科学:1-12.)建立细胞模型。将样品(冻干粉)配制成浓度为0.31mg/ml、2.5mg/ml、5mg/ml的溶液,加入到h2o2刺激2h的hsf细胞中,计算其细胞存活率(参见图4,图中横坐标c为空白对照组,横坐标m为h2o2模型组),并对细胞状态进行拍照(参见图5,图中横坐标c为空白对照组,横坐标m为h2o2模型组)。
从图4中可以看出模型组m细胞存活率显著低于空白对照组c,样品的加入能显著提高损伤细胞的细胞存活率,其中浓度为2.5mg/ml和10mg/ml时,两组样品处理细胞的存活率差异不显著,且均比c组高,表示样品能显著促进细胞增殖。图5中可以看出样品的加入使细胞数量明显增多(与m组比较),2.5mg/ml样品处理损伤细胞后,细胞状态较m组饱满,但是5mg/ml的样品刺激后,细胞数量虽然增多但是细胞周围呈现黑色颗粒,细胞变细长,形态不饱满,表明该浓度下虽然促进了细胞增殖,但是状态改变。说明本实施例制备的发酵产物在合适浓度下可以促进增殖和皮肤细胞再生,具有良好的修复和抗衰老性能。
6、稳定性测试
往本实施例步骤四制备的发酵滤液中添加防腐剂,即2.3wt.%1,2己二醇、0.5wt.%戊二醇,制成样品,根据国标qbt1857-2013对样品稳定性进行检测。
将发酵滤液样品分装到10ml样品瓶中,置于-20℃的冰箱中,并在0、1、2、3、4周取出,放置于室温后,观察是否分层、气味和固形物含量的变化(耐寒稳定性)。将样品置于40℃的冰箱中,并在0、1、2、3、4周取出,放置于室温后,观察是否分层、气味和固形物含量的变化(耐热稳定性)。把发酵滤液样品分装至10ml的透明样品瓶中,置于40℃的烘箱中24h,再取出,置于-20℃的冰箱中24h,视为1个循环,共观察五个循环,观察其有无分层、气味及固形物含量的变化(循环稳定性)。实验结果参见表7,可见本实施例制备的发酵滤液的稳定性良好。
表7本实施例制备的发酵滤液稳定性实验结果
7、安全性检测-封闭斑贴实验
对步骤四制得的发酵滤液及其冻干粉溶液,参照《化妆品安全技术规范(2015年版)》进行皮肤封闭型斑贴试验。按表8中的标准观察皮肤反应,并记录观察结果如表9所示。
表8皮肤封闭型斑贴试验皮肤反应分级标准
如表9所示,共30名志愿者完成了五个样品(空白组为去离子水)的斑贴实验,结果未出现阳性反应,说明样品较为安全。
表9皮肤封闭型斑贴试验结果
8、基因水平探究样品的抗氧化损伤功效测试
nrf2(nuclearfactor-erythroid2-relatedfactor2)通路是参与机体内调控抗氧化系统重要的因子,在生物机体内,nrf2相关的信号通路在机体氧化应激保护方面有着更为敏感的作用。nrf2与其抑制剂胞浆蛋白kelch样环氧氯丙烷相关蛋白-1(kelch-likeech-associatedprotein-1,keap1)结合,以不活性状态存在于胞内,在蛋白酶类作用下降解,使得nrf2呈低转录活性。当机体受到氧化刺激后,细胞中的nrf2与keap1分开,活化的nrf2进入核内,在maf蛋白作用下与抗氧化反应元件are结合,激活靶基因表达,启动are相关的一系列解毒酶及抗氧化酶基因表达,调控下游基因转录活性及抗氧化基因的表达(na(p)dh醌类氧化还原酶1(nqo1)、血红素氧合酶(ho-1)等),从而发挥抗氧化损伤作用。
具体实验方法如下:
1)样品的准备:
将处于对数生长期的hsf人皮肤成纤维细胞,接种于6孔板中,每孔细胞数约为1×106个,于37℃,5%co2的培养箱中培养过夜。用样品冻干粉配成2.5mg/ml(即实施例2制备的发酵滤液冻干粉溶于dmem细胞培养液),样品处理方法如下(培养在六孔板中,每孔2ml)。
实验设置h2o2诱导的模型组(100μmol/lh2o2刺激2h)、h2o2+样品组(细胞先加入100μmol/lh2o2刺激2h,再加入2.5mg/ml样品培养24h)、空白组,每组设3个重复。
2)rna的提取与反转录:
取上述培养完的细胞,按照试剂盒trizol总rna抽提试剂的方法提取总rna,所提总rna放于-80℃冰箱备用。通过使用
表10反转录体系
将该体系混合并短暂离心后,在pcr仪上42℃孵育15min,85℃加热5s,反应完成后,添加80μl生物级别水,存放于-20℃冰箱。
3)引物的设计与合成:
根据ncbi中发布的基因序列,通过primerexpress软件设计引物,以管家基因β-actin作为内参基因,基因的特异性引物序列见表11。
表11real-timepcr引物序列
4)qpcr检测细胞mrna表达水平
提取rna,qpcr检测这些基因的相对表达量,根据
表12试剂与用量
循环参数:94℃预变性30s,然后按94℃15s,60℃15s,72℃10s,共45个循环,72℃收集荧光数据。
实验结果如下:
1)样品对keap1及nrf2表达量的影响
keap1是该通路上的负反馈基因,也是nrf2上游重要的调控蛋白,当其充分表达时,会对nrf2基因产生抑制作用,从而加重氧化应激源的细胞毒性。由图6可知,model组的负反馈调节因子keap1显著高于control组,nrf2显著低于control组,表明模型组发生氧化应激损伤,表示模型建立成功。2.5mg/ml样品作用于损伤细胞后,负反馈调节因子keap1下调,nrf2上调,表明样品可以缓解细胞的氧化应激损伤。
2)样品对keap1-nrf2/are信号通路下游基因表达量的影响
血红素氧合酶1(hemeoxygenase-1,ho-1)在清除ros,抵御过氧化物、过氧亚硝酸盐、羟基和超氧化物自由基方面发挥着重要作用。醌氧化还原酶-1(nad(p)h:quinoneoxidoreductase1,nqo1)可以催化醌还原成氢醌,以促进醌的排泄,阻断醌参与ros的产生,减少对dna的氧化损伤程度。由图7可知,model组的nqo1和ho-1相对表达量显著低于control组,表示氧化损伤抑制了抗氧化相关基因的表达,当2.5mg/ml样品作用损伤细胞后,抗氧化相关基因nqo1和ho-1的相对表达量得到上调,表示样品可以上调细胞的抗氧化酶相关基因,以对抗氧化应激损伤。
实施例4
本实施例通过使用酿酒酵母(saccharomycescerevisiae)ywy-1cgmccno.17452制备的发酵滤液,进一步制备化妆水。
本实施例中的所用酵母发酵滤液为实施例3制备的酵母发酵滤液。所用浮游生物(tetraselmissuecica)提取物为交替单胞菌发酵产物提取物,具体为codif生产的epsseafillp即时除皱精华。
一、本实施例化妆水组分及用量参见表13。
表13实施例4制备的化妆水组分及用量
二、本实施例化妆水生产工艺
1)将a相中的原料称好加热至80℃,保温半小时;
2)将b相预先混合均匀后加入a相,搅拌均匀;
3)降温至60℃,将c相加入(预先分散溶解)搅拌均匀;
4)降温至42℃,将d相加入,搅拌均匀;
5)温度降至38℃时,用400目滤布过滤,出料,得化妆水成品。
三、性能测试
1、安全性和稳定性测试
采用同实施例3中相同的测试方法对本实施例制备的化妆水样品进行安全性和稳定性测试,结果参见表14至表18。从表中可见,本实施例制备的化妆水安全性和稳定性良好。
表14对实施例4制备的化妆水进行皮肤封闭型斑贴试验结果
表15对实施例4-1制备的化妆水进行稳定性实验结果
表16对实施例4-2制备的化妆水/*进行稳定性实验结果
表17对实施例4-3制备的化妆水进行稳定性实验结果
表18对实施例4-4制备的化妆水进行稳定性实验结果
2、水含、水散测试
测试样品对人体短时保湿效果的影响,样品包括两种,其中,发酵水18号即实施例4-1制得的化妆水,另外,采用市面上已有的skⅱ(即skii护肤精华露)作为对照。
1)测试环境:温度:22±1℃;湿度:50%-60%。
2)测试区域:皮肤水分含量测试、皮肤水分流失量测试:左右前臂。
3)测试时间点:皮肤水分含量测试、皮肤水分流失量测试:使用前、使用后5min、20min、60min。
4)实验仪器:cornemeter,cm825、tewameter,tm300。
5)测试方法:
30名符合条件的志愿者参加测试。测试场所无光线直射、无风,室温22~24℃,湿度40%~60%。检测前用洗面奶清洗双侧前臂,静息30min,取受试者双侧前臂内侧用记号笔画出面积为3.5×3.5cm正常皮肤。依次测量在使用前的皮肤水分含量及皮肤水分流失量。
将面膜分别剪成3×3cm大小,分别贴在前臂相应标记处,15min后取下,轻轻用化妆棉沾干测试部位未干的精华液,并开始计时。
分别在5min、20min、60min时测试3个部位角质层含水量及经皮水分丢失(transepidermalwaterloss,tewl)值。每个部位测量3次取平均值。
6)数据分析:
皮肤水分含量、皮肤水分流失量测试数据如果数据呈正态分布,应用t检验的方法分析四组间各参数的差别;如果数据呈非正态分布,应用非参数检验方法分析各参数五组间的差异。
7)注意事项:
测试者在测试前48小时内未用过保湿滋润型护肤品。
测试者在测试全过程中不能离开工作室,测试部位保持暴露无遮盖。
嘱测试者如果有任何过敏及不适情况,立即报告,停止测试,用大量清水清洗测试部位。
8)实验结果:
a.皮肤水分含量测试
对两个样品进行使用前和使用后不同时间点的皮肤含水量测试,结果见图8所示。
各样品使用后不同时间点的水含量数值与各自区域的使用前的数值进行t检验,判断其显著性,结果见表19。
表19样品的皮肤水含量在使用前后的显著性分析
发酵水18号在使用后5min、20min和60min的水含量与使用前相比具有显著性差异;skⅱ在使用后5min与使用前相比有显著性差异,但是随着使用后时间的延长,水含量与使用前相比差异不显著。
中位数是样本数据所占频率的等分线,它不受少数几个极端值得影响,反映了一组数据的中等水平。鉴于此,本测试对不同数据取中位数进行变化趋势分析,结果见图9和图10。由图9和图10可知,两个样品具有相似的皮肤含水量变化趋势,使用后5min的水含量最高,随着使用后时间的延长而逐渐降低;水含量变化百分数变化趋势也较为相似:在使用后5min,两个样品的水含量达到最大,其水含量变化百分比也最高;随着使用后时间的延长,两个样品的水含量逐渐降低并趋于稳定,其中发酵水18号水含量变化百分比大于0,表示与使用前相比水含量升高;skⅱ在使用后60min的水含量降低至使用前水平,水含量变化百分比趋于0。
b.经皮水分散失测试
对两个样品进行使用前和使用后不同时间点的皮肤经皮水分散失测试,结果见图8所示。各样品使用后不同时间点的tewl数值与各自区域的使用前的数值进行t检验,判断其显著性,结果见表20。
表20样品的皮肤tewl在使用前后的显著性分析
skⅱ样品在使用后5min的tewl值与使用前相比显著性提高,发酵水18号在使用后各个时间段的tewl值与使用前相比差异不显著,表示发酵水18号在各个时间点对皮肤的保水能力没显著影响。
中位数是样本数据所占频率的等分线,它不受少数几个极端值得影响,反映了一组数据的中等水平。鉴于此,本测试对不同数据取中位数进行变化趋势分析,结果见图11和图12。从图11和图12可知,两个样品在使用后5min的tewl值达到最高,其变化百分比也相应最高,随着使用后时间的延长,tewl值逐渐降低;发酵水18号在使用后20min的tewl值迅速降低并随后趋于稳定,表示发酵水18号的保水能力趋于稳定;skⅱ在使用后的各个时间点均呈现降低趋势。
综上,在根据本公开的实施例中,本公开提供了如下技术方案,但不限于此:
方案1、一种酿酒酵母(saccharomycescerevisiae)菌株ywy-1,其保藏编号为cgmccno.17452。
方案2、一种使用如方案1所述酿酒酵母(saccharomycescerevisiae)菌株ywy-1制备发酵滤液的方法,包括:
菌液制备步骤:将如方案1所述的酿酒酵母(saccharomycescerevisiae)菌株ywy-1接种于合适的培养基进行培养活化处理,然后将培养活化处理得到的单菌落接种至合适的培养基进行扩大培养得到酵母菌液;
大米发酵底物制备步骤:将大米与水按比例调配后,进行第一次灭菌处理,制得所述大米发酵底物;
发酵步骤:将所述酵母菌液接种至所述大米发酵底物,进行发酵处理;
尾处理步骤:将所述发酵处理后的产物依次进行分离、第二次灭菌,得到所述发酵滤液。
方案3、如方案2所述的制备方法,其特征在于,所述菌液制备步骤中,所述培养活化处理的温度为28-35℃,时间为24-48h。
方案4、如方案2或3所述的制备方法,其特征在于,所述菌液制备步骤中,所述扩大培养的温度为28-35℃,时间为20-30h。
方案5、如方案2-4中任一项所述的制备方法,其特征在于,所述菌液制备步骤中,在培养过程中进行搅拌,搅拌速度为150-200rpm。
方案6、如方案2-5中任一项所述的制备方法,其特征在于,所述菌液制备步骤中,所述培养活化处理所用培养基为葡萄糖马铃薯琼脂培养基或酵母浸出粉胨葡萄糖培养基。
方案7、如方案2-6中任一项所述的制备方法,其特征在于,所述菌液制备步骤中,所述扩大培养所用培养基为酵母浸出粉胨葡萄糖培养基。
方案8、如方案6或7所述的制备方法,其特征在于,所述菌液制备步骤中,所述酵母浸出粉胨葡萄糖培养基包括:葡萄糖2%,蛋白胨1%,酵母膏0.5%,或者,所述酵母浸出粉胨葡萄糖培养基包括:葡萄糖2%,蛋白胨2%,酵母粉1%。
方案9、如方案2-8中任一项所述的制备方法,其特征在于,所述菌液制备步骤中,所述酵母菌液的浓度为104-1010cfu/ml。
方案10、如方案2-9中任一项所述的制备方法,其特征在于,所述大米发酵底物制备步骤中,将大米与水按比例调配后、所述第一次灭菌处理前,还包括提取处理:首先对所述大米和水的混合物进行加热处理,所述加热处理结束后,加水稀释至初始体积并搅拌均匀,然后过滤取上清液,或者,所述加热处理结束后,过滤取上清液,再加水稀释至初始体积并搅拌均匀。
方案11、如方案10所述的制备方法,其特征在于,所述提取处理中,所述加热处理的温度为90-100℃、时间为90-150min。
方案12、如方案11所述的制备方法,其特征在于,所述提取处理中,所述加热处理过程中进行搅拌处理。
方案13、如方案2-12中任一项所述的制备方法,其特征在于,所述大米发酵底物制备步骤中,所述大米用量为大米与水总质量的0.5-3%。
方案14、如方案2-13中任一项所述的制备方法,其特征在于,所述大米发酵底物制备步骤中,所述水可以为蒸馏水、去离子水或温泉水。
方案15、如方案14所述的制备方法,其特征在于,所述大米发酵底物制备步骤中,所述温泉水为法国odycea公司提供的温泉水alpswarmwateron(inci:onsen-sui)。
方案16、如方案2-15中任一项所述的制备方法,其特征在于,所述大米发酵底物制备步骤中,所述第一次灭菌处理的温度为115-130℃、时间为10-30min。
方案17、如方案2-16中任一项所述的制备方法,其特征在于,所述发酵步骤中,所述酵母菌液与所述大米发酵底物的体积比为1-20:100。
方案18、如方案17所述的制备方法,其特征在于,所述发酵步骤中,所述酵母菌液与所述大米发酵底物的体积比为1-4:100。
方案19、如方案2-18中任一项所述的制备方法,其特征在于,所述发酵步骤中,所述发酵处理的温度为28-35℃,时间为12~120h。
方案20、如方案19所述的制备方法,其特征在于,所述发酵步骤中,所述发酵处理的时间为24-48h。
方案21、如方案2-20中任一项所述的制备方法,其特征在于,所述发酵步骤中,在培养过程中进行搅拌,搅拌速度为100-250rpm。
方案22、如方案21所述的制备方法,其特征在于,所述发酵步骤中,所述搅拌速度为180-210rpm。
方案23、如方案2-22中任一项所述的制备方法,其特征在于,所述尾处理步骤中,所述分离处理采用离心处理。
方案24、如方案23所述的制备方法,其特征在于,所述离心处理的转速为3000-5000rpm,时间为20-40min。
方案25、如方案2-24中任一项所述的制备方法,其特征在于,所述尾处理步骤中,所述第二次灭菌处理的温度为115-130℃、时间为10-30min。
方案26、如方案2-25中任一项所述的制备方法,其特征在于,所述尾处理步骤中,所述第二次灭菌处理后还包括防腐处理。
方案27、如方案26所述的制备方法,其特征在于,所述防腐处理所用防腐体系包括:辛甘醇0.2-0.5wt.%,1,2-己二醇0.2-0.5wt.%,对羟基苯乙酮0.2-0.5wt.%;添加方法是:首先,在所述发酵滤液冷却后,加入对所述羟基苯乙酮,搅拌均匀;然后加入预先混合好的辛甘醇和1,2-己二醇,继续搅拌均匀即可。
方案28、如方案26所述的制备方法,其特征在于,所述防腐处理所用所述防腐体系及其添加方法,可选自如下任一组:
a:2~2.3wt.%1,2-己二醇,0.5wt.%戊二醇;所述添加方法为:在所述发酵滤液冷却至低于40℃,直接添加搅拌均匀;
b:0.5wt.%对羟基苯乙酮,0.5wt.%1,2-己二醇;所述添加方法为:事先以1:1比例将两物质混合,在密封和搅拌条件下加热;然后按照比例添加入冷却至30~40℃的所述发酵滤液中搅拌均匀;
c:3wt.%戊二醇,0.3~0.5wt.%symdiol68;所述添加方法为:在所述发酵滤液冷却至低于40℃,直接添加搅拌均匀。
方案29、一种根据如方案2-28中任一项所述的制备方法得到的酵母发酵滤液。
方案30、一种将如方案29所述酵母发酵滤液进行干燥处理制得的干粉。
方案31、根据方案30所述的干粉,其特征在于,所述干燥处理采用冷冻干燥或喷雾干燥。
方案32、一种使用如方案29所述的酵母发酵滤液制备的化妆水。
方案33、如方案32所述的化妆水,其特征在于,按重量百分比,所述化妆水的原料组份如下:
方案34、如方案33所述的化妆水,其特征在于,所述浮游生物(tetraselmissuecica)提取物为交替单胞菌发酵产物提取物(alteromonasfermentextract)。
方案35、如方案34所述的化妆水,其特征在于,所述交替单胞菌发酵产物提取物(alteromonasfermentextract)为法国codif提供的epsseafillp即时除皱精华。
方案36、如方案33-35中任一项所述的化妆水,其特征在于,所述低分子透明质酸钠的分子量为400~1000kda,所述高分子透明质酸钠的分子量为1800~2200kda。
方案37、如方案33-36中任一项所述的化妆水,其特征在于,所述水为温泉水。
方案38、如方案37所述的化妆水,其特征在于,所述温泉水取自法国,生产厂家为odycea,产品名称为alpswarmwater,其中含温泉水99%~99.7%,苯甲酸钠0.25%~0.35%,山梨酸钾0.10%~0.20%。
方案39、一种如方案33-38中任一项所述的化妆水的制备方法,其特征在于,包括:
步骤一,将a相中的原料按照预定配比称好后混合,加热至75-85℃保温20-40min;
步骤二,将b相中的原料预先混合均匀后,加入至步骤一得到的混合物中,搅拌均匀;
步骤三,将c相中的原料预先分散溶解,待步骤二得到的混合物降温至50-60℃后将c相加入其中,搅拌均匀;
步骤四,将步骤三得到的混合物降温至40-42℃后,再将d相加入其中,搅拌均匀;
步骤五,将步骤四得到的混合物降温至35-38℃后,过滤,得到所述化妆水。
方案40、如方案39所述的制备方法,其特征在于,所述步骤五中,所述过滤采用400目滤布过滤。
最后,还需要说明的是,在本公开中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个……”限定的要素,并不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素。
尽管上面已经通过本公开的具体实施例的描述对本公开进行了披露,但是,应该理解,本领域技术人员可在所附方案的精神和范围内设计对本公开的各种修改、改进或者等同物。这些修改、改进或者等同物也应当被认为包括在本公开所要求保护的范围内。
- 还没有人留言评论。精彩留言会获得点赞!