一种提高烟草红花大金元遗传转化效率的培养基和方法与流程
本发明属于烟草红花大金元的遗传转化的技术领域,尤其涉及一种提高烟草红花大金元遗传转化效率的培养基和方法。
背景技术:
栽培烟草(nicotianatabacum)是异源四倍体,属于茄科,由于其容易遗传转化,被认为是一种重要的模式生物,用于验证其它植物的基因功能。与模式植物拟兰芥相比,烟草基因的功能研究还存在很大的差距。近年来,crispr/cas9技术的出现,为烟草基因功能的研究提供了有效的工具。为了快速获得更多的烟草突变体,可以采用基于crispr/cas9的敲除质粒库进行混转,加快烟草基因功能研究的步伐。
红花大金元原名路美邑烟,1962年云南省路南县路美邑村烟农从大金元变异株中选出,因花色深红而得名,是云南烟区的主要栽培品种之一。红花大金元具有抗逆性强,高产稳产等特性,现是烟草的主要栽培品种。尽管目前植物转基因技术比较成熟,但是烟草红花大金元的转化效率普遍不高,出芽率,生根率都较低。
技术实现要素:
本发明的目的在于克服现有技术的缺陷,提供了一种提高烟草红花大金元遗传转化效率的培养基和方法,烟草愈伤组织出芽率(分化芽/叶盘)达到127%,生根率(生根苗/分化芽)达到66%,比原有方法(出芽率是62%,生根率是10%)的出芽率提高了约2倍,生根率提高了约6倍,满足规模化遗传转化的需求。
本发明提高烟草红花大金元遗传转化效率的培养基,包括共培养基、选择培养基,共培养基、选择培养基均包括ms基本培养基、naa、6-ba,所述naa的终浓度为0.41mg/l,所述naa与6-ba的浓度比为1:5;
所述共培养基还包括蔗糖30g/l、琼脂8g/l;
所述选择培养基还包括蔗糖30g/l、琼脂8g/l、卡那霉素50mg/l、羧苄青霉素250mg/l。
本发明另一目的是提供一种提高烟草红花大金元遗传转化效率的方法,步骤如下:
(1)烟草红花大金元叶盘的制备:将烟草红花大金元无菌苗的叶片在无菌条件下获得叶盘,并将叶盘浸泡在ms培养基中,所述ms培养基为ms基本培养基、蔗糖30g/l,ph=5.75;
(2)农杆菌的侵染:将带有敲除载体或过表达载体的农杆菌单菌落进行培养,离心收集菌体,菌体用ms培养基重悬后,浸泡叶盘,并置于共培养基中黑暗培养;共培养基包括ms基本培养基、naa、6-ba、蔗糖30g/l、琼脂8g/l,ph=5.75,其中naa终浓度为0.41mg/l,所述naa与6-ba的浓度比为1:5;
(3)选择培养:将步骤(2)中共培养后得到的叶盘直接转移到选择培养基中培养直至长出绿芽,所述选择培养基包括ms基本培养基、naa、6-ba、蔗糖30g/l、琼脂8g/l、卡那霉素50mg/l、羧苄青霉素250mg/l;其中naa终浓度为0.41mg/l,所述naa与6-ba的浓度比为1:5;
(4)生根培养:将步骤(3)的绿芽沿绿芽的茎部切下后放入生根培养基中培养,所述生根培养基包括ms基本培养基、蔗糖30g/l、卡那霉素50mg/l、羧苄青霉素25mg/l、琼脂8g/l,ph=5.75。
所述步骤(1)中,利用打孔器获得长、宽均为4~6mm大小的叶盘。
所述步骤(2)中农杆菌菌种是lba4404。
所述步骤(2)中单菌落培养是在27~29℃、150~250rpm下过夜培养,将其培养至od600=0.5~1,再离心收集菌体,用ms培养基将菌体的od600控制在0.5~1,浸泡叶盘。
所述步骤(2)中浸泡叶盘后用灭菌后的滤纸吸干叶盘上的菌液,置于共培养基中27~29℃下黑暗培养2~4天。
所述步骤(3)选择培养基中培养条件为在28℃下光照培养16h,25℃条件下黑暗培养8h;每隔8~12天更换一次培养基。
所述步骤(4)中生根培养时间为5~10天。
本发明所用的ms基本培养基可为商用粉末也可为自配溶液;优选为自配溶液(具体配方见具体实施方式部分),自配溶液的ms基本培养基能促进叶盘分化,降低了财力成本。
与现有技术相比,本发明具有如下优点和效果:
本发明提供的提高烟草红花大金元遗传转化效率的方法,所用的培养基采用特殊比例的配方,烟草愈伤组织出芽率(分化芽/叶盘)达到127%,生根率(生根苗/分化芽)达到66%,比原有方法(出芽率是62%,生根率是10%)的出芽率提高了约2倍,生根率提高了约6倍,满足规模化遗传转化的需求。具体地:
(1)培养基添加有浓度比的naa、6-ba,促使叶盘分化更好,提高了分化芽效率;
(2)将培养基中的琼脂从以前用的高熔点替换为低熔点,现在琼脂添加8g/l,促进抗生素在琼脂未凝固之前均匀分散在琼脂的每个地方,充分保证了抗生素的选择作用,增加了阳性植株的比例;
(3)取消了预培养步骤,并在农杆菌侵染叶盘共培养后,取消了叶盘的清洗步骤,该方法使叶盘上的细胞更加完整,其更有活力、更容易分化为愈伤组织;
(4)将愈伤组织切分小块:经过该方法的改进后,促进愈伤组织形成的更多的分化芽。
附图说明
图1为本发明方法的流程示意图;
图2为本发明方法得到的烟草红花大金元。
具体实施方式
本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过购买获得的常规产品。
本发明实施例素所用的ms基本培养基配方为:
大量元素:硝酸钾(kno3)1.9g/l、硝酸铵(nh4no3)1.65g/l、七水硫酸镁(mgso4·7h2o)0.37g/l、磷酸二氢钾(kh2po4)0.17g/l;
钙元素:氯化钙(cacl2)0.332g/l;
微量元素:硫酸锰(mnso4·h2o)0.0169g/l;七水硫酸锌(znso4·7h2o)0.0086g/l;硼酸(h3bo3)0.0062g/l;碘化钾(ki)0.00083g/l;二水钼酸钠(na2moo4·2h2o)0.00025g/l;五水硫酸铜(cuso4·5h2o)0.000025g/l;六水氯化钴(cocl2·6h2o)0.000025g/l;
铁盐:乙二胺四乙酸二钠(na2-edta)0.0373g/l、七水合硫酸亚铁(feso4·7h2o)0.0278g/l;
有机物:甘氨酸0.001g/l、盐酸吡哆醇0.00025g/l、盐酸硫铵素0.00005g/l、烟酸0.00025g/l;
肌醇:0.1g/l;
各组成分分别称量溶解,混合在一起,定容至1l,调节ph5.75-5.76。
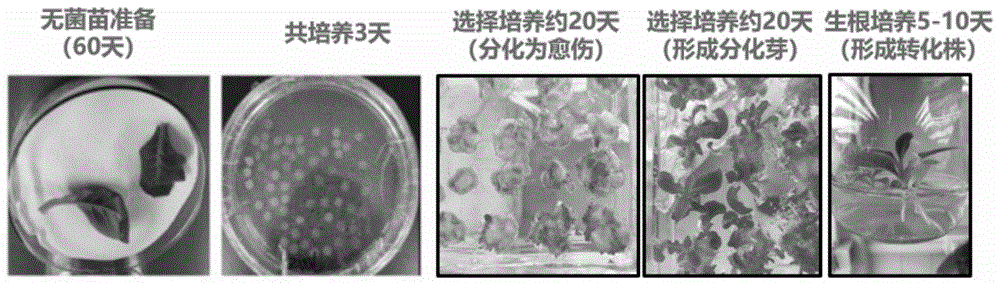
实施例1:如图1所示,本实施例提高烟草红花大金元遗传转化效率的方法,包括如下步骤:
1、烟草红花大金元叶盘的制备:
取饱满的烟草种子,将其放置在含有75%的酒精中消毒30s,再用10%的次氯酸钠溶液消毒8-10min,无菌水清洗4次,之后将消毒的种子种在ms培养基上,于25℃、16h光照/8h黑暗条件下培养45-60天,得到烟草无菌苗;
取烟草无菌苗的中上部叶片,在无菌条件下,利用打孔器获得5mm×5mm大小的叶盘,将叶盘浸泡在ms培养基中,所述ms培养基为ms基本培养基、蔗糖30g/l,ph=5.75;
2、农杆菌的侵染:将构建成功的敲除载体或是过表达载体的农杆菌单菌落于28℃,200rpm过夜培养,将其培养至od600=0.5~1,离心收集菌体,用40mlms培养基将菌体的od600控制在0.5~1,浸泡叶盘10min,并用灭菌后的滤纸吸干叶盘上的菌液,置于共培养基中28℃黑暗培养3天;所述共培养基包括ms基本培养基、naa、6-ba,蔗糖30g/l,琼脂8g/l,ph=5.75,其中所述naa的终浓度为0.4mg/l,所述naa与6-ba的浓度比为1:5;
3、选择培养:将步骤2的叶盘直接转移到选择培养基中,在28℃条件下光照培养16h,25℃条件下黑暗8h培养;每隔10天更换一次培养基,1个月左右能看到叶盘边缘出现的白色或绿色膨大的愈伤组织;当愈伤组织长到1cm左右大小时,对愈伤组织切分小块,放置在选择培养基中,2个月后长出绿芽;
所述选择培养基包括ms基本培养基、naa、6-ba,蔗糖30g/l、琼脂8g/l、卡那霉素0.05mg/l、羧苄青霉素0.25g/l;其中所述naa的终浓度为0.4mg/l,所述naa与6-ba的浓度比为1:5;
4、生根培养:用刀片将步骤3的绿芽沿绿芽的茎底基部切下,将其放入生根培养基中生长,约7天后生根(图2);所述生根培养基包括ms基本培养基、蔗糖30g/l、卡那霉素50mg/l、羧苄青霉素25mg/l、琼脂8g/l,ph=5.75;
对比例1
该对比例采用常规方法,具体为:
(1)制备叶盘
取饱满的烟草种子,将其放置在含有75%的酒精中消毒30s,再用10%的次氯酸钠溶液消毒8-10min,无菌水清洗4次,之后将消毒的种子种在ms培养基上,于25℃、16h光照/8h黑暗条件下培养45-60天,得到烟草无菌苗。将烟草无菌苗的中上部叶片,在无菌条件下,利用打孔器获得5mm×5mm大小的叶盘;
(2)叶盘预培养
将步骤(1)得到的叶盘,置放在ms固体培养基上,于25℃预培养3天;
(3)农杆菌侵染叶盘
将构建成功的敲除载体的农杆菌单菌落于28℃、200rpm下过夜培养,将其培养至od600=0.5~1,离心收集菌体,用40mlms培养基将菌体的od600控制在0.5~1,浸泡叶盘10min;
(4)叶盘共培养
用灭菌后的滤纸吸干叶盘上的菌液,置于共培养基中28℃黑暗培养3天;所述共培养基包括ms基本培养基、naa、6-ba,蔗糖30g/l,琼脂8g/l,ph=5.75,其中所述naa的终浓度为0.45mg/l,所述naa与6-ba的浓度比为1:4;
(5)叶盘清洗
用含有250mg/l羧苄霉素(cb)的无菌水洗涤共培养的叶盘,洗涤3次,采用无菌滤纸吸取叶片表面多余的水;
(6)叶盘选择培养
将步骤(5)的叶盘直接转移到选择培养基中,在28℃条件下光照16h,25℃条件下黑暗8h培养;每隔14天更换一次培养基,约1个月左右能看到叶盘边缘出现的白色或绿色膨大的愈伤组织。
所述选择培养基包括ms基本培养基、naa、6-ba、蔗糖30g/l、琼脂8g/l、卡那霉素50mg/l、羧苄青霉素250mg/l;其中所述naa的终浓度为0.41mg/l,所述naa与6-ba的浓度比为1:4;
(7)切芽
当愈伤组织长出绿芽后,绿芽约1-2cm高,利用小刀将绿芽从茎的底部切下;
(8)生根培养
将步骤(7)中切下的绿芽,插入在含有50mg/l卡那霉素的ms固体培养基(无激素)中生根;
结果试验例1
统计实施例1以及对比例1的出芽率(分化芽/叶盘),生根率(生根苗/分化芽),结果如表1所示;
表1
由表1可知,与对比例1相比,本发明的实施例1的出芽率和生根率均显著提高;实施例1的烟草愈伤组织出芽率(分化芽/叶盘)达到127%,生根率(生根苗/分化芽)达到66%,比对比例1(出芽率是62%,生根率是10%)的出芽率提高了约2倍,生根率提高了约6倍。
所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包括在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!