一种小麦胚乳细胞原生质体制备与转化的方法与流程
本发明涉及生物技术领域,特别涉及一种小麦胚乳细胞原生质体制备与转化的方法。
背景技术:
小麦胚乳是营养贮藏器官,约含75%的贮藏淀粉、15%的贮藏蛋白和1-2%的脂肪。在胚乳的发育过程中,大量基因参与营养物质的合成、运输和贮存。对这些胚乳表达基因调控和功能的理解是通过遗传手段提高小麦产量和品质的前提。由于小麦生长周期长和稳定遗传转化难度大,在小麦体内大规模开展胚乳表达基因的生物学功能研究尚有困难。因此,亟待开发替代技术。
原生质体瞬时表达是研究蛋白亚细胞定位和生物学功能的常规技术,目前较为成熟的有拟南芥叶肉细胞原生质体表达系统(陈颖,贾艳菊,张翠茹.拟南芥叶肉细胞原生质体分离及影响因素.河北大学学报(自然科学版),2008,28(4):423-426.)和水稻、玉米及小麦叶肉细胞原生质体表达系统(孙鹤,郎志宏,朱莉,黄大昉.玉米、小麦、水稻原生质体制备条件优化.生物工程学报,2013,29(2):224-234.)。然而,胚乳细胞与叶肉细胞在结构和功能方面并不相同。从结构上说,叶肉细胞有叶绿体,而胚乳细胞有造粉体和单膜结构的蛋白体等亚细胞器。从功能上说,叶肉细胞利用光反应中形成的同化力,将co2转化为碳水化合物;胚乳细胞则以叶肉细胞输出的蔗糖和游离氨基酸为原料,合成贮藏淀粉和贮藏蛋白。因此,在叶肉细胞原生质体中研究胚乳表达基因特别是胚乳特异表达基因的生物学功能显然并不合适。
谷物核型胚乳的发育分为游离核期、细胞化期、生长分化期和成熟期(olsenoa.nuclearendospermdevelopmentincerealsandarabidopsisthaliana.plantcell,2004,16:214-222.)。小麦开花后4天,胚乳完成细胞化(荆彦平,刘大同,李栋梁,李小刚,曾惜,顾蕴洁,王忠.小麦内胚乳细胞及其淀粉体的发育.麦类作物学报,2013,33(4):818-824.);之后进入细胞快增期,直到花后15天数目基本稳定(王蔚华,郭文善,方明奎,封超年,朱新开,彭永欣.小麦籽粒胚乳细胞增殖及物质充实动态.作物学报,2003,29(5):779-784.)。小麦胚乳细胞的造粉体合成两种淀粉粒:a型淀粉粒直径大(10-40μm)数量少(约占总淀粉粒的10%),从开花后4天开始合成;b型淀粉粒直径小(<10μm)数量多(约占总淀粉粒的90%),从开花后12天开始合成。受淀粉粒数量和体积的影响,胚乳细胞中细胞核从花后16天开始发生形变,诱发细胞程序性死亡(荆彦平,刘大同,李栋梁,李小刚,曾惜,顾蕴洁,王忠.小麦内胚乳细胞及其淀粉体的发育.麦类作物学报,2013,33(4):818-824.)。除了淀粉粒,胚乳细胞中还含有一定数量的蛋白体。小蛋白体在开花后8天开始出现,随着胚乳的发育相互融合,形成大的蛋白体,填充在淀粉粒的间隙中(荆彦平,刘大同,李栋梁,李小刚,曾惜,顾蕴洁,王忠.小麦内胚乳细胞及其淀粉体的发育.麦类作物学报,2013,33(4):818-824.)。
小麦大团胚乳细胞黏附在一起,比叶肉细胞的解离更加困难;a型淀粉颗粒的存在使得解离的胚乳细胞更容易发生机械损伤而导致细胞破裂;细胞内外的淀粉颗粒在原生质体转化过程中吸附大量载体,不利于目的基因的表达。显然,叶肉细胞原生质体的制备和转化方法并不适用于小麦胚乳细胞原生质体。
技术实现要素:
本发明旨在至少在一定程度上解决上述技术问题之一。为此,本发明提出一种小麦胚乳细胞原生质体制备与转化的方法,该方法能够有效、经济、快速的提取小麦胚乳细胞原生质体。
第一方面,本发明要求保护一种制备小麦胚乳细胞原生质体的方法。
本发明所要求保护的制备小麦胚乳细胞原生质体的方法,可包括如下步骤:
s1:取开花后8-11天的新鲜小麦籽粒,沿腹缝剖开,得胚乳组织;
s2:将胚乳组织置于缓冲液1中浸泡、洗涤;
s3:将洗涤过的胚乳组织置于缓冲液2中酶解,得粗制小麦胚乳细胞原生质体;
s4:采用冰浴静置时间梯度沉降法处理所述粗制小麦胚乳细胞原生质体(目的:去除淀粉粒),得纯化后小麦胚乳细胞原生质体。
在步骤s1中,选取开花后8-11天的新鲜小麦籽粒作为供试材料,是因为本发明研究发现该材料能够提供数量多、发育完善且内含淀粉颗粒小的胚乳细胞,这对胚乳原生质体的分离至关重要。
在步骤s2中,所述缓冲溶1中的渗透压稳定剂为蔗糖和甘露醇,其中蔗糖的浓度为20g/l,甘露醇的浓度为130g/l。
在步骤s2中,所述缓冲液1的溶剂为水,溶质及浓度如下:130g/l的d-甘露醇、20g/l的蔗糖、0.2mm的磷酸氢二钾(kh2po4)、1.0mm的硝酸钾(kno3)、10.0mm的二水氯化钙(cacl2·2h2o)、1.0mm的七水硫酸镁(mgso4·7h2o)、1.0μm的碘化钾(ki)、0.1μm的五水硫酸铜(cuso4·5h2o)以及2.0mm的ph为5.7的mes(2-(n-吗啉代)乙磺酸)。所述缓冲液1过滤除菌后备用。
其中,水合物用量可以换算为对应的非水合物质的量以非水合物替代。
在步骤s2中,将所述胚乳组织切成细条(如宽0.5mm的细条),置于所述缓冲液1中浸泡30-60min(如45min),期间轻柔颠倒混匀,然后用所述缓冲液1洗涤3-5次(如3次),直到所述缓冲液1变澄清。
在步骤s3中,所述缓冲液2中含有纤维素酶(如cellulase(r-10))和离析酶(如macerozyme(r-10)或与其组成相同的离析酶)。
进一步地,所述纤维素酶在所述缓冲液2中的含量为150u/ml;所述离析酶在所述缓冲液2中的含量为15.3u/ml。
在步骤s3中,所述缓冲溶2中的渗透压稳定剂为蔗糖和甘露醇,其中蔗糖的浓度为20g/l,甘露醇的浓度为130g/l。
进一步地,所述缓冲液2的溶剂为水,溶质及浓度如下:150u/ml的纤维素酶、15.3u/ml的离析酶、10g/l的牛血清白蛋白(bsa)、130g/l的d-甘露醇、20g/l的蔗糖、0.2mm的磷酸氢二钾(kh2po4)、1.0mm的硝酸钾(kno3)、10.0mm的二水氯化钙(cacl2·2h2o)、1.0mm的七水硫酸镁(mgso4·7h2o)、1.0μm的碘化钾(ki)、0.1μm的五水硫酸铜(cuso4·5h2o)以及2.0mm的ph为5.7的mes(2-(n-吗啉代)乙磺酸)。
所述缓冲液2按照如下制备得到:在所述缓冲液1(不包括10.0mm的二水氯化钙(cacl2·2h2o)的基础上添加终浓度为150u/ml的纤维素酶(cellulase(r-10))和终浓度为15.3u/ml的离析酶(macerozyme(r-10)),55℃水浴10min,颠倒混匀,使其充分溶解,冷却至室温后加入终浓度为10.0mm的二水氯化钙(cacl2·2h2o)和终浓度为10g/l的牛血清蛋白(bsa),过滤除菌后备用。
本发明研究发现所述缓冲液2对小麦胚乳组织的酶解以及原生质体的释放具有较好的效果。
在步骤s3中,所述酶解为将所述胚乳组织置于所述缓冲液2中24℃避光震荡90-120min(如120min)。
在本发明的具体实施方式中,所述震荡的速率为40rpm,振幅26mm。
在步骤s3中,所述胚乳组织和所述缓冲液2的配比为0.4-0.8g(如0.6g):2ml。
步骤s3中,在将所述胚乳组织置于所述缓冲液2中酶解之后还可包括如下步骤:向酶解后的体系中加入等体积的所述缓冲液1,然后用200目的细胞筛过滤至容器(如离心管,具体如10.0ml的圆底离心管)中,得到所述粗制小麦胚乳细胞原生质体。
其中,所述细胞筛和离心管事先用所述缓冲液1润洗。向所述酶解后的体系中加入等体积的所述缓冲液1后形成的混合液可通过去除尖端部位的5.0ml枪头转移到所述细胞筛中。
在此期间对酶解组织进行镜检、准备后续所用材料或试剂包括缓冲液1预冷、200目细胞筛和10.0ml圆底离心管润湿以及5.0ml枪头尖端处理等。由此可以提高原生质体的产出率并尽可能的降低因机械损伤导致的破损率。
步骤s4可按照包括如下进行:
s41:将装有步骤s3所得粗制小麦胚乳细胞原生质体的容器置于冰水浴或者置于4℃预冷10min,弃上清,去除的所述上清的量为总体积的一半(去除上部分,下部保留的为含有粗制胚乳细胞原生质体的缓冲液)。
s42:向装有步骤s41处理后样本的容器内沿侧壁缓慢加入所述缓冲液1,所述缓冲液1的加入量为容器内所述粗制小麦胚乳细胞原生质体体积的3.5倍,混合(轻柔颠倒混匀)后冰水浴垂直静置8min,弃上清,去除的所述上清的量为加入的所述缓冲液1的体积(去除上部分,下部保留的为含有粗制胚乳细胞原生质体的缓冲液);
s43:向装有步骤s42处理后样本的所述容器内沿侧壁缓慢加入所述缓冲液1,所述缓冲液1的加入量为容器内所述粗制小麦胚乳细胞原生质体体积的3.5倍,混合(轻柔颠倒混匀)后冰水浴垂直静置6min,弃上清,去除的所述上清的量为加入的所述缓冲液1的体积(去除上部分,下部保留的为含有粗制胚乳细胞原生质体的缓冲液)。
进一步地,在步骤s43之后还可包括如下步骤s44:
s44:将装有步骤s43处理后样本的所述容器冰水浴垂直静置30min,去除全部上清,即得所述纯化后小麦胚乳细胞原生质体。
也就是说,根据原生质体沉降速率较淀粉颗粒快的原理,采用原生质体的沉降时间逐次去除淀粉颗粒:冰水浴静置沉降10min,移去上清;加入缓冲液1悬浮,然后依次进行8min冰浴静置-弃上清和6min冰浴静置-弃上清步骤。由此可以减少离心力对原生质体产生的机械损伤,同时更加高效地去除大量淀粉颗粒,收到高效、经济、快速的效果。
第二方面,本发明要求保护一种小麦胚乳细胞原生质体的转化方法。
本发明所要求保护的小麦胚乳细胞原生质体的转化方法,可包括如下步骤:
s5:将利用前文第一方面所述方法制备得到的小麦胚乳细胞原生质体重悬于mmg缓冲液中;
s6:进行peg诱导转化。
在步骤s5中,所述mmg缓冲液的溶剂为水,溶质及浓度如下:130g/l的d-甘露醇、15.0mm的六水氯化镁(mgcl2·6h2o)以及4.0mm的ph为5.7的mes(2-(n-吗啉代)乙磺酸)。所述mmg缓冲液过滤除菌后备用。
在步骤s5中,将所述小麦胚乳细胞原生质体重悬于所述mmg缓冲液中后,重悬液中所述小麦胚乳细胞原生质体的含量约为1×106个/ml。
在步骤s6中,进行所述peg诱导转化时采用的peg诱导转化液的溶剂为水,溶质及浓度如下:400g/l的peg4000、0.2mol/l的d-甘露醇和10.0mmol/l的二水氯化钙(cacl2·2h2o)。所述peg诱导转化液过滤除菌后备用。
进一步地,步骤s6可按照包括如下进行:
s61:将步骤s5所得的含有所述小麦胚乳细胞原生质体的所述重悬液和待转化质粒混合,然后加入所述peg诱导转化液;所述重悬液、所述待转化质粒和所述peg诱导转化液的配比为200μl:10μg:220μl;
s62:轻柔颠倒混匀后,22-24℃避光静置10-15min(如15min);
s63:加入前文所述缓冲液1,轻柔颠倒混匀后,4℃、soft模式、100g,离心1min,弃上清;重复2-3次(如3次)该步骤,直到所述peg诱导转化液完全除去;
s64:加入所述缓冲液1,22-24℃避光孵育12h。
之后可进行检测。在本发明的具体实施方式中,所述待转化质粒为表达gfp荧光蛋白的质粒,通过用lsm780荧光共聚焦显微镜(zeiss,germany)观察原生质体的荧光情况从而判定转化效果。
第三方面,本发明要求保护如下任一:
(a1)一种小麦胚乳细胞原生质体的制备及转化方法,可包括前文第一方面中所述方法中的步骤s1-步骤s4和前文第二方面中所述方法中的步骤s5和s6。
(a2)利用前文第一方面中所述方法制备得到的小麦胚乳细胞原生质体。
(a3)将前文第一方面中所述方法制备得到的小麦胚乳细胞原生质体重悬于前文所述的mmg缓冲液中后所得的小麦胚乳细胞原生质体重悬液。
(a4)前文第一方面中所述方法或(a2)所述小麦胚乳细胞原生质体或(a3)所述小麦胚乳细胞原生质体重悬液在小麦遗传转化中的应用。
(a5)前文第一方面中所述方法或前文第二方面中所述方法或(a1)所述方法或(a2)所述小麦胚乳细胞原生质体或(a3)所述小麦胚乳细胞原生质体重悬液在小麦胚乳表达因子的亚细胞定位、转录因子活性分析、蛋白质互作鉴定和/或酶活分析中的应用。
本发明针对含有大量贮藏淀粉颗粒的小麦胚乳细胞提出一种能够高效、经济、快速的原生质体制备与转化方法,该方法能快速有效的分离开花后8-11天小麦新鲜籽粒的胚乳细胞原生质体,可用于小麦胚乳表达因子的亚细胞定位、转录因子活性分析、蛋白质互作鉴定和酶活分析,为该类因子的体内分子生物学研究创造了条件。该方法可有效避免了胚乳表达基因尤其是胚乳特异表达基因在其它细胞中错误表达而导致的实验偏差,提高了实验结果的准确性。由于通过本发明可以实现对胚乳表达基因的亚细胞准确定位,进而为进一步研究小麦胚乳表达基因在胚乳发育过程中所执行的分子生物学功能提供一套完整的技术体系。
本发明具有如下优点:
(1)试验材料:该方法选取开花后8-11天的小麦籽粒,避免了籽粒发育早期胚乳细胞数量少的问题,又避免了中后期胚乳细胞中储存过多的贮藏淀粉而导致细胞在制备和转化过程中破损严重难以获得完整胚乳原生质体的问题;
(2)操作简单:该方法原生质体的纯化步骤中采用时间梯度沉降,该方法简单易操作,是传统原生质体密度梯度纯化方法所无法比拟的;
(3)成本低:该方法在纯化胚乳原生质体的过程中用时间梯度沉降方法替代了密度梯度离心方法,不使用昂贵的氯化铯等介质,降低了成本;
(4)潜在价值高:该方法可用于小麦籽粒发育和营养物质合成相关基因的分子生物学功能研究,特别适用于胚乳特异表达基因:包括亚细胞定位、双荧光素酶报告基因检测、pulldown以及酶活检测等一些体内实验,克服了小麦遗传转化难度大、体内实验周期长等问题。
附图说明
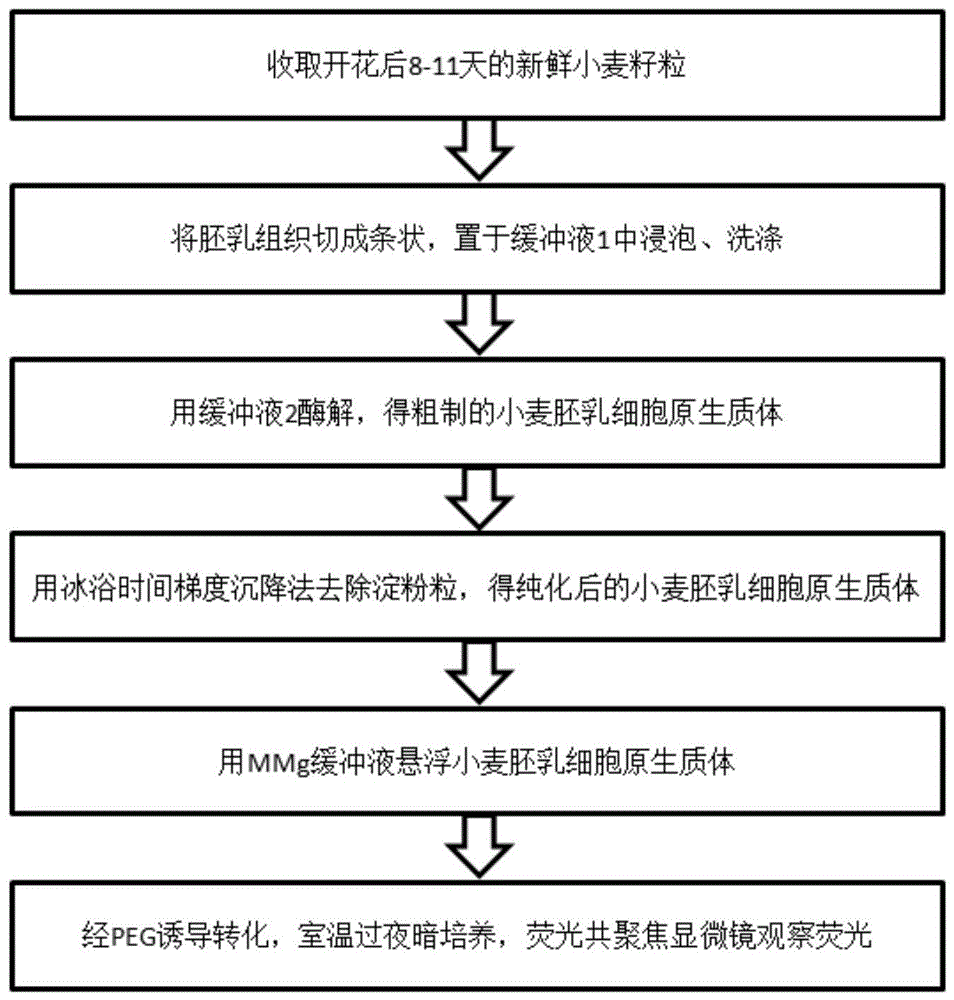
图1为本发明的小麦胚乳细胞原生质体的制备与瞬时转化的流程图。
图2为冰浴静置时间梯度沉降法去除淀粉颗粒效果图。
图3为不同渗透压对小麦胚乳细胞原生质体制备的影响。
图4为不同酶解时间对小麦胚乳细胞原生质体制备的影响。
图5为不同发育时期的小麦胚乳对胚乳细胞原生质体制备的影响。
图6为不同胚乳用量对小麦胚乳细胞原生质体制备的影响。
图7为开花后8天的小麦籽粒和胚乳细胞原生质体。
图8为转录因子taabi5在小麦胚乳细胞原生质体的亚细胞定位。
图中,fda为二乙酸荧光素(激发光波长488nm),gfp为绿色英光(激发光波长488nm),chorophyll为叶绿体荧光(激发光波长633nm),brightfield为明场,merged为叠加。
具体实施方式
本发明所提供的小麦胚乳细胞原生质体制备与转化的方法,主要包括:取材、原生质体的分离与纯化、peg诱导转化和显微观察分析等步骤。剥取新鲜的、特定时期的小麦胚乳组织,用缓冲液1浸泡和洗涤,以清除胚乳细胞因机械损伤而释放出来的淀粉颗粒;利用缓冲液2在设定条件下酶解释放胚乳细胞原生质体;使用冰浴静置时间梯度沉降法除去破碎细胞释放的淀粉颗粒;随后经mmg缓冲液悬浮、peg诱导转化、过夜孵育用于显微观察。使用lsm780激光共聚焦显微镜(zeiss,germany)观察原生质体荧光,研究基因的分子生物学功能。
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。下述实施例中操作步骤没有特别指明温度的,均为室温(大约22-24℃)。
下述实施中所用到的各种溶液:
1、缓冲液1:溶剂为水,溶质及浓度如下:130g/l的d-甘露醇、20g/l的蔗糖、0.2mm的磷酸氢二钾(kh2po4)、1.0mm的硝酸钾(kno3)、10.0mm的二水氯化钙(cacl2·2h2o)、1.0mm的七水硫酸镁(mgso4·7h2o)、1.0μm的碘化钾(ki)、0.1μm的五水硫酸铜(cuso4·5h2o)以及2.0mm的ph为5.7的mes(2-(n-吗啉代)乙磺酸)。过滤除菌后备用。
2、缓冲液2:溶剂为水,溶质及浓度如下:150u/ml的纤维素酶、15.3u/ml的离析酶、10g/l的牛血清白蛋白(bsa)、130g/l的d-甘露醇、20g/l的蔗糖、0.2mm的磷酸氢二钾(kh2po4)、1.0mm的硝酸钾(kno3)、10.0mm的二水氯化钙(cacl2·2h2o)、1.0mm的七水硫酸镁(mgso4·7h2o)、1.0μm的碘化钾(ki)、0.1μm的五水硫酸铜(cuso4·5h2o)以及2.0mm的ph为5.7的mes(2-(n-吗啉代)乙磺酸)。
缓冲液2按照如下方法制备:在缓冲液1(不包括10.0mm的二水氯化钙(cacl2·2h2o)的基础上添加终浓度为150u/ml的纤维素酶(cellulase(r-10))和终浓度为15.3u/ml的离析酶(macerozyme(r-10)),55℃水浴10min,颠倒混匀,使其充分溶解,冷却至室温后加入终浓度为10.0mm的二水氯化钙(cacl2·2h2o)和终浓度为10g/l的牛血清蛋白(bsa),过滤除菌后备用。
其中,纤维素酶(cellulase(r-10))为yakult公司产品,货号为l0012-10g;其酶活定义为:一个活力单位的纤维素酶25℃下每分钟能够降解纤维素释放1μmol葡萄糖。离析酶(macerozyme(r-10)为yakult公司产品,货号为l0021-10g。
3、mmg缓冲液:溶剂为水,溶质及浓度如下:130g/l的d-甘露醇、15.0mm的六水氯化镁(mgcl2·6h2o)以及4.0mm的ph为5.7的mes(2-(n-吗啉代)乙磺酸)。过滤除菌后备用。
4、peg诱导转化液:溶剂为水,溶质及浓度如下:400g/l的peg4000、0.2m的d-甘露醇和10.0mm的二水氯化钙(cacl2·2h2o)。过滤除菌后备用。
下述实施例中用到的待转化质粒35s::gfp(16318hgfp)可以从公司购买(如biovectorntcc典型培养物保藏中心(biovectorco.,ltd))。35s::taabi5:gfp由本实验室自行构建:以小麦胚乳cdna为模板,用引物5’-tatctctagaggatccatggcgtcggagatgagca-3’和5’-tgctcaccatggatccaccagatgcagctgccgca-3’扩增得到taabi5基因,利用同源重组法重组到16318hgfp载体中bamhi位点。
实施例1、小麦胚乳细胞原生质体的制备与转化
一、实验方法
本实施例的小麦胚乳细胞原生质体的制备与瞬时转化的流程图如图1。主要包括以下步骤:
s1:收获开花后8-11天的新鲜小麦籽粒,沿腹缝剖开,得胚乳组织;
s2:将胚乳组织切成细条,置于缓冲液1中浸泡、洗涤;
s3:将洗涤过的胚乳组织置于缓冲液2中,得粗制的小麦胚乳细胞原生质体;
s4:采用冰浴静置时间梯度沉降法处理粗制胚乳细胞原生质体,得纯化后的小麦胚乳细胞原生质体;
s5:用mmg缓冲液悬浮纯化后的小麦胚乳细胞原生质体;
s6:对上述所得小麦原生质体经peg诱导转化;过夜暗培养后,使用lsm780激光共聚焦显微镜(zeiss,germany)观察荧光。
本实施例摸索了不同发育时间的小麦籽粒、不同渗透压、不同酶解时间、不同胚乳用量对最终所得小麦胚乳细胞原生质体的影响。其中,不同渗透压是通过调整前文缓冲液1和缓冲液2中甘露醇浓度实现的,甘露醇浓度设置为11%、12%、13%和14%(%表示g/100ml)四个梯度,其余成分不变。
1、材料的取材
用中国春小麦品种发育的种子作为试验材料,取开花后不同时间(5、8、11和14天)的新鲜籽粒,用于小麦胚乳原生质体的分离与瞬时转化。
2、原生质体的分离与瞬时转化
(1)取15粒小麦的胚乳,切成0.5mm细条,置于1.5ml缓冲液1中浸泡45min,期间轻轻颠倒混匀,去上清;用缓冲液1轻柔洗涤3次;去上清。
(2)取补充(1)处理后的不同用量的胚乳(0.2、0.4、0.6和0.8g),加入2.0ml酶解缓冲液2,置于24℃恒温摇床,40rpm,振幅26mm,避光酶解不同时间(0.5、1、2和3h);期间取20μl裂解组织镜检,观察原生质体的状态、数量。
(3)加入等体积的缓冲液1经200目的细胞筛缓慢过滤至10.0ml的圆底离心管中。(所有器皿均提前用缓冲液1润洗)。该步骤是用处理过的5.0ml枪头(去除尖端部位)将粗制胚乳细胞原生质体转移到细胞筛中的。经该步骤得到粗制小麦胚乳细胞原生质体。
(4)将步骤(3)装有的粗制小麦胚乳细胞原生质体的圆底离心管冰水浴10min,移去上清直至管底保留2.0ml含有粗制原生质体的缓冲液。
(5)沿侧壁缓慢加入7.0ml缓冲液1,轻柔颠倒混匀,冰水浴垂直静置8min,弃上清直至管底留2.0ml含有原生质体的缓冲液。
(6)沿侧壁缓慢加入7.0ml缓冲液1,轻柔颠倒混匀,冰水浴垂直静置6min,弃上清直至管底留2.0ml含有原生质体的缓冲液;取20μl精制原生质体显微观察。
(7)冰浴静置30min,完全去除上清。
(8)沿侧壁缓慢加入适量mmg缓冲液,重新悬浮小麦胚乳细胞原生质体至其浓度为1×106个/ml。
(9)取2个2.0ml的离心管,分别依次加入200μl原生质体mmg悬浮液、10μg质粒(35s::gfp或35s::taabi5:gfp),轻柔混匀,再加入220μl的peg诱导转化液,轻柔颠倒混匀,室温避光静置15min。
(10)沿管壁缓慢加入880μl缓冲液1,轻柔颠倒混匀终止反应,4℃,离心机soft模式100g离心1min。
(11)重复步骤(10)3次,直到peg诱导转化液完全除去。
(12)去除上清,加入220μl缓冲液1,轻柔颠倒重悬,室温水平放置,用锡箔包裹,避光过夜孵育。
(13)使用lsm780荧光共聚焦显微镜(zeiss,germany)观察瞬时转化小麦胚乳细胞原生质体的gfp荧光。
二、结果与分析
1、冰浴静置时间梯度沉降法去除淀粉颗粒效果
本发明冰浴静置时间梯度沉降法去除淀粉颗粒效果如图2所示。a为粗制原生质体(未纯化前);b为精制原生质体(纯化后)。虚线圈和箭头表示淀粉颗粒。
随着籽粒的发育,淀粉颗粒在小麦胚乳细胞中逐渐累积。在样品处理过程中,大量淀粉颗粒从损伤的细胞中释放出来,一方面对脆弱的原生质体造成机械损伤,另一方面在转化时吸附大量载体,不利于外源dna片段被原生质体摄取。图2显示本纯化前,大量淀粉颗粒充满原生质体间隙(虚线圈所示);纯化后,仅有少量淀粉颗粒残留(箭头所示)。
2、不同渗透压对小麦胚乳细胞原生质体制备的影响
本发明不同渗透压对小麦胚乳细胞原生质体制备的影响如图3所示。
缓冲液的渗透压决定原生质体的质量和产量。缓冲液的渗透压过高会引起原生质体收缩,不利于原生质体的分裂;过低会导致原生质体破裂。取开花后8天的小麦胚乳组织0.5g,置于2.0ml缓冲液2中酶解2.0h。缓冲液1和2均用蔗糖和甘露醇作为渗透压稳定剂,其中蔗糖为2%(即20g/l);甘露醇则设11%、12%、13%和14%等四个浓度梯度。冰浴静置时间梯度沉降法去除大部分淀粉颗粒;加入终浓度为0.05g/mlfda(fluoresceindiacetate,二乙酸荧光素),避光常温静置5-10min,镜检。当甘露醇用量为13%时,获得活性原生质体最多。
3、不同酶解时间对小麦胚乳细胞原生质体制备的影响
本发明不同酶解时间对小麦胚乳细胞原生质体制备的影响如图4所示。
取0.5g开花后8天的小麦胚乳组织置于2.0ml含13%甘露醇的缓冲液2中酶解,设0.5、1.0、2.0和3.0h等四个时间梯度。冰浴静置时间梯度沉降法去除大部分淀粉颗粒;加入终浓度为0.05g/mlfda,避光常温静置5-10min,镜检。胚乳组织酶解2.0h效果最优,活性原生质体产量最高。酶解时间过短,游离原生质体数目少;酶解时间过长,原生质体破碎较多。
4、不同发育时期的小麦胚乳对胚乳细胞原生质体制备的影响
本发明不同发育时期的小麦胚乳对胚乳细胞原生质体制备的影响如图5所示。
不同发育时期的小麦胚乳影响原生质体的产量。在胚乳发育前期,胚乳细胞数量少;在胚乳发育中后期,淀粉颗粒过多、过大,容易引起原生质体损伤。取0.5g开花后5、8、11和14天的小麦胚乳组织置于2.0ml含13%甘露醇的缓冲液2中酶解2h。冰浴静置时间梯度沉降法去除大部分淀粉颗粒;加入终浓度为0.05g/mlfda,避光常温静置5-10min,镜检。从开花后8和11天胚乳组织中分离出活性原生质体数量较多。
5、不同胚乳用量对小麦胚乳细胞原生质体制备的影响
本发明不同胚乳用量对小麦胚乳细胞原生质体制备的影响如图6所示。
胚乳组织用量对原生质体的产量有影响。分别取0.2、0.4、0.6和0.8g开花后8天的小麦胚乳组织,置于2.0ml含13%甘露醇的缓冲液2中酶解2h。冰浴静置时间梯度沉降法去除大部分淀粉颗粒;加入终浓度为0.05g/mlfda,避光常温静置5-10min,镜检。0.6g胚乳组织释放出的活性原生质体最多。胚乳组织用量过少或过多,制备的原生质体浓度均较低。
6、精制小麦胚乳细胞原生质体的镜检
取开花后8天的小麦胚乳0.6g,2.0ml含13%甘露醇缓冲液2酶解2h。冰浴静置时间梯度沉降法去除大部分淀粉颗粒,镜检。如图7所示,为开花后8天的小麦籽粒和胚乳细胞原生质体。其中,a为开花后8天的小麦籽粒;b和c分别是40×和20×视野下精制胚乳细胞原生质体。箭头所示为a型淀粉粒。
7、转录因子taabi5在小麦胚乳细胞原生质体的亚细胞定位
取开花后8天的小麦胚乳0.6g,2.0ml含13%甘露醇缓冲液2酶解2h制备得到小麦胚乳细胞原生质体,peg诱导转化35s::gfp或35s::taabi5:gfp。结果如图8所示,为转录因子taabi5在小麦胚乳细胞原生质体的亚细胞定位。可见,转录因子taabi5融合gfp在35s启动子驱动下表达在小麦胚乳细胞原生质体中。taabi5被清晰地定位在细胞核中,与现有报道一致。
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
- 还没有人留言评论。精彩留言会获得点赞!