N2O-BOBPY荧光染料及其制备方法和应用与流程
本发明涉及荧光染料,具体地,涉及一种n2o-bobpy荧光染料及其制备方法和应用。
背景技术:
线粒体是细胞中制造能量的结构,是细胞进行有氧呼吸的主要场所。除了为细胞供能外,线粒体还参与诸如细胞分化、细胞信息传递和细胞凋亡等过程,并拥有调控细胞生长和细胞周期的能力。因此,实现线粒体的定位荧光成像具有重要的实用意义。
现有的线粒体的定位荧光成像中荧光染料有呫吨类、荧光黄类等,其中较为代表的有bodipy类似物有机荧光染料。
如bodipy类似物有机荧光染料:2012年安徽师范大学焦莉娟课题组开发了一种bodipy类线粒体定位荧光染料,如图10所示,但该类荧光染料的骨架由甲川键桥连,使其溶解性并没有得到有效改善。
而且现有的呫吨类和荧光黄类线粒体定位荧光成像染料或多或少地存在溶解性差、斯托克斯位移较小和定位效果不理想等缺点。
技术实现要素:
本发明的目的是提供一种n2o-bobpy荧光染料及其制备方法和应用,该n2o-bobpy荧光染料具有三苯基膦使得其能够应用到线粒体定位荧光成像中,同时其还具有溶解性好、斯托克斯位移大的优点;此外,该制备方法具有条件温和、合成简便的优点。
为了实现上述目的,本发明提供了一种n2o-bobpy荧光染料,该n2o-bobpy荧光染料的结构如式a所示,
其中,r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14、r15和r16各自独立地选自h、c1-c6的烃基、c1-c6的烃氧基和卤素中的一种,x为卤素。
本发明还提供了一种n2o-bobpy荧光染料的制备方法,该制备方法包括:
1)将如式b所示结构的吡咯类化合物、水合肼在催化剂存在下进行第一接触反应以制得如式c所示结构的化合物;
2)将如式d所示结构的水杨醛类化合物、如式c所示结构的化合物在催化剂存在下进行第二接触反应以制得如式f所示结构的化合物;
3)将如式e所示结构的苯硼酸类化合物、如式f所示结构的化合物进行第三接触反应以制得如式g所示结构的化合物;
4)在保护气的存在下,将三苯基膦、如式g所示结构的化合物进行第四接触反应以制得如上述的n2o-bobpy荧光染料;
其中,r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14、r15和r16各自独立地选自h、c1-c6的烃基、c1-c6的烃氧基和卤素中的一种,x为卤素。
本发明进一步提供了一种如上述的n2o-bobpy荧光染料在线粒体的荧光成像中的应用。
在上述技术方案中,本发明以如式b所示结构的吡咯类化合物为原料,依次通过水合肼、如式d所示结构的水杨醛类化合物、如式e所示结构的苯硼酸类化合物、三苯基膦进行官能团化反应以制得如式a所示结构的n2o-bobpy荧光染料。
由于该n2o-bobpy荧光染料中含有线粒体定位基团三苯基膦,进而使得该n2o-bobpy荧光染料能够应用到线粒体的定位荧光成像中。
相对于现有的线粒体定位有机荧光染料,该n2o-bobpy荧光染料由于参与配位的n2ob四原子在立体空间上呈四面体构型的原因,使其具有溶解性好等优异的理化性质,从而使其线粒体的定位荧光成像更加准确,其线粒体定位系数pearson’sr达到0.96。
本发明的其他特征和优点将在随后的具体实施方式部分予以详细说明。
附图说明
附图是用来提供对本发明的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本发明,但并不构成对本发明的限制。在附图中:
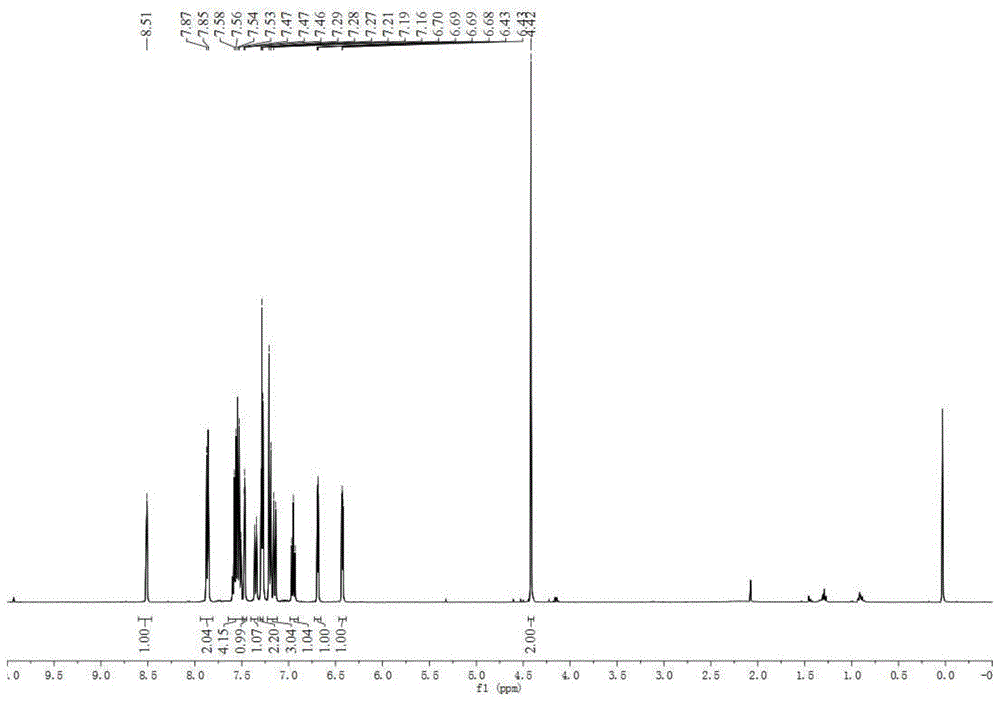
图1为实施例1制备的化合物g-1核磁共振(nmr)氢谱图;
图2为实施例1制备的化合物g-1核磁共振(nmr)碳谱图;
图3为实施例1制备的化合物g-1高分辨质谱(hrms)图;
图4为实施例1制备的化合物g-1紫外吸收(uv-absorbance)图;
图5为实施例1制备的化合物g-1荧光发射(fl-emission)图;
图6为实施例1制备的化合物a-1高分辨质谱(hrms)图;
图7为实施例1制备的化合物a-1紫外吸收(uv-absorbance)图;
图8为实施例1制备的化合物a-1荧光发射(fl-emission)图;
图9为实施例1制备的化合物a-1线粒体定位荧光成像图;
图10为现有技术中线粒体定位bodipy类似物荧光染料结构示意图。
具体实施方式
以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
本发明提供了一种n2o-bobpy荧光染料,该n2o-bobpy荧光染料的结构如式a所示,
其中,r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14、r15和r16各自独立地选自h、c1-c6的烃基、c1-c6的烃氧基和卤素中的一种,x为卤素。
在上述n2o-bobpy荧光染料中,各取代基的种类可以在宽的范围内选择,考虑到制备的难以程度、荧光染料的成像效果,优选地,r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14、r15和r16各自独立地选自h、甲基、乙基、正丙基、异丙基、正丁基、正戊基、正己基、甲氧基、乙氧基、溴和氯中的一种,更优选地,r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14、r15和r16均为h;进一步优选地,x为溴或氯;更进一步优选地,x为溴。
本发明还提供了一种n2o-bobpy荧光染料的制备方法,该制备方法包括:
1)将如式b所示结构的吡咯类化合物、水合肼在催化剂存在下进行第一接触反应以制得如式c所示结构的化合物;
2)将如式d所示结构的水杨醛类化合物、如式c所示结构的化合物在催化剂存在下进行第二接触反应以制得如式f所示结构的化合物;
3)将如式e所示结构的苯硼酸类化合物、如式f所示结构的化合物进行第三接触反应以制得如式g所示结构的化合物;
4)在保护气的存在下,将三苯基膦、如式g所示结构的化合物进行第四接触反应以制得如上述的n2o-bobpy荧光染料;
其中,r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14、r15和r16各自独立地选自h、c1-c6的烃基、c1-c6的烃氧基和卤素中的一种,x为卤素。
在上述制备方法中,各取代基的种类可以在宽的范围内选择,考虑到产率、荧光染料的成像效果,优选地,r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14、r15和r16各自独立地选自h、甲基、乙基、正丙基、异丙基、正丁基、正戊基、正己基、甲氧基、乙氧基、溴和氯中的一种,更优选地,r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14、r15和r16均为h;进一步优选地,x为溴或氯;更进一步优选地,x为溴。
在上述制备方法的步骤1)中,各物料的用量可以在宽的范围内选择,但是为了进一步提高产率,优选地,在步骤1)中,如式b所示结构的吡咯类化合物、水合肼、催化剂的用量摩尔比为1.2:80-90:0.02-0.05。
在上述制备方法的步骤1)中,反应条件可以在宽的范围内选择,但是为了进一步提高产率,优选地,第一接触反应至少满足以下条件:反应温度为100-120℃,反应时间为15-25h。
在上述制备方法的步骤2)中,各物料的用量可以在宽的范围内选择,但是为了进一步提高产率,优选地,在步骤2)中,如式d所示结构的水杨醛类化合物、如式c所示结构的化合物、催化剂的用量摩尔比为1.2:1.2-1.5:0.02-0.05。
在上述制备方法的步骤2)中,反应条件可以在宽的范围内选择,但是为了进一步提高产率,优选地,第二接触反应至少满足以下条件:反应温度为15-35℃,反应时间为2-4h。
在上述制备方法的步骤3)中,各物料的用量可以在宽的范围内选择,但是为了进一步提高产率,优选地,在步骤3)中,如式e所示结构的苯硼酸类化合物、如式f所示结构的化合物的用量摩尔比为1.2:1.2-1.5。
在上述制备方法的步骤3)中,反应条件可以在宽的范围内选择,但是为了进一步提高产率,优选地,第三接触反应至少满足以下条件:反应温度为100-120℃,反应时间为8-15h。
在上述制备方法的步骤4)中,各物料的用量可以在宽的范围内选择,但是为了进一步提高产率,优选地,在步骤4)中,如式g所示结构的化合物、三苯基膦的用量摩尔比为0.09:0.8-1.0。
在上述制备方法的步骤4)中,反应条件可以在宽的范围内选择,但是为了进一步提高产率,优选地,第四接触反应至少满足以下条件:反应温度为100-120℃,反应时间为8-15h。
在上述制备方法中,催化剂的种类可以在宽的范围内选择,但是为了进一步提高催化效果,优选地,在步骤1)和步骤2)中,催化剂选自冰醋酸、对甲苯磺酸、稀盐酸中的至少一种。
此外,为了进一步提高反应速率,在第一接触反应、第二接触反应、第三接触反应、第四接触反应中,反应体系中还含有溶剂,以1mmol的如式b所示结构的吡咯类化合物、如式c所示结构的化合物、式f所示结构的化合物和如式g所示结构的化合物中的任意一者为基准,溶剂的用量为15-50ml;
其中,溶剂的具体种类可以在宽的范围内选择,但是为了进一步提高分散效果,优选地,溶剂选自甲苯、乙醇、乙腈和溴苯中的至少一种。
本发明进一步提供了一种如上述的n2o-bobpy荧光染料在线粒体的荧光成像中的应用。
以下将通过实例对本发明进行详细描述。以下实例中,水合肼、水杨醛、4-溴甲基苯硼酸、三苯基磷、史莱克反应管均从市场上的销售厂家直接购买得到;hela细胞液为上海细胞库提供的产品。
2-苯甲酰吡咯采用文献“journalofchemicalresearch.2013,37(8),480-482”记载的方法制备而得。
表征使用的仪器如下:uv-2450紫外/可见分光光度计(日本岛津)、hplc/esi-ms质谱分析仪、av-400核磁共振仪(瑞士bruker公司,tms作标)、av-500核磁共振仪(瑞士bruker,tms作标)、x-射线单晶衍射仪(blk)、f-4600fl型荧光分光光度计(日本日立)。
实施例1
1)称取2-苯甲酰吡咯(1.2mmol)和87.98mmol水合肼,放入100ml圆底烧瓶中,30ml甲苯溶解,加入冰醋酸(0.02mmol)催化,110℃下加热回流19小时。反应结束后,混合物用二氯甲烷萃取(40ml×3次),有机相多次水洗(去除多余的水合肼),无水硫酸钠干燥,旋蒸仪器除去溶剂,得到化合物c-1。
2)将旋干固体c-1(1.2mmol)用50ml乙醇溶解,加入水杨醛1.2mmol,加入冰醋酸(0.02mmol)催化,25℃下反应2.5小时。点板跟踪反应结束后,二氯甲烷萃取(40ml×3次),有机相水洗,无水硫酸钠干燥,旋蒸仪器除去溶剂,得到化合物f-1。
3)将旋干固体f-1(1.2mmol)用30ml甲苯溶解,加入4-溴甲基苯硼酸(1.2mmol),110℃下反应10小时。反应结束后,混合溶液用二氯甲烷萃取(40ml×3次),有机相水洗,无水硫酸钠干燥,旋蒸仪器除去溶剂,柱层析分离提纯,得到化合物g-1。
4)称取化合物g-1(0.09mmol)、三苯基磷(0.9mmol)放入10ml史莱克反应管,将反应管抽真空、通氩气,如此反复三次,加入2.0ml甲苯,氩气保护,110℃下加热反应10小时。点板跟踪原料反应完全,将得到的固体用甲苯多次冲洗,除去多余的三苯基磷,110℃烘箱烘干,得到化合物a-1。
实施例2
按照实施例1的方法进行,所不同的是,在步骤1)中,2-苯甲酰吡咯、水合肼、冰醋酸的用量摩尔比为1.2:80:0.02;反应至少满足以下条件:反应温度为100℃,反应时间为25h。
实施例3
按照实施例1的方法进行,所不同的是,在步骤1)中,2-苯甲酰吡咯、水合肼、冰醋酸的用量摩尔比为1.2:90:0.05;反应至少满足以下条件:反应温度为120℃,反应时间为15h。
实施例4
按照实施例1的方法进行,所不同的是,在步骤2)中:c-1、水杨醛、冰醋酸的用量摩尔比为1.2:1.2:0.02;反应至少满足以下条件:反应温度为15℃,反应时间为4h。
实施例5
按照实施例1的方法进行,所不同的是,在步骤2)中:c-1、水杨醛、冰醋酸的用量摩尔比为1.2:1.5:0.05;反应至少满足以下条件:反应温度为35℃,反应时间为2h。
实施例6
按照实施例1的方法进行,所不同的是,在步骤3)中,4-溴甲基苯硼酸、f-1的用量摩尔比为1.2:1.2;反应至少满足以下条件:反应温度为100℃,反应时间为15h。
实施例7
按照实施例1的方法进行,所不同的是,在步骤3)中,4-溴甲基苯硼酸、f-1的用量摩尔比为1.2:1.5;反应至少满足以下条件:反应温度为120℃,反应时间为8h。
实施例8
按照实施例1的方法进行,所不同的是,在步骤4)中,g-1、三苯基膦的用量摩尔比为0.09:0.8;反应至少满足以下条件:反应温度为100℃,反应时间为15h。
实施例9
按照实施例1的方法进行,所不同的是,在步骤4)中,g-1、三苯基膦的用量摩尔比为0.09:1.0;反应至少满足以下条件:反应温度为120℃,反应时间为8h。
检测例1
1)用核磁共振(nmr)对实施例1所得化合物g-1进行氢谱分析检测,结果如图1所示,表征数据为:1hnmr(400mhz,cdcl3)δ8.51(s,1h),7.86(d,j=8.0hz,2h),7.59-7.50(m,4h),7.47(d,j=4.0hz,1h),7.35(d,j=8.0hz,1h),7.28(t,j=4.0hz,2h),7.21-7.14(m,3h),6.95(t,j=8.0hz,1h),6.69(d,j=4.0hz,1h),6.43(t,j=4.0hz,1h).
由此表明所制备的样品核磁共振氢谱出峰与预期一致。
2)用核磁共振(nmr)对实施例1所得化合物g-1进行碳谱分析检测,结果如图2所示,表征数据为:13cnmr(125mhz,cdcl3)δ159.6,158.9,155.1,138.2,136.8,135.2,132.1,131.0,130.8,129.4,129.2,128.5,128.3,125.0,120.3,119.4,119.2,117.0,112.7,34.2。
由此表明所制备的样品核磁共振碳谱出峰与预期一致。
3)用高效液相质谱(hrms)对实施例1所得化合物g-1分析检测,结果如图3所示,表征数据为:hrms(apci)calcd.forc25h20bbrn3o[m+h]+:468.0877,found468.0871.
由此表明所制备的样品液相质谱出峰与预期一致。
4)用紫外吸收(uv-absorbance)和荧光发射(fl-emission)对实施例1所得化合物g-1分析检测,分析结果如图4和5所示,从测试的结果可以看出,在正己烷溶剂中,紫外吸收波长为464nm,荧光发射波长为556nm,同时也可以看出,其在乙腈溶剂中的斯托克斯位移最大,为102nm。
5)用高效液相质谱(hrms)对实施例1所得化合物a-1分析检测,结果如图6所示,hrms(apci)calcd.forc43h34bbrn3op[m-br]+:650.2527,found650.2538.
由此表明所制备的样品液相质谱出峰与预期一致。
6)用紫外吸收(uv-absorbance)和荧光发射(fl-emission)对实施例1所得化合物a-1分析检测,分析结果如图7和8所示,从测试的结果可以看出,在正己烷溶剂中紫外吸收波长最大为472nm,在甲苯溶剂中荧光发射波长最大为564nm。
按照上述方法对实施例2-9中的步骤3)和步骤4)中的产物进行表征,表征结果与实施例1所得化合物g-1和化合物a-1的表征结果一致。
检测例2
实施例1中化合物a-1的线粒体定位荧光成像。
将实施例1中化合物a-1(1.0μmol),dapi(4',6-二脒基-2-苯基吲哚,0.08μg/ml)和商用mito
图9中,a部分为dapi细胞核荧光成像图(在dapi的染色作用下,细胞核整体呈现出蓝色荧光);b部分为化合物a-1线粒体定位荧光成像图(激发波长为488nm,在化合物a-1的染色作用下,hela细胞线粒体呈现出绿色荧光);c部分为深红色线粒体商用试剂mito
同时,在b部分中,可以看出化合物a-1在在线粒体中成像效果好,分散均匀,由此可以看出,化合物a-1具有优异的溶解性。
按照上述方法对实施例2-9中的步骤4)中的产物进行检测,检测结果与实施例1所得化合物a-1的检测结果一致。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
- 还没有人留言评论。精彩留言会获得点赞!