OATP1B3在制备监测移植细胞和/或其活体示踪的磁共振/近红外线报告器中的应用的制作方法
本发明属于分子影像技术领域,具体涉及oatp1b3在制备监测移植细胞和/或其活体示踪的磁共振/近红外线报告器中的应用。
背景技术:
oatp1b3在肝脏清除血液中的药物和内源性分子方面非常重要,并且与oatp1b1有相当大的底物重叠。内源性底物包括胆红素、胆汁酸、结合类固醇、二十碳酸和甲状腺激素[2,3]。重要的药物底物和抑制剂包括hmg-coa抑制剂(即他汀类)、吉非罗齐、利福平/利福霉素、环孢素和hiv蛋白酶抑制剂等。据报道,胃肠肽胆囊收缩素仅由oatp3b3转运[4,5],尽管这一观点最近受到质疑。据报道,其他特定的oatp1b3底物(在oatp家族中)包括多西紫杉醇、地高辛、紫杉醇和蘑菇毒素鹅膏碱[6]。尽管有这些报告,为了评估ddi风险,oatp1b3通常与oatp1b1分组,因为它们的底物和抑制剂谱高度重叠,并且由于它们在肝脏中的共同组织分布。
用基因报告器标记细胞可实现移植细胞的纵向实时可视化。肝转运体可以吸收多种生物发光(bl)、荧光、近红外(nir)或磁共振成像(mri)染料,有利于异种化合物的转运,并具有成为多模态报告者的巨大潜力。
细胞监测是细胞治疗学发展和进步的前提。分子影像学被广泛地分为直接和间接(基于基因的)报告标记。与预装造影剂的直接细胞标记相反,间接报告依赖于肽、受体、蛋白质或酶的表达,这些肽、受体、蛋白质或酶要么产生固有的成像信号,要么通过受体介导的服用造影剂的细胞摄取。由于操作简单,直接标记追踪细胞更为常见,但随着细胞分裂、巨噬细胞吞噬和死亡细胞和存活细胞信号的释放,造影剂的稀释为长期追踪创造了障碍。尽管基因报告比直接标记法敏感度低,但它在移植细胞的定量和重复无创成像方面具有优势。此外,如果报告者表达自组织特异性启动子,则可以检测到细胞的位置和分化状态。
不同的成像方式,包括磁共振成像(mri)、生物发光成像(bli)、正电子发射断层成像(pet)、单光子发射计算机断层成像(spect)和光学成像(oi)都可以用于间接报告系统。每种成像方式都有其独特的优缺点,因此,能够以多种成像方式对图像进行联合配准的报告基因非常适合于掩盖单一成像方法的缺点。由于磁共振成像能够在不暴露于电离辐射的情况下,以高时空分辨率和良好的穿透深度获取图像,因此人们已作出更多的努力来引入新型的基因编码磁共振成像报告器。在过去的20年里,通过不同的造影剂生成机制,已经引入了几个具有这种功能的mri报告基因。金属蛋白报告物具有顺磁性质,在t1或t2加权像上有一定的对比度。例如,酪氨酸酶仅增强了12%[4],铁蛋白增强了35%[5],转铁蛋白增强了50%[6],与之相比,外源性补铁加上非临床强的14t磁共振成像(14tmri)使对比度得到了适度的改善[6,7],另一方面,生物降解带电肽报告器产生了适度的信号通过化学交换饱和转移(cest)成像在11tmri上[8]。最近,水通道的使用,如水通道蛋白或尿素转移-b(ut-b)膜蛋白在肿瘤中的过度表达,在基于扩散的mri上产生了200%的对比度增强。[9]其他膜转运蛋白报告方法完全依赖于造影剂的顺磁性。据作者所知,表达啮齿动物有机阴离子转运多肽(roatp1a1)的肿瘤通过摄取临床认可的gd3+造影剂钆乙氧苄基二乙烯三胺五乙酸(gd-eob-dtpa)产生最高的780%磁共振信号增强,它在t1加权图像上产生信号增强,通常用于评估慢性肝病。有机阴离子转运多肽(人的oatps,啮齿动物的oatps)是一种多途径膜蛋白,介导多种底物的细胞摄取,包括许多内源和外源物质。这一特性使得转运者能够报告多种成像方式,包括磁共振成像、spect、光声成像(pai)、生物发光成像(bli)等。由于大多数新引进的报告者是通过非临床扫描仪和在大型实体瘤中表达报告蛋白。动物来源的报告基因也提出了与免疫原性相关的调控问题。考虑到这些局限性,研究者倾向于探索最优秀的mri报告基因roatp1a1的人类同源物,不仅追踪肿瘤,而且追踪移植细胞的其他关键方面,包括细胞植入、增殖和细胞迁移。
根据氨基酸的同源性,将11种有机阴离子转运肽(oatp)分为6个家族[10],在同一个分子亚家族中不需要具有相似的底物特异性。例如,roatp1a1亚家族的人类同源基因oatp1a2,序列同源性为80%,但不能转送mri造影试剂gd-eob-dtpa[11]。迄今还没有关于oatp1b3转运体用于活体示踪和/或监测移植细胞的磁共振/近红外线报告器的报道。
参考文献
[1]m.leonhardt,m.keiser,s.oswald,j.kuhn,j.jia,m.grube,h.k.kroemer,w.siegmund,w.weitschies,药物代谢处置2010,381024。
[2]b.cohen,k.ziv,v.plaks,t.israely,v.kalchenko,a.harmelin,l.e.benjamin,m.neeman,《自然医学》2007年,13498页。
[3]李美玲,王玉玲,刘美玲,兰小兰,理学2018,82954。
[4]r.weissleder,m.simonova,a.bogdanova,s.bredow,w.s.enochs,a.bogdanov,jr.,放射学1997,204,425。
[5]b.cohen,h.daffi,g.meir,a.harmelin,m.neeman,肿瘤(纽约,纽约)2005,7,109。
[6]r.weissleder,a.moore,u.mahmood,r.bhorade,h.benveniste,e.a.chiocca,j.p.basilion,自然医学2000,6351。
[7]c.yang,r.tian,t.liu,g.liu,《分子》(瑞士巴塞尔)2016,21580。
[8]a.a.gilad,m.t.mcmahon,p.walczak,p.t.winnard,jr.,v.raman,h.w.vanlaarhoven,c.m.skoglund,j.w.bμlte,p.c.vanzijl,自然生物技术2007,25,217。
[9]f.schilling,s.ros,d.e.hu,p.d'santos,s.mcguire,r.mair,a.j.wright,e.mannion,r.j.franklin,a.a.neves,k.m.brindle,natbiotechnol2017,35,75;a.mukherjee,d.wu,h.c.davis,m.g.shapiro,natcommon2016,713891。
[10]m.roth,a.obaidat,b.hagenbuch,英国药理学杂志2012,165,1260。
技术实现要素:
有鉴于此,本发明的目的在于提供oatp1b3在制备活体示踪和/或监测移植细胞的磁共振/近红外线报告器中的应用,oatp1b3介导的吲哚菁绿(icg)摄取在近红外波段的荧光输出、追踪细胞迁移及异种移植的存活长度方面具有突出的性能。
本发明提供了oatp1b3在制备活体示踪和/或监测移植细胞的磁共振/近红外线报告器中的应用。
优选的,所述oatp1b3的编码基因的核苷酸序列为seqidno.1。
优选的,所述活体示踪和/或监测移植细胞通过oatp1b3介导吲哚菁绿摄取进行。
优选的,所述oatp1b3介导吲哚菁绿摄取在近红外波段下进行。
优选的,所述监测移植细胞包括追踪移植细胞的增殖和/或迁移情况。
优选的,所述追踪移植细胞的增殖和/或迁移情况采用ivis成像。
优选的,所述追踪移植细胞的增殖和/或迁移为体内追踪早期细胞移植和细胞迁移。
优选的,所述oatp1b3在制备追踪体内细胞迁移的非侵入性多模态报告器中的应用;所述多模态报告器应用的成像种类包括ivis和mri。
优选的,所述mri是在oatp1b3介导的gd-eob-dtpa摄取条件下进行。
优选的,所述追踪细胞迁移的细胞包括异种移植细胞;所述异种移植细胞包括异种间充质干细胞或同种异体间充质干细胞。
本发明提供的oatp1b3在制备活体示踪和/或监测移植细胞的磁共振/近红外线报告器中的应用,是以oatp1b3作为报告分子,通过近红外或mri染料摄取,间接报告活体目标细胞或移植细胞的增殖或移植情况。oatp1b3制备磁共振/近红外线报告器有以下优势:1)荧光输出方面,在不同浓度icg摄取条件下,oatp1b3的荧光输出高;2)在追踪细胞迁移的敏感性方面,表达oatp1b3的细胞在腹股沟区的第一周内被描绘出来(n=4),同时rt-pcr也证实oatp1b3在移植细胞的表达,提示oatp1b3在追踪早期细胞移植和细胞迁移方面可起报告作用。3)在t1加权mri方面的优势,实验表明,与mock相比,oatp1b3显示出约20倍的增强;4)在异种移植的存活长度的比较,采用ivis成像,在oatp1b3表达细胞的右腓肠肌上明显检测到epi荧光;同时t1加权图像上显示,oatp1b3的骨髓间充质干细胞在注射部位显示约3.8倍的增强信号。
附图说明
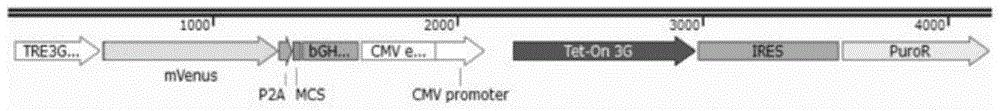
图1为具有肝转运体的诱导稳定细胞系的建立和鉴定结果,其中图1a)在多克隆位点(mcs)连续克隆oatp1b3全长cdna的诱导慢病毒构建示意图;图1b)加入dox激活的tre3g启动子,使荧光蛋白mvenus与转基因一起表达;图1c)抗flag标签抗体westernblot显示转基因无漏泄表达;oatp1b3的定量增加与dox浓度的增加有关;图1d)细胞在没有或存在1%tx-100的情况下固定结果,oatps主要位于细胞膜上(红色),细胞核用hoechst染色(蓝色);图1e)流式细胞仪在ex/em430/470处检测到zv(zombieviolet)与oatp1b3转运体的定量关系;图1f)流式细胞术显示icg染料与oatp1b3转运肽的定量关系;图1g)共聚焦显微镜在ex/em633/800上再次证实了表达oatp1b3的293t细胞对icg的摄取;图1h)用荧光素钠处理24孔板,进行细胞裂解,吸光度在ex/em:490/525处用多片式读卡器测定结果;
图2为oatp1b3介导的icg摄取在近红外区显示出最高的荧光输出;图2a)用不同浓度的icg处理2×105293t表达oatp1b3细胞10min,用ivis在ex/em745/840处测定细胞颗粒的辐射效率;图2b)用0.1μg/μl的icg处理后,将各组细胞的指示数移入0.5%琼脂糖模体中;图2c和图2d)在用0.1μg/μl的icg处理前,用指示浓度的dox诱导细胞24h,在ex/em745/840条件下,用ivis法测定细胞颗粒的辐射效率,数值代表两次重复试验的平均值,误差条代表标准偏差;图2e)侧腹皮下注射1μg/mldox诱导4t1细胞oatp1b3的表达,细胞移植24h后静脉注射icg5mg/kg,静脉注射icg24h后,用ivis进一步监测荧光输出;
图3为转运蛋白依赖性icg摄取追踪细胞迁移结果,其中动物用10mg/ml多西环素灌胃4d,腹腔注射icg,在指定时间用ivis(ex/em:745/840)获取图像,红圈代表原发部位,皮下注射1.5×106细胞;图3a)蓝圈将原发部位的迁移细胞指向腹股沟乳腺脂肪垫;图3b)该图表示辐射效率中量化的平均荧光。误差条表示标准偏差(n=4);图3c)图像摄于注射icg后24小时,表达oatp1b3的4t1细胞在移植2周后出现在腹股沟区;图3d)在注射icg后24小时,注射icg4d后,小鼠的表观荧光仍高于阈值;图3e)为细胞移植后14~21天(n=4)获得的图像的平均表观荧光;
图4为肝脏转运蛋白介导钆摄取对磁共振信号输出的定量结果,其中t1加权磁共振成像是通过pcr管对颗粒中细胞数相等的矢状截面进行成像(另提),采集参数为ti=800;tr=2000;te=13.32;回波序列长度(etl)=40;翻转角=67,切片厚度1.5mm;图4a)、图4b)和图4c)通过pcr管对颗粒内细胞数相等的矢状截面进行t1加权mr成像;用1μg/ml的dox诱导293t细胞转基因48小时,然后用gd-eob-dtpa或gd-dtpa处理,图形表示gd-eob-dtpa处理组的平均信号强度和与噪声比的比值;图4d)在0.5mm的gd-eob-dtpa处理90分钟后,将所示数量的293t细胞分离并移入pcr管中;图4e)图表示使用mango软件获得的平均信号强度,用与mock的平均信号强度差除以mock的标准差计算每个转基因的cnr;
图5为oatp1b3报告者能够在近红外和核磁共振中分别追踪icg和gd-eob-dtpa依赖的细胞迁移结果;图5a)静脉注射icg(5mg/kg)48h后用ivis采集图像;图5b)注射2mmol/kggd-eob-dtpa后2.5h获得t1加权图像;同一小鼠的三个不同横切面显示了迁移细胞的精确位置(红色箭头);内脏脂肪和皮下脂肪t1加权图像的明亮磁共振信号强度分别为黄色和绿色;图5c)通过定义相同的roi大小,提取不同器官的平均t1加权mr信号强度。误差条表示标准偏差;图5d)根据同一切片后肢提取的mr强度计算对比噪声比(cnr),bar表示不同横向切片的cnr平均值,误差bar表示标准偏差;
图6为oatp1b3报告器在描述adsc异种移植物存活长度的结果,具体将表达oatp1b3和空载体(mock)的adsc在balb/c右侧腓肠肌注射前用1μg/mldox同时诱导24h,用10mg/ml多西环素灌胃诱导8d,图6a)和图6b)在指定时间段静脉注射0.5mg/kgicg;图6c)以相同剂量的icg注入对照小鼠(无异种移植)正常化后,荧光强度以辐射效率定量;图6d)和图6e)注射2mmol/kggd-eob-dtpa后1h获得t1加权图像;两个不同的横切切片相同的小鼠在这里提出划界;黄色圈表示皮下脂肪和/或腘窝淋巴结;红色箭头表示移植区域;绿色圆圈表示注射部位的对比增强;图6f)对比噪声比(cnr)根据同一mr横切面左后肢提取的mr强度计算。
具体实施方式
本发明提供了oatp1b3在制备活体示踪和/或监测移植细胞的磁共振/近红外线报告器中的应用。
在本发明中,所述oatp1b3的编码基因的核苷酸序列优选为seqidno.1。利用oatp1b3进行活体示踪和/或检测移植细胞的方法,优选包括以下步骤:
通过慢病毒介导将oatp1b3的编码基因稳定插入移植细胞中,嘌呤霉素筛选,经过四环素(dox)诱导,得到稳定表达oatp1b3的细胞系;使用不同浓度的icg溶液处理所述稳定表达oatp1b3的细胞系,进行荧光成像;当进行活体失踪时,将稳定表达oatp1b3的细胞系移植至小鼠中,腹腔注射icg,麻醉小鼠后,用ivis光谱系统采集图像或将稳定表达oatp1b3的细胞系移植至小鼠中,麻醉后,静脉注射gd-eob-dtpa,用磁共振扫描仪扫描,采集t1加权mr图像,计算cnr。
在本发明中,所述监测移植细胞优选包括追踪移植细胞的增殖和/或迁移情况。所述追踪移植细胞的增殖和/或迁移情况优选通过oatp1b3介导吲哚菁绿(icg)摄取进行。所述吲哚菁绿的浓度优选为0.1~100μg/ml,更优选为1~80μg/ml,进一步优选为5~50,最优选为10μg/ml。稳定表达oatp1b3的293t细胞,其荧光强度输出随着icg的升高而下降,分析原因可能是icg主要以单体形式存在,但当超过100μm时,icg转变为低聚物,导致荧光团的猝灭,这表明荧光输出与icg剂量的增加无关。虽然移植细胞对icg的摄取也具有时间依赖性,但鉴于icg的性质,选择了较短的潜伏期,即从血流中迅速排出。所述吲哚菁绿的细胞处理时间优选为10min。同时表达oatp1b3细胞的4t1也进一步证明强力霉素依赖性icg摄取,因此,oatp1b3应用于体内追踪初始或早期细胞移植。所述早期细胞移植的时间优选为1-2周。oatp1b3介导的吲哚菁绿(icg)摄取优选在近红外波段下进行。
在本发明中,所述追踪移植细胞的增殖和/或迁移情况优选采用ivis成像。所述ivis成像优选在体内追踪早期细胞移植和细胞迁移中使用。所述ivis成像依次在icg注射和皮下移植后进行。
在本发明中,稳定表达oatp1b3的细胞系经gd-eob-dtpa(钆乙氧苄基二乙烯三胺五乙酸,mri造影剂)处理后,在不同倒置时间(700、800、900)下进行t1加权mri,得到t1加权图像。所述gd-eob-dtpa的浓度优选为1mm。结果表明,900ti条件下产生最大mr信号,但相对于700ti和800ti,900ti条件下cnr减少了5倍;800ti在gd-eob-dtpa浓度范围内表现出最高的cnr;与mock相比,oatp1b3显示cnr达到约20倍的增强。因此在t1加权mri上,oatp1b3显示最亮的对比增强。此外,表达oatp1b3的细胞在500ti时显示阳性t1加权图像。
在本发明中,基于oatp1b3在近红外(nir)和oatp1b3的t1加权mri上优异表现,因此,所述oatp1b3可以在制备追踪移植细胞迁移的非侵入性多模态报告器中的应用;所述多模态报告器应用的成像种类优选包括ivis和mri。所述ivis优选在icg摄取条件下进行。所述mri优选是在oatp1b3介导的gd-eob-dtpa摄取条件下进行。
在本发明中,所述多模态报告器在追踪异种移植的存活长度中应用。所述移植细胞优选包括异种移植细胞;所述异种移植细胞优选包括异种间充质干细胞或同种异体间充质干细胞。基于表达oatp1b3细胞优异的荧光输出性能及mr信号增强性能,能够最大限度的检测异种移植的存活时间。
在本发明中,icg与oatp1b3在体外、4t1移植或hadsc异种移植模型中的亲和力更高,表明oatp1b3是icg-ivis系统中较好的报告者。
下面结合实施例对本发明提供的oatp1b3在制备监测移植细胞和/或其活体示踪的磁共振/近红外线报告器中的应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
材料和方法
1、dox诱导的稳定细胞系的培养和产生
从商业供应商(美国型培养集)获得人胚胎肾细胞(hek293t)、小鼠trippel阴性乳腺癌细胞(4t1),在37℃和5%co2条件下常规培养于添加10%胎牛血清的dmem培养基中。
人脂肪间充质干细胞(hadsc,购自中国深圳biowit科技有限公司)在无血清超培养基(lonza)中培养,并添加2%尤特罗斯g(pall)和1%谷氨酰胺(gibco)。
将hek-293t细胞接种于6孔板(1×106/孔)中,用5μg含目标基因(oatp1b3)plvx-tet与3.2μgpmd2.g和1.2μgpspax2载体及含荧光蛋白mvenus的载体共转染细胞。转染48h后,收集含慢病毒的培养基,过滤并按照moi为5的量添加到293t、4t1或的hadsc目标细胞中。转导48h后,用0.5μg/ml嘌呤霉素(puro)筛选hek-293t细胞和hadsc细胞7d,用2.5μg/mlpuro筛选4t1细胞2周。这就产生hek-293t、4t1和hadsc多克隆细胞;同时制备携带空慢病毒载体的细胞,这些细胞称为模型细胞。
2、免疫荧光染色
用0.5μg/ml的dox诱导上述制备的细胞48h,然后在4孔载玻片(thermofisher)上镀膜。24小时后,将载玻片固定并用4%多聚甲醛(含或不含1%tritonx-100)渗透15分钟,在4℃下用5%牛血清白蛋白(bsa)封闭1小时。然后用兔抗flag标签抗体(solarbio)和3%bsa在4℃下孵育细胞过夜。用pbs清洗后,载玻片用驴抗兔alexa-fluor594(thermofisher)作为二级抗体孵育,在0.1%pbs吐温中稀释1:200045分钟,最后清洗后,载玻片用hoechst染色,在pbs中稀释1:200倍后孵育5分钟。对于阴性对照,载玻片仅用二级抗体孵育。
3、蛋白印迹检测
用含蛋白酶抑制剂混合物(solarbio)的ripa缓冲液对上述细胞进行裂解,用bradford法测定蛋白浓度。用6×sds负载缓冲液还原蛋白裂解液,在sds-page凝胶上每道电泳15μg总蛋白。需要注意的是,蛋白质裂解物没有经过热处理而变性,因为多径膜蛋白在较高温度下容易形成低聚物。将蛋白质转移到聚偏氟乙烯膜(微孔)后,用多克隆兔抗flag标签抗体(solarbio)检测靶蛋白,稀释度为1:5000,在4℃下过夜孵育。辣根过氧化物酶标记兔抗(abcam)用作二级抗体,稀释度为1:10000,孵育45分钟,转移的蛋白质条带用immobilon-western化学发光hrp底物(millipore)和bio-rad化学发光成像系统检测。
4、组织、细胞rna提取及实时pcr
应用定量实时聚合酶链反应(qrt-pcr)技术分析移植原发灶和继发灶(转移灶)报告基因的mrna表达。具体采用三唑试剂(invitrogen)从肿瘤组织、乳腺脂肪垫、肺、肝、脾、心和肠中提取总rna,按照提取试剂盒说明书操作。使用takara公司生产的primescriptrt试剂盒,用1μg总rna反向转录cdna。采用tb-greenpremixex-taq-ii(tli-rnaseh-plus,takara)试剂在appliedbiosystems7500实时pcr系统上进行25μl的qrt-pcr反应。为了定量评价诱导的hadmsc细胞间充质干细胞标志物,从trizol中提取总rna,转录总rna0.5μg,然后进行qrt-pcr。具体的引物序列如表1所示。
表1qrt-pcr扩增用引物信息
qpcr的反应程序如下:
95℃2min;94℃20sec,68℃30sec,32个循环。
5、荧光化合物的吸收
接种稳定细胞株约24小时后,用预先加热的hanks'balancedsaltsolution(hbss)和12mmhepes,在ph7.4或ph值5.5条件下对培养基进行抽吸和冲洗,以定量测定zv(zombieviolet)的吸收,并与hbss平衡15分钟。荧光染料加入hbss:1μg/mlicg10min;zv染料,1:1000稀释10min,20μm荧光素钠(nafloo)37℃孵育2min,加入冰冷hbss缓冲液,在指定时间终止摄取。随后,用0.5%triton-x的pbs对荧光素钠处理过的细胞进行裂解,并在rt中将其置于摇床上30min。在读板器中用荧光光谱(ex/em:495/520)分析细胞裂解物。用流式细胞术ex/em420/450对zv(biolegend)处理的细胞进行定量,而用icg(medchemexpress)处理的细胞用共焦显微镜(ex/em:633/800)进行成像。用flowjo软件生成流式细胞术数据。
6、生物荧光定量
将表达oatp1b3的hek-293t稳定肝细胞系和mock细胞系(对照)分别接种于6孔板中,然后用2μg荧光素酶载体(pgf-cmv-luc)瞬时转染。转染后24小时,将胰蛋白酶和细胞接种于96孔板(2500个细胞/孔)中,一式三份。细胞接种后第二天,将含指示浓度的荧光素钠(solarbio)、荧光素钾(solarbio)和游离酸荧光素(beyotine)的hbss缓冲液加入到每个孔中,并使用生物发光滤光片在ivislumina活体成像系统(perkinelmer)上快速采集图像。使用livingimagesoftware(perkinelmer)将每口井的光输出量化为光子/秒/平方厘米/立方米的平均辐射值。
实验结果
1、oatp1b3介导的吲哚菁绿(icg)摄取在近红外波段显示出最高的荧光输出
icg直接标记细胞有助于检测移植细胞的早期(1-2周)。可选择性摄取icg的转运子有很大潜力追踪移植细胞的纵向命运,包括细胞增殖和迁移。基于此,首先确定了荧光输出,使用不同浓度的icg处理表达oatp1b3的293t细胞。在0.1和1μg/mlicg下,oatp1b3的荧光输出较好。同时结果表明,293t-oatp1b3细胞的荧光强度随着icg的升高而下降(图2a)。icg主要以单体形式存在,但当超过100μm时,icg转变为低聚物,导致荧光团的猝灭。这表明光输出与icg剂量的增加无关,应确定每个细胞/启动子报告模型的最佳浓度。
为了追踪琼脂糖体模中细胞的最小数量,将0.1μg/ml的icg处理10分钟(图2b)。细胞对icg的摄取也具有时间依赖性(数据未显示),尽管如此,鉴于icg的性质,选择了较短的潜伏期,即从血流中迅速排出。在表达oatp1b3的4t1细胞也证实了强力霉素依赖性icg摄取(图2c、图2d),可以应用于体内追踪初始细胞植入。在该实验中,仅注射0.1mg/kg的icg就可以检测到50×103表达oatp1b3的4t1皮下移植细胞(图2e)。
2、oatp1b3介导的icg摄取在追踪细胞迁移方面研究
icg给药的肿瘤显像显示没有基因报告者的异位表达。因此,为了评估肿瘤动力学的长期追踪,首先确定4t1肿瘤的icg摄取能力。4t1模拟肿瘤细胞(n=4)注射8mg/kg的icg,在24小时时间点进行ivis成像。发现5×107的荧光是测量4t1-oatp1b3肿瘤敏感性的阈值。携带4t1的肿瘤具有高度的侵袭性,在原发部位生长旺盛,随后转移到远处的器官。4t1-oatp1b3(稳定表达oatp1b3的4t1细胞)和4t1模拟细胞(每组4个)在不同时间点注射icg后皮下移植并成像。
结果表明,皮下移植的细胞最初在腹股沟和腹部乳腺区域迁移(n=4/5)。尽管表达oatp1b3的4t1细胞显示出相似的肿瘤进展,但是表达oatp1b3的4t1细胞在腹股沟区的第一周内被描绘出来(n=4)(图3a,图3b)。同时通过追踪腹腔注射后12至168h的icg信号,发现最大强度出现在24小时,而从阈值开始的增强荧光信号可检测到icg注射后120小时(图3d)。在适当的时候,通过切除原发肿瘤区域、远侧器官和乳腺脂肪垫,用rt-pcr证实移植细胞中oatp1b3的表达。这表明,使用icg-ivis系统的oatp1b3报告器在追踪早期细胞移植和细胞迁移方面较为敏感。
3、在t1加权mri上,oatp1b3显示最亮的对比增强
为观察oatp1b3的t1加权成像灵敏度,也就是已知的摄取gd-eob-dtpa的肝转运蛋白,首先,将不同浓度的gd-eob-dtpa或gd-dtpa处理的oatp1b3-293t和mock-293t细胞在三种不同的倒置时间(ti)进行比较,如图4a、图4b、图4c所示。900ti产生最大mr信号,相对于700ti和800ti,cnr减少了5倍。800ti在gd-eob-dtpa浓度范围内表现出最高的cnr。与mock相比,oatp1b3显示出约20倍的增强。表达oatp1b3的细胞在800ti和900ti时也显示了gd-dtpa的摄取,但有限的造影剂摄取会限制其在非侵入性应用(图4b)。表达oatp1b3的细胞在500ti时显示阳性t1加权图像。
为了进一步探讨oatp1b3报告分子的invitro检测阈值,以形成体内移植后可量化的最小细胞数的基线。因此,经0.5mmgd-eob-dtpa处理后,在800ti处扫描293t表达的报告细胞梯度。结果表明,1×105的oatp1b3细胞在cnr中显示5倍的增强,有2×105的颗粒细胞。同样,mr信号也与转运体的表达呈正相关。表达oatp1b3磁共振信号的4t1和293t均随着强力霉素浓度的增加而增加。
实施例2
动物实验
材料来源和处理方法说明
所有动物护理和实验程序均符合国家研究委员会《实验动物护理和使用指南》,所有程序均经深圳大学(中国深圳)动物护理和使用机构委员会批准。雌性balb/c小鼠(6-8周龄;20-22g)购自vitalriver实验动物技术有限公司(中国北京),在22±5℃下进行12h光/暗循环,并免费提供食物和水。在细胞移植过程中,持续吸入2%异氟醚气体,使小鼠处于麻醉状态。为了推断早期细胞移植或细胞迁移,我们将4t1小鼠乳腺癌细胞接种于100μl细胞悬液中,接种于小鼠背部/侧面剃光的区域。为了确定报告器在间充质细胞中的适用性,将所示数量的hadsc稳定细胞悬浮在50μl的pbs中,用1ml注射器和27g注射到剃光的右后肢腓肠肌中。
1、通过icg摄取进行体内细胞追踪
腹腔注射icg(0.5mg/kg)后,在指定时间进行活体荧光成像,另有说明。在用ivis光谱系统(perkin-elmer)在745nm激发滤光片和800nm发射滤光片采集图像之前,用2%异氟醚麻醉小鼠。所有图像都是在不同的时间点使用相同的参数获得的:曝光时间:自动;binning:中等;镜头光圈(f/stop),2;视野,12cm(另有说明)。使用实时图像软件(perkin-elmer)对目标区域(roi)的光发射进行了定义和分析。
2、活体磁共振成像
4t1或hadsc移植的balb/c小鼠的细胞在指定日期用3特斯拉ge临床磁共振扫描仪(通用电气医疗发现mr7503.0t,密尔沃基,wi)使用商用螺线管射频线圈进行扫描。小鼠腹腔注射400mg/kg水合氯醛麻醉。静脉注射gd-eob-dtpa(2mmol/kg)3h后,采用稳态脉冲序列的破坏梯度回忆采集,获得t1加权像,参数为:视场,50mm;重复时间,15.8毫秒;回波时间,10.5毫秒;接收带宽,31.25兆赫;回波序列长度,4;翻转角度,60度;兴奋次数,1;100μm各向同性体素;扫描时间,每只小鼠约15分钟。利用开源软件multi-imageanalysisgui(mango)计算mr图像的对比噪声比(cnr)测量值(http://ric.uthscsa.edu/mango/).用目标区与后肢组织间差异的平均信号强度除以背景信号的标准差,计算出cnr。
结果表明
1、oatp1b3作为追踪细胞迁移的多模态报告器
mri对移植细胞提供了最高的时空分辨率,但由于其灵敏度较低,以往的mri基因报告者无法评估移植细胞的其他动态,包括细胞迁移。阐明oatp1b3报告分子在追踪细胞迁移中的非侵入性多模态应用。用3t临床磁共振成像扫描有ivis转移的oatp1b3荷瘤小鼠。在给药2小时后扫描小鼠时,在ivis的腹股沟和胸部乳腺区域出现显示荧光的4t1-oatp1b3移植细胞(图5a)在相同的形态学区域也显示出最高的mr信号强度(图5b、图5c和图5d)。不同的横切面显示出更精确的解剖位置。
2、多模态成像追踪adsc-oatp1b3异种移植的存活长度
通过在脂肪间充质干细胞(adsc)中的表达进一步验证了报告者的适用性和敏感性。dox诱导的稳定系是通过慢病毒转导产生的,其特征是间充质干细胞(msc)标记、细胞增殖和诱导oatps报告的三系分化。诱导的肝报告基因不干扰msc的增殖和分化能力,提示肝报告基因在msc驱动的临床应用中的相关性。msc植入物的存活时间主要取决于移植物的类型、剂量和注射部位。异种mscs、同种异体mscs和自体mscs移植物都易被cd8+和自然杀伤细胞溶解。追踪msc异种移植物在接受免疫介导的细胞毒性之前的存活时间。2×105adsc(oatp1b3)表达细胞移植于balb/c小鼠右腓肠肌远端。仅注射0.5mg/kgicg后,在oatp1b3表达细胞的右腓肠肌上明显检测到epi荧光。在t1加权图像上,表达oatp1b3的骨髓间充质干细胞在注射部位显示约3.8倍的增强。细胞移植后9天,再次给药icg或gd-eob-dtpa,与mock相比没有明显的信号,mock显示了腓肠肌msc异种移植的存活极限(图6e和图6f)。
由上述实施例结果可知,icg与oatp1b3在体外、4t1移植或hadsc异种移植模型中的亲和力更高,表明oatp1b3是icg-ivis系统中较好的报告者。同时icg-ivis系统在检测迁移细胞方面显示出较高的灵敏度。oatp1b3在t1加权图像上是mri报告者。因此oatp1b3作为追踪细胞迁移的多模态报告器应用于活体示踪和监测移植细胞。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>深圳市乐土丹伦生物医药有限公司
<120>oatp1b3在制备监测移植细胞和/或其活体示踪的磁共振/近红外线报告器中的应用
<160>23
<170>siposequencelisting1.0
<210>1
<211>2109
<212>dna
<213>人工序列(artificialsequence)
<400>1
atggaccaacatcaacatttgaataaaacagcagagtcagcatcttcagagaaaaagaaa60
acaagacgctgcaatggattcaagatgttcttggcagccctgtcattcagctatattgct120
aaagcactaggtggaatcattatgaaaatttccatcactcaaatagaaaggagatttgac180
atatcctcttctcttgctggtttaattgatggaagctttgaaattggaaatttgcttgtg240
attgtatttgtaagttactttggatctaaactacacagaccgaagttaattggaattggt300
tgtctccttatgggaactggaagtattttgacatctttaccacatttcttcatgggatat360
tataggtattctaaagaaacccatattaatccatcagaaaattcaacatcaagtttatca420
acctgtttaattaatcaaaccttatcattcaatggaacatcacctgagatagtagaaaaa480
gattgtgtaaaggaatctgggtcacacatgtggatctatgtcttcatggggaatatgctt540
cgtggcataggggaaacccccatagtaccattggggatttcatacattgatgattttgca600
aaagaaggacattcttccttgtatttaggtagtttgaatgcaataggaatgattggtcca660
gtcattggctttgcactgggatctctgtttgctaaaatgtacgtggatattggatatgta720
gatctgagcactatcagaataactcctaaggactctcgttgggttggagcttggtggctt780
ggtttccttgtgtctggactattttccattatttcttccataccattttttttcttgccg840
aaaaatccaaataaaccacaaaaagaaagaaaaatttcactatcattgcatgtgctgaaa900
acaaatgatgatagaaatcaaacagctaatttgaccaaccaaggaaaaaatgttaccaaa960
aatgtgactggttttttccagtctttgaaaagcatccttaccaatcccctgtatgttata1020
tttctgcttttgacattgttacaagtaagcagctttattggttcttttacttacgtcttt1080
aaatatatggagcaacagtacggtcagtctgcatctcatgctaactttttgttgggaatc1140
ataaccattcctacggttgcaactggaatgtttttaggaggatttatcattaaaaaattc1200
aaattgtctttagttggaattgccaaattttcatttcttacttcgatgatatccttcttg1260
tttcaacttctatatttccctctaatctgcgaaagcaaatcagttgccggcctaaccttg1320
acctatgatggaaataattcagtggcatctcatgtagatgtaccactttcttattgcaac1380
tcagagtgcaattgtgatgaaagtcagtgggaaccagtctgtgggaacaatggaataact1440
tacctgtcaccttgtctagcaggatgcaaatcctcaagtggtattaaaaagcatacagtg1500
ttttataactgtagttgtgtggaagtaactggtctccagaacagaaattactcagcacac1560
ttgggtgaatgcccaagagataatacttgtacaaggaaatttttcatctatgttgcaatt1620
caagtcataaactctttgttctctgcaacaggaggtaccacatttatcttgttgactgtg1680
aagattgttcaacctgaattgaaagcacttgcaatgggtttccagtcaatggttataaga1740
acactaggaggaattctagctccaatatattttggggctctgattgataaaacatgtatg1800
aagtggtccaccaacagctgtggagcacaaggagcttgtaggatatataattccgtattt1860
tttggaagggtctacttgggcttatctatagctttaagattcccagcacttgttttatat1920
attgttttcatttttgctatgaagaaaaaatttcaaggaaaagataccaaggcatcggac1980
aatgaaagaaaagtaatggatgaagcaaacttagaattcttaaataatggtgaacatttt2040
gtaccttctgctggaacagatagtaaaacatgtaatttggacatgcaagacaatgctgct2100
gccaactag2109
<210>2
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>2
tgcacttggcctacaattcca21
<210>3
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>3
agctgcccactcaaggatct20
<210>4
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>4
agctccgcgtctacaaagc19
<210>5
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>5
ctacacaggtagcgacctcc20
<210>6
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>6
ctacaacacctagtacccttgga23
<210>7
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>7
ggtgaacactgtgctgattaca22
<210>8
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>8
ctttggcttaatgagactgggac23
<210>9
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>9
gcaacaaacatcaccacacca21
<210>10
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>10
ctgccgctttgcaggtgta19
<210>11
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>11
cattgtgggcaaggtgctatt21
<210>12
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>12
acagccagcacctttcctac20
<210>13
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>13
gtgcaggtaaggcagcaga19
<210>14
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>14
aaggactgatcgagccactc20
<210>15
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>15
ggaagtgtatccaacgattccca23
<210>16
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>16
atgaaggtcctctacttatccgc23
<210>17
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>17
gcactgtgacgttctggga19
<210>18
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>18
atgttcgtcatgggtgtgaa20
<210>19
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>19
tgtggtcatgagtccttcca20
<210>20
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>20
caacctagagccgtttctaaagc23
<210>21
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>21
gcgcctaccagtagctgag19
<210>22
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>22
atcgcagccaactatccagat21
<210>23
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>23
ttccaggcaaatgagtggtgg21
- 还没有人留言评论。精彩留言会获得点赞!