一种双特异性抗体NK细胞制备方法及其细胞和应用与流程
本申请涉及细胞培养技术领域,尤其涉及一种双特异性抗体nk细胞制备方法及其细胞和应用。
背景技术:
自然杀伤细胞(naturalkillercell,nk)是机体重要的免疫细胞,不仅与抗肿瘤、抗病毒感染和免疫调节有关,而且在某些情况下参与超敏反应和自身免疫性疾病的发生,能够识别靶细胞、杀伤介质。自然杀伤细胞来源于骨髓淋巴样干细胞,其分化、发育依赖于骨髓及胸腺微环境,主要分布于骨髓、外周血、肝、脾、肺和淋巴结。nk细胞不同于t及b细胞,是一类无需预先致敏就能非特异性杀伤肿瘤细胞和病毒感染细胞的淋巴细胞。
nk的来源主要是靠自体和异源供给,自体nk细胞作用有限,在能够表达hla(人类白细胞抗原)的癌细胞面前无法发挥杀伤作用,而且人体自身nk细胞数量有限,nk细胞处于不同的发育阶段,甚至同一发育阶段的不同组织中,nk细胞的表型及功能均存在很大的差异。以往的异源nk细胞主要是来源于外周血、骨髓、胚胎和胎盘,不仅难收集供者,且由于分离其他免疫细胞的成本极高。这些都限制了nk细胞在临床中上大规模运用。因此,随时可以进行配型的脐血成为了nk细胞的最新来源。
由于脐血的复杂性,获得高纯度、高活性的脐血nk一直是大规模应用的障碍。目前,脐血nk细胞培养主要是通过与饲养细胞k562共培养获得;或者是采用磁珠分选及流式分选;再或者是通过诱导干细胞分化。但是上述方法都有明显的缺点。使用饲养细胞无疑引入了外源性的细胞,增加了临床应用的风险;而磁珠分选及流式分选操作繁琐,无疑增加了细胞污染的风险,并且成本也较高;而脐带血造血干细胞分化技术尚未成熟。
国内外已经有大量的研究者进行了人nk细胞的培养和将nk细胞用于癌症治疗方面的研究,但培养得到的nk细胞存在表型较差,纯度较低等问题,不能满足实际应用的需要。
技术实现要素:
本申请提供了一种双特异性抗体nk细胞制备方法及其细胞和应用,以解决在癌症治疗方面上nk细胞存在表型较差、纯度较低以及不能满足实际应用的需要的问题。
本申请提供一种双特异性抗体nk细胞制备方法,其特征在于,包括以下步骤:
培养nk细胞;
构建cd16a/hsp70双抗慢病毒表达载体;
将cd16a/hsp70双抗慢病毒表达载体感染所述nk细胞得到cd16a/hsp70抗体的双特异性抗体nk细胞。
可选的,所述培养nk细胞步骤包括:
对脐带血取样病毒检测;
将检测合格的所述脐带血离心,离心后的脐带血于50-60℃水浴中灭活30-60min;
将灭活后的脐带血于-20至-10℃下冷却10-15min后离心,得到上清血浆和下部细胞液;
将所述上清血浆分为血浆1和血浆2,将所述血浆1和所述血浆2一同置于4℃冰箱保存备用;
向所述下部细胞液加入d-pbs并搅拌均匀,离心去除上清液,得到细胞层;
取10-15ml人淋巴细胞分离液加入到所述细胞层中,离心摇匀,去除上清液得到白膜细胞层;
向所述白膜细胞层加入培养液并离心,将离心后的所述白膜细胞层加入培养基得到细胞悬液,将所述细胞悬液保存备用;
取15-20mld-pbs与试剂盒因子加入到培养瓶中,所述培养瓶于30-40℃在培养箱包被2-3h后,去除所述培养瓶中的包被液;
向去除包被液的培养瓶中加入10ml所述血浆1以及所述细胞悬液,将培养瓶记为培养瓶1。
可选的,所述培养nk细胞步骤还包括:
配置活化培养基和增殖培养基备用;
将培养瓶1放入37℃,5%二氧化碳饱和湿度培养箱培养,以及记为培养第一天;
培养第四天向所述培养瓶1中加入30-40ml所述活化培养基、10ml所述血浆1以及试剂盒因子,将所述培养瓶1放在37℃,5%二氧化碳饱和湿度培养箱培养;
培养第六天向所述培养瓶1中加入60-70ml所述活化培养基、10ml所述血浆1以及试剂盒因子,将所述培养瓶1放在37℃,5%二氧化碳饱和湿度培养箱培养;
培养第八天向所述培养瓶1中加入所述血浆2,得到细胞液,将所述细胞液倒入培养袋中,向所述培养袋中加入500ml所述活化培养基;将所述培养袋放入37℃,5%二氧化碳饱和湿度培养箱培养;
培养第十天将增殖培养基液500ml倒入培养袋中,将所述培养袋放在37℃,5%二氧化碳饱和湿度培养箱培养;
培养第十三天向所述培养袋补加所述增殖培养基液1000ml,将所述培养袋放在37℃,5%二氧化碳饱和湿度培养箱培养;
培养第十六天收集所述培养袋中的nk细胞悬液,离心得到nk细胞,将所述nk细胞计数封存。
可选的,所述构建cd16a/hsp70双抗慢病毒表达载体的步骤包括:
将igg的前导基因,抗cd16avl基因,第一链接linker,抗hsp70vh基因,第二链接linker,抗hsp70vl基因,第三链接linker,抗cd16avh基因,铰链序列基因,higg1ch2基因以及higg1ch3基因依次连接在一起后得到融合基因;
将所述融合基因插入到慢病毒过表达质粒载体pgreenpurotm的xbai/draiii的位点,即得到cd16a/hsp70双抗慢病毒表达载体。
可选的,所述将cd16a/hsp70双抗慢病毒表达载体感染所述nk细胞得到cd16a/hsp70抗体的双特异性抗体nk细胞的步骤包括:
将cd16a/hsp70双抗慢病毒表达载体和包装质粒分别进行高纯度无内毒素抽提;
将抽提之后的所述cd16a/hsp70双抗慢病毒表达载体和包装质粒共转染包装细胞;
更换所述转染包装细胞的完全培养基以及收集所述转染包装细胞的上清液;
对所述上清液进行浓缩病毒以及感染nk细胞,得到cd16a/hsp70抗体的双特异性抗体的nk细胞。
本申请提供根据上述的方法制备的双特异性抗体nk细胞。
本申请还提供根据上述方法制备的双特异性抗体nk细胞在制备治疗肝癌药品中的应用。
本申请提供通过基因修饰的nk细胞在体内持续分泌双特异性抗体,继承car-t(嵌合抗原受体t细胞)和双特异性抗体的优点并克服其不足,是一种融合了自体免疫细胞、基因修饰和双特异性抗体的细胞。
本申请提供的技术方案与现有技术相比具有以下有益效果:本发明提供的nk细胞的细胞表型优秀以及纯度高,其中cd3-cd56+达到97.13%,cd3-cd56+cd16+达到93%;携带有cd16a/hsp70双抗慢病毒表达载体的细胞能够有效消除肝癌细胞、抑制肝癌肿瘤体积增加的能力。
附图说明
为了更清楚地说明本申请的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
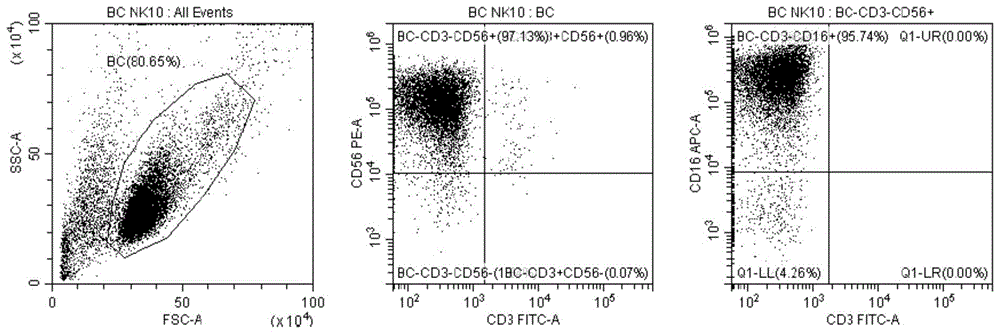
图1为本申请实施例制备的nk细胞样品1的流式表型检测图;
图2为本申请实施例制备的nk细胞样品2的流式表型检测图。
具体实施方式
下面将详细地对实施例进行说明,其示例表示在附图中。下面的描述涉及附图时,除非另有表示,不同附图中的相同数字表示相同或相似的要素。以下实施例中描述的实施方式并不代表与本申请相一致的所有实施方式。仅是与权利要求书中所详述的、本申请的一些方面相一致的系统和方法的示例。
过继免疫治疗主要包括特异性的til(肿瘤浸润淋巴细胞)、tcr(t细胞抗原受体)、car-t(嵌合抗原受体t细胞)、car-nk(嵌合抗原受体nk细胞)、非特异性的cik(细胞因子诱导的杀伤细胞)、dc(树突状细胞)以及nk等。其中,nk作为重要免疫效应细胞,不需要预先致敏即可直接杀伤病毒感染或异变的靶细胞,同时具有以下特征:无需特异性抗原识;直接杀伤靶细胞;不受mhc(组织相容性复合体)限制;具有较广的抗瘤谱以及基本无不良反应。在控制癌症的发生和发展中起着非常重要的作用。其可以通过释放穿孔素/颗粒酶、adcc效应(抗体依赖细胞介导的细胞毒性作用)、fas/fasl系统(凋亡系统)及nk细胞毒因子消灭人体内的病毒、细菌以及癌细胞。正是由于以上nk其独特的特点,其在肿瘤免疫治疗中的应用越来越受到重视。在日本,nk细胞不仅广泛用于癌症病人治疗,还应用于亚健康人群,预防癌症发生。
本申请提供一种双特异性抗体nk细胞制备方法,包括以下步骤:
s1:培养nk细胞;
s2:构建cd16a/hsp70双抗慢病毒表达载体;
s3:将cd16a/hsp70双抗慢病毒表达载体感染所述nk细胞得到cd16a/hsp70抗体的双特异性抗体nk细胞。
与t细胞、b细胞相比,nk细胞表面标志的特异性是相对的。人nk细胞mig-,部分以及nk细胞cd2、cd3和cd8呈阳性,表达il-2受体β链(p75,cd122),cd11b/cd18呈阳性。常用检测nk细胞的标记抗体有cd16、cd56、cd57、cd59、cd11b、cd94和lak-1。
本申请提供根据上述的方法制备的双特异性抗体nk细胞。
本申请还提供根据上述方法制备的双特异性抗体nk细胞在制备治疗肝癌药品中的应用。
本申请中的试剂盒因子均购于天津灏洋生物制品科技责任有限公司。
s1:培养nk细胞步骤包括:
对脐带血取样病毒检测;
将检测合格的所述脐带血离心,离心后的脐带血于50-60℃水浴中灭活30-60min;
将灭活后的脐带血于-20至-10℃下冷却10-15min后离心,得到上清血浆和下部细胞液;
将所述上清血浆分为血浆1和血浆2,将所述血浆1和血浆2一同置于4℃冰箱保存备用;
向所述下部细胞液加入d-pbs并搅拌均匀,离心去除上清液,得到细胞层;
取10-15ml人淋巴细胞分离液加入到所述细胞层中,离心摇匀,去除上清液得到白膜细胞层;
向所述白膜细胞层加入培养液并离心,将离心后的所述白膜细胞层加入培养基得到细胞悬液,将所述细胞悬液保存备用;
取15-20mld-pbs、一支jv-1试剂盒因子以及一支jv-2试剂盒因子加入到培养瓶中,将所述培养瓶于30-40℃培养箱或4℃冰箱包被2-3h后,去除所述培养瓶中的包被液;
向去除包被液的培养瓶中加入10ml血浆1、所述细胞悬液、五支jv-3试剂盒因子以及一支jv-r-plus试剂盒因子,将培养瓶记为培养瓶1;
配置活化培养基和增殖培养基备用;
将培养瓶1放入37℃,5%二氧化碳饱和湿度培养箱培养,以及记为培养第一天;
培养第四天向所述培养瓶1中加入30-40ml所述活化培养基、10ml所述血浆1、jv-r-plus试剂盒因子以及jv-6试剂盒因子,将所述培养瓶1放在37℃,5%二氧化碳饱和湿度培养箱培养;
培养第六天向所述培养瓶1中加入60-70ml所述活化培养基、10ml所述血浆1以及jv-7试剂盒因子,将所述培养瓶1放在37℃,5%二氧化碳饱和湿度培养箱培养;
培养第八天向所述培养瓶1中加入所述血浆2,得到细胞液,将所述细胞液倒入培养袋中,向所述培养袋中加入500ml所述活化培养基;将所述培养袋放入37℃,5%二氧化碳饱和湿度培养箱培养;
培养第十天将增殖培养基液500ml倒入培养袋中,将所述培养袋放在37℃,5%二氧化碳饱和湿度培养箱培养;
培养第十三天向所述培养袋补加所述增殖培养基液1000ml,将所述培养袋放在37℃,5%二氧化碳饱和湿度培养箱培养;
培养第十六天收集所述培养袋中的nk细胞悬液,离心得到nk细胞,将所述nk细胞计数封存。
在实际应用中,制备的nk细胞拥有对肿瘤靶向迁移功能,可以诱导肿瘤细胞凋亡,一直肿瘤细胞生长的作用,可以作为肝癌肿瘤靶向治疗载体。
在实际过程中,获得nk细胞之后需要进行如下步骤:
首先对动物注射hsp70抗原,得到动物细胞,其次将动物细胞与免疫人hsp70抗原细胞进行融合,并对得到的融合细胞进行培养,通过筛选后的得到杂交瘤细胞,并对杂交瘤细胞进行培养以及亚克隆,获得分泌单克隆抗体的杂交瘤细胞。
最后将杂交瘤细胞扩大培养,离心收集细胞上清液,用蛋白a亲和层析方法纯化细胞上清液中的抗体。
在实际过程中,需要提取总rna,反转录形成cdna,利用vh和vl引物扩增vh和vl基因片段,将载体与pcr产物连接、转化、筛选、鉴定以及测序,获得抗人hsp70单克隆抗体可变基因序列。得到抗人hsp70单克隆抗体可变基因序列之后构建cd16a/hsp70双抗慢病毒表达载体。
s2:构建cd16a/hsp70双抗慢病毒表达载体的步骤包括:
将igg的前导基因,抗cd16avl基因,第一链接linker,抗hsp70vh基因,第二链接linker,抗hsp70vl基因,第三链接linker,抗cd16avh基因,铰链序列基因,higg1ch2基因以及higg1ch3基因依次连接在一起后得到融合基因;
将所述融合基因插入到慢病毒过表达质粒载体pgreenpurotm的xbai/draiii的位点,即得到cd16a/hsp70双抗慢病毒表达载体。
在实际过程中,可以运用pcr技术(聚合酶链式反应)进行体外扩增以得到目的基因片段,利用重组技术将编码的基因片段转入慢病毒载体中,构建cd16a/hsp70双抗慢病毒表达载体。
在实际应用中,双特异性抗体又称为bsab,所以双特异性抗体nk细胞也被称为bsab-nk细胞,所以在本申请实施例中将双特异性抗体nk细胞称为bsab-nk细胞。
s3:将cd16a/hsp70双抗慢病毒表达载体感染所述nk细胞得到cd16a/hsp70抗体的bsab-nk细胞(双特异性抗体nk细胞)的步骤包括:
将cd16a/hsp70双抗慢病毒表达载体和包装质粒分别进行高纯度无内毒素抽提;
将抽提之后的所述cd16a/hsp70双抗慢病毒表达载体和包装质粒共转染包装细胞;
更换所述转染包装细胞的完全培养基以及收集所述转染包装细胞的上清液;
对所述上清液进行浓缩病毒以及感染nk细胞,得到cd16a/hsp70抗体的bsab-nk细胞。
在实际过程中,将上述构建得到的cd16a/hsp70双抗慢病毒表达载体转染nk细胞,利用双抗慢病毒载体在人脐带血细胞内的复制,使人脐带血细胞持续稳定表达。
在实际应用中,检测所述的cd16a/hsp70抗体的bsab-nk细胞的性能包括:
取对数生长期bsab-nk癌细胞系,以效靶比5:1的浓度培养4-8小时,得到上清液;
用elisa试剂盒对所述上清液检测bsab-nk细胞分泌ifn-γ(血清细胞因子抗干扰素)水平、tnf-α水平(肿瘤坏死因子)和il-2(白细胞介素)水平。
在实际应用中,对高效表达的自分泌抗cd16a/hsp70抗体的bsab-nk细胞进行体内和体外有效性的验证,针对相同效靶比时,考察未修饰的nk细胞与bsab-nk细胞的杀瘤活性。在高表达的hsp70的肝癌细胞系和低表达的hsp70的肝癌细胞系中,考察未修饰的nk细胞与bsab-nk细胞分泌细胞因子ifn-γ水平、tnf-α水平和il-2水平。对体内有效性分析:以hsp70小鼠模型为例,考察nk细胞注射治疗和bsab-nk细胞的注射治疗,对小鼠的肿瘤体积相对对照组增长速度、体重下降速度。比较bsab-nk细胞组、nk细胞组以及对照组的中位生存期。
下面是本申请提供的实施例:
首先制备nk细胞:
先对实验设备进行紫外消毒。
对脐带血取样病毒检测,检测内容为:乙肝五项、hcv(丙型肝炎病毒)、htlv(人类嗜t细胞病毒)、hiv(人类免疫缺陷病毒)、ebv(疱疹病毒科嗜淋巴细胞病毒)、cmv(巨细胞病毒)以及梅毒螺旋,检测标准:乙肝五项检测只能是表面抗体是阳性,两项和三项抗体阳性均不符合要求。
取20mld-pbs与一支jv-1试剂盒因子以及一支jv-2试剂盒因子加入到培养瓶中,再用移液管吸取培养瓶中的d-pbs清洗试剂盒2次,用封口膜封口,于30℃在培养箱包被3h。
配置活化培养基和增殖培养基:
取1000ml基础培养基加入一支试剂盒因子jv-5得到增殖培养基;
取500ml增殖培养基中加入一支jv-4得到活化培养基。将活化培养基和增殖培养基备用;
将检测合格的脐带血离心15min其中转速为1000g,离心后的脐带血于60℃水浴中灭活60min,灭活后的脐带血于-20℃下冷却15min后离心20min,其中转速为1000g,得到上清血浆和下部细胞液,将上清血浆分为血浆1和血浆2,一同置于4℃冰箱保存备用。
向所述下部细胞液加入d-pbs至50ml并搅拌均匀,离心去除上清液,得到细胞层。
取15ml人淋巴细胞分离液加入到所述细胞层中,离心(转速200g,离心5min)摇匀,去除上清液得到白膜细胞层。
向所述白膜细胞层加入基础培养基至50ml随后离心(转速500g,离心15min),将离心后的所述白膜细胞层加入未加任何因子的培养基得到细胞悬液。
用吸管吸出步骤1中包被后的培养瓶中的包被液,吸的过程中不要碰包被面,吸出之后向培养瓶中加入10ml血浆1、40ml所述细胞悬液(整个过程中保持培养瓶包被面处于湿润状态)、五支jv-3试剂盒因子以及一支jv-r-plus试剂盒因子,将所述培养瓶置于37℃,5%二氧化碳饱和湿度培养箱培养,此时记为培养第一天。
培养第四天向培养瓶中加入40ml活化培养基,并加入10ml血浆1以及一支jv-r-plus试剂盒因子和一支jv-6试剂盒因子,将培养瓶1放在37℃,5%二氧化碳饱和湿度培养箱培养。
培养第六天向培养瓶中加入60ml活化培养基,并加入10ml血浆1以及一支jv-7试剂盒因子,将培养瓶1放在37℃,5%二氧化碳饱和湿度培养箱培养。
培养第八天,将培养瓶1从培养箱中取出,显微镜下观察细胞状态和数量。向所述培养瓶1中加入血浆2,用移液管吸10ml活化培养基于培养瓶内,并不断吹洗瓶的内壁10-20次,如此反复多次,直至把瓶内壁上的大部分细胞吹掉,得到细胞液,将所述细胞液倒入培养袋中,向所述培养袋中加入500ml活化培养基;将所述培养袋放入37℃,5%二氧化碳饱和湿度培养箱培养。
在实际过程中,如果在第八天之前,细胞数量已经很多,且培养基已经变黄,可以先将培养瓶中液体扩充到另一个培养瓶中,等到第八天的时候,将两个培养瓶同时进行转袋。
在实际过程中,将所述细胞液倒入培养袋这一过程中,需要先检测培养袋是否漏液,可以先加入100ml活化培养基,如果袋子并没有漏液的话继续向培养袋中加入活化培养基,总计需要加入500ml活化培养基(包括最初检测袋子是否漏液的活化培养基)。
培养第十天培养基明显变黄,将增殖培养基液500ml倒入培养袋中,将培养瓶放在37℃,5%二氧化碳饱和湿度培养箱培养。
在实际过程中,倒入500ml培养液后,此时培养袋中共1l培养液,其中500ml活化培养液,500ml增殖培养液。
培养第十三天每个培养袋补加增殖培养基液1000ml,混匀,取出30ml培养液送检做细菌、真菌、支原体以及内毒素检测。
培养第十六天收集培养袋中的nk细胞悬液,离心得到nk细胞,将所述nk细胞计数封存。本实施例共制备得到两种nk细胞样品分别是nk细胞样品1和nk细胞样品2。
其中,图1为本申请实施例制备的nk细胞样品1的流式表型检测图,从中可以看出cd3-cd56-为1.84%,cd3-cd56+为97.13%,cd3+cd56-为0.07%,cd3+cd56+为0.96%,cd3-(cd56+cd16+)为93.00%。图2为本申请实施例制备的nk细胞样品2的流式表型检测图,可以得知,cd3-cd56+为98.34%,cd3-cd56+cd16+为96.06%。
得到nk细胞之后需要制备分泌单克隆抗体的杂交瘤细胞。
将20μg人hsp70抗原与相同剂量ifa试剂盒混合进行乳化反应,对balb/c小鼠背部多点、腋下及腹股沟进行免疫。第14天以及第28天,均以同样方法再次免疫。
第38天时取小鼠尾部血清,用间接elisa方法检测血清效价。融合前3天,取20μg人hsp70抗原进行腹部加强免疫。
小鼠骨髓瘤sp2/0细胞与免疫人hsp70抗原后小鼠的脾脏细胞,按1:10的比例混匀,在加入细胞融合剂peg,1min内无血清培养基终止peg作用,离心去除上清液,得到融合细胞,将融合细胞重悬于hat选择性培养基中。
将其加到96孔细胞培养板中,放置于37℃、5%co2的培养箱中培养15天,离心去除上清液,使用间接elisa(酶联免疫吸附测定)进行高通量筛选,将确定为阳性的杂交瘤细胞进行培养基转换,将其由hat选择性培养基换至ht选择性培养基再换至10%含血清培养基最后换至无血清培养基。
得到的杂交瘤细胞进行亚克隆获得分泌单克隆抗体的杂交瘤细胞。
之后根据杂交瘤细胞构建cd16a/hsp70双抗慢病毒表达载体。
将亚克隆后的细胞以105个/ml的密度加入到含无血清培养基的体积为1l的细胞培养瓶中,放置于37℃、5%co2培养箱中进行扩大培养20天,离心收集细胞上清液。
用蛋白a亲和层析方法纯化细胞上清液中的anti-hsp70。对anti-hsp70单抗进行纯度鉴定,效价鉴定以及亚型鉴定。其中纯度鉴定使用sds-page凝胶电泳(聚丙烯酰胺凝胶电泳)检测;效价鉴定使用elisa检测;亚型鉴定采用试剂盒对筛选到的抗体进行亚型鉴定。
提取杂交瘤的总rna,反转录形成cdna,利用vh和vl引物扩增vh片段和vl片段。将pgem-t载体与pcr产物(vh或vl)连接、转化、筛选、鉴定以及测序,获得抗人hsp70单克隆抗体可变区基因序列。
将igg的前导基因,抗cd16avl基因,第一链接linker,抗hsp70vh基因,第二链接linker,抗hsp70vl基因,第三链接linker,抗cd16avh基因,铰链序列基因,higg1ch2基因以及higg1ch3基因依次连接在一起后装入到慢病毒过表达质粒载体pgreenpurotm的xbai/draiii位点,得到慢病毒表达载体质粒。
将慢病毒表达载体质粒、慢病毒穿梭质粒及其辅助质粒分别进行高纯度无内毒素抽提后,共转染nk细胞,转染后6h更换为完全培养基,浓缩病毒后感染即得到bsab-nk细胞。
将bsab-nk细胞为效应细胞,以低表达hsp70的肝癌细胞系作为靶细胞,检测bsab-nk细胞的杀伤作用。
取对数生长期癌细胞系(低表达hsp70的肝癌细胞系和高表达hsp70的肝癌细胞系),以效靶比5:1的浓度共同培养4小时,收集上清液,用elisa试剂盒检测bsab-nk细胞分泌ifn-γ、tnf-α以及il-2水平。
取6周龄雌性裸鼠30只,每只裸鼠右腋下皮下注射1×107的人hsp70阳性肿瘤细胞系,随机分成3组进行尾静脉注射治疗:生理盐水对照组、nk细胞组和bsab-nk细胞组。
计算肿瘤体积以及称量小鼠重量。并统计每天死亡数,绘制移植瘤模型鼠的生存率曲线。
对高效表达的自分泌抗cd16a/hsp70抗体的bsab-nk细胞进行体内和体外有效性的验证,相同效靶比时,未修饰的nk细胞的杀瘤活性低于bsab-nk细胞。高表达的hsp70的肝癌细胞系和低表达的hsp70的肝癌细胞系,bsab-nk细胞分泌细胞因子ifn-γ水平、tnf-α水平和il-2水平均高于未修饰的nk细胞。体内有效性分析结果表明:在hsp70小鼠模型中,随着nk及bsab-nk细胞的注射治疗,小鼠的肿瘤体积相对对照组增长缓慢、体重下降缓慢,且bsab-nk细胞组>nk细胞组>对照组。bsab-nk细胞组中位生存期>nk细胞组中位生存期>对照组中位生存期。所以制备双特异性抗体nk细胞的方法制备得到的双特异性抗体nk细胞能够应用在制备治疗肝癌药品中。
本申请提供通过基因修饰的nk细胞在体内持续分泌双特异性抗体,继承car-t(嵌合抗原受体t细胞)和双特异性抗体的优点并克服其不足,是一种融合了自体免疫细胞、基因修饰和双特异性抗体的细胞。
本申请提供的技术方案与现有技术相比具有以下有益效果:本发明提供的nk细胞的细胞表型优秀以及纯度高,其中cd3-cd56+达到97.13%,cd3-cd56+cd16+达到93%;携带有cd16a/hsp70双抗慢病毒表达载体的细胞能够有效消除肝癌细胞、抑制肝癌肿瘤体积增加的能力。所以本申请提供的一种双特异性抗体nk细胞制备方法制备得到的双特异性抗体nk细胞能够应用在制备治疗肝癌药品中。
本申请提供的实施例之间的相似部分相互参见即可,以上提供的具体实施方式只是本申请总的构思下的几个示例,并不构成本申请保护范围的限定。对于本领域的技术人员而言,在不付出创造性劳动的前提下依据本申请方案所扩展出的任何其他实施方式都属于本申请的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!