一种制备4-戊烯-2-炔醛的方法与流程
[0001]
本发明涉及一种制备4-戊烯-2-炔醛的方法。
背景技术:
[0002]
鳄梨织蛾(stenoma catenifer)是在中美洲和南美洲(例如墨西哥、危地马拉、秘鲁、厄瓜多尔和巴西)攻击鳄梨果实的最严重害虫。例如,在南美洲的一些地区,每季喷洒杀虫剂7至11次。然而,据说仍有60%的果实受损。此原因之一是该害虫的幼虫钻入肉中,这使得很难用杀虫剂进行控制。因此,生物防治引起关注,并且认为使用性信息素是有前途的。
[0003]
鳄梨织蛾的性信息素是二烯炔醛(dienynal)化合物(9z)-9,13-十四碳二烯-11-炔醛(非专利文献1和2,在下面列出)。
[0004]
现有技术列表
[0005]
[非专利文献1]jocelyn g.millar et al,tetrahedron letters.2008,49:4820-4823.
[0006]
[非专利文献2]mark s.hoddle et al,ecology and behavior.2009,102(4):1460-1467.
[0007]
[非专利文献3]jones.e.r.h et al,journal of the chemical society,1958,1054-1059.
技术实现要素:
[0008]
认为上述(9z)-9,13-十四碳二烯-11-炔醛中的末端烯炔骨架可以由具有相似骨架的4-戊烯基-2-炔醛构造。例如,通过用二氧化锰在二氯甲烷中氧化4-戊烯-2-炔-1-醇来合成4-戊烯-2-炔醛(上述非专利文献3)。
[0009]
但是,非专利文献3中氧化所用的二氧化锰引起很大的环境负荷。此外,氧化反应经常涉及爆炸的危险。因此,难以在工业规模上实践该方法。收率极低至30%。
[0010]
在上述情况下完成了本发明,并且提供了制备4-戊烯-2-炔醛的方法,该方法可以在没有氧化反应相关危险的情况下以工业规模进行。
[0011]
作为深入研究的结果,本发明人发现,可以通过水解5,5-二烷氧基-1-戊烯-3-炔化合物而在短时间内有效地制备4-戊烯-2-炔醛,并因此完成了本发明。由此产生的4-戊烯-2-炔醛可用作制备二烯炔醛化合物的中间体,如(9z)-9,13-十四碳二烯-11-炔醛。
[0012]
根据本发明的一个方面,提供了一种制备下式(2)的4-戊烯-2-炔醛的方法:
[0013]
ch2=chc≡ccho
ꢀꢀꢀ
(2)
[0014]
该方法包括以下步骤
[0015]
水解以下通式(1)的5,5-二烷氧基-1-戊烯-3-炔化合物:
[0016]
ch2=chc≡cch(or1)(or2)
ꢀꢀꢀ
(1)
[0017]
其中,r1和r2彼此独立地表示具有1至15个、优选1至8个、更优选1至4个碳原子的一价烃基,或者r1和r2可以彼此键合以形成具有2至10个碳原子的二价烃基r
1-r2,
[0018]
以得到4-戊烯-2-炔醛(2)。
[0019]
根据本发明,能够以简短的方法和高收率制备4-戊烯-2-炔醛。此外,根据本发明制备4-戊烯-2-炔醛的方法不涉及氧化反应,因此不会有爆炸的危险。
具体实施方式
[0020]
制备4-戊烯-2-炔醛
[0021]
式(2)的4-戊烯-2-炔醛可以通过水解以下通式(1)的5,5-二烷氧基-1-戊烯-3-炔化合物来制备4-戊烯-2-炔醛(2),如以下化学反应式所示。
[0022][0023]
r1和r2彼此独立地表示具有1至15个、优选1至8个、更优选1至4个碳原子的一价烃基,或者r1和r2可以彼此键合以形成具有2至10个碳原子的二价烃基r
1-r2。
[0024]
一价烃基的实例包括直链饱和烃基,如甲基、乙基、正丙基、正丁基、正戊基、正己基、正庚基、正辛基、正壬基、正癸基、正十一烷基和正十二烷基;支链的饱和烃基,如异丙基、2-甲基丙基和2-甲基丁基;直链不饱和烃基,如2-丙烯基;支链不饱和烃基,如2-甲基-2-丙烯基;环状饱和烃基,如环丙基;及其异构体。这些烃基中的一部分氢原子可以被甲基或乙基取代。
[0025]
考虑到处理,优选甲基、乙基、正丙基和正丁基。
[0026]
二价烃基的实例包括直链饱和烃基,如亚乙基、1,3-亚丙基和1,4-亚丁基;支链饱和烃基,如1,2-亚丙基、2,2-二甲基-1,3-亚丙基、1,2-亚丁基、1,3-亚丁基、2,3-亚丁基和2,3-二甲基-2,3-亚丁基;直链不饱和烃基,如1-乙烯基亚乙基;支链不饱和烃基,如2-甲基-1,3-丙烯基;环状不饱和烃基,如1,2-环丙烯基和1,2-环丁烯基;及其异构体。这些烃基中的一部分氢原子可以被甲基或乙基取代。
[0027]
考虑到消除离去基团的反应性,纯化的容易性和可利用性,二价烃基优选为低级烃基,优选具有2-4个碳原子。它们具有高反应性,并且它们通过脱保护产生的副产物可以通过水洗或蒸发而容易地除去。
[0028]
然后,二价烃基的优选实例包括亚乙基、1,2-亚丙基、1,3-亚丙基、1,2-亚丁基、1,3-亚丁基和2,3-二甲基-2,3-亚丁基。
[0029]
5,5-二烷氧基-1-戊烯-3-炔化合物(1)的实例包括5,5-二甲氧基-1-戊烯-3-炔、5,5-二乙氧基-1-戊烯-3-炔、5,5-二丙氧基-1-戊烯-3-炔、5,5-二丁氧基-1-戊烯-3-炔、5,5-乙氧基甲氧基-1-戊烯-3-炔、1-戊烯-3-炔-1,3-二氧戊烷和1-戊烯-3-炔-1,3-二恶烷。考虑到通用性,优选5,5-二甲氧基-1-戊烯-3-炔、5,5-二乙氧基-1-戊烯-3-炔、5,5-二丙氧基-1-戊烯-3-炔和5,5-二丁氧基-1-戊烯-3-炔。
[0030]
5,5-二烷氧基-1-戊烯-3-炔化合物(1)的水解可以使用例如酸或水进行。
[0031]
酸的实例包括无机酸,如盐酸和氢溴酸;有机酸,如对甲苯磺酸(p-tsoh)、苯磺酸、三氟乙酸、乙酸、甲酸和草酸;以及碘代三甲基硅烷和四氯化钛,从反应性考虑,优选对甲苯磺酸和草酸。
[0032]
酸可以单独使用或组合使用。该酸可以是市售的一种。
[0033]
考虑到反应完成,相对于每摩尔5,5-二烷氧基-1-戊烯-3-炔化合物(1),酸的量优选为0.001至10.0摩尔。
[0034]
考虑到反应性,相对于每摩尔5,5-二烷氧基-1-戊烯-3-炔化合物(1),水的量优选为18至5000g。
[0035]
如果必要,溶剂可以在水解中与上述酸或水一起使用。
[0036]
溶剂的实例包括烃溶剂,如甲苯、二甲苯、己烷、庚烷、苯和异丙苯;醚溶剂,如四氢呋喃、乙醚、丁醚、4-甲基四氢吡喃、环戊基甲基醚和1,4-二恶烷;极性溶剂,如n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、n-甲基吡咯烷酮、二甲亚砜、乙腈、丙酮、γ-丁内酯、二氯甲烷和氯仿;和醇,如甲醇和乙醇。
[0037]
溶剂可以单独使用或组合使用。溶剂可以是市售的一种。
[0038]
最佳溶剂随所用的酸而变化。例如,当使用对甲苯磺酸作为酸时,考虑到反应性,溶剂优选为四氢呋喃。
[0039]
考虑到反应性,相对于每摩尔5,5-二烷氧基-1-戊烯-3-炔化合物(1),溶剂的量优选为0至3000g。
[0040]
如果必要,抗氧化剂可以在水解中与上述酸或水一起使用。
[0041]
抗氧化剂的实例包括二丁基羟基甲苯(bht)、维生素a、维生素c、维生素e、尿酸、谷胱甘肽和褪黑素。
[0042]
考虑到收率,相对于每摩尔5,5-二烷氧基-1-戊烯-3-炔化合物(1),抗氧化剂的量优选为0.001至1000g。
[0043]
抗氧化剂可以单独使用或组合使用。抗氧化剂可以是市售的一种。
[0044]
水解中的反应温度根据所使用的酸或溶剂而变化,考虑到反应性,优选为5至180℃。
[0045]
水解中的反应时间随所使用的溶剂或生产规模而变化,并且考虑到反应性,优选为0.5至55小时。
[0046]
制备5,5-二烷氧基-1-戊烯-3-炔化合物(1)
[0047]
5,5-二烷氧基-1-戊烯-3-炔化合物(1)例如可以通过在存在碱时,通过消除在下述通式(3)的2-炔醛缩醛化合物的5位上的离去基团z而合成,如以下化学反应式所示。
[0048][0049]
2-炔醛缩醛化合物(3)中的r1和r2彼此独立地表示具有1至15个、优选1至8个、更优选1至4个碳原子的一价烃基,或者r1和r2可以彼此键合以形成具有2至10个碳原子的二价烃基r
1-r2。
[0050]
当2-炔醛缩醛化合物(3)中的r1和r2为一价烃基或二价烃基时,r1和r2可以选自5,5-二烷氧基-1-戊烯-3-炔化合物(1)中的r1和r2选项。
[0051]
2-炔醛缩醛化合物(3)中的z表示离去基团,为具有1至12个碳原子的烷氧基、具有1至10个碳原子的酰氧基、具有3至20个碳原子的硅氧基、具有1至10个碳原子的烷烃磺酰氧基、具有6至20个碳原子的芳烃磺酰氧基或卤素原子。
[0052]
烷氧基的碳原子数为1至12个,优选1至9个。
[0053]
烷氧基的实例包括直链饱和烷氧基,如甲氧基、乙氧基、正丙氧基、正丁氧基和正戊氧基;支链饱和烷氧基,如异丙氧基和叔丁氧基;直链不饱和烷氧基,如2-丙烯氧基和2-丙炔氧基;支链不饱和烷氧基,如2-甲基-2-丙烯氧基;环烷氧基,如环丙氧基、2-甲基环丙氧基、环丁氧基和环戊氧基;包括芳环的烷氧基,如苄氧基和对甲氧基苄氧基;烷氧基烷氧基,如甲氧基甲氧基、甲氧基乙氧基、2-甲氧基乙氧基甲氧基、苄氧基甲氧基、对甲氧基苄氧基甲氧基、1-乙氧基乙氧基和四氢吡喃-2-基氧基;和卤代烷氧基,,如2,2,2-三氯乙氧基和五氟乙氧基;及其异构体。这些烷氧基中的氢原子的一部分可以被甲基或乙基取代。
[0054]
烷氧基的特别优选的实例包括甲氧基、乙氧基、2-丙烯氧基、甲氧基甲氧基、甲氧基乙氧基和1-乙氧基乙氧基,因为它们的可用性以及由于在脱保护中形成的副产物很容易通过水洗或蒸发去除。
[0055]
酰氧基的碳原子数为1至10个,优选1至7个。
[0056]
酰氧基的实例包括直链脂族酰氧基,如甲酰氧基、乙酰氧基、丙酰氧基、丁酰氧基和巴豆酰氧基;支链脂族酰氧基,如2-甲基丙酰氧基和新戊酰氧基;卤代酰氧基,如三氯乙酰氧基和三氟乙酰氧基;以及芳族酰氧基,如苯甲酰氧基;及其异构体。这些酰氧基中的一部分氢原子可以被甲基或乙基取代。
[0057]
考虑到可获得性,酰氧基的特别优选的实例包括乙酰氧基、丙酰氧基、新戊酰氧基和苯甲酰氧基。
[0058]
硅氧基的碳原子数为3至20个,优选3至16个,更优选3至10个。
[0059]
硅氧基的实例包括三烷基硅氧基,如三甲基硅氧基、三乙基硅氧基、三异丙基硅氧基和叔丁基二甲基硅氧基;以及单烷基二芳基硅氧基,如叔丁基二苯基硅氧基;及其异构体。这些硅氧基中的一部分氢原子可以被甲基或乙基取代。
[0060]
考虑到可获得性,并且考虑到通过脱保护产生的副产物可以容易地通过洗涤或浓缩除去的事实,硅氧基的特别优选的实例包括三甲基硅氧基、三乙基硅氧基。
[0061]
烷烃磺酰氧基的碳原子数为1至10个,优选1至7个。
[0062]
烷烃磺酰氧基的实例包括甲磺酰氧基、乙磺酰氧基、1-丁磺酰氧基、1-辛磺酰氧基、烯丙基磺酰氧基、10-樟脑磺酰氧基、三氟甲磺酰氧基和苄基磺酰氧基、及其异构体。这些烷烃磺酰氧基中的一部分的氢原子可以被甲基或乙基取代。
[0063]
考虑到可获得性,烷烃磺酰氧基的特别优选的实例包括甲磺酰氧基和乙磺酰氧基。
[0064]
芳烃磺酰氧基的碳原子数为6至20个,优选6至15个,更优选6至7个。
[0065]
芳烃磺酰氧基的实例包括苯磺酰氧基、4-氯苯磺酰氧基、4-甲氧基苯磺酰氧基、2-硝基苯磺酰氧基、2,4,6-三甲基苯磺酰氧基、对甲苯磺酰氧基、1-萘磺酰氧基、和2-萘磺酰氧基、及其异构体。这些芳烃磺酰氧基中的一部分的氢原子可以被甲基或乙基取代。
[0066]
考虑到可获得性,芳烃磺酰氧基的特别优选的例子包括苯磺酰氧基和对甲苯磺酰氧基。
[0067]
卤素原子的实例包括氟原子、氯原子、溴原子和碘原子。
[0068]
考虑到可获得性,卤素原子的特别优选的实例是氯原子和溴原子。
[0069]
z为具有1至12个碳原子的烷氧基的2-炔醛缩醛化合物(3)的具体实例包括1,1-二
烷氧基-5-(甲氧基甲氧基)-2-戊炔化合物,如1,1-二甲氧基-5-(甲氧基甲氧基)-2-戊炔和1,1-二乙氧基-5-(甲氧基甲氧基)-2-戊炔;1,1-二烷氧基-5-(甲氧基乙氧基)-2-戊炔化合物,如1,1-二甲氧基-5-(甲氧基乙氧基)-2-戊炔、1,1-二乙氧基-5-(甲氧基乙氧基)-2-戊炔;1,1-二烷氧基-5-甲氧基-2-戊炔化合物,如1,1-二甲氧基-5-甲氧基-2-戊炔和1,1-二乙氧基-5-甲氧基-2-戊炔;以及1,1-二烷氧基-5-乙氧基-2-戊炔化合物,如1,1-二甲氧基-5-乙氧基-2-戊炔和1,1-二乙氧基-5-乙氧基-2-戊炔。
[0070]
z为具有1至10个碳原子的酰氧基的2-炔醛缩醛化合物(3)的具体实例包括1,1-二烷氧基-5-乙酰氧基-2-戊炔化合物,如1,1-二甲氧基-5-乙酰氧基-2-戊炔和1,1-二乙氧基-5-乙酰氧基-2-戊炔。
[0071]
z为具有3至20个碳原子的硅氧基的2-炔醛缩醛化合物(3)的具体实例包括1,1-二烷氧基-5-三甲基硅氧基-2-戊炔化合物,如1,1-二甲氧基-5-三甲基硅氧基-2-戊炔和1,1-二乙氧基-5-三甲基硅氧基-2-戊炔;1,1-二烷氧基-5-三乙基硅氧基-2-戊炔化合物,如1,1-二甲氧基-5-三乙基硅氧基-2-戊炔和1,1-二乙氧基-5-三乙基硅氧基-2-戊炔。
[0072]
z为具有1至10个碳原子的烷烃磺酰氧基的2-炔醛缩醛化合物(3)的具体实例包括1,1-二烷氧基-5-甲磺酰氧基-2-戊炔化合物,如1,1-二甲氧基-5-甲磺酰氧基-2-戊炔和1,1-二乙氧基-5-甲磺酰氧基-2-戊炔。
[0073]
z为具有6至20个碳原子的芳烃磺酰氧基的2-炔醛缩醛化合物(3)的具体实例包括1,1-二烷氧基-5-(对甲苯磺酰氧基)-2-戊炔化合物,如1,1-二甲氧基-5-(对甲苯磺酰氧基)-2-戊炔和1,1-二乙氧基-5-(对甲苯磺酰氧基)-2-戊炔。
[0074]
z为卤原子的2-炔醛缩醛化合物(3)的具体实例包括1,1-二烷氧基-5-氯-2-戊炔化合物,如1,1-二甲氧基-5-氯-2-戊炔和1,1-二乙氧基-5-氯-2-戊炔;以及1,1-二烷氧基-5-溴-2-戊炔化合物,如1,1-二甲氧基-5-溴-2-戊炔和1,1-二乙氧基-5-溴-2-戊炔。
[0075]
通过缩醛基团和三键的电子作用,2-炔醛缩醛化合物(3)中第4位的酸度大大提高,从而,即使离去基团z是具有低离去能力的烷氧基、酰氧基或硅氧基时,不需要将离去基团转化为具有高离去能力的另一个离去基团,并且当然,当离去基团z为都具有高离去能力的烷烃磺酰氧基、芳烃磺酰氧基或卤素原子时,都可以发生离去基团z的消除反应。
[0076]
在离去基团z为具有低离去能力的烷氧基、酰氧基或硅氧基的情况下,与烷烃磺酰氧基、芳烃磺酰氧基和卤素原子相比,2-炔醛缩醛化合物(3)有利地具有高的热稳定性。这允许通过蒸馏纯化,这在工业上是有利的。
[0077]
同时,在具有烃基而不是缩醛基的化合物中,在4位的酸度不高,使得特别是在具有低消除能力的离去基团,即烷氧基、酰氧基或硅氧基的情况下,消除反应不能有效地进行。
[0078]
在离去基团z的消除反应中使用的碱的实例包括氢氧化物,如氢氧化钠、氢氧化钾、氢氧化钙和氢氧化镁;金属醇盐,如甲醇钠、乙醇钠、叔丁醇钠、叔戊醇钠、甲醇锂、乙醇锂、叔丁醇锂、叔戊醇锂、甲醇钾、乙醇钾、叔丁醇钾和叔丁醇钾;有机金属试剂,如甲基锂、乙基锂、正丁基锂、甲基氯化镁、二甲亚砜钠、乙炔钠和乙炔钾;金属酰胺,如酰胺钠、酰胺锂、二异丙基酰胺锂、六甲基二硅叠氮化锂、六甲基二硅叠氮钠、六甲基二硅叠氮钾和二环己基酰胺锂;金属氢化物,例如氢化钠、氢化钾和氢化钙;和胺,如三乙胺、哌啶、吡咯烷、吡啶、4-二甲基氨基吡啶和1,8-二氮杂双环[5.4.0]-7-十一碳烯(dbu)。
[0079]
从抑制丙二烯化合物和杂质的形成从而以高收率获得4-戊烯-2-炔醛(2)的角度考虑,碱的优选实例包括金属醇盐,例如甲醇钠、乙醇钠和叔丁醇钾。
[0080]
该碱可以单独使用或组合使用。该碱可以是市售的一种。
[0081]
相对于每摩尔2-炔醛缩醛化合物(3),碱的量优选为0.6至3.0摩尔,更优选为0.7至2.0摩尔,甚至更优选为0.8至1.5摩尔。
[0082]
如果必要,可以在消除反应中使用溶剂。
[0083]
溶剂的实例包括醚,如乙醚、丁醚、四氢呋喃(thf)、4-甲基四氢吡喃、环戊基甲基醚和1,4-二恶烷;烃,如己烷、庚烷、苯、甲苯、二甲苯和异丙苯;氯化物溶剂,如二氯甲烷、氯仿和三氯乙烯;非质子极性溶剂,如n,n-二甲基甲酰胺(dmf)、n,n-二甲基乙酰胺、n-甲基吡咯烷酮、二甲亚砜、γ-丁内酯、1,3-二甲基-2-咪唑啉酮和六甲基磷酰三胺;腈,如乙腈和丙腈;酯,如乙酸乙酯和乙酸正丁酯;以及醇如甲醇、乙醇和叔丁醇。
[0084]
溶剂可以单独使用或组合使用。溶剂可以是市售的一种。
[0085]
相对于每摩尔2-炔醛缩醛化合物(3),溶剂的量优选为0至10000g,更优选0至5000g。
[0086]
考虑到收率,当碱是金属醇盐、有机金属试剂、金属酰胺或金属氢化物时,消除反应的温度优选为-78至70℃,更优选为-50至40℃,甚至更优选为-30至30℃。
[0087]
考虑到收率,当碱是胺时,消除反应的温度优选为0至180℃,更优选为10至150℃,甚至更优选为20至130℃。
[0088]
消除的反应时间可以根据溶剂或制备规模而变化,并且考虑到反应性,优选为0.5至55小时。
[0089]
制备(9z)-9,13-十四碳二烯-11-炔醛
[0090]
上述制备4-戊烯-2-炔醛的方法可用于制备例如9,13-十四碳二烯-11-炔醛,如(9z)-9,13-十四碳二烯-11-炔醛,它是被称为最严重鳄梨害虫的鳄梨织蛾(stenoma catenifer)的信息素。
[0091]
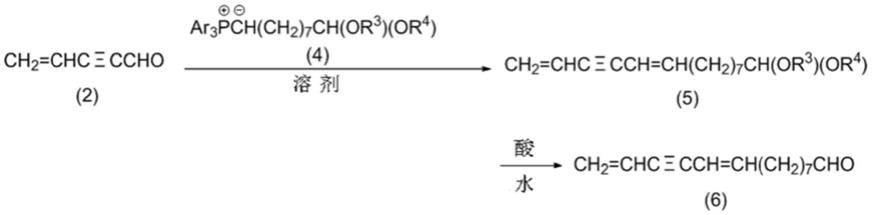
下述式(6)的9,13-十四碳二烯-11-炔醛可以如下制备:通过上述4-戊烯-2-炔醛(2)与下述通式(4)的三芳基鏻9,9-二烷氧基壬基叶立德(triarylphosphonium 9,9-dialkoxynonylide)化合物的维蒂希反应,得到下述通式(5)的14,14-二烷氧基-1,5-十四碳二烯-3-炔化合物;水解14,14-二烷氧基-1,5-十四碳二烯-3-炔化合物(5),如以下化学反应式所示。
[0092][0093]
首先,下面将说明维蒂希反应。
[0094]
三芳基鏻9,9-二烷氧基壬基叶立德化合物由以下通式(4)表示。
[0095]
ar3p
+
c-h(ch2)7ch(or3)(or4)(4)
[0096]
其中r3和r4彼此独立地表示具有1至15个碳原子、优选1至8个、更优选1至4个碳原
子的一价烃基,或r3和r4可以彼此键合以形成具有2至10个碳原子的二价烃基r
3-r4。
[0097]
r3和r4的实例与5,5-二烷氧基-1-戊烯-3-炔化合物(1)中的r1和r2的实例相同。
[0098]
三芳基鏻9,9-二烷氧基壬基叶立德化合物(4)中的ar可以彼此相同或不同,并且表示芳基。芳基的碳原子数优选为6至24个,更优选为6至12个,甚至更优选为6或7个。
[0099]
芳基的实例包括苯基(ph基团)、甲苯基、萘基和蒽基,考虑到合成的容易性,优选苯基。考虑到合成的容易性,三个芳基均优选为苯基。
[0100]
三芳基鏻9,9-二烷氧基壬基叶立德化合物(4)的实例包括三苯基鏻9,9-二烷氧基壬基叶立德化合物,如三苯基鏻9,9-二甲氧基壬基叶立德、三苯基鏻9,9-二乙氧基壬基叶立德、三苯基鏻9,9-二丙氧基壬基叶立德和三苯基鏻9,9-二丁氧基壬基叶立德;以及三甲苯基鏻9,9-二烷氧基壬基叶立德化合物,如三甲苯基鏻9,9-二甲氧基壬基叶立德、三甲苯基鏻9,9-二乙氧基壬基叶立德、三甲苯基鏻9,9-二丙氧基壬基叶立德和三甲苯基鏻9,9-二丁氧基壬基叶立德。
[0101]
三芳基鏻9,9-二烷氧基壬基叶立德化合物(4)可以单独使用或组合使用。三芳基鏻9,9-二烷氧基壬基叶立德化合物(4)可以是市售的一种或可以自行合成。
[0102]
三芳基鏻9,9-二烷氧基壬基叶立德化合物(4)可以如下制备:使以下通式(7)的9-卤代-1,1-二烷氧基壬烷化合物与以下通式(8)的磷化合物反应,得到以下通式(9)的9,9-二烷氧基壬基三芳基鏻卤化物;并将得到的9,9-二烷氧基壬基三芳基鏻卤化物(9)在存在碱时进行去质子化反应,以得到所述三芳基鏻9,9-二烷氧基壬基叶立德化合物(4),如以下化学反应式所示。
[0103][0104]
9-卤代-1,1-二烷氧基壬烷化合物(7)中的r3和r4彼此独立地表示具有1至15个、优选1至8个、更优选1至4个碳原子的一价烃基,或r3和r4可以彼此键合以形成具有2至10个碳原子的二价烃基r
3-r4。
[0105]
r3和r4的实例与5,5-二烷氧基-1-戊烯-3-炔化合物(1)中的r1和r2的实例相同。
[0106]
9-卤代-1,1-二烷氧基壬烷化合物(7)中的x表示卤素原子,如氯原子、溴原子和碘原子,从通用性考虑,优选氯原子和溴原子。
[0107]
9-卤代-1,1-二烷氧基壬烷化合物(7)的实例包括9-氯-1,1-二烷氧基壬烷化合物,如9-氯-1,1-二甲氧基壬烷、9-氯-1,1-二乙氧基壬烷、9-氯-1,1-二丙氧基壬烷、9-氯-1,1-二丁氧基壬烷、9-氯-1,1-二戊氧基壬烷、9-氯-1,1-二己氧基壬烷、9-氯-1,1-二庚氧基壬烷、和9-氯-1,1-二辛氧基壬烷;9-溴-1,1-二烷氧基壬烷化合物,如9-溴-1,1-二甲氧基壬烷、9-溴-1,1-二乙氧基壬烷、9-溴-1,1-二丙氧基壬烷、9-溴-1,1-二丁氧基壬烷、9-溴-1,1-二戊氧基壬烷、9-溴-1,1-二己氧基壬烷、9-溴-1,1-二庚氧基壬烷和9-溴-1,1-二辛氧基壬烷;以及9-碘-1,1-二烷氧基壬烷化合物,如9-碘-1,1-二甲氧基壬烷、9-碘-1,1-二乙氧基壬烷、9-碘-1,1-二丙氧基壬烷、9-碘-1,1-二丁氧基壬烷、9-碘-1,1-二戊氧基壬烷、9-碘-1,1-二己氧基壬烷、9-碘-1,1-二庚氧基壬烷和9-碘-1,1-二辛氧基壬烷。
[0108]
磷化合物(8)中的ar可以彼此相同或不同,并且表示芳基。芳基的碳原子数优选为6至24个,更优选为6至12个,甚至更优选为6或7个。
[0109]
芳基的实例包括苯基(ph基)、甲苯基、萘基和蒽基,考虑到合成的容易性,优选苯基。考虑到合成的容易性,三个芳基均更优选为苯基。
[0110]
磷化合物(8)的实例包括三芳基膦化合物,如三苯基膦和三甲苯基膦,从反应性考虑,优选三苯基膦。
[0111]
考虑到反应性,相对于每摩尔9-卤代-1,1-二烷氧基壬烷化合物(7),磷化合物(8)的量优选为0.8至5.0摩尔。
[0112]
如果必要,在制备9,9-二烷氧基壬基三芳基鏻卤化物(9)时可以使用卤化物。
[0113]
卤化物的实例包括碘化钠、碘化钾、溴化钠和溴化钾,考虑到反应性,优选碘化物,如碘化钠和碘化钾。
[0114]
卤化物可以单独使用或组合使用。卤化物可以是市售的一种。
[0115]
考虑到反应性,相对于每摩尔9-卤代-1,1-二烷氧基壬烷化合物(7),卤化物的量优选为0.1至5.0摩尔。
[0116]
如果必要,可以在制备9,9-二烷氧基壬基三芳基鏻卤化物(9)时加入碱。
[0117]
碱的实例包括碱金属碳酸盐,如碳酸钾和碳酸钠;碱土金属碳酸盐,如碳酸钙和碳酸镁;以及胺,如三乙胺、三丙胺、三异丙胺、三丁胺、n,n-二乙基苯胺和吡啶,从处理的角度来看,优选碱金属碳酸盐。
[0118]
该碱可以单独使用或组合使用。该碱可以是市售的一种。
[0119]
考虑到反应性,相对于每摩尔9-卤代1,1-二烷氧基壬烷化合物(7),碱的量优选为0.001至1.0摩尔。
[0120]
制备9,9-二烷氧基壬基三芳基鏻卤化物(9)的最佳温度随所用溶剂而变化,考虑到反应性,优选为60至180℃。
[0121]
制备9,9-二烷氧基壬基三芳基鏻卤化物(9)的反应时间随所用溶剂和生产规模而变化,优选为3至55小时。
[0122]
9,9-二烷氧基壬基三芳基鏻卤化物(9)中的r3和r4彼此独立地表示具有1至15个、优选1至8个、更优选1至4个碳原子的一价烃基,或者r3和r4可以彼此键合以形成具有2至10个碳原子的二价烃基r
3-r4。
[0123]
r3和r4的实例与5,5-二烷氧基-1-戊烯-3-炔化合物(1)中的r1和r2的实例相同。
[0124]
9,9-二烷氧基壬基三芳基鏻卤化物(9)中的y表示卤原子,且其实例包括氯原子、溴原子和碘原子。
[0125]
在制备9,9-二烷氧基壬基三芳基鏻卤化物(9)中不使用卤化物的情况下,y为与x相同的卤素原子。在使用碘化物作为卤化物的情况下,y为与x相同的卤素原子或碘原子。
[0126]
9,9-二烷氧基壬基三芳基鏻卤化物(9)中的ar表示芳基。ar如磷化合物(8)所定义。
[0127]
9,9-二烷氧基壬基三芳基鏻卤化物(9)的实例包括9,9-二烷氧基壬基三苯基鏻氯化物,如9,9-二甲氧基壬基三苯基鏻氯化物、9,9-二乙氧基壬基三苯基鏻氯化物、9,9-二丙氧基壬基三苯基鏻氯化物和9,9-二丁氧基壬基三苯基鏻氯化物;9,9-二烷氧基壬基三苯基鏻溴化物,如9,9-二甲氧基壬基三苯基鏻溴化物、9,9-二乙氧基壬基三苯基鏻溴化物、9,9-二丙氧基壬基三苯基鏻溴化物和9,9-二丁氧基壬基三苯基鏻溴化物;9,9-二烷氧基壬基三苯基鏻碘化物,如9,9-二甲氧基壬基三苯基鏻碘化物、9,9-二乙氧基壬基三苯基鏻碘化物、
9,9-二丙氧基壬基三苯基鏻碘化物和9,9-二丁氧基壬基三苯基鏻碘化物;9,9-二烷氧基壬基三甲苯基鏻氯化物,如9,9-二甲氧基壬基三甲苯基鏻氯化物、9,9-二乙氧基壬基三甲苯基鏻氯化物、9,9-二丙氧基壬基三甲苯基鏻氯化物和9,9-二丁氧基壬基三甲苯基鏻氯化物;9,9-二烷氧基壬基三甲苯基鏻溴化物,如9,9-二甲氧基壬基三甲苯基鏻溴化物、9,9-二乙氧基壬基三甲苯基鏻溴化物、9,9-二丙氧基壬基三甲苯基鏻溴化物和9,9-二丁氧基壬基三甲苯基鏻溴化物;以及9,9-二烷氧基壬基三甲苯基鏻碘化物,如9,9-二甲氧基壬基三甲苯基鏻碘化物、9,9-二乙氧基壬基三甲苯基鏻碘化物、9,9-二丙氧基壬基三甲苯基鏻碘化物和9,9-二丁氧基壬基三甲苯基鏻碘化物。
[0128]
通过使如此获得的9,9-二烷氧基壬基三芳基鏻卤化物(9)在存在碱时进行去质子化反应,从而获得三芳基鏻9,9-二烷氧基壬基叶立德化合物(4)。
[0129]
可以在制备9,9-二烷氧基壬基三芳基鏻卤化物(9)后,通过在反应体系中直接加入碱,可以制备三芳基鏻9,9-二烷氧基壬基叶立德化合物(4)。或者,分离并纯化9,9-二烷氧基壬基三芳基鏻卤化物(9),然后向其中加入碱以获得三芳基鏻9,9-二烷氧基壬基叶立德化合物(4)。
[0130]
在制备三芳基鏻9,9-二烷氧基壬基叶立德化合物(4)中使用的碱的实例包括烷基锂,例如正丁基锂和叔丁基锂;金属醇盐,例如叔丁醇钾、叔丁醇钠、甲醇钾、甲醇钠、乙醇钾、乙醇钠;以及金属酰胺,如二异丙基酰胺锂和双(三甲基硅烷基)酰胺钠。考虑到反应性,优选金属醇盐,特别是叔丁醇钾、甲醇钠和乙醇钠。
[0131]
考虑到反应性,相对于每摩尔9-卤代-1,1-二烷氧基壬烷化合物(7),碱的量优选为0.7至5.0摩尔。
[0132]
制备三芳基鏻9,9-二烷氧基壬基叶立德化合物(4)的温度随溶剂和碱而变化,并且优选为-78至25℃。
[0133]
制备三芳基鏻9,9-二烷氧基壬基叶立德化合物(4)的反应时间随溶剂和生产规模而变化,并且优选为0.5至50小时。
[0134]
如果必要,可以在制备9,9-二烷氧基壬基三芳基鏻卤化物(9)和在制备三芳基鏻9,9-二烷氧基壬基叶立德化合物(4)中使用溶剂。
[0135]
溶剂的实例包括醚溶剂,如四氢呋喃、乙醚、丁醚、4-甲基四氢吡喃、环戊基甲基醚和1,4-二恶烷;烃类溶剂,如己烷、庚烷、苯、甲苯、二甲苯和异丙苯;以及极性溶剂,如n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、n-甲基吡咯烷酮、二甲亚砜、γ-丁内酯、乙腈、二氯甲烷和氯仿,考虑到反应性,优选乙醚溶剂如四氢呋喃和极性溶剂如乙腈和n,n-二甲基乙酰胺。
[0136]
溶剂可以单独使用或组合使用。溶剂可以是市售的一种。
[0137]
考虑到反应性,相对于每摩尔9-卤代-1,1-二烷氧基壬烷化合物(7)或9,9-二烷氧基壬基三芳基鏻卤化物(9),溶剂的量优选为50至5000g。
[0138]
考虑到反应性,相对于每摩尔4-戊烯-2-炔醛(2),三芳基鏻9,9-二烷氧基壬基叶立德化合物(4)的量优选为1.0至4.0摩尔,更优选为1.0至2.0摩尔。
[0139]
如果必要,可以在维蒂希反应中使用溶剂。
[0140]
溶剂的实例包括醚溶剂,例如四氢呋喃、乙醚、丁醚、4-甲基四氢吡喃、环戊基甲基醚和1,4-二恶烷;烃类溶剂,例如己烷、庚烷、苯、甲苯、二甲苯和异丙苯;极性溶剂,例如n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、n-甲基吡咯烷酮、二甲亚砜、γ-丁内酯、乙腈、二氯甲
烷和氯仿。考虑到反应性,优选醚溶剂如四氢呋喃和极性溶剂如乙腈、n,n-二甲基甲酰胺和n,n-二甲基乙酰胺。
[0141]
溶剂可以单独使用或组合使用。溶剂可以是市售的一种。
[0142]
考虑到反应性,相对于每摩尔4-戊烯-2-炔醛(3),溶剂的量优选为50至5000g。
[0143]
维蒂希反应的最佳温度随所用溶剂而变化,优选为-78至40℃。在z优先进行维蒂希反应的情况下,温度优选为-78至10℃。在e优先进行维蒂希反应的情况下,温度优选为-78至-40℃。然后,使中间产物在改良的schlosser条件下反应,其中该中间产物用强碱例如苯基锂处理。
[0144]
维蒂希反应中的反应时间随生产规模而变化,并且优选为大于0(>0)至50小时。
[0145]
14,14-二烷氧基-1,5-十四碳二烯-3-炔化合物(5)的几何异构体是以下通式(5-z)的14,14-二烷氧基-(5z)-1,5-十四碳二烯-3-炔化合物、以下通式(5-e)的14,14-二烷氧基-(5e)-1,5-十四碳二烯-3-炔化合物及其混合物。
[0146][0147]
14,14-二烷氧基-1,5-十四碳二烯-3-炔化合物(5)的实例包括14,14-二烷氧基-(5z)-1,5-十四碳二烯-3-炔化合物,如14,14-二甲氧基-(5z)-1,5-十四碳二烯-3-炔、14,14-二乙氧基-(5z)-1,5-十四碳二烯-3-炔、14,14-二丙氧基-(5z)-1,5-十四碳二烯-3-炔、14,14-二丁氧基-(5z)-1,5-十四碳二烯-3-炔、14,14-二戊氧基-(5z)-1,5-十四碳二烯-3-炔、14,14-二己氧基-(5z)-1,5-十四碳二烯-3-炔、14,14-二庚氧基-(5z)-1,5-十四碳二烯-3-炔、和14,14-二辛氧基-(5z)-1,5-十四碳二烯-3-炔;以及14,14-二烷氧基-(5e)-1,5-十四碳二烯-3-炔化合物,如14,14-二甲氧基-(5e)-1,5-十四碳二烯-3-炔、14,14-二乙氧基-(5e)-1,5-十四碳二烯-3-炔、14,14-二丙氧基-(5e)-1,5-十四碳二烯-3-炔、14,14-二丁氧基-(5e)-1,5-十四碳二烯-3-炔、14,14-二戊氧基-(5e)-1,5-十四碳二烯-3-炔、14,14-二己氧基-(5e)-1,5-十四碳二烯-3-炔、14,14-二庚氧基-(5e)-1,5-十四碳二烯-3-炔和14,14-二辛氧基-(5e)-1,5-十四碳二烯-3-炔。
[0148]
接下来,将解释水解步骤。
[0149]
在水解中,可以单独或组合使用14,14-二烷氧基-1,5-十四碳二烯-3-炔化合物(5)。
[0150]
例如,可以将14,14-二烷氧基-(5z)-1,5-十四碳二烯-3-炔化合物和14,14-二烷氧基-(5e)-1,5-十四碳二烯-3-炔化合物的混合物用于获得(9z)-9,13-十四碳二烯-11-炔醛和(9e)-9,13-十四碳二烯-11-炔醛的混合物。
[0151]
水解可以使用例如酸或水进行。
[0152]
酸的实例包括无机酸,如盐酸和氢溴酸、对甲苯磺酸、苯磺酸、三氟乙酸、乙酸、甲酸、草酸、碘代三甲基硅烷和四氯化钛,考虑到反应性,优选乙酸、甲酸和草酸。
[0153]
酸可以单独使用或组合使用。所述酸可以是市售的一种。
[0154]
相对于每摩尔14,14-二烷氧基-1,5-十四碳二烯-3-炔化合物(5),酸的量优选为0.01至10.0摩尔。
[0155]
相对于每摩尔14,14-二烷氧基-1,5-十四碳二烯-3-炔化合物(5),水的量优选为18至3000g。
[0156]
水解中,如果必要,溶剂可以与上述酸或水一起使用。
[0157]
溶剂的实例包括烃溶剂,如甲苯、二甲苯、己烷、庚烷、苯和异丙苯;醚溶剂,例如四氢呋喃、乙醚、丁醚、4-甲基四氢吡喃、环戊基甲基醚和1,4-二恶烷;极性溶剂,如n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、n-甲基吡咯烷酮、二甲亚砜、乙腈、丙酮、γ-丁内酯、二氯甲烷和氯仿;和醇,如甲醇和乙醇。
[0158]
溶剂可以单独使用或组合使用。溶剂可以是市售的一种。
[0159]
最佳溶剂随所用的酸而变化。例如,当使用草酸作为酸时,考虑到反应性,溶剂优选为四氢呋喃、丙酮和γ-丁内酯。
[0160]
考虑到反应性,相对于每摩尔14,14-二烷氧基-1,5-十四碳二烯-3-炔化合物(5),溶剂的量优选为0至3000g。
[0161]
水解时的温度随所用的酸或溶剂而变化,考虑到反应性,优选为5至180℃。
[0162]
水解的反应时间随所用的酸或溶剂或制备规模而变化,考虑到反应性,优选为1至55小时。
[0163]
9,13-十四碳二烯-11-炔醛(6)的实例包括下式(6-z)的(9z)-9,13-十四碳二烯-11-炔醛、下式(6-e)的(9e)-9,13-十四碳二烯-11-炔醛及其混合物。
[0164][0165]
实施例
[0166]
将参考以下实施例进一步描述本发明。应当理解,本发明不限于实施例。
[0167]
除非另有说明,否则本文所用的术语“纯度”是指气相色谱法(gc)中的面积百分比。术语“生产率”是指gc中面积百分比的比率。从gc中的面积百分比计算出产率。
[0168]
在实施例中,在以下gc条件下进行反应的监测。
[0169]
gc条件:shimadzu corporation出品的gc-2014毛细管气相色谱仪;柱:db-5,0.25mm
×
0.25mm
×
30m;载气:he(1.55ml/min);检测器:fid;色谱柱温度:150℃,以5℃/min的速度升高,最高到230℃。
[0170]
考虑到原料和产物的纯度(%gc),根据以下等式计算收率。
[0171]
收率(%)={[(反应所得产物的重量
×
%gc)/产物的分子量]
÷
[(反应中原料的重量
×
%gc)/原料的分子量]}
×
100
[0172]
实施例1
[0173]
制备5,5-二乙氧基-1-戊烯-3-炔(1:r1=et,r2=et)
[0174][0175]
将叔丁醇钾(tbuok)(402.39g,3.59mol)和四氢呋喃(thf)(1856.64g)放入室温反应器中,并在10至15℃搅拌28分钟。然后,将1,1-二乙氧基-5-(甲氧基甲氧基)-2-戊炔(3:r1=et,r2=et;z=ch3och2o)(704.18g,3.26mol,纯度:100%)滴加到10至15℃的反应器中。在滴加完成后,将反应混合物在10至20℃搅拌5.5小时。接下来,将水(1953.60g)加入到反应混合物中,随后进行相分离并去除水相以获得有机相。然后,将有机相减压浓缩,并将残余物减压(51.3至57.9℃/3.0mmhg(0.40kpa))进行蒸馏,以获得5,5-二乙氧基-1-戊烯-3-炔(1:r1=et,r2=et)(436.26g,2.78mol,纯度:98.41%),收率为85.52%。
[0176]
以下是由此制备的5,5-二乙氧基-1-戊烯-3-炔(1:r1=et,r2=et)的光谱数据。
[0177]
[核磁共振谱]1h-nmr(500mhz,cdcl3):δ1.22(6h,t,7.1hz),3.58(2h,dq,j=6.9hz,7.8hz),3.73(2h,dq,j=6.9hz,7.9hz),5.36(1h,d,j=1.6hz),5.52(1h,dd,j=11.0hz,2.3hz),5.69(1h,dd,j=17.6hz,2.3hz),5.81(1h,ddd,j=17.8hz,10.9hz,1.5hz);
13
c-nmr(125mhz,cdcl3):δ15.01,60.81,83.76,84.89,91.57,116.04,128.48.
[0178]
[质谱]ei质谱(70ev):m/z153(m
+-1),125,109,81,63,53.
[0179]
[红外吸收光谱](nacl):νmax2977,2886,1355,1328,1162,1091,1054,1012.
[0180]
实施例2
[0181]
制备5,5-二乙氧基-1-戊烯-3-炔(1:r1=et,r2=et)
[0182][0183]
将叔丁醇钾(17.08g,0.15mol)和n,n-二甲基甲酰胺(dmf)(78.92g)放入室温反应器中,并在10至15℃搅拌40分钟。然后,将1,1-二乙氧基-5-(甲氧基甲氧基)-2-戊炔(3:r1=et,r2=et;z=ch3och2o)(30.00g,0.14mol,纯度:99.80%)滴加到10至15℃的反应器中。在滴加完成后,将反应混合物在10至20℃搅拌3小时。接下来,将水(83.04g)加入到反应混合物中,随后进行相分离并去除水相以获得有机相。然后,将有机相减压浓缩,并将残余物减压(51.3至57.9℃/3.0mmhg(0.40kpa))进行蒸馏,以获得5,5-二乙氧基-1-戊烯-3-炔(1:r1=et,r2=et)(15.42g,0.072mol,纯度:70.41%),收率为50.87%。
[0184]
由此获得的5,5-二乙氧基-1-戊烯-3-炔(1:r1=et,r2=et)的光谱数据与实施例1相同。
[0185]
实施例3
[0186]
制备5,5-二乙氧基-1-戊烯-3-炔(1:r1=et,r2=et)
[0187]
[0188]
将乙炔钠(7.31g,0.15mol)和n,n-二甲基甲酰胺(dmf)(78.92g)放入室温反应器中,并在10至15℃搅拌40分钟。然后,将1,1-二乙氧基-5-(甲氧基甲氧基)-2-戊炔(3:r1=et,r2=et;z=ch3och2o)(30.00g,0.14mol,纯度:99.80%)滴加到10至15℃的反应器中。在滴加完成后,将反应混合物在10至20℃搅拌3小时,并再在60℃搅拌2.5小时。接下来,将水(83.04g)加入到反应混合物中,随后进行相分离并去除水相以获得有机相。然后,将有机相减压浓缩,并将残余物减压(51.3至57.9℃/3.0mmhg(0.40kpa))进行蒸馏,以获得5,5-二乙氧基-1-戊烯-3-炔(1:r1=et,r2=et)(36.21g,0.026mol,纯度:10.89%),收率为18.48%。
[0189]
由此获得的5,5-二乙氧基-1-戊烯-3-炔(1:r1=et,r2=et)的光谱数据与实施例1相同。
[0190]
实施例4
[0191]
制备5,5-二甲氧基-1-戊烯-3-炔(1:r1=me,r2=me)
[0192][0193]
将叔丁醇钾(23.19g,0.21mol)和四氢呋喃(107.14g)放入室温反应器中,并在10至15℃搅拌25分钟。然后,将1,1-二甲氧基-5-乙酰氧基-2-戊炔(3:r1=me,r2=me;z=ch3c(=o)-o)(34.99g,0.19mol)滴加到10至15℃的反应器中。在滴加完成后,将反应混合物在10至20℃搅拌1小时。接下来,将水(112.74g)加入到反应混合物中,随后进行相分离并去除水相以获得有机相。然后,将有机相减压浓缩,并将残余物减压(69.2至71.1℃/25.0mmhg(3.3kpa))进行蒸馏,以获得5,5-二甲氧基-1-戊烯-3-炔(1:r1=me,r2=me)(20.73g,0.16mol),收率为87.44%。
[0194]
以下是由此制备的5,5-二甲氧基-1-戊烯-3-炔(1:r1=me,r2=me)的光谱数据。
[0195]
[核磁共振谱]1h-nmr(500mhz,cdcl3):δ3.37(6h,s),5.24(1h,d,j=1.1hz),5.55(1h,dd,j=2.3hz,11.1hz),5.71(1h,dd,j=2.3hz,17.7hz),5.82(1h,ddd,j=1.2hz,10.9hz,17.9hz);
13
c-nmr(125mhz,cdcl3):δ52.42,83.96,84.30,93.30,115.82,128.75.
[0196]
[质谱]ei质谱(70ev):m/z 125(m
+-1),111,95,80,65,52.
[0197]
[红外吸收光谱](nacl):νmax 2938,2905,2831,2230,1603,1358,1343,1192,1162,1099,1056,963,901.
[0198]
实施例5
[0199]
制备5,5-二甲氧基-1-戊烯-3-炔(1:r1=me,r2=me)
[0200][0201]
将叔丁醇钾(23.19g,0.21mol)和四氢呋喃(109.08g)放入室温反应器中,并在10至15℃搅拌17分钟。然后,将1,1-二甲氧基-5-三甲基硅氧基-2-戊炔(3:r1=me,r2=me;z=(ch3)3sio)(41.39g,0.19mol)滴加到10至15℃的反应器中。在滴加完成后,将反应混合物在
10至20℃搅拌1.5小时。接下来,将水(114.78g)加入到反应混合物中,随后进行相分离并去除水相以获得有机相。然后,将有机相减压浓缩,并将残余物减压(69.2至71.1℃/25.0mmhg(3.3kpa))进行蒸馏,以获得5,5-二甲氧基-1-戊烯-3-炔(1:r1=me,r2=me)(13.02g,0.10mol),收率为53.93%。
[0202]
由此获得的5,5-二甲氧基-1-戊烯-3-炔(1:r1=me,r2=me)的光谱数据与实施例4相同。
[0203]
实施例6
[0204]
制备5,5-二甲氧基-1-戊烯-3-炔(1:r1=me,r2=me)
[0205][0206]
将叔丁醇钾(23.96g,0.21mol)和四氢呋喃(110.68g)放入室温反应器中,并在10至15℃搅拌21分钟。然后,将1,1-二甲氧基-5-甲磺酰氧基-2-戊炔(3:r1=me,r2=me;z=oms(即oso2ch3))(43.14g,0.19mol)滴加到10至15℃的反应器中。在滴加完成后,将反应混合物在10至20℃搅拌1.5小时。接下来,将水(116.46g)加入到反应混合物中,随后进行相分离并去除水相以获得有机相。然后,将有机相减压浓缩,并将残余物减压(69.2至71.1℃/25.0mmhg(3.3kpa))进行蒸馏,以获得5,5-二甲氧基-1-戊烯-3-炔(1:r1=me,r2=me)(14.22g,0.11mol),收率为58.05%。
[0207]
由此获得的5,5-二甲氧基-1-戊烯-3-炔(1:r1=me,r2=me)的光谱数据与实施例4相同。
[0208]
实施例7
[0209]
制备4-戊烯-2-炔醛(2)
[0210][0211]
将按照实施例1的方法制备并纯化的5,5-二乙氧基-1-戊烯-3-炔(1:r1=et,r2=et)(46.26g,0.30mol)、维生素e(0.20g)、二丁基羟基甲苯(bht)(0.20g)、四氢呋喃(150.00g)和水(150.00g)置于室温反应器中,并在20至30℃搅拌5分钟。然后,将对甲苯磺酸一水合物(p-tsoh
·
h2o)(2.91g,0.015mol)在20至30℃添加至反应器中,并在60至65℃搅拌3小时。接下来,将碳酸氢钠(2.52g)和甲苯(272.31g:包括用于从容器中吸收碳酸氢钠的40g甲苯)添加到反应混合物中,随后进行相分离并除去水相以获得有机相。然后,将有机相减压浓缩,获得在甲苯(234.36g)和四氢呋喃(93.53g)的混合溶剂中的4-戊烯-2-炔醛(2)(17.93g,0.22mol),收率为74.63%。通过gc和nmr测定混合物中甲苯和四氢呋喃的量。
[0212]
以下是由此制备的4-戊烯-2-炔醛(2)的光谱数据。
[0213]
[核磁共振谱]1h-nmr(500mhz,cdcl3):δ9.35(1h,,d,j=0.7hz),6.08(1h,dd,j=17.2hz,2.3hz),6.01(1h,ddd,j=17.4hz,10.9hz,0.7hz),5.91(1h,dd,j=10.9hz,2.3hz);
13
c-nmr(125mhz,cdcl3):δ88.28,93.02,114.75,134.25,176.70.
[0214]
[质谱]ei质谱(70ev):m/z 80(m
+
),61,52.
[0215]
[红外吸收光谱](nacl):νmax 2977,2873,2210,2172,1664,1162,1080,1035,972,947,798.
[0216]
参考例1
[0217]
制备9,13-十四碳二烯-11-炔醛(6)
[0218][0219]
将9-氯-1,1-二乙氧基壬烷(7:x=cl;r1=et,r2=et)(90.29g,0.36mol)、三苯膦(8:ar=ph)(94.65g,0.36mol)、碘化钠(58.46g,0.39mol),碳酸钾(2.90g,0.021mol)和乙腈(192.45g)置于室温反应器中,并在75至85℃搅拌15小时,以获得9,9-二乙氧基壬基三苯基膦碘化物(9:y=i;ar=ph;r3=et,r4=et)。然后,在30至40℃向反应器中滴加四氢呋喃(346.14g)。滴加完成后,将反应混合物冷却至-5至10℃。接着,加入叔丁醇钾(38.71g,0.35mol)并搅拌1小时以获得三苯基鏻9,9-二乙氧基壬基叶立德(4:ar=ph;r3=et,r4=et)。
[0220]
接着,将在实施例7中制备的在甲苯(220.99g)和四氢呋喃(78.56g)的混合液中的4-戊烯-2-炔醛(2)(16.14g,0.20mol)滴加到-5至5℃反应器中。滴加完成后,将反应混合物在20至30℃搅拌2小时。接下来,将氯化钠(45.47g)在水(454.65g)中的溶液加入到反应混合物中,随后进行相分离并去除水相以获得有机相。然后,将有机相减压浓缩以获得粗产物14,14-二乙氧基-1,5-十四碳二烯-3-炔(5:r3=et,r4=et)(74.22g,0.18mol,纯度:68.06%,e/z=26/74),粗收率为90.02%。粗产物包含甲苯、三苯基膦和三苯基膦氧化物为杂质。
[0221]
随后,由此获得的粗产物14,14-二乙氧基-1,5-十四碳二烯-3-炔(5:r3=et,r4=et)(74.22g,0.18mol,纯度:68.06%,e/z=26/74)、草酸二水合物(68.61g,0.54mol)、四氢呋喃(181.40g)和纯水(181.40g)加入反应器中,并在60至65℃搅拌4小时。然后,将反应混合物冷却至50℃,并加入己烷(53.35g),并将反应混合物搅拌30分钟。搅拌完成后,将反应混合物静置以进行相分离,然后除去水相以获得有机相。然后,将有机相减压浓缩,并将残
余物减压(125.1至133.1℃/3.0mmhg(0.40kpa))进行蒸馏,以获得9,13-十四碳二烯-11-炔醛(6)(31.40g,0.15mol,纯度:96.03%,e/z=25/75),两步收率为73.25%。
[0222]
以下是由此制备的9,13-十四碳二烯-11-炔醛(6)的光谱数据。
[0223]
[核磁共振谱]1h-nmr(500mhz,cdcl3):δ1.27-1.35(6h,m),1.40(2h,br.quint,j=6.5hz),1.61(2h,br.quint,j=6.9hz),2.30(2h,ddt,j=1.5hz,7.3hz,7.3hz),2.40(2h,dt,j=1.9hz,7.3hz),5.44(1h,dd,j=11.2hz,1.9hz),5.55(1h,br.dd,j=10.7hz,1.9hz),5.60(1h,dd,j=17.6hz,1.9hz),5.86-5.97(2h,m),9.75(1h,t,j=1.9hz);
13
c-nmr(125mhz,cdcl3):δ21.99,28.63,28.80,29.01,29.05,30.14,43.84,86.98,92.16,108.91,117.36,126.03,144.18,202.80.
[0224]
[质谱]ei质谱(70ev):m/z 204(m
+
),175,161,147,133,119,105,91,78,65,53.
[0225]
[红外吸收光谱](nacl):νmax 2929,2856,1725,1464,1413,1392,972,918,739。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1