一种蓝莓果中儿茶酚氧化酶的提取和纯化方法与流程
[0001]
本发明属于酶分离、纯化技术领域,具体涉及一种蓝莓果中儿茶酚氧化酶的提取和纯化方法。
背景技术:
[0002]
儿茶酚氧化酶也称为多酚氧化酶或邻二酚氧化酶(cos;ec1.10.3.1)是一种含铜的核编码氧化酶,广泛存在于植物组织中。尽管它缺乏羟化酶活性,但其可以催化氧化具有邻苯二酚结构的物质成为相应的醌类,而这些醌类通过聚合最终形成黑色或者褐色色素。众多研究者发现儿茶酚氧化酶不仅导致果蔬的褐变,其在植物逆境胁迫防御、次生代谢及细胞死亡方面都有着非常重要的作用。此外,儿茶酚氧化酶在生物传感器形成,食品工业,医药和废水处理领域具有广泛的应用。
[0003]
随着研究技术和设备的发展,儿茶酚氧化酶更多的信息将会被挖掘出来,人们也将会根据其自身的结构特征、生理功能或者用途进行细致划分。然而现阶段有关儿茶酚氧化酶纯化的研究较少,其中能够成功获得有活性且纯度较高的儿茶酚氧化酶的案例十分有限。此外,现有的研究也发现不同的植物组织中儿茶酚氧化酶的结构有一定的差异,特别是酶的一级结构和亚基数量,这也就导致了其提取、纯化的方法通用性较差。
[0004]
蓝莓果是一种具有代表性的热敏性浆果,也是一种研究果实酶促褐变问题和儿茶酚氧化酶生理功能及用途的良好材料。一方面是因为蓝莓果中富含酚酸、类黄酮、花色苷等酚类物质,这些物质可能是儿茶酚氧化酶的潜在底物;另一方面,部分蓝莓品种的全基因组已经公布于genomedatabasefor vaccinium(www.vaccinium.org/)网站上,这将为深入研究蓝莓果实中儿茶酚氧化酶的蛋白结构、生理功能及用途提供丰富的生物学信息支持。然而,现阶段人们未能从蓝莓果实中获得具有活性且纯度较高的天然儿茶酚氧化酶。
技术实现要素:
[0005]
本发明的第一个目的在于提供了一种蓝莓果中儿茶酚氧化酶的提取方法。
[0006]
所述提取方法具体为在0~4℃的条件下,将蓝莓果按料液比为1:1~4的比例加入弱酸性缓冲液中,制成均匀浆质;然后再离心处理,取上清液,即得蓝莓果儿茶酚氧化酶提取液;
[0007]
其中,所述弱酸性缓冲液中添加有酚类螯合剂和表面活性剂,所述酚类螯合剂的添加量(g
·
ml-1
)为1~7%;所述表面活性剂的添加量为0~1.5%。
[0008]
由于蓝莓果中富含多种酚类物质,这些物质可能会影响儿茶酚氧化酶的活性,因此本发明在蓝莓果匀浆过程中添加了酚类螯合剂,从而减少酚类对儿茶酚氧化酶活性的影响;
[0009]
其中,所述酚类螯合剂为pvpp、pvp中的一种或两种;优选为pvpp和pvp的混合物,质量比为1.8~2.2:1;最优选为2:1。
[0010]
进一步提出的,当所述料液比为1:3~4时,提取效果最优。
[0011]
优选的,所述弱酸性缓冲液的ph值为5.8~6.2;
[0012]
优选的,所述弱酸性缓冲液为柠檬酸-柠檬酸钠缓冲液。
[0013]
优选的,所述酚类螯合剂的添加量(g
·
ml-1
)为1~3%。
[0014]
优选的,所述表面活性剂的添加量(g
·
ml-1
)为0.5~1.5%。
[0015]
进一步提出的,所述表面活性剂为非离子表面活性剂;优选为曲拉通x-100。曲拉通x-100是一种非离子表面活性剂也是一种良好的破膜剂,本发明将曲拉通x-100加入提取液中是为了破坏细胞或细胞器的膜结构,从而使得儿茶酚氧化酶能被充分的释放。
[0016]
进一步提出的,所述离心处理前还包括冰浴超声,所述冰浴超声的功率为40~100w,时间为5~30min。使用冰浴超声是为了提高儿茶酚氧化酶的提取效率,需要注意的是超声处理时间不应过长,且功率不宜过高,避免将目标蛋白结构破坏致使其失活。由此,更优选所述超声的功率为40~60w,时间为5~10min。
[0017]
本发明的第二个目的在于,提供一种蓝莓果中儿茶酚氧化酶的纯化方法,包括如下步骤:
[0018]
1)将蓝莓果儿茶酚氧化酶提取液进行硫酸铵进行分级沉淀,获得粗酶液;
[0019]
2)将粗酶液进行透析处理,获得酶液a;
[0020]
3)将酶液a进行柱层析纯化,获得酶液b;
[0021]
4)将酶液b进行非变性电泳纯化处理,具体如下:
[0022]
a)将酶液b与非变性非还原上样缓冲液按体积比3.5~4.5:1的比例混合,获得酶液b1;将酶液b与甘油按体积比1~3:1的比例进行混合,获得酶液b2;
[0023]
b)将酶液b1分别加入聚丙烯酰胺凝胶最左侧和最右侧的两个孔中;将酶液b2依次加入到聚丙烯酰胺凝胶剩余的孔中;在hepes电泳缓冲液进行电泳,当溴酚蓝到达聚丙烯酰胺凝胶底部时电泳结束;
[0024]
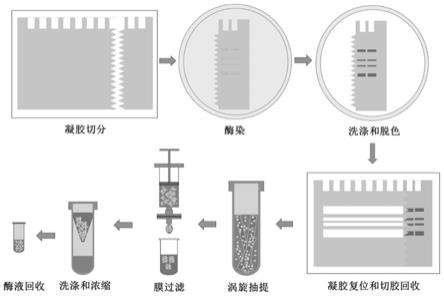
c)取出聚丙烯酰胺凝胶板,洗去电泳液,将所述聚丙烯酰胺凝胶板一侧的玻璃板剥离;将所述聚丙烯酰胺凝胶最左侧或最右侧的两孔胶由上到下按“z”或“s”形缓慢切分并从玻璃板上剥离;然后将剥离的两孔胶进行酶染,将酶染后的两孔胶洗涤并脱色,将脱色后的两孔胶重新对接到聚丙烯酰胺凝胶板上,以两孔胶中酶条带的位置为参照,将未酶染的聚丙烯酰胺凝胶板中同一位置的凝胶进行切割回收,即得含蓝莓果儿茶酚氧化酶的胶条;
[0025]
d)将所述蓝莓果儿茶酚氧化酶胶条碾碎,加水涡旋震荡,离心过滤取滤液,即得蓝莓果儿茶酚氧化酶酶液;
[0026]
优选的,所述的非变性电泳纯化处理在0~4℃的温度下进行;
[0027]
更优选的,所述步骤d)重复3~6次。
[0028]
优选的,所述酶染采用的酶染液的为:浓度1~3%的邻苯二酚与浓度0.4~0.8%对苯二胺按5:2~3:1的比例进行混合;
[0029]
优选的,所述脱色液为体积比为45~55:5:50~60的甲醇、乙酸和水。
[0030]
优选的,聚丙烯酰胺凝胶的配制为浓缩胶4%、分离胶6%,缓冲系统为hepes,所得制得的聚丙烯酰胺凝胶不含sds及其他变性或还原的物质。
[0031]
优选的,电泳液为hepes电泳缓冲液。
[0032]
进一步提出的,步骤1)所使用的硫酸铵分级沉淀是对蓝莓果儿茶酚氧化酶提取液的一种粗纯化,其目的就是为了除去大量的杂蛋白及其他杂质,尽可能的保留目标蛋白。
[0033]
所述步骤1)具体为:
[0034]
a)将硫酸铵缓慢加入到蓝莓果儿茶酚氧化酶提取液中,使其硫酸铵的饱和度为33~40%,然后静置10~15h,过滤,离心取上清液,获得粗酶液1;
[0035]
b)将粗酶液1中缓慢加入硫酸铵,使其硫酸铵的饱和度为70~90%,然后静置10~15h,离心留沉淀和漂浮物加水复溶,获得粗酶液。
[0036]
进一步提出的,所述步骤2)具体为:将所述粗酶液移入透析袋中,所述透析袋置于饱和度为30~50%的硫酸铵溶液中进行渗透压平衡;然后逐步更换更低饱和度的硫酸铵溶液直至硫酸铵饱和度为零;结束透析后,收集透析袋内混合物,获得酶液a;
[0037]
优选的,所述透析袋为即用型再生纤维素透析袋,分子截流量为12~14kda;
[0038]
更优选的,所述透析结束后,将透析袋放入装有peg-6000溶液的烧杯中,脱除透析袋内多余的水。
[0039]
进一步提出的,所述步骤3)中柱层析纯化具体为:将酶液a进行柱层析纯化,获得酶液b;
[0040]
a)离子交换层析:向经过tris-hcl缓冲液平衡的离子交换树脂柱中加入酶液a,静置,分别用含有0~1mol
·
l-1
nacl的tris-hcl缓冲液由低浓度向高浓度进行梯度洗脱,将有酶活性的洗脱液进行收集,用超滤离心管将收集的酶液进行浓缩,即得酶液a1;
[0041]
b)凝胶分子筛层析:将酶液a1加入经过tris-hcl缓冲液平衡的凝胶分子筛层析柱中,用tris-hcl缓冲液进行缓慢洗脱,收集具酶活性峰周围的洗脱液,用超滤离心管将洗脱液进行脱盐和浓缩处理,即得酶液b;
[0042]
优选的,所述离子交换树脂柱为edae-sepharose fast flow;和/或,所述凝胶分子筛层析柱为交联葡聚糖sephadex g-150。
[0043]
其中,优选本发明中使用的超滤离心管容积为15ml、分子截流量为10kda。
[0044]
其中,优选本发明的步骤在0~4℃的温度下进行。
[0045]
本发明的又一目的在于提供上述提取方法获得的蓝莓果儿茶酚氧化酶提取液;
[0046]
或者,上述提纯方法获得的蓝莓果中儿茶酚氧化酶酶液。
[0047]
本发明提供了一套系统完整的从蓝莓果中提取、纯化儿茶酚氧化酶的方法,由本发明提供的蓝莓果儿茶酚氧化酶的提取纯化方法可以获得三种电泳纯级别的儿茶酚氧化酶。能够准确地将几种分子量不同的儿茶酚氧化酶进行分离,最终获得纯度较高的酶。
附图说明
[0048]
图1为硫酸铵分级沉淀条件筛选图;
[0049]
图2是本发明所述的蓝莓果儿茶酚氧化酶的edae-sepharose fast flow阴离子交换层析洗脱曲线图;
[0050]
图3是本发明所述的蓝莓果儿茶酚氧化酶的sephadex g-150层析洗脱曲线;
[0051]
图4是本发明所述的聚丙烯酰胺凝胶中酶回收方法示意图;
[0052]
图5是本发明所述的聚丙烯酰胺凝胶中酶回收实际操作结果;
[0053]
图6是发明所述的蓝莓果儿茶酚氧化酶各个纯化阶段纯化产物的sds-page检测结果;
[0054]
其中,mw为标准蛋白,1为粗酶液,2为粗酶液硫酸铵分级沉淀产物,3为离子交换层
析产物,4为交联葡聚糖纯化产物;
[0055]
图7是本发明所述的蓝莓果儿茶酚氧化酶纯化后的native-page检测结果;
[0056]
其中,mw为标准蛋白,co-1、co-2、co-3是纯化出来的三种蓝莓果儿茶酚氧化酶;
[0057]
图8为本发明所述的蓝莓果儿茶酚氧化酶纯化后的sds-page检测结果;
[0058]
其中,mw为标准蛋白,co-1、co-2、co-3是纯化出来的三种蓝莓果儿茶酚氧化酶。
具体实施方式
[0059]
以下实施例用于说明本发明,但不用来限制本发明的范围。
[0060]
在酶的层析纯化过程中,蛋白浓度是由紫外分光光度计测定od
280
确定。
[0061]
利用蛋白bca试剂盒测定酶液单位体积中蛋白的含量,根据总体积计算出蛋白质总量。
[0062]
在酶的柱层析纯化过程中,酶活性的检测方法为,取10μl样品加入到200μl检测液中,在波长为410nm条件下监测吸光度的变化,每隔10s记录一次吸光度的变化,连续记录180s,读数间震荡。儿茶酚氧化酶活性的检测液由添加有邻苯二酚(0.02mol
·
l-1
)的柠檬酸-柠檬酸钠缓冲液(0.05mol
·
l-1
,ph=6.0)组成。
[0063]
一种蓝莓果中儿茶酚氧化酶的提取纯化的方法,包含以下步骤:
[0064]
(1)粗酶液的制备
[0065]
取冻藏的蓝莓果和添加有酚类螯合剂及曲和拉通x-100的柠檬酸-柠檬酸钠缓冲液匀浆5min,冰浴超声(40~60w)辅助提取5~10min,离心所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行;
[0066]
蓝莓冻果和添加有酚类螯合剂及曲拉通x-100的柠檬酸-柠檬酸钠缓冲液的料液比(g
·
ml-1
)为1:1~1:4,柠檬酸-柠檬酸钠缓冲液(0.05mol
·
l-1
)的ph为5.8~6.2,添加有酚类螯合剂及曲拉通x-100的柠檬酸-柠檬酸钠缓冲液中酚类螯合剂的添加量(g
·
ml-1
)为1~7%,曲拉通x-100的添加量为0~1.5%;
[0067]
(2)粗酶液的硫酸铵分级沉淀
[0068]
第一步,向粗酶液a中缓慢加入硫酸铵搅拌至其全部溶解,使得粗酶液a中硫酸铵的饱和度为33~40%,静置12h后用400目尼龙布过滤,滤液再经离心处理,整个过程在0~4℃下进行,离心后的上清液即为蓝莓果儿茶酚氧化酶粗酶液b;
[0069]
第二步,向粗酶液b中缓慢加入硫酸铵搅拌至其全部溶解,使得粗酶液b中硫酸铵的饱和度为70~90%,静置12h后离心,收集沉淀和褐色漂浮物,整个过程在0~4℃下进行,用双蒸水将收集的沉淀和褐色漂浮物溶解,即得蓝莓果儿茶酚氧化酶酶液c;
[0070]
(3)粗酶液的透析处理
[0071]
第一步,将酶液c移入再生纤维素透析袋中,用密封夹将透析袋密封,将密封好的透析袋放入饱和度为30~50%的硫酸铵溶液中进行渗透压平衡(防止透析袋涨破),适时逐步更换更低饱和度的硫酸铵溶液直至硫酸铵饱和度为零,吸出少量透析外液并加入bacl2溶液,若无沉淀则可结束透析,若有沉淀则用双蒸水继续透析,直至用bacl2溶液检测透析外液无沉淀,透析期间缓慢搅拌透析外液,透析结束后将透析袋放入装有peg-6000溶液的烧杯中,脱除透析袋内多余的水,将透析袋内的混合物进行收集,整个过程在0~4℃下进行,所得的溶液即为蓝莓果儿茶酚氧化酶酶液d;
[0072]
第二步,将酶液d移入离心管中进行离心处理,弃去沉淀将上清液用滤膜进行过滤,将滤液转移至截留分子量适宜的超滤离心管中,用ph为7.4~7.6的tris-hcl缓冲液洗去低分子量物质,超滤管中最终剩余的溶液即为蓝莓果儿茶酚氧化酶酶液e,整个过程在0~4℃下进行;
[0073]
(4)粗酶液的柱层析纯化
[0074]
离子交换层析:向经过tris-hcl缓冲液平衡的离子交换树脂柱中加入酶液e,
[0075]
静置,分别用含有0~1mol
·
l-1
nacl的tris-hcl缓冲液由低浓度向高浓度进行梯度洗脱,将有酶活性的洗脱液进行收集,用超滤离心管将收集的酶液进行浓缩,即得蓝莓果儿茶酚氧化酶酶液f;
[0076]
凝胶分子筛层析:将提取液f加入经过tris-hcl缓冲液(含有nacl)平衡的凝胶分子筛层析柱中,用tris-hcl缓冲液(含有nacl)进行缓慢洗脱,收集具酶活性峰周围的洗脱液,用超滤离心管将洗脱液(酶液)进行脱盐和浓缩处理,即得蓝莓果儿茶酚氧化酶酶液g;
[0077]
(5)酶液的非变性电泳纯化
[0078]
第一步,将酶液g与非变性非还原上样缓冲液按4:1的比例混合,即得蓝莓果儿茶酚氧化酶酶液h;将酶液g与甘油按1:1~3:1的比例进行混合,即得蓝莓果儿茶酚氧化酶酶液i;
[0079]
第二步,将酶液h加入到聚丙烯酰胺凝胶(不含sds)最左侧和最右侧的孔中;将酶液i依次加入到聚丙烯酰胺凝胶(不含sds)剩余的孔中;缓慢加入hepes电泳缓冲液进行电泳,当溴酚蓝到达聚丙烯酰胺凝胶底部时电泳结束;
[0080]
第三步,取出聚丙烯酰胺凝胶板并用双蒸水洗去电泳液,在装有双蒸水的托盘中将聚丙烯酰胺凝胶板一侧的玻璃板剥离,用刀片将聚丙烯酰胺凝胶最左侧或最右侧的两孔胶由上到下按“z”或“s”形缓慢切分并从玻璃板上剥离,将剥离的两孔胶进行酶染,出现酶条带后用双蒸水将其进行清洗并转移到脱色液中静置3~5min,将处理好的两孔胶重新对接到聚丙烯酰胺凝胶板上,以两孔胶中酶条带的位置为参照,将未酶染的聚丙烯酰胺凝胶板中同一位置的凝胶进行切割回收,即得蓝莓果儿茶酚氧化酶胶条j;
[0081]
第四步,将胶条j在离心管中碾碎,加入双蒸水涡旋,离心取上清液膜过滤,将沉淀再次加入双蒸水中涡旋抽提,再次离心取上清液膜过滤,反复抽提3-5次,将抽提液汇总用超滤离心管进行浓缩,即得纯化的蓝莓果儿茶酚氧化酶酶液k,整个过程在0~4℃下进行。
[0082]
酶活性的检测方法为,取10μl样品加入到200μl检测液中,在波长为410nm条件下监测吸光度的变化,每隔10s记录一次吸光度的变化,连续记录180s,读数间震荡。儿茶酚氧化酶活性的检测液由添加有邻苯二酚(0.02mol
·
l-1
)的柠檬酸-柠檬酸钠缓冲液(0.05mol
·
l-1
,ph=6.0)组成。一个儿茶酚氧化酶活力单位(u)定义为:在测定条件下,每毫升样品每分钟引起吸光值改变0.001所需的酶量,结果以umin-1-1
·
g-1
蓝莓果质量或蛋白质量表示。
[0083]
u=((od
410b-od
410a
)
×
v0)/(t
×
v
t
×
m)
[0084]
od
410a
:反应液吸光度初始值;
[0085]
od
410b
:反应液吸光度终止值;
[0086]
t:反应时间,min;
[0087]
v0:提取液总体积,ml;
[0088]
v
t
:测定时所用的酶液体积,ml;
[0089]
m:蓝莓果的质量或蛋白总质量,g;
[0090]
非变性电泳
[0091]
先将电泳槽放入冰浴箱中,把聚丙烯酰胺凝胶板(缓冲系统为hepes)固定在电泳槽中,在内槽和外槽中分别加入已预冷的hepes电泳缓冲液,将酶液h与酶液i分别加入到对应的孔中,每孔的上样量为20μl,电泳仪电压为100v,当溴酚蓝到达聚丙烯酰胺凝胶底部时电泳结束,整个电泳过程在黑暗条件下进行。
[0092]
如下实施例中,具体涉及的方法如下:
[0093]
1、native-page电泳检验方法:
[0094]
将纯化的酶液k与非变性非还原上样缓冲液混合后,加入到非变性聚丙烯酰胺凝胶(浓缩胶4%,分离胶6%)孔中,上样量为10μl,电泳仪电压为120v,电泳缓冲液为hepes,当溴酚蓝到达聚丙烯酰胺凝胶底部时电泳结束,缓慢取出聚丙烯酰胺凝胶并放入盛有考马斯亮蓝染液的槽中进行染色,将染色槽密封后置于37℃恒温振荡器中缓慢摇晃2h,倒出染液用双蒸水清洗聚丙烯酰胺凝胶后放入脱色液中进行脱色,定时更换脱色液直至聚丙烯酰胺凝胶大部分呈无色透明状。
[0095]
2、sds-page电泳检验方法:
[0096]
将纯化的酶液k与sds-page上样缓冲液混合后,置于沸水中处理5min,冷却至室温后依次加入到变性聚丙烯酰胺凝胶(浓缩胶4%,分离胶10%)孔中,上样量为10μl,电泳仪电压为120v,电泳缓冲液为tris-甘氨酸,当溴酚蓝到达聚丙烯酰胺凝胶底部时电泳结束,缓慢取出聚丙烯酰胺凝胶并放入盛有考马斯亮蓝染液的槽中进行染色,将染色槽密封后置于37℃恒温振荡器中缓慢摇晃2h,倒出染液用双蒸水清洗聚丙烯酰胺凝胶后放入脱色液中进行脱色,定时更换脱色液直至聚丙烯酰胺凝胶大部分呈无色透明状。
[0097]
实施例1
[0098]
本实施例提供一种蓝莓果中儿茶酚氧化酶的提取方法,具体如下:
[0099]
取无损伤,无病虫害,大小均一的蓝莓冻果40g,按料液比(g
·
ml-1
)为1:1,将其与预冷的柠檬酸-柠檬酸钠缓冲液40ml混合,缓冲液中含有1%的酚类螯合剂(g
·
ml-1
)且不含曲拉通x-100,匀浆5min,冰浴超声(40w)辅助提取5min,将混合液移入离心管中在6000
×
g,4℃条件下离心10min,所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行。
[0100]
实施例2
[0101]
本实施例提供一种蓝莓果中儿茶酚氧化酶的提取方法,具体如下:
[0102]
取无损伤,无病虫害,大小均一的蓝莓冻果40g,按料液比(g
·
ml-1
)为1:4,将其与预冷的柠檬酸-柠檬酸钠缓冲液160ml混合,缓冲液中含有5%的酚类螯合剂(g
·
ml-1
)及0.5%的曲拉通x-100,匀浆5min,冰浴超声(40w)辅助提取10min,将混合液移入离心管中在6000
×
g,4℃条件下离心10min,所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行。
[0103]
实施例3
[0104]
本实施例提供一种蓝莓果中儿茶酚氧化酶的提取方法,具体如下:
[0105]
取无损伤,无病虫害,大小均一的蓝莓冻果40g,按料液比(g
·
ml-1
)为1:2,将其与
预冷的柠檬酸-柠檬酸钠缓冲液80ml混合,缓冲液中含有7%的酚类螯合剂(g
·
ml-1
)及1%的曲拉通x-100,匀浆5min,冰浴超声(40w)辅助提取20min,将混合液移入离心管中在6000
×
g,4℃条件下离心10min,所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行。
[0106]
实施例4
[0107]
本实施例提供一种蓝莓果中儿茶酚氧化酶的提取方法,具体如下:
[0108]
取无损伤,无病虫害,大小均一的蓝莓冻果40g,按料液比(g
·
ml-1
)为1:3,将其与预冷的柠檬酸-柠檬酸钠缓冲液120ml混合,缓冲液中含有3%的酚类螯合剂(g
·
ml-1
)及1.5%的曲拉通x-100,匀浆5min,冰浴超声(40w)辅助提取30min,将混合液移入离心管中在6000
×
g,4℃条件下离心10min,所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行。
[0109]
实施例5
[0110]
本实施例提供一种蓝莓果中儿茶酚氧化酶的提取方法,具体如下:
[0111]
取无损伤,无病虫害,大小均一的蓝莓冻果40g,按料液比(g
·
ml-1
)为1:3,将其与预冷的柠檬酸-柠檬酸钠缓冲液120ml混合,缓冲液中含有7%的酚类螯合剂(g
·
ml-1
)及0.5%的曲拉通x-100,匀浆5min,冰浴超声(60w)辅助提取5min,将混合液移入离心管中在6000
×
g,4℃条件下离心10min,所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行。
[0112]
实施例6
[0113]
本实施例提供一种蓝莓果中儿茶酚氧化酶的提取方法,具体如下:
[0114]
取无损伤,无病虫害,大小均一的蓝莓冻果40g,按料液比(g
·
ml-1
)为1:2,将其与预冷的柠檬酸-柠檬酸钠缓冲液80ml混合,缓冲液中含有3%的酚类螯合剂(g
·
ml-1
)且不含曲拉通x-100,匀浆5min,冰浴超声(60w)辅助提取10min,将混合液移入离心管中在6000
×
g,4℃条件下离心10min,所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行。
[0115]
实施例7
[0116]
本实施例提供一种蓝莓果中儿茶酚氧化酶的提取方法,具体如下:
[0117]
取无损伤,无病虫害,大小均一的蓝莓冻果40g,按料液比(g
·
ml-1
为1:4,将其与预冷的柠檬酸-柠檬酸钠缓冲液160ml混合,缓冲液中含有1%的酚类螯合剂(g
·
ml-1
)及1.5%的曲拉通x-100,匀浆5min,冰浴超声(60w)辅助提取20min,将混合液移入离心管中在6000
×
g,4℃条件下离心10min,所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行。
[0118]
实施例8
[0119]
本实施例提供一种蓝莓果中儿茶酚氧化酶的提取方法,具体如下:
[0120]
取无损伤,无病虫害,大小均一的蓝莓冻果40g,按料液比(g
·
ml-1
)为1:1,将其与预冷的柠檬酸-柠檬酸钠缓冲液40ml混合,缓冲液中含有5%的酚类螯合剂(g
·
ml-1
)及1%的曲拉通x-100,匀浆5min,冰浴超声(60w)辅助提取30min,将混合液移入离心管中在6000
×
g,4℃条件下离心10min,所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行。
[0121]
实施例9
[0122]
本实施例提供一种蓝莓果中儿茶酚氧化酶的提取方法,具体如下:
[0123]
取无损伤,无病虫害,大小均一的蓝莓冻果40g,按料液比(g
·
ml-1
)为1:4,将其与预冷的柠檬酸-柠檬酸钠缓冲液160ml混合,缓冲液中含有3%的酚类螯合剂(g
·
ml-1
)及1%的曲拉通x-100,匀浆5min,冰浴超声(80w)辅助提取5min,将混合液移入离心管中在6000
×
g,4℃条件下离心10min,所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行。
[0124]
实施例10
[0125]
本实施例提供一种蓝莓果中儿茶酚氧化酶的提取方法,具体如下:
[0126]
取无损伤,无病虫害,大小均一的蓝莓冻果40g,按料液比(g
·
ml-1
)为1:1,将其与预冷的柠檬酸-柠檬酸钠缓冲液40ml混合,缓冲液中含有7%的酚类螯合剂(g
·
ml-1
)及1.5%的曲拉通x-100,匀浆5min,冰浴超声(80w)辅助提取10min,将混合液移入离心管中在6000
×
g,4℃条件下离心10min,所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行。
[0127]
实施例11
[0128]
本实施例提供一种蓝莓果中儿茶酚氧化酶的提取方法,具体如下:
[0129]
取无损伤,无病虫害,大小均一的蓝莓冻果40g,按料液比(g
·
ml-1
)为1:3,将其与预冷的柠檬酸-柠檬酸钠缓冲液120ml混合,缓冲液中含有5%的酚类螯合剂(g
·
ml-1
)且不含曲拉通x-100,匀浆5min,冰浴超声(80w)辅助提取20min,将混合液移入离心管中在6000
×
g,4℃条件下离心10min,所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行。
[0130]
实施例12
[0131]
本实施例提供一种蓝莓果中儿茶酚氧化酶的提取方法,具体如下:
[0132]
取无损伤,无病虫害,大小均一的蓝莓冻果40g,按料液比(g
·
ml-1
)为1:2,将其与预冷的柠檬酸-柠檬酸钠缓冲液80ml混合,缓冲液中含有1%的酚类螯合剂(g
·
ml-1
)及0.5%的曲拉通x-100,匀浆5min,冰浴超声(80w)辅助提取30min,将混合液移入离心管中在6000
×
g,4℃条件下离心10min,所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行。
[0133]
实施例13
[0134]
本实施例提供一种蓝莓果中儿茶酚氧化酶的提取方法,具体如下:
[0135]
取无损伤,无病虫害,大小均一的蓝莓冻果40g,按料液比(g
·
ml-1
)为1:2,将其与预冷的柠檬酸-柠檬酸钠缓冲液80ml混合,缓冲液中含有5%的酚类螯合剂(g
·
ml-1
)及1.5%的曲拉通x-100,匀浆5min,冰浴超声(100w)辅助提取5min,将混合液移入离心管中在6000
×
g,4℃条件下离心10min,所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行。
[0136]
实施例14
[0137]
本实施例提供一种蓝莓果中儿茶酚氧化酶的提取方法,具体如下:
[0138]
取无损伤,无病虫害,大小均一的蓝莓冻果40g,按料液比(g
·
ml-1
)为1:3,将其与预冷的柠檬酸-柠檬酸钠缓冲液120ml混合,缓冲液中含有1%的酚类螯合剂(g
·
ml-1
)及1%
的曲拉通x-100,匀浆5min,冰浴超声(100w)辅助提取10min,将混合液移入离心管中在6000
×
g,4℃条件下离心10min,所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行。
[0139]
实施例15
[0140]
本实施例提供一种蓝莓果中儿茶酚氧化酶的提取方法,具体如下:
[0141]
取无损伤,无病虫害,大小均一的蓝莓冻果40g,按料液比(g
·
ml-1
)为1:1,将其与预冷的柠檬酸-柠檬酸钠缓冲液40ml混合,缓冲液中含有3%的酚类螯合剂(g
·
ml-1
)及0.5%的曲拉通x-100,匀浆5min,冰浴超声(100w)辅助提取20min,将混合液移入离心管中在6000
×
g,4℃条件下离心10min,所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行。
[0142]
实施例16
[0143]
本实施例提供一种蓝莓果中儿茶酚氧化酶的提取方法,具体如下:
[0144]
取无损伤,无病虫害,大小均一的蓝莓冻果40g,按料液比(g
·
ml-1
)为1:4,将其与预冷的柠檬酸-柠檬酸钠缓冲液160ml混合,缓冲液中含有7%的酚类螯合剂(g
·
ml-1
)且不含曲拉通x-100,匀浆5min,冰浴超声(100w)辅助提取20min,将混合液移入离心管中在6000
×
g,4℃条件下离心10min,所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行。
[0145]
表1蓝莓果儿茶酚氧化酶粗酶液提取方案及结果
[0146][0147]
表1为实施1~16所述提取方法获得的结果;由上表可知,料液比、超声功率、时间以及螯合剂的用量等因素都会影响提取的效果。当料液比为1:3~4,超声功率为40~60w,超声时间为5~10min,酚类螯合剂的用量为1~3%时,提取的效果显著。
[0148]
实施例17
[0149]
本实施例提供一种蓝莓果中儿茶酚氧化酶的纯化方法,具体如下:
[0150]
1)蓝莓果中儿茶酚氧化酶粗酶液的提取
[0151]
取无损伤,无病虫害,大小均一的蓝莓冻果200g,按料液比(g
·
ml-1
)为1:2,将其与预冷的柠檬酸-柠檬酸钠缓冲液400ml混合,缓冲液中含有6%的酚类螯合剂(g
·
ml-1
)及1%的曲拉通x-100,匀浆5min,冰浴超声(60w)辅助提取10min,将混合液移入离心管中在6000
×
g,4℃条件下离心10min,所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行。
[0152]
2)粗酶液的硫酸铵分级沉淀
[0153]
①
向541ml粗酶液a中缓慢加入30.29g硫酸铵搅拌至其全部溶解,使得粗酶液a中硫酸铵的饱和度为10%,在10000
×
g,静置6h,4℃条件下离心10min,离心后的上清液即为蓝莓果儿茶酚氧化酶粗酶液a1,沉淀加双蒸水定容至100ml,即为粗酶液a
1+
;
[0154]
②
向554ml粗酶液a1中加入31.57g硫酸铵搅拌至其全部溶解,使得粗酶液a1中硫酸
铵的饱和度为20%,在10000
×
g,静置6h,4℃条件下离心10min,离心后的上清液即为蓝莓果儿茶酚氧化酶粗酶液a2,沉淀加双蒸水定容至50ml,即为粗酶液a
2+
;
[0155]
③
向547ml粗酶液a2中加入32.27g硫酸铵搅拌至其全部溶解,使得粗酶液a2中硫酸铵的饱和度为30%,在10000
×
g,静置6h,4℃条件下离心10min,离心后的上清液即为蓝莓果儿茶酚氧化酶粗酶液a3,沉淀加双蒸水定容至50ml,即为粗酶液a
3+
;
[0156]
④
向551ml粗酶液a3中加入34.16g硫酸铵搅拌至其全部溶解,使得粗酶液a3中硫酸铵的饱和度为40%,在10000
×
g,静置6h,4℃条件下离心10min,离心后的上清液即为蓝莓果儿茶酚氧化酶粗酶液a4,沉淀加双蒸水定容至50ml,即为粗酶液a
4+
;
[0157]
⑤
向563ml粗酶液a4中加入35.46g硫酸铵搅拌至其全部溶解,使得粗酶液a4中硫酸铵的饱和度为50%,在10000
×
g,静置6h,4℃条件下离心10min,离心后的上清液即为蓝莓果儿茶酚氧化酶粗酶液a5,沉淀加双蒸水定容至25ml,即为粗酶液a
5+
;
[0158]
⑥
向574ml粗酶液a5中加入37.88g硫酸铵搅拌至其全部溶解,使得粗酶液a5中硫酸铵的饱和度为60%,在10000
×
g,静置6h,4℃条件下离心10min,离心后的上清液即为蓝莓果儿茶酚氧化酶粗酶液a6,沉淀加双蒸水定容至10ml,即为粗酶液a
6+
;
[0159]
⑦
向583ml粗酶液a6中加入40.22g硫酸铵搅拌至其全部溶解,使得粗酶液a6中硫酸铵的饱和度为70%,在10000
×
g,静置6h,4℃条件下离心10min,离心后的上清液即为蓝莓果儿茶酚氧化酶粗酶液a7,沉淀加双蒸水定容至10ml,即为粗酶液a
7+
;
[0160]
⑧
向597ml粗酶液a7中加入42.98g硫酸铵搅拌至其全部溶解,使得粗酶液a7中硫酸铵的饱和度为80%,在10000
×
g,静置6h,4℃条件下离心10min,离心后的上清液即为蓝莓果儿茶酚氧化酶粗酶液a8,沉淀加双蒸水定容至10ml,即为粗酶液a
8+
;
[0161]
⑨
向611ml粗酶液a8中加入47.04g硫酸铵搅拌至其全部溶解,使得粗酶液a8中硫酸铵的饱和度为90%,在10000
×
g,静置6h,4℃条件下离心10min,离心后的上清液即为蓝莓果儿茶酚氧化酶粗酶液a9,沉淀加双蒸水定容至10ml,即为粗酶液a
9+
;
[0162]
⑩
向625ml粗酶液a9中加49.37g硫酸铵搅拌至其全部溶解,使得粗酶液a9中硫酸铵的饱和度为100%,在10000
×
g,静置6h,4℃条件下离心10min,离心后的上清液即为蓝莓果儿茶酚氧化酶粗酶液a9,沉淀加双蒸水定容至10ml,即为粗酶液a
10+
;
[0163]
分别对酶液a0~a
10
以及a
1+
~a
10+
中儿茶酚氧化酶的活性进行测定,测定结果见图1。
[0164]
实施例18
[0165]
本实施例提供一种蓝莓果中儿茶酚氧化酶的纯化方法,具体如下:
[0166]
(1)蓝莓果中儿茶酚氧化酶粗酶液的提取
[0167]
取无损伤,无病虫害,大小均一的蓝莓冻果600g,按料液比(g
·
ml-1
)为4:7,将其与预冷的柠檬酸-柠檬酸钠缓冲液1050ml混合,缓冲液中含有6%的酚类螯合剂(g
·
ml-1
)及1%的曲拉通x-100,匀浆5min,冰浴超声(60w)辅助提取10min,将混合液移入离心管中在6000
×
g,4℃条件下离心10min,所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行。
[0168]
(2)粗酶液的硫酸铵分级沉淀
[0169]
第一步,向1475ml粗酶液a中缓慢加入352.35g硫酸铵搅拌至其全部溶解,使得粗酶液a中硫酸铵的饱和度为40%,静置12h后用400目尼龙布过滤,滤液再经离心处理,整个
过程在0~4℃下进行,离心后的上清液即为蓝莓果儿茶酚氧化酶粗酶液b;
[0170]
第二步,向1495ml粗酶液b中缓慢加入560.62g硫酸铵搅拌至其全部溶解,使得粗酶液b中硫酸铵的饱和度为90%,在4℃条件下静置12h,在4℃条件下离心(11,000
×
g)20min,移除上清液,收集沉淀和褐色漂浮物,整个过程在0~4℃下进行,用双蒸水将收集的沉淀和褐色漂浮物溶解,即得蓝莓果儿茶酚氧化酶酶液c;
[0171]
(3)粗酶液的透析处理
[0172]
第一步,将酶液c移入再生纤维素透析袋中,装载量不超过透析袋总体积的1/2,排除顶部的空气用密封夹将透析袋密封,将密封好的透析袋放入饱和度为40%的硫酸铵溶液中进行渗透压平衡,以防止透析袋涨破,适时逐步更换更低饱和度的硫酸铵溶液直至硫酸铵饱和度为零,吸出10ml透析外液并与等体积5%的bacl2溶液(g
·
ml-1
),若无沉淀则可结束透析,若有沉淀则用双蒸水继续透析,直至用bacl2溶液检测透析外液无沉淀,透析期间缓慢搅拌透析外液,透析结束后将透析袋放入装有30%peg-6000溶液(g
·
ml-1
)的烧杯中浓缩,将透析袋内的混合物进行收集,整个过程在0~4℃下进行,所得的溶液即为蓝莓果儿茶酚氧化酶酶液d;
[0173]
第二步,将酶液d移入离心管中,在6000
×
g条件下离心处理10min,弃去沉淀将上清液用0.45μm的滤膜进行过滤,将滤液转移至截留分子量为10kda的超滤离心管中,用ph为7.4的tris-hcl(0.05mol
·
l-1
)缓冲液洗去低分子量物质,超滤管中最终剩余的溶液即为蓝莓果儿茶酚氧化酶酶液e,整个过程在0~4℃下进行;
[0174]
(4)粗酶液的柱层析纯化
[0175]
①
edae-sepharose fast flow阴离子交换层析
[0176]
平衡:用ph为7.4的tris-hcl缓冲液(0.05mol
·
l-1
)平衡edae-sepharose fast flow阴离子交换柱,当层析柱下端的流出液与缓冲液的ph一致时平衡结束。
[0177]
向平衡后的离子交换树脂柱中加入酶液e,打开层析柱的下端阀门放出部分缓冲液,使得酶液e与离子交换树脂充分接触,静置15min,分别用含有0.00、0.04、0.06、0.08、0.10、0.15、0.20、0.30、0.40、0.50以及1.00mol
·
l-1
nacl的tris-hcl缓冲液由低浓度向高浓度进行梯度洗脱,控制洗脱速度每分钟收集洗脱液1ml,将有酶活性的洗脱液进行收集,用分子截留量为10kda的超滤离心管将收集的酶液进行浓缩,即得蓝莓果儿茶酚氧化酶酶液f;
[0178]
②
交联葡聚糖sephadex g-150层析
[0179]
平衡:用含有0.1mol
·
l-1
nacl的tris-hcl缓冲液(0.05mol
·
l-1
;ph=7.4)对交联葡聚糖sephadex g-150层析柱进行平衡,当层析柱下端的流出液与缓冲液的ph一致时平衡结束。
[0180]
将酶液f加入平衡后的交联葡聚糖sephadex g-150层析柱中,继续用含有0.1mol
·
l-1
nacl的tris-hcl缓冲液(0.05mol
·
l-1
;ph=7.4)对交联葡聚糖sephadex g-150层析柱进行洗脱,控制洗脱速度每分钟收集洗脱液1ml,收集具酶活性峰周围的洗脱液,用分子截留量为10kda的超滤离心管将收集的酶液进行浓缩,将浓缩后的酶液中加入双蒸水进行脱盐处理,即得蓝莓果儿茶酚氧化酶酶液g;
[0181]
(5)酶液的非变性电泳纯化
[0182]
第一步,取40μl酶液g与非变性非还原上样缓冲液按4:1的比例混合,即得蓝莓果
儿茶酚氧化酶酶液h;将剩余的酶液g与甘油按2:1的比例进行混合,即得蓝莓果儿茶酚氧化酶酶液i;
[0183]
第二步,先将电泳槽放入冰浴箱中,把聚丙烯酰胺凝胶板(缓冲系统为hepes,不含sds)固定在电泳槽中,在内槽和外槽中分别加入已预冷的hepes电泳缓冲液,将分别取20μl酶液h加入到聚丙烯酰胺凝胶最左侧和最右侧的孔中,将酶液i分别加入到剩余的孔中,每孔的上样量为20μl,电泳仪电压为100v,当溴酚蓝到达聚丙烯酰胺凝胶底部时电泳结束,整个电泳过程在黑暗条件下进行。
[0184]
第三步,取出聚丙烯酰胺凝胶板并用双蒸水洗去电泳液,在装有双蒸水的托盘中将聚丙烯酰胺凝胶板一侧的玻璃板剥离,用刀片将聚丙烯酰胺凝胶最左侧或最右侧的两孔胶由上到下按“z”或“s”形缓慢切分并从玻璃板上剥离,将剥离的两孔胶进行酶染,出现酶条带后用双蒸水将其进行清洗并转移到脱色液中静置3~5min,将处理好的两孔胶重新对接到聚丙烯酰胺凝胶板上,以两孔胶中酶条带的位置为参照,将未酶染的聚丙烯酰胺凝胶板中同一位置的凝胶进行切割回收,即得蓝莓果儿茶酚氧化酶胶条j;
[0185]
第四步,将胶条j在离心管中碾碎,加入双蒸水涡旋,离心取上清液膜过滤,将沉淀再次加入双蒸水中涡旋抽提,再次离心取上清液用0.45μm膜过滤,反复抽提3-5次,将抽提液汇总用超滤离心管进行浓缩,即得纯化的蓝莓果儿茶酚氧化酶酶液k,整个过程在0~4℃下进行;
[0186]
实施例19
[0187]
本实施例提供一种蓝莓果中儿茶酚氧化酶的纯化方法,具体如下:
[0188]
(1)蓝莓果中儿茶酚氧化酶粗酶液的提取
[0189]
取无损伤,无病虫害,大小均一的蓝莓冻果600g,按料液比(g
·
ml-1
)为1:2,将其与预冷的柠檬酸-柠檬酸钠缓冲液1200ml混合,缓冲液中含有5%的酚类螯合剂(g
·
ml-1
)及1.5%的曲拉通x-100,匀浆5min,冰浴超声(60w)辅助提取10min,将混合液移入离心管中在6000
×
g,4℃条件下离心10min,所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行。
[0190]
(2)粗酶液的硫酸铵分级沉淀
[0191]
第一步,向1632ml粗酶液a中缓慢加入341.08g硫酸铵搅拌至其全部溶解,使得粗酶液a中硫酸铵的饱和度为35%,静置12h后用400目尼龙布过滤,滤液再经离心处理,整个过程在0~4℃下进行,离心后的上清液即为蓝莓果儿茶酚氧化酶粗酶液b;
[0192]
第二步,向1657ml粗酶液b中加缓慢加入394.36g硫酸铵搅拌至其全部溶解,使得粗酶液b中硫酸铵的饱和度为70%,在4℃条件下静置12h,在4℃条件下离心(11,000
×
g)20min,移除上清液,收集沉淀和褐色漂浮物,整个过程在0~4℃下进行,用双蒸水将收集的沉淀和褐色漂浮物溶解,即得蓝莓果儿茶酚氧化酶酶液c;
[0193]
(3)粗酶液的透析处理
[0194]
第一步,将酶液c移入再生纤维素透析袋中,装载量不超过透析袋总体积的1/2,排除顶部的空气用密封夹将透析袋密封,将密封好的透析袋放入饱和度为40%的硫酸铵溶液中进行渗透压平衡,以防止透析袋涨破,适时逐步更换更低饱和度的硫酸铵溶液直至硫酸铵饱和度为零,吸出10ml透析外液并与等体积5%的bacl2溶液(g
·
ml-1
),若无沉淀则可结束透析,若有沉淀则用双蒸水继续透析,直至用bacl2溶液检测透析外液无沉淀,透析期间
缓慢搅拌透析外液,透析结束后将透析袋放入装有35%peg-6000溶液(g
·
ml-1
)的烧杯中浓缩,将透析袋内的混合物进行收集,整个过程在0~4℃下进行,所得的溶液即为蓝莓果儿茶酚氧化酶酶液d;
[0195]
第二步,将酶液d移入离心管中,在6000
×
g条件下离心处理10min,弃去沉淀将上清液用0.45μm的滤膜进行过滤,将滤液转移至截留分子量为10kda的超滤离心管中,用ph为7.6的tris-hcl(0.05mol
·
l-1
)缓冲液洗去低分子量物质,超滤管中最终剩余的溶液即为蓝莓果儿茶酚氧化酶酶液e,整个过程在0~4℃下进行;
[0196]
(4)粗酶液的柱层析纯化
[0197]
①
edae-sepharose fast flow阴离子交换层析
[0198]
平衡:用ph为7.6的tris-hcl缓冲液(0.05mol
·
l-1
)平衡edae-sepharose fast flow阴离子交换柱,当层析柱下端的流出液与缓冲液的ph一致时平衡结束。
[0199]
向平衡后的离子交换树脂柱中加入酶液e,打开层析柱的下端阀门放出部分缓冲液,使得酶液e与离子交换树脂充分接触,静置15min,分别用含有0.00、0.04、0.06、0.08、0.10、0.15、0.20、0.30、0.40、0.50以及1.00mol
·
l-1
nacl的tris-hcl缓冲液由低浓度向高浓度进行梯度洗脱,控制洗脱速度每分钟收集洗脱液1ml,将有酶活性的洗脱液进行收集,用分子截留量为10kda的超滤离心管将收集的酶液进行浓缩,即得蓝莓果儿茶酚氧化酶酶液f;
[0200]
②
交联葡聚糖sephadex g-150层析
[0201]
平衡:用含有0.1mol
·
l-1
nacl的tris-hcl缓冲液(0.05mol
·
l-1
;ph=7.6)对交联葡聚糖sephadex g-150层析柱进行平衡,当层析柱下端的流出液与缓冲液的ph一致时平衡结束。
[0202]
将酶液f加入平衡后的交联葡聚糖sephadex g-150层析柱中,继续用含有0.1mol
·
l-1
nacl的tris-hcl缓冲液(0.05mol
·
l-1
;ph=7.6)对交联葡聚糖sephadex g-150层析柱进行洗脱,控制洗脱速度每分钟收集洗脱液1ml,收集具酶活性峰周围的洗脱液,用分子截留量为10kda的超滤离心管将收集的酶液进行浓缩,将浓缩后的酶液中加入双蒸水进行脱盐处理,即得蓝莓果儿茶酚氧化酶酶液g;
[0203]
(5)酶液的非变性电泳纯化
[0204]
第一步,取30μl酶液g与非变性非还原上样缓冲液按4:1的比例混合,即得蓝莓果儿茶酚氧化酶酶液h;将剩余的酶液g与甘油按2:1的比例进行混合,即得蓝莓果儿茶酚氧化酶酶液i;
[0205]
第二步,先将电泳槽放入冰浴箱中,把聚丙烯酰胺凝胶板(缓冲系统为hepes,不含sds)固定在电泳槽中,在内槽和外槽中分别加入已预冷的hepes电泳缓冲液,将分别取15μl酶液h加入到聚丙烯酰胺凝胶最左侧和最右侧的孔中,将酶液i分别加入到剩余的孔中,每孔的上样量为15μl,电泳仪电压为90v,当溴酚蓝到达聚丙烯酰胺凝胶底部时电泳结束,整个电泳过程在黑暗条件下进行。
[0206]
第三步,取出聚丙烯酰胺凝胶板并用双蒸水洗去电泳液,在装有双蒸水的托盘中将聚丙烯酰胺凝胶板一侧的玻璃板剥离,用刀片将聚丙烯酰胺凝胶最左侧或最右侧的两孔胶由上到下按“z”或“s”形缓慢切分并从玻璃板上剥离,将剥离的两孔胶进行酶染,出现酶条带后用双蒸水将其进行清洗并转移到脱色液中静置3~5min,将处理好的两孔胶重新对
接到聚丙烯酰胺凝胶板上,以两孔胶中酶条带的位置为参照,将未酶染的聚丙烯酰胺凝胶板中同一位置的凝胶进行切割回收,即得蓝莓果儿茶酚氧化酶胶条j;
[0207]
第四步,将胶条j在离心管中碾碎,加入双蒸水涡旋,离心取上清液膜过滤,将沉淀再次加入双蒸水中涡旋抽提,再次离心取上清液用0.45μm膜过滤,反复抽提3-5次,将抽提液汇总用超滤离心管进行浓缩,即得纯化的蓝莓果儿茶酚氧化酶酶液k,整个过程在0~4℃下进行;
[0208]
实施例20
[0209]
本实施例提供一种蓝莓果中儿茶酚氧化酶的纯化方法,具体如下:
[0210]
取无损伤,无病虫害,大小均一的蓝莓冻果600g,按料液比(g
·
ml-1
)为1:3,将其与预冷的柠檬酸-柠檬酸钠缓冲液1800ml混合,缓冲液中含有3%的酚类螯合剂(g
·
ml-1
)及1%的曲拉通x-100,匀浆5min,冰浴超声(60w)辅助提取10min,将混合液移入离心管中在6000
×
g,4℃条件下离心10min,所得上清液即为蓝莓果儿茶酚氧化酶粗酶液a,制备过程在0~4℃下进行。
[0211]
(2)粗酶液的硫酸铵分级沉淀
[0212]
第一步,向2226ml粗酶液a中缓慢加入436.29g硫酸铵搅拌至其全部溶解,使得粗酶液a中硫酸铵的饱和度为33%,静置12h后用400目尼龙布过滤,滤液再经离心处理,整个过程在0~4℃下进行,离心后的上清液即为蓝莓果儿茶酚氧化酶粗酶液b;
[0213]
第二步,向2250ml粗酶液b中缓慢加入657g硫酸铵搅拌至其全部溶解,使得粗酶液b中硫酸铵的饱和度为75%,在4℃条件下静置12h,在4℃条件下离心(11,000
×
g)20min,移除上清液,收集沉淀和褐色漂浮物,整个过程在0~4℃下进行,用双蒸水将收集的沉淀和褐色漂浮物溶解,即得蓝莓果儿茶酚氧化酶酶液c;
[0214]
(3)粗酶液的透析处理
[0215]
第一步,将酶液c移入再生纤维素透析袋中,装载量不超过透析袋总体积的1/2,排除顶部的空气用密封夹将透析袋密封,将密封好的透析袋放入饱和度为40%的硫酸铵溶液中进行渗透压平衡,以防止透析袋涨破,适时逐步更换更低饱和度的硫酸铵溶液直至硫酸铵饱和度为零,吸出10ml透析外液并与等体积5%的bacl2溶液(g
·
ml-1
),若无沉淀则可结束透析,若有沉淀则用双蒸水继续透析,直至用bacl2溶液检测透析外液无沉淀,透析期间缓慢搅拌透析外液,透析结束后将透析袋放入装有40%peg-6000溶液(g
·
ml-1
)的烧杯中浓缩,将透析袋内的混合物进行收集,整个过程在0~4℃下进行,所得的溶液即为蓝莓果儿茶酚氧化酶酶液d;
[0216]
第二步,将酶液d移入离心管中,在6000
×
g条件下离心处理10min,弃去沉淀将上清液用0.45μm的滤膜进行过滤,将滤液转移至截留分子量为10kda的超滤离心管中,用ph为7.5的tris-hcl(0.05mol
·
l-1
)缓冲液洗去低分子量物质,超滤管中最终剩余的溶液即为蓝莓果儿茶酚氧化酶酶液e,整个过程在0~4℃下进行;
[0217]
(4)粗酶液的柱层析纯化
[0218]
①
edae-sepharose fast flow阴离子交换层析
[0219]
平衡:用ph为7.5的tris-hcl缓冲液(0.05mol
·
l-1
)平衡edae-sepharose fast flow阴离子交换柱,当层析柱下端的流出液与缓冲液的ph一致时平衡结束。
[0220]
向平衡后的离子交换树脂柱中加入酶液e,打开层析柱的下端阀门放出部分缓冲
液,使得酶液e与离子交换树脂充分接触,静置15min,分别用含有0.00、0.04、0.06、0.08、0.10、0.15、0.20、0.30、0.40、0.50以及1.00mol
·
l-1
nacl的tris-hcl缓冲液由低浓度向高浓度进行梯度洗脱,控制洗脱速度每分钟收集洗脱液1ml,将有酶活性的洗脱液进行收集,用分子截留量为10kda的超滤离心管将收集的酶液进行浓缩,即得蓝莓果儿茶酚氧化酶酶液f;
[0221]
②
交联葡聚糖sephadex g-150层析
[0222]
平衡:用含有0.1mol
·
l-1
nacl的tris-hcl缓冲液(0.05mol
·
l-1
;ph=7.5)对交联葡聚糖sephadex g-150层析柱进行平衡,当层析柱下端的流出液与缓冲液的ph一致时平衡结束。
[0223]
将酶液f加入平衡后的交联葡聚糖g-150层析柱中,继续用含有0.1mol
·
l-1
nacl的tris-hcl缓冲液(0.05mol
·
l-1
;ph=7.5)对交联葡聚糖sephadex g-150层析柱进行洗脱,控制洗脱速度每分钟收集洗脱液1ml,收集具酶活性峰周围的洗脱液,用分子截留量为10kda的超滤离心管将收集的酶液进行浓缩,将浓缩后的酶液中加入双蒸水进行脱盐处理,即得蓝莓果儿茶酚氧化酶酶液g;
[0224]
(5)酶液的非变性电泳纯化
[0225]
第一步,取20μl酶液g与非变性非还原上样缓冲液按4:1的比例混合,即得蓝莓果儿茶酚氧化酶酶液h;将剩余的酶液g与甘油按2:1的比例进行混合,即得蓝莓果儿茶酚氧化酶酶液i;
[0226]
第二步,先将电泳槽放入冰浴箱中,把聚丙烯酰胺凝胶板(缓冲系统为hepes,不含sds)固定在电泳槽中,在内槽和外槽中分别加入已预冷的hepes电泳缓冲液,将分别取10μl酶液h加入到聚丙烯酰胺凝胶最左侧和最右侧的孔中,将酶液i分别加入到剩余的孔中,每孔的上样量为10μl,电泳仪电压为80v,当溴酚蓝到达聚丙烯酰胺凝胶底部时电泳结束,整个电泳过程在黑暗条件下进行。
[0227]
第三步,取出聚丙烯酰胺凝胶板并用双蒸水洗去电泳液,在装有双蒸水的托盘中将聚丙烯酰胺凝胶板一侧的玻璃板剥离,用刀片将聚丙烯酰胺凝胶最左侧或最右侧的两孔胶由上到下按“z”或“s”形缓慢切分并从玻璃板上剥离,将剥离的两孔胶进行酶染,出现酶条带后用双蒸水将其进行清洗并转移到脱色液中静置3~5min,将处理好的两孔胶重新对接到聚丙烯酰胺凝胶板上,以两孔胶中酶条带的位置为参照,将未酶染的聚丙烯酰胺凝胶板中同一位置的凝胶进行切割回收,即得蓝莓果儿茶酚氧化酶胶条j;
[0228]
第四步,将胶条j在离心管中碾碎,加入双蒸水涡旋,离心取上清液膜过滤,将沉淀再次加入双蒸水中涡旋抽提,再次离心取上清液用0.45μm膜过滤,反复抽提3-5次,将抽提液汇总用超滤离心管进行浓缩,即得纯化的蓝莓果儿茶酚氧化酶酶液k,整个过程在0~4℃下进行;
[0229]
经过实验可知,在edae-sepharose fast flow阴离子交换层析过程中会出现多个酶活性峰,面积最大的洗脱峰出现在nacl为0.06、0.08mol
·
l-1
的条件下,因此实验中将这个两个条件下洗脱的蛋白进行收集。
[0230]
对实施例18中提取、纯化各个步骤所得的酶提取液进行sds-page检测发现(图6),各个步骤的纯化效果十分显著,杂蛋白逐渐减少,目标蛋白条带逐渐清晰。
[0231]
对实施例19中提取、纯化步骤所得的酶提取液进行酶活力u、比活力u/mg计算,结
果如表2所示,表明经过纯化后的酶液的比活力显著提高。
[0232]
将实施例19-20所得到的酶提取液k分别用native-page及sds-page电泳检测,如图7、8所示条带清晰,sds-page电泳检测中2(co-2)、3(co-3)都只有一个蛋白条带,1(co-1)有两个条带,说明本发明提取纯化的蓝莓果儿茶酚氧化酶纯度较高。
[0233]
表2蓝莓果儿茶酚氧化酶分离纯化结果
[0234][0235]
虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1