一种严格厌氧菌来源的菌果聚糖合成酶的制作方法
[0001]
本发明属于酶工程和合成生物学技术领域,具体的说就是一种来自严格厌氧菌的耐热耐有机溶剂并且产物专一性好的菌果聚糖合成酶。
背景技术:
[0002]
果聚糖是一种主要由果糖基连接而成的多糖,广泛地存在于自然界中(biggs dr,hancock kr.2001.fructan 2000.trends in plant science,6(1):8-9)。根据果糖基连接方式的不同,果聚糖被分为三类:(1)菊糖(inulin):主要以β(2
→
1)糖苷键连接,主要存在于双子叶植物中(koops aj,jonker hh.1996.purification and characterization of the enzymes of fructan biosynthesis in tubers of helianthus tuberosus colombia-.purification of sucrose:sucrose 1-fructosyltransferaseand reconstitution of fructan synthesis in vitro with purified sucrose:sucrose 1-fructosyltransferase and fructan:fructan 1-fructosyltransferase.plant physiology,110(4):1167-1175.);(2)菌果聚糖(levan):主要以β(2
→
6)糖苷键键连接,主要存在于细菌,因此被称为菌果聚糖(bonnet gd,sims im,simpson rj,cairns aj.1997.structural diversity of fructan in relation to the taxonomyof the poaceae.new phytologist,136(1):11-17);(3)新型果聚糖:一种由不同糖苷键连接的果聚糖,主要来源于百合科植物(pollock cj.1986.tansley review no.5.fructans and the metabolism of sucrose in vascular plants.new phytologist,104(1):1-24)。与菊糖和新型果聚糖相比,菌果聚糖(levan)的研究起步较晚,但是具有重要的理论研究价值和应用前景(park nh,choi hj,oh dk.2005.lactosucrose production by various microorganisms harboring levansucrase activity.biotechnology letter,27(7):495-497)。
[0003]
菌果聚糖主要由β(2
→
6)果糖苷键组成,分子大小为2
×
10
6-100
×
10
6
da。与其它相似分子量的多糖分子相比,它具有相对较低的黏度(苗君莅,于鹏,肖杨,任璐,蔡涛等.2014.胞外多糖的研究现状与展望.食品科技,39(10):226-231)。另外,菌果聚糖与甘油共热处理后则会形成柔韧性强的粘性薄膜(bae iy,oh ik,lee s,yoo sh,lee hg.2008.rheological characterization of levan polysaccharides from microbacterium laevaniformans.international journal of biological macromolecules,42(1):10-13)。因此,菌果聚糖可以用作增稠剂,在食品工业中广泛应用。另具报道,菌果聚糖还具有降低血清胆固醇含量(belghith ks,dahech i,hamden k,feki a,mejdoub h,et al.2012.hypolipidemic effect of diet supplementation with bacterial levan in cholesterol-fed rats.international journal of biological macromolecules,50(4):1070-1074)、调节血糖水平(dahech i,belghith ks,hamden k,feki a,belghith h,et al.2011.antidiabetic activity of levan polysaccharide in alloxan-induced diabetic rats.biological macromolecules,(49):742-746)、调理肠
道(korakli m,ganzle mg,vogel rf.2002.metabolism of bifidobacteria and lactic acid bacteria of polysaccharides from wheat and rye and exopolysaccharides produced by lacto bacillus sanfrancisce-nsis.journal of applied microbiology,92(5):958-965)、保湿与消炎(kim kh,chunq cb,kim yh,kim ks,et al.2005.cosmeceutical properties of levan produced by zymomonas mobilis.international journal of cosmetic science,56(6):395-406)、增强机体免疫(rairakhwada d,pal ak,bhathena zp,sahu np,jha a,et al.2007.dietary microbial levan enhances cellular non-specific immunity and survival of common carp(cyprinus carpio)juveniles.fish and shellfish immunology,22(5):477-486)、抗肿瘤(dahech i,belghith ks,belghith h,mejdoub h.2012.partial purification of a bacillus licheniformis levansucrase producing levan with antitumor activity.international journal of biological macromolecules,51(3):329-335)等作用。因此,被广泛应用于医药、食品、化妆品和其它工业中。
[0004]
在微生物中,菌果聚糖是在菌果聚糖合成酶的作用下,以蔗糖为底物催化产生的,其催化产物中还伴有果糖、葡萄糖、低聚果糖等副产物。随着菌果聚糖的应用范围越来越广泛,更大规模、更低成本生产菌果聚糖尤为重要。目前菌果聚糖的制备主要通过以下三种方法:即微生物发酵液提取、酶法合成和化学合成法。其中酶法合成是最合理方法,因为酶法合成具有产量高、步骤简单、成本低、转化率高等优点(陆娟,卢丽丽,肖敏.2014.levan蔗糖酶及其在levan果聚糖合成中的应用.微生物学报.54(6):601-607),因而备受关注。目前已知多粘类芽孢杆菌、枯草芽孢杆菌和解淀粉芽孢杆菌等菌中含有菌果聚糖合成酶(li h,ullrich ms.2001.characterization and mutational analysis of three allelic lsc genes encoding levansucrase in pseudomonas syringae.bacteriology,183(11):3282-3292),但是现有的菌果聚糖合成酶的热稳定性和有机溶剂耐受性仍有待提高,因此不能在一些特殊的催化条件下发挥作用。另外,已有研究表明该酶的催化反应产物专一性较差,产物中除了菌果聚糖,还伴有大量的果寡糖等副产物(park nh,choi hj,oh dk.2005.lactosucrose production by various microorganisms harboring levansucrase activity.biotechnology letter,27(7):495-497)。而高聚合度和低聚合度菌果聚糖的理化性质有很大的差异,因此从混合物中分离纯化高聚合度菌果聚糖会增加后续的工作量和制备成本。另外,目前已知的菌果聚糖合成酶均来自于好氧菌或者兼性厌氧菌,还没有严格厌氧微生物来源菌果聚糖合成酶的相关研究。究其原因,可能是严格的厌氧菌分离和培养条件较为苛刻,因此限制了其功能基因的挖掘。因此,包括严格厌氧微生物来源的菌果聚糖合成酶在内更多新酶资源的挖掘,特别是获得耐热、耐有机溶剂、产物专一性好的菌果聚糖合成酶,具有非常重要的现实意义。
技术实现要素:
[0005]
本发明的目的在于提供一种严格厌氧菌来源的菌果聚糖合成酶。
[0006]
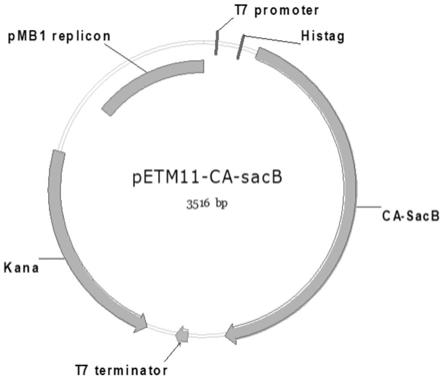
实现上述目的,从沈阳农业大学实验地分离获得的一株严格厌氧菌,经过16s rdna测序分析,确定该菌属于梭菌属,并由本实验室保存。以该菌为基础,从中克隆获得的菌果聚糖合成酶基因的重组质粒petm11-ca-sacb(如图1所示)。具体的技术方案为:
[0007]
1)总dna提取:首先对上述厌氧菌进行培养,提取总dna。
[0008]
2)目的基因扩增:根据在genebank中已发布的菌果聚糖合成酶的基因序列,用vector nti advance 10.0设计引物,其中能扩增出目的大小片段的引物为:ca-sacb-aat ii-for:5
’-
ctagg acgtc gttga aaacaagaaaaactt ataaaatgat atctt cgc-3
’
和ca-sacb-spe i-rev1:5
’-
tacca ctagt atgtg caggc gtaac tactc cttcc ccaag-3
’
。用上述引物进行pcr反应,其反应体系如下:2.0μl的10
×
buffer,0.4μl 100mm的dntp,0.25μl的浓度40mm的上述两条引物,0.5μl总dna模板,0.2μl pfu dna聚合酶,加水定容到20μl。反应条件为:94℃变性2min,25
×
(94℃变性30s,58℃退火30s,72℃延伸4min),72℃延伸10min。
[0009]
3)重组质粒的构建:将上述pcr产物进行电泳检测,然后将pcr产物进行琼脂糖凝胶电泳,并进行胶回收。将纯化得到的片段和petm11载体分别用spei和aatii进行双酶切,反应体系为1
×
buffer、8.4μl的dna、0.3μl的spei酶和0.3μl的aatii酶,37℃过夜酶切。将酶切产物纯化,并将其按照载体与目的基因片段摩尔浓度1:3进行混合,用t4dna连接酶进行连接,连接完成后将产物进行纯化,并转化到大肠杆菌jm109中。随机挑取单菌落,进行培养和质粒提取,并进行spei和aatii双酶切验证,并将酶切验证正确的质粒进行测序分析,测序正确的质粒为目标质粒,命名为petm11-ca-sacb。
[0010]
所述菌果聚糖合成酶基因为来自于土壤来源的严格厌氧微生物。
[0011]
所述菌果聚糖合成酶由seq id no:1所示的氨基酸序列。
[0012]
seq id no:1
[0013]
mvnklkivkciligsmicsgiitqqtfastndmnyketygvshitrynmskipmeqndlkfkvpqfnastlkniasakgydkngnlidldvwdswplqngdgtvanyhgyhivfalagdpknqddtsiymfyqkigensidswknagkvfkdsdkyvandpylkyqtqewsgsatltsdgqvrlfytdfsgvakdggtdasnqvitttqvnlsqpdsntinidsvsdhksvfdggngtiyqnvqqfidegkwssgdnhtlrdphyvedngrkylvfeantgtndgyqgdtsllnkafygrsqsffktekdqllidtnkkhdaslangalgiielnndytlkkemkpliasntvtdeieranvfkmngrwylftdsrgskmtingisskdiymlgfssnsltgpykplnktglvlnlnldptdltftyshfavpqtngknvvitsyitnrgmysdhhssfapsfllnikgtktsvisnsilqqgqltidnyts*
[0014]
与现有的菌果聚糖合成酶相比,本发明所具有的优点在于:
[0015]
1)本发明所涉及到的菌果聚糖合成酶具有很高的热稳定性,其最适反应温度高达60℃(如图2-a所示),50℃热稳定性最高,在80℃放置30min仍能够残留20%的酶活性(如图2-b所示)。这种热稳定性特征使其能够适应工业生产中特殊的催化条件,在一定的温度范围内,不需要降温处理。
[0016]
2)本发明所涉及到的菌果聚糖合成酶具有很高的有机溶剂耐受性,其特征在于:对乙醇的耐受性最强,10%乙醇溶液对酶活性没有显著影响;在50%乙醇溶液中放置30min,仍有60%的残留活性。这一特征提示该酶在含酒精食品和饮料中可能具有应用潜力(如图3所示)。
[0017]
3)本发明所涉及到的菌果聚糖合成酶具有很高的产物专一性,其特征在于:以蔗糖为底物,催化产物中的果聚糖均为高聚合度果聚糖,几乎检测不到低聚果糖产物的产生,因此产物专一性好(如图4所示)。由于高聚合度果聚糖和低聚合度果聚糖的理化性质不同,尤其是其应用范围有所不同,因此较高的产物专一性对于后续的产物分离纯化及应用具有重要意义。
[0018]
4)本发明所涉及到的菌果聚糖合成酶也具有其它良好的酶学特征,具体表现为:该酶的最适反应ph为6.0,在ph4.0-8.0范围内具有良好的稳定性(如图5所示);5mmol/l的agno
3
、hg(no
3
)
2
、cucl
2
和sds能够抑制酶活性,而5mmol/l的sncl
2
和mncl
2
能够促进酶活性分别达到43%和28%(如图6所示);该酶的k
m
为64mmol/l,v
max
为190μmol/min/mg,酶活力高达1133u/mg。
[0019]
5)本发明所涉及到的菌果聚糖合成酶是首次被表征的来源于严格厌氧微生物的菌果聚糖合成酶。由于其较为特殊的来源,因此与已表征的菌果聚糖合成酶相比,其序列相似性最高仅有53%。由此可见,拓展不同的微生物来源,有利于获取更丰富高效的新酶。
附图说明
[0020]
图1本发明所构建的petm11-ca-sacb质粒的物理图谱。其中ca-sacb是菌果聚糖合成酶编码基因;his-tag是组氨酸标签,用于ni-nta纯化蛋白;t7 promoter和t7 terminator分别是t7启动子和t7终止子;kana编码卡那霉素抗性基因;pmb1 replicon是大肠杆菌质粒复制子。
[0021]
图2本发明所涉及的ca-sacb酶的最适温度和热稳定性。a为酶的最适温度测定;b为酶的热稳定性测定。相对活性=(样品活性/最高活性)
×
100%,每个反应重复三次,取平均值。
[0022]
图3本发明所涉及的ca-sacb酶的有机溶剂耐受性。相对活性=(样品活性/最高活性)
×
100%,每个反应重复三次,取平均值。
[0023]
图4本发明所涉及的ca-sacb酶的产物专一性分析。a.ca-sacb催化蔗糖反应,tube1为以蔗糖为底物的催化产物,tube2为蔗糖溶液;b.ca-sacb催化产物高效液相分析,其中g,gf,gf2,gf3,gf4分别为葡萄糖,蔗糖,蔗果三糖,蔗果四糖,蔗果五糖。
[0024]
图5本发明所涉及的ca-sacb酶的最适ph和ph稳定性。a为酶的最适ph测定;b为酶的ph稳定性测定。相对活性=(样品活性/最高活性)
×
100%,每个反应重复三次,取平均值。
[0025]
图6.几种化学物质和金属离子对本发明所涉及的ca-sacb酶活性的影响。相对活性=(样品活性/最高活性)
×
100%,每个反应重复三次,取平均值。
具体实施方式
[0026]
本发明是涉及一种菌果聚糖合成酶,该酶来自于一种严格厌氧的梭菌属微生物,并能够在大肠杆菌中高效表达。通过该酶的克隆,表达和酶学性质研究,揭示了该酶具有很高的热稳定性;对乙醇具有较高的耐受性;并且以蔗糖为底物所得到的催化产物中的果聚糖均为高聚合度果聚糖,而没有低聚果糖产物的产生,因此产物专一性好。
[0027]
实施例1:本发明所涉及的来自严格厌氧菌的菌果聚糖合成酶ca-sacb基因的分子克隆
[0028]
从沈阳农业大学实验地分离获得的一株严格厌氧菌,经过16s rdna测序分析,确定该菌属于梭菌属,并由本实验室保存。以该菌为基础,从中克隆获得的菌果聚糖合成酶基因的重组质粒petm11-ca-sacb(如图1所示)。具体的技术方案为:
[0029]
1)总dna提取:首先对上述厌氧菌进行培养,提取总dna。
[0030]
2)目的基因扩增:根据在genebank中已发布的菌果聚糖合成酶的基因序列,用vector nti advance 10.0设计引物,其中能扩增出目的大小片段的引物为:ca-sacb-aat ii-for:5
’-
ctagg acgtc gttga aaaca agaaa aactt ataaa atgat atctt cgc-3
’
和ca-sacb-spe i-rev1:5
’-
tacca ctagt atgtg caggc gtaac tactc cttcc ccaag-3
’
。用上述引物进行pcr反应,其反应体系如下:2.0μl的10
×
buffer,0.4μl 100mm的dntp,0.25μl的浓度40mm的上述两条引物,0.5μl总dna模板,0.2μl pfu dna聚合酶,加水定容到20μl。反应条件为:94℃变性2min,25
×
(94℃变性30s,58℃退火30s,72℃延伸4min),72℃延伸10min。
[0031]
3)重组质粒的构建:将上述pcr产物进行电泳检测,然后将pcr产物进行琼脂糖凝胶电泳,并进行胶回收。将纯化得到的片段和petm11载体分别用spei和aatii进行双酶切,反应体系为1
×
buffer、8.4μl的dna、0.3μl的spei酶和0.3μl的aatii酶,37℃过夜酶切。将酶切产物纯化,并将其按照载体与目的基因片段摩尔浓度1:3进行混合,用t4dna连接酶进行连接,连接完成后将产物进行纯化,并转化到大肠杆菌jm109中。随机挑取单菌落,进行培养和质粒提取,并进行spei和aatii双酶切验证,并将酶切验证正确的质粒进行测序分析,测序正确的质粒为目标质粒,命名为petm11-ca-sacb。
[0032]
实施例2:本发明所涉及的来自严格厌氧菌的菌果聚糖合成酶ca-sacb的表达
[0033]
将构建正确的质粒petm11-ca-sacb转化到用于表达的大肠杆菌bl21(de3)中。挑取转化后的单菌落,接种于液体tb培养基中,37℃,150rpm培养直至菌液od
600
=0.4-0.6之间,加入终浓度为0.1mmol/l的诱导剂iptg进行诱导表达。诱导表达条件改为22℃,100rpm,诱导时间24h。培养结束后,离心收集菌体,用50mmol/l ph 5.9的磷酸缓冲液重悬菌体。将重悬菌体进行超声破碎,离心收集上清,即为粗酶液,然后用ni-nta进行蛋白纯化,得到较纯的酶。
[0034]
实施例3:本发明所涉及的来自严格厌氧菌的菌果聚糖合成酶ca-sacb的活性测定
[0035]
将纯化后的5ml酶液加入到100ml的反应液中,室温反应48h,使酶与底物充分反应。其中反应液为含有20%蔗糖的ph 5.9的磷酸缓冲液。反应结束后,将反应产物高速离心去除酶蛋白杂质。然后向其中加入无水酒精,直到溶液中产生白色絮状浑浊物,其酒精的终浓度达到50%。将浑浊的溶液转移到2ml的ep管中,4℃条件下80000rpm离心5min,收集沉淀,然后对产物进行冷冻干燥。将产物进行hplc检测,检测器为shodex示差折光率检测器。采用asahipak nh2p-50-4e氨基柱,流动相为经过0.22μm膜过滤的65%乙腈;上样体积为10μl;洗脱流速为1ml/min。
[0036]
实施例4:本发明所涉及的来自严格厌氧菌的菌果聚糖合成酶ca-sacb的最适温度和热稳定性测定
[0037]
1)酶的最适温度测定:在20℃-90℃区间,以10℃为间隔,在50mmol浓度的ph 5.9的磷酸缓冲液中反应,反应条件为:0.5ml酶液+1.5ml 10%蔗糖磷酸缓冲液,不同温度下反应10min,终止反应,按照实施例3所示方法进行产物测定,进而确定酶的最适温度。相对活性=(样品活性/最高活性)
×
100%,每个反应重复三次,取平均值。
[0038]
2)酶的热稳定性测定:分别将酶液放在20℃-90℃区间,每10℃一个间隔;然后在此温度下保温30min。最后取出酶液在最适温度下进行酶活性测定。相对活性=(样品活性/最高活性)
×
100%,每个反应重复三次,取平均值。
[0039]
实施例5:本发明所涉及的来自严格厌氧菌的菌果聚糖合成酶ca-sacb的有机溶剂
耐受性测定
[0040]
将纯化后的酶液分别和乙醇、丙酮和丁醇溶液混合,使混合液中含有不同浓度的上述有机溶剂,以酶液与去离子水作为对照,在最适温度下保温30min,按照实施例3所示方法在最适条件下进行催化反应和产物测定。以去离子水处理所测定的对照酶活性值为100%,每个处理的相对活性=(样品活性/对照酶活性)
×
100%,每个反应重复三次,取平均值。
[0041]
实施例6:本发明所涉及的来自严格厌氧菌的菌果聚糖合成酶ca-sacb的最适ph和ph稳定性测定
[0042]
1)酶的最适ph测定:在ph 3.0-10.0区间,以1个ph为间隔,在最适反应温度下,反应10min,终止反应,按照实施例3所示方法进行产物测定,进而确定酶的最适ph。相对活性=(样品活性/最高活性)
×
100%,每个反应重复三次,取平均值。
[0043]
2)酶的ph稳定性测定:将酶液分别与ph 3.0-10.0的缓冲液按照体积比1:1混合,在最适温度下保温30min,然后在最适温度下进行酶活性测定。相对活性=(样品活性/最高活性)
×
100%,每个反应重复三次,取平均值。
[0044]
实施例7:几种化学物质和金属离子对本发明所涉及的来自严格厌氧菌的菌果聚糖合成酶ca-sacb活性影响的测定
[0045]
将酶液分别和10mmol/l的sds、edta、urea和多种金属离子进行混合体积比为1:1,离子终浓度为5mmol/l,以酶液与去离子水等体积混合作为对照,在最适温度下保温30min,以去离子水等体积混合后测定的酶活性值为100%,每个处理的相对活性=(样品活性/对照酶活性)
×
100%,每个反应重复三次,取平均值。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1