一种以邻香兰素缩氨基硫脲为配体的金配合物及其合成方法与流程
[0001]
本发明涉及金配合物的合成,具体涉及一种以邻香兰素缩氨基硫脲为配体的金配合物及其合成方法和应用。
背景技术:
[0002]
癌症,是一种细胞生长增殖机制受到控制引起的疾病,世界上最普遍的疾病之一。在人体细胞新陈代谢过程中,正常细胞主要以受控分裂的细胞代替衰老的细胞,但是当正常细胞因某种疾病不受控制时,癌症就有可能发生。
[0003]
顺铂类药物在临床治疗癌症上获得了巨大成功,但同时也具有较强的毒副作用和交叉抗药性的缺陷。鉴于au(-)与pt(-)为等电子体,且配位时都采取平面四方构型,au(-)配合物已经成为金属药物研究领域的热点。缩氨基硫脲是指酮或者醛与n-氨基硫脲通过脱水缩合反应得到含-rc=n-键的一类希夫碱化合物。许多au(-)配合物的确表现出良好的体外抗肿瘤活性,但在近生理条件下不够稳定是一严重缺陷,邻香兰素缩氨基硫脲是一个具有多个配位点的配体,其对过渡元素亲和力很强,au(-)与之能形成非常稳定的配合物。
技术实现要素:
[0004]
本发明的目的是提供一种以邻香兰素缩氨基硫脲为配体的金配合物及其合成方法和应用,该合成方法,操作简单,便于实施。
[0005]
本发明还提供了上述金配合物在制备抗肿瘤药物中的应用。
[0006]
实现本发明目的的技术方案是:
[0007]
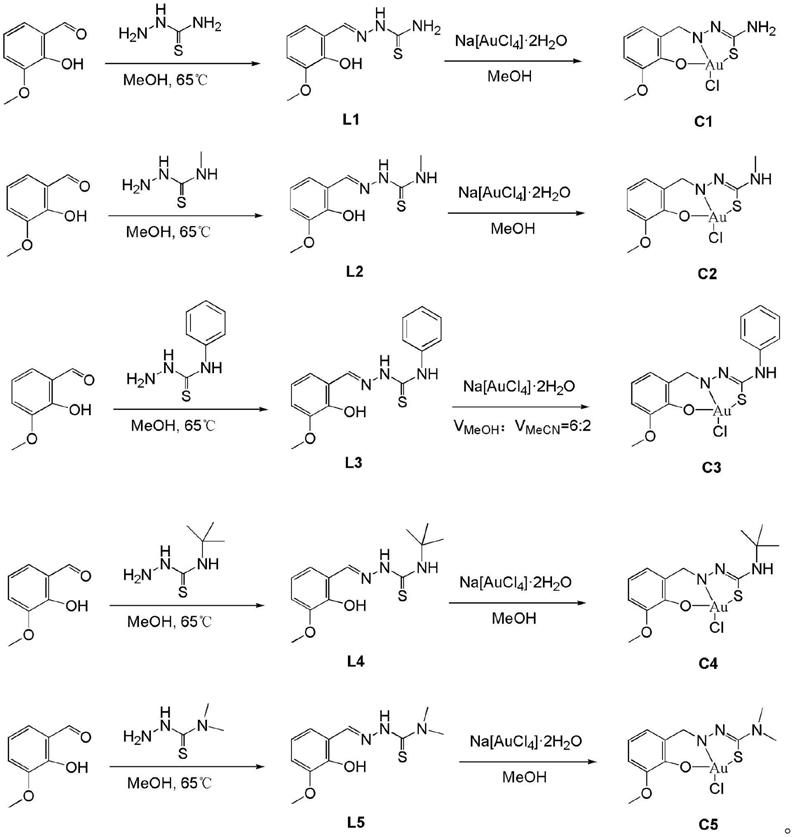
一种以邻香兰素缩氨基硫脲为配体的金配合物,其结构式如下式c1-c5
[0008]
[0009]
上述式c1-c5所示金配合物的合成路线如下:
[0010][0011]
本发明以邻香兰素缩氨基硫脲为配体的金配合物的合成方法,包括以下步骤:
[0012]
(1)将氨基硫脲溶于甲醇,再加入邻香兰素,65℃回流反应,过滤,滤液室温挥发,有晶体析出,用乙醚洗涤2-3次干燥后,得到配体;
[0013]
(2)取步骤(1)得到的配体溶于甲醇或v
甲醇
:v
乙腈
=3:1中,将na[aucl
4
]
·
2h
2
o加入其中,65℃回流反应,过滤,得到沉淀,用乙醚洗涤沉淀,将洗涤后的沉淀置于烘箱70℃烘干最后用丙酮或二氯甲烷溶解沉淀,过滤,取滤液置于试管底部,上层铺上正己烷,扩散数小时后得到晶体,即金配合物。
[0014]
步骤(1)所述氨基硫脲与邻香兰素的摩尔比为1:1;
[0015]
所述的氨基硫脲为氨基硫脲,4-甲基氨基硫脲、4-苯基氨基硫脲,4-叔丁基氨基硫脲,4,4-二甲基-3-氨基硫脲。
[0016]
所述溶剂的用量以能溶解参加反应的原料为宜。
[0017]
步骤(2)所述配体与na[aucl
4
]
·
2h
2
o的摩尔比为1:1;
[0018]
所述溶剂的用量以能溶解参加反应的原料为宜。
[0019]
本发明合成了五个以邻香兰素缩氨基硫脲为配体的金配合物,并利用x-单晶衍射,元素分析,红外光谱等进行表征。通过筛mtt对配体和配合物的活性进行测试,将配体和配合物的活性进行了比较,结果表明,合成的金配合物比其配体的体外活性普遍较好,表现出很好的抑制活性,并且对人正常细胞毒性作用不大,适用于制备高效,低毒的抗肿瘤药物。
附图说明
[0020]
图1为实施例1合成的c1金配合物的单晶结构图;
[0021]
图2为实施例2合成的c2金配合物的单晶结构图;
[0022]
图3为实施例3合成的c3金配合物的单晶结构图;
[0023]
图4为实施例4合成的c4金配合物的单晶结构图;
[0024]
图5为实施例5合成的c5金配合物的单晶结构图。
具体实施方式
[0025]
下面结合具体实施例和附图对本发明作进一步的详述,以更好地理解本发明的内容,但本发明并不限于以下实施例。
[0026]
实施例1:
[0027]
c1金配合物的合成,具体合成方法为:
[0028]
(1)将氨基硫脲3mmol溶于15ml甲醇,再加入邻香兰素3mmol,65℃回流4h,过滤,滤液室温挥发,有白色粉末状晶体析出,用无水乙醇洗涤2-3次得到配体l1;
[0029]
yield:534.63mg,79.11%,c
9
h
13
n
3
o
2
s:c,48.18;h,4.73;n,18.41;o,14.54,s,14.09.found:c,47.99;h,4.92;n,18.65;o,14.20.s,14.23;ir,cm-1
:1498.55(c=c),3462.02(s,amide),3032.69(m,aromatic hydrogen),1617(s),1262.95(m,c=n),1119.19(s,thioamide),1458.58(m,c-h),768.47(m,c=s),3462.02(s,hydroxide radical),1058.70(s,c-o);
[0030]
(2)取0.1mmol步骤(1)得到的配体l1溶于10ml甲醇中,向其中加入0.1mmol na[aucl
4
]
·
2h
2
o,常温搅拌4-6h,过滤,得到黑色沉淀,用乙醚洗涤沉淀3次,每次4ml,置于烘箱干燥,将洗涤后的沉淀置于烘箱70℃烘干,最后用3ml丙酮溶解沉淀,过滤,置于试管底部,上层铺上8ml正己烷,扩散96h后得到黑色长条状晶体,即金配合物c1,其单晶结构如图1所示;
[0031]
yield:37.71mg,80.12%,c
10
h
12
aucln
3
o
2
s:c,23.33;h,2.54;n,9.44;o,6.78;s,7.07.found:c,23.66;h,2.24;n,9.23;o,6.99;s,7.04.ir,cm-1
:1616.16(c=c),3115.2(m,aromatic hydrogen),2553.2(s),1238(m,c=n),539(s,c-s),1437(m,c-h),3434.81(s,hydroxide radical),1271(s,c-o)。
[0032]
实施例2
[0033]
c2金配合物的合成,具体合成方法为:
[0034]
(1)取4-甲基氨基硫脲3mmol溶于15ml甲醇,再加入邻香兰素3mmol,65℃回流4h,过滤,滤液室温挥发,有白色絮状晶体析出,用无水乙醚洗涤2-3次得到配体l2;
[0035]
yield:517.25mg,72.12%,c
10
h
13
n
3
o
2
s:c,49.88;h,5.69;n,17.09;o,13.74;s,
13.50,found:c,50.19;h,5.48;n,17.56;o,13.37;s,13.40;ir,cm-1
:1481,1606.8(c=c),3000.25(s,amide),3032.69(m,aromatic hydrogen),1617(s),1276(m,c=n),1157.42(s,thioamide),1361.90,1488.48(m,c-h),756.24(m,c=s),3308.50(s,hydroxide radical),1276.00(s,c-o);
[0036]
(2)取0.1mmol步骤(1)得到的l2溶于10ml甲醇,向其悬浊液中加入0.1mmol na[aucl
4
]
·
2h
2
o,常温搅拌4-6h,反应后的产物为棕黄色沉淀,乙醚洗涤沉淀2-3次,置于烘箱干燥,用丙酮溶解干燥后的沉淀,过滤,取滤液4ml于试管底部,上层铺上10ml正己烷,扩散72h得到棕黄色针状晶体,即金配合物c2,其单晶结构如图2所示;
[0037]
yield:34.20mg,72.66%,c
10
h
12
aucln
3
o
2
s:c,25.32;h,2.78;n,9.15;o,6.70;s,6.70,found:c,25.52;h,2.57;n,8.93;o,6.80;s,6.81;ir,1496.08,1600.31(c=c),3423(s,amide),2974.25,880.12(m,aromatic hydrogen),1211.43(m,c=n),502.83(s,c-s),1383.65,1432.26(m,c-h),3324.00(s,hydroxide radical),1211.43(s,c-o)。
[0038]
实施例3
[0039]
c3金配合物的合成,具体合成方法为:
[0040]
(1)取4-苯基氨基硫脲3mmol溶于15ml甲醇,再加入邻香兰素3mmol,65℃回流4h,过滤,滤液室温挥发,有白色粉末状晶体析出,用无水乙醚洗涤2-3次得到配体l3;
[0041]
yield:705.63mg,78.12%,c
15
h
15
n
3
o
2
s:c,59.58;h,5.30;n,13.90;o,10.55;s,10.71,found:c,59.78;h,5.02;n,13.94;o,10.62;s,10.64,ir,1594.95,1508.00(c=c),694.71(s,amide),3057.32,1862.10(m,aromatic hydrogen),1281.94(m,c=n),1166.83(s,thioamide),1463.00(m,c-h),757.97(m,c=s),3302.42(s,hydroxide radical),1166.83(s,c-o);
[0042]
(2)取0.1mmol步骤(1)得到的配体l3溶于体积比为v
meoh
:v
mecn
=6:2的混合溶剂中,向其中加入0.1mmol na[aucl
4
]
·
2h
2
o,常温搅拌4-6h,反应后的产物为灰黑色沉淀,乙醚洗涤沉淀2-3次,置于烘箱干燥,用二氯甲烷溶解干燥后的沉淀,过滤,取滤液4ml于试管底部,上层铺上10ml正己烷,扩散72h得到灰黑色针状晶体,即金配合物c2,其单晶结构如图3所示;
[0043]
yield:22.41mg,42.12%,c
15
h
14
aucln
3
o
2
s:c,23.44;h,2.95;n,8.97;o,6.25;s,6.47,found:c,23.82;h,2.65;n,8.89;o,6.01;s,6.71;ir,1496.08,1600.31(c=c),3423(s,amide),2974.25,880.12(m,aromatic hydrogen),1211.43(m,c=n),502.83(s,c-s),1383.65,1432.26(m,c-h),3324.00(s,hydroxide radical),1211.43(s,c-o)。
[0044]
实施例4
[0045]
c4金配合物的合成,具体合成方法为:
[0046]
(1)取4-叔丁基氨基硫脲3mmol溶于15ml甲醇,再加入邻香兰素3mmol,65℃回流4h,过滤,滤液室温挥发,有淡黄色针状晶体析出,用无水乙醚洗涤2-3次得到配体l4;
[0047]
yield:41.60mg,81.12%,c
13
h
18
n
3
o
2
s:c,55.29;h,7.02;n,14.92;o,11.01;s,11.76,found:c,55.49;h,6.81;n,14.93;o,11.37;s,11.40,ir,1598.56(c=c),768.70(s,amide),3032.85(m,aromatic hydrogen),1281.35(m,c=n),1119.56(s,thioamide),1458.61,1374.00(m,c-h),768.27(m,c=s),3343.32(s,hydroxide radical),1213.47(s,c-o);
[0048]
(2)取0.1mmol步骤(1)得到的配体l4溶于10ml甲醇,向其中加入0.1mmol na[aucl
4
]
·
2h
2
o,常温搅拌8h,反应后的产物为灰黑色沉淀,乙醚洗涤沉淀2-3次,置于烘箱干燥,用二氯甲烷溶解干燥后的沉淀,过滤,取滤液4ml于试管底部,上层铺上10ml正己烷,扩散72h得到黑绿色针状晶体,即金配合物c4,其单晶结构如图4所示;
[0049]
yield:41.60mg,81.12%,c
13
h
18
aucln
3
o
2
s:c,30.04;h,3.95;n,8.02;o,6.50;s,6.16,found:c,30.45;h,3.54;n,8.19;o,6.24;s,6.25,ir,1598.18(c=c),3433.06(s,amide),2965.27,730,91(m,aromatic hydrogen),1208.49(m,c=n),510.23(s,c-s),1381.81,1453.85(m,c-h),3292.90(s,hydroxide radical),1201.43(s,c-o)。
[0050]
实施例5
[0051]
c5金配合物的合成,具体合成方法为:
[0052]
(1)取4,4-二甲基氨基硫脲3mmol溶于15ml甲醇,再加入邻香兰素3mmol,65℃回流4h,过滤,滤液室温挥发,有黄色针状晶体析出,用无水乙醚洗涤2-3次得到配体l5;
[0053]
yield:676.66mg,89.12%,c
11
h
15
n
3
o
2
s:c,51.26;h,6.01;n,16.64;o,12.52;s,12.57,found:c,52.15;h,5.97;n,16.59;o,12.63;s,12.66,ir,1559.44,1506.5(c=c),735.16(s,amide),834.23(m,aromatic hydrogen),1232(m,c=n),1132.37(s,thioamide),1462.59,1379.55(m,c-h),766.75(m,c=s),3287.63(s,hydroxide radical),1079(s,c-o);
[0054]
(2)取0.1mmol步骤(1)得到的配体l5溶于10ml甲醇,向其中加入0.1mmol na[aucl
4
]
·
2h
2
o,65℃回流4-6h,反应后的产物为深绿色沉淀,乙醚洗涤沉淀2-3次,置于烘箱干燥,用二氯甲烷溶解干燥后的沉淀,过滤,取滤液4ml于试管底部,上层铺上10ml正己烷,扩散72h得到黑绿色针状晶体,即金配合物c5,其单晶结构如图5所示;
[0055]
yield:40.29mg,83.12%,c
11
h
14
aucln
3
o
2
s:c,27.06;h,3,01;n,8.48;o,6.81;s,6.41;s,6.59,found:c,27.26;h,2.91;n,8.67;o,6.60;s,6.61,ir,1593.69(c=c),1627.99,897.04(m,aromatic hydrogen),1211.59(m,c=n),511.23(s,c-s),1383.65,1466.44(m,c-h),3460(s,hydroxide radical),1251.17(s,c-o),1211.38(c-o)。
[0056]
为说明本发明合成的五个以邻香兰素缩氨基硫脲为配体的金配合物,申请人对金配合物进行了体外增殖抑制活性实验,实验过程如下:
[0057]
1、细胞株与细胞培养
[0058]
本实验选用了人宫颈癌细胞株(hela),人乳腺癌细胞(mcf-7),人正常肝细胞(hl-7702)进行了活性研究。
[0059]
所有细胞株均培养在含10%小牛血清、100u/ml链霉素的rpmi-1640/dmem培养液内,置37℃含体积浓度5%co
2
孵箱中培养。
[0060]
2、待测配合物的配制
[0061]
所用的受试药物的纯度≥95%,将其dmso储液用生理缓冲液稀释后配置成5mmol/l的终溶液,加入到96孔培养板中后,dmso的浓度≤1%,测试该浓度下化合物对各种肿瘤细胞生长的抑制程度。
[0062]
3、细胞生长抑制实验(mtt法)
[0063]
(1)取对数生长期的肿瘤细胞,经胰蛋白酶消化后,用含10%小牛血清的培养液配置成浓度为5000个/ml的细胞悬液,以每孔180μl接种于96孔培养板中,使待测细胞浓度至
每孔1000~10000/孔(边缘孔用无菌pbs填充);
[0064]
(2)5%co
2
,37℃孵育24h,至细胞单层铺满孔底,每孔加入一定浓度梯度的药物20μl,每个浓度梯度设5个复孔;
[0065]
(3)5%co
2
,37℃孵育48h,至倒置显微镜下观察;
[0066]
(4)每孔加入10μl的mtt溶液(5mg/ml mtt,即0.5%mtt),继续培养4h-6h;
[0067]
(5)终止培养,小心吸去孔内培养液,每孔加入100μl的dmso充分溶解甲瓒沉淀,振荡器混匀后,在酶标仪用波长为570/630nm,测定各孔的光密度值;
[0068]
(6)根据测得的光密度值(od值),来判断活细胞数量,od值越大,活细胞数量越多。
[0069]
ic
50
测定:利用以上方法,每种化合物须设置浓度梯度,其中含多个(一般5~8个)浓度,每个浓度也须设置3~5个副孔,实验得到每个不同浓度的抑制率,然后在spss软件中计算配合物的ic
50
值,如表1所示。
[0070]
表1:配体以及配合物对不同细胞株的ic
50
值(μm),数值越低表明化合物抑制活性越好。
[0071][0072]
实验结果表明,对所测试的几种肿瘤细胞株,合成的系列邻香兰素缩胺基硫脲金配合物均比其配体的活性好,特别是对人乳腺癌细胞具有高度特异性,表现出很好的抑制活性。这一系列配合物对人正常细胞毒性作用都比较小,适用于制备高效,低毒的抗肿瘤药物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1