一种猪瘟抗体检测试剂盒及制备方法与流程
[0001]
本发明属于生物制品领域,具体涉及一种猪瘟抗体检测试剂盒及制备方法。
背景技术:
[0002]
猪瘟是由猪瘟病毒引起的一种高度接触性动物传染病,与牛病毒性腹泻病毒、羊边界病病毒同属于瘟病毒属。因其基因组序列与猪瘟病毒具有高度同源性,三者之间存在交叉抗原。因此,血清学上存在交叉反应。动物世界卫生组织将猪瘟列入a类传染病,我国也将其列为一类动物传染病。目前该病已经在许多国家和地区广泛传播,虽然有一些国家采用疫苗免疫和“扑杀”的方式来控制和消灭该病,但随着生态环境的改变,仍有猪瘟散发流行的报道。我国对于猪瘟的防控主要采用疫苗接种的预防措施,随着生猪及肉制品的内需增长,生猪的流通成为传播疾病的主要方式,使猪瘟病毒存在流行的风险。猪瘟病毒感染猪群后不但会严重影响猪群的健康,而且会导致较高的死亡率和不断向外排毒的风险,因此对猪群的健康评估以便及时了解猪群的感染及免疫情况成为防控该病的关键。
[0003]
猪瘟病毒是rna病毒,其编码区编码的多聚蛋白在加工、翻译过程中形成12种成熟的病毒蛋白。不同的蛋白在病毒的复制和基因的表达调控中均起着重要的作用。猪瘟病毒的功能性蛋白包括e
rns
(但其诱导产生的中和抗体中和谱很窄)、e2蛋白(是猪瘟的保护性抗原蛋白,能携带刺激机体产生保护性免疫的抗原决定簇,诱导产生中和抗体。但e2蛋白拥有4个不同的抗原区域(a、b、c、d),且大部分的区域都是极容易变异的(b、c、d))和ns3非结构蛋白。因此,仅仅依赖于单一的蛋白建立的检测方法难免会因蛋白抗原表位较为单一,导致检测的抗体就会相对单一,不能较好的反映病毒刺激机体以后的抗体总体水平。因此在进行该病的健康评估过程中难免会存在灵敏度低或漏检等情况。
[0004]
目前,用于猪瘟病毒检测的血清学方法主要有免疫琼扩试验法、正向血凝试验法、猪瘟中和免疫荧光试验法等,这些方法在一定程度上都存在着结果判定人为误差影响较大,试验设备要求较高、难以满足批量化检测需求等缺陷,因此,临床上也很难得到推广应用。酶联免疫吸附试验是当前应用较为广泛的一种血清学检测技术,因其样本检测量大、灵敏度好和特异性高等特点而得到广泛的应用。但当前针对猪瘟抗体的检测方法主要集中于采用基因工程技术表达蛋白作为包被用抗原的方法,在抗体水平的检测上相对过于单一。虽然也有极少数报道采用猪瘟病毒作为检测用抗原,但其识别性抗体为血清多抗,容易引起不同程度的非特异性反应,造成假阴性、假阳性的出现。
[0005]
针对猪瘟检测,一些学者建立了相应的血清学检测方法(如中国专利cn103882051b,一种检测猪瘟病毒抗体的elisa方法及检测试剂盒,中国专利cn104483490b,一种猪瘟病毒阻断elisa抗体检测试剂盒及应用),但这些方法大多针对猪瘟病毒的某一单一蛋白做包被抗原,存在抗体识别相对较为单一、不能更好的反应整个猪瘟病毒在不同的感染时期血清中抗体水平的变化,也有学者采用猪瘟病毒的形式作为包被用抗原(如中国专利cn107064488b,一种猪瘟病毒血清总抗体固相阻断elisa试剂盒所用抗原的制备方法)检测血清中的抗体水平,但其过氧化物酶标记物为多抗成分,因猪瘟病毒与
牛病毒性腹泻病毒、羊边界病病毒同属于瘟病毒属,三者之间存在抗原及血清学上交叉反应。因此,采用羊抗猪瘟多抗进行过氧化物酶标记,在样品的测定过程中很难保证其竞争性结合仅为猪瘟病毒,增加了假阴性的概率,不利于自然感染猪群的筛查。
[0006]
为了解决现有背景技术中存在的包被蛋白抗原过于单一,标记多抗难以排除相同病毒属非特异性交叉反应,猪瘟病毒纯化等问题,本发明主要从猪瘟病毒的纯化技术、鼠抗猪瘟单抗制备技术等方面解决当前遇到的难题。
技术实现要素:
[0007]
本发明的目的在于提供一种猪瘟抗体检测试剂盒及制备方法,解决目前包被蛋白抗原过于单一,标记多抗难以排除相同病毒属非特异性交叉反应等问题。
[0008]
为实现上述目的,本发明采用如下技术方案:
[0009]
一种猪瘟抗体检测试剂盒,包括以下组分:包被板用抗原、抗原包被板、鼠抗猪瘟病毒单克隆抗体、羊抗鼠igg-hrp、阳性对照、阴性对照、样品稀释液、洗涤液、tmb显色液和终止液,所述包被板用抗原为通过peg浓缩、蔗糖密度梯度离心后纯化的猪瘟病毒。
[0010]
进一步的,所述包被板用抗原的制备方法如下:采用牛睾丸原代细胞进行猪瘟病毒的扩大培养,按照2-5g猪瘟脾淋毒接种到10000ml-15000ml细胞培养瓶中的比例进行猪瘟病毒的增殖,经带毒传代1-2次后,收获病毒液,即为猪瘟病毒培养物;将收获的猪瘟病毒培养物经反复冻融、离心去除细胞碎片后,用聚乙二醇(peg)沉淀法进行病毒浓缩,再通过蔗糖密度梯度离心获取纯化的猪瘟病毒。
[0011]
进一步的,所述病毒浓缩过程,peg的浓度为8-10%,沉淀时间为16-18h。
[0012]
进一步的,抗原包被浓度为0.33μg/ml,包被条件为4℃包被16-18h或37℃包被1-2h。
[0013]
进一步的,所述抗原包被板是用碳酸盐缓冲液作为包被液,将通过peg浓缩、蔗糖密度梯度离心后纯化的猪瘟病毒稀释至浓度为0.33μg/ml,包被酶标板。
[0014]
进一步的,所述样品稀释液为pbs缓冲液,洗涤液为pbst缓冲液、显色液为tmb显色液,终止液为h2so4。
[0015]
与现有技术相比,本发明具有以下优点:(1)本发明具有通过聚乙二醇浓缩和蔗糖密度梯度技术对猪瘟病毒进行纯化,以获取的纯化病毒作为包被抗原,一方面解决了猪瘟病毒纯化难题,另一方面解决了目前采用单一蛋白(如e2蛋白、e
rns
蛋白)作为包被用抗原导致检测的抗体针对性单一的问题。此外,聚乙二醇是一种高分子聚合物,其主要通过吸收大量水分,降低病毒粒子之间的距离使病毒粒子聚集在一起,达到沉淀病毒的目的。该方法不仅适用于大批量病毒的浓缩、且能够很好的保持病毒粒子的活性,操作简单。蔗糖密度梯度离心方法根据培养物中不同成分的沉降系数进行分层,完美的解决了猪瘟病毒培养用细胞对后期实验的干扰,提高了病毒的纯度。经蔗糖密度梯度离心后能够达到很好的病毒分离效果,纯度较高,该技术为猪瘟病毒的纯化提供了一种经济、便捷、高效的方法,且完全能够满足该技术方法的建立。
[0016]
(2)本发明以鼠抗猪瘟单克隆抗体作为竞争性抗体,避免了瘟病毒属其他病毒发生感染产生血清交叉反应问题。本发明采用纯化的猪瘟病毒作为包被用抗原,以鼠抗单克隆抗体作为竞争性抗体,同时采用过氧化物酶标记的相对应种属的抗体作为标记抗体,建
立猪瘟病毒抗体竞争elisa检测方法,在提高猪瘟病毒抗体检测灵敏度的同时,大大提高了猪瘟病毒抗体检测的特异性。
[0017]
(3)虽然猪瘟病毒e2蛋白单克隆抗体的制备已经相对较为成熟,但还未有猪瘟病毒与采用单克隆抗体技术制备的单抗联合,高效特异性的竞争血清中的抗体的检测方法,且该方法采用与检测样品异源的相对应的抗体作为标记物,极大的提高了血清学elisa检测方法的特异性。
具体实施方式
[0018]
实施例1猪瘟抗体检测试剂盒的制备方法
[0019]
(一)猪瘟抗体检测试剂盒的制备流程
[0020]
一、猪瘟病毒抗体检测用抗原的制备
[0021]
1、猪瘟病毒的培养、鉴定及效价的测定
[0022]
采用牛睾丸原代细胞进行猪瘟病毒的扩大培养。按照2-5g猪瘟脾淋毒(c株)接种到10000ml-15000ml细胞培养瓶中的比例进行猪瘟病毒的增殖,经带毒传代1-2次后,收获病毒液,即为猪瘟病毒培养物。
[0023]
2、猪瘟病毒的纯化
[0024]
将收获的病毒液反复冻融3次,6000g-8000g/min离心30-60min,去除细胞碎片后,用peg沉淀法进行病毒浓缩,再通过蔗糖密度梯度离心获取较纯净的猪瘟病毒。与其他方法相比,peg浓缩法能较高倍数的进行病毒浓缩,且对病毒的结构和抗原性有一定的保护作用。且peg对细胞具有很好的聚合作用,有利于病毒对细胞的侵染作用,因此,采用该方法不仅可以进行大批量初次浓缩,还可以通过该方法降低培养基中的非特异性物质、异源蛋白等,为疫苗中导致过敏反应的异源物质的去除提供一定的参考依据。而蔗糖密度梯度离心能更好将病毒液中各种沉降系数的蛋白进行分离,大大提高的病毒的纯度,因其易溶于水,对核酸和蛋白质均无不良影响,所以在病毒的纯化及其蔗糖的去除过程均较为方便。虽然蔗糖梯度离心在病毒纯化方面已经得到了广泛的应用,但在病毒浓缩过程中大多采用超速离心的方法进行浓缩,超速离心的方法虽然适用于大批量病毒的浓缩纯化,但超速离心剪切力的作用会对病毒结构造成一定的损失。因此,两者的结合大大降低了上述的缺陷,当前虽然存在着超滤、层析柱法等进行病毒的纯化,但这些方法需多次使用不同截留分子量的层析柱进行病毒的截留,操过过程较为复杂,操作时间较长,且需要相应的蛋白纯化系统进行样品的上样及收集,该方法仅适用于实验室操作,不适合大批量生产。
[0025]
二、鼠抗猪瘟病毒单克隆抗体腹水的制备及纯化
[0026]
1、腹水的制备
[0027]
对8-12周龄balb/c雄性小鼠进行腹腔注射适量(500μl-1ml)的弗氏不完全佐剂,1周后,将处理好的阳性杂交瘤细胞按照10
6-108个/ml比例进行腹腔注射,500ul/只。每日观察小鼠状态,待小鼠腹部出现明显的膨胀后,注射器吸取小鼠腹水,并进行4℃10000g离心5-10min,-20℃保存备用。
[0028]
2、鼠抗猪瘟单克隆抗体的纯化
[0029]
因链球菌蛋白g(protein g)能与抗体的fc区发生特异性的结合,该亲和介质可以用于抗体的分离纯化。因此,采用protein g试剂盒说明书,对上述制备的腹水进行igg抗体
的纯化。
[0030]
3、单克隆抗体的特异性试验
[0031]
将杂交瘤细胞株纯化后的单克隆抗体作为一抗,采用商品化试剂盒方法测定该单克隆抗体与猪瘟病毒、牛病毒性腹泻病毒、猪流行性腹泻病毒的特异性反应情况。
[0032]
三、猪瘟病毒抗体竞争elisa检测方法的建立
[0033]
1、竞争elisa检测条件的优化
[0034]
a、采用方阵滴定法确定最佳的抗原包被浓度和鼠抗猪瘟单抗的最佳稀释度及阴阳性血清的最佳稀释度。
[0035]
b、确定最佳的封闭液种类、浓度和封闭时间
[0036]
c、确定鼠抗猪瘟单抗与阴阳性血清的最佳工作时间
[0037]
d、确定酶标记抗体的最佳工作条件
[0038]
e、确定最佳显色时间
[0039]
2、临界值的确定
[0040]
采用本发明建立的猪瘟病毒抗体竞争elisa方法对临床采集的已知阴性的47份血清样本进行测定,并与猪瘟抗体检测试剂盒(idexx)进行比较,计算样品的阻断率。pi=(阴性对照-样品)/阴性对照*100%;利用统计学方法计算阴性样品pi平均值和标准差,一般当样品pi值大于平均值加上3倍标准差,可以确定有99%以上的置信度确定为样品阳性。
[0041]
3、特异性试验
[0042]
采用本发明建立的elisa方法对猪瘟病毒阳性血清、阴性血清、牛病毒性腹泻病毒阳性血清、猪流行性腹泻阳性血清进行测定。
[0043]
4、敏感性与符合率的测定
[0044]
采用本发明建立的检测方法对已知的血清样本进行测定,并与猪瘟中和免疫荧光试验做对比分析,比较其敏感性和符合率情况。
[0045]
通过对已知猪瘟中和免疫荧光试验结果的血清样本进行测定,对其敏感性情况进行分析。
[0046]
5、重复性试验
[0047]
采用本发明建立的检测方法对30份临床血清样本进行测定,并进行组内和组间测定,每个样品做3个重复,分析该检验方法的重复性差异。
[0048]
6、各组分稳定性试验
[0049]
elisa包被板:用包被液将一定浓度的抗原包被于elisa酶标板上,经过最佳条件的包被时间后,pbst洗涤3次,加入适量的封闭液进行封闭,作用一段时间后,pbst洗板,加入适量的酶标板稳定剂,抽真空干燥封板,4℃保存备用。
[0050]
阴阳性标准血清及鼠抗单克隆抗体:采用抗体稳定剂进行一定浓度的稀释后,4℃保存备用。
[0051]
酶标记抗体:采用酶标抗体稳定剂按照一定的浓度稀释后,4℃保存备用。
[0052]
以上试剂和耗材均采用37℃加速试验进行稳定性分析。
[0053]
(二)猪瘟抗体检测试剂盒制备参数的确定
[0054]
一、猪瘟病毒纯化条件的摸索结果
[0055]
1、聚乙二醇(peg)浓缩条件的摸索
[0056]
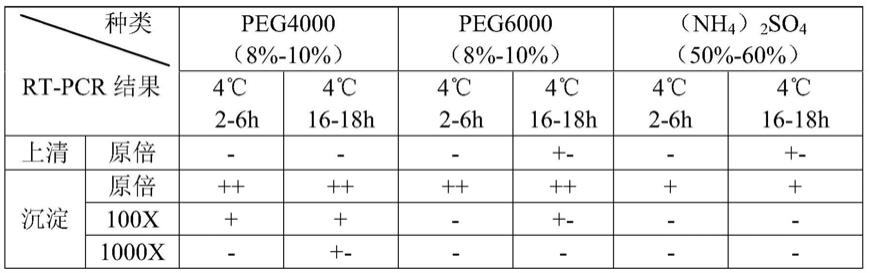
在一定的盐离子浓度下采用不同浓度的peg4000-peg6000、(nh4)2so4对猪瘟病毒进行浓缩,分析猪瘟病毒的沉淀情况。结果发现8%-10%范围内peg4℃放置16-18h沉淀更有利于猪瘟病毒的浓缩。
[0057][0058]
2、蔗糖梯度密度离心条件的摸索
[0059]
将浓缩后的猪瘟病毒加入到10%-50%蔗糖密度梯度介质中,经过25600g超速离心后,收获蛋白条带并进行测定。
[0060][0061]
蔗糖梯度离心发现在10%-20%、20%-30%、30%-40%、40%-50%均出现病毒条带,其中20%-30%病毒带病毒含量最高。
[0062]
3、鼠抗猪瘟单克隆抗体特异性鉴定
[0063]
将杂交瘤细胞株纯化后的单克隆抗体作为一抗,采用商品化试剂盒方法测定该单克隆抗体与猪瘟病毒、牛病毒性腹泻病毒、猪流行性腹泻病毒的特异性反应情况,结果显示特异性良好。
[0064][0065]
4、猪瘟病毒抗体竞争elisa检测条件的优化
[0066]
a、采用方阵滴定法确定最佳的抗原包被浓度和鼠抗猪瘟单抗的最佳稀释度及阴阳性血清的最佳稀释度,以n/p值最大为最优反应条件。
[0067][0068][0069]
结果显示,当抗原浓度为0.33μg/ml,单抗稀释倍数1:2000倍稀释,血清工作浓度为1:80倍稀释时,n/p最大为7.34。
[0070]
b、猪瘟病毒抗体竞争elisa最佳工作条件的确定
[0071]
以最优的抗原浓度将抗原包被于酶标板上,经4℃包被过夜后,用pbst洗涤3次,每次300μl/孔,甩干后,经1%酪蛋白封闭处理后,加入经pbs稀释的一抗和二抗,分别于37℃作用一段时间后,洗板5次,每次300μl/孔。加入适量的羊抗鼠igg-hrp,100μl/孔,37℃作用一段时间后,洗板5次,每次300μl/孔,最后加入显色液,室温显色一定时间后,确定最优反应条件。
[0072][0073]
c、临界值确定
[0074]
采用本发明建立的猪瘟病毒抗体竞争elisa方法对临床采集的已知阴性的47份血清样本进行测定,并与猪瘟抗体检测试剂盒(idexx)进行比较,计算样品的阻断率,pi=(阴性对照-样品)/阴性对照
×
100%,并根据roc曲线确定临界值范围。当阴性对照的od450nm>0.6;阳性对照阻断率>50%时判定试验条件成立。
[0075]
pi=(阴性对照-样品)/阴性对照
×
100%≥40%为阳性;pi≤30%为阴性;30%<pi<40%可疑。出现可疑的情况经重复测定后仍为可疑的判定为阴性。
[0076]
d、特异性检测
[0077]
采用本发明建立的elisa方法对猪瘟病毒阳性血清、阴性血清、牛病毒性腹泻病毒阳性血清、猪流行性腹泻阳性血清进行测定,结果表明该方法的特异性良好。
[0078][0079]
e、灵敏度检验
[0080]
对临床样本中已经确定的149份血清样本进行测定,以猪瘟中和免疫荧光试验结果为相对标准进行灵敏度的测定。
[0081][0082]
灵敏度(%)=a/a+c
×
100%=96/102=94.12%
[0083]
符合率(%)=a+d/a+b+c+d
×
100%=143/146=97.9%
[0084]
f、重复性试验
[0085]
采用建立的检测方法对30份临床血清样本进行测定,并进行组内和组间测定,每个样品做3个重复,分析该检验方法的重复性差异。结果显示组内试验和组间试验结果均不超过5%。
[0086]
组内重复性测定:
[0087][0088][0089]
组间重复性试验
[0090][0091]
g、猪瘟病毒抗体竞争elisa检测方法各组分稳定性试验
[0092]
酶标板稳定性试验:将处理好的酶标板分别放置37℃和4℃保存不同的时间后,用阳性、弱阳性、阴性参照品进行验证,确定酶标板的稳定性情况。结果显示,将酶标板放置37℃保存7天以上仍有较好的抗原性,确定该酶标板4℃可以保存1年以上。
[0093]
[0094]
将阴性和阳性样品、单抗及羊抗鼠igg-hrp用抗体稳定剂按照一定的比例稀释,放置4℃冰箱一段时间后,测定与标准阴阳性对照之间的差异。结果发现,当阴阳性样品按照1:20倍稀释处理后,4℃至少可以保存半年。
[0095][0096]
实施例2猪瘟抗体检测试剂盒的制备
[0097]
试剂盒包括以下组分:包被板用抗原、抗原包被板、鼠抗猪瘟病毒单克隆抗体、羊抗鼠igg-hrp、阳性对照、阴性对照、样品稀释液、洗涤液、tmb显色液和终止液,所述包被板用抗原为通过peg浓缩、蔗糖密度梯度离心后纯化的猪瘟病毒。
[0098]
抗原制备步骤:
[0099]
1、阳性对照、阴性对照的制备
[0100]
阴性对照:为猪瘟抗体检测试剂盒、猪瘟中和免疫荧光试验法测定猪瘟病毒抗体为阴性的猪只,无菌获取血清后,加入0.05%叠氮钠,-80℃保存备用。
[0101]
阳性对照:选取猪瘟抗体检测试剂盒、猪瘟中和免疫荧光试验法检测猪瘟病毒抗体均为阴性的35-40日龄断奶仔猪,多次免疫猪瘟病毒后,经猪瘟抗体检测试剂盒检测为阳性、猪瘟中和免疫荧光试验检测抗体水平大于28的猪只,无菌采血,获取血清,经56℃水浴灭活30min,加入0.05%叠氮钠,-80℃保存备用。
[0102]
2、抗原包被板的制备
[0103]
将上述方法纯化的猪瘟病毒按照0.33μg/ml的浓度稀释后,用0.1m碳酸盐缓冲液(ph9.6)包被酶标板,50-100μl/孔,4℃作用16-18h,或37℃作用1-2h,pbst洗涤3次,300μl/孔;1%酪蛋白对酶标板进行封闭,37℃作用1-3h或者4℃作用16-18h后,pbst洗涤5次,300μl/孔;加入适量的酶标板稳定剂37℃作用30-60min或者4℃16-18h后,抽真空或风干处理,4℃保存备用。
[0104]
3、鼠抗猪瘟病毒单克隆抗体的制备
[0105]
将纯化的猪瘟病毒作为免疫用抗原。通过balb/c小鼠免疫、细胞融合、阳性克隆株的筛选及亚克隆、鉴定,以及腹水制备等流程获取。
[0106]
(1)动物免疫:取本发明纯化方法纯化的猪瘟病毒与完全弗氏佐剂按照1:1的比例进行乳化后,免疫8-12周龄雄性balb/c小鼠,150μg/只。皮下多点注射。每隔2周用不完全佐剂处理后,采用相同方式免疫,最后一次用猪瘟病毒进行加强免疫,待抗体水平达到相应的
比例后,进行细胞融合。
[0107]
(2)细胞融合:无菌制备免疫后小鼠脾细胞,将小鼠脾细胞与骨髓瘤细胞sp2/0按照5:1的比例进行混匀离心沉淀后置37℃水浴中,缓慢加入适量的浓度的peg,静置片刻后,立即加入37℃预温的dmem培养基,加入适量的hat培养液,轻轻混匀后,铺于已经含有一定量的饲养细胞的细胞培养板中,100μl/孔,置37℃5%co2培养箱内培养。
[0108]
(3)阳性杂交瘤细胞株的筛选与亚克隆:采用间接elisa方法,向包被猪瘟病毒的酶标板中加入一定稀释倍数的培养基上清,于37℃作用30min后,弃去孔中液体,洗板3次后,加入一定稀释倍数的羊抗鼠igg-hrp,37℃作用45min后,tmb显色15min,酶标仪进行od450nm的测定。采用该方法进行阳性杂交瘤细胞株的筛选。同时设置sp2/0细胞培养液做阴性对照,当待测培养液上清od450nm/阴性对照大于2.1时判定为阳性。并对检测结果为阳性的细胞株采用有限稀释法进行亚克隆,并进行标记、储存。
[0109]
(4)单克隆抗体的制备:主要采用的是小鼠体内培养的方法进行制备。对8-12周龄balb/c雄性小鼠进行腹腔注射适量(500μl-1ml)的弗氏不完全佐剂,1周后,将处理好的阳性杂交瘤细胞按照10
6-108个/ml比例进行腹腔注射,500ul/只。每日观察小鼠状态,待小鼠腹部出现明显的膨胀后,注射器吸取小鼠腹水,并进行4℃10000g离心5-10min,-20℃保存备用。
[0110]
4、pbst洗涤液(1x)
[0111]
氯化钠8g,氯化钾0.2g,磷酸氢二钠12h2o 2.9g,磷酸二氢钾0.2g,吐温-20 500μl,补足水至1000ml。
[0112]
5、样品稀释液为pbs液:
[0113]
氯化钠8g,氯化钾0.2g,磷酸氢二钠12h2o 2.9g,磷酸二氢钾0.2g,补足水至1000ml。
[0114]
6、终止液为2m硫酸溶液:浓硫酸178.3ml,补足浓硫酸至200ml。
[0115]
实施例3猪瘟抗体检测试剂盒的应用
[0116]
1、将包被有猪瘟病毒的抗原包被板充分回温,用pbs按1:80稀释倍数对待检样品进行稀释,50μl/孔,同时设置阴性和阳性对照,每个对照做2个重复。37℃作用30min后,加入用pbs按1:2000倍稀释的鼠抗猪瘟单抗,50μl/孔,37℃继续作用30min;
[0117]
2、弃去孔中的液体,用pbst洗涤5次,300μl/孔,最后一次甩干酶标板;
[0118]
3、用pbs将羊抗鼠igg-hrp进行1:2000倍稀释后,100μl/孔,37℃作用45min,弃去孔内液体,pbst洗涤5次,300μl/孔,最后一次甩干酶标板;
[0119]
4、加入tmb显色液,100μl/孔,室温作用10min;
[0120]
5、加入2m h2so4终止液,5min内用酶标仪读取od450nm值。
[0121]
判定标准:当阴性对照的od
450nm
>0.6;阳性对照阻断率>50%时判定试验条件成立。
[0122]
pi=(阴性对照-样品)/阴性对照
×
100%≥40%为阳性;pi≤30%为阴性;30%<pi<40%可疑。出现可疑的情况经重复测定后仍为可疑的判定为阴性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1